Method Article
La disección de la Auditivo Bulla en ratones postnatales: Aislamiento de los huesos del oído medio y el análisis histológico
En este artículo
Resumen
We present a protocol to isolate the auditory bulla, capsule, and ossicles from postnatal mice for whole mount and histological analysis.
Resumen
En la mayoría de los mamíferos, huesecillos del oído medio, incluyendo el martillo, yunque y estribo, son los huesos más pequeños. En ratones, una estructura ósea llamada la bulla auditiva alberga la cadena de huesecillos, mientras que la cápsula auditiva encierra el oído interno, a saber, la cóclea y canales semicirculares. huesecillos murinos son esenciales para la audición y por lo tanto de gran interés para los investigadores en el campo de la otorrinolaringología, pero su metabolismo, el desarrollo y la evolución son altamente relevantes para otros campos. Metabolismo óseo alterado puede afectar la función de la audición en ratones adultos, y varios ratones de genes deficientes en mostrar cambios en la morfogénesis de los huesecillos del oído en el útero. A pesar de huesecillos del oído murinos son pequeñas, su manipulación es factible si uno entiende su orientación anatómica y la estructura 3D. A continuación, describimos cómo diseccionar la bulla auditiva y la cápsula de ratones postnatales y luego aislar huesecillos individuales mediante la eliminación de parte de la bulla. También discutimos cómo emcama la bulla y la cápsula en diferentes orientaciones para generar parafina o secciones congeladas adecuados para la preparación de secciones longitudinales, horizontales, o frontales del martillo. Por último, se apuntan las diferencias anatómicas entre el ratón y huesecillos del oído humano. Estos métodos serían útiles en el análisis de los aspectos patológicos, de desarrollo y evolutivas de huesecillos del oído y el oído medio en ratones.
Introducción
Los tres huesecillos del oído del oído medio, a saber los martillo, yunque y estribo, forman una cadena auditivo mamífero específico que transmite el sonido de la membrana timpánica en el oído interno, o cóclea 1,2. La función auditiva puede ser evaluada en ratones mediante la medición de la respuesta auditiva del tronco cerebral (ABR) Umbrales de 3-6, y la vibración del martillo detrás de la membrana timpánica pueden ser monitoreados utilizando láser Doppler vibrometría (LDV) 7. Mediante la combinación de la ABR, LDV, y mediciones de productos de distorsión de emisiones otoacústicas (DPOAE), pérdida de audición conductiva puede ser discriminado por deterioro neurosensorial 8.
Se necesitan modelos animales de enfermedades del oído, dada la importancia de la audición y la salud del oído para el bienestar de los pacientes de todas las edades. Por ejemplo, la otitis media es una infección de oído muy común que se observa en lactantes y niños humanos, y graves, otitis media aguda y sus complicaciones puede ocurrir si la condición no se trata con antibióticos apropiados 9. Los modelos de ratón de la otitis media podrían resultar útiles en la comprensión de la patogénesis y en el desarrollo de tratamientos 10,11.
Osículos murino, que (excepto por la parte goniale del martillo) se forman por osificación endocondral 12,13, son altamente relevantes para el estudio de metabolismo de los huesos y la morfogénesis. En primer lugar, su pequeño tamaño permite un análisis de alta resolución de los huesos con un periostio intacto el uso de rayos X o la microscopía de fluorescencia 14. En segundo lugar, el metabolismo óseo aberrantes, tales como la resorción ósea excesiva o deficiente, o interacciones con discapacidad entre las células óseas 15, puede ser analizada como un contribuyente potencial para la audición 3,4,7 pérdida. En tercer lugar, la morfogénesis de huesecillos anormal se informa en varios ratones con deficiencia de genes, tales como los animales que carecen Hoxa2 16-19, 20-22 MSX1, Prrx1 23, goosecoid(GSC) 24,25, Bapx1 13, 26 Tshz1, dusp6 (Mkp3) 27, Noggin (Nog) 28, 29 Fgfr1, receptores de hormonas tiroideas (Thra, thrB) 5, Bcl2 30 y otros 1,31, o en ratones que sobreexpresan Hoxa2 32. Por último, a pesar de su pequeño tamaño, las estructuras asociadas con huesecillos tales como los músculos y las articulaciones 33 34,35 son accesibles.
huesecillos del ratón son más pequeños que los huesecillos humanos, pero hay que destacar que el oído medio del ratón no es una versión en miniatura de su homólogo humano. Por ejemplo, en ratones, la arteria estapedial, que pasa a través del anillo del estribo, persiste durante toda la vida 36, mientras que en los seres humanos, la arteria estapedial embrionario desaparece durante la gestación. Además, la morfología del martillo de ratón difiere de la de THhueso humano e (ver Figura 6). En ratones, la auditiva (timpánica) bulla encierra la cavidad del oído medio lleno de aire, mientras que en los seres humanos, las células mastoideas compuestas de hueso trabecular en el hueso temporal alberga la cadena de huesecillos en lugar de una bulla 37. En ambas especies, la cápsula auditiva (cápsula ótica, laberinto óseo) encierra la cóclea y los canales semicirculares del oído interno. La biología comparativa y evolutiva del oído medio ha sido revisado extensamente 38-40.
El protocolo previsto inferior a la primera se describe cómo diseccionar la bulla auditiva y de la cápsula, que consisten principalmente en el oído medio y el oído interno, respectivamente. Este protocolo también demuestra cómo aislar el martillo, yunque y estribo de la bulla auditiva. Por último, muestra cómo orientar la bulla auditiva y de la cápsula para incrustar en preparación para seccionar los tejidos de los huesecillos del oído.
Protocolo
Todos los animales procedimientos realizados en este estudio son aprobados por el Cuidado de Animales institucional y el empleo Comisión de la Universidad de Keio (IACUC - número de homologación: 09221) y siguen las directrices institucionales en la Experimentación Animal de la Universidad de Keio para el uso de animales en la investigación. muestras humanas fueron aisladas de un cadáver donado al Departamento de Anatomía de la Facultad de Medicina de la Universidad de Keio, y fueron utilizados de conformidad con las regulaciones institucionales.
1. Aislamiento del Bulla auditivo y de la cápsula
- La eutanasia a los ratones en un frasco que contiene una plataforma por encima de toallas de papel empapadas en isoflurano o sevoflurano hasta que la ventilación respiratoria deja durante más de un minuto y a continuación, realizar la dislocación cervical. Tenga cuidado para evitar el contacto directo de los ratones con las toallas de papel empapadas.
- Hacer una pequeña incisión transversal en el lado dorsal del cuello y tirar de la piel, aparte hacia la cabeza y la cola con las dos manos para exponer el cuello mu subyacenteEscleritos tejido.
- Decapitar a los ratones en la región cervical, utilizando 14 cm tijeras quirúrgicas agudas.
- Pelar la piel por completo hacia la nariz. Cortar toda la piel junto con el hocico y los incisivos.
- Inserte tijeras en la boca y cortar los músculos maseteros en ambos lados.
- Abrir la mandíbula con cuidado y retire la lengua y la mandíbula inferior juntos.
- Con unas tijeras afiladas, cráneo y fractura de base de cráneo en dos mitades a lo largo del plano medio sagital (Figura 1A, B).
- Con unas pinzas, retire los hemisferios cerebrales y el cerebelo y el tronco cerebral. La bulla auditiva y la cápsula están situados lateralmente al cerebelo y el tronco cerebral. Tenga en cuenta que la bulla auditiva es lateral adicional a la cápsula auditivo (Figura 1C, D).
- Diseccionar la bulla y la cápsula con el hueso del cráneo circundante (Figura 1E).
- Introducir el espécimen en un plato que contiene buffer fosfato salino (PBS) pH 7,4 a temperatura ambiente.
- Tnder un microscopio de disección binocular, el uso de fórceps de separar los huesos que rodean y tijeras para cortar el límite aflojado alrededor de la bulla y la cápsula (Figura 1F). Los huesos que rodean retirados son los basioccipital (borde ventral), exoccipital (frontera ventro-posterior), supraoccipital (borde posterior), interparietal, parietal (borde dorsal), escamoso (frontera dorso-anterior), alisphenoid (borde anterior), y basisphenoid (frontera antero-ventral) huesos. Tenga en cuenta que el proceso styliform (Sp), que apoya la apertura del tímpano de la trompa de Eustaquio 41, es distinta de la apófisis estiloides del hueso temporal.
2. Aislamiento de los huesecillos auditivos: martillo, yunque y estribo
- Maleo
- Con las dos tijeras y pinzas pequeñas, retire la parte lateral del conducto auditivo externo al tympanicus surco de modo que la membrana timpánica es visible (Figura 2 A, B).
- Retire parte de la membrana timpánica y hueso timpánico cerca de la malleal processus brevis (apófisis orbicular, ver Discusión), tanto en la ventral (de puntos) y posterior (#) paredes (Figura 2C). El músculo tensor del tímpano martillo y ahora debe ser expuesto (Figura 2D, E).
- Levantar el martillo (Figura 2F) y cortar el músculo tensor del tímpano con el borde biselado de una aguja G 27 (Figura 2G). Tenga en cuenta que el manubrio malleal se fija firmemente a la membrana timpánica, como se ve en otros mamíferos.
- Desprender la membrana timpánica con cuidado del manubrio, que es frágil. Quitar el hueso timpánico para revelar los tres huesecillos del oído.
- Dislocar el martillo del yunque en la articulación de huesecillos (Figura 2H).
- Aislar el malleus fracturando el proceso anterior en el goniale.
- Yunque y estribo
- aislar tque incus cortando el ligamento posterior del yunque en el corto crus (Figura 3A).
- Aislar el estribo por el corte de la arteria estapedial cerca del estribo con el borde biselado de una aguja G 27 (Figura 3 B, C). Si es necesario, cortar el tendón del músculo estapedial en el proceso muscular del estribo con la aguja.
- Insertar una aguja de coser (o una aguja de grabado) en el agujero obturador de estribo y levantar el estribo. Después de retirar el estribo, la abertura de la ventana ovalada debe ser claramente visible (Figura 3D).
3. Incorporación de Bulla auditivo y de la cápsula
- Preparación para incrustar en bloques de parafina
- Aislar la bulla y la cápsula como se describe en la Sección 1.
- Cortar el extremo anterior de la bulla (el proceso styliform) con unas tijeras, sumerja la bulla y la cápsula en el 4% de paraformaldehído (PFA) en PBS a 4 °C, y permitir que el fijador para entrar en la bulla. Si el aire queda atrapado en la bulla, quitarlo con una aguja y una jeringa. Deja la bulla y la cápsula en el fijador a 4 ° CO / N en un rotador tubo.
Precaución: PFA es tóxico y debe ser manejado con cuidado. - Lavar una vez con PBS.
- Descalcificar bulla y cápsula para una semana a 4 ° C en 10% de dihidrato de sal disódica del ácido etilendiaminotetraacético (EDTA-2Na), base Tris 100 mM, pH 7,0, en un tubo de 2 ml. Cambiar el tampón cada dos días.
- Lavar una vez con PBS. Las muestras se pueden almacenar en 70% de etanol en agua a 4 ° C. Opcionalmente, la transferencia a 70% de etanol a través de una serie graduada de alcohol (30%, 50%, 70% en agua).
- En un procesador de tejidos, deshidratar especímenes en una serie graduada de soluciones de etanol (70%, 2x 95%, 3x 100%, cada uno 1 h), claras en xileno (4x, cada 1 h a 40 ° C), y de infiltrarse en las muestras con cera de parafina fundida 42. Opcionalmente, sustituto de xileno con clearin tejido comercialg de solución (por ejemplo, Histo-Clear).
- Descargar especímenes del procesador, y sacarlos de sus casetes.
- En un sistema de consola tejido incrustación, lugar especímenes en moldes llenos de cera de parafina fundida. Proceder a la incrustación (Sección 4).
- Preparación para empotrar en los bloques congelados (método de la película de Kawamoto) 43
- Aislar la bulla y la cápsula como se describe en la Sección 1.
- Cortar el extremo anterior de la bulla (el proceso styliform) con unas tijeras, sumergir la bulla y la cápsula en fijador (2% o 1% en lugar de PFA 4% en PBS para conservar la antigenicidad) a 4 ° C. Si queda aire dentro de bulla, y eliminar el uso de una aguja y una jeringa. Deja la bulla y la cápsula en el fijador a 4 ° CO / N en un rotador tubo.
- Lavar bulla y la cápsula de forma rápida en PBS y se sumerja inmediatamente en el compuesto crio-incrustación de líquido a 4 ° C.
- Importante: Eliminar las burbujas de aire en su caso en el medioy oído externo a través de la aspiración con una aguja, y añadiendo el compuesto de la incrustación con fórceps. Proceder a la incrustación (Sección 4).
4. Orientación de la muestra e incrustación
NOTA: El conjunto bulla y de la cápsula deben ser dispuestos en una orientación particular durante la incrustación para cortar secciones deseadas. Los procedimientos descritos a continuación se utilizan para la sección del martillo en distintas orientaciones.
- Longitudinal (parasagital) seccionamiento del martillo
- Coloque la cara lateral de la bulla o meato auditivo externo hacia abajo en parafina caliente (o compuesto de la crio-incrustación). Ajuste la orientación de manera que el cuello y transversal lámina del martillo son paralelas a la parte inferior horizontal de la placa de la incrustación (Figura 4A - C). Tenga en cuenta que la membrana timpánica está inclinado en un ángulo de aproximadamente 30 ° con la vertical en la cabeza del ratón (Figura 4A; la Figura 59 en Kampen 44).
- Seccionamiento Horizontal del martillo
- Coloque la cresta dorsal horizontalmente en parafina caliente (o compuesto crio-incrustación). Ajustar la orientación de la bulla y la cápsula de manera que el cuello y transversal lámina del martillo son perpendiculares a la parte inferior del plato de la incrustación (Figura 4D - F).
- Seccionamiento frontal (secciones transversales) del manubrio y la membrana timpánica 5
- Coloque el manubrio malleal en parafina caliente (o compuesto de la crio-incrustación) de tal manera que es perpendicular a la parte inferior de la placa de la incrustación.
- Enfriar el bloque a temperaturas adecuadas para endurecer la cera de parafina en un sistema de la consola de tejido incrustación (otra alternativa es utilizar el compuesto crio-incrustación en un baño de hielo seco / hexano).
- bloque de tejido proceso y secciones cortadas utilizando procedimientos de rutina. Por ejemplo, las secciones de parafina mancha con hematoxilina y eosina (H & #38; E), safranina O (para el cartílago), o para la actividad de tartrato resistente a la fosfatasa ácida (TRAP) (por osteoclastos) 3, o por inmunohistoquímica. Cryosections undecalcified son adecuados para el etiquetado hueso utilizando fluorocromos 14, alizarina tinción con rojo para el calcio, y la inmunofluorescencia 42.
Resultados
Este protocolo presenta un método para aislar los huesecillos de la bulla auditiva ratón. En primer lugar, la bulla y la cápsula se diseccionaron en una sola pieza del cráneo (Figura 1). La bulla diseccionado se utiliza entonces para preparar el malleus (Figura 2) y el yunque y el estribo (Figura 3). Hitos de la bulla auditiva y la cápsula son el proceso styliform en el extremo anterior de la bulla, la cresta dorsal, el canal semicircular anterior, y la fosa subarcuate (Figura 1F). La tomografía de imágenes microtomografía (CT) revela huesecillos en la bulla auditiva, así como las orientaciones óptimas para seccionamiento longitudinal y horizontal de los osículos (Figura 4).
Para seccionamiento parafina longitudinal del martillo, la bulla y la cápsula fueron descalcificadas en EDTA a 4 ° C durante una semana, incrustado en un pabloque raffin en la orientación mostrada en la Figura 4 A - C, se seccionaron a 4 micras, y luego teñidas utilizando H & E. El martillo unido a la membrana timpánica en el bulla auditiva reveló osificación endocondral en curso en P14 (Figura 5A). Para visualizar la formación de hueso nuevo, calceína (30 mg / g de peso corporal) se inyectó intraperitoneal en un ratón P20, y la bulla y la cápsula se aislaron 24 h más tarde en P21. La muestra sin descalcificación se ha incrustado congelado y luego cryosectioned a 6 micras utilizando una película adhesiva basada en el método de Kawamoto 43. Después de la tinción nuclear con DAPI (4 ', 6-diamidino-2-fenilindol), se observó la sección bajo un microscopio de fluorescencia. Señales de calceína (verde) revelaron la formación de hueso nuevo en el martillo (m), bulla y la cápsula (Figura 5B). Para seccionamiento horizontal del martillo, la bulla auditiva aislado de un ratón de 5 semanas de edad, se ha incrustado congelado sin descalcificación (para elOrientación ver Figura 4D - F), cryosectioned a los 6 micras utilizando el método de Kawamoto, y se tiñe usando H & E. Seccionamiento horizontal de la brevis malleal processus (MPB) también muestra la cóclea (Figura 5C).
Una vista medial de los huesecillos del oído derecho aisladas de un ratón P31 muestra las características típicas del martillo del ratón, (o persa 45 de espada) manubrio, un prominente brevis processus (apófisis orbicular a saber, el "delta-gaviota-ala-como" , ver Discusión), y la lámina transversal (Figura 6). Tenga en cuenta que el proceso anterior (processus anterior) fue fracturado en el procedimiento de disección alrededor de la goniale y se separó de la anillo timpánica (ectotimpánico). Esta muestra representativa exhibe una articulación intacta incudomalleolar entre el martillo y el yunque, mientras que la articulación incudoestapedial está dislocado. inserciones tendinosas en el malleal yprocesos musculares estapediales son detectables (Figura 6A, asteriscos).
La Figura 6B compara ratón y huesecillos del oído humano con la misma ampliación. Las diferencias entre especies, aparte de tamaño, son los siguientes. El manubrio malleal es en forma de ala en ratones, pero parecido a un club en el ser humano. El ángulo entre el eje anatómico (o el eje de rotación, la línea a través del proceso anterior del martillo y la corta del yunque) y el manubrio es mucho menor en los ratones y los dos son casi paralelas, a diferencia de casi perpendicular en los seres humanos 6,46-48. En huesecillos humanos, los estudios revelan que vibrometric la articulación incudo-maleolar es móvil en lugar de funcionalmente fijado 49. El martillo de ratón exhibe una amplia y delgada y plana de la lámina transversal no es evidente en los seres humanos 47. En ratones, la parte anterior processus fusiona con los huesos membranosos, a saber, la goniale y el tímpanoel anillo C, mientras que en los seres humanos la anterior processus se reduce a una pequeña espícula de hueso 41. El estribo de ratones y seres humanos también difiere: en ratones, la crus anterior es curvo y la crus posterior es más recta mientras que en los seres humanos, la crus anterior es más recta que la crus posterior. Vale la pena señalar que la cabeza del martillo en relación con el tamaño del cuerpo se agranda de forma masiva en especies como el topo dorado, lo que demuestra una variabilidad significativa en las relaciones alométricas de "los más pequeños" huesos 48.
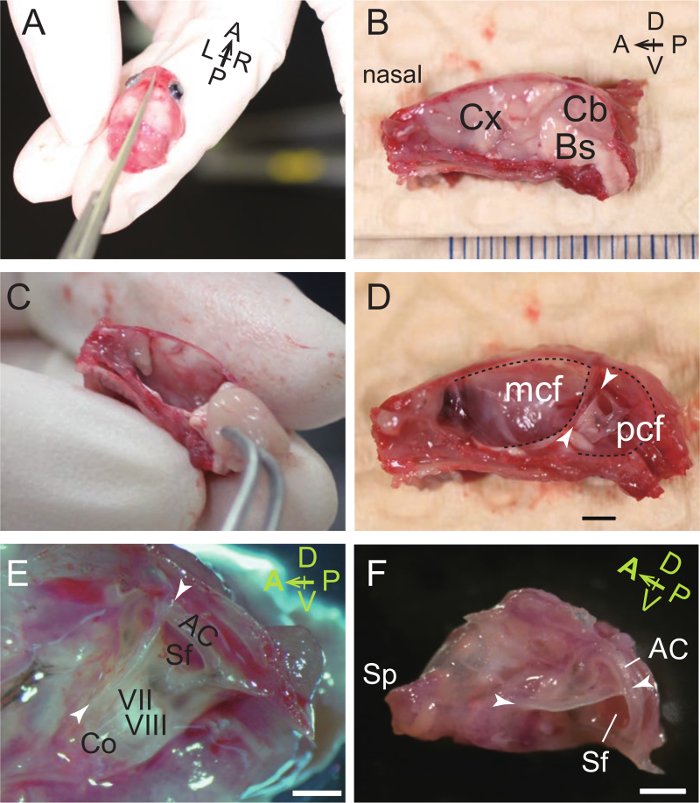
Figura 1. La disección de la cápsula y auditiva Bulla. (A) el cráneo de un ratón P31 se divide en mitades derecha e izquierda. A, anterior; P, posterior; L, izquierda; R, derecha. (B) la superficie medial de la mitad derecha de la cabeza dividido en dos partes, sin piel. Cx, corteza cerebral; Cb, cerebelo; Bs, Brainstem. D, dorsal; V, ventral. (C) La eliminación del cerebro con fórceps. (D) vista medial de la cápsula auditiva en el cráneo derecha. La cresta dorsal (puntas de flecha) se encuentra entre la fosa craneal media (mpc) y la fosa craneal posterior (PCF) y separa las superficies ventro-posterior de la cápsula auditiva dorso-anterior y. Barra de escala, de 2 mm. (E) Un mayor aumento de la bulla auditiva y de la cápsula (vista medial). Co, cóclea; VII, del nervio facial; VIII, nervio vestíbulo; AC, anterior (superior) del canal semicircular; Sf, la fosa subarcuate, que alberga el paraflocculus cerebelosa. Barra de escala, 1 mm. (F) Micrografía de bulla auditiva aislados y la cápsula (vista medial). Sp, styliform proceso. Barra de escala, 1 mm. (A - E), ratón P31. (F), ratón P33. Haga clic aquí para ver una versión más grande de esta figura.
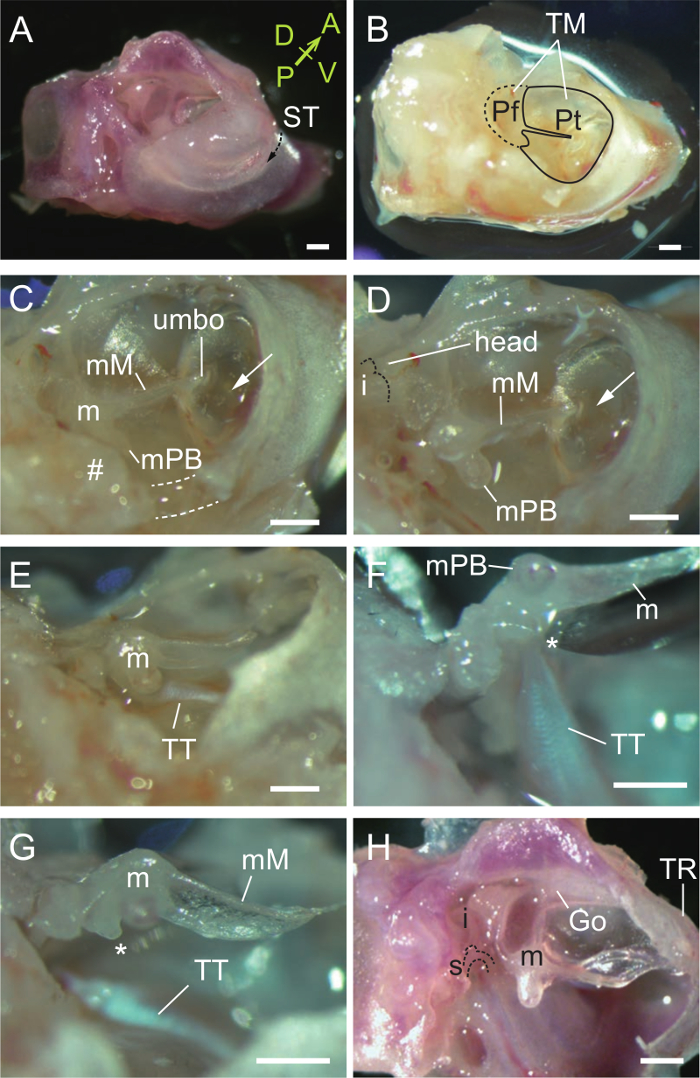
Figura 2. Disección del martillo. (A) Vista ventrolateral de una bulla auditiva derecha y de la cápsula. El tympanicus surco (ST, flecha de trazos) es el sitio de unión de la membrana timpánica. El lateral hueso a la ST es parte del oído externo y el medial hueso a la ST forma el suelo de la cavidad del oído medio. A, anterior; P, posterior; D, dorsal; V, ventral. (B) Vista después de la eliminación del conducto auditivo externo para revelar la membrana timpánica (TM) incluyendo la pars flaccida (PF) y pars tensa (Pt). (C) La eliminación de partes del hueso timpánico (líneas de puntos y #) cerca de la malleal processus brevis (MPB). m, martillo; mM, manubrio malleal. Flecha, burbuja de aire en la cavidad del oído medio visto a través de la membrana timpánica. (D) martillo expuesto. Martillo de cabeza se indica. Punteadolínea indica la superficie articular del yunque. (E) tendón del músculo tensor del tímpano (TT) unido al martillo. (F) El tensor del tímpano se tira cuando se levanta el martillo. *, Proceso muscular. (G) tensor del tímpano se corta mediante una aguja. (H) Tres huesecillos del oído después de la eliminación de la membrana timpánica. La articulación incudo-maleolar está dislocado. m, martillo; i, yunque; s, estribo; Ir, goniale (fusionado al anillo de martillo y del tímpano, TR). Todas las barras de escala, de 0,5 mm. (A, H), de ratón P33. (B - G), ratón P31. Haga clic aquí para ver una versión más grande de esta figura.
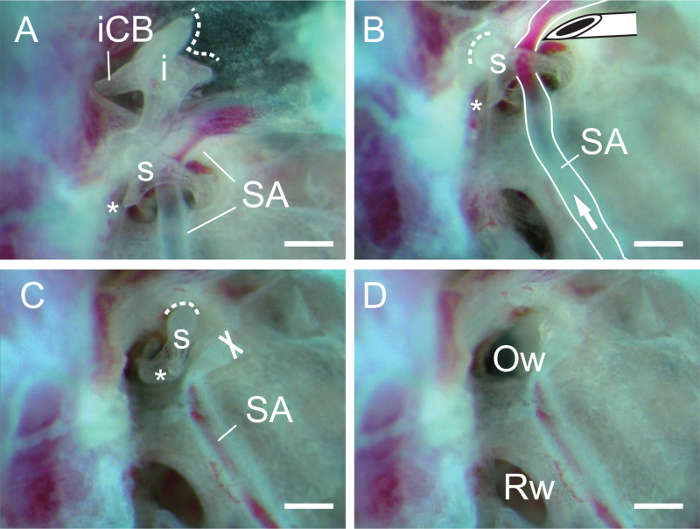
Figura 3. La disección del yunque y el estribo. (A) y Incusestribo después de la eliminación del martillo. La arteria estapedial (SA) pasa a través del estribo (s). La línea punteada indica la superficie articular del yunque. Tenga en cuenta que el corto crus (ICB, crus breve) del yunque (i) se fija por el ligamento posterior (no mostrado). Asterisco, proceso muscular del estribo. (B) del estribo después de la eliminación del yunque. punta de la aguja se utiliza para cortar la arteria estapedial (SA). Flecha, dirección del flujo sanguíneo. La línea punteada indica la superficie articular del estribo. (C) La arteria estapedial se elimina de estribo. X indica el extremo del corte de la arteria estapedial (SA). (D) La ventana oval (Ow, ventana oval o vestibular fenestra) es visible después de la retirada del estribo. Rw, ventana redonda (fenestra rotunda o cócleas fenestra). Las barras de escala, de 0,5 mm. Haga clic aquí para ver una versión más grande de estafigura.
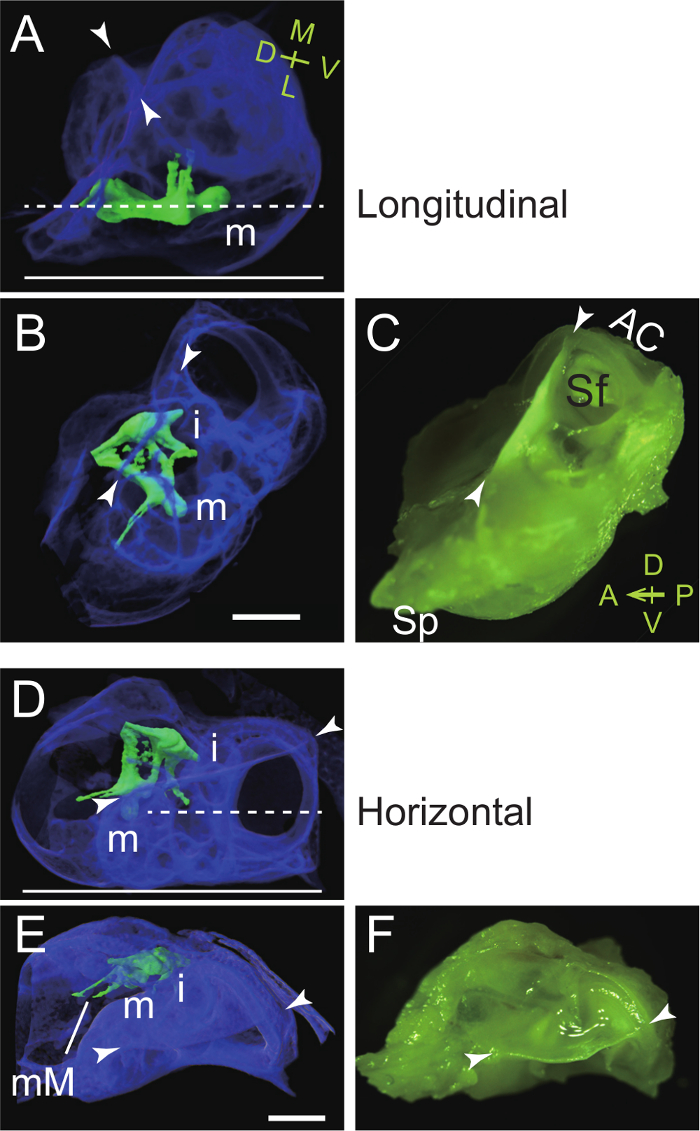
Figura 4. La orientación de la Bulla auditiva y la cápsula durante la incrustación de Longitudinal (parasagital, A - C) y horizontal (D - E) seccionamiento del martillo. (A - C) El cuello y transversal lámina del martillo se colocan en paralelo a la parte inferior de la incrustación de plato. (A) Vista lateral: Imagen micro-CT para mostrar la incrustación del martillo justo en la bulla (pseudocoloreada azul). El martillo y el yunque se pseudocoloreada verde. La línea, el plano de corte deseado. línea continua, parte inferior de la incrustación de plato. m, martillo; puntas de flecha, la cresta dorsal. M, medial; L, lateral; D, dorsal; V, ventral. (B) Vista superior: Imagen micro-CT. Tenga en cuenta que el extremo anterior de la bulla (proceso styliform) se eliminó. i, yunque. (C) Vista superior: micrografía (tomada con unafiltro de color). AC, anterior (superior) del canal semicircular; Sf, la fosa subarcuate; Sp, styliform proceso. A, anterior; P, posterior; D, dorsal; V, ventral. (D - F) El brevis processus del martillo se coloca perpendicular a la parte inferior de la incrustación de plato. (D) Vista lateral: Imagen micro-CT para mostrar la incrustación del martillo derecha. La línea, el plano de corte deseado. línea continua, parte inferior de la incrustación de plato. (E) Vista superior: Imagen micro-CT. mM, manubrio malleal. (F) Vista superior: micrografía (tomada con un filtro de color). Las barras de escala, 1 mm. Imágenes Micro-CT se obtuvieron a una resolución voxel de 5 micras, tal como se describe previamente 7. Haga clic aquí para ver una versión más grande de esta figura.
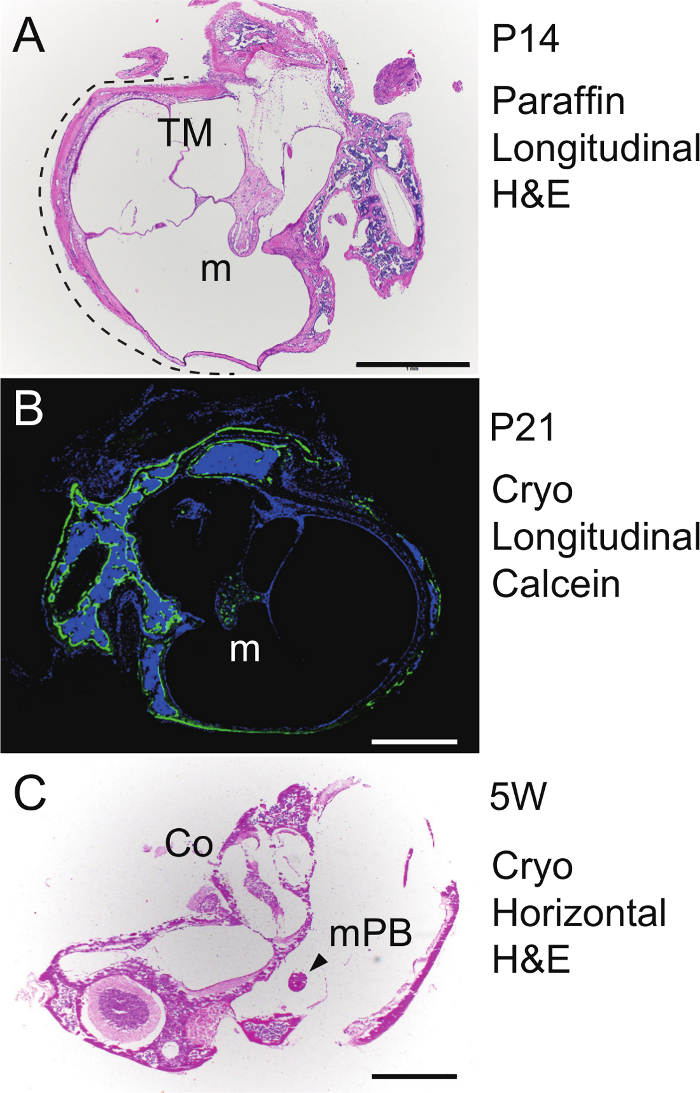
Figura 5. Histología. (A) tinción H & E. Sección longitudinal (parasagital) del martillo incrustado en parafina derecha (m) en la bulla auditiva (línea de puntos) en P14. TM, la membrana timpánica. Etiquetado de hueso (B) calceína. Sección longitudinal del martillo congelado, sin descalcificar izquierda (m) en la bulla auditiva en P21. Contratinción, DAPI. (C) tinción H & E. Sección horizontal de la brevis congelado, sin descalcificar la izquierda malleal processus (MPB) en la bulla auditiva y la cápsula (5 semanas de edad del ratón). Co, cóclea. Las barras de escala, 1 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6. Vista medial de huesecillos auditivos. (A) huesecillos del oído derecho de P31 ratón. A, anterior; P, posterior; D, dorsal; V, ventral. Barra de escala, 1 mm. martillo de cabeza (caput mallei, Capitulum mallei); cuello (Collum mallei); la lámina (lámina transversal); mM (manubrio mallei); asterisco negro (proceso muscular del martillo); MPa (Processus anterior, Processus gracilis); MPB (processus brevis); cuerpo de yunque (Corpus incudis); ICB (Crus breve, corta crus, proceso corto); ICL (longum Crus, a largo crus, proceso largo); iPL (lenticular Processus, proceso lenticular, Sylvian apófisis); la cabeza del estribo (Caput stapedis); asterisco blanco (proceso muscular del estribo); SCA (anterius Crus, crus anterior); SCP (Crus posterius, crus posterior); stapedis base (Base, footplate); SOF (agujero obturador, foramen intercrural). (B) huesecillos del oído derecho de un 76 años de edad, hembra humana (Cortesía del Departamento de Anatomía de la Keio University School of Medicine). Los huesecillos del ratón P31 (inferior derecha) se crean imágenes con el mismo aumento que el utilizado para la cadena de huesecillos humanos. curvflechas ed indican el ángulo entre el eje anatómico y el manubrio (líneas de puntos). Barra de escala, de 2 mm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
A continuación, presentamos un método útil para aislar la bulla auditiva y de la cápsula en ratones postnatales. Antes de P12, los tejidos son frágiles y pueden dañarse durante el aislamiento. Después de P12, la bulla auditiva y la cápsula pueden ser fácilmente aislados de los tejidos circundantes. La disección de la bulla de la cabeza antes de seccionar tiene varias ventajas. En primer lugar, la cavitación y el crecimiento posnatal de la bulla auditiva se presentan con más activamente de P6 en adelante y están completos, por P14 50. El tejido mesenquimal entre la membrana timpánica y la pared coclear se sustituye por aire a través del proceso de cavitación. El aire resultante en la cavidad del oído medio puede impedir el contacto entre los tejidos y líquidos durante la fijación, la descalcificación y la incrustación. Es más fácil de eliminar el aire de la bulla auditiva aislados cortando el final (proceso styliform) anterior en lugar de intentar hacerlo en la bulla no aislado. En segundo lugar, la orientación del martillo (y la membrana timpánica) no es verticalEn la cabeza. Por tanto, es más fácil de la sección del martillo en planos deseados mediante la incorporación de la bulla auditiva aislado y la cápsula en una orientación determinada.
Una vez aislado, bulla auditiva y cápsulas son útiles para numerosos análisis. Por ejemplo, la alta resolución de rayos X de micro-CT puede revelar la morfología de la microestructura del hueso tales como capilares osteogénicas en el martillo 14. El microscopio de disección stereofluorescence es una poderosa herramienta para visualizar estructuras en la evaluación de reportero ratones que expresan las proteínas fluorescentes en el oído medio o interno 33. Además, varios in vivo o ex vivo de fluorescencia métodos de marcaje y detección de inmunofluorescencia conjunto de montaje podrían llevarse a cabo. La microscopía de fluorescencia hoja de luz también es útil para el análisis tridimensional 51. Aunque no se describe aquí, las diversas estructuras anatómicas asociadas con la bulla auditiva y la cápsula tales como nervios periféricos, los vasos sanguíneos, yla membrana timpánica en el oído medio también se puede evaluar usando este protocolo.
Tenga en cuenta que el seccionamiento de parafina requiere descalcificación de tejidos óseos antes de la incrustación y por lo tanto no permite el análisis de la mineralización. Por el contrario, el método de película Kawamoto 43 usado para preparar las secciones congeladas se puede realizar sin descalcificación y es adecuado para estudios de mineralización utilizando en técnicas de etiquetado de hueso in vivo o tinción especial tal como la tinción de alizarina. condiciones de crio-seccionamiento deben optimizarse según basada en la edad del ratón. Por ejemplo, se recomienda una temperatura de menos fresco dentro de la cámara del criostato para las muestras más antiguas de ratón para minimizar el daño a las secciones.
En el ratón, el término correcto para el prominente protuberancia semiesférica del martillo es "apófisis orbicular". Sin embargo, el término "brevis processus" ha sido ampliamente utilizado para indicar la apófisis orbicular para más THotros dos décadas, en particular entre los biólogos del desarrollo del ratón 16,20,22-25. "Processus brevis" originalmente se refería al proceso lateral (processus lateralis), que difiere de la apófisis orbicular. En los seres humanos, un proceso lateral se asemeja a una ligera proyección cónica forma la línea general de unión a la membrana timpánica, que se extiende desde el manubrio (no se ve en la figura 6B, la vista medial). En ratones, el proceso lateral es también una proyección del manubrio en el extremo opuesto a la umbo 48. La pars flaccida de la membrana timpánica está por encima del proceso lateral del martillo. apófisis orbiculares no es evidente en el martillo humano.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The authors thank Masaki Yoda and Elise Lamar for critical reading of the manuscript, Kazumasa Takenouchi for help with histology, Mari Fujiwara for help with microscopy and Makoto Morikawa for help in photographing human and mouse auditory ossicles.
Materiales
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Paper towel | DAIO PAPER CORPORATION | 703347 | can be purchased from other vendors |
| Glass Jar | Various | can be purchased from other vendors | |
| 14cm surgical scissors | Fine Science Tools (F.S.T.) | 91400-14 | can be purchased from other vendors |
| Extra fine scissors-straight | Fine Science Tools (F.S.T.) | 14084-08 | can be purchased from other vendors |
| Fine Forceps Angled 45° | Fine Science Tools (F.S.T.) | 11063-07 | can be purchased from other vendors |
| Dissecting microscope | Nikon | SMZ800N | for routine dissection |
| Dissecting microscope | Nikon | SMZ18 | for movies |
| Injection needle 27G | TERUMO | NN-2719S | |
| Syringe (1ml) | TERUMO | SS-01T | |
| Marking Pin | Various | ||
| Tube rotator RT-50 | TAITEC | 0000165-000 | can be purchased from other vendors |
| Cryostat | Leica | CM3050S | http://www.leicabiosystems.com/histology-equipment/cryostats/details/product/leica-cm3050-s/ |
| TC-65 Tungsten blade | Leica | 14021626379 | for Kawamoto's firm method |
| Stainless containers | Leica | for Kawamoto's firm method | |
| Cryofilm type IIC | Leica | for Kawamoto's firm method | |
| Silane coated slide (New Silane II) | Muto Pure Chemicals | 511617 | can be purchased from other vendors |
| Cover glass | Matsunami | can be purchased from other vendors | |
| Tissue processor | Sakura Finetek | VIP-5 | can be purchased from other vendors |
| Tissue Embedding Console System | Sakura Finetek | Tissue-Tek TEC 5 | can be purchased from other vendors |
| Sliding microtome for paraffin | Yamato Kohki Industrial | REM-710 | can be purchased from other vendors |
| Path Blade+pro for hard tissue | Matsunami | PB3503C | for paraffin section |
| Micro-CT | RIGAKU | R_mCT2 | http://www.rigaku.com/en |
| Fluorescence microscope | KEYENCE | BZ-9000 | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Isoflurane | Maruishi pharmaceutical Co. Ltd | ||
| NaCl | wako | 191-01665 | for PBS |
| KCl | wako | 285-14 | for PBS |
| Na2HPO4 12H2O | wako | 196-02835 | for PBS |
| KH2PO4 | wako | 287-21 | for PBS |
| Paraformaldehyde(EM Grade) | TAAB | P001 | |
| EDTA-2Na | wako | 15111-45 | |
| Trizma base | Sigma | T1503-1KG | |
| Super Cryoembedding Medium | Leica | for Kawamoto's firm method | |
| Dry Ice | Various | for Kawamoto's firm method | |
| Hexane | wako | 080-03423 | for Kawamoto's firm method |
| Super Cryomouting Medium type R2 | Leica | for Kawamoto's firm method | |
| Paraffin | Sakura Finetek | 781001A0107 | |
| Histo-Clear | NDS | HS-200 | |
| Calcein | DOJINDO | 340-00433 | |
| Hematoxylin | wako | 131-09665 | |
| Eosin | wako | 051-06515 |
Referencias
- Mallo, M. Formation of the middle ear: recent progress on the developmental and molecular mechanisms. Dev Biol. 231, 410-419 (2001).
- Manley, G. A. An evolutionary perspective on middle ears. Hear Res. 263, 3-8 (2010).
- Kanzaki, S., Ito, M., Takada, Y., Ogawa, K., Matsuo, K. Resorption of auditory ossicles and hearing loss in mice lacking osteoprotegerin. Bone. 39, 414-419 (2006).
- Kanzaki, S., Takada, Y., Ogawa, K., Matsuo, K. Bisphosphonate therapy ameliorates hearing loss in mice lacking osteoprotegerin. J Bone Miner Res. 24, 43-49 (2009).
- Cordas, E. A., et al. Thyroid hormone receptors control developmental maturation of the middle ear and the size of the ossicular bones. Endocrinology. 153, 1548-1560 (2012).
- Dong, W., Varavva, P., Olson, E. S. Sound transmission along the ossicular chain in common wild-type laboratory mice. Hear Res. 301, 27-34 (2013).
- Kanzaki, S., et al. Impaired vibration of auditory ossicles in osteopetrotic mice. Am J Pathol. 178, 1270-1278 (2011).
- Qin, Z., Wood, M., Rosowski, J. J. Measurement of conductive hearing loss in mice. Hear Res. , (2009).
- Klein, J. O. Is acute otitis media a treatable disease?. N Engl J Med. 364, 168-169 (2011).
- Rosch, J. W., et al. A live-attenuated pneumococcal vaccine elicits CD4+ T-cell dependent class switching and provides serotype independent protection against acute otitis media. EMBO Mol Med. 6, 141-154 (2014).
- Li, X., et al. Otitis media in sperm-associated antigen 6 (Spag6)-deficient mice. PLoS One. 9, e112879 (2014).
- Rodríguez Vázquez, J. F., Mérida Velasco, J. R., Jiménez Collado, J. A study of the os goniale in man. Acta Anat (Basel). 142, 188-192 (1991).
- Tucker, A. S., Watson, R. P., Lettice, L. A., Yamada, G., Hill, R. E. Bapx1 regulates patterning in the middle ear: altered regulatory role in the transition from the proximal jaw during vertebrate evolution. Development. 131, 1235-1245 (2004).
- Matsuo, K., et al. Osteogenic capillaries orchestrate growth plate-independent ossification of the malleus. Development. 142, 3912-3920 (2015).
- Matsuo, K. Cross-talk among bone cells. Curr Opin Nephrol Hypertens. 18, 292-297 (2009).
- Rijli, F. M., et al. A homeotic transformation is generated in the rostral branchial region of the head by disruption of Hoxa-2, which acts as a selector gene. Cell. 75, 1333-1349 (1993).
- Mallo, M., Gridley, T. Development of the mammalian ear: coordinate regulation of formation of the tympanic ring and the external acoustic meatus. Development. 122, 173-179 (1996).
- O'Gorman, S. Second branchial arch lineages of the middle ear of wild-type and Hoxa2 mutant mice. Dev Dyn. 234, 124-131 (2005).
- Santagati, F., Minoux, M., Ren, S. Y., Rijli, F. M. Temporal requirement of Hoxa2 in cranial neural crest skeletal morphogenesis. Development. 132, 4927-4936 (2005).
- Satokata, I., Maas, R. Msx1 deficient mice exhibit cleft palate and abnormalities of craniofacial and tooth development. Nat Genet. 6, 348-356 (1994).
- Zhang, Z., et al. Malleal processus brevis is dispensable for normal hearing in mice. Dev Dyn. 227, 69-77 (2003).
- Houzelstein, D., Cohen, A., Buckingham, M. E., Robert, B. Insertional mutation of the mouse Msx1 homeobox gene by an nlacZ reporter gene. Mech Dev. 65, 123-133 (1997).
- Martin, J. F., Bradley, A., Olson, E. N. The paired-like homeo box gene MHox is required for early events of skeletogenesis in multiple lineages. Genes Dev. 9, 1237-1249 (1995).
- Yamada, G., et al. Targeted mutation of the murine goosecoid gene results in craniofacial defects and neonatal death. Development. 121, 3005-3012 (1995).
- Rivera-Pérez, J. A., Mallo, M., Gendron-Maguire, M., Gridley, T., Behringer, R. R. Goosecoid is not an essential component of the mouse gastrula organizer but is required for craniofacial and rib development. Development. 121, 3005-3012 (1995).
- Coré, N., et al. Tshz1 is required for axial skeleton, soft palate and middle ear development in mice. Dev Biol. 308, 407-420 (2007).
- Li, C., Scott, D. A., Hatch, E., Tian, X., Mansour, S. L. Dusp6 (Mkp3) is a negative feedback regulator of FGF-stimulated ERK signaling during mouse development. Development. 134, 167-176 (2007).
- Hwang, C. H., Wu, D. K. Noggin heterozygous mice: an animal model for congenital conductive hearing loss in humans. Hum Mol Genet. 17, 844-853 (2008).
- Calvert, J. A., et al. A missense mutation in Fgfr1 causes ear and skull defects in hush puppy mice. Mamm Genome. 22, 290-305 (2011).
- Carpinelli, M. R., et al. Anti-apoptotic gene Bcl2 is required for stapes development and hearing. Cell death dis. 3, e362 (2012).
- Chapman, S. C. Can you hear me now? Understanding vertebrate middle ear development. Front Biosci (Landmark Ed). 16, 1675-1692 (2011).
- Kitazawa, T., et al. Distinct effects of Hoxa2 overexpression in cranial neural crest populations reveal that the mammalian hyomandibular-ceratohyal boundary maps within the styloid process. Dev Biol. 402, 162-174 (2015).
- Wang, L., et al. Scleraxis is required for differentiation of the stapedius and tensor tympani tendons of the middle ear. J Assoc Res Otolaryngol. 12, 407-421 (2011).
- Amin, S., Tucker, A. S. Joint formation in the middle ear: lessons from the mouse and guinea pig. Dev Dyn. 235, 1326-1333 (2006).
- Amin, S., Matalova, E., Simpson, C., Yoshida, H., Tucker, A. S. Incudomalleal joint formation: the roles of apoptosis, migration and downregulation. BMC Dev Biol. 7, 134 (2007).
- Hiruma, T., Nakajima, Y., Nakamura, H. Development of pharyngeal arch arteries in early mouse embryo. Journal of anatomy. 201, 15-29 (2002).
- Treuting, P. M., Dintzis, S. M., Treuting, P. M., Dintzis, S. M. Ch. 22, Special senses: ear. Comparative Anatomy and Histology: A Mouse and Human Atlas. 22, 419-432 (2012).
- Mallo, M., Schrewe, H., Martin, J. F., Olson, E. N., Ohnemus, S. Assembling a functional tympanic membrane: signals from the external acoustic meatus coordinate development of the malleal manubrium. Development. 127, 4127-4136 (2000).
- Anthwal, N., Joshi, L., Tucker, A. S. Evolution of the mammalian middle ear and jaw: adaptations and novel structures. Journal of anatomy. 222, 147-160 (2013).
- Takechi, M., Kuratani, S. History of studies on mammalian middle ear evolution: a comparative morphological and developmental biology perspective. J Exp Zool B Mol Dev Evol. 314, 417-433 (2010).
- Henson, O. W., Keidel, W. D., Neff, W. D. Ch. 3, Comparative Anatomy of the Middle Ear. Handbook of Sensory Physiology. Vol. 1, Auditory System. Anatomy, Physiology (Ear), 39-110 (1974).
- . . Handbook of Histology Methods for Bone and Cartilage. , (2003).
- Kawamoto, T. Use of a new adhesive film for the preparation of multi-purpose fresh-frozen sections from hard tissues, whole-animals, insects and plants. Arch Histol Cytol. 66, 123-143 (2003).
- Kampen, P. N. V. . Gegenbaurs Morphologiesches Jahrbuch. 34, 321-722 (1905).
- Lee, J. H., Park, K., Kang, T. C., Choung, Y. H. Three-dimensional anatomy of the temporal bone in normal mice. Anat Histol Embryol. 38, 311-315 (2009).
- Fleischer, G. Evolutionary principles of the mammalian middle ear. Adv Anat Embryol Cell Biol. 55, 3-70 (1978).
- Lavender, D., Taraskin, S. N., Mason, M. J. Mass distribution and rotational inertia of "microtype" and "freely mobile" middle ear ossicles in rodents. Hear Res. 282, 97-107 (2011).
- Mason, M. J. Of mice, moles and guinea pigs: functional morphology of the middle ear in living mammals. Hear Res. 301, 4-18 (2013).
- Willi, U. B., Ferrazzini, M. A., Huber, A. M. The incudo-malleolar joint and sound transmission losses. Hear Res. 174, 32-44 (2002).
- Richter, C. A., et al. Defects in middle ear cavitation cause conductive hearing loss in the Tcof1 mutant mouse. Hum Mol Genet. 19, 1551-1560 (2010).
- Buytaert, J. A., Johnson, S. B., Dierick, M., Salih, W. H., Santi, P. A. MicroCT versus sTSLIM 3D imaging of the mouse cochlea. J Histochem Cytochem. 61, 382-395 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados