Method Article
La dissezione del Auditory Bulla nei topi postnatale: Isolamento delle ossa dell'orecchio medio e l'analisi istologica
In questo articolo
Riepilogo
We present a protocol to isolate the auditory bulla, capsule, and ossicles from postnatal mice for whole mount and histological analysis.
Abstract
Nella maggior parte dei mammiferi, ossicini dell'orecchio medio, tra cui il martello, l'incudine e la staffa, sono le ossa più piccole. Nei topi, una struttura ossea chiamata bulla uditivo ospita gli ossicini, mentre la capsula uditivo racchiude l'orecchio interno, vale a dire la coclea e canali semicircolari. ossicini murini sono essenziali per l'ascolto e quindi di grande interesse per i ricercatori nel campo della otorinolaringoiatria, ma il loro metabolismo, lo sviluppo e l'evoluzione sono molto importanti per altri campi. Metabolismo osseo Altered può influenzare la funzione dell'udito nei topi adulti, e vari topi gene-carenti mostrano cambiamenti nella morfogenesi di ossicini uditivi in utero. Anche se murini ossicini sono piccoli, la loro manipolazione è fattibile se si comprende il loro orientamento anatomico e struttura 3D. Qui, descriviamo come sezionare la bulla uditivo e capsule di topi postnatale e quindi isolare i singoli ossicini rimuovendo parte della bolla. Discuteremo anche come emletto la bulla e la capsula in diversi orientamenti per generare paraffina o sezioni congelate adatto per la preparazione di sezioni longitudinali, orizzontali, o frontali sul martello. Infine, annoveriamo differenze anatomiche tra mouse e ossicini umani. Questi metodi sarebbero utile per analizzare gli aspetti patologici, di sviluppo e di evoluzione di ossicini e dell'orecchio medio nei topi.
Introduzione
I tre ossicini dell'orecchio medio, vale a dire i martello, incudine e staffa, formano una catena uditivo-specific mammiferi che trasmette il suono dalla membrana timpanica all'orecchio interno, o coclea 1,2. La funzione uditiva può essere valutata in topi misurando Auditory Brainstem Response (ABR) soglie 3-6, e le vibrazioni del martello dietro la membrana timpanica può essere monitorato tramite Laser Doppler Vibrometry (LDV) 7. Grazie alla combinazione di ABR, LDV, e misure di distorsione del prodotto Otoacoustic Emission (DPOAE), ipoacusia trasmissiva può essere discriminato da compromissione neurosensoriale 8.
Modelli animali di condizioni per le orecchie sono necessari, data l'importanza di ascoltare e di salute orecchio per il benessere dei pazienti di tutte le età. Ad esempio, l'otite media è una infezione dell'orecchio molto comune visto nei neonati e nei bambini umani, e gravi, otite media acuta e le sue complicazioni può verificarsi se il Condizione non è trattato con antimicrobici appropriati 9. Modelli murini di otite media potrebbero rivelarsi utili per la comprensione della patogenesi e nello sviluppo di trattamenti 10,11.
Ossicini murini, che (ad eccezione della parte goniale del martello) sono formate da encondrale 12,13, sono molto importanti per lo studio del metabolismo osseo e la morfogenesi. Innanzitutto, le loro piccole dimensioni permette l'analisi ad alta risoluzione di ossa con periostio intatti utilizzando raggi X o la microscopia a fluorescenza 14. In secondo luogo, il metabolismo osseo aberranti, come eccessiva o carente riassorbimento osseo, o interazioni con problemi tra le cellule ossee 15, può essere analizzato come un potenziale contributo alla perdita dell'udito 3,4,7. In terzo luogo, anormale morfogenesi ossicino è riportato in diversi topi gene-deficienti, come gli animali privi Hoxa2 16-19, 20-22 Msx1, Prrx1 23, Goosecoid(GSC) 24,25, Bapx1 13, Tshz1 26, Dusp6 (Mkp3) 27, Noggin (Nog) 28, FGFR1 29, recettore degli ormoni tiroidei (THRA, Thrb) 5, Bcl2 30 e altri 1,31, o nei topi che iperesprimono Hoxa2 32. Infine, nonostante le loro piccole dimensioni, le strutture associate a ossicini come i muscoli e le articolazioni 33 34,35 sono accessibili.
ossicini del mouse sono più piccoli ossicini umani, ma è da notare che l'orecchio centrale del mouse non è una versione in miniatura della sua controparte umana. Ad esempio, nei topi, l'arteria stapediale, che passa attraverso l'anello della staffa, persiste per tutta la vita 36, che negli esseri umani, l'arteria stapediale embrionale scompare durante la gestazione. Inoltre, la morfologia del martello del mouse differisce da quello di the ossa umane (vedi figura 6). Nei topi, l'uditivo (timpanica) bulla racchiude la cavità dell'orecchio medio piena d'aria, mentre negli esseri umani, le cellule mastoidee composto da osso trabecolare nell'osso temporale ospita gli ossicini, piuttosto che una bulla 37. In entrambe le specie, la capsula uditivo (capsula otica, labirinto osseo) racchiude la coclea e canali semicircolari dell'orecchio interno. Biologia comparativa ed evolutiva dell'orecchio medio è stato ampiamente rivisto 38-40.
Il protocollo di seguito prima spiega come sezionare la bulla uditivo e la capsula, che consistono principalmente l'orecchio medio e orecchio interno, rispettivamente. Questo protocollo dimostra anche come isolare il martello, incudine e staffa dal bulla uditivo. Infine, si mostra come orientare la bulla uditivo e capsule per l'incorporamento, in preparazione per il sezionamento del tessuto di ossicini uditivi.
Protocollo
Tutte le procedure sugli animali eseguiti in questo studio sono approvati dalla Keio University Istituzionale cura degli animali e del Comitato uso (IACUC - numero di omologazione: 09221) e seguire le linee guida istituzionali sulla sperimentazione animale presso la Keio University per l'utilizzo degli animali nella ricerca. campioni umani sono stati isolati da un cadavere donato al Dipartimento di Anatomia, Keio University School of Medicine, e sono stati utilizzati in conformità con le normative istituzionali.
1. Isolamento di Auditory Bulla e Capsule
- Euthanize topi in un vaso contenente una piattaforma sopra asciugamani di carta imbevuti di isoflurano o sevoflurano fino ventilazione respiratoria cessa per più di un minuto e quindi eseguire dislocazione cervicale. Fare attenzione a evitare il contatto diretto dei topi con i tovaglioli di carta imbevuti.
- Effettuare una piccola incisione trasversale al lato dorsale del collo e tirare la pelle a parte verso la testa e la coda utilizzando entrambe le mani per esporre sottostante mu collotessuto SCLE.
- Decapitare topi alla regione cervicale con 14 cm forbici chirurgiche taglienti.
- pelle a buccia completamente verso il naso. Tagliare tutta la pelle insieme con il muso e incisivi.
- Inserire le forbici in bocca e tagliare i muscoli masseteri su entrambi i lati.
- Aprire la ganascia attentamente e rimuovere la lingua e la mascella inferiore insieme.
- Utilizzando forbici affilate, cranio spaccato e base del cranio in due metà lungo il piano sagittale mediano (Figura 1A, B).
- Utilizzando pinze, rimuovere gli emisferi cerebrali e cerebellari e del tronco cerebrale. La bulla uditivo e la capsula si trovano lateralmente al cervelletto e tronco cerebrale. Si noti che la bolla uditiva è anche lateralmente alla capsula uditivo (Figura 1C, D).
- Sezionare la bulla e capsula con il circostante ossa del cranio (Figura 1E).
- Trasferire la provetta in un piatto contenente fosfato-Buffered Saline (PBS) pH 7,4 a temperatura ambiente.
- Under una dissezione microscopio binoculare, usare il forcipe per separare le ossa e le forbici per tagliare circondano il confine allentato attorno alla bulla e la capsula (Figura 1F). Le ossa che circondano rimossi sono il basioccipital (confine ventrale), exoccipital (ventro-posteriore confine), sopraoccipitale (bordo posteriore), interparietale, parietale (dorsale di confine), squammoso (confine dorso-anteriore), alisphenoid (bordo anteriore), e basisfenoide (confine antero-ventrale) ossa. Si noti che il processo styliform (Sp), che sostiene l'apertura timpanica del tubo di Eustachio 41, è distinto dal processo stiloideo dell'osso temporale.
2. Isolamento di Auditory Ossicini: martello, incudine e la staffa
- Martello
- Con entrambe le piccole forbici e pinze, rimuovere la parte del canale laterale uditivo esterno al tympanicus solco in modo che la membrana timpanica è visibile (Figura 2A, B).
- Rimuovere parte della membrana timpanica e l'osso timpanica vicino al malleal processus brevis (apofisi orbicolare, vedi la discussione), sia a livello ventrale (tratteggiata) e posteriore (#) pareti (Figura 2C). Il muscolo tympani martello e tensore dovrebbe ora essere esposta (Figura 2D, E).
- Sollevare il martello (Figura 2F) e tagliare il muscolo tensore del timpano con il bordo smussato di un ago G 27 (Figura 2G). Si noti che il manubrio malleal attacca saldamente alla membrana timpanica, come si vede in altri mammiferi.
- Staccare la membrana timpanica con cura dal manubrio, che è fragile. Rimuovere l'osso timpanica per rivelare i tre ossicini.
- Dislocare il martello dal incudine in corrispondenza della giunzione degli ossicini (Figura 2H).
- Isolare il martello dalla frattura del processo anteriore al goniale.
- Incudine e staffe
- isolare tegli incudine tagliando il legamento posteriore del dell'incudine a breve crus (Figura 3A).
- Isolare staffa tagliando l'arteria stapediale prossimità della staffa con il bordo smussato di un ago G 27 (Figura 3B, C). Se necessario, tagliare il tendine del muscolo stapediale il processo muscolare della staffa con l'ago.
- Inserire un ago per cucire (o uno spillo marcatura) nei forame otturatorio della staffa e sollevare la staffa. Dopo aver rimosso la staffa, l'apertura finestra ovale deve essere chiaramente visibile (Figura 3D).
3. Integrazione di Auditory Bulla e Capsule
- Preparazione per l'incorporamento in blocchi di paraffina
- Isolare la bulla e la capsula come descritto nella Sezione 1.
- Tagliare l'estremità anteriore della bolla (il processo styliform) al largo con le forbici, immergere la bulla e la capsula nel 4% paraformaldeide (PFA) in PBS a 4 °C, e consentire fissativo per entrare nel bulla. Se l'aria rimane intrappolata nella bolla, rimuoverla con un ago e la siringa. Lasciare la bulla e capsule nel fissativo a 4 ° CO / N su un rotatore tubo.
Attenzione: PFA è tossico e deve essere maneggiato con cura. - Risciacquare una volta con PBS.
- Decalcificare bulla e capsule per una settimana a 4 ° C in 10% etilendiamminotetraacetico sale disodico diidrato (EDTA-2Na), 100 base mM Tris, pH 7,0, in un tubo 2 mL. Modificare il buffer di ogni altro giorno.
- Risciacquare una volta con PBS. I campioni possono essere conservati in etanolo al 70% in acqua a 4 ° C. Facoltativamente, il trasferimento al 70% di etanolo attraverso una serie graduata di alcool (30%, 50%, 70% in acqua).
- Su un processore tessuto, disidrata esemplari in una serie graduata di soluzioni di etanolo (70%, 2x 95%, 3x 100%, ogni 1 h), xilene (4x, ogni 1 ora a 40 ° C), e infiltrarsi provini con cera di paraffina fusa 42. Opzionalmente, xilene sostituto con clearin tessuto commercialesoluzione g (per esempio, Histo-Clear).
- Scaricare esemplari dal processore, e rimuoverli dalle loro cassette.
- Su un sistema console tessuto embedding, luogo campioni in stampi riempiti di paraffina fusa. Procedere alla embedding (sezione 4).
- Preparazione per l'incorporamento in blocchi congelati (metodo film di Kawamoto) 43
- Isolare la bulla e la capsula come descritto nella Sezione 1.
- Tagliare l'estremità anteriore della bolla (il processo styliform) con forbici, immergere il bulla e capsule in fissativo (2% o 1% PFA anziché 4% in PBS per preservare antigenicità) a 4 ° C. Se l'aria è intrappolato in bulla, rimuoverlo usando un ago e la siringa. Lasciare la bulla e capsule nel fissativo a 4 ° CO / N su un rotatore tubo.
- Lavare bulla e la capsula rapidamente in PBS e subito immergere in compound crio-embedding liquido a 4 ° C.
- Importante: rimuovere le bolle d'aria eventualmente in mezzoed orecchio esterno attraverso l'aspirazione da un ago, e aggiungendo il composto incorporamento con una pinza. Procedere alla embedding (sezione 4).
4. Orientamento del campione e Embedding
NOTA: L'intero bulla e la capsula devono essere disposti in un particolare orientamento durante l'incorporamento di tagliare sezioni desiderate. Le procedure descritte di seguito vengono utilizzate per la sezione martello in diversi orientamenti.
- Longitudinale (parasagittale) sezionamento del martello
- Mettere la parte laterale della bolla o condotto uditivo esterno basso in paraffina calda (o di composti crio-embedding). Regolare l'orientamento in modo che il collo e trasversale lamina del martello sono parallele al fondo orizzontale del piatto incorporamento (Figura 4A - C). Si noti che la membrana timpanica è inclinata di un angolo di circa 30 ° rispetto alla verticale nella testa del mouse (Figura 4A; la figura 59 in Kampen 44).
- Sezionamento orizzontale del martello
- Posizionare la cresta dorsale orizzontalmente in paraffina calda (o di composti crio-embedding). Regolare l'orientamento della bolla e della capsula in modo che il collo e trasversale lamina del martello sono perpendicolari al fondo del piatto incorporamento (Figura 4D - F).
- Sezionamento frontale (sezioni) del manubrio e della membrana timpanica 5
- Posizionare il manubrio malleal in paraffina calda (o di composti crio-embedding) tale che è perpendicolare al fondo del piatto incorporamento.
- Raffreddare il blocco a temperature adeguate per indurire paraffina su un sistema di console tessuto embedding (in alternativa, composto crio-embedding in ghiaccio / vasca esano secco).
- blocco dei tessuti di processo e sezioni tagliate utilizzando procedure di routine. Ad esempio, le sezioni macchia paraffina con ematossilina e eosina (H & #38; E), safranina O (per la cartilagine), o per il tartrato resistente attività fosfatasi acida (TRAP) (per osteoclasti) 3, o mediante immunoistochimica. Criosezioni Undecalcified sono adatti per l'etichettatura delle ossa utilizzando fluorocromi 14, alizarin colorazione rosso per il calcio, ed immunofluorescenza 42.
Risultati
Questo protocollo presenta un metodo per isolare ossicini dalla bolla del mouse uditivo. Innanzitutto, la bolla e capsule sono sezionati come un unico pezzo dal cranio (Figura 1). La bolla sezionato viene poi utilizzata per preparare il martello (Figura 2) e l'incudine e staffe (Figura 3). Punti di riferimento della bulla uditivo e capsule sono il processo styliform alla fine anteriore della bolla, la cresta dorsale, anteriore canale semicircolare, e la fossa subarcuate (Figura 1F). Microcomputed tomografia (CT) Imaging rivela ossicini della bolla uditiva nonché gli orientamenti ottimali per sezionamento longitudinale ed orizzontale di detti ossicini (Figura 4).
Per longitudinale paraffina sezionamento del martello, la bolla e capsule sono state decalcificate in EDTA a 4 ° C per una settimana, incorporato in un pablocco Raffin con l'orientamento mostrato in Figura 4 A - C, sezionato a 4 micron, e quindi colorato con H & E. Il martello attaccato alla membrana timpanica in bolla uditiva rivelato corso encondrale a P14 (Figura 5A). Per visualizzare formazione di nuovo osso, calceina (30 mcg / g di peso corporeo) è stato peritoneally iniettato in un topo P20, e bulla e la capsula sono stati isolati 24 ore dopo a P21. Il campione senza decalcificazione stato incorporato congelato e poi cryosectioned a 6 micron utilizzando una pellicola adesiva sulla base del metodo di Kawamoto 43. Dopo la colorazione nucleare con DAPI (4 ', 6-diamidino-2-fenilindolo), la sezione è stata osservata sotto un microscopio a fluorescenza. Segnali calceina (verde) ha rivelato la formazione di nuovo tessuto osseo nel martello (m), Bulla e capsula (Figura 5B). Per il sezionamento orizzontale del martello, la bulla uditivo isolato da un topo 5 settimane di età è stato incorporato congelato senza decalcificazione (per laorientamento vedi Figura 4D - F), cryosectioned a 6 micron con il metodo Kawamoto, e macchiato con H & E. Sezionamento orizzontale della brevis malleal processus (MPB) mostra anche la coclea (Figura 5C).
Una vista mediale degli ossicini uditivi giusti isolati da un topo P31 presenta caratteristiche tipiche del martello del mouse, vale a dire, il "volo a vela-gabbiano-ala-like" (o persiano spada come 45) manubrio, un processus di primo piano brevis (apofisi orbicolare , vedi Discussione), e la lamina trasversale (Figura 6). Si noti che il processo anteriore (processus anterior) è stato fratturato nella procedura dissezione attorno al goniale ed è stato separato dal ring timpanica (ectotympanic). Questo campione rappresentativo presenta un giunto incudomalleolar intatta tra il martello e incudine, mentre l'articolazione incudostapedial è dislocata. inserzioni tendinee nel malleal estapediali processi muscolari sono rilevabili (Figura 6A, asterischi).
Figura 6B confronta mouse e ossicini umani allo stesso ingrandimento. differenze di specie, diverse dalla taglia, sono i seguenti. Il manubrio è malleal ala-come nei topi, ma club come negli esseri umani. L'angolo tra l'asse anatomico (o l'asse di rotazione, la linea attraverso il processo anteriore del martello e processo breve dell'incudine) ed il manubrio è molto più piccolo in topi ei due sono quasi parallele, al contrario di quasi perpendicolare negli esseri umani 6,46-48. In ossicini umani, gli studi vibrometrico rivelano che la joint-incudo malleolare è mobile, piuttosto che funzionalmente fisso 49. Il martello del mouse presenta un ampio, sottile e piatta lamina trasversale non evidente negli esseri umani 47. Nei topi, anteriore processus fonde alle ossa membranose, vale a dire la goniale e timpanianello c, mentre nell'uomo anteriore processus è ridotta ad una piccola spicule di osso 41. La staffa di topi e gli esseri umani differisce anche: nei topi, la crus anteriore è curvo e la crus posteriore è più dritta, mentre negli esseri umani, la crus anteriore è più diretto rispetto al cru posteriore. Vale la pena notare che la testa martello rispetto alle dimensioni del corpo è massicciamente ampliato in specie come la talpa d'oro, dimostrando una significativa variabilità nei rapporti allometriche dei "più piccoli" ossa 48.
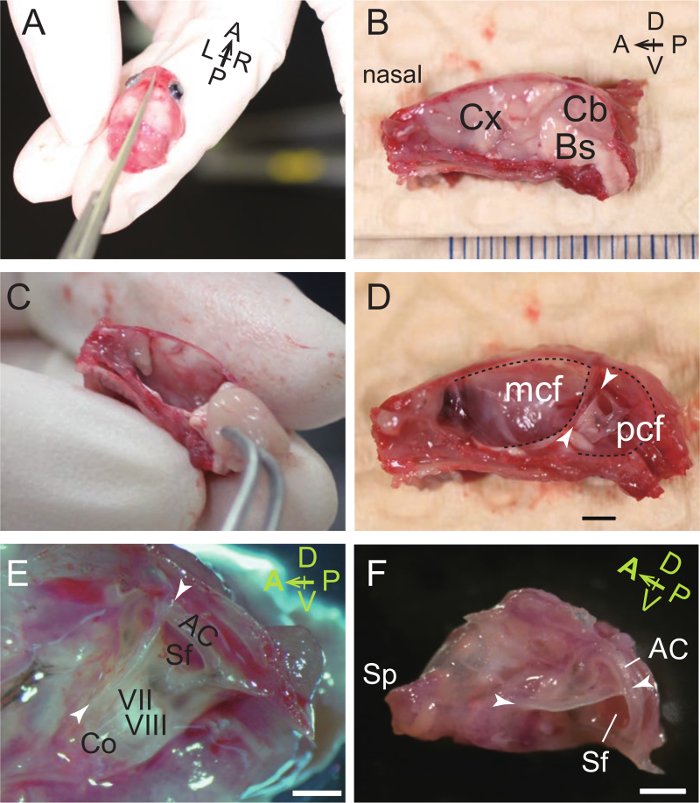
Figura 1. Dissezione del Auditory Bulla e della capsula. (A) Il cranio di un mouse P31 è diviso in due metà destra e sinistra. A, anteriore; P, posteriore; L, a sinistra; R, a destra. (B) superficie mediale della metà destra della tagliata in due, la testa pelata. Cx, corteccia cerebrale; Cb, cervelletto; Bs, Brainstem. D, dorsale; V, ventrale. (C) La rimozione del cervello con una pinza. (D) vista mediale della capsula uditivo nel cranio destra. La cresta dorsale (punte di freccia) si trova tra la fossa cranica mezzo (MCF) e posteriore del cranio fossa (PCF) e separa dorso-anteriore e superfici ventro-posteriore della capsula uditivo. Barra di scala, 2 mm. (E) maggiore ingrandimento di bulla uditivo e capsula (vista mediale). Co, coclea; VII, nervo facciale; VIII, nervo vestibolococleare; AC, anteriore (superiore) Canale semicircolare; Sf, fossa subarcuate, che ospita il paraflocculus cerebellare. Barra di scala, 1 mm. (F) Micrografia di isolati bulla uditivo e capsula (vista mediale). Sp, processo styliform. Barra di scala, 1 mm. (A - E), P31 mouse. (F), P33 mouse. Clicca qui per vedere una versione più grande di questa figura.
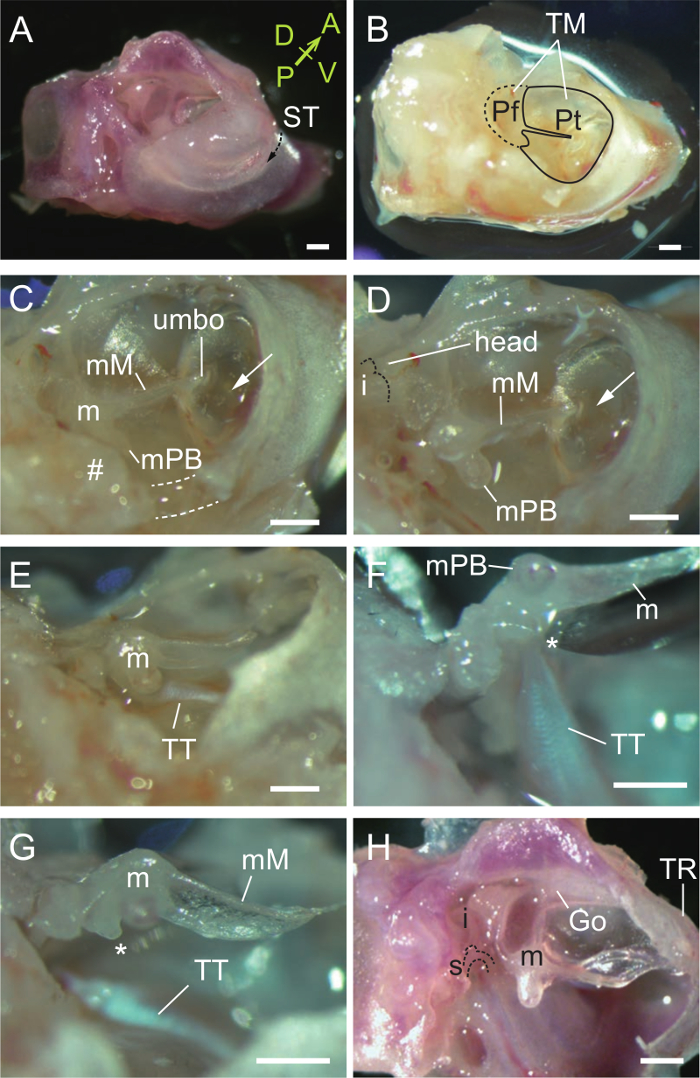
Figura 2. La dissezione del Malleus. (A) Vista ventrolaterale di una bolla uditiva destra e capsula. Il tympanicus solco (ST, freccia tratteggiata) è il sito di attacco della membrana timpanica. Il laterali osso al ST è parte dell'orecchio esterno e mediale osso al ST forma il pavimento della cavità dell'orecchio medio. A, anteriore; P, posteriore; D, dorsale; V, ventrale. (B) Vista dopo la rimozione del condotto uditivo esterno per rivelare la membrana timpanica (TM), comprese le pars flaccida (Pf) e pars Tensa (Pt). (C) rimozione di parti di osso timpanica (linee tratteggiate e #) vicino al malleal processus brevis (MPB). m, malleus; mM, manubrio malleal. Freccia, bolla d'aria nella cavità dell'orecchio medio visto attraverso la membrana timpanica. (D) Malleus esposto. Malleus testa è indicato. punteggiatolinea indica la superficie articolare dell'incudine. (E) tendine del muscolo tensore del timpano (TT) attaccato al martello. (F) La timpani tensore è tirato quando il martello è sollevato. *, Processo muscolare. (G) Tensor timpani è tagliato con un ago. (H) Tre ossicini dopo la rimozione della membrana timpanica. La joint-incudo malleolare è dislocato. m, malleus; Io, incudine; s, staffa; Go, goniale (fusa al martello e timpanica anello, TR). Tutte le barre di scala, 0,5 mm. (A, H), P33 mouse. (B - G), P31 mouse. Clicca qui per vedere una versione più grande di questa figura.
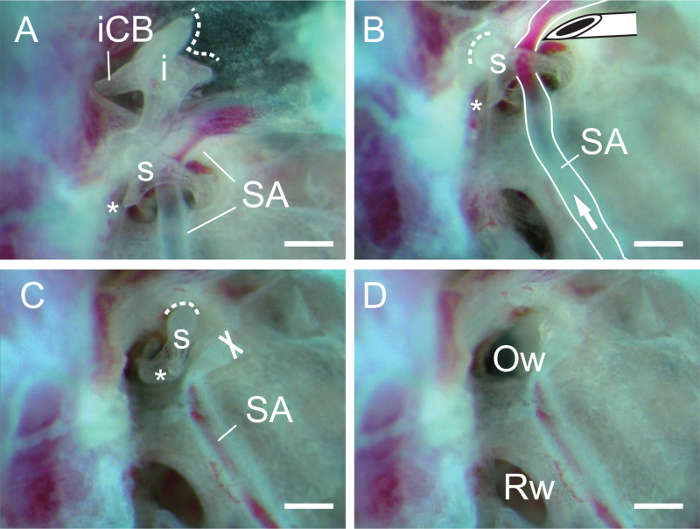
Figura 3. La dissezione del incudine e staffe. (A) Incudine estaffa dopo la rimozione del martello. L'arteria stapediale (SA) passa attraverso la staffa (s). La linea tratteggiata indica la superficie articolare dell'incudine. Si noti che il breve crus (ICB, crus breve) dell'incudine (i) è fissato dal legamento posteriore (non mostrata). Asterisk, processo muscolare della staffa. (B) della staffa dopo la rimozione dell'incudine. punta dell'ago viene utilizzato per tagliare l'arteria stapediale (SA). Freccia, direzione del flusso ematico. La linea tratteggiata indica superficie articolare della staffa. (C) L'arteria stapediale viene rimosso dalla staffa. X indica la fine del taglio dell'arteria stapediale (SA). (D) La finestra ovale (Ow, ovalis Fenestra o vestibuli Fenestra) è visibile dopo la rimozione della staffa. Rw, finestra rotonda (finestra rotonda o coclee Fenestra). Barre di scala, 0,5 mm. Clicca qui per vedere una versione più grande di questafigura.
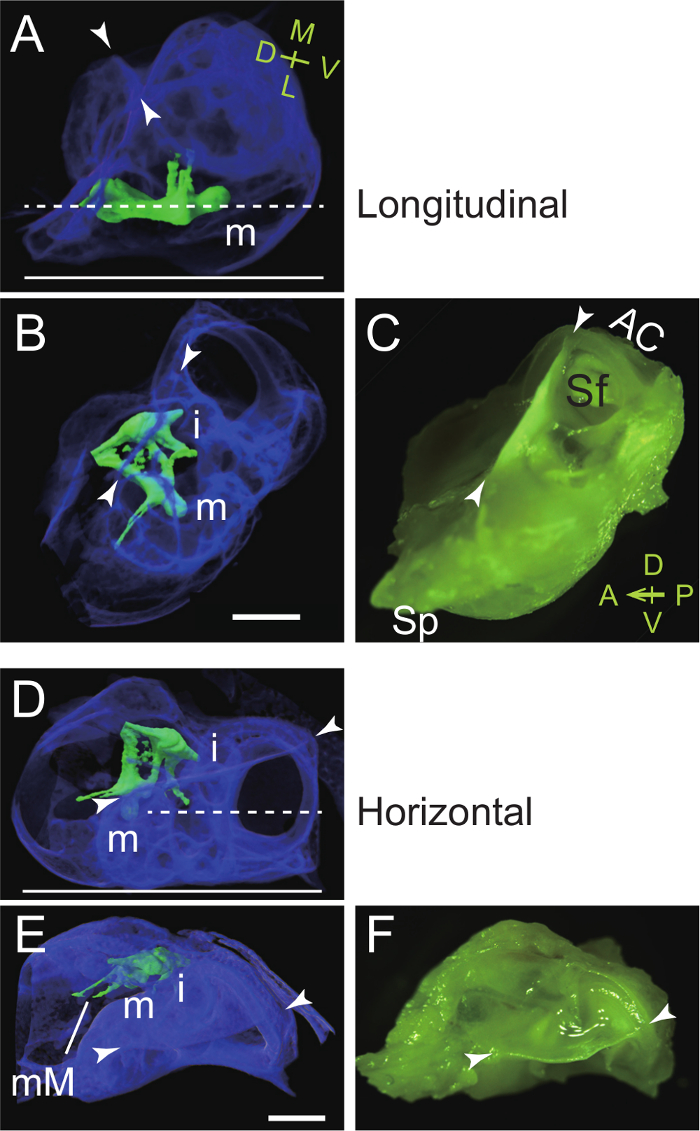
Figura 4. Orientamento uditivo Bulla e della capsula durante Incorporare per Longitudinale (parasagittale, A - C) e orizzontale (D - E) sezionamento del Malleus. (A - C) Il collo e trasversale lamina del martello sono posti parallelamente al fondo del piatto incorporamento. (A) Vista laterale: Immagine micro-CT per mostrare incorporamento del martello proprio in bolla (pseudocolored blu). Il martello e incudine sono pseudocolored verde. La linea tratteggiata, il piano di taglio desiderato. linea continua, fondo di incorporare piatto. m, malleus; punte di freccia, cresta dorsale. M, mediale; L, laterale; D, dorsale; V, ventrale. (B) Vista: immagine Micro-CT. Si noti che l'estremità anteriore della bolla (processo styliform) è stato rimosso. Io, incudine. (C) Vista: microfotografia (prese con unafiltro colore). AC, anteriore (superiore) Canale semicircolare; Sf, fossa subarcuate; Sp, processo styliform. A, anteriore; P, posteriore; D, dorsale; V, ventrale. (D - F) Il brevis processus del martello è posizionato perpendicolare al fondo di incorporamento piatto. (D) Vista laterale: Immagine Micro-CT per mostrare incorporamento del martello destra. La linea tratteggiata, il piano di taglio desiderato. linea continua, fondo di incorporare piatto. (E) Vista: immagine Micro-CT. mM, manubrio malleal. (F) Vista dall'alto: al microscopio (scattate con un filtro di colore). Barre di scala, 1 mm. Immagini Micro-TC sono stati ottenuti con una risoluzione voxel di 5 micron, come precedentemente descritto 7. Clicca qui per vedere una versione più grande di questa figura.
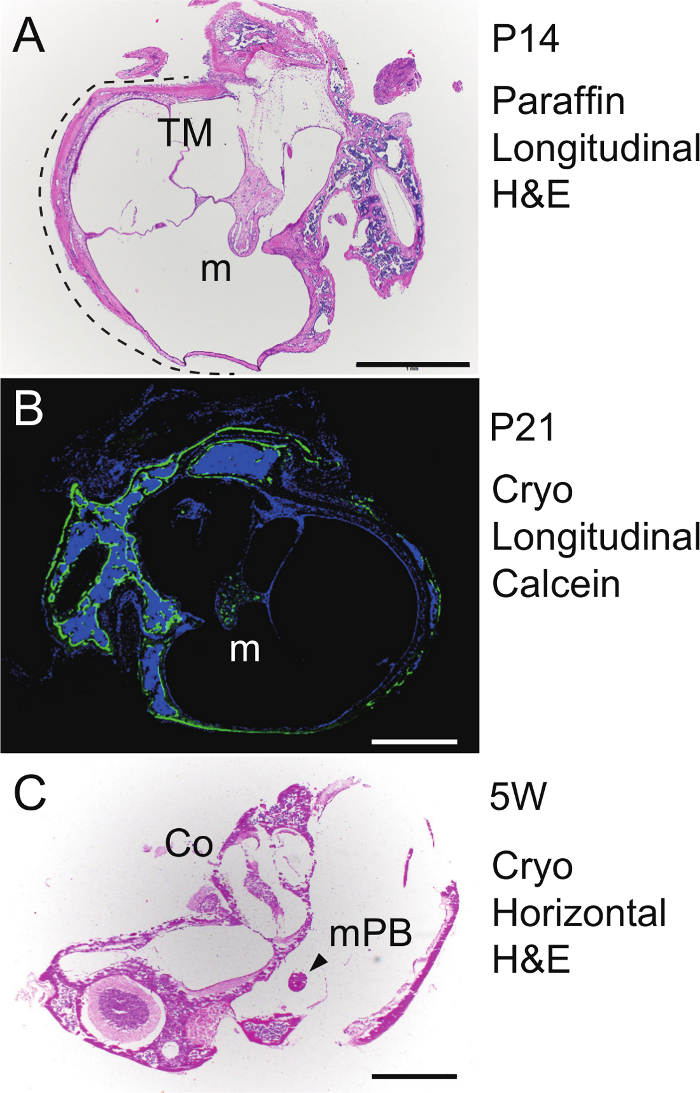
FIGURA 5. Istologia. (A) colorazione H & E. Sezione longitudinale (parasagittale) del martello in paraffina destra (m) nella uditivo bulla (linea tratteggiata) a P14. TM, membrana timpanica. Etichettatura ossea (B) calceina. Sezione longitudinale del, malleus congelato undecalcified sinistra (m) nella bolla uditiva a P21. Di contrasto, DAPI. (C) colorazione H & E. Sezione orizzontale del brevis congelato, undecalcified sinistra malleal processus (MPB) nel bulla uditivo e capsula (5 settimane di età del mouse). Co, coclea. Barre di scala, 1 mm. Clicca qui per vedere una versione più grande di questa figura.

Figura 6. mediale Vista Auditory Ossicini. (A) Diritto ossicini di P31 del mouse. A, anteriore; P, posteriore; D, dorsale; V, ventrale. Barra di scala, 1 mm. malleus testa (Caput mallei, Capitulum mallei); collo (Collum mallei); lamina (lamina trasversale); mm (manubrio mallei); asterisco nero (processo muscolare del martello); MPa (Processus anteriore, Processus gracile); MPB (processus brevis); corpo incudine (Corpus incudis); ICB (breve Crus, breve crus, processo breve); ICL (longum Crus, lungo crus, lungo processo); IPL (Processus Lenticularis, processo lenticolare, Sylvian apofisi); testa della staffa (Caput stapedis); asterisco bianco (processo muscolare della staffa); sca (Crus anterius, crus anteriore); SCP (Crus posterius, posteriore crus); di base (stapedis base, pedana); SOF (forame otturatorio, forame intercrural). (B) destra ossicini di un 76-year-old femmina umana (Per gentile concessione del Dipartimento di Anatomia, Keio University School of Medicine). Gli ossicini di topo P31 (in basso a destra) vengono esposte allo stesso ingrandimento di quello usato per ossicini umani. curvfrecce cati indicano l'angolo tra l'asse anatomico e il manubrio (linee tratteggiate). Barra di scala, 2 mm. Clicca qui per vedere una versione più grande di questa figura.
Discussione
Qui, vi presentiamo un metodo utile per isolare la bulla uditivo e la capsula nei topi postnatale. Prima di P12, i tessuti sono fragili e possono essere danneggiati durante l'isolamento. Dopo P12, la bulla uditivo e capsule possono essere facilmente isolati dai tessuti circostanti. Sezionare la bulla dalla testa prima di sezionamento ha diversi vantaggi. In primo luogo, la cavitazione e la crescita della bolla uditiva postnatale si verificano più attivamente dal P6 in poi e sono completi da P14 50. Il tessuto mesenchimale tra la membrana timpanica e la parete cocleare viene sostituita da aria attraverso il processo di cavitazione. L'aria risultante nella cavità dell'orecchio medio può impedire il contatto tra i tessuti e liquidi durante la fissazione, decalcificazione e incorporamento. E 'più facile per eliminare l'aria dal bulla uditivo isolato tagliando la fine (processo styliform) anterior piuttosto che cercare di farlo nel bulla non isolato. In secondo luogo, l'orientamento del martello (e la membrana timpanica) non è verticalenella testa. È quindi più facile da parte del martello in piani desiderati incorporando isolate bulla uditivo e capsule in un determinato orientamento.
Una volta isolato, bulla uditivo e le capsule sono utili per numerose analisi. Ad esempio, alta risoluzione a raggi X micro-CT può rivelare osso microstruttura morfologia come capillari osteogeniche del martello 14. Il stereofluorescence dissezione microscopio è un potente strumento per visualizzare le strutture nella valutazione topi indicatori che esprimono proteine fluorescenti nell'orecchio medio o interno 33. Inoltre, vari in vivo o ex vivo fluorescenza metodi di etichettatura e di tutta la rilevazione immunofluorescenza monte possono essere intraprese. Luce microscopia a fluorescenza con è utile anche per l'analisi tridimensionale 51. Anche se qui non descritto, diverse strutture anatomiche associate con la bolla uditivo e capsule come nervi periferici, vasi sanguigni, ela membrana timpanica nell'orecchio medio può anche essere valutata utilizzando questo protocollo.
Si noti che la paraffina sezionamento richiede la decalcificazione di tessuti ossei prima di incorporare e quindi non consentire l'analisi di mineralizzazione. Al contrario, il metodo pellicola Kawamoto 43 utilizzato per preparare sezioni congelate può essere eseguita senza la decalcificazione ed è adatto per studi di mineralizzazione utilizzando tecniche in osso-etichettatura vivo o schegge speciali come alizarina colorazione. condizioni di Cryo-sezionamento devono essere ottimizzati in funzione in base all'età del mouse. Ad esempio, una temperatura meno fredda all'interno della camera criostato è raccomandato per esemplari più vecchi mouse per minimizzare i danni alle sezioni.
Nel topo, il termine corretto per la sporgenza di primo piano semi-sferica del martello è "apofisi orbicolare". Tuttavia, il termine "processus brevis" è stato ampiamente utilizzato per indicare all'apofisi orbicolare per più thun ventennio, in particolare tra il mouse biologi dello sviluppo 16,20,22-25. "Processus brevis", originariamente riferito al processo laterale (processus lateralis), che si differenzia dal apofisi orbicolare. Negli esseri umani, un processo laterale simile a una leggera sporgenza conica costituisce la linea generale di attacco alla membrana timpanica, che si estende dal manubrio (non visibile in figura 6B, vista mediale). Nei topi, il processo laterale è anche una proiezione del manubrio all'estremità opposta al umbone 48. I pars flaccida della membrana timpanica è al di sopra del processo laterale del martello. apofisi orbicolare non è evidente nel martello umano.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The authors thank Masaki Yoda and Elise Lamar for critical reading of the manuscript, Kazumasa Takenouchi for help with histology, Mari Fujiwara for help with microscopy and Makoto Morikawa for help in photographing human and mouse auditory ossicles.
Materiali
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Paper towel | DAIO PAPER CORPORATION | 703347 | can be purchased from other vendors |
| Glass Jar | Various | can be purchased from other vendors | |
| 14cm surgical scissors | Fine Science Tools (F.S.T.) | 91400-14 | can be purchased from other vendors |
| Extra fine scissors-straight | Fine Science Tools (F.S.T.) | 14084-08 | can be purchased from other vendors |
| Fine Forceps Angled 45° | Fine Science Tools (F.S.T.) | 11063-07 | can be purchased from other vendors |
| Dissecting microscope | Nikon | SMZ800N | for routine dissection |
| Dissecting microscope | Nikon | SMZ18 | for movies |
| Injection needle 27G | TERUMO | NN-2719S | |
| Syringe (1ml) | TERUMO | SS-01T | |
| Marking Pin | Various | ||
| Tube rotator RT-50 | TAITEC | 0000165-000 | can be purchased from other vendors |
| Cryostat | Leica | CM3050S | http://www.leicabiosystems.com/histology-equipment/cryostats/details/product/leica-cm3050-s/ |
| TC-65 Tungsten blade | Leica | 14021626379 | for Kawamoto's firm method |
| Stainless containers | Leica | for Kawamoto's firm method | |
| Cryofilm type IIC | Leica | for Kawamoto's firm method | |
| Silane coated slide (New Silane II) | Muto Pure Chemicals | 511617 | can be purchased from other vendors |
| Cover glass | Matsunami | can be purchased from other vendors | |
| Tissue processor | Sakura Finetek | VIP-5 | can be purchased from other vendors |
| Tissue Embedding Console System | Sakura Finetek | Tissue-Tek TEC 5 | can be purchased from other vendors |
| Sliding microtome for paraffin | Yamato Kohki Industrial | REM-710 | can be purchased from other vendors |
| Path Blade+pro for hard tissue | Matsunami | PB3503C | for paraffin section |
| Micro-CT | RIGAKU | R_mCT2 | http://www.rigaku.com/en |
| Fluorescence microscope | KEYENCE | BZ-9000 | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Isoflurane | Maruishi pharmaceutical Co. Ltd | ||
| NaCl | wako | 191-01665 | for PBS |
| KCl | wako | 285-14 | for PBS |
| Na2HPO4 12H2O | wako | 196-02835 | for PBS |
| KH2PO4 | wako | 287-21 | for PBS |
| Paraformaldehyde(EM Grade) | TAAB | P001 | |
| EDTA-2Na | wako | 15111-45 | |
| Trizma base | Sigma | T1503-1KG | |
| Super Cryoembedding Medium | Leica | for Kawamoto's firm method | |
| Dry Ice | Various | for Kawamoto's firm method | |
| Hexane | wako | 080-03423 | for Kawamoto's firm method |
| Super Cryomouting Medium type R2 | Leica | for Kawamoto's firm method | |
| Paraffin | Sakura Finetek | 781001A0107 | |
| Histo-Clear | NDS | HS-200 | |
| Calcein | DOJINDO | 340-00433 | |
| Hematoxylin | wako | 131-09665 | |
| Eosin | wako | 051-06515 |
Riferimenti
- Mallo, M. Formation of the middle ear: recent progress on the developmental and molecular mechanisms. Dev Biol. 231, 410-419 (2001).
- Manley, G. A. An evolutionary perspective on middle ears. Hear Res. 263, 3-8 (2010).
- Kanzaki, S., Ito, M., Takada, Y., Ogawa, K., Matsuo, K. Resorption of auditory ossicles and hearing loss in mice lacking osteoprotegerin. Bone. 39, 414-419 (2006).
- Kanzaki, S., Takada, Y., Ogawa, K., Matsuo, K. Bisphosphonate therapy ameliorates hearing loss in mice lacking osteoprotegerin. J Bone Miner Res. 24, 43-49 (2009).
- Cordas, E. A., et al. Thyroid hormone receptors control developmental maturation of the middle ear and the size of the ossicular bones. Endocrinology. 153, 1548-1560 (2012).
- Dong, W., Varavva, P., Olson, E. S. Sound transmission along the ossicular chain in common wild-type laboratory mice. Hear Res. 301, 27-34 (2013).
- Kanzaki, S., et al. Impaired vibration of auditory ossicles in osteopetrotic mice. Am J Pathol. 178, 1270-1278 (2011).
- Qin, Z., Wood, M., Rosowski, J. J. Measurement of conductive hearing loss in mice. Hear Res. , (2009).
- Klein, J. O. Is acute otitis media a treatable disease?. N Engl J Med. 364, 168-169 (2011).
- Rosch, J. W., et al. A live-attenuated pneumococcal vaccine elicits CD4+ T-cell dependent class switching and provides serotype independent protection against acute otitis media. EMBO Mol Med. 6, 141-154 (2014).
- Li, X., et al. Otitis media in sperm-associated antigen 6 (Spag6)-deficient mice. PLoS One. 9, e112879 (2014).
- Rodríguez Vázquez, J. F., Mérida Velasco, J. R., Jiménez Collado, J. A study of the os goniale in man. Acta Anat (Basel). 142, 188-192 (1991).
- Tucker, A. S., Watson, R. P., Lettice, L. A., Yamada, G., Hill, R. E. Bapx1 regulates patterning in the middle ear: altered regulatory role in the transition from the proximal jaw during vertebrate evolution. Development. 131, 1235-1245 (2004).
- Matsuo, K., et al. Osteogenic capillaries orchestrate growth plate-independent ossification of the malleus. Development. 142, 3912-3920 (2015).
- Matsuo, K. Cross-talk among bone cells. Curr Opin Nephrol Hypertens. 18, 292-297 (2009).
- Rijli, F. M., et al. A homeotic transformation is generated in the rostral branchial region of the head by disruption of Hoxa-2, which acts as a selector gene. Cell. 75, 1333-1349 (1993).
- Mallo, M., Gridley, T. Development of the mammalian ear: coordinate regulation of formation of the tympanic ring and the external acoustic meatus. Development. 122, 173-179 (1996).
- O'Gorman, S. Second branchial arch lineages of the middle ear of wild-type and Hoxa2 mutant mice. Dev Dyn. 234, 124-131 (2005).
- Santagati, F., Minoux, M., Ren, S. Y., Rijli, F. M. Temporal requirement of Hoxa2 in cranial neural crest skeletal morphogenesis. Development. 132, 4927-4936 (2005).
- Satokata, I., Maas, R. Msx1 deficient mice exhibit cleft palate and abnormalities of craniofacial and tooth development. Nat Genet. 6, 348-356 (1994).
- Zhang, Z., et al. Malleal processus brevis is dispensable for normal hearing in mice. Dev Dyn. 227, 69-77 (2003).
- Houzelstein, D., Cohen, A., Buckingham, M. E., Robert, B. Insertional mutation of the mouse Msx1 homeobox gene by an nlacZ reporter gene. Mech Dev. 65, 123-133 (1997).
- Martin, J. F., Bradley, A., Olson, E. N. The paired-like homeo box gene MHox is required for early events of skeletogenesis in multiple lineages. Genes Dev. 9, 1237-1249 (1995).
- Yamada, G., et al. Targeted mutation of the murine goosecoid gene results in craniofacial defects and neonatal death. Development. 121, 3005-3012 (1995).
- Rivera-Pérez, J. A., Mallo, M., Gendron-Maguire, M., Gridley, T., Behringer, R. R. Goosecoid is not an essential component of the mouse gastrula organizer but is required for craniofacial and rib development. Development. 121, 3005-3012 (1995).
- Coré, N., et al. Tshz1 is required for axial skeleton, soft palate and middle ear development in mice. Dev Biol. 308, 407-420 (2007).
- Li, C., Scott, D. A., Hatch, E., Tian, X., Mansour, S. L. Dusp6 (Mkp3) is a negative feedback regulator of FGF-stimulated ERK signaling during mouse development. Development. 134, 167-176 (2007).
- Hwang, C. H., Wu, D. K. Noggin heterozygous mice: an animal model for congenital conductive hearing loss in humans. Hum Mol Genet. 17, 844-853 (2008).
- Calvert, J. A., et al. A missense mutation in Fgfr1 causes ear and skull defects in hush puppy mice. Mamm Genome. 22, 290-305 (2011).
- Carpinelli, M. R., et al. Anti-apoptotic gene Bcl2 is required for stapes development and hearing. Cell death dis. 3, e362 (2012).
- Chapman, S. C. Can you hear me now? Understanding vertebrate middle ear development. Front Biosci (Landmark Ed). 16, 1675-1692 (2011).
- Kitazawa, T., et al. Distinct effects of Hoxa2 overexpression in cranial neural crest populations reveal that the mammalian hyomandibular-ceratohyal boundary maps within the styloid process. Dev Biol. 402, 162-174 (2015).
- Wang, L., et al. Scleraxis is required for differentiation of the stapedius and tensor tympani tendons of the middle ear. J Assoc Res Otolaryngol. 12, 407-421 (2011).
- Amin, S., Tucker, A. S. Joint formation in the middle ear: lessons from the mouse and guinea pig. Dev Dyn. 235, 1326-1333 (2006).
- Amin, S., Matalova, E., Simpson, C., Yoshida, H., Tucker, A. S. Incudomalleal joint formation: the roles of apoptosis, migration and downregulation. BMC Dev Biol. 7, 134 (2007).
- Hiruma, T., Nakajima, Y., Nakamura, H. Development of pharyngeal arch arteries in early mouse embryo. Journal of anatomy. 201, 15-29 (2002).
- Treuting, P. M., Dintzis, S. M., Treuting, P. M., Dintzis, S. M. Ch. 22, Special senses: ear. Comparative Anatomy and Histology: A Mouse and Human Atlas. 22, 419-432 (2012).
- Mallo, M., Schrewe, H., Martin, J. F., Olson, E. N., Ohnemus, S. Assembling a functional tympanic membrane: signals from the external acoustic meatus coordinate development of the malleal manubrium. Development. 127, 4127-4136 (2000).
- Anthwal, N., Joshi, L., Tucker, A. S. Evolution of the mammalian middle ear and jaw: adaptations and novel structures. Journal of anatomy. 222, 147-160 (2013).
- Takechi, M., Kuratani, S. History of studies on mammalian middle ear evolution: a comparative morphological and developmental biology perspective. J Exp Zool B Mol Dev Evol. 314, 417-433 (2010).
- Henson, O. W., Keidel, W. D., Neff, W. D. Ch. 3, Comparative Anatomy of the Middle Ear. Handbook of Sensory Physiology. Vol. 1, Auditory System. Anatomy, Physiology (Ear), 39-110 (1974).
- . . Handbook of Histology Methods for Bone and Cartilage. , (2003).
- Kawamoto, T. Use of a new adhesive film for the preparation of multi-purpose fresh-frozen sections from hard tissues, whole-animals, insects and plants. Arch Histol Cytol. 66, 123-143 (2003).
- Kampen, P. N. V. . Gegenbaurs Morphologiesches Jahrbuch. 34, 321-722 (1905).
- Lee, J. H., Park, K., Kang, T. C., Choung, Y. H. Three-dimensional anatomy of the temporal bone in normal mice. Anat Histol Embryol. 38, 311-315 (2009).
- Fleischer, G. Evolutionary principles of the mammalian middle ear. Adv Anat Embryol Cell Biol. 55, 3-70 (1978).
- Lavender, D., Taraskin, S. N., Mason, M. J. Mass distribution and rotational inertia of "microtype" and "freely mobile" middle ear ossicles in rodents. Hear Res. 282, 97-107 (2011).
- Mason, M. J. Of mice, moles and guinea pigs: functional morphology of the middle ear in living mammals. Hear Res. 301, 4-18 (2013).
- Willi, U. B., Ferrazzini, M. A., Huber, A. M. The incudo-malleolar joint and sound transmission losses. Hear Res. 174, 32-44 (2002).
- Richter, C. A., et al. Defects in middle ear cavitation cause conductive hearing loss in the Tcof1 mutant mouse. Hum Mol Genet. 19, 1551-1560 (2010).
- Buytaert, J. A., Johnson, S. B., Dierick, M., Salih, W. H., Santi, P. A. MicroCT versus sTSLIM 3D imaging of the mouse cochlea. J Histochem Cytochem. 61, 382-395 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon