Method Article
Dissektion der Auditory Bulla in postnatale Mäuse: Die Isolierung der Gehörknöchelchen und histologische Analyse
In diesem Artikel
Zusammenfassung
We present a protocol to isolate the auditory bulla, capsule, and ossicles from postnatal mice for whole mount and histological analysis.
Zusammenfassung
Bei den meisten Säugetieren, Gehörknöchelchen im Mittelohr, einschließlich der Hammer, Amboß und Steigbügel, sind die kleinsten Knochen. Bei Mäusen, die so genannte eine knöcherne Struktur der auditorischen Bulla die Gehörknöchelchen beherbergt, während die Gehörkapsel das Innenohr umschließt, nämlich die Cochlea und Bogengänge. Murine Gehörknöchelchen sind von wesentlicher Bedeutung für das Hören und somit von großem Interesse für Forscher auf dem Gebiet der HNO-Heilkunde, sondern ihren Stoffwechsel, Entwicklung und Evolution sind auf anderen Gebieten sehr relevant. Veränderte Knochenstoffwechsel kann zu Gehörfunktion in erwachsenen Mäusen beeinflussen und verschiedene Gen-defiziente Mäuse zeigen Veränderungen in der Morphogenese von Gehörknöchelchen in utero. Obwohl murine Gehörknöchelchen klein sind, ist ihre Handhabung möglich ist, wenn man ihre anatomischen Orientierung und 3D-Struktur versteht. Hier beschreiben wir, wie die auditorischen Bulla und Kapsel von postnatalen Mäusen zu sezieren und dann einzelne Gehörknöchelchen isolieren, indem ein Teil der Bulla zu entfernen. Wir diskutieren auch, wie emBett der Bulla und Kapsel in unterschiedlichen Ausrichtungen geeignet zur Herstellung von longitudinal, horizontal oder frontalen Abschnitte des Malleus Paraffin oder Gefrierschnitten zu erzeugen. Schließlich aufzuzählen wir anatomischen Unterschiede zwischen Maus und Mensch Gehörknöchelchen. Diese Verfahren wäre nützlich bei der Analyse von pathologischen, Entwicklungs- und evolutionäre Aspekte der Gehörknöchelchen und das Mittelohr bei Mäusen.
Einleitung
Die drei Gehörknöchelchen des Mittelohrs, nämlich die Hammer, Amboß und Steigbügel, bilden eine Säugetierspezifischen auditorischen Kette , die Schall vom Trommelfell zum Innenohr überträgt, oder Cochlea 1,2. Gehörfunktion kann durch Messung Hirnstammaudiometrie (ABR) Schwellen 3-6, und die Schwingung des Hammers hinter dem Trommelfell in Mäusen bewertet werden kann unter Verwendung von Laser - Doppler - Vibrometer überwacht werden (LDV) 7. Durch die Kombination von ABR, LDV und Verzerrungsprodukt otoakustischer Emission (DPOAE) Messungen kann Leitungsschwerhörigkeit von sensorineuralen Beeinträchtigung 8 unterschieden werden.
Tiermodelle von Ohr Bedingungen benötigt werden, angesichts der Bedeutung des Hörens und Ohr Gesundheit das Wohlbefinden von Patienten aller Altersgruppen. Zum Beispiel ist Otitis media eine extrem häufige Ohr-Infektion in menschlichen Säuglingen und Kindern gesehen, und schwere, akute Otitis media und ihre Komplikationen, wenn die Bedin auftreten kanntion nicht mit geeigneten antimikrobiellen Mitteln 9 behandelt. Mausmodelle von Otitis media konnte die Pathogenese beim Verständnis und bei der Entwicklung von Behandlungen 10,11 nützlich erweisen.
Murine Gehörknöchelchen, die ( mit Ausnahme des goniale Teil des Malleus) durch endochondrale Ossifikation gebildet werden 12,13 sind von großer Bedeutung für die Untersuchung des Knochenstoffwechsels und Morphogenese. Erstens, ihre geringe Größe ermöglicht hochauflösende Analyse von Knochen mit einem intakten Periost 14 Röntgen- oder Fluoreszenzmikroskopie. Zweitens anomale Knochenmetabolismus, wie übermäßige oder mangelhafte Knochenresorption oder beeinträchtigter Wechselwirkungen zwischen Knochenzellen 15 kann als potenzieller Beitrag zum Hörverlust 3,4,7 analysiert werden. Drittens abnormal Gehörknöchelchen Morphogenese in mehreren Gen-defizienten Mäusen, wie Tiere berichtet Hoxa2 fehlt 16-19, Msx1 20-22, Prrx1 23, goosecoid(GSC) 24,25, Bapx1 13, Tshz1 26, Dusp6 (Mkp3) 27, Noggin (Nog) 28, Fgfr1 29, Schilddrüsenhormon - Rezeptoren (Thra, Thrb) 5, Bcl - 2 30 und andere 1,31 oder bei Mäusen überexprimiert , Hoxa2 32. Schließlich trotz ihrer geringen Größe mit Gehörknöchelchen verbunden sind Strukturen wie Muskeln 33 und Gelenke 34,35 sind zugänglich.
Maus Gehörknöchelchen sind kleiner als menschliche Gehörknöchelchen, aber es ist bemerkenswert, dass die Maus Mittelohr ist nicht eine Miniaturversion der weibliche Körper. Zum Beispiel bei Mäusen, die Steigbügel Arterie, die durch den Ring der Steigbügel geht, bleibt während des gesamten Lebens 36, während bei Menschen, die embryonale Steigbügel Arterie während der Schwangerschaft verschwindet. Darüber hinaus unterscheidet sich die Morphologie der Maus malleus von der the menschlichen Knochen (siehe Abbildung 6). Bei Mäusen umschließt die auditorische (Pauken) Bulla die luftgefüllten Mittelohrhöhle, während beim Menschen, von trabekulären Knochen zusammengesetzt mastoid Luftzellen im Schläfenbein die Gehörknöchelchen und nicht als Bulla 37 untergebracht ist . Bei beiden Arten, die Gehörkapsel (Ohrkapsel, knöcherne Labyrinth) umschließt die Cochlea und Bogengänge des Innenohrs. Vergleichende und Evolutionsbiologie des Mittelohrs wurde 38-40 ausführlich überprüft.
Das Protokoll unten zuerst bereitgestellt wird beschrieben, wie die auditorischen Bulla und Kapsel zu sezieren aus, die vor allem aus dem Mittelohr und Innenohr bestehen jeweils. Dieses Protokoll zeigt auch, wie die Hammer, Amboß und Steigbügel aus dem Gehör Bulla zu isolieren. Schließlich zeigt es, wie die auditorischen Bulla und Kapsel in der Vorbereitung für die Einbettung für die Gewebeschnittplan der Gehörknöchelchen zu orientieren.
Protokoll
Alle Tierverfahren in dieser Studie durchgeführt werden, von der Keio University Institutional Animal Care und Use Committee genehmigt (IACUC - Zulassungsnummer: 09221) und die Richtlinien des Instituts für Tierversuche an der Keio-Universität für den Einsatz von Tieren in der Forschung folgen. Menschliche Proben wurden von einem kadaver in der Abteilung für Anatomie, Keio University School of Medicine gespendet isoliert und wurden in Übereinstimmung mit institutionellen Regelungen verwendet.
1. Isolierung von Auditory Bulla und Kapsel
- Euthanize Mäuse in einem Glas eine Plattform über Papiertücher getränkt in Isofluran oder Sevofluran bis respiratorischen Beatmung nicht mehr länger als eine Minute enthält, und dann Zervikaldislokation durchführen. Achten Sie darauf, den direkten Kontakt von Mäusen mit dem getränkten Papiertüchern zu vermeiden.
- Machen Sie einen kleinen Quereinschnitt an der dorsalen Seite des Halses und ziehen die Haut auseinander in Richtung Kopf und Schwanz mit beiden Händen zugrunde liegenden Hals mu aussetzenscle Gewebe.
- Enthaupten Mäuse im Halsbereich mit 14 cm scharf chirurgische Scheren.
- Peel Haut vollständig gegen die Nase. Schneiden Sie alle Haut zusammen mit der Schnauze und Schneidezähne ab.
- Legen einer Schere in den Mund und Kaumuskeln auf beiden Seiten geschnitten.
- Öffnen Sie den Kiefer vorsichtig und entfernen Sie die Zunge und Unterkiefer zusammen.
- Mit einer scharfen Schere, Split Schädel und Schädelbasis in zwei Hälften entlang der Midsagittalebene (1A, B).
- Mit einer Pinzette entfernen Sie die zerebrale und zerebelläre Hemisphären und den Hirnstamm. Die auditorische Bulla und Kapsel befinden sich lateral des Kleinhirns und des Hirnstamms. Beachten Sie, dass der Gehör Bulla zum Gehörkapsel weiter lateral ist (1C, D).
- Präparieren aus der Bulla und Kapsel mit dem umgebenden Schädelknochen (Abbildung 1E).
- Die Probe wird auf eine Schale mit Phosphat-gepufferter Saline (PBS) pH 7,4 bei RT.
- Under ein Binokular Binokular, verwenden Pinzette die umliegenden Knochen und Schere auseinander zu ziehen , die gelockert Grenze um der Bulla und Kapsel (1F) zu schneiden. Die umliegenden Knochen entfernt sind die Basioccipitale (ventralen Rand), exoccipital (ventro-posteriore Grenze), Supraoccipitale (posterior Grenze), interparietal, parietalen (dorsalen Rand), Squamosum (dorso-anterioren Grenze), alisphenoid (vordere Grenze) und Basisphenoid (antero- ventralen Rand) Knochen. Beachten Sie, dass die styliform Prozess (Sp), die das Trommelfell Öffnung der Eustachischen Röhre unterstützt 41, von der Griffelfortsatz des Schläfenbeins unterscheidet.
2. Isolierung von Gehörknöchelchen: Malleus, Amboß und Steigbügel
- Hammer
- Verwendung von sowohl einer kleinen Schere und Pinzette, entfernen Sie den Teil des äußeren Gehörgangs lateral des Sulcus tympanicus so dass das Trommelfell sichtbar ist (2A, B).
- Entfernen Sie Teil des Trommelfells und Pauken Knochen in der Nähe des malleal Processus brevis (orbicular apophysis, siehe Diskussion), die beide an der ventralen (gepunktet) und posterioren (#) Wände (2C). Der Malleus und Tensor tympani sollte nun ausgesetzt (2D, E) werden.
- Heben Sie den Malleus (2F) und schneiden Sie den Tensor tympani mit der abgeschrägten Kante einer 27 G - Nadel (2G). Beachten Sie, dass die malleal Manubrium an das Trommelfell fest befestigt, wie es in anderen Säugetieren zu sehen ist.
- Nehmen Sie das Trommelfell vorsichtig aus dem Manubrium, die zerbrechlich ist. Entfernen Sie das Trommelfell Knochen die drei Gehörknöchelchen zu offenbaren.
- Verrücken die Malleus aus dem Ambos am Gehörknöchelchen Gelenk (Abbildung 2H).
- Isolieren Sie die Hammers durch den vorderen Prozess am goniale Fracturing.
- Amboß und Steigbügel
- Isolieren ter incus durch den hinteren Ligamentum des Incus am kurzen crus (3A) abschneidet.
- Isolieren Sie die Steigbügel durch die Steigbügel Arterie in der Nähe der Steigbügel mit der abgeschrägten Kante einer 27 G - Nadel (3B, C) abschneidet. Falls erforderlich, schneiden die Sehne des M. stapedius am Muskelprozess der Steigbügel mit der Nadel.
- Legen Sie eine Nähnadel (oder einen Markierungsstift) in die Hüftbeinloch des Steigbügels und heben Sie die Steigbügel nach oben. Nach dem Steigbügel zu entfernen, sollte die ovalen Fensteröffnung deutlich sichtbar (Abbildung 3D) sein.
3. Embedding von Auditory Bulla und Kapsel
- Vorbereitung für die in Paraffinblöcken Einbetten
- Isolieren Sie die Bulla und Kapsel, wie in Abschnitt 1 beschrieben.
- Schneiden Sie das vordere Ende des Bulla (der styliform Prozess) aus mit einer Schere, tauchen Sie die Bulla und Kapsel in 4% Paraformaldehyd (PFA) in PBS bei 4 °C und erlauben Fixiermittel in die Bulla einzugeben. Wenn die Luft in der Bulla eingeschlossen wird, entfernen Sie sie mit einer Nadel und Spritze. Lassen Sie das Bulla und Kapsel in dem Fixiermittel bei 4 ° CO / N an einem Rohr Rotator.
Achtung: PFA ist giftig und sollte sorgfältig behandelt werden. - Wasche einmal mit PBS.
- Entkalken Bulla und Kapsel für eine Woche bei 4 ° C in 10% Ethylendiamintetraessigsäure-Dinatriumsalz-Dihydrat (EDTA-2Na), 100 mM Tris-Base, pH 7,0, in einem 2-ml-Röhrchen. Ändern Sie den Puffer jeden zweiten Tag.
- Wasche einmal mit PBS. Proben können in 70% Ethanol in Wasser bei 4 ° C gelagert werden. Wahlweise Übertragung auf 70% Ethanol durch eine abgestufte Alkoholserie (30%, 50%, 70% in Wasser).
- Auf einem Gewebeprozessor, dehydrieren Proben in einer abgestuften Reihe von Ethanollösungen (70%, 2 x 95%, 3 x 100%, jeweils 1 h), klar in Xylol (4x, jeweils 1 h bei 40 ° C) und infiltrieren Proben mit geschmolzene Paraffinwachs 42. Optional Ersatz Xylol mit kommerziellen Gewebe clearing Lösung (zB Histo-Clear).
- Unload Proben aus dem Prozessor, und entfernen Sie sie aus ihren Kassetten.
- Auf einem Konsolensystem Gewebeein, Ort Proben in Formen mit geschmolzenem Paraffinwachs gefüllt. Gehen Sie zur Einbettung (Abschnitt 4).
- Vorbereitung für die in gefrorenen Blöcken (Kawamoto Film - Methode) das Einbetten 43
- Isolieren Sie die Bulla und Kapsel, wie in Abschnitt 1 beschrieben.
- Schneiden Sie das vordere Ende des Bulla (der styliform Prozess) aus mit einer Schere, tauchen Sie die Bulla und Kapsel in Fixierungsmittel (2% bzw. 1% PFA und nicht 4% in PBS Antigenität zu erhalten) bei 4 ° C. Wenn Luft in Bulla gefangen ist, entfernen Sie sie mit einer Nadel und Spritze. Lassen Sie das Bulla und Kapsel in dem Fixiermittel bei 4 ° CO / N an einem Rohr Rotator.
- Waschen Sie Bulla und Kapsel schnell in PBS und sofort in flüssigem Kryo-Einbettmasse bei 4 ° C tauchen.
- Wichtig: Entfernen Sie Luftblasen, wenn eine in der Mitteund Außenohr durch Aspiration durch eine Nadel, und durch die Einbettung Verbindung mit einer Pinzette hinzufügen. Gehen Sie zur Einbettung (Abschnitt 4).
4. Probenorientierung und Embedding
HINWEIS: Die gesamte Bulla und Kapsel muss beim Einbetten in einer bestimmten Ausrichtung angeordnet werden, um gewünschte Abschnitte zu schneiden. Die unten beschriebenen Verfahren werden in Abschnitt verwendet, um die Malleus in verschiedenen Ausrichtungen.
- Längs (parasagittal) Schnitte des Hammers
- Setzen Sie die Querseite des Bulla oder äußeren Gehörgang nach unten in warmen Paraffin (oder Kryo-Einbettmasse). Passen Sie die Ausrichtung so , dass der Hals und Quer Lamina des Hammers auf den horizontalen Boden des Einbettungsschale parallel sind (4A - C). Man beachte , dass das Trommelfell in einem Winkel von etwa 30 ° zur Vertikalen in der Maus Kopf (4A geneigt ist, Figur 59 in Kampen 44).
- Horizontale Schnitte des Hammers
- Platzieren Sie den Rückenkamm horizontal in warmem Paraffin (oder Kryo-Einbettmasse). Stellen Sie die Ausrichtung der Bulla und Kapsel , so dass der Hals und transversal Lamina des Hammers auf die Unterseite des Einbettungsschale senkrecht sind (4D - F).
- Frontal Schnitte (Querschnitte) von manubrium und Trommelfell 5
- Legen Sie die malleal manubrium in warmem Paraffin (oder Kryo-Einbettmasse), so dass es senkrecht zum Boden des Einbettungsschale.
- Kühlen Sie den Block auf Temperaturen geeignet Paraffinwachs auf einem Gewebeeinkonsolensystem härten (alternativ verwenden Kryo-Einbettmasse in einem Trockeneis / Hexan-Bad).
- Prozessgewebeblock und Zuschnitten unter Verwendung von Routineverfahren. Beispielsweise stain Paraffinschnitte mit Hämatoxylin und Eosin (H & #38; E), Safranin O (für Knorpel) oder zur Tartrat-resistente saure Phosphatase (TRAP) Aktivität (für Osteoklasten) 3, oder durch Immunhistochemie. Unentkalkte Kryoabschnitte eignen sich für die Kennzeichnung Knochen Fluorochrome 14, Alizarin - Rot - Färbung für Kalzium verwendet und Immunofluoreszenz 42.
Ergebnisse
Dieses Protokoll stellt eine Methode Gehörknöchelchen aus der auditorische Bulla zu isolieren. Zuerst werden die Bulla und Kapsel herauspräpariert als ein einzelnes Stück aus dem Schädel (Abbildung 1). Die sezierten Bulla wird dann verwendet , um den Malleus (Abbildung 2) und dem Amboß und Steigbügel (Abbildung 3) herzustellen. Sehenswürdigkeiten des auditorischen Bulla und Kapsel sind die styliform Prozess am vorderen Ende des Bulla, der Rückenkamm, vorderen Bogengangs und der subarcuate Fossa (1F). Microcomputed - Tomographie (CT) Bildgebungs zeigt Gehörknöchelchen im auditorischen Bulla sowie die optimale Ausrichtung für Längs- und horizontale Schnitte dieser Gehörknöchelchen (Abbildung 4).
Für Längs Paraffin Schneide des Hammers wurden die Bulla und Kapsel bei 4 ° C in EDTA entkalkt für eine Woche in einem pa eingebettetraffin Block bei der gezeigten Ausrichtung in Figur 4 A - C, bei 4 & mgr; m, geschnitten und dann H & E gefärbt werden. Der Malleus an das Trommelfell im auditorischen Bulla angebracht enthüllt laufenden endochondral Verknöcherung bei P14 (5A). Um neue Knochenbildung sichtbar zu machen, Calcein (30 ug / g Körpergewicht) wurde peritoneal in eine P20-Maus injiziert, und Bulla und Kapsel wurden 24 Stunden später bei P21 isoliert. Die Probe ohne Entkalkung wurde gefroren eingebettet und dann bei 6 um gefriergeschnitten einen Klebefilm unter Verwendung basierend auf dem Verfahren von Kawamoto 43. Nach Kernfärbung mit DAPI (4 ', 6-Diamidino-2-phenylindol), wurde der Abschnitt unter einem Fluoreszenzmikroskop beobachtet. Calcein - Signale (grün) zeigte neue Knochenbildung in der Malleus (m), Bulla und Kapsel (5B). Für horizontale Schnitte des Hammers, die auditorischen Bulla von einem 5-Wochen alten Maus isoliert wurde ohne Entkalkung gefroren eingebettet (für denOrientierung siehe Abbildung 4D - F), gefriergeschnitten bei 6 um die Kawamoto - Methode und unter Verwendung von H & E gefärbt. Horizontale Schnitte des malleal Processus brevis (mPB) zeigt auch die Cochlea (5C).
Eine mediale Ansicht der rechten Gehörknöchelchen aus einer P31 - Maus isoliert zeigt typische Merkmale der Maus Malleus, nämlich die "Gleit-Möwe-Flügel-like" (oder persischer schwertartigen 45) manubrium, ein prominentes Processus brevis (orbicular apophysis siehe Diskussion), und die transversale Lamina (Abbildung 6). Beachten Sie, dass der vordere Prozess (Processus anterior) in der Dissektion Verfahren um die goniale gebrochen wurde und aus der Paukenring (ectotympanic) getrennt. Diese repräsentative Stichprobe zeigt eine intakte incudomalleolar Verbindung zwischen dem Hammer und Amboß, während die incudostapedial Gelenk verrenkt wird. Sehnenansätze in die malleal undSteigbügelmuskel Prozesse sind nachweisbar (6A, Sternchen).
6B vergleicht Maus und Mensch Gehörknöchelchen bei gleicher Vergrößerung. Speziesunterschiede, andere als Größe, sind die folgenden. Der malleal manubrium ist flügelartig in Mäusen, aber Club-beim Menschen. Der Winkel zwischen der anatomischen Achse (oder der Drehachse, die Linie, die durch den vorderen Prozess des Hammers und dem kurzen Fortsatz des Amboß) und dem Manubrium ist viel kleiner in Mäusen und die beiden sind fast parallel, hinsichtlich nahezu senkrecht Gegensatz beim Menschen 6,46-48. In der menschlichen Gehörknöchelchen, offenbaren vibrometric Studien , dass die incudo-malleolar Gelenk beweglich ist und nicht funktional 49 fixiert. Die Maus Malleus zeigt eine breite, dünne und flache transversale Lamina nicht offensichtlich beim Menschen 47. Bei Mäusen, Sicherungen der Processus anterior membranösen Knochen, nämlich die goniale und der tympanic Ring, während beim Menschen die processus anterior zu einem kleinen spicule Knochen 41 reduziert. Der Steigbügel von Mäusen und Menschen unterscheidet sich auch: bei Mäusen, die vordere Crus gekrümmt ist und der hintere Crus ist gerade während bei Menschen, die vordere Crus ist gerade als die hintere Crus. Es ist erwähnenswert, dass der Malleus Kopf relativ zur Körpergröße massiv in Arten wie der Goldmulle vergrößert wird, 48 erhebliche Variabilität in allometric Beziehungen von "kleinsten" Knochen zu demonstrieren.
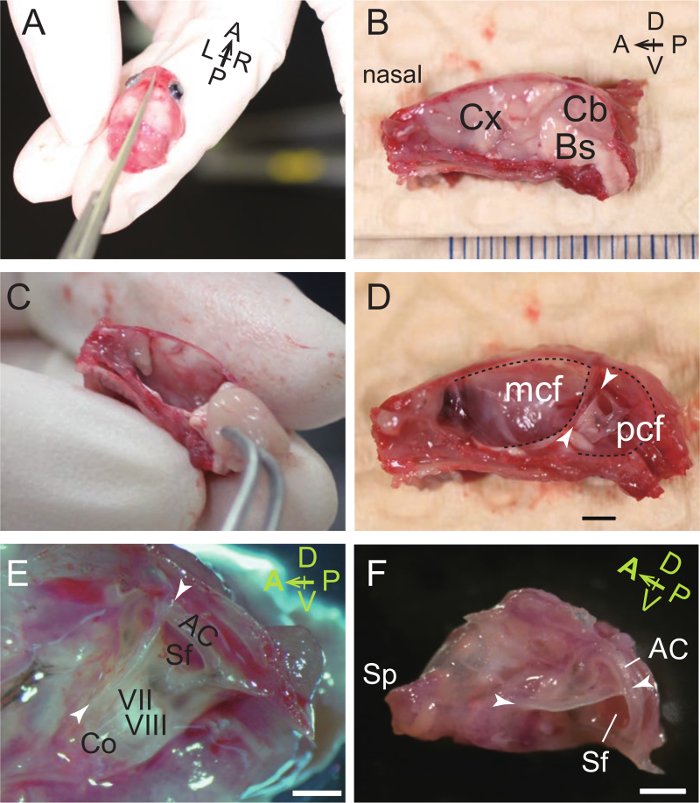
Abbildung 1. Dissection des Auditory Bulla und Kapsel. (A) Der Schädel eines P31 - Maus ist in rechte und linke Hälften geteilt. A, vordere; P, posterior; L, links; R, rechts. (B) Medial Oberfläche der rechten Hälfte des halbierten, gehäutet Kopf. Cx, Hirnrinde; Cb, Cerebellum; Bs, brainstem. D, dorsale; V, ventralen. (C) Entfernung des Gehirns mit einer Pinzette. (D) Medial Ansicht des auditorischen Kapsel im rechten Schädel. Der Rückenkamm (Pfeilspitzen) liegt zwischen der mittleren Schädelgrube (mcf) und hinteren Schädelgrube (PCF) und trennt dorso-anterioren und ventro- hinteren Oberflächen der Gehörkapsel. Maßstabsbalken, 2 mm. (E) Eine stärkere Vergrößerung der auditorischen Bulla und Kapsel (medial). Co, Cochlea; VII, Gesichtsnerven; VIII, N. vestibulocochlearis; AC, vordere (superior) Bogengang; Sf, subarcuate Fossa, die die Kleinhirns paraflocculus beherbergt. Maßstabsbalken, 1 mm. (F) Mikroskopische Aufnahme von isolierten auditorischen Bulla und Kapsel (medial). Sp, styliform Prozess. Maßstabsbalken, 1 mm. (A - E), P31 Maus. (F), P33 Maus. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
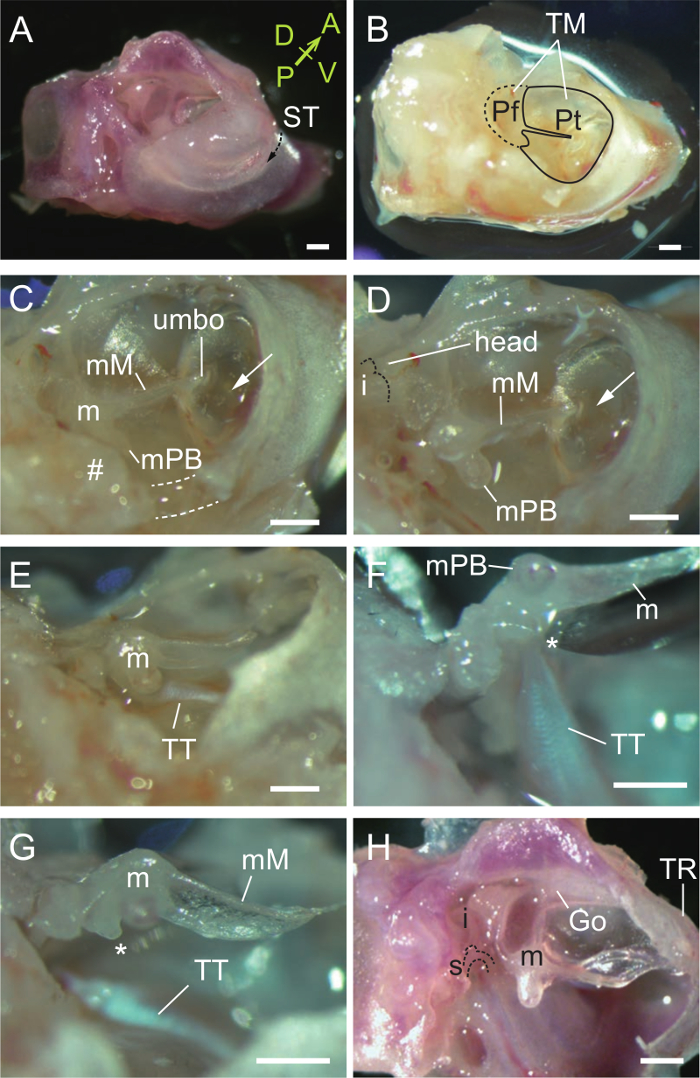
Abbildung 2. Dissektion der Malleus. (A) Ventrolateral Ansicht eines rechten Gehör Bulla und Kapsel. Der Sulcus tympanicus (ST, gestrichelte Pfeil) ist die Bindungsstelle des Trommelfells. Der Knochen lateral der ST ist ein Teil des äußeren Ohrs und der Knochen medial der ST bildet den Boden der Mittelohrhöhle. A, vordere; P, posterior; D, dorsale; V, ventralen. (B) Ansicht nach Entfernung des äußeren Gehörgangs zu offenbaren das Trommelfell (TM) einschließlich der Pars flaccida (Pf) und Pars tensa (Pt). (C) Entfernung von Teilen des Trommelfells Knochen (gestrichelte Linien und #) in der Nähe des malleal Processus brevis (mPB). m, Malleus; mM, malleal manubrium. Pfeil, Luftblase in der Paukenhöhle durch das Trommelfell gesehen. (D) Exposed Malleus. Malleus Kopf angezeigt. GepunkteteLinie zeigt die Gelenkfläche des Ambos. (E) Tendon des Tensor tympani (TT) mit dem Malleus befestigt. (F) Der Tensor tympani gezogen wird , wenn der Hammer angehoben wird. *, Muskel Prozess. (G) Tensor tympani geschnitten , um eine Nadel. (H) drei Gehörknöchelchen nach Entfernung des Trommelfells. Die incudo-malleolar Gelenk verrenkt. m, Malleus; i, Amboß; s, Steigbügel; Gehen, goniale (fusioniert mit dem Malleus und Paukenring, TR). Alle Maßstabsbalken, 0,5 mm. (A, H), P33 Maus. (B - G), P31 Maus. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
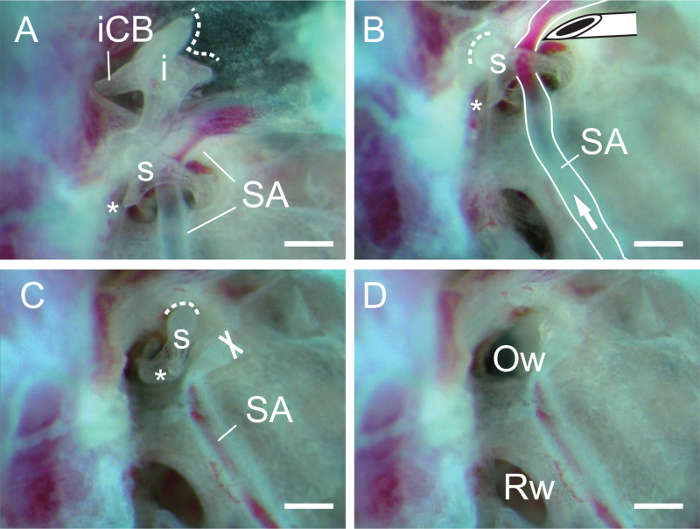
Abbildung 3. Dissektion der Amboß und Steigbügel. (A) Incus undSteigbügel nach Entfernung des Hammers. Die Steigbügel Arterie (SA) durch den Steigbügel (s). Die gestrichelte Linie zeigt die Gelenkfläche des Ambos. Beachten Sie, dass die kurze crus (ICB, crus breve) des Amboß (i) durch das hintere Band befestigt ist (nicht gezeigt). Asterisk, Muskel Prozess der Steigbügel. (B) Steigbügels nach Entfernen des Incus. Nadelspitze wird verwendet, um die Steigbügel Arterie zu schneiden (SA). Pfeil, Richtung des Blutflusses. Die gestrichelte Linie zeigt Gelenkfläche des Steigbügels. (C) Die Steigbügel Arterie aus dem Steigbügel entfernt. X zeigt die abgeschnittene Ende des Steigbügel Arterie (SA). (D) Das ovale Fenster (Ow, ovalen Fenster oder fenestra vestibuli) sichtbar ist nach dem Entfernen der Steigbügel. Rw, runde Fenster (runden Fensters oder fenestra Cochlea). Maßstabsbalken, 0,5 mm. Bitte klicken Sie hier , um eine größere Version davon zu sehenZahl.
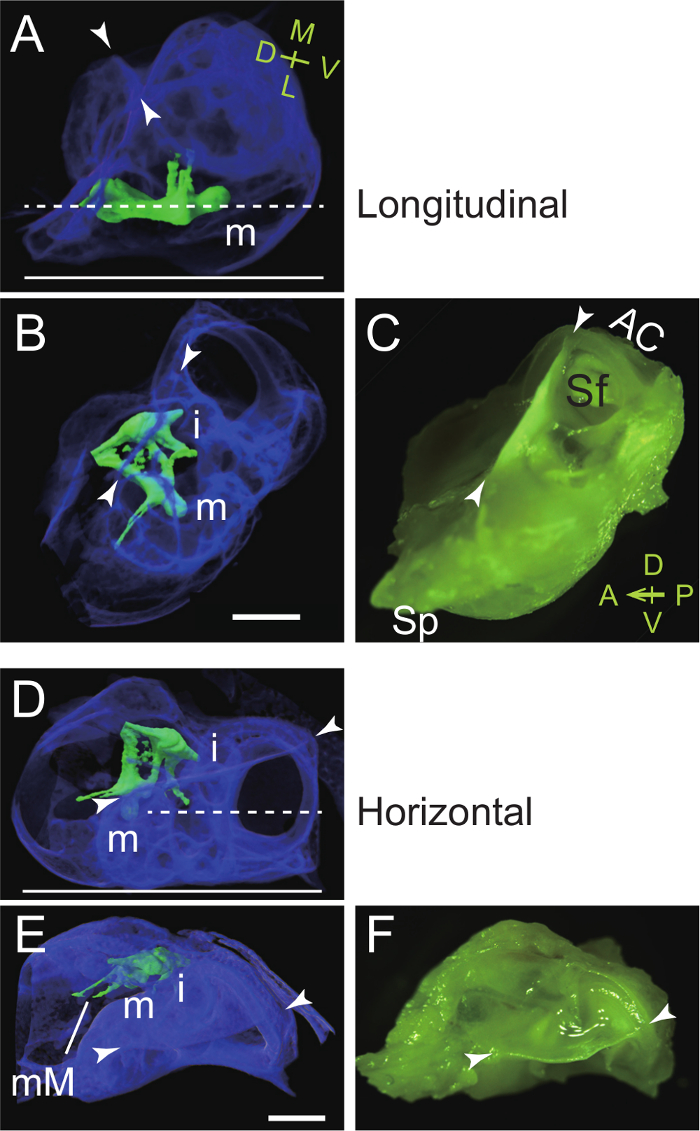
Abbildung 4. Ausrichten der Auditory Bulla und Kapsel während der Einbettung für Longitudinal (parasagittal, A - C) und horizontale (D - E) Sectioning des Malleus. (A - C) Der Hals und Quer Lamina des Hammers angeordnet sind parallel zum Boden des Tellers einzubetten. (A) Seitenansicht: Mikro-CT - Bild zu zeigen Einbettung des rechten Malleus in der Bulla (pseudocolored blau). Der Hammer und Amboß sind pseudocolored grün. Eine gestrichelte Linie, die gewünschte Schnittebene. Durchgezogene Linie, Schalenboden eingebettet ist. m, Malleus; Pfeilspitzen, Rückenkamm. M, medial; L, lateral; D, dorsale; V, ventralen. (B) Draufsicht: Micro-CT - Bild. Beachten Sie, dass das vordere Ende des Bulla (styliform Prozess) entfernt wurde. i, Amboß. (C) Draufsicht: Aufnahme (mit AAFarbfilter). AC, vordere (superior) Bogengang; Sf, subarcuate Fossa; Sp, styliform Prozess. A, vordere; P, posterior; D, dorsale; V, ventralen. (D - F) Der Processus brevis des Hammers senkrecht Schale der Einbettung auf den Boden gelegt. (D) Seitenansicht: Micro-CT - Bild Einbettung des rechten Malleus zu zeigen. Eine gestrichelte Linie, die gewünschte Schnittebene. Durchgezogene Linie, Schalenboden eingebettet ist. (E) Draufsicht: Micro-CT - Bild. mM, malleal manubrium. (F) Draufsicht: Aufnahme (mit einem Farbfilter aufgenommen). Maßstabsbalken, 1 mm. Micro-CT - Bilder wurden in einem Voxel Auflösung von 5 um, erhalten wie zuvor beschrieben 7. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
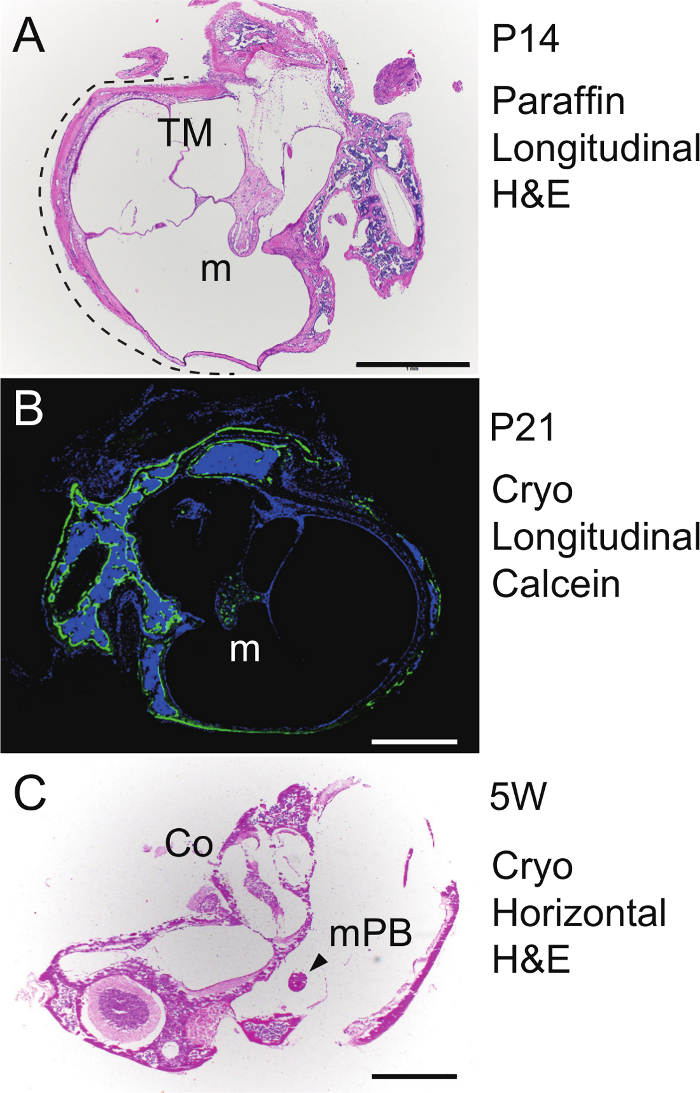
Fild 5. Histologie. (A) H & E - Färbung. Längs (parasagittal) Abschnitt der in Paraffin eingebetteten rechts Malleus (m) im auditorischen Bulla (gepunktete Linie) bei P14. TM, Trommelfell. (B) Calcein Knochen Kennzeichnung. Längsschnitt des gefrorenen, unentkalkte links Malleus (m) im auditorischen Bulla bei P21. Counterstain, DAPI. (C) H & E - Färbung. Horizontalschnitt des gefrorenen, unentkalkte links malleal Processus brevis (mPB) im auditorischen Bulla und Kapsel (5 Wochen alten Maus). Co, Cochlea. Maßstabsbalken, 1 mm. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 6. Mediale Ansicht der Gehörknöchelchen. (A) rechts Gehörknöchelchen von P31 Maus. A, vordere; P, posterior; D, dorsale; V, ventralen. Maßstabsbalken, 1 mm. Malleus Kopf (Caput mallei, Capitulum mallei); Hals (Collum mallei); Lamina (transversal Lamina); mM (Manubrium mallei); schwarzer Stern (muskuläre Prozess des Hammers); MPa (Processus anterior Processus gracilis); mPB (Processus brevis); incus Körper (Corpus incudis); ICB (Crus breve, kurz Crus, kurze Prozess); iCL (Crus longum, lange Crus, langer Prozess); IPL (Processus lenticularis, Lentikular-Prozess, Sylvian apophysis); Steigbügelkopf (Caput stapedis); weiß Sternchen (muskuläre Prozess des Steigbügels); sCA (Crus anterius, vordere Crus); scp (Crus posterius, posterior Crus); Basis (Basis stapedis, Fußplatte); SOF (Hüftbeinloch, intercrural Foramen). (B) Recht Gehörknöchelchen eines 76-jährigen weiblichen Menschen ( mit freundlicher Genehmigung von Institut für Anatomie, Keio University School of Medicine). Die Gehörknöchelchen der P31-Maus (unten rechts) in der gleichen Vergrößerung abgebildet wird, wie es für die menschliche Gehörknöchelchen verwendet. Curved Pfeile zeigen den Winkel zwischen der anatomischen Achse und dem Manubrium (gepunktete Linien). Maßstabsbalken, 2 mm. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Hier präsentieren wir eine Methode nützlich, um die Gehör Bulla und Kapsel in der postnatalen Mäusen zu isolieren. Vor dem P12 sind Gewebe zerbrechlich und kann während der Isolierung beschädigt werden. Nach P12 kann der auditorischen Bulla und Kapsel leicht aus den umliegenden Gewebe isoliert werden. die Bulla vom Kopf Dissecting vor sectioning hat mehrere Vorteile. Als erstes postnatale Kavitation und das Wachstum des auditorischen Bulla treten am aktivsten von P6 ab und sind vollständig von P14 50. Die mesenchymalen Gewebe zwischen dem Trommelfell und Cochlea-Wand wird durch Luft, die durch die Kavitation ersetzt. Die sich ergebende Luft in der Paukenhöhle kann Kontakt zwischen Gewebe und Flüssigkeiten während der Fixierung, Entkalkung und Einbettung behindern. Es ist einfacher, Luft aus dem isolierten auditorischen Bulla zu entfernen, indem das vordere Ende (styliform Prozess) das Abschneiden anstatt zu versuchen, so in der unisolierten Bulla zu tun. Zweitens Ausrichtung des Hammers (und das Trommelfell) nicht vertikalim Kopf. Es ist daher leichter zu Abschnitt der Malleus in gewünschten Ebenen, die durch die isolierte auditorischen Bulla und Kapsel in einer bestimmten Orientierung Einbettung.
Einmal isoliert, auditiv Bulla und Kapseln sind für zahlreiche Analysen nützlich. Zum Beispiel, hochauflösende Röntgen Mikro-CT kann Knochenmikrostruktur Morphologie wie osteogene Kapillaren in der Malleus 14 offenbaren. Die die Stereo Präpariermikroskop ist ein leistungsfähiges Werkzeug Strukturen zu visualisieren reporter Mäuse bei der Bewertung 33 fluoreszierende Proteine in der Mittel- oder Innenohr exprimiert. Darüber hinaus könnten verschiedene in vivo oder ex vivo Fluoreszenz - Markierungsverfahren und whole mount Immunfluoreszenz - Nachweis durchgeführt werden. Lichtbogenfluoreszenzmikroskopie ist auch nützlich für die dreidimensionale Analyse 51. Obwohl hier nicht beschrieben, diverse anatomische Strukturen mit auditorischen Bulla und Kapsel verbunden sind, wie periphere Nerven, Blutgefäßen, unddas Trommelfell in das Mittelohr können auch unter Verwendung dieses Protokolls ausgewertet werden.
Beachten Sie, dass Paraffin Schneide Entkalkung von Knochengewebe erfordert vor dem Einbetten und daher nicht Analyse der Mineralisierung nicht gestattet. Im Gegensatz dazu 43 der Kawamoto Filmverfahren verwendet , um Gefrierschnitten zubereiten können ohne Entkalkung durchgeführt werden und ist geeignet für Studien Mineralisierung in vivo Knochen-Markierungstechniken oder spezielle Färbung wie Alizarin - Färbung verwendet wird . Cryo-Schneidebedingungen sollten entsprechend auf Maus Alter optimiert basiert. Beispielsweise wird eine weniger kühle Temperatur im Inneren der Kryostatkammer für ältere Maus Proben empfohlen Beschädigung Abschnitte zu minimieren.
In der Maus ist die korrekte Bezeichnung für den prominenten halbkugelförmigen Vorsprung des Hammers "orbicular apophysis". Dennoch wurde der verwendete Begriff "Processus brevis" weit die orbicular apophysis für mehr th, um anzuzeigen,ein zwei Jahrzehnte, vor allem bei der Maus Entwicklungsbiologen 16,20,22-25. "Processus brevis" ursprünglich auf den seitlichen Prozess bezeichnet (Processus lateralis), die von der orbicular apophysis unterscheidet. Beim Menschen bildet eine seitliche Prozess der allgemeinen Linie der Bindung an das Trommelfell einen leichten konischen Vorsprung ähnelt, von der manubrium erstreckt (nicht in 6B, Ansicht von medial gesehen). In Mäusen ist die laterale Verfahren auch ein Vorsprung des Manubrium am entgegengesetzten Ende mit dem Umbo 48. Die Pars flaccida des Trommelfells über dem seitlichen Prozess des Hammers. Orbicular apophysis ist im menschlichen Malleus nicht ersichtlich.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors thank Masaki Yoda and Elise Lamar for critical reading of the manuscript, Kazumasa Takenouchi for help with histology, Mari Fujiwara for help with microscopy and Makoto Morikawa for help in photographing human and mouse auditory ossicles.
Materialien
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Paper towel | DAIO PAPER CORPORATION | 703347 | can be purchased from other vendors |
| Glass Jar | Various | can be purchased from other vendors | |
| 14cm surgical scissors | Fine Science Tools (F.S.T.) | 91400-14 | can be purchased from other vendors |
| Extra fine scissors-straight | Fine Science Tools (F.S.T.) | 14084-08 | can be purchased from other vendors |
| Fine Forceps Angled 45° | Fine Science Tools (F.S.T.) | 11063-07 | can be purchased from other vendors |
| Dissecting microscope | Nikon | SMZ800N | for routine dissection |
| Dissecting microscope | Nikon | SMZ18 | for movies |
| Injection needle 27G | TERUMO | NN-2719S | |
| Syringe (1ml) | TERUMO | SS-01T | |
| Marking Pin | Various | ||
| Tube rotator RT-50 | TAITEC | 0000165-000 | can be purchased from other vendors |
| Cryostat | Leica | CM3050S | http://www.leicabiosystems.com/histology-equipment/cryostats/details/product/leica-cm3050-s/ |
| TC-65 Tungsten blade | Leica | 14021626379 | for Kawamoto's firm method |
| Stainless containers | Leica | for Kawamoto's firm method | |
| Cryofilm type IIC | Leica | for Kawamoto's firm method | |
| Silane coated slide (New Silane II) | Muto Pure Chemicals | 511617 | can be purchased from other vendors |
| Cover glass | Matsunami | can be purchased from other vendors | |
| Tissue processor | Sakura Finetek | VIP-5 | can be purchased from other vendors |
| Tissue Embedding Console System | Sakura Finetek | Tissue-Tek TEC 5 | can be purchased from other vendors |
| Sliding microtome for paraffin | Yamato Kohki Industrial | REM-710 | can be purchased from other vendors |
| Path Blade+pro for hard tissue | Matsunami | PB3503C | for paraffin section |
| Micro-CT | RIGAKU | R_mCT2 | http://www.rigaku.com/en |
| Fluorescence microscope | KEYENCE | BZ-9000 | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Isoflurane | Maruishi pharmaceutical Co. Ltd | ||
| NaCl | wako | 191-01665 | for PBS |
| KCl | wako | 285-14 | for PBS |
| Na2HPO4 12H2O | wako | 196-02835 | for PBS |
| KH2PO4 | wako | 287-21 | for PBS |
| Paraformaldehyde(EM Grade) | TAAB | P001 | |
| EDTA-2Na | wako | 15111-45 | |
| Trizma base | Sigma | T1503-1KG | |
| Super Cryoembedding Medium | Leica | for Kawamoto's firm method | |
| Dry Ice | Various | for Kawamoto's firm method | |
| Hexane | wako | 080-03423 | for Kawamoto's firm method |
| Super Cryomouting Medium type R2 | Leica | for Kawamoto's firm method | |
| Paraffin | Sakura Finetek | 781001A0107 | |
| Histo-Clear | NDS | HS-200 | |
| Calcein | DOJINDO | 340-00433 | |
| Hematoxylin | wako | 131-09665 | |
| Eosin | wako | 051-06515 |
Referenzen
- Mallo, M. Formation of the middle ear: recent progress on the developmental and molecular mechanisms. Dev Biol. 231, 410-419 (2001).
- Manley, G. A. An evolutionary perspective on middle ears. Hear Res. 263, 3-8 (2010).
- Kanzaki, S., Ito, M., Takada, Y., Ogawa, K., Matsuo, K. Resorption of auditory ossicles and hearing loss in mice lacking osteoprotegerin. Bone. 39, 414-419 (2006).
- Kanzaki, S., Takada, Y., Ogawa, K., Matsuo, K. Bisphosphonate therapy ameliorates hearing loss in mice lacking osteoprotegerin. J Bone Miner Res. 24, 43-49 (2009).
- Cordas, E. A., et al. Thyroid hormone receptors control developmental maturation of the middle ear and the size of the ossicular bones. Endocrinology. 153, 1548-1560 (2012).
- Dong, W., Varavva, P., Olson, E. S. Sound transmission along the ossicular chain in common wild-type laboratory mice. Hear Res. 301, 27-34 (2013).
- Kanzaki, S., et al. Impaired vibration of auditory ossicles in osteopetrotic mice. Am J Pathol. 178, 1270-1278 (2011).
- Qin, Z., Wood, M., Rosowski, J. J. Measurement of conductive hearing loss in mice. Hear Res. , (2009).
- Klein, J. O. Is acute otitis media a treatable disease?. N Engl J Med. 364, 168-169 (2011).
- Rosch, J. W., et al. A live-attenuated pneumococcal vaccine elicits CD4+ T-cell dependent class switching and provides serotype independent protection against acute otitis media. EMBO Mol Med. 6, 141-154 (2014).
- Li, X., et al. Otitis media in sperm-associated antigen 6 (Spag6)-deficient mice. PLoS One. 9, e112879 (2014).
- Rodríguez Vázquez, J. F., Mérida Velasco, J. R., Jiménez Collado, J. A study of the os goniale in man. Acta Anat (Basel). 142, 188-192 (1991).
- Tucker, A. S., Watson, R. P., Lettice, L. A., Yamada, G., Hill, R. E. Bapx1 regulates patterning in the middle ear: altered regulatory role in the transition from the proximal jaw during vertebrate evolution. Development. 131, 1235-1245 (2004).
- Matsuo, K., et al. Osteogenic capillaries orchestrate growth plate-independent ossification of the malleus. Development. 142, 3912-3920 (2015).
- Matsuo, K. Cross-talk among bone cells. Curr Opin Nephrol Hypertens. 18, 292-297 (2009).
- Rijli, F. M., et al. A homeotic transformation is generated in the rostral branchial region of the head by disruption of Hoxa-2, which acts as a selector gene. Cell. 75, 1333-1349 (1993).
- Mallo, M., Gridley, T. Development of the mammalian ear: coordinate regulation of formation of the tympanic ring and the external acoustic meatus. Development. 122, 173-179 (1996).
- O'Gorman, S. Second branchial arch lineages of the middle ear of wild-type and Hoxa2 mutant mice. Dev Dyn. 234, 124-131 (2005).
- Santagati, F., Minoux, M., Ren, S. Y., Rijli, F. M. Temporal requirement of Hoxa2 in cranial neural crest skeletal morphogenesis. Development. 132, 4927-4936 (2005).
- Satokata, I., Maas, R. Msx1 deficient mice exhibit cleft palate and abnormalities of craniofacial and tooth development. Nat Genet. 6, 348-356 (1994).
- Zhang, Z., et al. Malleal processus brevis is dispensable for normal hearing in mice. Dev Dyn. 227, 69-77 (2003).
- Houzelstein, D., Cohen, A., Buckingham, M. E., Robert, B. Insertional mutation of the mouse Msx1 homeobox gene by an nlacZ reporter gene. Mech Dev. 65, 123-133 (1997).
- Martin, J. F., Bradley, A., Olson, E. N. The paired-like homeo box gene MHox is required for early events of skeletogenesis in multiple lineages. Genes Dev. 9, 1237-1249 (1995).
- Yamada, G., et al. Targeted mutation of the murine goosecoid gene results in craniofacial defects and neonatal death. Development. 121, 3005-3012 (1995).
- Rivera-Pérez, J. A., Mallo, M., Gendron-Maguire, M., Gridley, T., Behringer, R. R. Goosecoid is not an essential component of the mouse gastrula organizer but is required for craniofacial and rib development. Development. 121, 3005-3012 (1995).
- Coré, N., et al. Tshz1 is required for axial skeleton, soft palate and middle ear development in mice. Dev Biol. 308, 407-420 (2007).
- Li, C., Scott, D. A., Hatch, E., Tian, X., Mansour, S. L. Dusp6 (Mkp3) is a negative feedback regulator of FGF-stimulated ERK signaling during mouse development. Development. 134, 167-176 (2007).
- Hwang, C. H., Wu, D. K. Noggin heterozygous mice: an animal model for congenital conductive hearing loss in humans. Hum Mol Genet. 17, 844-853 (2008).
- Calvert, J. A., et al. A missense mutation in Fgfr1 causes ear and skull defects in hush puppy mice. Mamm Genome. 22, 290-305 (2011).
- Carpinelli, M. R., et al. Anti-apoptotic gene Bcl2 is required for stapes development and hearing. Cell death dis. 3, e362 (2012).
- Chapman, S. C. Can you hear me now? Understanding vertebrate middle ear development. Front Biosci (Landmark Ed). 16, 1675-1692 (2011).
- Kitazawa, T., et al. Distinct effects of Hoxa2 overexpression in cranial neural crest populations reveal that the mammalian hyomandibular-ceratohyal boundary maps within the styloid process. Dev Biol. 402, 162-174 (2015).
- Wang, L., et al. Scleraxis is required for differentiation of the stapedius and tensor tympani tendons of the middle ear. J Assoc Res Otolaryngol. 12, 407-421 (2011).
- Amin, S., Tucker, A. S. Joint formation in the middle ear: lessons from the mouse and guinea pig. Dev Dyn. 235, 1326-1333 (2006).
- Amin, S., Matalova, E., Simpson, C., Yoshida, H., Tucker, A. S. Incudomalleal joint formation: the roles of apoptosis, migration and downregulation. BMC Dev Biol. 7, 134 (2007).
- Hiruma, T., Nakajima, Y., Nakamura, H. Development of pharyngeal arch arteries in early mouse embryo. Journal of anatomy. 201, 15-29 (2002).
- Treuting, P. M., Dintzis, S. M., Treuting, P. M., Dintzis, S. M. Ch. 22, Special senses: ear. Comparative Anatomy and Histology: A Mouse and Human Atlas. 22, 419-432 (2012).
- Mallo, M., Schrewe, H., Martin, J. F., Olson, E. N., Ohnemus, S. Assembling a functional tympanic membrane: signals from the external acoustic meatus coordinate development of the malleal manubrium. Development. 127, 4127-4136 (2000).
- Anthwal, N., Joshi, L., Tucker, A. S. Evolution of the mammalian middle ear and jaw: adaptations and novel structures. Journal of anatomy. 222, 147-160 (2013).
- Takechi, M., Kuratani, S. History of studies on mammalian middle ear evolution: a comparative morphological and developmental biology perspective. J Exp Zool B Mol Dev Evol. 314, 417-433 (2010).
- Henson, O. W., Keidel, W. D., Neff, W. D. Ch. 3, Comparative Anatomy of the Middle Ear. Handbook of Sensory Physiology. Vol. 1, Auditory System. Anatomy, Physiology (Ear), 39-110 (1974).
- . . Handbook of Histology Methods for Bone and Cartilage. , (2003).
- Kawamoto, T. Use of a new adhesive film for the preparation of multi-purpose fresh-frozen sections from hard tissues, whole-animals, insects and plants. Arch Histol Cytol. 66, 123-143 (2003).
- Kampen, P. N. V. . Gegenbaurs Morphologiesches Jahrbuch. 34, 321-722 (1905).
- Lee, J. H., Park, K., Kang, T. C., Choung, Y. H. Three-dimensional anatomy of the temporal bone in normal mice. Anat Histol Embryol. 38, 311-315 (2009).
- Fleischer, G. Evolutionary principles of the mammalian middle ear. Adv Anat Embryol Cell Biol. 55, 3-70 (1978).
- Lavender, D., Taraskin, S. N., Mason, M. J. Mass distribution and rotational inertia of "microtype" and "freely mobile" middle ear ossicles in rodents. Hear Res. 282, 97-107 (2011).
- Mason, M. J. Of mice, moles and guinea pigs: functional morphology of the middle ear in living mammals. Hear Res. 301, 4-18 (2013).
- Willi, U. B., Ferrazzini, M. A., Huber, A. M. The incudo-malleolar joint and sound transmission losses. Hear Res. 174, 32-44 (2002).
- Richter, C. A., et al. Defects in middle ear cavitation cause conductive hearing loss in the Tcof1 mutant mouse. Hum Mol Genet. 19, 1551-1560 (2010).
- Buytaert, J. A., Johnson, S. B., Dierick, M., Salih, W. H., Santi, P. A. MicroCT versus sTSLIM 3D imaging of the mouse cochlea. J Histochem Cytochem. 61, 382-395 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten