Method Article
Preparación fisiológica de las células ciliadas del sáculo de la rana toro americana (
En este artículo
Resumen
(Rana catesbeiana) sáculo de la rana toro americana permite el examen directo de la fisiología de las células del cabello. A continuación se describe la disección y preparación del sáculo de la rana toro para estudios biofísicos. Mostramos experimentos representativos de estas células, incluyendo el cálculo de la relación fuerza-desplazamiento de un paquete y la medición de su movimiento no forzado.
Resumen
El estudio de la audición y el equilibrio se basa en ideas extraídas de los estudios biofísicos de los sistemas modelo. Uno de estos modelos, el sáculo de la rana toro, se ha convertido en un pilar de la investigación auditivo y vestibular. Los estudios de este órgano han puesto de manifiesto cómo las células sensoriales del cabello puede detectar activamente señales del entorno. Debido a estos estudios, que ahora entendemos mejor la compuerta mecánica y localización de los canales de transducción de una célula de pelo, el papel del calcio en la adaptación mecánica, así como la identidad de las corrientes de células ciliadas. Este órgano muy accesible continúa proporcionando información sobre el funcionamiento de las células ciliadas. Aquí se describe la preparación de sáculo de la rana toro para estudios biofísicos en sus células ciliadas. Incluimos el procedimiento de disección completa y proporcionar protocolos específicos para la preparación del sáculo en contextos específicos. Además incluimos resultados representativos que utilizan esta preparación, incluyendo el cálculo deinstantáneo relación fuerza-desplazamiento de un haz de pelo y medida de la oscilación espontánea de un paquete.
Introducción
Los órganos acousticolateralis de mamíferos poseen una arquitectura compleja y se encuentran dentro de un nicho anatómica que puede ser de difícil acceso. Por ejemplo, la cóclea de los mamíferos comprende un laberinto en espiral y está insertada dentro del hueso temporal de espesor. Aislamiento de la cóclea a menudo causa daño mecánico a las células sensoriales que están dentro de ella y, por tanto, ha demostrado ser una tarea difícil 1. por tanto, los neurocientíficos han recurrido a modelar sistemas que se extraen más fácilmente desde el santuario de la oreja.
Uno de estos sistemas modelo, el sáculo de la rana toro (Rana catesbeiana), tiene desde hace décadas dieron una visión generalizables a la función de los sistemas auditivos y vestibulares. El sáculo es un órgano de función mixta con funciones sensoriales en tanto audiencia de baja frecuencia y la sensación sísmica. Las células sensoriales del sáculo son sus células ciliadas, transductores especializados que convierten la energía mecánicaen señales eléctricas dentro de nuestros órganos auditivos y vestibulares. Sobresalen de la superficie apical de cada célula del cabello es un haz de pelo mechanosensitive que comprende un mechón graduada de microvellosidades ampliada llamado estereocilios. Las puntas de los estereocilios adyacentes están interconectados por proteínas punta de enlace filamentosos que mecánicamente los canales de iones de compuerta en respuesta a los estímulos mecánicos 2, 3. Aunque los órganos auditivos y vestibulares responden a diferentes tipos de estímulos, comparten un mecanismo de detección común. Esta coincidencia subyace en los conocimientos adquiridos en muchos mechanotransduction de células cabello a través de estudios de la rana toro sáculo. Por ejemplo, proceso activo de la célula de pelo se ha estudiado ampliamente en este órgano 4, 5, 6, 7, y el haz de pelo emplea un proceso que consume energía para producir mecánicotrabajo. No sólo se ha demostrado que las células ciliadas generan trabajo activo 6, pero distintos mecanismos que subyacen al proceso activo y las características de sintonización de una célula de pelo se han dado a conocer a través de estudios de rana toro acousticolateralis órganos. Estos incluyen activo pelo de haz de la motilidad 8 y las células ciliadas de resonancia eléctrica 9, 10, 11 en el sáculo y la selectividad de frecuencia en la sinapsis de la cinta de la célula de pelo 12 en la papila anfibio.
sáculo de la rana toro hace un llamamiento a los neurólogos sensoriales por numerosas razones. A diferencia de la cóclea de los mamíferos, este órgano se encuentra dentro de la cápsula ótica fácilmente accesible. En segundo lugar, las células ciliadas dentro de este órgano puede mantenerse saludable durante varias horas en condiciones apropiadas 13, 14. Esto permite experimentation sobre estas células a través de largas escalas de tiempo en relación con sus homólogos de mamíferos. En tercer lugar, el órgano tiene poca curvatura, lo que permite una fácil manipulación. En cuarto lugar, cada órgano comprende un millar o más células ciliadas 15, proporcionando un alto rendimiento y una alta probabilidad de localizar un conjunto apropiado de las células ciliadas para un experimento dado. Finalmente, sáculo de la rana toro se visualiza fácilmente debido a la delgadez de este órgano y el gran tamaño de sus células de pelo.
Estas propiedades proporcionan una gran versatilidad para el estudio de las células sensoriales dentro sáculo de la rana toro. Dependiendo de la pregunta a la mano, una de las diversas preparaciones experimentales se puede obtener de la sáculo. La más simple de éstas es la preparación de una sola cámara. Aquí el sáculo se inmoviliza en una cámara llena de perilinfa artificial, una solución salina rica en sodio y alto contenido de calcio. Esta preparación permite el estudio de las corrientes de células ciliadas y mecánica básica haz de pelo. Una segunda configuración, la preparación de dos cámaras, se puede utilizar para estudiar los movimientos espontáneos haz de pelo. Aquí el lado apical de las células ciliadas se expone a una solución salina rica en potasio y calcio de los pobres denominado endolinfa artificial, mientras que el lado basolateral está bañado por la perilinfa artificial. Estos dos compartimientos imitan la disposición in vivo de salines y proporcionan un entorno que permite haces de pelo oscilen de forma espontánea.
Se describe en este artículo la preparación del sáculo de la rana toro para el estudio biofísico de sus células ciliadas sensoriales. En primer lugar, ofrecemos una descripción detallada del aislamiento de este órgano del oído interno de la rana. A continuación describimos tanto el uno y dos de la cámara de preparaciones experimentales e incluir los resultados representativos para cada configuración.
Protocolo
Declaración de Ética: Todos los procedimientos fueron aprobados por el Comité Institucional de Cuidado de Animales y el empleo (IACUC) de la Universidad Rockefeller.
1. Pre-experimental Prespanparation
- soluciones
- Preparar la solución de eugenol (2,5 g · L-1 · kg -1 rana). Preparar las soluciones salinas (Tabla 1).
NOTA: En caso de preparados de una sola cámara, preparar perilinfa artificial; para una preparación de dos cámaras, preparar tanto perilinfa artificial y endolinfa artificial.
- Preparar la solución de eugenol (2,5 g · L-1 · kg -1 rana). Preparar las soluciones salinas (Tabla 1).
2. Herramientas experimentales
- Preparación de fibras de vidrio estimulación
- Para concretar un capilar de vidrio de borosilicato con un extractor de electrodos en un tirón de una línea con altas temperaturas y alta velocidad. Cargar el capilar tirado en un extractor accionado por solenoide.
- Llevar la punta del capilar hacia un filamento con una cuenta de vidrioderretida en él hasta que los contactos capilares del grano de cristal.
- Encienda el filamento para fundir la punta del capilar en la perla de vidrio. Una vez que un delgado puente de formas de cristal entre el capilar y el talón, apague el filamento y casi al mismo tiempo activar el extractor de solenoide.
NOTA: Esto hará que el capilar de vidrio en un ángulo recto a su eje largo y crear una fibra sólida. - Asegúrese de que el diámetro de la fibra es de no más de 0,5 a 1 micras y que su longitud no excede de 100 a 300 micras. Si la longitud de la fibra es superior a esta dimensión, se recorta con tijeras iris. Use las tijeras que ya están opaco para evitar daños en las herramientas de disección.
- Para mejorar el contraste óptico, revestir la fibra. Utilice un dispositivo de revestimiento por bombardeo iónico con una fuente de oro-paladio. Verticalmente cargar cada fibra en un aparato de revestimiento por bombardeo iónico con su extremo cónico hacia la fuente. Llevar la punta de la fibra a una distancia de 1 - 2 cm de la fuente de oro-paladio.
- Cierra elpulverización catódica cámara del dispositivo de recubrimiento para formar un sello y vuelva a encenderlo. En repetidas ocasiones expulsar el aire ambiente con argón. Después de lavar el aire, reducir la presión dentro de la cámara a 10 Pa (70 mTorr).
- Pulverización catódica abrigo en 10 s 10 s pulsos con retrasos más de un curso de 120 s.
NOTA: La punta de la fibra se oscurece durante la duración de este protocolo si el revestimiento por bombardeo iónico fue un éxito.
- Preparación de microelectrodos afilados
- Tirar de un capilar de vidrio con un filamento interno utilizando una sola línea de tracción de alta temperatura. Los electrodos deben tener una resistencia de los 100 - 300 mO cuando esté lleno de 3 M KCl. Llene cada electrodo con 3 M KCl.
- Curva punta de cada electrodo con el microforge que lo convierta en perpendicular a la superficie apical de las células ciliadas cuando está montado en el cabezal de la platina 16 amplificador.
- Preparación de pipetas de iontoforesis
- Tirar de un capilar de vidrio con un interiorfilamento a una punta 50 mO. Rellenar con soluto concentrado (sulfato por ejemplo, 500 mM de gentamicina).
- Preparación de la plaza de montaje de aluminio
- Corte un 1 cm x 1 cm cuadrado de papel de aluminio. Perfore el papel aluminio en el centro con la punta de una varilla de inserción de aguja u otro objeto afilado. Forma de la perforación de modo que es circular y aproximadamente 1 mm de diámetro.
- Preparación de vacío jeringa lleno de grasa.
- Retire el émbolo de una jeringa de 5 mL. Llenar la jeringa de la parte posterior con grasa de vacío. Vuelva a colocar el émbolo.
- Preparación de politetrafluoroetileno aplicador de cola
- Hacer un largo axial 2 mm cortada en el extremo de un aplicador de madera. La ranura debe estar en el centro del aplicador cuando se observa al final en.
- Con unas tijeras afiladas o una hoja de afeitar, cortar un 2 mm x 4 mm rectángulo de politetrafluoroetileno de una lámina de 1 mm de espesor.
- Utilice una hoja de afeitar para delgada uno de los bordes de 2 mm de largo del rectángulo politetrafluoroetileno. Comenzando en el centro del rectángulo, reducir el espesor del rectángulo por cortado hacia fuera para formar un bisel en el extremo del rectángulo.
- Insertar el rectángulo de politetrafluoroetileno en la ranura aplicador de madera de tal manera que el borde biselado se enfrenta lejos de la barra. Aplicar 5 min epoxi a la base del rectángulo politetrafluoroetileno para asegurarlo en su lugar. Permitir que el aplicador de cola para curar durante 1 h a temperatura ambiente.
- Preparación de la mitad inferior del de dos cámaras,
- Máquina de impresión en 3D o la mitad inferior de la cámara de montaje de dos (2 archivo Suplementario). Identificar el círculo de diámetro 20 mm empotrado en la superficie inferior de la cámara.
- Aplicar una fina capa de epoxy para los laterales más de 3 mm del círculo rebajada. Aplicar una 18 mm cubreobjetos de vidrio circular sobre el epoxi. Permita que el epoxy se cure por 1marido.
3. La extracción de órganos del oído interno
- Anestesiar a una rana toro, colocándolo en un pequeño cubo que contiene eugenol solución anestésica durante 10 minutos. Ajustar el volumen de la solución de manera que húmero-escapular de la rana mentiras conjuntas justo por encima de la interfaz aire-líquido.
- La eutanasia a la rana toro anestesiado por doble descabello.
- Agarre la rana anestesiado con un dedo encima de su nariz y la otra por debajo de la mandíbula y girar la cabeza de la rana hacia adelante.
- Sumergirse rápidamente la varilla descabello en la bóveda del cráneo a través del foramen magnum, que se encuentra en la línea media entre los procesos occipital de la rana.
- Retire lentamente y gire la varilla hasta que su punta se aparta del foramen magnum. Forzar la varilla en sentido caudal a través del foramen vertebral para destruir la médula espinal.
- Confirmar que la rana ha sido debidamente doblemente Amedular mediante la observación de que sus extremidades inferiores se extienden.
- Agarre la rana con un pulgar encima de la nariz y el dedo índice agarrar los dientes vomerianos para mejorar la estabilidad. Decapitar a la rana por el corte de la articulación temporomandibular bilateral y posteriormente el corte ortogonal al eje rostrocaudal. Para asegurar que los órganos del oído interno dentro del cráneo se mantienen intactos, asegúrese de que el corte es caudal a ambos tímpanos.
- Utilizando un microscopio stereodissection, ejecutar una línea media cortar a través del tejido palatal de los dientes vomerianos en la medida más posterior del tejido (Figura 1A).
- Sever y claro con cortes horizontales del bisturí cualquier músculo se extiende por debajo del tejido palatino para revelar el cartílago posterior. Después de retirar el músculo, observar la forma piruleta del cartílago temporal que forma el límite de la cápsula ótica.
- Cortar la columela en su punto de contacto con el cartílago de la cápsula ótica.
- Repetidamente afeitar capas delgadas de este cartílago haciendo shallow cortes horizontales a través de él. Evitar cortes profundos para evitar daños en los órganos del oído interno. Esto abre la cápsula ótica se encuentra dentro de la estructura de piruleta del cartílago temporal (Figura 1B). Dentro de la cápsula ótica son órganos del oído interno de la rana (Figura 1C).
- Recorte la parte posterior y bordes laterales de la cápsula ótica, teniendo cuidado de no dañar los órganos del oído interno. Durante la disección, con frecuencia el flujo de solución salina sobre los órganos del oído interno para asegurarse de que permanecen sumergidas e hidratada.
- Localizar las dos aberturas circulares en el hueso temporal en la conexión medial del cartílago a la línea media. Cortar hacia abajo a través de la abertura más medial a la ruptura del hueso temporal.
- Hacer un segundo corte hacia abajo a través de la cápsula ótica en su borde postero-lateral. Retire el trozo de cartílago entre esto y el corte anterior para proporcionar acceso a los órganos del oído interno.
- Haga palanca perder el cartílago entre los cortes de los pasos 3.8 unaND 3.9 y cortar lejos de la cápsula ótica. Esta acción corta el canal semicircular más cercano, que entonces se puede utilizar como un asa para manipulaciones adicionales.
- Teniendo cuidado de no tocar el sáculo, cortar la VIII o de los nervios craneales.
- Mantenga la ampolla del canal semicircular más cercano. Girar suavemente el oído interno para exponer los dos restantes canales semicirculares. Tras la exposición de cada canal, cortarlo.
- Sosteniendo el nervio o una ampolla canal semicircular, extraer el oído interno de la cabeza y colocarla en un plato lleno de frío perilinfa artificial oxigenado. La eliminación del oído interno permite la visualización de los pasajes dentro del hueso temporal a través del cual una vez que pasaron los canales semicirculares (Figura 1D).
NOTA: Repita estos pasos para extraer el segundo oído.
4. Preparación de una sola cámara
- Aislamiento de sáculo
- Busque el sáculo mediante la identificación de su gran white masa de otoconias y el nervio sacular que se encuentra encima de ella (Figura 1E). Tenga cuidado de no traumatizar físicamente el sáculo durante los siguientes pasos con el fin de mantener la integridad de las células ciliadas saculares.
- Recorte los canales semicirculares para hacer que el oído interno más maniobrable.
- Retire la cisterna perilinfática que recubre la parte neural del sáculo. Hacer cortes suaves en todo el perímetro de la cisterna. Siguiente cortar las pequeñas columnas de tejido que unen la membrana de la cisterna a la parte neural del sáculo.
- Retire el lagena y su nervioso asociado.
- Sosteniendo el nervio sacular, levante suavemente el sáculo y cortar a través de la delgada membrana del saco otoconiales. Como otoconias derrame fuera de la bolsa, liberar el sáculo cortando alrededor de su perímetro.
NOTA: Después de aislar el sáculo, los restantes órganos del oído interno pueden ser salvados si se desea. La eliminación del sáculo facilita la identificación de otras estructuras, tales comolas papilas anfibios y basilar. - Use tijeras o pinzas para limpiar cuidadosamente cualquier resto de otoconias restante en el sáculo. Tenga cuidado de no tocar el sáculo durante este proceso.
- Recortar cualquier membrana otoconiales salida restante de la orilla los sáculo. Esta membrana tiende a adherirse a las superficies de plástico y de vidrio y su retirada minimiza desafíos en el manejo del tejido.
- Suavemente el flujo de solución salina sobre el sáculo con una pipeta Pasteur para eliminar cualquier otoconia restante (Figura 1F).
NOTA: Repita este procedimiento para el segundo sáculo, que es una imagen especular de la primera.
- La digestión y de montaje
- Con el extremo posterior de una pipeta Pasteur con su punta rota, transferir el sacculi aislada a una placa de Petri que contiene 3 ml de 67 mg XXIV ∙ L-1 proteasa en perilinfa artificial.
NOTA: Este tratamiento proteasa digiere los enlaces que permitan amarrar cada bombilla kinociliary a la otolíticamembrana, lo que permite la eliminación de la membrana sin dañar los haces de pelo sensoriales. - Incubar el tejido durante 30 min a 22 ° C (o 35 min a 21 ° C). Transferir cada sáculo digerido con una cámara experimental de cara abierta y asegurar el tejido con pasadores magnéticos.
- La mácula sacular se encuentra directamente debajo de la membrana otolítica y es la parte de la sáculo que contiene células de pelo. Identificarlo y retirar con cuidado su membrana que recubre otolítica usando una multa de pestañas, teniendo cuidado de no tocar la mácula sacular.
- Con el extremo posterior de una pipeta Pasteur con su punta rota, transferir el sacculi aislada a una placa de Petri que contiene 3 ml de 67 mg XXIV ∙ L-1 proteasa en perilinfa artificial.
5. Preparación bicameral
- Aislamiento de sáculo
- Aislar el sáculo de los órganos del oído interno como en la Sección 4.1.
- El montaje y la digestión
- Llene el bloque de montaje (archivo Suplementario 3) con perilinfa artificial y colocar la lámina de aluminio perforada por una abertura, utilizando dos puntos de vacíoengrasar para mantenerlo en su lugar y formar un sello débil.
- Transferencia uno sáculo a la hoja y centrarla en la parte superior del agujero con la mácula hacia abajo y el muñón del nervio hacia arriba.
- Retire la solución salina que rodea el sáculo con un trozo de tejido trenzado. Wick de la solución salina para secar la superficie de la plaza de aluminio que rodea el sáculo.
- Utilice el aplicador de politetrafluoroetileno para aplicar pegamento de cianoacrilato para formar un sello hermético a lo largo de la frontera entre el borde de la sáculo y el cuadrado de aluminio. Asegúrese de que toda la circunferencia de la sáculo se cubre con pegamento.
NOTA: Procediendo demasiado lentamente permite que el pegamento de cianoacrilato a la fluencia sobre el lado neural del sáculo y, finalmente, lo cubre. Por tanto, es imprescindible para completar esta tarea con rapidez. - Colocar una gota de solución salina en la parte superior del tejido montada para curar el pegamento. Una fina capa de cola puede formar en la parte superior de la gota de solución salina; retira con las pinzas.
- Retirar con cuidado tque frustrar del bloque de montaje. Da la vuelta al tejido montado de manera que el lado macular del sáculo mire hacia arriba y flotar en un plato artificial perilinfa lleno de Petri.
- Añadir una gota de solución XXIV de la proteasa en la parte superior de la mácula y se incuba durante 30 min a 22 ° C (o 35 min a 21 ° C). Llene el canal inferior del aparato de dos cámaras (archivo Suplementario 2) con grasa perilinfa y lugar vacío alrededor de la cámara central.
- Coloque el sáculo lámina montada en la cámara inferior con su nervio hacia la superficie de la cámara. Añadir la grasa alrededor del perímetro de la lámina.
- Coloque la cámara superior (archivo Suplementaria 1) de la preparación de la lámina, teniendo cuidado de formar un sello completo con la grasa de vacío. Llenar la cámara superior de endolinfa artificial burbujear y retire con cuidado la membrana otolítica con una pestaña.
Resultados
El epitelio sensorial del sáculo de la rana toro se puede emplear en varias configuraciones para investigar la fisiología de las células ciliadas. Debido a que el tejido es relativamente plana, que se puede montar en ambas preparaciones de uno y de dos cámaras. La configuración de una sola cámara ofrece una sencilla configuración de los registros electrofisiológicos y de micromecánica de células ciliadas. La preparación de dos cámaras en lugar simula tanto el endolinfático y compartimentos perilinfáticos sobre respectivamente los lados apical y basal de las células ciliadas. Estos compartimentos juntos proporcionan un entorno fisiológicamente relevante para el estudio de mechanotransduction por las células de pelo.
Las características de sensibilidad y de transducción de las células ciliadas subyacen a su respuesta eléctrica a la estimulación mecánica. Para investigar estas características, que a la vez grabada de una célula individual del pelo de la posición de su paquete yel potencial del receptor de la célula (Figura 2). En primer lugar, adjuntamos una fibra de vidrio flexible para la bombilla kinociliary de un mechón de cabello para aplicar pulsos de fuerza. A continuación, medir el desplazamiento del haz de pelo usando un sistema de doble fotodiodo 2 (Figura 2A). Nos simultáneamente adquirido el potencial de la célula de pelo por empalar la célula con un microelectrodo agudo. Se obtuvo una curva de desplazamiento de respuesta por el trazado de la respuesta pico de tensión provocada por cada estímulo mecánico contra correspondiente desplazamiento del haz de pelo (Figura 2B). respuesta eléctrica de las células del cabello satura tanto para extremos positiva y negativa de desplazamiento. La reducción del potencial de membrana con pasos de desplazamiento negativo indica la presencia de una corriente de entrada de descanso mechanotransduction. Esta corriente de reposo es modulada por la acción de Ca 2+ en tanto rápido y lento de adaptación 17, 18, 19, 20, 21.
El comportamiento de una célula de pelo depende no sólo de sus propiedades eléctricas, sino también de los micromecánica de su haz de pelo sensorial. Los imitadores de configuración de dos cámaras de separación de la endolinfa y perilinfa in vivo, proporcionando las condiciones ideales para el estudio de la mecánica de un lote de pelo. En estas condiciones y con la membrana otolítica eliminado, haces de pelo pueden oscilar espontáneamente 6. Aquí hemos empleado la preparación de dos cámaras para evaluar los micromecánica de paquetes individuales. Registramos las oscilaciones espontáneas de un haz de pelo por proyectando su sombra en un monitor de desplazamiento de doble fotodiodo (Figura 3). Para evaluar el papel de la aminoglicósido antibiótico gentamicina en mechanotransduction, que iontoforéticamente Rele obre la base de gentamicina directamente sobre el haz de pelo (Figura 3). La concentración de gentamicina liberada aumenta proporcionalmente con la corriente pasa a través de la micropipeta. La gentamicina inhibe oscilaciones de un haz de pelo e induce un desplazamiento del haz hacia su lado de altura estática. Estos efectos reflejan el papel de gentamicina como un bloqueador de canal abierto que mantiene el estado abierto de los canales mechanotransduction mientras que el bloqueo de los poros de su permeabilidad. La iontoforesis de productos químicos cargados permisos localizada y liberación cuantificable de productos químicos en diferentes concentraciones en ausencia de la rotura mecánica de fluidos inducida por el flujo y es por tanto ideal para el estudio de orgánulos mechanosensitive tales como el haz de pelo 22.
El movimiento espontáneo de un mechón de cabello se debe a la interacción entre la adaptación y la rigidez no lineal haz 7,xref "> 8, 23, 24. Este movimiento espontáneo es una firma de proceso activo de un haz de pelo, que convierte la energía de la señal en trabajo mecánico para superar la fricción viscosa. haces de pelo se ha demostrado que exhiben la rigidez instantánea no lineal en el vestibular 2, auditiva 25, y la línea lateral 26 sistemas.
Nosotros medimos directamente la rigidez instantánea de un haz de pelo individuo de sáculo de la rana toro (Figura 4). Para lograr esto, acoplan las punta de una fibra de vidrio flexible para bombilla kinociliary del haz de pelo (Figura 4A). Hemos entregado fuerzas para el haz de pelo mediante el desplazamiento de la base de la fibra. La fuerza ejercida sobre el haz de pelo por la fibra estímulo corresponde a la diferencia entre los desplazamientos de bas de la fibrae y la punta, multiplicados por la rigidez de la fibra 2, 27. La entrega de pulsos a través de una gama de fuerzas revela una relación entre la fuerza ejercida sobre el haz y el desplazamiento subsiguiente del paquete. La pendiente de esta relación de fuerza-desplazamiento corresponde a la rigidez instantánea del haz de pelo (Figura 4A).
Este método nos permitió medir la rigidez instantánea de un paquete individual como una función de su deflexión (Figura 4B). La curva de fuerza-desplazamiento instantánea muestra una relación no lineal, revelando una rigidez no lineal del haz sobre un rango de alrededor de 20 nm en torno a su posición de reposo. Fuera de este rango, el haz de pelo se comporta como un material Hookean, su rigidez es lineal para las desviaciones de magnitud grande.
Estos resultados demonstevaluar la versatilidad del sáculo rana toro en el estudio de la fisiología de las células del cabello. El uso de estas y otras preparaciones, uno puede explorar mechanotransduction en múltiples etapas en la transmisión de la información desde el haz hacia el cerebro.

Figura 1: La disección del Oído Interno de la rana toro. (A) Visualización de paladar superior de la rana toro de su cara ventral permita la identificación de la trompa de Eustaquio (círculo). reflejo lateral de la piel que cubre el lado derecho de la parte superior del paladar revela la ubicación del oído interno (caja punteada). (B) La eliminación del cartílago en el lado ventral del hueso temporal de la rana se abre la cápsula ótica (línea discontinua). (C) Se muestra es una imagen de mayor aumento de la cápsula ótica, en el que el sáculo, lagena, CN VIII, y sacc ular nervio se puede identificar fácilmente. (D) Una vista de la cápsula ótica después de la eliminación de los órganos del oído interno revela las ubicaciones de los canales semicirculares. (E) Después de la eliminación de la oreja aislado interior, el sáculo, lagena, y VIII TH nervio craneal (CN VIII) se pueden identificar fácilmente. (F) El sáculo aislado posee un corto muñón del nervio sacular y una membrana otolítica se extiende encima de su epitelio sensorial. Las etiquetas corresponden a la (i) sáculo, (ii) lagena, (iii) CN VIII, (iv) del nervio sacular, y (v) la membrana otolítica. Etiquetas de eje P y A corresponden respectivamente a las direcciones posterior y anterior. Las barras de escala representan 1 cm (A, B), 1 mm (C, D, E), y 400 micras (F).
Haga clic aquí para ver una versión más grande de esta figura.
s "target =" _ blank "> Haga clic aquí para descargar una versión vectorial de esta figura.
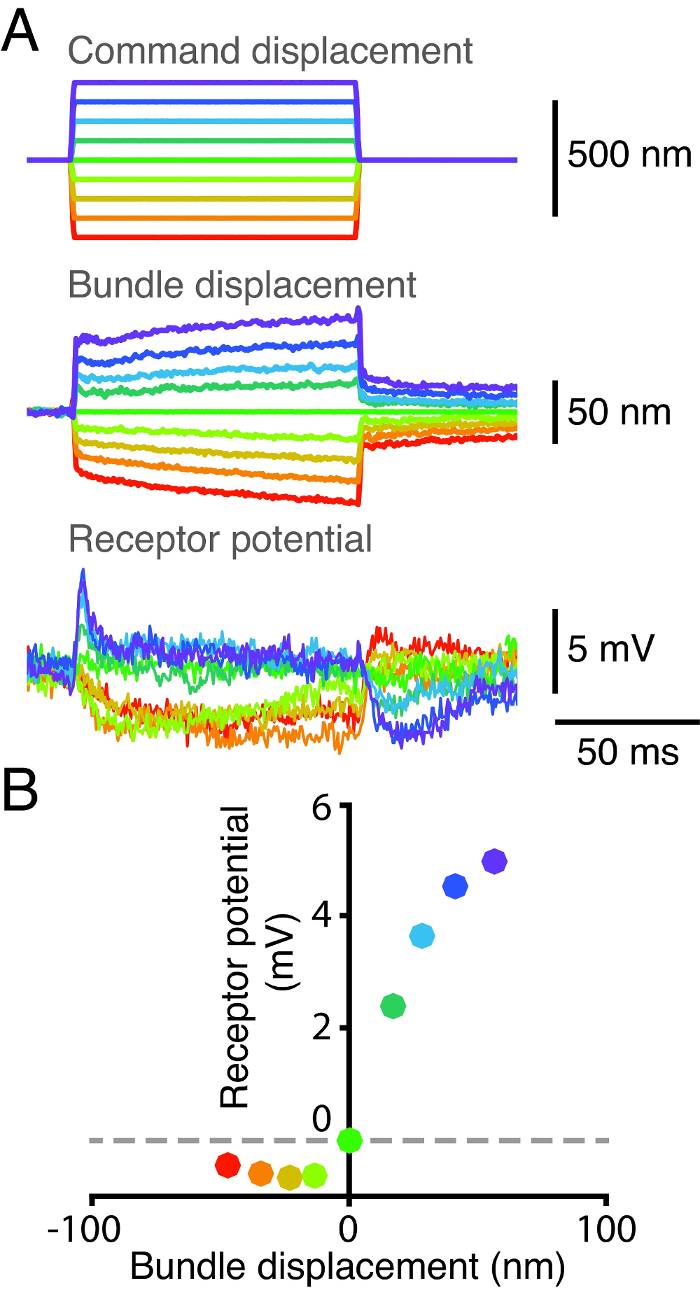
Figura 2: curva de desplazamiento de respuesta para una célula de pelo individual. (A) La punta de una fibra de vidrio de estímulo se acopló a la bombilla kinociliary de un haz de pelo y la base de la fibra fue desplazada posteriormente a través de nueve pasos discretos. La posición del haz fue localizado en un sistema de doble fotodiodo, y su potencial de receptor se midió simultáneamente usando un microelectrodo cuya salida se pasó a través de un amplificador en modo de puente. resistencia a la punta del electrodo fue de 95 mO y el potencial de membrana en reposo del lote fue -47 mV. (B) Un diagrama del potencial receptor del haz como una función de su desplazamiento revela una relación no lineal entre la respuesta y su del loteposición. Cada punto corresponde a la media potencial y la media de desplazamiento a través de una ventana de tiempo de 2,5 ms, a partir de 2,5 ms después del inicio de la estimulación mecánica. Cada color representa un conjunto de series de tiempo correspondiente a la misma de pulsos de desplazamiento.
Haga clic aquí para ver una versión más grande de esta figura.
Por favor, haga clic aquí para descargar una versión vectorial de esta figura.
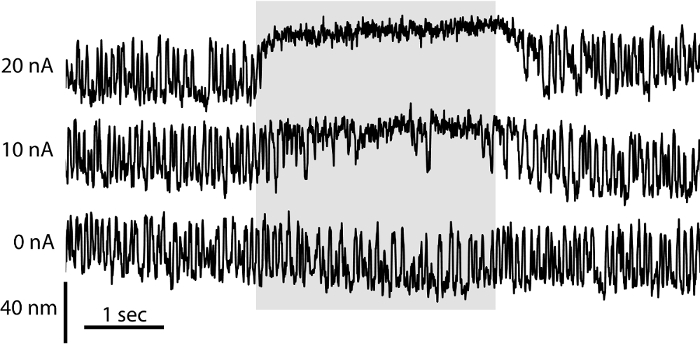
Figura 3: Efecto de gentamicina en espontánea de pelo Bundle oscilación. El movimiento espontáneo de un haz de pelo en una preparación de dos cámaras se registró usando un sistema de fotodiodos dual. En ausencia de la liberación iontoforética de gentamicina (0 nA), el cabellohaz de muestra oscilaciones simétricas. A medida que la magnitud de la corriente pasa a través de una pipeta iontoforético lleno con 500 mM de sulfato de gentamicina crece (10 nA, 20 nA), la frecuencia de excursiones de pelo paquete cae de una manera dependiente de la dosis y el haz se compensa hacia su borde alto durante más tiempo períodos de tiempo.
Haga clic aquí para ver una versión más grande de esta figura.
Por favor, haga clic aquí para descargar una versión vectorial de esta figura.
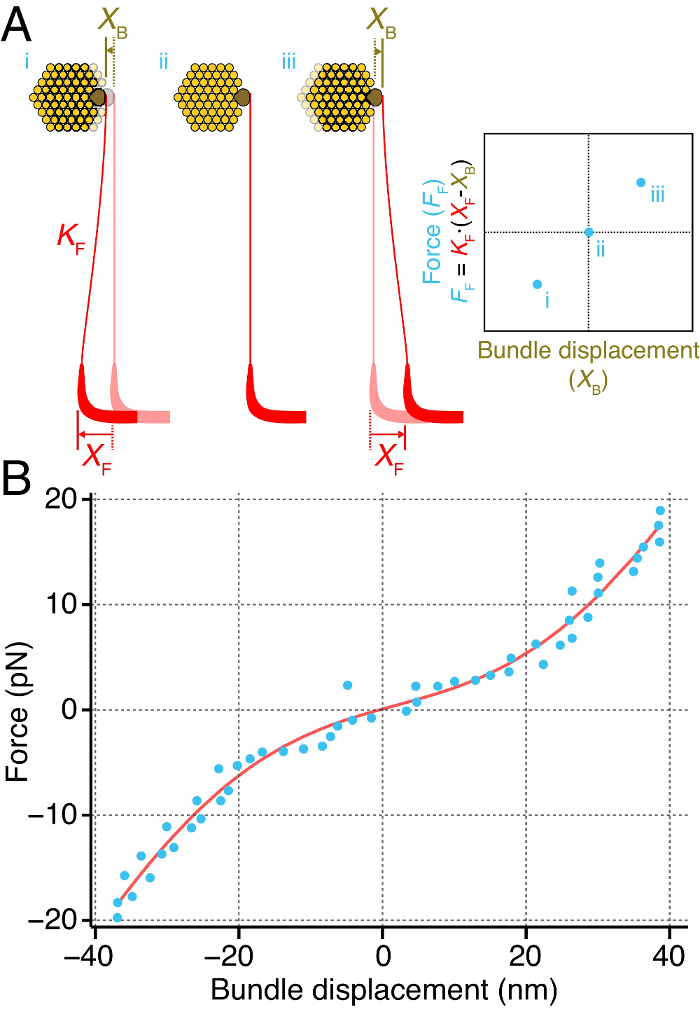
Figura 4. Cálculo de un mechón de cabello instantánea rigidez. (A) Una fibra de estímulo (rojo) de la rigidez K F está acoplado to la bombilla kinociliary (marrón) de un haz de pelo individuales (amarillo). El desplazamiento de la base de la fibra a una distancia conocida X F hace que el haz para moverse una distancia X B. La diferencia entre los desplazamientos de la fibra y el haz es proporcional a la fuerza ejercida sobre el haz por la fibra de estímulo, F F. La repetición de este a través de una gama de fuerzas produce una relación de fuerza-desplazamiento instantáneo (derecha), la pendiente de lo que corresponde a la rigidez instantánea del haz de pelo. (B) Un paquete individual se somete a una fuerza pulsos de magnitud creciente y su desplazamiento dentro de los primeros 50 ms después de la aparición de pulso se midió (puntos azules). Aquí el haz de pelo muestra una rigidez instantánea no lineal en un rango de aproximadamente 20 nm en torno a su posición de reposo. La curva roja corresponde a un ajuste a la relación F = k * X - 60 * z * (1 / (1 + exp (- z * (X - X 0) / (k B * T))) + F 0, en la que F es la fuerza aplicada al haz, X es el desplazamiento del haz, k = 790 ± 51 μN ∙ m -1 es el paquete de constante rigidez cuando todos los canales están cerradas o abiertas, z = 0,43 ± 0,04 pN es la fuerza de un solo resorte compuerta, X 0 = 2 ± 1,9 nm es la posición del haz de la cual el 50% de sus canales están abiertos, k B es de Boltzmann constante, T es la temperatura, y F = 0 11,7 ± 1,3 pN es una fuerza de desplazamiento. El ajuste posee un coeficiente de determinación de 0,98. La fibra de estímulo tenía una rigidez de 107 μN ∙ m -1.
Haga clic aquí para ver una versión más grande de esta figura.
en / ftp_upload / 55380 / Figure4_v5.eps "target =" _ blank "> Haga clic aquí para descargar una versión vectorial de esta figura.
| Sustancia disoluta | Fórmula Peso (g / mol) | Añadir a 1 L | |
| perilinfa artificial | endolinfa artificial | ||
| NaCl | 58.4 | 6,54 g | 0,117 g |
| KCl | 0,149 | 0,149 g | 8,62 g |
| CaCl 2 ⦁ 2H 2 O | 147 | 2 ml de 1 M CaCl 2 stock | 250 l de 1 M CaCl 2 stock |
| HEPES | 238,3 | 1,19 g | 1,19 g |
| D - (+) - glucosa | 180.2 | 0,541 g | 0. 541 g |
Tabla 1. Las soluciones para la disección y preparación experimental. Muestran en esta tabla son las recetas para perilinfa artificial y soluciones endolinfa artificiales utilizados en la disección y en los preparativos de una o de dos cámaras. Las soluciones deben ser llevados a un pH de 7.2 a 7.4 con aproximadamente 2 ml de NaOH (perilinfa) o 2 ml de KOH (endolinfa). La fuerza osmótica debe decir aproximadamente 230 mmol · kg -1 debido a la disociación iónica incompleta.
Discusión
Dentro sáculo de la rana toro se encuentran varios miles de células ciliadas sensoriales de fácil acceso. Aquí se demuestra la extracción y la preparación del sáculo para las grabaciones de una y de dos cámaras. Estas dos preparaciones permiten ambos estudios micromecánica y electrofisiológicas de las células ciliadas y sus paquetes asociados. Debido a que el tejido puede sobrevivir durante varias horas con el reemplazo frecuente de solución salina oxigenada, los experimentos pueden continuar durante largos períodos de tiempo. Las células pilosas en estas preparaciones normalmente permanecen viables durante la grabación de microelectrodos para un máximo de 6 h después de la disección, mientras haces de pelo oscilan de forma espontánea hasta 24 h después de la extracción.
extracción exitosa y montaje del sáculo gira en torno a la superación de varios problemas comunes. En primer lugar, el contacto directo con la superficie apical de la mácula sacular debe ser evitado en todo el procedimiento de preparación. El nervio sacular proporciona un mango conveniente para manipu seguramento del sáculo. Una vez liberado del resto de los órganos del oído interno, el sáculo debe ser transferido utilizando una pipeta de gran calibre sin dejar de ser sumergido en el fluido para evitar daños mecánicos a su epitelio sensorial. La eliminación de otoconia de la superficie macular debe ser completado sin daño mecánico a las células de pelo. Debido a que el otoconias se encuentran directamente sobre la mácula, las células ciliadas pueden ser dañados por el contacto accidental entre las herramientas de disección y la membrana otolítica mientras se quita la otoconias. Para evitar daños, se recomienda que la masa gelatinosa de otoconias llevará a cabo en un lugar lejos de la mácula y se retira como una sola masa. Esto evita la fragmentación de la masa otoconiales en numerosos grupos, cada uno de los cuales se pueden extraer individualmente. Si pequeños grupos de otoconia permanecen se pueden eliminar con la presión de fluido suave entregado por una pipeta Pasteur. Un desafío final implica la formación de un sello hermético entre la plaza sáculo y aluminio de montaje en elpreparación de dos cámaras. El empleo de un cuadrado con una perforación suficientemente pequeño para permitir la superposición de alrededor de 100 micras entre el sáculo y los permisos de aluminio de hermeticidad circundante completa del tejido. La cola debe ser puesto en contacto con aproximadamente 100 micras de tejido sacular alrededor del perímetro de la mácula con el fin de formar un sello hermético.
La concentración de Ca 2+ libre es una consideración importante en el estudio de las células ciliadas. Ca 2+ regula la adaptación a la vez rápido y lento, determinando así la cinética de la aparato mechanotransduction y las características de los fenómenos-proceso activo del haz de pelo, incluyendo espontánea movimiento paquete 8, 23. Endolinfático calcio in vivo está presente en 250 M, por lo tanto, la cinética más fisiológicamente relevantes son evaluados en esta concentración (Maunsell JHR, R. Jacobs, y AJ Hudspeth. Unpublisobservaciones HED 16). Sin embargo, las grabaciones de microelectrodos de células ciliadas requieren una concentración de calcio exterior superior a 2 mM para el sellado adecuado de la membrana celular alrededor del microelectrodo. Por tanto, es imperativo el uso de una solución salina alto contenido de calcio para estos experimentos. Por último, se puede desear para estudiar los efectos del calcio externo sobre mechanotransduction usando una variedad de concentraciones de calcio. En estos casos, es importante recordar que las concentraciones de calcio por debajo de 1 mM suelen conducir a la punta de enlace de la ruptura y la pérdida irreversible de transducción 28.
Las dos preparaciones experimentales descritos aquí permiten una gama de mediciones biofísicas en las células de pelo. Sin embargo, las mediciones adicionales pueden hacerse con ligeras modificaciones a estas preparaciones. En la preparación sacular plegada, mechones de cabello se visualizan lateralmente. De imágenes de movimiento del pelo-haz desde este punto de vista revela mot coherentede iones de muy poca altura y 29 estereocilios. Aquí la mácula sacular se separa primero a partir de su tejido subyacente y posteriormente plegada a lo largo del eje definido por el nervio sacular tal que haces de pelo se enfrentan hacia el exterior y se visualizan lateralmente en el pliegue. Una segunda modificación, la disociación de las células de pelo, permite el estudio tanto de haz de la célula de pelo y su soma. Las células ciliadas se disocian mecánicamente sobre un portaobjetos de vidrio para la formación de imágenes y grabación electrofisiológica 30. Por último, las células ciliadas se pueden extruir a partir del epitelio siguiendo un protocolo de disociación similar pero sin la etapa de disociación mecánica. Este tratamiento resulta en células de pelo que sacan gradualmente del epitelio, que proporciona acceso basolateral para los registros electrofisiológicos y reducir al mínimo los daños mecánicos. Estas preparaciones y sus muchas modificaciones demuestran la versatilidad del sáculo rana como un sistema modelo para la biofísicaestudio de las células ciliadas sensoriales.
Divulgaciones
The authors declare no competing interests.
Agradecimientos
The authors wish to acknowledge Dr. A. J. Hudspeth for funding and expertise in developing the preparations described in this paper. We also wish to thank Brian Fabella for creating and maintaining much of the custom equipment and software used in this protocol.
J. B. A. is supported by grant F30DC014215, J. D. S. is supported by grant F30DC013468, and both J. B. A. and J. D. S. are supported by grant T32GM07739 from the National Institutes of Health.
Materiales
| Name | Company | Catalog Number | Comments |
| Common to both preparations | |||
| Stereo-dissection microscope | Leica | MZ6 | Other sources can be used |
| Tricaine methanesulfonate | Sigma | E10521 | Other sources can be used |
| Metal pithing rod | Fine Science Tools | 10140-01 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | |
| Glass Pasteur pipette and bulb (x2) | Fisher Scientific | 22-042816 | |
| Fine eyelash mounted on a hypodermic needle | Fisher Scientific | 22-557-172 | |
| Dow-corning vacuum grease | Fisher Scientific | 14-635-5C | |
| Syringe for vacuum grease | Fisher Scientific | 14-829-45 | Other sources can be used |
| 35 mm Petri dish (x2 - 3) | Fisher Scientific | 08-772A | Other sources can be used |
| Micropipette puller | Sutter | P-97 or P-2000 | |
| 120 V Solenoid puller | Home-made, see parts list | ||
| Sputter coater | Anatech USA | Hummer 6.2 | |
| Current source for iontophoresis | Axon Instruments | AxoClamp 2B | Other sources can be used |
| Piezoelectric actuator | Piezosystem Jena | P-150-00 | |
| Amplifier for piezoelectric actuator | Piezosystem Jena | ENV800 | |
| Borosilicate glass capillary | World Precision Instruments | 1B120F-3 | |
| Name | Company | Catalog Number | Comments |
| For one-chamber preparation | |||
| Microelectrode amplifier | Axon Instruments | AxoClamp 2B | Can be used for iontophoresis and microelectrode recordings simultaneously |
| Magnetic pins (x2) | Home-made, see parts list | ||
| Open-top chamber with magnetic sheet | Home-made, see parts list | ||
| Name | Company | Catalog Number | Comments |
| For two-chamber preparation | |||
| Upper chamber | Supplementary file 1 | ||
| Troughed lower chamber | Supplementary file 2 | ||
| Aluminum foil | Fisher Scientific | 01-213-100 | Other sources can be used |
| Mounting block | Supplementary file 3 | ||
| Wooden applicator sticks | Fisher Scientific | 23-400-112 | Other sources can be used |
| Teflon sheet | McMaster-Carr | 8545K12 | For teflon applicator |
| Cyanoacrylate glue | 3M | 1469SB | |
| Lab tissues (Kimwipes) | Fisher Scientific | 06-666A | Other sources can be used |
| Gentamicin sulfate | Sigma-Aldrich | G1914 | Other sources can be used |
| Quick-setting epoxy | McMaster-Carr | 7605A18 | |
| 18 mm glass coverslips | Fisher Scientific | 12-546 | Other sources can be used |
| Name | Company | Catalog Number | Comments |
| Saline components | |||
| NaCl | Fisher Scientific | S271-3 | Other sources can be used |
| KCl | Sigma-Aldrich | P4504-500G | Other sources can be used |
| CaCl2 • 2H2O | Fisher Scientific | 10035-04-8 | Other sources can be used |
| HEPES | Sigma-Aldrich | H3375-100G | Other sources can be used |
| D-(+)-glucose | Sigma-Aldrich | G7021 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Parts lists for home-made equipment | |||
| Solenoid puller | |||
| Solenoid | Guardian Electric | A420-065426-00 | Other sources can be used |
| Foot-pedal switch | Linemaster | T-51-SC36 | Other sources can be used |
| Pipette holder | World Precision Instruments | MEH900R | Other sources can be used |
| Coarse manipulator | Narishige Group | MM-3 | Other sources can be used |
| Platinum wire | Alfa Aesar | 25093 | Other sources can be used |
| Power supply | Leica | Z050-261 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Magnetic pins | |||
| Epoxy | McMaster-Carr | 7556A33 | Other sources can be used |
| 1 mm thickness aluminum | McMaster-Carr | 89015K45 | Other sources can be used |
| Insect pins | Fine Science Tools | 26000-40 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Open-top magnetic chamber | |||
| Flexible magnetic strip | McMaster-Carr | 5759K75 | Other sources can be used |
| 1 mm thickness aluminum | McMaster-Carr | 89015K45 | Other sources can be used |
Referencias
- Brandon, C. S., Voelkel-Johnson, C., May, L. A., Cunningham, L. L. Dissection of Adult Mouse Utricle and Adenovirus-mediated Supporting-cell Infection. JoVE (Journal of Visualized Experiments). (61), e3734-e3734 (2012).
- Howard, J., Hudspeth, A. J. Compliance of the hair bundle associated with gating of mechanoelectrical transduction channels in the bullfrog's saccular hair cell. Neuron. 1 (3), 189-199 (1988).
- Jaramillo, F., Hudspeth, A. J. Localization of the hair cell's transduction channels at the hair bundle's top by iontophoretic application of a channel blocker. Neuron. 7 (3), 409-420 (1991).
- Assad, J. A., Hacohen, N., Corey, D. P. Voltage dependence of adaptation and active bundle movement in bullfrog saccular hair cells. Proceedings of the National Academy of Sciences of the United States of America. 86 (8), 2918-2922 (1989).
- Benser, M. E., Issa, N. P., Hudspeth, A. J. Hair-bundle stiffness dominates the elastic reactance to otolithic-membrane shear. Hearing research. 68 (2), 243-252 (1993).
- Martin, P., Hudspeth, A. J. Active hair-bundle movements can amplify a hair cell's response to oscillatory mechanical stimuli. Proceedings of the National Academy of Sciences of the United States of America. 96 (25), 14306-14311 (1999).
- Salvi, J. D., Ó Maoiléidigh, D., Fabella, B. A., Tobin, M., Hudspeth, A. J. Control of a hair bundle's mechanosensory function by its mechanical load. Proceedings of the National Academy of Sciences. 112 (9), E1000-E1009 (2015).
- Martin, P., Bozovic, D., Choe, Y., Hudspeth, A. J. Spontaneous Oscillation by Hair Bundles of the Bullfrog's Sacculus. Journal of Neuroscience. 23 (11), 4533-4548 (2003).
- Hudspeth, A. J., Lewis, R. S. A model for electrical resonance and frequency tuning in saccular hair cells of the bull-frog, Rana catesbeiana. The Journal of physiology. 400, 275-297 (1988).
- Hudspeth, A. J., Lewis, R. S. Kinetic analysis of voltage-and ion-dependent conductances in saccular hair cells of the bull-frog, Rana catesbeiana. The Journal of physiology. , (1988).
- Fisher, J. A. N., Kowalik, L., Hudspeth, A. J. Imaging electrical resonance in hair cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (4), 1651-1656 (2011).
- Patel, S. H., Salvi, J. D., Ó Maoiléidigh, D., Hudspeth, A. J. Frequency-selective exocytosis by ribbon synapses of hair cells in the bullfrog's amphibian papilla. The Journal of neuroscience : the official journal of the Society for Neuroscience. 32 (39), 13433-13438 (2012).
- Gale, J. E., Meyers, J. R., Periasamy, A., Corwin, J. T. Survival of bundleless hair cells and subsequent bundle replacement in the bullfrog's saccule. Journal of neurobiology. 50 (2), 81-92 (2002).
- Hudspeth, A. J. Mechanoelectrical transduction by hair cells of the bullfrog's sacculus. Progress in brain research. 80, 129-135 (1989).
- Hudspeth, A. J. Integrating the active process of hair cells with cochlear function. Nature Reviews Neuroscience. 15 (9), 600-614 (2014).
- Corey, D. P., Hudspeth, A. J. Response latency of vertebrate hair cells. Biophysical journal. 26 (3), 499-506 (1979).
- Cheung, E. L. M., Corey, D. P. Ca2+Changes the Force Sensitivity of the Hair-Cell Transduction Channel. Biophysical journal. 90 (1), 124-139 (2006).
- Choe, Y., Magnasco, M. O., Hudspeth, A. J. A model for amplification of hair-bundle motion by cyclical binding of Ca2+ to mechanoelectrical-transduction channels. Proceedings of the National Academy of Sciences of the United States of America. 95 (26), 15321-15326 (1998).
- Assad, J. A., Corey, D. P. An active motor model for adaptation by vertebrate hair cells. Journal of Neuroscience. 12 (9), 3291-3309 (1992).
- Crawford, A. C., Evans, M. G., Fettiplace, R. Activation and adaptation of transducer currents in turtle hair cells. The Journal of physiology. , 405-434 (1989).
- Howard, J., Hudspeth, A. J. Mechanical relaxation of the hair bundle mediates adaptation in mechanoelectrical transduction by the bullfrog's saccular hair cell. Proceedings of the National Academy of Sciences of the United States of America. 84 (9), 3064-3068 (1987).
- Purves, R. D. The release of drugs from iontophoretic pipettes. Journal of Theoretical Biology. 66 (4), 789-798 (1977).
- Tinevez, J. Y., Jülicher, F., Martin, P. Unifying the various incarnations of active hair-bundle motility by the vertebrate hair cell. Biophysical journal. 93 (11), 4053-4067 (2007).
- Ó Maoiléidigh, D., Nicola, E. M., Hudspeth, A. J. The diverse effects of mechanical loading on active hair bundles. Proceedings of the National Academy of Sciences of the United States of America. 109 (6), 1943-1948 (2012).
- Kennedy, H. J., Crawford, A. C., Fettiplace, R. Force generation by mammalian hair bundles supports a role in cochlear amplification. Nature. 433 (7028), 880-883 (2005).
- van Netten, S. M., Khanna, S. M. Stiffness changes of the cupula associated with the mechanics of hair cells in the fish lateral line. Proceedings of the National Academy of Sciences of the United States of America. 91 (4), 1549-1553 (1994).
- Bormuth, V., Barral, J., Joanny, J. F., Jülicher, F., Martin, P. Transduction channels' gating can control friction on vibrating hair-cell bundles in the ear. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7185-7190 (2014).
- Crawford, A. C., Evans, M. G., Fettiplace, R. The actions of calcium on the mechano-electrical transducer current of turtle hair cells. The Journal of physiology. , 369-398 (1991).
- Kozlov, A. S., Risler, T., Hudspeth, A. J. Coherent motion of stereocilia assures the concerted gating of hair-cell transduction channels. Nature Neuroscience. 10 (1), 87-92 (2007).
- Lumpkin, E. A., Hudspeth, A. J. Regulation of free Ca2+ concentration in hair-cell stereocilia. Journal of Neuroscience. 18 (16), 6300-6318 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados