Method Article
ウシガエルの球形嚢(からの有毛細胞の生理的な準備
要約
ウシガエルの( ウシガエル )球形嚢毛細胞生理学の直接検査を可能にします。ここで解剖し、生物物理学的研究のためのウシガエルの球形嚢の調製が記載されています。私たちは、その自発的運動の束の力 - 変位関係の計算と測定を含むこれらの有毛細胞からの代表的な実験を示します。
要約
聴覚とバランスの研究では、モデル系の生物物理学的研究から引き出された洞察に載ります。そのようなモデルでは、ウシガエルの球形嚢は、聴覚と前庭研究の主力となっています。この器官の研究が積極的に環境からの信号を検出することができますどのように感覚細胞髪を明らかにしました。そのため、これらの研究のため、我々は今より良好な機械的ゲーティングと有毛細胞の形質導入チャネル、機械的な適応におけるカルシウムの役割の局在、および有毛細胞電流のアイデンティティを理解しています。この非常にアクセス可能な臓器は、有毛細胞の働きへの洞察を提供し続けています。ここでは、その毛細胞上の生物物理学的研究のためのウシガエルの球形嚢の調製を記載します。我々は完全な解剖の手順が含まれており、特定のコンテキストで球形嚢の調製のための特定のプロトコルを提供します。我々はさらに、の計算を含む本製剤を使用して代表的な結果を含みますバンドルの自発的な振動の毛束の瞬発力 - 変位関係と測定。
概要
哺乳類のacousticolateralis器官は複雑な構造を有し、アクセスが困難であることができる解剖学的ニッチ内にあります。例えば、哺乳動物の蝸牛は螺旋状迷路を含み、厚い側頭骨の中に埋め込まれています。蝸牛の単離は、しばしば内にある感覚細胞の機械的損傷を引き起こし、したがって、困難なタスク1であることが判明しています。神経科学者は、より容易に耳の聖域から抽出されたシステムをモデル化するためになっています。
これらのモデル系の一つ、アメリカウシガエル( ウシガエル )の球形嚢は、何十年も聴覚と前庭系の機能に一般化洞察をもたらしました。球形嚢は、低周波の聴力や地震感覚の両方における感覚の役割を持つ混合機能器官です。球形嚢の感覚細胞は、その有毛細胞、機械的エネルギーに変換する特殊なトランスデューサです私たちの聴覚と前庭器官内の電気信号に変換します。各有毛細胞の頂端面から突出することは不動と呼ばれる拡大微絨毛の傾斜房を備える機械受容毛束です。隣接不動毛の先端は、機械的刺激2,3に応答して機械的にゲートイオンチャネル糸状先端リンクタンパク質によって相互接続されています。聴覚と前庭器官が刺激の異なる種類に反応するが、これらは一般的な検出メカニズムを共有しています。この共通点は、ウシガエルの球形嚢の研究によって毛細胞のメカノに得られた多くの知見の下にあります。例えば、有毛細胞の能動的プロセスは、この臓器4、5、6、7で広く研究されており、毛束は、機械製造するためにエネルギーを消費するプロセスを採用します作業。だけでなく、有毛細胞が活性ワーク6を生成することが示されているが、個別のアクティブなプロセスのメカニズムや有毛細胞の同調特性は、臓器acousticolateralisウシガエルの研究によって発表されました。これらは両生類乳頭内有毛細胞のリボンシナプス12で球形嚢と周波数選択性で11、10、アクティブ毛束の運動性8と有毛細胞の電気的共振9が含まれます。
ウシガエルの球形嚢は多くの理由のために、感覚神経科学者に訴えます。哺乳動物の蝸牛とは異なり、この器官は、容易にアクセス可能な耳用カプセル内にあります。第二に、この器官内の有毛細胞は、適切な条件13、14下に数時間、健康を維持することができます。これはexperimentatを許可します彼らの哺乳類の対応に比較的長い時間スケールにわたって、これらの細胞上でのイオン。第三に、臓器は、容易な操作を可能にして、少し湾曲を負いません。第四に、各器官は、高スループット、所定の実験に有毛細胞の適切なセットを配置する高い確率の両方を提供する、数千以上の有毛細胞15を含みます。最後に、ウシガエルの球形嚢を簡単に、その有毛細胞のこの器官と大きなサイズの薄さに可視化されます。
これらのプロパティは、ウシガエルの球形嚢内の感覚細胞の研究のための優れた汎用性を提供します。当面の問題に応じて、いくつかの実験的な製剤の一つが球形嚢から得ることができます。これらのうち最も簡単なものは、1室の準備です。ここでは球形嚢は、人工外リンパ、ナトリウムが豊富な、高カルシウム生理食塩水で満たされたチャンバ内に固定化されています。この準備は、有毛細胞電流および基本的な毛束の力学の研究を可能にします。第二の構成、二室の調製は、自発的な毛束の動きを研究するために使用することができます。ここでは有毛細胞の頂端側はカリウムが豊富でカルシウムに乏しい生理食塩水にさらされている側底側は人工外リンパを浴びれるのに対し、人工内リンパと呼ばれます。これら二つの区画には、生理食塩水のin vivoでの配置を模倣し、毛束が自然に振動することを可能にする環境を提供します。
本稿ではその感覚有毛細胞の生物物理学的研究のためのウシガエルの球形嚢の調製を記載します。私たちは、最初のカエルの内耳からこの器官の分離の詳細な描写を提供します。私たちは、その後、1次元と2室の実験準備の両方を説明し、各構成の代表的な結果が含まれています。
プロトコル
倫理声明:すべての手順は、ロックフェラー大学の施設内動物管理使用委員会(IACUC)によって承認されました。
1.予備実験Prespanparation
- ソリューション
- オイゲノール溶液(2.5グラム・L -1・キログラム-1カエル)を準備します。生理食塩水( 表1)を準備します。
注:1室製造のために、人工外リンパを準備します。 2室の準備のために、人工外リンパと人工内リンパの両方を準備します。
- オイゲノール溶液(2.5グラム・L -1・キログラム-1カエル)を準備します。生理食塩水( 表1)を準備します。
2.実験ツール
- ガラス刺激繊維の調製
- 高耐熱・高速度で1ラインのプルにおける電極プラーとホウケイ酸ガラスキャピラリーの範囲を絞ります。ソレノイド駆動型プラーに引き込ま毛細管をロードします。
- ガラスビーズでフィラメントに向かって、キャピラリの先端を持参キャピラリーコンタクトガラスビーズまでに溶け。
- ガラスビーズにキャピラリの先端を溶融するフィラメントをオンにします。キャピラリーとビードの間にガラスの形の薄いブリッジたら、フィラメントをオフにして、同時期にソレノイドプラーを活性化させます。
注:これは、その長軸に対して直角にガラスキャピラリーを引き出し、固体繊維を作成します。 - 1ミクロン、長さが100超えていないこと - - 300ミクロンの繊維の直径は、これ以上0.5以下であることを確認してください。繊維の長さがこの次元を超えた場合、アイリスはさみでそれをトリミングします。すでに解剖ツールを損傷しないように鈍いはさみを使用してください。
- 光学コントラストを向上させるために、コートに繊維をスパッタ。金 - パラジウム源とスパッタコーターを使用してください。垂直ソースに向かってテーパー状の端部を備えたスパッターコーターに各繊維をロードします。金 - パラジウム源から2センチメートル - 1の距離に繊維の先端を持参してください。
- それを閉めてシールを形成し、それをオンにするコータのチャンバーをスパッタ。繰り返しアルゴンで周囲空気を洗い流します。空気をフラッシュした後、10 Paの(70トル)に、チャンバ内の圧力を低下させます。
- 120秒かけて10秒遅れで10秒パルスでコートをスパッタ。
注:スパッタコーティングが成功した場合、繊維の先端は、このプロトコルの期間にわたって暗くなります。
- 鋭い微小電極の作製
- 1行の高耐熱プルを使用して、内部のフィラメントとガラスキャピラリーを引き出します。 3 M KClで満たされたときに300MΩ - 電極は100の抵抗を持っている必要があります。 3 M KClで各電極を埋めます。
- アンプのヘッドステージ16に搭載されたときに有毛細胞頂端表面に垂直それをレンダリングするマイクロフォージベンド各電極の先端。
- イオン導入ピペットの準備
- 内部でガラスキャピラリーを引いて50MΩの先端にフィラメント。濃縮された溶質( 例えば、500mMの硫酸ゲンタマイシン)で記入してください。
- アルミマウント正方形の調製
- アルミ箔から1cm X 1cm角に切ります。ピッシングロッドまたは他の鋭利な物体の先端と中央に箔を穿孔。それは、円形、直径約1mmになるように穿孔を形成。
- 真空グリース充填された注射器の調製。
- 5 mLシリンジからプランジャーを取り外します。真空グリースと背中から注射器を埋めます。プランジャーを交換してください。
- ポリテトラフルオロエチレングルーアプリケーターの準備
- 木製のアプリケータースティックの端部に2ミリメートル、長軸方向のカットを行います。エンドオンを見たとき、スリットは、アプリケータの中心にあるべきです。
- 鋭いハサミやカミソリの刃で、厚さ1mmのシートから、ポリテトラフルオロエチレンの2ミリメートル×4ミリメートルの長方形をカット。
- ポリテトラフルオロエチレンの長方形の2ミリメートル、長辺の薄い1にカミソリの刃を使用してください。長方形の途中で開始し、長方形の先端にベベルを形成するために外側にスライスして、長方形の厚さを減少させます。
- 面取りエッジが離れスティックから対向するように木製のアプリケータースリットにポリテトラフルオロエチレンの四角形を挿入します。所定の位置に固定するためにポリテトラフルオロエチレンの長方形のベースに5分エポキシを適用します。糊アプリケータは、室温で1時間硬化させます。
- 二室マウントの下半分の調製
- マシンまたは3Dは、2室の下半分は( 補足ファイル2)をマウントし、印刷します。チャンバの下面に直径20mm凹ん円を特定します。
- 凹型円のほとんど横3mmとエポキシの薄い層を適用します。エポキシ上の1つの18ミリメートルの円形カバーガラスを適用します。エポキシは1のために硬化させます時間。
インナーイヤー臓器の3抽出
- 10分間オイゲノールの麻酔薬溶液を含む小さなバケツの中に置くことによってウシガエルを麻酔。カエルのhumero肩甲骨の関節がちょうど液体 - 空気界面の上にあるように、溶液の量を調整します。
- ダブルピッシングにより麻酔ウシガエルを安楽死させます。
- 顎下の1の鼻の上に指や他で麻酔カエルをつかみ、前方にカエルの頭を回転させます。
- 急速にカエルの後頭部プロセス間の正中線で発見された大後頭孔を通って頭蓋冠にピッシングロッドを急落。
- ゆっくり撤回し、その先端が大後頭孔から離れるまで、棒を回転させます。脊髄を破壊するために、椎孔を通って尾側ロッドを強制します。
- カエルが適切に二重にその下肢が拡張されていることを観察することによってpithedされていることを確認してください。
- 改善された安定性のために鋤骨歯を把握鼻と最初の指の上に親指でカエルをつかみます。両側性顎関節を切断し、その後rostrocaudal軸に直交するように切断してカエルを刎ねます。頭蓋骨内の内耳器官が無傷のままであることを保証するために、カットが両方tympanaに尾側であることを確認してください。
- stereodissection顕微鏡を使用して、組織( 図1A)の最も後部程度に鋤骨歯の口蓋組織を通って正中線のカットを実行します。
- 後部軟骨を明らかにするために口蓋組織下にある任意の筋肉断つとメスの水平カットとは明らか。筋肉を除去した後、耳のカプセルの境界を形成する時間的な軟骨のロリポップ形状を観察します。
- 耳のカプセルの軟骨に接触し、その時点で柱軸を断ちます。
- 繰り返しshalloを行うことで、この軟骨の薄層を剃りますそれを通じてワット水平カット。内耳器官の損傷を防ぐために深い切り傷を避けます。これは一時的な軟骨( 図1B)のロリポップ構造内で見つかった、耳のカプセルを開きます。耳のカプセル内にカエルの内耳器官( 図1C)があります。
- 内耳器官を損傷しないように注意しながら、耳のカプセルの後部と横方向のエッジをトリム。解剖時には、頻繁に彼らが水没し、水和ままであることを保証するために内耳器官の上に生理食塩水を流します。
- 正中線に軟骨の内側接続部で側頭骨内の2つの円形の開口部の位置を確認します。頭骨を破裂させるために、最も内側の開口部を通って下方向にカットします。
- その後外側エッジで耳のカプセルを介して第2の下方にカットしてください。内耳器官へのアクセスを提供するために、これと前のカットの間の軟骨の一部を削除します。
- ステップ3.8からカット間の軟骨を失うてこND 3.9と耳のカプセルからそれを切り取ります。このアクションは、その後、さらなる操作のためのハンドルとして使用することができます最寄りの三半規管を切断します。
- 球形嚢に触れないように注意しながら、脳神経第 VIIIを断ちます。
- 最寄りの半規管の膨大部を保持します。静かに残りの2半規管を公開するために内耳を回転させます。各運河を露光する際に、それを断ちます。
- 神経や半規管の膨大部を持ち、頭から内耳を抽出し、チルド酸素人工外リンパで満たされたシャーレに入れてください。内耳の除去は、半規管が一度通過した側頭骨( 図1D)内の通路の可視化を可能にします。
注:第二耳を抽出するために、これらの手順を繰り返します。
4.ワン室の準備
- 球形嚢の単離
- その大きな聖霊降臨祭を識別することによって球形嚢の位置を確認しますEの聴砂の質量とそれの上にある嚢状神経( 図1E)。物理的に嚢状有毛細胞の完全性を維持するために、次の手順の間に球形嚢を傷つけるしないように注意してください。
- 内耳より機動レンダリングする半規管トリム。
- 球形嚢の神経側面を覆う外リンパ水槽を削除します。水槽の周囲に緩やかなカットを行います。次の球形嚢の神経側に貯水槽の膜を埋める組織の小さな柱を切断。
- つぼとそれに関連する神経を削除します。
- 嚢状神経を持って、静かに球形嚢を持ち上げ、otoconial嚢の薄い膜を通ってカット。嚢のうち聴砂流出したように、その周囲の周りに切断することにより、球形嚢を解放。
注:必要であれば球形嚢を単離した後、残りの内耳器官を保存することができます。球形嚢の除去のような他の構造の同定を容易に両生類と脳底乳頭。 - 慎重に球形嚢に残っ聴砂を払拭するためにハサミやピンセットを使用してください。このプロセスの間に球形嚢に触れないように注意してください。
- 球形嚢「エッジから任意の残りのotoconial嚢の膜をトリミングします。この膜は、プラスチックやガラスの表面に付着する傾向があり、その除去は、組織を処理する際の課題を最小限に抑えることができます。
- 静かに残っている聴砂( 図1F)を除去するために、パスツールピペットで球形嚢の上に生理食塩水を流します。
注:最初の鏡像である第二の球形嚢、この手順を繰り返します。
- 消化と取り付け
- 壊れたその先端にパスツールピペットのバックエンドを使用して、人工外リンパ中の67 mgの∙L -1プロテアーゼXXIVの3 mLを含むペトリ皿に孤立した球形嚢を転送します。
注:このプロテアーゼ処理は、耳石に各kinociliary電球をテザリングリンクを消化します膜、感覚毛束に損傷を与えることなく、膜の除去を可能にします。 - 22℃(または21℃で35分)で30分間、組織をインキュベートします。オープンフェイスの実験室にそれぞれ消化球形嚢を移し、磁気ピンで組織を固定します。
- 嚢状黄斑は、直接耳石膜の下にあると有毛細胞が含まれている球形嚢の一部です。それを確認し、慎重に嚢状黄斑に触れないように注意しながら、細かいまつげを使用して、その上に重なる耳石膜を除去します。
- 壊れたその先端にパスツールピペットのバックエンドを使用して、人工外リンパ中の67 mgの∙L -1プロテアーゼXXIVの3 mLを含むペトリ皿に孤立した球形嚢を転送します。
5.二室の準備
- 球形嚢の単離
- 4.1節のように内耳器官から球形嚢を分離します。
- マウントと消化
- 真空の2つのスポットを使用して、人工外リンパと取付ブロック( 補足ファイル3)を記入し、一方の開口部に穿孔されたアルミ箔を配置所定の位置に保持し、弱シールを形成するためにグリース。
- 転送1箔と球形嚢と下を向い黄斑と上向きに神経切り株の穴の上にそれを中央に配置します。
- ねじれた組織片と球形嚢の周囲の生理食塩水を削除します。球形嚢の周囲のアルミ正方形の面を乾燥させる生理食塩水を吸い上げます。
- 球形嚢のエッジとアルミニウム広場の間の境界に沿って気密シールを形成するために、シアノアクリレート接着剤を適用するために、ポリテトラフルオロエチレンのアプリケーターを使用してください。球形嚢の全周が接着剤で覆われていることを確認してください。
注:あまりにもゆっくりと進むとシアノアクリレート接着剤は、球形嚢の神経側を超えるクリープし、最終的にそれをカバーすることができます。急速にこのタスクを完了することが不可欠です。 - 接着剤を硬化させるために取り付けられた組織の上に生理食塩水のドロップを置きます。接着剤の薄膜は、生理食塩水の液滴の上に形成してもよいです。ピンセットでそれを削除。
- 慎重トンを削除します彼は、取付ブロックから箔。球形嚢の黄斑側が上を向くように上に取り付けられた組織を裏返して、人工外リンパで満たされたペトリ皿の上に浮かんでいます。
- 黄斑の上にプロテアーゼXXIV溶液の液滴を加え、22℃(または21℃で35分)で30分間インキュベートします。中央チャンバの周囲に外リンパと場所真空グリースを持つ2つのチャンバ装置( 補足ファイル2)の下側の運河を入力します。
- チャンバーの表面に面するその神経と下室に箔に取り付けられた球形嚢を置きます。箔の周囲にグリースを追加します。
- 真空グリースとの完全なシールを形成するように注意しながら、箔上に準備の上部チャンバー( 補足ファイル1)を配置します。バブリング人工内リンパと上部チャンバーを記入し、優しくまつげで耳石膜を除去します。
結果
ウシガエルの球形嚢の感覚上皮は、有毛細胞の生理機能を調べるために様々な構成で使用することができます。組織は比較的平坦であるので、1次元と2室の製剤の両方に取り付けることができます。 1室の構成は、有毛細胞の電気生理学的およびマイクロメカニカル記録のための簡単なセットアップを提供します。 2室の準備ではなく、有毛細胞のそれぞれ頂端および基底側に内リンパと外リンパのコンパートメントの両方をシミュレートします。これらの区画は、一緒に毛細胞によるメカノの研究のための生理学的に関連性の高い環境を提供します。
有毛細胞の感受性および形質導入特性は機械的刺激に対する電気的応答の根底にあります。これらの機能を調べるために、我々は同時に、個々の有毛細胞からそのバンドルの位置を記録し、細胞の受容器電位( 図2)。我々は、第1の力のパルスを印加するための毛束のkinociliaryバルブフレキシブルガラス繊維が取り付けられています。我々は、次に、デュアルフォトダイオードシステム2( 図2A)を用いて毛束の変位を測定しました。我々は同時に、鋭い微小電極を細胞に突き刺すことにより、有毛細胞の潜在能力を獲得しました。我々は、毛束の対応する変位量( 図2B)に対するそれぞれの機械的刺激によって誘発されるピーク電圧応答をプロットすることにより、変位反応曲線を得ました。有毛細胞の電気的応答は両方の正負変位極値ために飽和します。負の変位ステップの膜電位の低減は、メカノ電流内側休止の存在を示します。この静止電流は、両方の高速及び低速適応17上の Ca 2+の作用によって調節されます 18、19、20、21。
有毛細胞の挙動は、その電気的特性に応じて、だけでなく、その感覚毛束のマイクロメカニクスの際だけでなく、依存しています。二チャンバ構成は、毛束の力学の研究のための理想的な条件を提供し、 生体内での内リンパおよび外リンパの分離を模倣します。これらの条件下で除去耳石膜と、毛束が自発的に6を発振することができます。ここでは、個々のバンドルのマイクロメカニクスを評価するために二室の準備を採用しました。我々は、デュアルフォトダイオード変位モニタ( 図3)にその影をキャストすることにより毛束の自発的な振動を記録しました。メカノ上のアミノグリコシド系抗生物質ゲンタマイシンの役割を評価するために、我々は、イオン導入RELE毛束に直接ゲンタマイシンをASED( 図3)。放出されたゲンタマイシンの濃度は、マイクロピペットを流れる電流に比例して上昇します。ゲンタマイシンは、毛束の振動を抑制し、その背の高い側にバンドルのオフセット静的を誘導します。これらの効果は、それらの透過孔をブロックしながらメカノチャネルの開いた状態を維持し、オープンチャネルブロッカーとしてゲンタマイシンの役割を反映しています。帯電した化学物質の許可のイオントフォレシスは、ローカライズおよび定量化可能な種々の濃度の化学物質の放出を流体の流れによって誘発される機械的破壊の不在下で、したがって、そのような毛束22のような機械受容細胞小器官の研究に最適です。
毛束の自発的な運動は、適応および非線形バンドル剛性7の間の相互作用から生じます外部参照"> 8、23、24。この自発的な動きは、粘性抵抗を克服するために機械的な仕事に信号エネルギーを変換する毛束のアクティブなプロセスの署名である。毛束が前庭2非線形瞬間的な剛性を示すことが示されており、聴覚25、および横ラインシステム26。
私たちは、直接ウシガエルの球形嚢( 図4)から個々の毛束の瞬間剛性を測定しました。これを達成するために、我々は、毛束のkinociliary電球( 図4A)に柔軟なガラス繊維の先端に結合されています。我々は、繊維のベースを移動させることにより、毛束に力を配信しました。刺激繊維によって毛束に加わる力は、繊維の浅の変位との間の差に相当します電子チップ、繊維の剛性2、27を乗じました。力の範囲にわたってパルスを提供することは、バンドルおよびバンドルのその後の変位に加えられた力との関係を明らかにする。この力-変位関係の傾きは、毛束の瞬間剛性( 図4A)に対応しています。
この方法は、私たちはそのたわみ( 図4B)の関数として、個々のバンドルの瞬間剛性を測定することができました。瞬発力 - 変位曲線は、その静止位置の周囲に約20nmの範囲にわたる束の非線形剛性を明らかにし、非線形の関係が表示されます。この範囲外では、毛束は、その剛性が大の大きさのたわみのための線形で、Hookean材料のように振る舞います。
これらの結果は、demonst毛細胞生理学の研究でウシガエルの球形嚢の汎用性を評価します。これらおよび他の調製物を使用して、人は、脳に向かってバンドルからの情報の送信に複数の段階でメカノを探索することができます。

図1: ウシガエルの内耳の解剖。 (A)の腹側からウシガエルの上口蓋を表示するには、耳管(円)の同定を可能にします。上側口蓋の右側を覆う皮膚の側面反射は、内耳(破線のボックス)の位置を明らかにする。カエルの頭骨の腹側に軟骨の(B)の除去は、耳のカプセル(破線)を開きます。 (C)表示は、耳のカプセルの高倍率の画像で球形嚢、つぼ、CN VIII、及びSACCですウラル神経が容易に識別することができます。 (D)内耳器官を除去した後の耳のカプセルのビューは、三半規管の位置を明らかにする。孤立した内耳、球形嚢、つぼ、およびVIII 番目の脳神経(CN VIII)を除去した後(E)は、容易に識別することができます。 (F)は 、単離された球形嚢は嚢状神経とその感覚上皮の上に横たわっている耳石膜の短い切り株を持っています。ラベルは、(i)球形嚢、(ii)のつぼ、(iii)のCN VIII、(iv)の嚢状神経、および(v)の耳石膜に対応しています。 AxisはPにラベルを付け、Aは後方と前方方向にそれぞれ対応します。スケールバー、1 cmの(A、B)、1mMの(C、D、E)、及び400ミクロン(F)を表します。
この図の拡大版をご覧になるにはこちらをクリックしてください。
"ターゲット=" _空白 ">この図のベクトルのバージョンをダウンロードするにはこちらをクリックしてください。
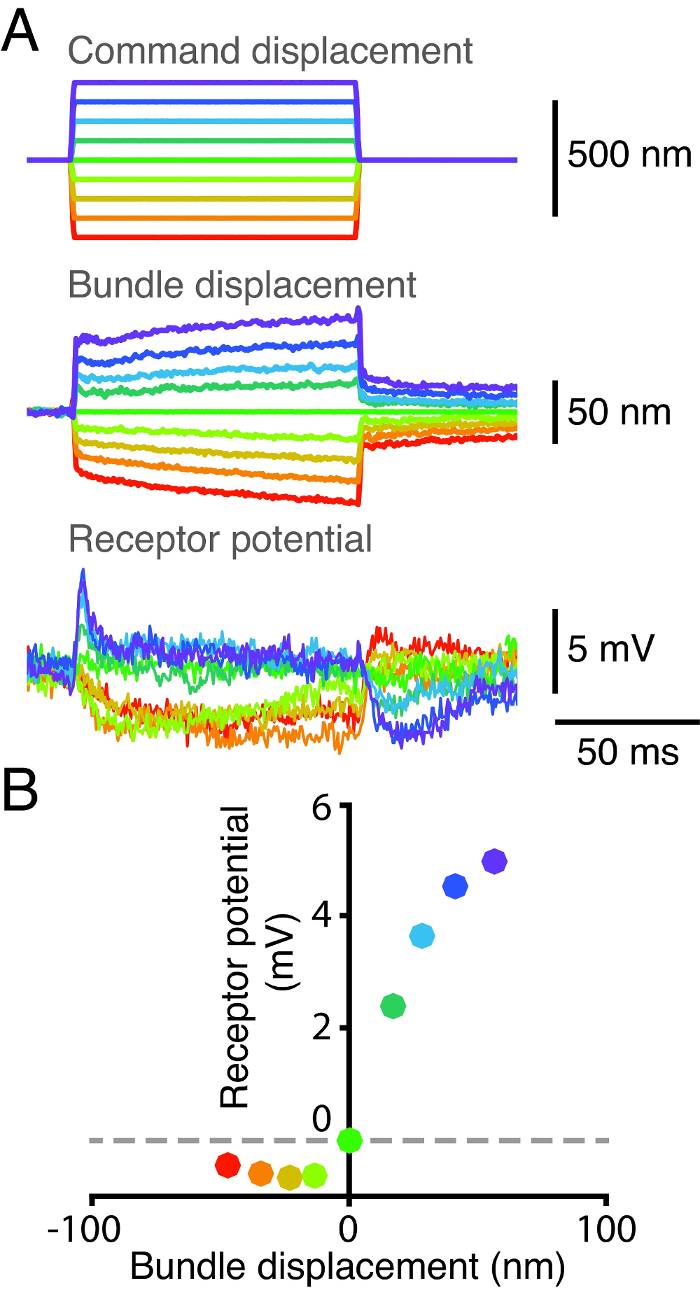
図2: 独身髪の細胞のための変位応答曲線。 (A)ガラス刺激繊維の先端がkinociliary毛束の電球と繊維のベースに結合されたが、その後9離散的なステップ全体で置換しました。バンドルの位置は、デュアルフォトダイオードシステムで追跡し、その受容体電位は同時に、その出力がブリッジモードでアンプを通過した微小電極を用いて測定しました。電極の先端抵抗は95MΩだったとバンドルの静止膜電位はあった-47 mVで。 (B)その変位の関数として、バンドルの受容器電位のプロットは、バンドルの応答とその間の非線形の関係を明らかにポジション。各点は平均電位に対応しており、機械的刺激の発症後2.5ミリ秒を始め、2.5ミリ秒の時間ウィンドウにわたって変位を意味します。各色は、同じ変位パルスに対応する時系列の集合を表します。
この図の拡大版をご覧になるにはこちらをクリックしてください。
この図のベクトルのバージョンをダウンロードするにはこちらをクリックしてください。
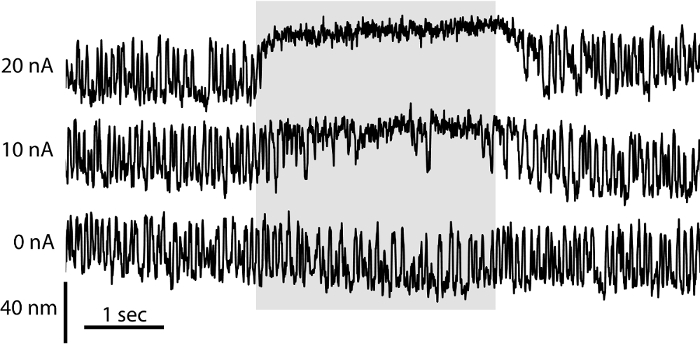
図3:自発的な髪のバンドル振動に対するゲンタマイシンの影響。二チャンバー調製における毛束の自発運動は、デュアルフォトダイオードシステムを用いて記録しました。ゲンタマイシンのイオントフォレーシスリリース(0 NA)の非存在下では、髪バンドルは、対称振動が表示されます。 500 mMの硫酸ゲンタマイシンが充填されたイオン導入ピペットを流れる電流の大きさ(10 NAの20 NA)を増大するように、毛束エクスカーションの周波数は、用量依存的に低下し、バンドルが長く、その背の高い縁部に向かってオフセットされています期間。
この図の拡大版をご覧になるにはこちらをクリックしてください。
この図のベクトルのバージョンをダウンロードするにはこちらをクリックしてください。
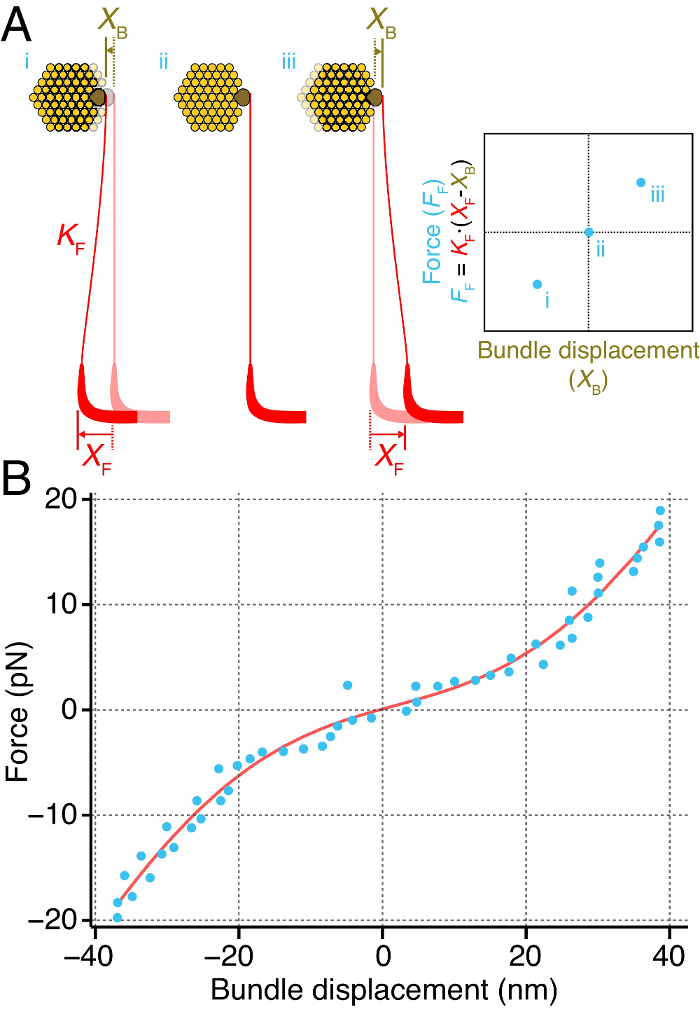
図4は、 髪の束の瞬間 剛性を 計算 します。剛性K Fが結合している、Tの(A)刺激繊維(赤)個々の毛束のkinociliary電球(茶色)(黄色)O。ファイバベースの既知の距離X Fを変位するバンドルは、距離X Bを移動させます。繊維の変位と束との間の差は、刺激繊維、F Fによってバンドルに加えられた力に比例しています。力の範囲にわたってこれを繰り返すことで、瞬発力 - 変位関係(右)、毛束の瞬間剛性に相当するのスロープが得られます。 (B)は、個々のバンドルは、パルス開始を測定した後の最初の50ミリ秒以内(青色の点)を増加させる大きさと、その変位のパルスを強制的に行きました。ここで毛束は、その静止位置の周囲約20nmの範囲にわたって非線形瞬間剛性が表示されます。 * Z - 60 * のz *(1 /(1 + EXP( -赤い曲線は、関係F = K * Xへのフィットに対応します (X - X 0)/(K のb * T)))+ F 0、Fは力が束に適用した、Xは、バンドルの変位であり、Kは、= 790±51μNがmに∙-1バンドルの定数であります剛性すべてのチャネルが閉じたり開いいずれかであり、Z = 0.43±0.04 PNは、単一のゲートばねの力であり、Xは 0 = 2±1.9 nmのは、そのチャンネルの50%が開いている時に、バンドルの位置であり、K Bはボルツマンです定数、Tは温度であり、F 0 = 11.7±1.3 PNオフセット力です。フィットは、0.98の決意の係数を有しています。刺激繊維は107μN∙mの剛性を持っていた-1。
この図の拡大版をご覧になるにはこちらをクリックしてください。
エス/ ftp_upload / 55380 / Figure4_v5.eps "ターゲット=" _空白 ">この図のベクトルのバージョンをダウンロードするにはこちらをクリックしてください。
| 溶質 | 式重量(g /モル) | 1 Lに追加 | |
| 人工外リンパ | 人工内リンパ | ||
| NaClを | 58.4 | 6.54グラム | 0.117グラム |
| 塩化カリウム | 0.149 | 0.149グラム | 8.62グラム |
| CaCl 2⦁2H 2 O | 147 | 1 MのCaCl 2ストックの2 mLの | 1 MのCaCl 2株式の250μL |
| HEPES | 238.3 | 1.19グラム | 1.19グラム |
| D - (+) - グルコース | 180.2 | 0.541グラム | 0 541グラム |
解剖や実験の準備のために表1のソリューション。人工外リンパと解剖および1または2室の製剤に使用される人工内リンパ液のためのレシピは、この表にある表示されます。 NaOHを約2mL(外リンパ)または2mLのKOH(内リンパ)で7.4 - ソリューションは、pHを7.2になっていることが必要です。浸透力は、約230ミリモルをお読みください・キログラム-1不完全なイオン解離に起因します。
ディスカッション
ウシガエルの球形嚢の中で数千簡単にアクセス可能な感覚有毛細胞をうそ。ここでは、1次元と2室の録音のための抽出と球形嚢の製造を実証します。これらの2つの調製物は、有毛細胞の微小機械および電気生理学的研究とその関連のバンドルの両方を可能にします。組織が酸素化生理食塩水の頻繁な交換で数時間生存することができるので、実験が長時間継続することができます。毛束が抽出後24時間までのために自然に振動しながら、これらの調製物中の有毛細胞は、典型的には、解剖後最大6時間の微小電極記録のために生き続けます。
球形嚢の抽出成功と実装はいくつかの共通の課題を乗り越える時にかかっています。まず、嚢状黄斑の先端面との直接接触は、調製手順を通して避けるべきです。嚢状神経は安全manipuに便利なハンドルを提供します球形嚢のレーション。内耳器官の残りの部分から解放されると、その感覚上皮への機械的な損傷を避けるために、流体中に浸漬されたまま、球形嚢は、大口径のピペットを使用して転送する必要があります。黄斑表面から聴砂の除去は、有毛細胞の機械的な損傷を与えることなく完了する必要があります。聴砂は、黄斑の上に直接横たわるので聴砂を除去しながら、有毛細胞は、解剖ツールと耳石膜との間の偶発的な接触によって損傷することができます。損傷を避けるために、我々は聴砂のゼラチン状の塊が黄斑から遠く離れた場所で開催し、単一の質量として除去することをお勧めします。これは、個別に抽出されるであろう、それぞれが多数のクラスタにotoconial質量の断片化を回避することができます。聴砂の小さな塊が残っている場合、それらはパスツールピペットにより送達穏やか流体圧を用いて除去することができます。最後の課題は、中の球形嚢とアルミニウム取付広場の間に密封シールの形成を含みます二チャンバー製剤。約100μm球形嚢と周囲のアルミ許可組織の完全なシールとの間の重複を可能にするのに十分に小さい穿孔の正方形を採用。接着剤は、密封を形成するために約100μm黄斑の周囲に嚢状の組織に接触すべきです。
遊離Ca 2+の濃度は、有毛細胞の研究における重要な考慮事項です。 Ca 2+がこのように自発的なバンドルモーション8、23を含むメカノ装置の動態と毛束のアクティブなプロセス現象の特性を決定する、高速と低速の両方の適応を調節します。 in vivoでの内リンパカルシウムは、したがって、最も生理学的に関連する速度はこの濃度(Maunsell JHR、R.ジェイコブス、およびAJ Hudspethで評価され、250μMで存在する。UnpublisHED観測16)。しかし、有毛細胞からの微小電極記録は、微小電極の周りの細胞膜の適切なシーリングのため2ミリメートルを超える外部のカルシウム濃度を必要とします。これらの実験のために、高カルシウムの生理食塩水を使用することが必須です。最後に、1は、カルシウム濃度のさまざまな方法を使ってメカノた際に、外部のカルシウムの効果を研究することもできます。これらのケースでは、1μM以下のカルシウム濃度は、典型的には、先端リンク破裂および伝達28の不可逆的損失につながることを覚えておくことが重要です。
ここで説明する2つの実験の製剤は、有毛細胞上の生物物理学的測定値の範囲を可能にします。しかし、追加の測定は、これらの調製物にわずかな改変を行うことができます。折り畳まれた嚢状の準備では、毛束が横方向に可視化されます。この視点からイメージング毛束の動きは、コヒーレント名言を明らかに短いと背の高い不動29の両方のイオン。ここで嚢状黄斑は、最初にその下にある組織から分離し、続いて毛束が外側に面しており、しわに横方向に可視化されるように嚢状神経によって定義された軸に沿って折り畳まれます。第2の変形例、毛細胞解離は、有毛細胞のバンドルとそのソーマの両方の研究を可能にします。有毛細胞は、機械的に画像化し、電気生理学的記録30用ガラススライド上に分離されています。最後に、有毛細胞は、同様の解離プロトコルを以下ではなく、機械的解離工程なし上皮から押し出すことができます。機械的損傷を最小限に抑えながら、徐々に電気生理学的記録のための基底外側のアクセスを提供し、上皮の外に押し出す有毛細胞におけるこの治療の結果。これらの製剤およびそれらの多くの変更は、生物物理学的のためのモデル系としてカエルの球形嚢の汎用性を実証します感覚毛細胞の研究。
開示事項
The authors declare no competing interests.
謝辞
The authors wish to acknowledge Dr. A. J. Hudspeth for funding and expertise in developing the preparations described in this paper. We also wish to thank Brian Fabella for creating and maintaining much of the custom equipment and software used in this protocol.
J. B. A. is supported by grant F30DC014215, J. D. S. is supported by grant F30DC013468, and both J. B. A. and J. D. S. are supported by grant T32GM07739 from the National Institutes of Health.
資料
| Name | Company | Catalog Number | Comments |
| Common to both preparations | |||
| Stereo-dissection microscope | Leica | MZ6 | Other sources can be used |
| Tricaine methanesulfonate | Sigma | E10521 | Other sources can be used |
| Metal pithing rod | Fine Science Tools | 10140-01 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | |
| Glass Pasteur pipette and bulb (x2) | Fisher Scientific | 22-042816 | |
| Fine eyelash mounted on a hypodermic needle | Fisher Scientific | 22-557-172 | |
| Dow-corning vacuum grease | Fisher Scientific | 14-635-5C | |
| Syringe for vacuum grease | Fisher Scientific | 14-829-45 | Other sources can be used |
| 35 mm Petri dish (x2 - 3) | Fisher Scientific | 08-772A | Other sources can be used |
| Micropipette puller | Sutter | P-97 or P-2000 | |
| 120 V Solenoid puller | Home-made, see parts list | ||
| Sputter coater | Anatech USA | Hummer 6.2 | |
| Current source for iontophoresis | Axon Instruments | AxoClamp 2B | Other sources can be used |
| Piezoelectric actuator | Piezosystem Jena | P-150-00 | |
| Amplifier for piezoelectric actuator | Piezosystem Jena | ENV800 | |
| Borosilicate glass capillary | World Precision Instruments | 1B120F-3 | |
| Name | Company | Catalog Number | Comments |
| For one-chamber preparation | |||
| Microelectrode amplifier | Axon Instruments | AxoClamp 2B | Can be used for iontophoresis and microelectrode recordings simultaneously |
| Magnetic pins (x2) | Home-made, see parts list | ||
| Open-top chamber with magnetic sheet | Home-made, see parts list | ||
| Name | Company | Catalog Number | Comments |
| For two-chamber preparation | |||
| Upper chamber | Supplementary file 1 | ||
| Troughed lower chamber | Supplementary file 2 | ||
| Aluminum foil | Fisher Scientific | 01-213-100 | Other sources can be used |
| Mounting block | Supplementary file 3 | ||
| Wooden applicator sticks | Fisher Scientific | 23-400-112 | Other sources can be used |
| Teflon sheet | McMaster-Carr | 8545K12 | For teflon applicator |
| Cyanoacrylate glue | 3M | 1469SB | |
| Lab tissues (Kimwipes) | Fisher Scientific | 06-666A | Other sources can be used |
| Gentamicin sulfate | Sigma-Aldrich | G1914 | Other sources can be used |
| Quick-setting epoxy | McMaster-Carr | 7605A18 | |
| 18 mm glass coverslips | Fisher Scientific | 12-546 | Other sources can be used |
| Name | Company | Catalog Number | Comments |
| Saline components | |||
| NaCl | Fisher Scientific | S271-3 | Other sources can be used |
| KCl | Sigma-Aldrich | P4504-500G | Other sources can be used |
| CaCl2 • 2H2O | Fisher Scientific | 10035-04-8 | Other sources can be used |
| HEPES | Sigma-Aldrich | H3375-100G | Other sources can be used |
| D-(+)-glucose | Sigma-Aldrich | G7021 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Parts lists for home-made equipment | |||
| Solenoid puller | |||
| Solenoid | Guardian Electric | A420-065426-00 | Other sources can be used |
| Foot-pedal switch | Linemaster | T-51-SC36 | Other sources can be used |
| Pipette holder | World Precision Instruments | MEH900R | Other sources can be used |
| Coarse manipulator | Narishige Group | MM-3 | Other sources can be used |
| Platinum wire | Alfa Aesar | 25093 | Other sources can be used |
| Power supply | Leica | Z050-261 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Magnetic pins | |||
| Epoxy | McMaster-Carr | 7556A33 | Other sources can be used |
| 1 mm thickness aluminum | McMaster-Carr | 89015K45 | Other sources can be used |
| Insect pins | Fine Science Tools | 26000-40 | Other sources can be used |
| Name | Company | Catalog Number | Comments/Description |
| Open-top magnetic chamber | |||
| Flexible magnetic strip | McMaster-Carr | 5759K75 | Other sources can be used |
| 1 mm thickness aluminum | McMaster-Carr | 89015K45 | Other sources can be used |
参考文献
- Brandon, C. S., Voelkel-Johnson, C., May, L. A., Cunningham, L. L. Dissection of Adult Mouse Utricle and Adenovirus-mediated Supporting-cell Infection. JoVE (Journal of Visualized Experiments). (61), e3734-e3734 (2012).
- Howard, J., Hudspeth, A. J. Compliance of the hair bundle associated with gating of mechanoelectrical transduction channels in the bullfrog's saccular hair cell. Neuron. 1 (3), 189-199 (1988).
- Jaramillo, F., Hudspeth, A. J. Localization of the hair cell's transduction channels at the hair bundle's top by iontophoretic application of a channel blocker. Neuron. 7 (3), 409-420 (1991).
- Assad, J. A., Hacohen, N., Corey, D. P. Voltage dependence of adaptation and active bundle movement in bullfrog saccular hair cells. Proceedings of the National Academy of Sciences of the United States of America. 86 (8), 2918-2922 (1989).
- Benser, M. E., Issa, N. P., Hudspeth, A. J. Hair-bundle stiffness dominates the elastic reactance to otolithic-membrane shear. Hearing research. 68 (2), 243-252 (1993).
- Martin, P., Hudspeth, A. J. Active hair-bundle movements can amplify a hair cell's response to oscillatory mechanical stimuli. Proceedings of the National Academy of Sciences of the United States of America. 96 (25), 14306-14311 (1999).
- Salvi, J. D., Ó Maoiléidigh, D., Fabella, B. A., Tobin, M., Hudspeth, A. J. Control of a hair bundle's mechanosensory function by its mechanical load. Proceedings of the National Academy of Sciences. 112 (9), E1000-E1009 (2015).
- Martin, P., Bozovic, D., Choe, Y., Hudspeth, A. J. Spontaneous Oscillation by Hair Bundles of the Bullfrog's Sacculus. Journal of Neuroscience. 23 (11), 4533-4548 (2003).
- Hudspeth, A. J., Lewis, R. S. A model for electrical resonance and frequency tuning in saccular hair cells of the bull-frog, Rana catesbeiana. The Journal of physiology. 400, 275-297 (1988).
- Hudspeth, A. J., Lewis, R. S. Kinetic analysis of voltage-and ion-dependent conductances in saccular hair cells of the bull-frog, Rana catesbeiana. The Journal of physiology. , (1988).
- Fisher, J. A. N., Kowalik, L., Hudspeth, A. J. Imaging electrical resonance in hair cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (4), 1651-1656 (2011).
- Patel, S. H., Salvi, J. D., Ó Maoiléidigh, D., Hudspeth, A. J. Frequency-selective exocytosis by ribbon synapses of hair cells in the bullfrog's amphibian papilla. The Journal of neuroscience : the official journal of the Society for Neuroscience. 32 (39), 13433-13438 (2012).
- Gale, J. E., Meyers, J. R., Periasamy, A., Corwin, J. T. Survival of bundleless hair cells and subsequent bundle replacement in the bullfrog's saccule. Journal of neurobiology. 50 (2), 81-92 (2002).
- Hudspeth, A. J. Mechanoelectrical transduction by hair cells of the bullfrog's sacculus. Progress in brain research. 80, 129-135 (1989).
- Hudspeth, A. J. Integrating the active process of hair cells with cochlear function. Nature Reviews Neuroscience. 15 (9), 600-614 (2014).
- Corey, D. P., Hudspeth, A. J. Response latency of vertebrate hair cells. Biophysical journal. 26 (3), 499-506 (1979).
- Cheung, E. L. M., Corey, D. P. Ca2+Changes the Force Sensitivity of the Hair-Cell Transduction Channel. Biophysical journal. 90 (1), 124-139 (2006).
- Choe, Y., Magnasco, M. O., Hudspeth, A. J. A model for amplification of hair-bundle motion by cyclical binding of Ca2+ to mechanoelectrical-transduction channels. Proceedings of the National Academy of Sciences of the United States of America. 95 (26), 15321-15326 (1998).
- Assad, J. A., Corey, D. P. An active motor model for adaptation by vertebrate hair cells. Journal of Neuroscience. 12 (9), 3291-3309 (1992).
- Crawford, A. C., Evans, M. G., Fettiplace, R. Activation and adaptation of transducer currents in turtle hair cells. The Journal of physiology. , 405-434 (1989).
- Howard, J., Hudspeth, A. J. Mechanical relaxation of the hair bundle mediates adaptation in mechanoelectrical transduction by the bullfrog's saccular hair cell. Proceedings of the National Academy of Sciences of the United States of America. 84 (9), 3064-3068 (1987).
- Purves, R. D. The release of drugs from iontophoretic pipettes. Journal of Theoretical Biology. 66 (4), 789-798 (1977).
- Tinevez, J. Y., Jülicher, F., Martin, P. Unifying the various incarnations of active hair-bundle motility by the vertebrate hair cell. Biophysical journal. 93 (11), 4053-4067 (2007).
- Ó Maoiléidigh, D., Nicola, E. M., Hudspeth, A. J. The diverse effects of mechanical loading on active hair bundles. Proceedings of the National Academy of Sciences of the United States of America. 109 (6), 1943-1948 (2012).
- Kennedy, H. J., Crawford, A. C., Fettiplace, R. Force generation by mammalian hair bundles supports a role in cochlear amplification. Nature. 433 (7028), 880-883 (2005).
- van Netten, S. M., Khanna, S. M. Stiffness changes of the cupula associated with the mechanics of hair cells in the fish lateral line. Proceedings of the National Academy of Sciences of the United States of America. 91 (4), 1549-1553 (1994).
- Bormuth, V., Barral, J., Joanny, J. F., Jülicher, F., Martin, P. Transduction channels' gating can control friction on vibrating hair-cell bundles in the ear. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7185-7190 (2014).
- Crawford, A. C., Evans, M. G., Fettiplace, R. The actions of calcium on the mechano-electrical transducer current of turtle hair cells. The Journal of physiology. , 369-398 (1991).
- Kozlov, A. S., Risler, T., Hudspeth, A. J. Coherent motion of stereocilia assures the concerted gating of hair-cell transduction channels. Nature Neuroscience. 10 (1), 87-92 (2007).
- Lumpkin, E. A., Hudspeth, A. J. Regulation of free Ca2+ concentration in hair-cell stereocilia. Journal of Neuroscience. 18 (16), 6300-6318 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved