Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En Vivo Medición electrofisiológica del nervio cubital con la excitabilidad Axonal prueba rata
En este artículo
Resumen
La excitabilidad axonal técnicas proporcionan una poderosa herramienta para analizar la fisiopatología y los cambios biofísicos que preceden acontecimientos degenerativos irreversibles. Este manuscrito muestra el uso de estas técnicas en el nervio cubital de ratas anestesiados.
Resumen
Electrofisiológico permite la evaluación objetiva de la función de nervio periférico en vivo. Conducción nerviosa tradicional medidas tales como amplitud y latencia de detectaron pérdida crónica axon y desmielinización, respectivamente. Técnicas de excitabilidad axonal "por umbral de seguimiento" amplían estas medidas al proporcionar información sobre la actividad de canales iónicos, bombas e intercambiadores que se relacionan con la función aguda y pueden preceder eventos degenerativos. Como tal, el uso de excitabilidad axonal en modelos animales de trastornos neurológicos puede proporcionar una medida útil en vivo para evaluar intervenciones terapéuticas novedosas. Aquí se describe una instalación experimental para medidas múltiples de técnicas motor excitabilidad axonal en el nervio cubital de rata.
Los animales son anestesiados con isoflurano y cuidadosamente monitoreados para asegurar una profundidad constante y adecuada de anestesia. Temperatura corporal, ritmo respiratorio, ritmo cardíaco y saturación de oxígeno en la sangre son continuamente monitoreados. Se realizan estudios de excitabilidad axonal utilizando la estimulación percutánea del nervio cubital y grabación de la musculatura hipotenar de la pata del miembro anterior. Con la colocación correcta del electrodo, se registra un potencial de acción muscular compuesto claro que aumenta en amplitud con el aumento de intensidad del estímulo. Un programa automatizado se utiliza entonces para ofrecer una serie de impulsos eléctricos que generan 5 medidas específicas de excitabilidad en la secuencia siguiente: estímulo respuesta comportamiento, constante de tiempo de duración de fuerza, electrotonus umbral, umbral de corriente relación y el ciclo de recuperación.
Los datos presentados aquí indican que estas medidas son repetibles y muestran similitud entre los nervios cubitales derecha e izquierdos cuando se evaluó en el mismo día. Una limitación de estas técnicas en este entorno es el efecto de dosis y tiempo bajo anestesia. Cuidadoso monitoreo y registro de estas variables deben realizarse para su examen en el momento del análisis.
Introducción
El uso de técnicas electrofisiológicas es una herramienta esencial para la investigación en vivo de la función nerviosa periférica en trastornos neurológicos. Métodos de conducción del nervio convencionales utilizan estímulos supramaximal latencia y amplitud del potencial de acción motor. Estas técnicas por lo tanto proporcionan información útil sobre el número de la realización de las fibras y la velocidad de conducción de las fibras más rápidas. Una valiosa herramienta complementaria es la de prueba de excitabilidad axonal. Esta técnica utiliza patrones de estimulación electrofisiológica sofisticado para evaluar indirectamente las propiedades biofísicas de los nervios periféricos, como la actividad de canales iónicos, bombas dependientes de energía, procesos de intercambio iónico y potencial de membrana 1.
Prueba de excitabilidad axonal es comúnmente utilizada en el ajuste clínico para investigar procesos fisiopatológicos y los efectos de las intervenciones terapéuticas en diversos trastornos neurológicos. Lo importante, las medidas de la excitabilidad axonal son sensibles a las intervenciones terapéuticas que afectan la función de nervio periférico como la terapia de inmunoglobulina intravenosa (IgIV)2, quimioterapia3 y calcineurin inhibidor (CNI) 4. aunque estos estudios han aportado importantes ideas, estudios clínicos a menudo impiden investigación de características de la enfermedad temprana y nuevas opciones terapéuticas5. Por lo tanto, el uso de estos métodos en modelos animales de trastornos neurológicos ha ganado recientemente la tracción6,7,8,9. De hecho, estos métodos proporcionan una oportunidad para comprender los cambios de excitabilidad del nervio específico asociados con estos trastornos, por lo tanto avance de la investigación traslacional.
El procedimiento descrito aquí es un método sencillo y fiable para medidas de registro excitabilidad axonal en los nervios cubitales de la rata intacta.
Protocolo
Todos los procedimientos experimentales descritos aquí cumplieron con el cuidado Animal y ética Comité de UNSW de Sydney y se realizaron según la salud nacional y el Consejo de investigación médica (NHMRC) de regulaciones de Australia para la experimentación animal.
1. experimental establecido
Nota: se utilizaron ratas Long-Evans 12 semanas de edad, femeninas en este procedimiento.
- Anestesiar la rata en una cámara de inducción con 4% de isoflurano y 1 L por min O2 caudal. Confirmar anestesia suficiente probando el righting reflex y asegúrese que su ausencia antes de retirar el animal de la cámara de inducción. Tenga en cuenta que varios agentes anestésicos tienen efectos diferenciales sobre la excitabilidad de nervio10.
- Bien colocar el hocico del animal en el accesorio del cono de nariz y entregar una dosis de mantenimiento de 2.5% de isoflurano y 1 L por min O2 caudal.
- Confirmar adecuada anestesia comprobando el retiro pedal y reflejos corneales por los pies del animal se atore y tocar suavemente sus ojos.
Nota: Aplicación de ungüento veterinario en los ojos, para evitar sequedad mientras que bajo anestesia, se recomienda pero no esencial, ya que el procedimiento generalmente toma 30 minutos por animal. - Mantener la temperatura corporal de la rata a 37 ° C con el uso de una esterilla de retroalimentación controlada y una sonda de termómetro rectal. Establecer la esterilla y el sensor de temperatura de cuerpo integrado a 40 ° C para evitar cualquier daño en la piel que se produce con temperaturas más altas.
Nota: Se recomienda al monitor y registro de medidas fisiológicas (frecuencia cardíaca, saturación de oxígeno, temperatura corporal y frecuencia respiratoria) cada 10s con el uso de un sistema de monitorización fisiológico animal. Procedimientos de grabación óptimo deben incluir medición local de la temperatura de la extremidad como la temperatura periférica puede ser más fría que el de la temperatura de base11 (figura 1). - Guantes antisépticos y siempre use instrumentos que hayan sido limpiados con etanol al 70%, para mantener un ambiente libre de patógenos durante el procedimiento.
2. electrofisiológico configurar
- Para este procedimiento, utilice electrodos de aguja de platino electroencefalograma (EEG) de baja impedancia.
- Preparar los grabación electrodos de aguja insertando el electrodo de aguja de registro (figura 1; indicados en morado) a través del músculo hipotenar y el electrodo de referencia a través de la cara dorsal de la cifra 4 (figura 1, indica en naranja) para registrar los potenciales de acción compuestos del músculo (CMAPs).
- Coloque el electrodo de tierra a través de la piel en la parte superior del antebrazo entre estimular y registrar los electrodos (figura 1; indicadas en verde). Tenga cuidado al insertar los electrodos para evitar tejido muscular.
- Preparar los electrodos estimulantes percutánea de aguja insertando el cátodo (figura 1; marcadas en azul) túnel de aproximadamente 4 mm distal a la cubital en el codo. Inserte el ánodo (figura 1; etiquetado en rojo) aproximadamente 1 cm proximal a través de la piel de la región axilar.

Figura 1: esquema de la colocación del electrodo de aguja en miembro anterior de la rata. El cátodo (azul) se inserta distal al túnel cubital en el codo de aproximadamente 4 mm y se introduce el ánodo (rojo) aproximadamente 1 cm proximal a través de la piel de la región axilar. El electrodo de aguja de tierra (verde) se inserta a través de la piel en la parte superior del antebrazo entre el estimulante y electrodos de grabación. La grabación (púrpura) y los electrodos de aguja referencia (naranja) se insertan a través del músculo hipotenar y a través de la cara dorsal de los 4 dígitos deth . En el aspecto superior del músculo tenar se coloca la sonda de temperatura (gris). Haga clic aquí para ver una versión más grande de esta figura.
3. axonal excitabilidad procedimientos
- Realizar el nervio motor roedor protocolo TRONDNF con un semiautomático, programa de ordenador controlados excitabilidad axonal (véase la tabla de materiales) vinculado a un estimulador de corriente constante y un amplificador. Eliminar el excesivo ruido eléctrico de 50 Hz con un eliminador de ruido de 50/60 Hz.
- Grabar el CMAP del músculo hipotenar simultáneamente visualizar la morfología CMAP y aplicando un 1 pulso de onda cuadrada de ms para el nervio cubital con el electrodo de aguja de cátodo.
- Para lograr grabaciones óptima, ajuste cuidadosamente el ángulo o posición del cátodo hasta que una curva de respuesta bifásica óptima con amplitud constante se logra (figura 2A.). Una vez que se ha determinado la posición óptima, estabilizar el cátodo con un sostenedor de electrodo reposicionable.
Nota: El software utilizado automáticamente proporciona los estímulos de la prueba, que se describe a continuación y aumenta o disminuye la corriente necesaria para alcanzar el umbral.
- Para lograr grabaciones óptima, ajuste cuidadosamente el ángulo o posición del cátodo hasta que una curva de respuesta bifásica óptima con amplitud constante se logra (figura 2A.). Una vez que se ha determinado la posición óptima, estabilizar el cátodo con un sostenedor de electrodo reposicionable.
- Registrar una curva de respuesta del estímulo aumentando gradualmente la intensidad del estímulo de un 1 ms impulso de 1 mA hasta que se consigue una respuesta máxima.
Nota: La línea púrpura y verde en la figura 2B y 2C representa respectivamente el aumento incremental de la intensidad del estímulo y el sistema automatizado. La amplitud del objetivo de umbral de seguimiento se establece automáticamente en el 40% de la amplitud máxima correspondiente a la zona de la cuesta más escarpada en la curva de respuesta del estímulo. El cambio en el 'umbral' (es decir, el estímulo necesario para obtener el 40% CMAP) inducida por diversos estímulos de la prueba es la variable de obtenidos en el resto del protocolo. - Grabar múltiples parámetros de excitabilidad axonal, incluyendo electrotonus umbral (TE), umbral de corriente (I / V) relación y recuperación (RC) como se describe en la referencia12del ciclo.
Nota: El programa de ordenador controlados excitabilidad axonal evalúa el umbral (TE) con una subliminal despolarizantes e hiperpolarizantes corrientes de 100 ms que es de ±20% y ±40% del umbral de control actual. El cambio en el umbral después de corrientes despolarizantes e hiperpolarizantes se graba automáticamente en 14 puntos del tiempo durante la polarización actual de 100 ms y 12 puntos después de la polarización actual. Electrotonus umbral indirectamente evalúa las conductancias internodales y es un marcador de potencial de membrana. El I / relación V es evaluado con 200 ms subliminal acondicionado corrientes que se alternan en la intensidad de + 50% -100% del umbral de control en incrementos del 10%. El I / relación V diferencia a TE en que las corrientes son más largas en duración, progresivamente se altera la intensidad de polarización de + 50% -100% y el cambio de umbral se evalúa en cada intensidad 1 ms después de la polarización actual ha cesado. La relación V proporciona una penetración en las propiedades de rectificación del axon1. La RC se evalúa con un paradigma de pulso sincronizado, donde se aplica un estímulo de acondicionado supramaximal inicial seguido por una serie de estímulos de la prueba a intervalos específicos de 2,5 ms a 200 ms. este parámetro pone a prueba una serie bien definida de eventos que se producen en el nodal región del axón después del estímulo supramaximal. Estos eventos incluyen la inactivación de los canales voltaje-bloqueados del Na+ que hace más difícil provocar una respuesta posterior y se cuantifica por refractariedad y el período refractario relativo 1. Esto es seguido por una carga de entrenudo y un periodo de excitabilidad aumentada mediada por canales de potasio rápidamente cuantificados por superexcitability. Finalmente, poco a poco activa canales de potasio median un último período de excitabilidad reducida, cuantificado como subexcitability.
- Grabar el CMAP del músculo hipotenar simultáneamente visualizar la morfología CMAP y aplicando un 1 pulso de onda cuadrada de ms para el nervio cubital con el electrodo de aguja de cátodo.
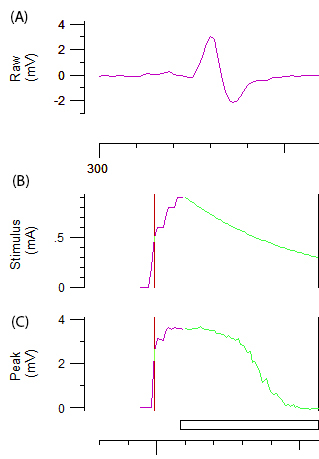
Figura 2: datos de un test de excitabilidad axonal Panel A muestra la curva de respuesta CMAP abiphasic después aumento incremental de la estimulación del nervio cubital. Paneles B y C representan la intensidad del estímulo (mA) y la amplitud de CMAP (mV), respectivamente. El componente verde de B y C representa la disminución incremental automatizada de intensidad del estímulo y la disminución en forma sigmoide asociada en CMAP para umbral de seguimiento.
4. publicar procedimientos de electrofisiología
- Transferencia de la rata en una jaula separada hasta que ha recuperado la conciencia suficiente para mantener el recumbency esternal. No deje un animal desatendido y en compañía de otros animales hasta que ha recuperado de la anestesia. Una vez que la rata ha recuperado de la anestesia, traslado nuevo en su caja original.
- Al finalizar el estudio, eutanasia la rata sin dolor para el animal, por ejemplo letal inyección intraperitoneal de un barbitúrico (e.g. lethabarb).
Resultados
Medidas electrofisiológicas del nervio cubital rata fueron obtenidas con el presente Protocolo. Figura 3 se muestra a un representante de la grabación del nervio cubital izquierdo de 12 semanas de edad hembra Evans largo rata. Potencial de acción compuesto del músculo se relaciona con el número de fibras que se activan al mismo tiempo llevar a cabo. La respuesta de pico supramaximal (mV) (Figura 3A) muestra la respuesta máx...
Discusión
El procedimiento descrito demuestra una simple y confiable, técnica mínimamente invasiva que permite la evaluación de las propiedades biofísicas y potencial de la membrana del axón en un corto periodo de tiempo. En comparación con otras técnicas más invasivas, que requieren la exposición del nervio, el presente método de prueba de excitabilidad axonal induce daño mínimo del tejido permitiendo así la evaluación en vivo que conserva las condiciones fisiológicas de la nervio de interés y permite med...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El proyecto fue apoyado por Fundación Lundbeck, la Fundación de Novo Nordisk, el Consejo Danés de investigación médica, la Ludvig y Sara Elsass Foundation, la Fundación para la investigación en Neurología y Jytte y Kaj Dahlboms Fundación. R.A es apoyado por una beca de post-doctorado de carrera temprana de la salud nacional y el Consejo médico de investigación de España (#1091006)
Materiales
| Name | Company | Catalog Number | Comments |
| QTracS Program | Digitimer Ltd. | Axonal excitability program | |
| AM-Systems 2200, Analog Stimulus Isolator, 2200V/50Hz | SDR Scientific | 850005 | Stimulator |
| High Performance AC Amplifier Model LP511 | Grass Technologies | Amplifier | |
| Humbug 50/60Hz Noise eliminator | Quest Scientific Instruments | 726310 | Noise eliminator |
| Low Impedance Platinum Monopolar Subdermal Needle Electrodes | Grass Technologies | F-E2-24 | Recording electrodes, 10 mm length, 30 gauge |
| Low Impedance Platinum Electroencephalography Needle Electrodes | Cephalon | 9013L0702 | Stimulating electrodes, 10 mm length, 30 gauge |
| Multifunction I/O Device Model USB-6341 | National Instruments | Multifunction input/output device | |
| Iron Base Plate IP | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Rotating X-block X-4 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Magnetic Stand GJ-8 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Micromanipulator M-3333 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place |
Referencias
- Krishnan, A. V., Lin, C. S. -. Y., Park, S. B., Kiernan, M. C. Axonal ion channels from bench to bedside: a translational neuroscience perspective. Prog neurobiol. 89 (3), 288-313 (2009).
- Lin, C. S. -. Y., Krishnan, A. V., Park, S. B., Kiernan, M. C. Modulatory effects on axonal function after intravenous immunoglobulin therapy in chronic inflammatory demyelinating polyneuropathy. Arch neurol. 68 (7), 862-869 (2011).
- Park, S. B., Goldstein, D., Lin, C. S. -. Y., Krishnan, A. V., Friedlander, M. L., Kiernan, M. C. Acute abnormalities of sensory nerve function associated with oxaliplatin-induced neurotoxicity. J. Clin. Oncol. 27 (8), 1243-1249 (2009).
- Arnold, R., Pussell, B. A., Pianta, T. J., Lin, C. S. -. Y., Kiernan, M. C., Krishnan, A. V. Association between calcineurin inhibitor treatment and peripheral nerve dysfunction in renal transplant recipients. Am. J. Transplant. 13 (9), 2426-2432 (2013).
- Boërio, D., Greensmith, L., Bostock, H. Excitability properties of motor axons in the maturing mouse. J. Peripher. Nerv. Syst. 14 (1), 45-53 (2009).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant SOD1(G93A) model of amyotrophic lateral sclerosis. Muscle & Nerve. 41 (6), 774-784 (2010).
- Alvarez, S., Calin, A., Graffmo, K. S., Moldovan, M., Krarup, C. Peripheral motor axons of SOD1(G127X) mutant mice are susceptible to activity-dependent degeneration. Neurosci. 241, 239-249 (2013).
- Fledrich, R., et al. Soluble neuregulin-1 modulates disease pathogenesis in rodent models of Charcot-Marie-Tooth disease 1A. Nat. Med. 20 (9), 1055-1061 (2014).
- Vianello, S., et al. Low doses of arginine butyrate derivatives improve dystrophic phenotype and restore membrane integrity in DMD models. FASEB J. 28 (6), 2603-2619 (2014).
- Osaki, Y., et al. Effects of anesthetic agents on in vivo axonal HCN current in normal mice. Clin Neurophysiol. 126 (10), 2033-2039 (2015).
- Biessels, G. J., et al. Phenotyping animal models of diabetic neuropathy: a consensus statement of the diabetic neuropathy study group of the EASD (Neurodiab). J. Peripher. Nerv. Syst. 19 (2), 77-87 (2014).
- Boërio, D., Greensmith, L., Bostock, H. A model of mouse motor nerve excitability and the effects of polarizing currents. J. Peripher. Nerv. Syst. 16 (4), 322-333 (2011).
- Arnold, R., Moldovan, M., Rosberg, M. R., Krishnan, A. V., Morris, R., Krarup, C. Nerve excitability in the rat forelimb: a technique to improve translational utility. J. Neurosci. Methods. 275, 19-24 (2017).
- Moldovan, M., Alvarez, S., Krarup, C. Motor axon excitability during Wallerian degeneration. Brain. 132 (Pt 2), 511-523 (2009).
- Madison, R. D., Robinson, G. A., Krarup, C., Moldovan, M., Li, Q., Wilson, W. A. In vitro electrophoresis and in vivo electrophysiology of peripheral nerve using DC field stimulation. J. Neurosci. Methods. 225, 90-96 (2014).
- Moldovan, M., Krarup, C. Evaluation of Na+/K+ pump function following repetitive activity in mouse peripheral nerve. J. Neurosci. Methods. 155 (2), 161-171 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados