Method Article
Una metodología estándar para examinar in situ mutagenicidad en función de la mutación de punto reparación catalizada por CRISPR/Cas9 y SsODN en células humanas
En este artículo
Resumen
Este protocolo describe el flujo de trabajo de un gen CRISPR/Cas9 basado en sistema para la reparación de las mutaciones de punto en células de mamíferos. Aquí, utilizamos un enfoque combinatorio gene edición con una detallado seguimiento estrategia experimental para medir la formación de indel en el sitio de destino, en esencia, analizar in situ la mutagénesis.
Resumen
Combinatoria genética edición utilizando CRISPR/Cas9 y oligonucleótidos de cadena simple es una estrategia efectiva para la corrección de las mutaciones de punto solo-base, que a menudo son responsables de una variedad de enfermedades hereditarias humanas. Utiliza un sistema bien establecido modelo basado en la célula, la mutación de un gen eGFP mutante solo copia integrada células HCT116 de punto ha sido reparada usando esta aproximación combinatoria. El análisis de las células corregidas y sin corregir revela la precisión de edición génica y el desarrollo de lesiones genéticas, cuando se crean indels en células sin corregir en la secuencia del ADN que rodea el sitio de destino. Aquí, se describe la metodología específica utilizada para analizar este enfoque combinatorio para la edición de gen de una mutación de punto, juntada con una detallada estrategia experimental para medir la formación indel en el sitio de destino. Este protocolo describe un enfoque fundamental y el flujo de trabajo para las investigaciones orientadas al desarrollo gene base de Cas9 CRISPR edición para la terapia humana. La conclusión de este trabajo es que mutagénesis in situ ocurre como resultado de actividad CRISPR/Cas9 durante el proceso de reparación de la mutación de punto. Este trabajo pone en su lugar una metodología estandarizada para identificar el grado de mutagénesis, que debe ser un aspecto importante y fundamental de cualquier estrategia destinada a la aplicación clínica.
Introducción
Pionera en estudios realizados por Mandecki (1986) demostraron cambios permanentes en el DNA plasmídico utilizando oligonucleótidos transformados en bacterias1, mientras que Walder y Walder (1986) llevó a cabo estudios similares en levadura2. Poco después, Sherman y sus colaboradores publicaron una serie de documentos en los que sola oligonucleótidos fueron introducidos en células de levadura para hacer cambios hereditarios en los genes3. Basándose en el trabajo seminal de las células microbianas, Kmiec y sus colegas comenzaron a desarrollar únicos oligonucleótidos de agente único que reparación de la base solo en células de mamíferos4. Este concepto se basó en datos bioquímicos que demostraron que moléculas de RNA del cojinete se unen más estrechamente al sitio de destino que los compuesto enteramente de bases de ADN. Aunque hubo numerosos informes de éxito edición de genes utilizando oligonucleótidos quiméricos5,6,7, los niveles de edición seguía siendo muy variables entre experimentos y a través de la célula de destino diferentes combinaciones.
ADN monocatenario donante es preferido a doble hebra donante ADN porque es menos probable para integrar al azar sitios dentro del genoma8. Sin embargo, introducidos exógeno monocatenario oligonucleótidos son propensos a la rápida degradación por las nucleasas celulares. Se han empleado varias estrategias para proteger el termini de oligonucleótidos de degradación. Una protegido de exonucleasa, monocatenario DNA que contiene la secuencia deseada era suficiente para obtener una eficacia de edición en el 0.1-1% rango6. Mejor y más consistentes técnicas de transfección, juntadas con lecturas fenotípicas, permitieron más consistentes por múltiples investigaciones grupos8,9,10,11, 12,13.
En los últimos 10 años, ha habido un esfuerzo importante para hacer más susceptibles a la edición de genes las células diana. Una estrategia emplea la modulación del ciclo celular14,15,16. Mientras que edición de frecuencias bajo condiciones de reacción normal con oligonucleótidos de cadena simple (ssODNs) introducido en células mamíferas cultivadas rondaron entre 0.1% y 1%, las frecuencias del gene edición aumentada 3 a 5 veces cuando los oligonucleótidos fueron introducidos en las células durante su transición a través de la fase S. En una serie separada de experimentos, Brachman y Kmiec (2005) demostraron que niveles relativamente altos del gen preciso Editar (3-5%) se obtuvieron cuando se incubó 2'3 ' dideoxycytosine (ddC) en las células durante 24 h antes de la adición de los oligonucleótidos17 . ddC reduce la tasa de movimiento de la horquilla la replicación de ADN, sugiriendo que el gene edición ssODNs en reproducir células probablemente implica la incorporación de ODNs en regiones de activa replicación11,18. Tomados en conjunto, estos estudios conducidos al concepto que donantes de ADN se incorpora en una horquilla de replicación cada vez mayor como parte del verdadero mecanismo de acción de edición génica, independiente de si hay una rotura de doble hebra o no19. Por lo tanto, la corrección de una mutación de punto o el reemplazo de un segmento de ADN en el cromosoma ocurre a través de un ADN emparejamiento y la vía de asimilación del solo-filamento.
Inducir al azar roturas de DNA de doble hebra en el cultivo de células con moléculas pequeñas agentes crea un ambiente en que sucesos de replicación de ADN se estancaron como la célula intenta reparar el daño de20,21. Esta desaceleración transitoria de las horquillas de replicación permite una penetración más eficiente de la estructura de la cromatina por oligonucleótidos edición monocatenario, mejora de accesibilidad del objetivo15. La creación de ADN de doble hebra se rompe por las drogas como VP16, bleomicina, o camptothecin22,23, se ha demostrado para estimular el gen editar niveles por casi 10 veces, hasta 6-8%. Sin embargo, roturas de DNA de doble cadena al azar son indeseables en un ambiente terapéutico.
Gen con oligonucleótidos y nucleasas programables también es estimulado durante la división celular24,25. Cuando entrega basados en ácidos nucleicos fue utilizado para llevar a cabo la reparación dirigida por homología en sincronizado HCT 116 células, Rivera Torres y sus colegas demostraron el mismo aumento en la actividad de orientación cuando nucleasas efectoras como activador de transcripción (TALENs) se emplearon con oligonucleótidos de cadena simple, ambos introducen una replicación celular población26,27 . Más recientemente, Bialk y sus colegas demostraron que la reparación de las mutaciones base solo con oligonucleótidos de cadena simple y un arsenal de agrupan regularmente otro corto repite palindrómico Cas9 (CRISPR/Cas9) las moléculas se lleva a cabo con mayor eficacia Cuando la población celular mueve S fase28. La molécula CRISPR consta de ARN y funciones para identificar la región dentro de la meta secuencia de ADN que se señala para el escote. Cas9 es una enzima bacteriana cuya función es la de hender la DNA de doble hebra en una reacción de intercambio de nucleolytic. Así, CRISPR posiciones el complejo en el destino de genomic y nucleasa Cas9 ejecuta la rotura de doble hebra. Lin et al. (2014) también demostró la importancia del ciclo celular para lograr altas frecuencias del gene de edición, con un modificado CRISPR/Cas9 ribonulceoprotien (RNP) mediada por el complejo sistema de distribución en fibroblastos neonatales primarios, células madre embrionarias humanas, y otras líneas celulares24. Así, la relación establecida entre gene edición y la progresión del ciclo celular para la edición de agente único gen es aplicable a la combinatoria genética editar con nucleasas programables y plantillas de la DNA de donantes. Mientras que el enfoque combinatorio gene edición ha reunido a una gran variedad de socios con la plantilla de ADN de donantes, mayoría de los trabajadores en el campo utiliza CRISPR/Cas9 para proporcionar la función de rotura de doble hebra. Esta elección se basa en la facilidad de uso de esta herramienta genética particular y la flexibilidad con que puede utilizarse para desactivar la función de genes o para introducir una pieza exterior de la DNA en un sitio específico. La generación de un golpe de gracia es técnicamente más fácil comparada con un reemplazo del gen, donde la incorporación de copias de "correctos" o normales de un gen en el sitio de la enfermedad debe realizarse con precisión. Un número de investigadores es identificar y estudiar el uso de fármacos específicos y los reactivos que permiten la corrección de bases mutantes y la inserción de secuencias genéticas normales en la posición adecuada a las frecuencias elevadas29.
Recientemente, Rivera Torres et al. 30 utilizadas combinatorio gene edición, aprovechando la actividad de rotura de doble hebra de un sistema CRISPR/Cas9 específicamente diseñado y la información genética proporcionada por una plantilla de ADN donante de oligonucleótidos de cadena simple, para reparar una mutación de punto en unsola copia del gen de la proteína fluorescente verde mejorada (eGFP) integrado en células HCT116. Los autores tomaron ventaja de este modelo bien caracterizado de células para evaluar la especificidad de la hendidura que rodea el sitio de destino. Los datos revelan que existe heterogeneidad en el sitio de destino, especialmente en las células que no contienen una mutación de punto corregida. En este manuscrito, de detalle y enfoque en la metodología utilizada por estos trabajadores para examinar in situ heterogeneidad mutacional creado editando CRISPR/Cas9 gene.
Protocolo
el siguiente protocolo implica trabajar con células de mamíferos, se espera que la familiaridad con la cultura técnica estéril/celular.
1. línea celular y las condiciones de cultivo
- hacer 500 mL de medio para el cultivo de células de HCT 116: McCoy ' s 5A modificado suplementado con 10% suero bovino fetal (FBS), 2 mM L-glutamina y 1% de penicilina (esto es completa medio).
Nota: Crecen HCT 116-19 las células en un frasco de T-75 o T-175 antes de la galjanoplastia. Cuando confluentes de 90%, cada frasco de T-75 producirá 8.4 x 10 6 células, aproximadamente cinco placas de 10 cm, y cada T-175 producirá 18,4 x 10 6 células, aproximadamente quince placas de 10 cm.
2. Recolección de las células del frasco
- aspirar a medio, lavar con Dulbecco ' s Phosphate-Buffered salina sin calcio y magniesium (PBS) (10 mL para T-75 o 25 mL de T-175) y aspirar. Tripsina de
- agregar gota a gota al matraz con una pipeta de 2 mL (2 mL de T-175 o 1 mL de T-75). Colocar el matraz en una incubadora a 37 ° C y 5% de CO 2 durante 5 minutos permitir que las células separar.
- Golpee el frasco para asegurarse de que todas las células son desalojadas y luego apagan con medio completo al dispersar por toda la superficie de la cubeta (8 mL de T-175 o 4 mL T-75).
- Pipeta de arriba y abajo varias veces para romper grumos de células y transferir las células a un tubo cónico de 15 mL
- Antes de girar las celdas hacia abajo, tomar 10 μl de la cónica de 15 mL y combinar con 10 μl de trypan azul para contar las células. Las células de la pelotilla de spinning durante 5 minutos a 125 x g y 16 ° C.
3. Conteo de las células
- transferir 10 μl de las células mezcladas con trypan azul para el hemocitómetro. Contar las 4 rejillas alrededor del exterior (cada rejilla contiene 16 plazas).
- Tomar el recuento celular promedio de cada conjunto de dieciséis cuadrados de esquina.
- Multiplicar por 10.000 (10 4).
- Multiplicar por el volumen total del medio utilizado para cosechar las células para corregir para la dilución de la adición de azul trypan.
Nota: El formato de la ecuación para calcular el volumen para resuspender las células sigue:
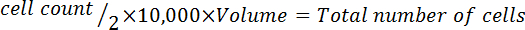
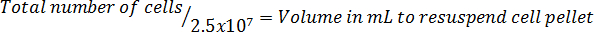
4. Las células de la galjanoplastia
- para cada placa de 10 cm de las células para que se sincronice, añadir 5 mL de medio completo y 6 μm de aphidicholin (12 μl de un caldo de 2,5 mM en etanol 200 proof).
- De la pelotilla de transferir 100 μl de células suspende de nuevo, 2,5 x 10 6 células, a cada placa de 10 cm y agitar suavemente para mezclar.
- Incubar las placas a 37 ° C y 5% de CO 2 por 16-24 h para sincronizar las células en la frontera de G1/S.
5. Liberación de las células de la sincronización Aphidicolin
- 4 h antes de apuntar al blanco, aspirar el medio de lavar con PBS, aspirar el PBS y añadir 5 mL de medio completo
- colóquelo en la incubadora a 37 ° C y 5% CO 2 4 h
6. Secuestrantes de RNA
- Enter la secuencia del gen eGFP mutantes en el laboratorio de Zhang ' s generador en línea 25 (http:// crispr.mit.edu/) y elegir la guía CRISPR secuencias que se unen con proximidad cercana al sitio de destino. Obtener la guía CRISPR secuencias de una fuente comercial.
- Almacenar el CRISPR ARN (crRNA), trans-activar crRNA (tracrRNA) y proteína Cas9 a 20 ° C y utilizar según sugerencias del fabricante.
Tubo
- Mix el ARN en concentraciones equimolares a 45 μm. 6.75 añadir μl de un stock de 200 μm de crRNA y 6.75 μl de un stock de 200 μm de tracrRNA a una centrífuga de 1,5 mL. Agregar 16.50 μl de tampón TE hacer un volumen final de 30 μl.
- Calor a 95 ° C por 5 min en el bloque de calor o máquina PCR.
PRECAUCIÓN: Caliente! - Deje que se enfríe a temperatura ambiente.
Nota: Si utiliza una máquina PCR, sistema refrigeración a 0,2 ° C/s. - Siga los siguientes pasos para cada muestra.
- 2.22 diluir μl de crRNA:tracrRNA complejo en 2.78 μl de Buffer TE (10 mM Tris, pH 8.0 y 0.1 mM EDTA, pH 8.0) hasta un volumen final de 5 μl.
- Μl diluir 1.67 de Cas9 proteína de un stock de 60 μm en 3.33 μl de suero bajo medio a volumen final de 5 μl.
- Mix 5 μl de proteína Cas9 con 5 μl de RNA complejado
7. Recolección de las células de orientación
- aspirar el medio de lavado con 5 mL de PBS, aspirar el PBS y añadir 1 mL de tripsina precalentado a cada placa de 10cm. Poner las placas en la incubadora a 37 ° C y 5% de CO 2 por 5 min
- Toque en la placa para asegurarse de que todas las células son desalojadas y luego apagan con 4 mL de medio completo dispersando por toda la superficie de la placa de 10 cm.
- Pipeta de arriba y abajo varias veces para romper grumos de células y transferir las células a un tubo cónico de 15 mL.
- Antes de girar las celdas hacia abajo, tomar 10 μl del tubo cónico de 15 mL y combinar con 10 μl de trypan azul para contar las células. Las células de la pelotilla de spinning durante 5 minutos a 125 x g y temperatura ambiente.
- El medio de aspirar y lavar con 5 mL de PBS. Sedimenten las células por giro a 125 x g durante 5 min a temperatura ambiente.
8. Conteo de las células
- transferir 10 μl de las células mezcladas con trypan azul para el hemocitómetro. Contar las 4 rejillas alrededor del exterior (cada rejilla contiene dieciséis cuadrados).
- Tomar el recuento celular promedio de cada conjunto de dieciséis cuadrados de esquina.
- Multiplicar por 10.000 (10 4).
- Multiplicar por el volumen total del medio utilizado para cosechar las células para corregir para la dilución de la adición de azul trypan.
Nota: El siguiente es el formato de la ecuación para calcular el volumen para resuspender las células. Vuelva a suspender el número de células de McCoy libre de suero ' s 5A modificado medio.
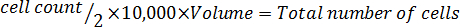
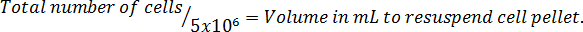
9. dirigidos a muestras de
- transferencia 100 Μl de suspensión celular (5 x 10 5 células) en el paso 8.1 cada cubeta de 4 mm de espacio de electroporación. Añadir 10 μl de RNP complejo de paso 6.7 a 100 μl de las células a una densidad celular de 5 x 10 5. Añadir ODN (2 μm) a cada muestra.
Nota: Para un control positivo, añadir 1 μl de eGFP en 1 μg/μl expresando plásmido- tomar la rejilla a una máquina de electroporación, ligeramente cada muestra la película y colocar en la cámara. Electroporate a 250 V, LV; 2 pulsos, 1 s; ms 13; pulso unipolar.
- Transferencia de la rejilla hacia la campana. Transferir cada muestra de un pozo que contiene 2 ml de medio completon una placa de 6 pozos. Incubar a 37 ° C y 5% de CO 2 por 72 h antes de comprobar los niveles de corrección.
10. Análisis de las células el gen editado y eficiencia de transfección
- el medio de aspirar y lavar las células con 2 mL de PBS. Aspire el PBS y agregar 500 μl de tripsina precalentado a cada pocillo de la placa de la pozo 6. Poner las placas en la incubadora a 37 ° C y 5% de CO 2 por 5 min
- Toque la placa para asegurarse de que todas las células son desalojadas y luego apagan con 1 mL de medio completo dispersando por toda la superficie del pozo.
- Pasar las células a un tubo de centrífuga de 1,5 mL y pellets a 5.000 x g durante 5 min a temperatura ambiente.
- Aspire el medio. Resuspenda el precipitado de células en 500 μl de tampón FACS (0,5% BSA, 2 mM EDTA y yoduro de propidio de 2 μg/mL en PBS).
- Medir la fluorescencia de la célula (eGFP +) por citometría de flujo.
- Calcular la eficacia de la corrección como el porcentaje de las células vivas total de eGFP-positivo sobre el número total de células vivas en cada muestra, como se describe en Rivera Torres et al. 30.
11. Análisis de la secuencia de ADN
- Electroporate el HCT sincronizado y lanzado 116-19 las células a una concentración de 5 x 10 5 células/100 μl, con RNP en 100 pmols y 72NT ODN a 2.0 μm.
- Transferir las células a placas de 6 pocillos y permitirles recuperar para 72 h.
- Clasificar las células individualmente en placas de 96 pozos utilizando un clasificador de FACS con un laser de 488 nm (100 mw) para la eGFP +-, como se describe en Rivera-Torres et al. 30.
Nota: No todos los pozos con éxito crecerá. - Ampliar las células más de 6 semanas y de la cosecha como se describe en el paso 7.
- De los pozos que tienen crecimiento, aislar gDNA celular utilizando un aislamiento de ADN disponible en el mercado kit (véase la Tabla de materiales) y amplifican la región que rodea el objetivo base mediante PCR (718 bp; primer avance 5 '- ATGGTGAGCAAGGGCGAGGA-3 ' y cartilla 5 ' - ACTTGTACAGCTCGTCCATGC - 3 ').
- Realizar la DNA que ordenaba análisis en muestras de.
Resultados
Utilizamos un sistema modelo para estudiar edición de genes en células de mamíferos, que se basa en la corrección de una mutación de punto en el gen eGFP integrado como un solo ejemplar en las células HCT116. Es importante tener en cuenta que se trata de un gen de copia única; así, se puede hacer una vista menos complicada de las alteraciones del ADN o mutagénesis. Figura 1A se muestra la secuencia del gen eGFP mutante con la base dirigida, el tercera base del codón TAG, resaltado en rojo. El oligonucleótido 72-base, que es parcialmente complementaria a la hebra no transcrito del gen eGFP (72NT) y está diseñado para inducir el intercambio de la base de una G a C, también se ilustra. Además, un CRISPR, designado como 2C, con la secuencia protospacer indica en un 5' a 3' orientación, también se muestra en la figura 1A. Para llevar a cabo esta reacción gen-edición, hemos utilizado una ribonucleoproteína (RNP) que consiste en el CRISPR (cr) ARN y el ARN tracr (tr) acoplado a la proteína purificada de Cas9 (figura 1B), en lugar de utilizar un vector de expresión mamífero consisten en el Cas9 de gen y la guía específica apropiada secuencia de ARN.
Cuando las partículas de RNP diseñada específicamente con el oligonucleótido de cadena simple en células HCT116 por electroporación, gene edición, evidenciado por la reparación de la única mutación base en eGFP, se observa después de 72 h de incubación con un flujo citómetro. Reparación funcional es observable por la aparición de fluorescencia verde en células específicas, que también pueden ser separados de toda la población al ordenar a causa de esta fluorescencia. Como se muestra en la figura 2, puede verse una respuesta gradual de la dosis como los niveles coordinados de aumento de la RNP y 72NT. La relación molecular, picomoles de RNP y concentración micromolar de 72NT como se muestra en la figura, se basan en dosis óptima usadas en reacciones edición de genes dependientes de la introducción de Cas9 y guía específica RNA de expresión transfected vectores. El recuadro en la figura 2 muestra una reacción gen-edición llevado a cabo en ausencia de la partícula de la RNP. Aquí, aproximadamente el 1% de las células apuntadas se corrigen cuando una 10 veces mayor concentración de los oligonucleótidos de 72NT se utiliza en la reacción gene-edición de agente único.
Con el fin de determinar si existe heterogeneidad genética en el efecto de mutagénesis en el sitio llamado el sitio de destino-que decidimos examinar el resultado del gene edición actividad en células individuales. Mientras que mucho más laborioso que examinar el total de la población, una verdadera medida de la huella genética o lesiones puede ser había comprobada al examinar el genoma de células clonally ampliados. Hemos repetido el experimento descrito en la figura 2, esta vez usando sólo 100 pmol de complejo RNP y 2,0 μmol de los oligonucleótidos 72NT. Como arriba, HCT 116 células fueron sincronizadas por 24 h con aphidicholine y detenidas en la frontera de G1/S. 4 h después, las células fueron puestos en libertad y las herramientas de edición de gene fueron introducidas por electroporación. 72 h más tarde, las células se analizaron utilizando FACS y clasificar individualmente en placas de 96 pocillos (el proceso experimental se ilustra en la figura 3). Células con fluorescencia verde fueron ordenadas por citometría de flujo en los pocillos de una placa de 96 pocillos para la expansión clonal. Importante, las células que carecían de expresión de eGFP también fueron aisladas y ordenadas de manera similar para la expansión en las mismas condiciones.
Después de 14 días de crecimiento, la mayoría de los clones individuales había ampliado suficientemente para permitir la extracción de ADN. Como tal, fueron seleccionados 16 clones de las muestras de eGFP-positivo, y la integridad genética que rodea el sitio de destino se analizaron por secuenciación de ADN. Información alrededor de la secuencia de la DNA de los alelos dentro de la población se generó utilizando a Sanger secuenciación, ensambladas con software de visualización de la secuencia para comparar la secuencia de un alelo de tipo salvaje (Figura 4A). El sitio de corte del complejo RNP está indicado por una flecha negra, situada en el verde de la barra (2C crRNA). Como también se muestra en la Figura 4A, todas las células de eGFP-positivo 16 contienen el intercambio de nucleótidos predicha en el sitio de destino. El residuo de C se puede convertir está resaltado en rojo, y el perfil de pico que refleja ese cambio exacto se proporciona debajo de la secuencia de eGFP-positivo. De manera similar, 15 no-verde clonal aísla, suficientemente ampliado para permitir la extracción de ADN y secuenciación, se analizaron de la heterogeneidad en el sitio de destino. Como se predijo, en aproximadamente la mitad de la muestras, no se observó ningún cambio de base de ADN. Esto se refleja en el mantenimiento de los residuos de G en el sitio de destino, como se muestra en la Figura 4B. El resto de las expansiones clonales en estos experimentos muestra una población heterogénea de las mutaciones de la canceladura, por lo tanto son responsables de la falta de fluorescencia verde. El tamaño de la canceladura osciló entre una base y 19 bases. Es importante tener en cuenta que sólo hemos examinado 15 muestras de las células positivas de eGFP, y aunque creemos que esto es absolutamente representante del tipo de lesiones genéticas de CRISPR/Cas9 actividad, existe la posibilidad otros tipos o formas de indels podrían estar presentes en la población objetivo.
Tomados en conjunto, los resultados mostrados en la figura 4 confirman la lectura fenotípica en la eGFP a sistema. Conversión de la G en el nucleótido C permite la aparición de fluorescencia verde en células HCT116 corregidas. Ninguna substitución baja que rodea el sitio de destino se ha observado en los clones aislados para este experimento o en anteriores experimentos27,28. Los datos también demuestran que las células no sufren de edición a través de la reparación de la mutación de punto del gene permanecen sin corregir, pero en algunos casos, no sin modificaciones, con un rango de heterogeneidad genética que rodea el sitio de destino.
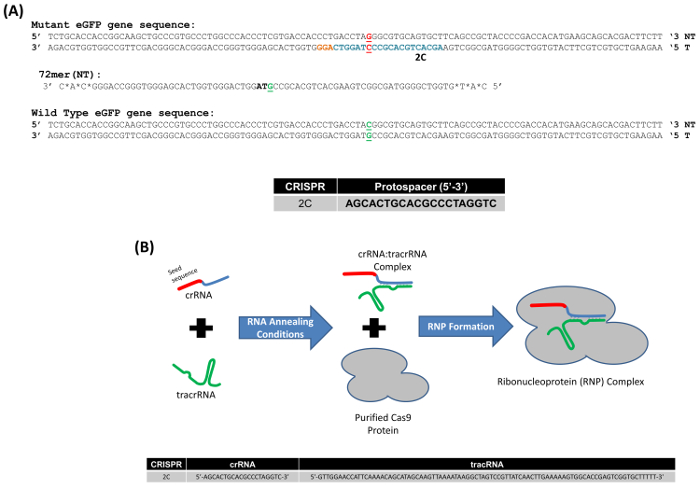
Figura 1. (A) modelo de sistema para la edición del gene del gene del mutante eGFP. Los segmentos apropiados del tipo salvaje y gen eGFP mutado con el codón específico, situado en el centro de la secuencia, se muestran en verde y rojo, respectivamente. Los nucleótidos destinados a intercambio es en negrita y subrayan. Bases la resaltada en azul representan la secuencia de protospacer de 2 C CRISPR y las bases naranjas destacan el sitio de PAM. Los oligonucleótidos utilizados en estos experimentos es 72 bases de longitud, teniendo vínculos fosfotioato modificado en las tres bases terminal; 72-mer objetivo el filamento (NT) no transcrito (72NT). (B) CRISPR/Cas9reacción de la Asamblea de ribonucleoproteína. crRNA proporciona especificidad de objetivo (sección de 20 bases, rojo) correspondiente a la secuencia de protospacer de 2C y un dominio de interacción (azul) con el tracrRNA (verde). crRNA y tracrRNA se recuecen en concentraciones equimolares. Cas9 proteína (gris) se agrega para completar el montaje de la RNP. Guía RNAs (gRNAs) dirigirán y activan el Cas9 endonucleasa, que entonces el ADN diana. La parte inferior de la figura muestra la secuencia de semilla de 2 C y la secuencia de tracrRNA. Esta figura fue modificada de Rivera-Torres, N. et al. (2017). haga clic aquí para ver una versión más grande de esta figura.
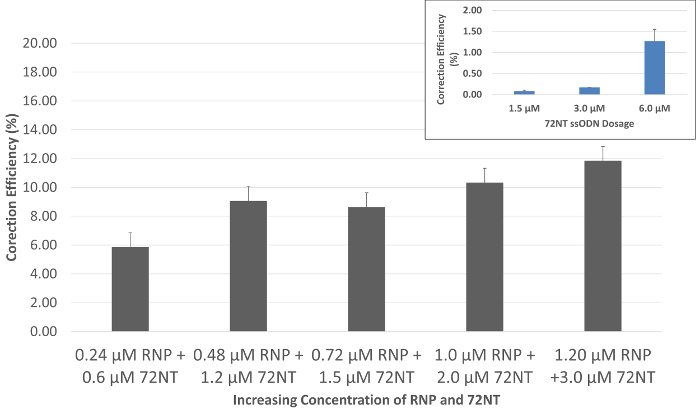
Figura 2. Gen de edición es dependiente de la dosis cuando dirigido por el RNP y el ssODN. Sincronizado y lanzado HCT 116-19 las células fueron electroporated con 24-120 pmol de CRISPR/Cas9 RNP y 0.6-3.0 μm de 72mer. Después de un período de recuperación de 72 h, gene-editar la actividad fue medida usando un citómetro de flujo. Gen de edición se muestra como la eficiencia de la corrección (%), determinada por el número de células viables de eGFP-positivo dividido por el número total de células viables en la población. Barras de error se producen de tres conjuntos de puntos de datos generados sobre tres experimentos separados mediante cálculos básicos del error estándar. Detalle: agente único gen edición. Actividad de edición génica dirigida por oligonucleótidos monocatenario (72NT) en la ausencia de la RNP compleja bajo condiciones idénticas se presenta como una función de aumento de la concentración. Esta figura fue modificada de Rivera-Torres, N. et al. (2017). haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Estrategia experimental para el aislamiento de clones celulares solo. Células que expresión de eGFP se calificaron como positiva y ordenada utilizando un citómetro de flujo como las células en pocillos individuales para expansión clonal. Las células que carecían de expresión de eGFP fueron aisladas y clasificadas de manera similar y ampliadas en las mismas condiciones. El ADN fue entonces aislado y el gen eGFP fue amplificado y sometido a Sanger secuenciación para analizar la actividad de edición de gene que rodea el sitio de destino. Esta figura fue modificada de Rivera-Torres, N. et al. (2017). haga clic aquí para ver una versión más grande de esta figura.
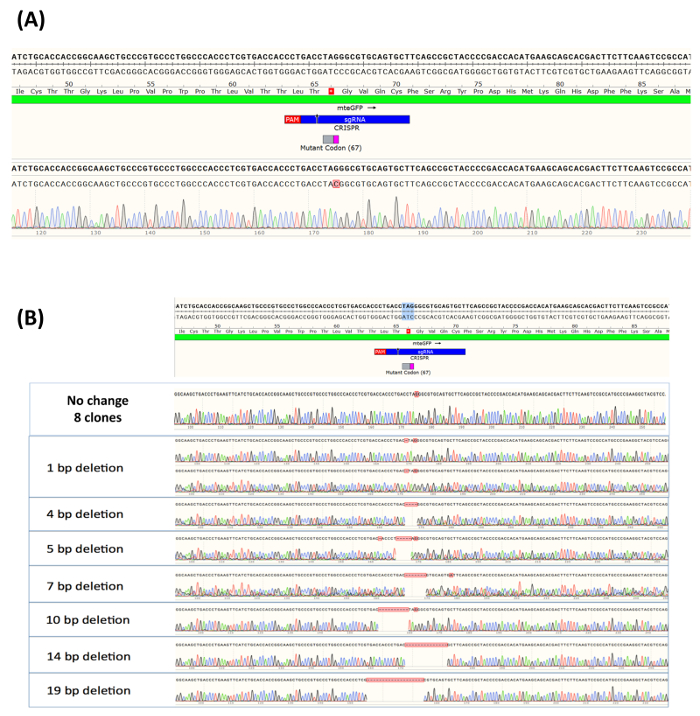
Figura 4. (A) análisis alélico de eGFP-positive células ampliado como una población clónica. Clonally aislado y ampliadas eGFP-positivos muestras (dieciséis clones) fueron analizadas en el sitio que rodea la base específica y el ADN de cada uno, cosechadas, purificadas, amplificadas y secuenciadas. Alélicas se realizó análisis con Sanger secuenciación, ensambladas con software de visualización de la secuencia y en comparación con la secuencia de un alelo de tipo salvaje, que se ilustra en la parte superior de la figura. El sitio de corte del complejo RNP se indica como una pequeña flecha negra ubicada en el green bar (crRNA de 2C). (B) Análisis alélico de eGFP-negativo células ampliado como una población clónica. Quince muestras individuales, de clones procedentes de la población sin corregir, fueron aleatoriamente seleccionadas y analizadas para formación de indel en el sitio que rodea el nucleótido de destino. Como arriba, alélicas se realizó análisis con Sanger secuenciación y ensamblado utilizando un software de visualización de la secuencia. Una vez más, se presentan la secuencia de un alelo de tipo salvaje en la parte superior de la figura, junto con el sitio de corte de la RNP. Esta figura fue modificada de Rivera-Torres, N. et al. (2017). haga clic aquí para ver una versión más grande de esta figura.
Discusión
Gene edición ha surgido como una disciplina científica corriente sobre todo debido a la aparición del sistema CRISPR/Cas9. Esta vía notable, que facilita la inmunidad adoptiva en células bacterianas, ha sido repurposed como herramienta molecular para permitir alteración genómica en cromosomas humanos. La función natural de CRISPR/Cas9 es desactivar el ADN viral mediante la introducción de roturas del DNA de doble hebra a fragmentación30,31. Esta actividad resulta en la destrucción de ADN exógeno que invaden y conduce a inmunidad procariota que suprime la infección posterior por la misma partícula viral. Sorprendentemente, este sistema exhibe un comportamiento neumónico, que puede reactivar específico gRNA CRISPR creado por eventos de infección anterior.
La eficiencia y la exactitud de la interrupción del gene catalizada por CRISPR/Cas9 se ha utilizado en numerosos sistemas genéticos eucariotas donde el objetivo fue desactivar un gen funcional32,33. Cuando se reduce a su nivel basal, el proceso consta de dos pasos fundamentales. La primera es una rotura de doble cadena, mientras que el segundo se basa en el proceso inherente de no homóloga se terminan uniendo (NHEJ) para completar el nocaut. En la mayoría de los casos, los resultados de rotura de doble hebra en la creación de terminó de blunt, segmentos cromosómicos desunidos y enzimas implicadas en NHEJ reaccionan a la rotura cromosómica y actúan para unimos los extremos rotos. Este proceso a veces puede implicar la pérdida de nucleótidos individuales en el sitio dañado. La pérdida de algunas bases puede causar un mutágeno ' frameshift ' y deja de expresión funcional. El uso de CRISPR/Cas9 para crear genético knockout enganchando el proceso natural de NHEJ ha revolucionado la genética eucariota; la pérdida de ADN en el sitio de destino es previsible y esperado.
En contraste con el golpe de gracia del gene, un número de investigadores se ha dedicado a intentar redirigir y reformatear CRISPR/Cas9 actividad hacia el proceso de reparación dirigido por homología. El objetivo de los estudios es corrección génica. En esta estrategia, CRISPR/Cas9 se combina con una plantilla de ADN donante que proporciona la información genética para reparar un error innato o introducir mutaciones en genes sanos. Primeros informes destacando la notable capacidad de CRISPR/Cas9 para catalizar la reparación dirigida por homología indican (directa o indirectamente) que el proceso se produjo en una manera altamente precisa24,34. Nuestro laboratorio ha estado estudiando reparación dirigida por homología o corrección génica usando oligonucleótidos de cadena simple en un intento para definir el mecanismo y el circuito regulador que rodea15,17,18 ,23. Nos hemos centrado principalmente en el gene de la edición de mutaciones puntuales, ya que es la mutación genética más básica conocida por ser responsable de muchos trastornos hereditarios. Nuestros conocimientos básicos de edición de gene nos llevaron a cuestionar la precisión de la actividad CRISPR/Cas9 en estas reacciones, desde la función CRISPR/Cas9 en resultados de knockout de genes en la formación de indels. Utilizamos un sistema modelo bien definido, en lugar de un gen no seleccionable pero clínicamente relevante, para el estudio de mutagénesis in situ de una manera decididamente reduccionista. Mediante el uso de un gen simple objetivo, al que gene corrección puede medirse a nivel genotípico y fenotípico, razonamos que heterogeneidad que ocurre en el sitio de destino podría identificar de manera fiable y robusta.
Nuestros datos confirman que el gen bien establecido sistema de edición, que consta de un mutante eGFP gen integrado en células HCT116, puede ofrecer información fundamental con respecto a la generación de lesiones genéticas y el proceso de mutagénesis in situ. Moléculas de ADN de donantes del oligonucleótido CRISPR/Cas9 y sola trabajando en tándem pueden conducir a la reparación precisa de la mutación de punto en el gen eGFP. Proponemos un nuevo modelo para la reparación de las mutaciones de punto, un camino molecular en el cual el ADN donante actúa como una plantilla de replicación para la reparación de la base mutante, un proceso que hemos denominado exactamente30. La población objetivo, no exhibe el fenotipo corregido, muestra una variedad de células que contienen heterogéneos y ampliamente desde ADN indels que rodea el sitio de destino. En aproximadamente la mitad los clones aislados de la población sin corregir, mutagénesis de eliminación se observó en el sitio de destino. Puesto que no hay informe anterior ha indicado que monocatenario oligonucleótidos actúan como agente único herramientas de edición de gen pueden inducir indels en el sitio de destino, concluimos que la actividad CRISPR/Cas9 es responsable de estas mutaciones.
En este manuscrito, proporcionamos una metodología detallada para que la heterogeneidad genética en el sitio de destino puede medirse de manera fiable y robusta. Mientras que una enorme cantidad de atención se ha prestado al análisis y mapeo de mutagénesis fuera del sitio, es probable que una mutación heterogénea creado en el sitio de destino tendrá un mayor efecto sobre el éxito o fracaso del gene de edición en el ámbito clínico. Tecnologías adicionales o proteínas modificadas Cas9 pueden ser requeridas para mejorar la precisión de la reparación dirigida por homología de errores innatos en células de mamíferos35. Algunas de estas tecnologías incluyen el uso de oligonucleótidos auxiliares para actuar como un puente, sosteniendo los extremos cromosómicos juntos y evitar la acción destructiva de NHEJ. Definir el grado de heterogeneidad en el sitio de destino como resultado de la actividad de edición de gene es y debe ser una parte importante de cualquier protocolo diseñado para la intervención terapéutica.
Divulgaciones
Los autores no tener nada que revelar.
Agradecimientos
Los autores no tienen ninguna agradecimientos.
Materiales
| Name | Company | Catalog Number | Comments |
| McCoy’s 5A Modified medium | ATCC | 30-2007 | |
| Fetal Bovine Serum (FBS) | ATCC | 30-2020 | |
| L-glutamine | ATCC | 30-2214 | |
| Penicillin-Streptomycin Solution | ATCC | 30-2300 | |
| Dulbecco's Phosphate Buffered Saline | ATCC | 30-2200 | No Calcium or magnesium |
| Trypsin EDTA Solution | ATCC | 30-2101 | |
| Aphidicolin 1mg | Thermo Fisher | AC611970010 | |
| Alt-R CRISPR crRNA, 10 nmol | IDT | No catalog number since its made to your specific gene target. | |
| CRISPR-Cas9 tracrRNA, 20 nmol | IDT | 1072533 | |
| S.p. Cas9 Nuclease 3NLS, 500 µg | IDT | 1074182 | |
| IDTE Buffer | IDT | 11-01-03-01 | |
| Zeus Electroporation Cuvettes 0.4 Cm | VWR | 10497-474 | |
| Gene Pulser Xcell Electroporation Systems | BioRad | 1652660 | |
| Bovine serum albumin lyophilized powder, crystallized, ≥98.0% (GE) | Sigma | 05470-1G | |
| EDTA (0.5 M), pH 8.0 | ThermoFisher Scientific | AM9260G | |
| Propidium Iodide - 1.0 mg/mL Solution in Water | ThermoFisher Scientific | P3566 | |
| DNeasy Blood & Tissue Kit (250) | Qiagen | 69581 | |
| 6-well Standard Line Multiwell Cell Culture Plates | VWR | 10062-892 | |
| Petri Dishes | Fisher | 12-565-90 | |
| Conical Tubes (15 mL) (racked) | Thermo Fisher | AM12500 | |
| Trypan Blue Solution, 0.4% | Thermo Fisher | 15250061 | |
| Reduced Serum Medium | Thermo Fisher | 31985062 |
Referencias
- Mandecki, W. Oligonucleotide-directed double-strand break repair in plasmids of Escherichia coli: a method for site-specific mutagenesis. Proc Natl Acad Sci. 83 (19), 7177-7181 (1986).
- Walder, R. Y., Walder, J. A. Oligodeoxynucleotide-directed mutagenesis using the yeast transformation system. Gene. 42 (2), 133-139 (1986).
- Moerschell, R. P., Tsunasawa, S., Sherman, F. Transformation of yeast with synthetic oligonucleotides. Proc Natl Acad Sci. 85 (2), 524-528 (1988).
- Yoon, K., Cole-Strauss, A., Kmiec, E. B. Targeted gene correction of episomal DNA in mammalian cells mediated by a chimeric RNADNA oligonucleotide. Genetics. 93, 2071-2076 (1996).
- Beetham, P. R., Kipp, P. B., Sawycky, X. L., Arntzen, C. J., May, G. D. A tool for functional plant genomics: chimeric RNA/DNA oligonucleotides cause in vivo gene-specific mutations. Proc Natl Acad Sci U S A. 96 (15), 8774-8778 (1999).
- Bertoni, C., Morris, G. E., Rando, T. A. Strand bias in oligonucleotide-mediated dystrophin gene editing. Hum Mol Gen. 14 (2), 221-233 (2004).
- Alexeev, V., Yoon, K. Stable and inheritable changes in genotype and phenotype of albino melanocytes induced by an RNA-DNA oligonucleotide. Nat Biotechnol. 16 (13), 1343-1346 (1998).
- Zorin, B., Hegemann, P., Sizova, I. Nuclear-gene targeting by using single-stranded DNA avoids illegitimate DNA integration in Chlamydomonas reinhardtii. Eukaryot Cell. 4 (7), 1264-1272 (2005).
- Brachman, E. E., Kmiec, E. B. DNA replication and transcription direct a DNA strand bias in the process of targeted gene repair in mammalian cells. J Cell Sci. 117 (Pt 17), 3867-3874 (2004).
- Pierce, E. A., et al. Oligonucleotide-directed single-base DNA alterations in mouse embryonic stem cells. Gene Ther. 10 (1), 24-33 (2003).
- Radecke, S., Radecke, F., Peter, I., Schwarz, K. Physical incorporation of a single-stranded oligodeoxynucleotide during targeted repair of a human chromosomal locus. J Gene Med. 8 (2), 217-228 (2006).
- Bertoni, C., Rustagi, A., Rando, T. A. Enhanced gene repair mediated by methyl-CpG-modified single-stranded oligonucleotides. Nucleic Acids Res. 37 (22), 7468-7482 (2009).
- Andrieu-Soler, C., et al. Stable transmission of targeted gene modification using single-stranded oligonucleotides with flanking LNAs. Nucleic Acids Res. 33 (12), 3733-3742 (2005).
- Olsen, P. A., Randol, M., Krauss, S. Implications of cell cycle progression on functional sequence correction by short single-stranded DNA oligonucleotides. Gene Ther. 12 (6), 546-551 (2005).
- Engstrom, J. U., Kmiec, E. B. DNA replication, cell cycle progression and the targeted gene repair reaction. Cell Cycle. 7 (10), 1402-1414 (2008).
- Aarts, M., te Riele, H. Parameters of oligonucleotide-mediated gene modification in mouse ES cells. J Cell Mol Med. 14 (6b), 1657-1667 (2010).
- Brachman, E. E., Kmiec, E. B. Gene repair in mammalian cells is stimulated by the elongation of S phase and transient stalling of replication forks. DNA Repair. 4 (4), 445-457 (2005).
- Engstrom, J. U., Suzuki, T., Kmiec, E. B. Regulation of targeted gene repair by intrinsic cellular processes. BioEssays. 31 (2), 159-168 (2009).
- Parekh-Olmedo, H., Ferrara, L., Brachman, E., Kmiec, E. B. Gene therapy progress and prospects: targeted gene repair. Gene Ther. 12 (8), 639-646 (2005).
- Olsen, P. A., Randol, M., Luna, L., Brown, T., Krauss, S. Genomic sequence correction by single-stranded DNA oligonucleotides: role of DNA synthesis and chemical modifications of the oligonucleotide ends. J Gene Med. 7 (12), 1534-1544 (2005).
- Wang, Z., Zhou, Z. -. J., Liu, D. -. P., Huang, J. -. D. Double-stranded break can be repaired by single-stranded oligonucleotides via the ATM/ATR pathway in mammalian cells. Oligonucleotides. 18 (1), 21-32 (2008).
- Ferrara, L., Kmiec, E. B. Camptothecin enhances the frequency of oligonucleotide-directed gene repair in mammalian cells by inducing DNA damage and activating homologous recombination. Nucleic Acids Res. 32 (17), 5239-5248 (2004).
- Ferrara, L., Parekh-Olmedo, H., Kmiec, E. B. Enhanced oligonucleotide-directed gene targeting in mammalian cells following treatment with DNA damaging agents. Exp Cell Res. 300 (1), 170-179 (2004).
- Lin, S., Staahl, B., Alla, R. K., Doudna, J. A. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery. eLife. 3, 04766 (2014).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature Biotechnol. 31 (9), 827-832 (2013).
- Rivera-Torres, N., et al. The position of DNA cleavage by TALENs and cell synchronization influences the frequency of gene editing directed by single-stranded oligonucleotides. PLoS One. 9 (5), (2014).
- Strouse, B., Bialk, P., Niamat, R. a., Rivera-Torres, N., Kmiec, E. B. Combinatorial gene editing in mammalian cells using ssODNs and TALENs. Sci Rep. 4 (ii), 3791 (2014).
- Bialk, P., Rivera-Torres, N., Strouse, B., Kmiec, E. B. Regulation of Gene Editing Activity Directed by Single-Stranded Oligonucleotides and CRISPR/Cas9 Systems. PloS One. 10 (6), e0129308 (2015).
- Yu, C., et al. Small Molecules Enhance CRISPR Genome Editing in Pluripotent Stem Cells. Cell Stem Cell. 16 (2), 142-147 (2015).
- Rivera-Torres, N., Banas, K., Bialk, P., Bloh, K. M., Kmiec, E. B. Insertional Mutagenesis by CRISPR/Cas9 Ribonucleoprotein Gene Editing in Cells Targeted for Point Mutation Repair Directed by Short Single-Stranded DNA Oligonucleotides. PLoS One. 12 (1), e0169350 (2017).
- Mali, P., et al. CAS9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering. Nat Biotechnol. 31 (9), 833-838 (2013).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Richardson, C. D., Ray, G. J., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nature Biotechnol. 34 (3), 339-344 (2016).
- Slaymaker, I. M., Gao, L., Zetsche, B., Scott, D. A., Yan, W. X., Zhang, F. Rationally engineered Cas9 nucleases with improved specificity. Science. 351 (6268), 84-88 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados