Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Registro actividad electromagnética cerebral durante la administración del xenón gaseoso agentes anestésicos y óxido nitroso en voluntarios sanos
En este artículo
Resumen
Electroencefalograma (EEG) y magnetoencefalografía simultánea proporciona una útil herramienta para buscar mecanismos comunes y distintas macro escala de reducciones en la conciencia inducida por anestésicos diferentes. Este artículo ilustra los métodos empíricos que subyace a la grabación de los datos de los seres humanos sanos durante la anestesia de N-Methyl-D-Aspartate-(NMDA)-receptor-antagonist-based durante la inhalación de óxido nitroso y xenón.
Resumen
Anestesia proporciona sin duda una de las formas sólo sistemáticas para el estudio de los correlatos neuronales de global de consciencia/inconsciencia. Sin embargo hasta la fecha la mayoría neuroimagen o investigaciones neurofisiológicas en los seres humanos se han confinado al estudio de los anestésicos γ-Amino-Butyric-Acid-(GABA)-receptor-agonist-based, mientras que los efectos de la N-Methyl-D-Aspartate-(NMDA) disociativo- basado en el antagonista de receptor de anestésicos ketamina, óxido nitroso (N2O) y xenón (Xe) son en gran parte desconocidos. Este artículo describe los métodos subyacentes la grabación simultánea de Magnetoencefalografía (MEG) y Electroencefalografía (EEG) de hombres sanos durante la inhalación de los agentes anestésicos gaseosos N2O y Xe. Combinando datos de MEG y EEG permite la evaluación de la actividad electromagnética cerebral durante la anestesia en la alta resolución espacial, temporal y moderada. Aquí describimos un protocolo detallado, refinado en varias sesiones de grabación, que incluye el tema reclutamiento, configuración de equipos de anestesia en la sala de escáner de MEG, recopilación de datos y análisis de datos básicos. En este protocolo cada participante está expuesto a diferentes niveles de Xe y N2O en un diseño cruzado de medidas repetidas. Después de base relevante participantes grabaciones están expuestos a aumento de step-wise inspiraron en concentraciones de Xe y N2O de 8, 16, 24 y 42% y 16, 32 y 47% respectivamente, durante el cual su nivel de sensibilidad se realiza un seguimiento con un auditivo tarea de rendimiento continuo (aCPT). Se presentan resultados de una serie de grabaciones para resaltar las propiedades de sensor de nivel de los datos en bruto, la topografía espectral, la minimización de los movimientos de la cabeza y los efectos dependientes nivel inequívocos en las respuestas evocadas auditivas. Este paradigma describe un acercamiento general a la grabación de señales electromagnéticas asociadas con la acción de diferentes tipos de gases anestésicos, que pueden ser fácilmente adaptados para utilizarse con agentes anestésicos volátiles e intravenosos. Se espera que el método descrito puede contribuir a la comprensión de los mecanismos de la macro escala de anestesia permitiendo extensiones metodológicas que implican fuente espacio la proyección de imagen y análisis funcional de la red.
Introducción
Existe buen consenso entre evidencia neurocientífica preclínicos y clínico que sugieren que el fenómeno de la conciencia humana depende de la integridad de los circuitos neuronales explícitos. La observación que dichos circuitos son sistemáticamente influenciadas por el descenso en la inconsciencia ha justificado la necesidad de técnicas de neuroimagen utilizados durante la anestesia y permitir 'navegar' en la búsqueda de los correlatos neuronales de conciencia. Con la posible excepción del sueño, la anestesia representa el único método por el cual uno puede, de manera controlada, reversible y reproducible, perturban y diseccionar así, los mecanismos que el servir a conciencia, especialmente en la escala macroscópica de dinámica global del cerebro. Clínicamente, la anestesia general puede definirse como un estado de hipnosis/inconsciencia, inmovilidad y analgesia y sigue siendo una de las intervenciones médicas más abundantemente utilizadas y más seguras. A pesar de la claridad y eficacia en el resultado final, existe gran incertidumbre con respecto a los mecanismos de acción de los distintos tipos de agentes, dando lugar a inconsciencia inducida por anestesia1.
Los anestésicos pueden dividirse en agentes intravenosos especialmente propofol y los barbitúricos o agentes volátiles/gaseosos como el sevoflurano, isoflurano, el óxido nitroso (N2O) y xenón (Xe). La farmacología de la anestesia ha sido bien establecida con varios destinos celulares identificados como vinculados a la acción anestésica. Mayoría de los agentes estudiados fecha acto principalmente mediante el agonismo de la actividad mediada por receptores de γ-Amino-Butyric-Acid-(GABA). En contraste, la ketamina agentes disociativos, Xe y N2O se cree que ejercen sus efectos principalmente apuntando a N-Methyl-D-Aspartate-(NMDA) glutamatérgicos receptores2,3. Otros importantes objetivos farmacológicos incluyen canales de potasio, receptores de la acetilcolina y los receptores de glutamato del remanente, AMPA y kainato, sin embargo la medida de su contribución a la acción anestésica se mantiene esquiva (para una revisión completa véase 4).
El grado de variabilidad en el mecanismo de acción y los efectos fisiológicos y neuronales observados de los diferentes tipos de agentes hace difícil que la derivación de conclusiones generales sobre su influencia en el proceso consciente. Pérdida de conciencia (LOC) inducida por agentes GABAérgicos típicamente se caracteriza por un cambio global en la actividad cerebral. Esto es evidente en la aparición de gran amplitud, baja frecuencia delta (δ, 0.5-4 Hz) las ondas y la reducción de actividad de la gamma (γ, 35-45Hz) en el electroencefalograma (EEG), similar al lento de la onda de alta frecuencia, sueño5,6 así como las reducciones generalizadas en sangre cerebral caudal y glucosa metabolismo5,6,7,8,9,10,11,12 . Boveroux et al. 13 agregada a tales observaciones demostrando una disminución significativa en la reclinación de conectividad funcional del estado bajo anestesia de propofol con la proyección de imagen de resonancia magnética funcional (fMRI). En contraste, anestésicos disociativos producen menos claro el perfil de efectos sobre la actividad cerebral. En algunos casos, se asocian con aumentos en sangre cerebral caudal y glucosa metabolismo14,15,16,17,18,19, 20,21 mientras que los estudios de Rex y sus colegas22 y Laitio y colegas23,24 mirando los efectos del Xe proporciona evidencia de ambos aumentaron y disminuyeron el cerebro actividad. Una irregularidad similar puede verse en los efectos sobre el EEG señales25,26,27,28. Johnson et al. 29 demostraron un aumento en la energía total de la baja frecuencia bandas delta y theta, así como en la mayor gamma de banda de frecuencia en una estudio de EEG de anestesia Xe mientras que se realizaron observaciones opuestas para el N2O en el delta, de alta densidad theta y bandas de frecuencias alfa de30,31 y Xe en el más alto de frecuencias32. Tal variabilidad en los efectos del Xe en la actividad eléctrica del cuero cabelludo puede observarse en la alfa y gamas de frecuencia beta también con ambos aumenta33 y reducciones34 divulgando.
A pesar de las discrepancias mencionadas anteriormente, la imagen empieza a ser más consistente a través de los agentes cuando uno intenta ver alteraciones en la conectividad funcional entre áreas del cerebro. Sin embargo, estas medidas han sido predominantemente restringidas a las modalidades que necesariamente hacen concesiones con respecto a la resolución espacial o temporal. Mientras que los estudios usando el EEG parecen revelar clara y hasta cierto punto constante, cambios en la estructura topológica de redes funcionales durante la anestesia/sedación con propofol35, sevoflurane36 y N2O37, el datos EEG muy espaciados sensor tienen suficiente resolución espacial significativo definir y delinear los vértices de las redes funcionales correspondientes. Por el contrario, estudios utilizando la resolución espacial superior de fMRI y tomografía por emisión de positrones (PET), encuentran alteraciones topológicas similares en conectividad funcional a gran escala a la de EEG13,38,39 ,40,41, sin embargo posee escasa resolución temporal para caracterizar la fase amplitud en la banda (8-13 Hz) EEG alfa y otros fenómenos dinámicos que están surgiendo como importantes firmas de acción anestésica12,42. Por otra parte, estas medidas no evaluar directamente actividad neural electromagnética43.
Por lo tanto, para avanzar significativamente en la comprensión de los procesos macroscópicos relacionados con la acción de los anestésicos, las limitaciones de las investigaciones anteriormente mencionadas deben abordarse; la cobertura limitada de los agentes anestésicos y la resolución espacio-temporal insuficiente de las mediciones no invasivas. Sobre esta base, los autores describen un método para grabar simultáneamente equipo (MEG) y la actividad EEG en voluntarios sanos que se ha desarrollado para la administración de los agentes anestésicos disociativos gaseosos, Xe y N2O.
La MEG es utilizada ya que es la técnica neurofisiológica sólo no invasivo que no sea el EEG que tiene una resolución temporal en la gama del milisegundo. EEG tiene un problema de confusión de campos eléctricos por el cráneo, que actúa como un filtro de paso bajo en la actividad cortical generada, mientras MEG es mucho menos sensible a este tema y el tema de la conducción de volumen44. Se puede argumentar que MEG tiene más espacial y precisión de localización de EEG 45,46la fuente. EEG no permite verdadera grabación libre de referencia37,47, sin embargo hace de MEG. Sistemas de MEG también suelen registran actividad cortical en una gama de frecuencia mucho más amplia que el EEG, incluyendo gamma alta48(típicamente 70-90 Hz), que se han sugerido para ser implicados en los efectos hipnóticos de agentes anestésicos como Xe29 y N 2 O28. La MEG ofrece actividad neurofisiológica que complementa que transmitía por EEG, como actividad de EEG se relaciona con las corrientes eléctricas extracelulares mientras que MEG refleja principalmente los campos magnéticos generados por corrientes intracelulares46, 49. por otra parte, MEG es particularmente sensible a la actividad electrofisiológica tangencial a la corteza, mientras que el EEG registra principalmente extracelular actividad radial a la corteza49. Así, combinando datos de MEG y EEG tiene ventajas súper aditivo50.
Los agentes disociativos gaseoso Xe y N2O han sido elegidos por las siguientes razones de principio: son inodoro (Xe) o esencialmente inodoro (N2O) y por lo tanto pueden ser utilizados fácilmente en presencia de condiciones de control cuando trabajan en concentraciones sub-clínicas. Además, son aptos para administración remota y seguimiento en un entorno de laboratorio debido a sus efectos depresores cardio-respiratorio débil61. Xenon y a un menor grado N2O, retener un mínimo relativamente bajo-alveolar - concentración-(MAC)-despierto en que 50% de los pacientes dejen de responder a un comando verbal con valores de 32,6 ± 6.1%51 y52 de 63,3 + - 7.1% respectivamente. A pesar de Xe y N2O tanto ser antagonistas de los receptores NMDA, modulan el EEG diferentemente - Xe parece comportarse más como un agente típico de GABAérgico cuando supervisar mediante el índice biespectral33,53,54 (uno de varios métodos usados para monitorear electroencephalographically profundidad de la anestesia). En cambio, N2O produce un efecto electroencephalographic mucho menos aparente en que es mal, si en todos, supervisar mediante el índice biespectral26. Porque Xe tiene diferentes propiedades electroencephalographic informadas a los otros agentes disociativos, pero posee características similares a los agentes más comúnmente estudiados de GABAérgico, su estudio electrofisiológico tiene el potencial para revelar importantes características relativas a los correlatos neuronales de la conciencia y los cambios de red funcional correspondiente. Agentes que actúan en el receptor NMDA están probables que revelan más acerca de las redes cerebrales que favorecen la conciencia normal y alterada, dado el papel crítico que mediada por el receptor NMDA actividad desempeña en el aprendizaje y la memoria y su papel implicado en una gama de trastornos psiquiátricos que incluyen la esquizofrenia y la depresión80.
Este documento se centra principalmente en el exigentes y complejas datos colección procedimiento asociado con la entrega de los agentes anestésicos gaseosos en medio no hospitalario mientras se graban simultáneamente MEG y EEG. Análisis de los datos básicos en el nivel del sensor se contornea y se proporcionan datos de ejemplo mostrando que se pueden obtener grabaciones de alta fidelidad con un mínimo movimiento de la cabeza. No se describen los muchos métodos posibles para fuente posterior proyección de imagen o funcionales conectividad análisis que se realizan normalmente utilizando este tipo de datos, ya que estos métodos están bien descritos en la literatura demuestran diversas opciones para Análisis de55,56.
Protocolo
El estudio titulado "Efectos de la inhalación Xe y N2O en la actividad cerebral registrada mediante EEG y MEG" fue aprobado (número de aprobación: 260/12) por el Hospital de Alfred y el Comité de ética de la Universidad de Swinburne de la tecnología y los requisitos de la nacional Declaración sobre la conducta ética en la investigación humana (2007).
1. participante selección y pre-estudios requisitos
- Realizar una entrevista para seleccionar machos sanos, zurdos, adultos entre las edades de 20 y 40 años de edad.
- Confirmar un estado de buena salud general mediante la obtención índice de masa corporal (IMC del participante) y la falta de contraindicaciones de la IRM o MEG (como implantados metálicos cuerpos extraños), así como recoger una historia médica detallada incluyendo cualquier cirugías previas, lo importante es que cualquier reacción desfavorable a la anestesia general que daría lugar a la exclusión del estudio.
- Específicamente excluye cualquier ingesta reciente de medicamento psicoactivo o de otro, así como garantizar la ausencia de cualquier uso de drogas recreativas y la falta de cualquier trastorno neurológico, epilepsia, enfermedades del corazón, apnea del sueño, enfermedad de movimiento y claustrofobia. Como será posteriormente importante obtener un buen sello con una máscara anestésica excluir a participantes con grandes barbas, a menos que estén dispuestos a afeitarse.
Nota: Excluye las hembras debido a los efectos documentados de extremos57 o edad de la menstruación en la señal de EEG/MEG descansa, así como la creciente propensión a náuseas y vómitos58.
- Siga el procedimiento de anestesia general de estancia de día como señalado en Australia y Nueva Zelanda Colegio de anestesistas directrices (ANZCA) (documento PS15).
- En línea con estas directrices, pedir los temas rápido durante al menos 6 horas y no consumir ningún líquido durante al menos 2 horas antes del inicio del experimento. Confirmar el cumplimiento con el anestesiólogo en contacto con el participante el día antes de la prueba tiene lugar.
- Después de la terminación del experimento, tienen temas experimentar la poste estándar de anestesia cuidado supervisión indicando a que no se operar cualquier maquinaria o tomar decisiones importantes dentro de las 24 horas del experimento (debido a la posibilidad de bajo nivel residual deterioro cognitivo de Xe y N2O).
2. instalaciones y equipos
Nota: Las instalaciones están conforme a requisitos ANZCA para el suministro de anestesia fuera de un conjunto operativo quirúrgico normal (http://www.anzca.edu.au/resources/professional-documents. Documento PS55). En concreto, la sala satisface regulaciones ingeniería eléctrica administración médica seguridad y gas.
- Ejecutar el experimento en el laboratorio de la Swinburne centro de tecnología avanzada proyección de imagen del cerebro, es decir, la habitación de MEG que contiene un cuarto blindado magnéticamente (MSR) que alberga el escáner de MEG. La sala blindada se sienta en un piso flotante aislado de movimientos ambientales como pasar los trenes.
- Suministrar gases de anestesia mediante una máquina de anestesia, situado fuera de la MSR, capaz de la entrega y monitoreo de xenón gaseoso. Esta máquina de anestesia está especialmente diseñada para administrar cerrado bajo flujo gas Xe y para medir las concentraciones Xe de fin-de marea usando katharometry (conductividad térmica, precisión de ± 1%), además de proporcionar el seguimiento de pacientes estándar de atención. Esto incluye el fin-de marea O2, CO2, N2O medida (cuando proceda), pulso oximetría, ECG de 3 derivaciones y medición de la presión arterial no invasiva (NIBP) según ANZCA pauta documento PS18. Medir el fin-de marea N2O las concentraciones utilizando espectroscopia infrarroja en la máquina de anestesia.
- Tubo de los gases a los participantes con diámetro de 22 mm largo mangueras atravesando conductos MSR de respiración.
- Proporcionar monitorización estándar de atención del paciente según ANZCA pauta documento PS18. Esto incluye el fin-de marea O2, CO2, N2O medida (cuando proceda), pulso oximetría, ECG de 3 derivaciones y medición de la presión arterial no invasiva (NIBP).
- Monitor presión según ANZCA pauta documento PS18 usando a un monitor de presión arterial no invasiva ubicado fuera de la MSR y conectada por un tubo largo de inflación a un manguito colocado en el brazo.
- Durante todo el experimento, registrar y documentar los parámetros fisiológicos todos a intervalos de 1 minuto además de un registro automatizado de todos los parámetros cada 30 s.
- Asegúrese de que los gases se canaliza a los participantes con diámetro de 22 mm largo mangueras atravesando conductos MSR de respiración. Un sistema de aspiración se encuentra fuera de la MSR y un tubo de entrega largo, conectado a un Yankauer, tubo de succión se transmite a través de un conducto para colocarse cerca el observador paciente y clínico.
- Además, asegúrese de cuencas de vómito se encuentran cerca en el MSR para facilitar su rápida colocación del observador sobre la ocurrencia de emesis. El observador clínico en el MSR tendrá que permanecer alerta a cualquier obstrucción de la vía aérea, responde inicialmente con un mentón levante o empuje de la quijada y suspender inmediatamente el Protocolo si vómito inminente se señala por la ingestión excesiva o retching o vía aérea obstrucción no se resuelve por la vida de la barbilla o la mandíbula de empuje.
- Registro EEG utilizando una MEG compatible 64 canales Ag/AgCl electrodo tapa conectada a una batería de potencia amplificador dentro de la MSR. El amplificador está conectado mediante un cable de fibra óptica y un convertidor de medios adecuados para un portátil ejecutando un software de adquisición compatibles.
- Actividad de campo magnético cerebro registro (MEG) a una velocidad de muestreo de 1000 Hz mediante un sistema de MEG que tiene cobertura de todo el cerebro y bien ha definido matrices de sensores que pueden incluir magnetómetros y gradiometers axial/planar; el presente estudio utilizando un sistema compuesto por 102 magnetómetros y 204 gradiometers planares. Para evitar complejidades no directamente pertinentes para el protocolo o la configuración del sistema MEG, datos de ejemplo de los magnetómetros solo divulga, aunque datos de magnetómetro y gradiómetro se adquirieron como parte del protocolo.
- Jefe de pista posición continuamente usando 5 bobinas de indicador (HPI) de posición de la cabeza. Digitalizar la ubicación de las bobinas de cabeza, electrodos de EEG y marcadores fiduciales (nasion y preauricular derecha e izquierda) antes de MEG análisis mediante adecuada digitalización de equipos.
- Porque el objetivo es obtener resultados en el espacio de la fuente, desactivar cualquier sistema blindaje activo interno empleado por el sistema de MEG para cancelación de ruido tridimensional, para hacer la canalización de procesamiento flexible con respecto a la utilización del espacio de señal métodos de separación (SSS) que se emplean normalmente.
- Utilizar un escáner de MRI para obtener correspondientes T1-weighted estructurales escáneres cerebrales para más adelante co-registro con las grabaciones de M/EEG.
3. estudio de diseño y protocolo
Nota: Se sigue un protocolo experimental de cruce de dos vías. Realizar dos sesiones de pruebas separadas para cada tema separado por un máximo de cuatro semanas entre las sesiones de prueba. Un brazo del estudio consiste en la administración de Xe mientras N2O se da en el segundo brazo. Los participantes son ciegos para el tipo de gas que se administra al mismo tiempo el personal médico y los investigadores son no debido a las ligeras diferencias en el procedimiento seguidos para su administración.
- Después se obtiene el consentimiento informado, confirmar elegibilidad de participantes con una entrevista extensa historia clínica y las mediciones de signos vitales que incluyen la presión arterial, frecuencia cardiaca, cuerpo temperatura y pico espiratorio flujo. Después se confirma la elegibilidad del participante, el sujeto somete a una medida breve de la MEG para asegurarse de que no existen imprevistos fuentes de ruido.
- Coloque la tapa de EEG en cabeza del sujeto y todos los electrodos de gel. Coloque las 5 bobinas HPI en la tapa para registrar continuamente la posición del cabezal en el MEG.
- Digitalización de los canales de EEG, HPI bobina posiciones y puntos extra en la nariz del sujeto y almacenar todas las ubicaciones utilizando el paquete de software que lo acompaña de MEG.
- Hacia el tema de la MSR, conecte la tapa del electrodo los electrodos EEG amplificador y volver a gel si es necesario para asegurar que sus impedancias contacto eléctricos por debajo de 5 kΩ.
- Además de la MEG y la EEG, grabar tres bio-canal bipolar adicional.
- Porque la administración del agente anestésico se asocia con cambios en el tono muscular, registro la electromiografía (EMG) con un par de electrodos de Ag/AgCl solo uso coloca submentally para grabar la actividad de los músculos del milohioideo y digástrico (vientre anterior).
- Grabar el electrooculograma (EOG) colocando un par de electrodos por encima de uno de los ojos, cerca de la ceja y cerca el canto lateral correspondiente y hacer grabaciones de tres conductores Electrocardiograma (ECG) utilizando electrodos en cada muñeca y un codo de tierra (véase Figura 1).
- Pida a los participantes para mantener los ojos cerrados durante todas las fases de la grabación del experimento.
- Realizar el manejo clínico del sujeto con un anestesiólogo y una enfermera de anestesia u otro observador clínico debidamente capacitado. Tiene el enfermero/observador sentarse con el sujeto en el MSR para monitorear la condición del participante (en particular el sello de la máscara facial y vía aérea del sujeto) y el anestesiólogo, situado en la sala de control para gestionar el suministro de gas y electrónico monitoreo.
- Recopilar datos en un equipo de tres personas: un miembro del seguimiento y control de la adquisición de la MEG la señal, otra de seguimiento y control de la adquisición de EEG y otro comenzar y detener la tarea de rendimiento continuo auditivo automatizado mientras que monitoreo de las respuestas de los sujetos, coordinación de todos los tiempos experimentales y registro de minutos la presión arterial y las concentraciones de gases de fin-de marea y tasa de flujo de gas proporcionado por el anestesiólogo.
- Monitorear continuamente visualmente el participante en el MSR mediante una cámara adecuada, que también registra todas las fases del experimento para la posterior evaluación y revisión.
- Su comportamiento medir el nivel actual de la sensibilidad durante todo el experimento usando una tarea de rendimiento continuo auditivo (aCPT). Usar auriculares compatibles de MEG para entregar un tono auditivo binaural de la frecuencia de 1 o 3 kHz de amplitud estéreo fijo (aprox. 76 dBA), con un intervalo inter-estímulo de entre 2 a 4 segundos de una distribución uniforme.
- Pregunte al participante a responder lo más rápidamente posible utilizando dos cajas de botón separado en cada mano. Utilice la izquierda y botones de la derecha de cada cuadro corresponden a un bajo o un tono de alta frecuencia, respectivamente, y cajas de la tecla izquierda y derecha, respectivamente, para que el participante indicar la ausencia o presencia de náuseas.
- Vigilar estrechamente la respuesta durante todo el experimento. La latencia de tiempo de reacción y exactitud (porcentaje de tonos clasificados correctamente) de las respuestas se registran automáticamente así como visualizado en un monitor fuera el MSR para los investigadores obtener una indicación en tiempo real de los participantes comportamiento Estado.
- Tras múltiples botón derecho secuencial caja respuestas (indicando la náusea), alertar al observador en el MSR y el anestesiólogo administradora que gas administración deba cerrarse bruscamente para evitar el vómito.
- Record ojos cerrados descanso los EEG y MEG por 5 min seguido de una grabación de EEG/MEG de 5 min ojos base cerrada con el tema la tarea de aCPT.
- Quitar al tema de la MSR y permiten una cánula intravenosa de 20 calibre ser colocado en la fosa antecubital izquierda por el anestesiólogo. Antiemético, que ocurre lentamente durante un período de 1-2 minutos, que consiste en dexametasona de 4 mg y 4 mg de ondansetrón59, sigue para evitar que cualquier vómito causada por la inhalación de gas anestésico, que se observa a menudo con N2O en el concentraciones más altas utilizan60.
- Coloque la mascarilla y respirar circuito el tema usando un arnés de presión (CPAP) modificada la apnea positiva continua en las vías respiratorias y evaluar para la comodidad del sujeto y la ausencia de cualquier salida con presión positiva de 5 cm H2O.
- Retomar al tema del MSR a permanecer sentados en el MEGOHMIO para el resto del estudio.
- Tomar una serie de medidas preventivas para garantizar un movimiento limitada sujeto durante las grabaciones de MEG y EEG simultáneas, ya que el movimiento de la cabeza y el cuerpo pueden causar grandes artefactos en grabaciones electromagnéticas y se espera que durante la administración de la agentes anestésicos disociativos debido a su conocida propensión a inducir agitación psicomotora.
- Colocar una tapa a la medida de una densidad baja espuma sin color en la cabeza que asegura la posición de la cabeza dentro del casco de MEG dewar independientemente de su forma y tamaño de la cabeza.
- Además, uso un paño envuelto alrededor de los muslos y los músculos glúteos y aseguró el respaldo de la silla de MEG para reducir al mínimo cualquier flacidez/postura desgarbada que se produce en la posición vertical del participante (ver figura 1).
- Durante la grabación, seguimiento de la posición de la cabeza continuamente con las bobinas HPI, para ver sin conexión después de la terminación del experimento (ver sección de análisis de datos para más detalles).
- Una vez que el participante es colocado de manera segura, administrar 100% inspirado O2 y seguir esto hasta por 30 minutos hasta su fin-de marea O2 concentración es > 90% lo que indica que efectivamente son de-nitrogenadas, un proceso necesario para asegurar mediciones precisas de las concentraciones de gas anestésico extremo-de marea.
- Durante los últimos 5 minutos de denitrogenation, realizar un ojos final 5 minutos cerrado descanso EEG/MEG aCPT la grabación para asegurarse de que cualquier antiemético efectos y denitrogenation que tenga de actividad cerebral puede posteriormente determinada y controlada para.
- Comparar esta tercera grabación de línea de base a las líneas de base anteriores (ojos de resto cerrados sin antiemético y tarea ojos cerrados sin antiemético) para determinar los efectos de los antieméticos y aCPT M/EEG espontáneo/descanso. Las líneas de base se conocen como líneas de base 1, 2 y 3 en el manuscrito de resto ojos cerrados sin antiemético, ojos de tarea cerrados sin antiemético y tarea ojos cerrados con antieméticos, respectivamente.
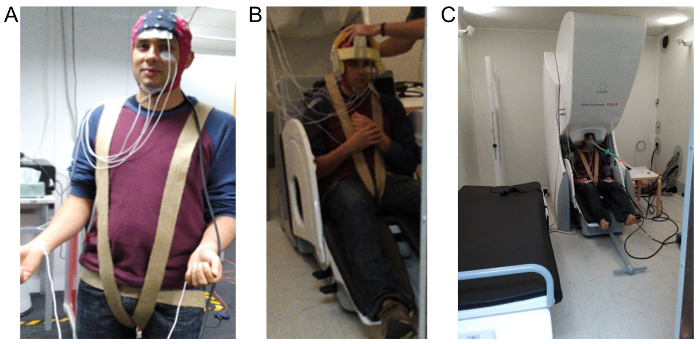
Figura 1 : Imágenes demostrando EEG, EOG, EMG y ECG diseño de electrodo y el general se encuentra en la MSR. (A) muestra la tapa compatible de 64 canales MEG, utilizada para registrar el EEG, EOG se registra utilizando los dos electrodos se muestra colocados por encima y debajo del ojo izquierdo, EMG se registra utilizando los dos electrodos que se colocan debajo de la mandíbula y el ECG se registra mediante dos electrodos colocados en la en la muñeca. (B) muestra la tapa de espuma a medida y arnés utilizado para minimizar el movimiento del objeto durante la grabación. (C) muestra la configuración final necesaria para la administración de anestésica que incluye la colocación de la cabeza dentro de la MEG y adjuntando una ajustada máscara de gas. Haga clic aquí para ver una versión más grande de esta figura.
4. Protocolo de administración de gas
Nota: El protocolo de administración de gas varía ligeramente según el brazo del estudio.
- Administrar Xe en cuatro step-wise aumento de los niveles y N2O tres step-wise aumentar los niveles. Los primeros niveles de gas de tres para cada gas corresponden a niveles equi-MAC-despertar de 0.25 (nivel 1), (nivel 2) de 0.5 y 0.75 (nivel 3) veces la concentración MAC despierta. Estas concentraciones son 8%, 16%, 24% y 16%, 32%, 47% concentraciones para Xe/O2 y N2O/O2, respectivamente.
Nota: El nivel 4 deth para Xe corresponde a 1,3 veces la concentración MAC despierta. - Elegir el nivel de gas 4th para Xe que se espera que el 95% de los participantes pierde la conciencia a este nivel (todos los temas estudiados hasta la fecha han logrado completa pérdida de la sensibilidad durante la tarea de aCPT). Debido a la propensión bien documentada de N2O inducir náuseas y vómitos a altas concentraciones, no incluyen un nivel de N2O en una concentración suficiente para inducir la pérdida de la conciencia en el 95% de los participantes (~ 75%). Figura 2 resume los perfiles de administración de gas.
- Siga el mismo procedimiento experimental para todos equi-MAC Xe y N2O los niveles con excepción de 42% Xe/O2, que requerirá una metodología ligeramente diferente (ver 4.4. abajo).
- Al comienzo de cada nivel, informar al sujeto y observador enfermera anestesia, clínica que administración de gas comenzar y comenzar a grabar el EEG y la MEG, la señal para el anestesiólogo administradora iniciar administración de gas y comenzar la tarea de aCPT. Lavado de gas se produce durante un período de 10 minutos que la concentración de gas fin-de marea del objetivo se alcanza al final de este período y mantenido durante 5 minutos (la supuesta fase estacionaria).
- Al final de este período de estado estacionario de 5 minutos, realizar el lavado-hacia fuera con la administración de 100% O2 durante un período de 10 minutos durante el cual concentración de fin-de marea del gas vuelve a 0.
- Repita el procedimiento para el siguiente nivel de gas de paso.
Nota: Pérdida de la sensibilidad (LOR) para Xe se espera que en el 95% de los participantes en una concentración de 42% Xe/O261. La administración de este nivel se produce en cuanto a los niveles más bajos hasta que el observador enfermera anestesia, clínica y la pérdida de las respuestas de botón indican LOR.
- Una vez lograda la LOR, mantener el nivel de gas Xe durante 10 minutos o hasta que el anestesiólogo o enfermera anestesia, clínica observador considere inseguro continuar después de que fuera lavado con 100% O2 toma lugares. Casos en que el anestesiólogo puede considerarlo inseguro continuar incluyen presionar frecuente del cuadro botón derecho indicando náuseas, ruidos glotal, signos de vómito como salivación excesiva o reacciones vaso-vagales y deglución.
Nota: En este nivel más alto, tenga gran cuidado y establecer un umbral bajo de clínico para la interrupción de la administración de gas Xe. La experiencia el authors' sugiere que este nivel puede estar asociado con una reducción en la ingestión, permitió la acumulación de saliva y la aparición de comportamiento retching, eso si continuar mayo anuncian la regurgitación en la máscara. Naturalmente, las consecuencias de esto podrían incluir aspiración mortal. También es posible que las respuestas menos intensas pueden ocurrir a niveles más bajos de gas y así ejercer un alto nivel de vigilancia durante la administración de todos los niveles de gas paso a paso. Además de estos posibles problemas de las vías respiratorias, ser conscientes de la posibilidad de síncope vasovagal, particularmente en los participantes masculinos más jóvenes. Su edad y las restricciones temporales de líquido y alimentos son todos los factores de riesgo62.

Figura 2 : Resumen de administración de gas perfiles para Xe y N 2O. Concentraciones de gas y línea de tiempo durante el curso de administración para el N2O (superior) y Xe (parte inferior). Los números encima de cada línea de tiempo indican el tiempo en minutos desde el inicio de la primera entrega de gas. Cada nivel de concentración de gas pico equilibrado se alcanza con 10 minutos equilibrando el período, seguido por un estado constante de 5 minutos durante el cual se mantiene la concentración de gas pico equilibrado, y, a continuación, un lavado de 10 minutos. El pico de equilibrado de gas las concentraciones aumentan secuencialmente en el tiempo. Tenga en cuenta que la línea de tiempo de preparación para el experimento, así como el período después de la administración de gas no se muestran. Haga clic aquí para ver una versión más grande de esta figura.
5. estructural exploración
- Antes de la resonancia magnética, colocar cápsulas de vitamina E en la cabeza del participante para ser utilizados como marcadores para resaltar los puntos fiduciales digitalizados para el ápice nasal y preauricular derecha e izquierda. Esto asegura una mejor co-registro de los sensores de MEG/EEG y MRI las exploraciones del cerebro al intentar relacionar la proyección de imagen de fuente EEG/MEG a neuroanatomía basada en MRI.
- Obtener una sola exploración de T1-weighted MRI estructural, ya sea después de la terminación de un brazo del estudio si el participante se siente bien, de lo contrario les pedimos que volver en un día separado para la exploración estructural del cerebro.
6. participante seguimiento
Nota: El tema es libre de irse cuando acompañado por un amigo o pariente.
- Tras una descarga, solicite al participante completar una versión truncada de las 5-Dimensional estados alterados de conciencia escala de calificación (5D-ASC); un cuestionario diseñado para acceder a las diferencias individuales comparando el estado de conciencia normal y alterada por medio de una escala analógica visual63,64.
- Además, solicitar la presentación de una breve narrativa de su experiencia en general durante el experimento, así como detalles específicos acerca de los efectos cualitativos dependiente nivel.
- Tener estos documentos completado y enviado a los investigadores 24 horas después de cada sesión de grabación.
7. Análisis de datos
Nota: Esta sección describe el análisis de los datos básicos a nivel de sensor de EEG/MEG, cubriendo los pasos involucrados en la generación de ejemplos de preprocesados datos de EEG/MEG, espectral topografía, movimientos de la cabeza, puntuación de la capacidad de respuesta y las respuestas evocadas auditivas. El enfoque de este artículo es sobre la ilustración de los ejemplos típicos para que el lector pueda entender las características importantes de los datos registrados. No hay análisis estadísticos intra individuales o de grupo se realizan como el principal objetivo de esta sección del análisis es detalle importante pre-procesamiento pasos que atestiguan la calidad y la integridad de los datos recogidos. No hay detalles se proporcionan para los múltiples análisis que podrían realizarse en este55,datos del56 ya que quedan fuera del alcance de la descripción del método.
- Completar el análisis de datos sin conexión en una computadora de escritorio con software de análisis de datos adecuados y uso de cajas de herramientas pertinentes para el procesamiento de datos EEG y MEG. En la tubería de los autores, utilizar la versión 20160801 del paseo de la caja de herramientas65 .
- Calcular el movimiento de la cabeza durante cada MEG grabación por obtener primero las posiciones de cabeza continuadas como una secuencia de coordenadas cuaternión mediante el análisis de las 5 señales de bobina HPI guardadas como parte de cada uno de lo nivel dependiente y base grabaciones de MEG. Convertir posiciones de la cabeza del cuaternión en coordenadas cartesianas.
- Montar el 6 y 7 grabaciones de N2O y Xe estudian brazos (líneas 1, 2 y 3, niveles 1 a 3 o 1 a 4 del gas respectivamente). Tiempo cambio crudo EEG en relación con datos de la MEG para sincronizar los dos tipos de señal basado en un canal común de gatillo. Esta forma de sincronización surge de la elección del sistema de grabación de EEG.
Nota: Muchos sistemas de MEG contienen un sistema de EEG que ofrece sincronización de nivel electrónico muy exacta de la MEG y la EEG, pero a menudo tienen cuantificación de baja resolución DAC de 16 bits. Por este motivo, utilizar un sistema externo de EEG (véase 2.3) tiene mayor resolución de amplitud EEG de 24 bits para permitir una tolerancia mayor al electrodo compensar potenciales, la medición de la información de baja frecuencia y una respuesta de frecuencia plana en todos los canales. - Para todas las grabaciones que implican el suministro de gas y el rendimiento de la aCPT, redefinir el tiempo cero para el comienzo de tarea gas aCPT.
- Visualmente inspeccione datos MEG y excluir cualquier mal canal de posterior análisis. A continuación, filtrar los datos usando una separación temporal de la señal-espacio algoritmo76 implementado en el software del sistema de MEG. El algoritmo suprime las fuentes de interferencias magnéticas fuera de la matriz del sensor y por lo tanto resulta en una reducción de los artefactos de movimiento de cuerpo rígido o de externos. Importar el conjunto de datos de salida en el software de análisis de datos para ser utilizado con los magnetómetros (102 canales) seleccionados para su posterior procesamiento.
- Pase de banda filtro a MEG 2 a 50 Hz y aplicar filtros de ruido de línea en 50, 100 y 150 Hz. Visual artefacto detección y un procedimiento de detección de artefacto automático implementado en el software de paseo permiten la eliminación de cualquier elemento artifactual. Inspeccione visualmente cualquier segmentos que contiene el ojo parpadea, latidos del corazón o artefactos musculares y excluir de los datos, así como cualquier segmentos correlacionaron con cambios significativos en el movimiento de la cabeza mayor que 5 mm (véase abajo).
Nota: Movimientos de más de 5 mm con respecto al principio de cada línea base 5 minutos o gas equilibrado período se utilizan para rechazar datos MEG continuamente adquiridos desde la proyección de imagen de fuente MEG por lo general tiene una resolución espacial del orden de 5 mm (por ejemplo, para MEG/EEG beamformers55). Es sin embargo posible realizar compensación de movimiento de los datos de la MEG66 en lugar de rechazar segmentos de datos correlacionaron con importante movimiento de la cabeza, sin embargo, tales métodos son más allá del alcance de este documento. - Como con los datos de la MEG, visualmente Inspeccione el EEG de 64 canales raw y excluir cualquier malos canales de más análisis de datos. Pase de banda filtro los datos utilizando las mismas gamas de frecuencia en cuanto a la MEG. Volver a hacer referencia al EEG a una media común como estándar para métodos de proyección de imagen de la fuente. Por último, retire cualquier segmentos que contienen artefactos contemporáneos con los de la MEG correspondiente.
- Para visualizar las propiedades espectrales de los datos de EEG/MEG, computar espectros de amplitud de un solo lado a lo largo de la línea media antero-posterior para los canales EEG FPz, la Cz y la Oz y la línea media frontal, centrales y occipitales MEG magnetómetro canales ( figura 3 ).
- Calcular el mapa topográfico de sensor de nivel de potencia de la banda alfa (8-13 Hz) para MEG/EEG, dado venda alfa fuerte se han observado cambios previamente para el N2O y GABAérgico anestésicos25,31,67 .
- Para los datos de EEG, utilice el canal de FPz como referencia para calcular la potencia de la banda alfa topográfico para mejor poner de relieve cambios de energía alfa.
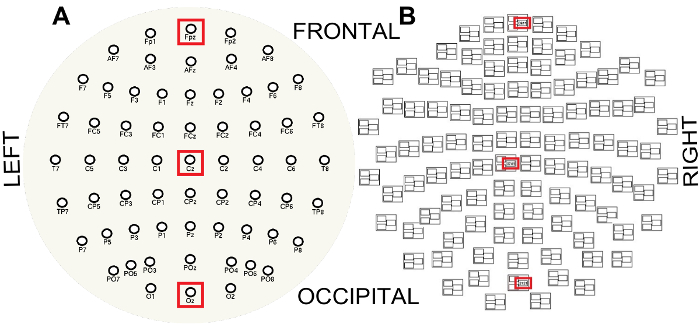
Figura 3 : Diseños de sensores EEG (A) y MEG (B) visto desde la parte superior de la cabeza y aplanado en un plano. Tenga en cuenta la estructura de trío de MEG donde sensores en 1 ### son magnetómetros y sensores en ### 2 o 3 ### gradiometers. Cajas rojas indican los canales a lo largo de la línea media antero-posterior utilizado para visualizar las propiedades espectrales de los canales central y occipital magnetómetro EEG y MEG, FPz (frontal), Cz (central) y Oz (occipital) y frontal, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
- Obtener las respuestas evocadas auditivas para filtrada libre de artefacto MEG y EEG los datos para cada registro que implica la tarea de aCPT. Época las señales de ms-1000 a 2000 m en relación con el tono activan veces y media todo artefacto disponible libre de épocas. Tomar la latencia entre el estímulo disparador generación y entrega del sonido al oído en cuenta, en este caso ms 190,5.
Resultados
Esta sección utiliza datos obtenidos de un tema con el fin de demostrar las características típicas de las grabaciones simultáneas y el potencial de esa información para contribuir a una mejor comprensión de la anestesia inducida por estados alterados de conciencia. Para simplificar la exposición, se muestran resultados para grabaciones i) de la línea de base de administración de post anti emético (referencia 3), ii) 0.75 equi-MAC-despertar las concentraciones máximas del gas (...
Discusión
Este trabajo ha definido un protocolo completo para la grabación simultánea de MEG y EEG durante la entrega de gas anestésico con N2O y Xe. Dicho Protocolo será valioso para el estudio de los correlatos neurales electromagnéticos de reducción inducida por el anestésico en la conciencia. El protocolo pretende generalizar la entrega de otros gases anestésicos como el sevoflurano o isoflurano. Esto facilitará una mayor comprensión de los mecanismos macroscópicos comunes, específicos y distintos que su...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a Mahla Cameron Bradley, Rachel Anne Batty y Johanna Stephens valiosa asistencia técnica con la recopilación de datos de la MEG. Gracias se extienden además a Dr. Steven Mcguigan para apoyo como un segundo anestesiólogo. Paige Pappas proporciona supervisión de enfermería anestésica invaluable. Markus Stone ofreció amablemente su tiempo y experiencia en edición y filmación del protocolo. Dr. Suresh Muthukumaraswamy dio consejos específicos sobre análisis de datos y la interpretación de resultados. Finalmente, Jarrod Gott muchos contribuyó una estimulante discusión, ayudó en la ejecución de una serie de experiencias piloto y fue central en el diseño de la rodillera cabeza de espuma.
Esta investigación fue apoyada por una beca de colaboración de James S. McDonnell #220020419 "Reconstrucción de la conciencia" otorgada a George Mashour, Michael Avidan, Max Kelz y David Liley.
Materiales
| Name | Company | Catalog Number | Comments |
| Neuromag TRIUX 306-channel MEG system | Elekta Oy, Stockholm, SWEDEN | N/A | |
| Polhemus Fastrak 3D system | Polhemus, VT, USA | N/A | |
| MEG compatible ER-1 insert headphones | Etymotic Research Inc., IL, USA | N/A | |
| Low Density foam head cap, MEG compatible | N/A | N/A | Custom made by research team |
| Harness, MEG compatible | N/A | ~3 m long, ~ 5 cm wide, cloth/jute strip to secure participant position on MEG chair | |
| Ambu Neuroline 720 Single Patient Surface Electrodes | Ambu, Copenhagen, Denmark | 72015-K10 | |
| 3.0T TIM Trio MRI system | Siemens AB, Erlangen, GERMANY | N/A | |
| Asalab amplifier system | ANT Neuro, Enschede, NETHERLANDS | N/A | this system is no longer manufactured and has been deprecated to 64 channel eego EEG amplifier |
| 64-channel Waveguard EEG cap, MEG compatible | ANT Neuro, Enschede, NETHERLANDS | CA-138 | size Medium |
| Magnetically shielded cordless battery box | ANT Neuro, Enschede, NETHERLANDS | N/A | Magnetic shielding not provided by manufacturer – Modified by research team |
| OneStep ClearGel Electrode gel | H+H Medizinprodukte GbR, Munster, GERMANY | 154547 | |
| Akzent Xe Color Anesthesia Machine | Stephan GmbH, Gackenbach, GERMANY | N/A | |
| Omron M6-Comfort Blood Pressure Monitor | Omron Healthcare, Kyoto, JAPAN | N/A | |
| Xenon gas (99.999% purity) | Coregas, Thomastown, VIC, AUSTRALIA | N/A | we estimate that we use approx 40 L (SATP) per participant |
| Medical Nitrous Oxide | Coregas, Thomastown, VIC, AUSTRALIA | N/A | x2 G size cylinders |
| Medical Oxygen | Coregas, Thomastown, VIC, AUSTRALIA | N/A | x2 G size cylinders |
| Medical Air | Coregas, Thomastown, VIC, AUSTRALIA | N/A | x2 G size cylinders |
| Filter Respiratory & HMES with Capno Port Hypnobag | Medtronic, MN, USA | 352/5805 | |
| Yankauer High Adult | Medtronic, MN, USA | 8888-502005 | |
| Quadralite EcoMask anaesthetic masks | Intersurgical Australia Pty Ltd | 7093000/7094000 | size 3 and size 4 |
| Suction Canister Disp 1200 mL Medival Guardian | Cardinal Health, OH, USA | 65651-212 | |
| Catheter Mount Ext 4-13 cm with 90A elbow | Medtronic, MN, USA | 330/5667 | |
| Catheter IV Optiva 24g x 19 mm Yellow St Su | Smiths Medical, MN, USA | 5063-INT | |
| Dexamethasone Mylan Injection Vials (4 mg/1 mL) | Alphapharm Pty Ltd, Sydney, AUSTRALIA | 400528517 | |
| Ondasetron (4 mg/2 mL) | Alphapharm Pty Ltd, Sydney, AUSTRALIA | 400008857 | |
| Medical resuscitation cart | The medical resuscitation cart is configured according to the suggested minimal requirements for Adult resuscitation recommended in the document "Standards for Resuscitation: Clinical Practice and Education; June 2014) by the Australian and New Zealand Resuscitation councils and specifically endorsed by multiple professional health care organizations including the Australian and New Zealand College of Anaesthetists. It includes all the necessary airway and circulatory equipment, as well as the associated pharmacuetical agents to enable full cardio-respiratory resuscitation and support in a non-clinical environment. Full details can be found at https://resus.org.au/standards-for-resuscitation-clinical-practice-and-education/ | ||
| Maxfilter Version 2.2 | Elekta Oy, Stockholm, SWEDEN | N/A | Data analysis software provided with Elekta's Neuromag TRIUX MEG system |
Referencias
- Hudetz, A., Hudetz, A., Pearce, R. . Suppressing the Mind. , 178-189 (2010).
- Franks, N. P., Dickinson, R., de Sousa, S. L., Hall, A. C., Lieb, W. R. How does xenon produce anaesthesia?. Nature. 396 (6709), 324 (1998).
- Jevtović-Todorović, V., Todorović, S. M., Mennerick, S., Powell, S., Dikranian, K., Benshoff, N., Zorumski, C. F., Olney, J. W. Nitrous oxide (laughing gas) is an NMDA antagonist, neuroprotectant and neurotoxin. Nat Med. 4 (4), 460-463 (1998).
- Alkire, M. T., Hudetz, A. G., Tononi, G. Consciousness and Anesthesia. NIH Public Access. 322 (5903), 876-880 (2009).
- Fiset, P., et al. Brain Mechanisms of Propofol-Induced Loss of Consciousness in Humans: a Positron Emission Tomographic Study. The J Neurosci. 19 (13), 5506-5513 (1999).
- Schlünzen, L., et al. Effects of subanaesthetic and anaesthetic doses of sevoflurane on regional cerebral blood flow in healthy volunteers. A positron emission tomographic study. Acta Anaesthesiologica Scandinavica. 48 (10), 1268-1276 (2004).
- Alkire, M. T., et al. Cerebral Metabolism during Propofol Anesthesia in Humans Studied with Positron Emission Tomography. Anesthesiology. 82, 393-403 (1995).
- Alkire, M. T., Haier, R. J., Shah, N. K., Anderson, C. T. Positron Emission Tomography Study of Regional Cerebral Metabolism in Humans during Isoflurane Anesthesia. Anesthesiology. 86, 549-557 (1997).
- Alkire, M. T., et al. Functional Brain Imaging during Anesthesia in Humans. Effects of Halothane on Global and Regional Cerebral Glucose Metabolism. Anesthesiology. 90, 701-709 (1999).
- Kaike, K. K., et al. Effects of surgical levels of propofol and sevoflurane anesthesia on cerebral blood flow in healthy subjects studied with positron emission tomography. Anesthesiology. 6, 1358-1370 (2002).
- Prielipp, R. C., et al. Dexmedetomidine-induced sedation in volunteers decreases regional and global cerebral blood flow. Anesthesia and analgesia. 95 (4), 1052-1059 (2002).
- Mukamel, E. A., et al. A transition in brain state during propofol-induced unconsciousness. J Neurosci. 34 (3), 839-845 (2014).
- Boveroux, P., Vanhaudenhuyse, A., Phillips, C. Breakdown of within- and between-network Resting State during Propofol-induced Loss of Consciousness. Anesthesiology. 113 (5), 1038-1053 (2010).
- Pelligrino, D. A., Miletich, D. J., Hoffman, W. E., Albrecht, R. F. Nitrous oxide markedly increases cerebral cortical metabolic rate and blood flow in the goat. Anesthesiology. 60 (5), 405-412 (1984).
- Hansen, T. D., Warner, D. S., Todd, M. M., Vust, L. J. The role of cerebral metabolism in determining the local cerebral blood flow effects of volatile anesthetics: evidence for persistent flow-metabolism coupling. J Cereb Blood Flow Metab. 9, 323-328 (1989).
- Roald, O. K., Forsman, M., Heier, M. S., Steen, P. A. Cerebral effects of nitrous oxide when added to low and high concentrations of isoflurane in the dog. Anesth Analg. 72 (1), 75-79 (1991).
- Algotsson, L., Messeter, K., Rosén, I., Holmin, T. Effects of nitrous oxide on cerebral haemodynamics and metabolism during isoflurane anaesthesia in man. Acta Anaesthesiol Scand. 36 (1), 46-52 (1992).
- Field, L. M., Dorrance, D. E., Krzeminska, E. K., Barsoum, L. Z. Effect of nitrous oxide on cerebral blood flow in normal humans. Br J Anaesth. 70 (2), 154-159 (1993).
- Matta, B. F., Lam, A. M. Nitrous oxide increases cerebral blood flow velocity during pharmacologically induced EEG silence in humans. J Neurosurg Anesthesiol. 7 (2), 89-93 (1995).
- Langsjo, J. W., et al. Effects of subanesthetic doses of ketamine on regional cerebral blood flow, oxygen consumption, and blood volume in humans. Anesthesiology. 99 (3), 614-623 (2003).
- Reinstrup, P., et al. Regional cerebral metabolic rate (positron emission tomography) during inhalation of nitrous oxide 50% in humans. Br J Anaesth. 100 (1), 66-71 (2008).
- Rex, S., et al. Positron emission tomography study of regional cerebral blood flow and flow-metabolism coupling during general anaesthesia with xenon in humans. Br J Anaesth. 100 (5), 667-675 (2008).
- Laitio, R. M., et al. Effects of xenon anesthesia on cerebral blood flow in humans. Anesthesiology. 106 (6), 1128-1133 (2007).
- Laitio, R. M., et al. The effects of xenon anesthesia on the relationship between cerebral glucose metabolism and blood flow in healthy subjects: A positron emission tomography study. Anesthesia and Analgesia. 108 (2), 593-600 (2009).
- Yamamura, T., Fukuda, M., Takeya, H., Goto, Y., Furukawa, K. Fast oscillatory EEG activity induced by analgesic concentrations of nitrous oxide in man. Anesth Analg. 60 (5), 283-288 (1981).
- Rampil, I. J., Kim, J. S., Lenhardt, R., Negishi, C., DI, S. Bispectral EEG index during nitrous oxide administration. Anesthesiology. 89 (3), 671-677 (1998).
- Maksimow, A., et al. Increase in high frequency EEG activity explains the poor performance of EEG spectral entropy monitor during S-ketamine anesthesia. Clinical Neurophysiology. 117 (8), 1660-1668 (2006).
- Foster, B. L., Liley, D. T. J. Effects of nitrous oxide sedation on resting electroencephalogram topography. Clinical Neurophysiology. 124 (2), 417-423 (2013).
- Johnson, B. W., Sleigh, J. W., Kirk, I. J., Williams, M. L. High-density EEG mapping during general anaesthesia with Xenon and propofol: A pilot study. Anaesthesia and Intensive Care. 31 (2), 155-163 (2003).
- Foster, B. L., Bojak, I., Liley, D. T. J. Population based models of cortical drug response: Insights from anaesthesia. Cognitive Neurodynamics. 2 (4), 283-296 (2008).
- Kuhlmann, L., Liley, D. T. J. Assessing nitrous oxide effect using electroencephalographically-based depth of anesthesia measures cortical state and cortical input. J Clin Monit Comput. , (2017).
- Goto, T., et al. Bispectral analysis of the electroencephalogram does not predict responsiveness to verbal command in patients emerging from xenon anaesthesia. Br J Anaesth. 85 (3), 359-363 (2000).
- Laitio, R. M., Kaskinoro, K., Maksimow, A., Kangas, K., Scheinin, H. Electroencephalogram during Single-agent Xenon. Anesthesiology. 18 (1), 63-70 (2008).
- Hartmann, A., Dettmers, C., Schuier, F. J., Wassmann, H. D., Schumacher, H. W. Effect of stable xenon on regional cerebral blood flow and the electroencephalogram in normal volunteers. Stroke. 22 (2), 182-189 (1991).
- Lee, U., Müller, M., Noh, G. J., Choi, B., Mashour, G. a Dissociable network properties of anesthetic state transitions. Anesthesiology. 114 (4), 872-881 (2011).
- Ku, S. W., Lee, U., Noh, G. J., Jun, I. G., Mashour, G. A. Preferential inhibition of frontal-to-parietal feedback connectivity is a neurophysiologic correlate of general anesthesia in surgical patients. PLoS ONE. 6 (10), 1-9 (2011).
- Kuhlmann, L., Foster, B. L., Liley, D. T. J. Modulation of Functional EEG Networks by the NMDA Antagonist Nitrous Oxide. PLoS ONE. 8 (2), (2013).
- Greicius, M. D., et al. Persistent default-mode network connectivity during light sedation. Human Brain Mapping. 29 (7), 839-847 (2008).
- Deshpande, G., Sathian, K., Hu, X. Assessing and compensating for zero-lag correlation effects in time-lagged granger causality analysis of fMRI. IEEE Transactions on Biomedical Engineering. 57 (6), 1446-1456 (2010).
- Schrouff, J., et al. Brain functional integration decreases during propofol-induced loss of consciousness. NeuroImage. 57 (1), 198-205 (2011).
- Langsjo, J. W., et al. Returning from Oblivion: Imaging the Neural Core of Consciousness. J Neurosci. 32 (14), 4935-4943 (2012).
- Mukamel, E. A., Wong, K. F., Prerau, M. J., Brown, E. N., Purdon, P. L. Phase-based measures of cross-frequency coupling in brain electrical dynamics under general anesthesia. Conf Proc IEEE Eng Med Biol Soc, EMBS. 6454, 1981-1984 (2011).
- Logothetis, N. K. What we can do and what we cannot do with fMRI. Nature Reviews Neuroscience. 453 (June), 869-878 (2008).
- Nunez, P. L., Srinivasan, R. . Electric fields of the brain: the neurophysics of EEG. , (2006).
- Hämäläinen, M. S., Hari, R., Ilmoniemi, R. J., Knuutila, J., Lounasmaa, O. V. Magnetoencephalography - theory, instrumentation, and applications to noninvasivee studies of the working human brain. Rev Modern Physics. 65 (2), 413-505 (1993).
- Nunez, P. L., Srinivasan, R. A theoretical basis for standing and traveling brain waves measured with human EEG with implications for an integrated consciousness. Clinical Neurophysiology. 117 (11), 2424-2435 (2006).
- Kayser, J., Tenke, C. E. In search of the Rosetta Stone for scalp EEG: Converging on reference-free techniques. Clinical Neurophysiology. 121 (12), 1973-1975 (2010).
- Barkley, G. L., Baumgartner, C. MEG and EEG in epilepsy. J Clin Neurophysiol. 20 (3), 163-178 (2003).
- Parra, L. C., Bikson, M. Model of the effect of extracellular fields on spike time coherence. . , 4584-4587 (2004).
- Liu, A. K., Dale, A. M., Belliveau, J. W. Monte Carlo simulation studies of EEG and MEG localization accuracy. Human Brain Mapping. 16 (1), 47-62 (2002).
- Cullen, S. C., Eger, E. I., Cullen, B. F., Gregory, P. Observations on the anesthetic effect of the combination of xenon and halothane. Anesthesiology. 31 (4), 305-309 (1969).
- Hornbein, T. F., et al. The minimum alveolar concentration of nitrous oxide in man. Anesth Analg. 61 (7), 553-556 (1982).
- Fahlenkamp, A. V., et al. Evaluation of bispectral index and auditory evoked potentials for hypnotic depth monitoring during balanced xenon anaesthesia compared with sevoflurane. Br J Anaesth. 105 (3), 334-341 (2010).
- Stoppe, C., et al. AepEX monitor for the measurement of hypnotic depth in patients undergoing balanced xenon anaesthesia. Br J Anaesth. 108 (1), 80-88 (2012).
- Huang, M. X., et al. Commonalities and Differences among Vectorized Beamformers in Electromagnetic Source Imaging. Brain Topography. 16 (3), 139-158 (2004).
- Bastos, A. M., Schoffelen, J. M. A Tutorial Review of Functional Connectivity Analysis Methods and Their Interpretational Pitfalls. Frontiers in systems neuroscience. 9 (January), 175 (2015).
- Bazanova, O. M., Nikolenko, E. D., Barry, R. J. Reactivity of alpha rhythms to eyes opening (the Berger effect) during menstrual cycle phases. International Journal of Psychophysiology. , 0 (2017).
- Schaefer, M. S., et al. Predictors for postoperative nausea and vomiting after xenon-based anaesthesia. Br J Anaesth. 115 (1), 61-67 (2015).
- Gan, T. J., et al. Consensus guidelines for the management of postoperative nausea and vomiting. Anesthesia and Analgesia. 118 (1), 85-113 (2014).
- De Vasconcellos, K., Sneyd, J. R. Nitrous oxide: Are we still in equipoise? A qualitative review of current controversies. Br J Anaesth. 111 (6), 877-885 (2013).
- Sanders, R. D., Ma, D., Maze, M. Xenon: Elemental anaesthesia in clinical practice. British Medical Bulletin. 71, 115-135 (2004).
- da Silva, R. M. Syncope: Epidemiology, etiology, and prognosis. Frontiers in Physiology. 5 (DEC), 8-11 (2014).
- Dittrich, A., Lamparter, D., Maurer, M. 5D-ASC: Questionnaire for the assessment of altered states of consciousness. A short introduction. , (2010).
- Studerus, E., Gamma, A., Vollenweider, F. X. Psychometric evaluation of the altered states of consciousness rating scale (OAV). PLoS ONE. 5 (8), (2010).
- Oostenveld, R., Fries, P., Maris, E., Schoffelen, J. M. FieldTrip: Open source software for advanced analysis of MEG, EEG, and invasive electrophysiological data. Computational Intelligence and Neuroscience. 2011, (2011).
- Stolk, A., Todorovic, A., Schoffelen, J. M., Oostenveld, R. Online and offline tools for head movement compensation in MEG. NeuroImage. 68, 39-48 (2013).
- Cimenser, A., et al. Tracking brain states under general anesthesia by using global coherence analysis. Proc Natl Acad Sci. 108 (21), 8832-8837 (2011).
- Hall, S. D., et al. GABA(A) alpha-1 subunit mediated desynchronization of elevated low frequency oscillations alleviates specific dysfunction in stroke - A case report. Clinical Neurophysiology. 121 (4), 549-555 (2010).
- Hall, S. D., et al. The role of GABAergic modulation in motor function related neuronal network activity. NeuroImage. 56 (3), 1506-1510 (2011).
- Cornwell, B. R., et al. Synaptic potentiation is critical for rapid antidepressant response to ketamine in treatment-resistant major depression. Biological Psychiatry. 72, 555-561 (2012).
- Saxena, N., et al. Enhanced Stimulus-Induced Gamma Activity in Humans during Propofol-Induced Sedation. PLoS ONE. 8 (3), 1-7 (2013).
- Quaedflieg, C. W. E. M., Munte, S., Kalso, E., Sambeth, A. Effects of remifentanil on processing of auditory stimuli: A combined MEG/EEG study. J Psychopharmacol. 28 (1), 39-48 (2014).
- Muthukumaraswamy, S. D., Shaw, A. D., Jackson, L. E., Hall, J., Moran, R., Saxena, N. Evidence that Subanesthetic Doses of Ketamine Cause Sustained Disruptions of NMDA and AMPA-Mediated Frontoparietal Connectivity in Humans. J Neurosci. 35 (33), 11694-11706 (2015).
- Bruhn, J., Myles, P. S., Sneyd, R., Struys, M. M. R. F. Depth of anaesthesia monitoring: What's available, what's validated and what's next?. Br J Anaesth. 97 (1), 85-94 (2006).
- Punjasawadwong, Y., Phongchiewboon, A., Bunchungmongkol, N. Bispectral index for improving anaesthetic delivery and postoperative recovery (Review) Bispectral index for improving anaesthetic delivery and postoperative recovery. Cochrane Library. 10, 10-12 (2010).
- Taulu, S., Kajola, M., Simola, J. Suppression of interference and artifacts by the Signal Space Separation Method. Brain Topography. 16 (4), 269-275 (2004).
- Purdon, P. L., et al. Electroencephalogram signatures of loss and recovery of consciousness from propofol. Proc Natl Acad Sci U S A. 110 (12), 1142-1151 (2013).
- Mhuircheartaigh, R. N., et al. Cortical and Subcortical Connectivity Changes during Decreasing Levels of Consciousness in Humans: A Functional Magnetic Resonance Imaging Study using Propofol. J Neurosci. 30 (27), 9095-9102 (2010).
- Pandit, J. J., et al. 5th National Audit Project (NAP5) on accidental awareness during general anaesthesia: summary of main findings and risk factors. Br J Anaesth. 113 (4), 549-559 (2014).
- Lakhan, S. E., Caro, M., Hadzimichalis, N. NMDA Receptor Activity in Neuropsychiatric Disorders. Frontiers in Psychiatry. 4 (Junne), 52 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados