È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Registrazione attività elettromagnetica cerebrale durante l'amministrazione del xeno di agenti anestetici gassosi e protossido di azoto in volontari sani
In questo articolo
Riepilogo
Elettroencefalografia e simultanea magnetoencefalografia fornisce uno strumento utile per cercare i meccanismi comuni e distinte macro-scala delle riduzioni in coscienza indotta da differenti anestetici. Questo articolo illustra i metodi empirici sottostante la registrazione di tali dati dagli esseri umani sani durante l'anestesia N-Methyl-D-Aspartate-(NMDA)-receptor-antagonist-based durante l'inalazione del protossido d'azoto e xenon.
Abstract
Anestesia senza dubbio fornisce uno dei modi solo sistematici per studiare i correlati neurali della coscienza globale/perdita di coscienza. Tuttavia fino ad oggi la maggior parte neuroimaging o indagini neurofisiologiche in esseri umani sono state limitate allo studio degli anestetici γ-Amino-Butyric-Acid-(GABA)-receptor-agonist-based, mentre gli effetti di dissociativi N-Methyl-D-Aspartate-(NMDA)- basati su recettore-antagonista anestetici ketamina, xeno (Xe) e protossido di azoto (N2O) sono largamente sconosciuti. Questo articolo descrive i metodi alla base la registrazione simultanea di magnetoencefalografia (MEG) e l'elettroencefalografia (EEG) da maschi sani durante l'inalazione di agenti anestetici gassosi N2O le Xe. Combinando i dati EEG e MEG consente la valutazione dell'attività elettromagnetica cerebrale durante l'anestesia ad alta risoluzione spaziale, temporale e moderata. Qui descriviamo un protocollo dettagliato, affinato nel corso di più sessioni di registrazione, che include soggetto reclutamento, installazione di apparecchiatura di anestesia nella stanza dello scanner di MEG, raccolta dati e analisi di dati di base. In questo protocollo ogni partecipante è esposto a diversi livelli di Xe e N2O in un disegno cross-over di misure ripetute. Seguendo la linea di base pertinente registrazioni partecipanti sono esposti al graduale aumento ispirato le concentrazioni di Xe e N2O di 8, 16, 24 e 42% e 16, 32 e 47%, rispettivamente, durante il quale viene registrato il loro livello di reattività con un uditivo compito continuo della prestazione (aCPT). Risultati sono presentati per una serie di registrazioni per evidenziare la proprietà a livello di sensore di dati grezzi, la topografia spettrale, la minimizzazione dei movimenti della testa e gli effetti dipendenti livelli inequivocabili sulle risposte evocate uditive. Questo paradigma descrive un approccio generale alla registrazione di segnali elettromagnetici associata all'azione di diversi tipi di anestetici gassosi, che possono essere facilmente adattati per essere utilizzato con agenti anestetici volatili ed endovenosi. Si prevede che il metodo descritto può contribuire alla comprensione dei meccanismi macro-scala di anestesia di abilitazione delle estensioni metodologiche che coinvolgono fonte spazio imaging e l'analisi di rete funzionale.
Introduzione
C'è un buon consenso tra prove neuroscientifiche pre-cliniche e cliniche, suggerendo che il fenomeno della coscienza umana dipende dall'integrità dei circuiti neurali espliciti. L'osservazione che tali circuiti sono sistematicamente influenzati dalla discesa in stato di incoscienza è motivata la necessità di tecniche di neuroimaging essere utilizzati durante l'anestesia e consentono di 'navigare' la ricerca delle correlazioni neurali di coscienza. Con la possibile eccezione di sonno, anestesia rappresenta l'unico metodo con cui si può, in modo controllato, reversibile e riproducibile, perturbare e sezionare così, i meccanismi che Sub-servono coscienza, soprattutto su scala macroscopica di dinamica del cervello globale. Clinicamente, l'anestesia generale può essere definita come uno stato di ipnosi/perdita di coscienza, l'immobilità e l'analgesia e rimane uno degli interventi medici più abbondantemente usati e più sicuri. Nonostante la chiarezza e l'efficienza nel risultato finale, resta grande incertezza per quanto riguarda i meccanismi di azione dei vari tipi di agenti dando luogo a anestetico incoscienza indotto1.
Gli anestetici possono essere suddivisi in agenti endovenosi in particolare propofol e barbiturici o agenti volatili/gassosi quali sevoflurano, isoflurano, protossido di azoto (N2O) e xeno (Xe). La farmacologia dell'anestesia è stata affermata con bersagli cellulari più identificati come collegati all'azione anestetica. Maggior parte degli agenti studiato per data atto principalmente tramite l'agonismo di γ-Amino-Butyric-Acid-(GABA) l'attività del recettore mediato. In contrasto, la ketamina agenti dissociativi, Xe e N2O sono creduti di esercitare i loro effetti mirando principalmente N-Methyl-D-Aspartate-(NMDA) glutamatergic recettori2,3. Altri importanti bersagli farmacologici includono canali del potassio, recettori per l'acetilcolina e i recettori per il glutammato residuo, AMPA e kainato, tuttavia l'entità del loro contributo all'azione anestetica rimane inafferrabile (per una rassegna completa, vedere 4).
L'entità della variabilità nel meccanismo d'azione e gli effetti fisiologici e neurali osservati dei vari tipi di agenti, rende difficile la derivazione di conclusioni generali sulla loro influenza sull'elaborazione cosciente. Perdita di coscienza (LOC) indotto da agenti GABAergici è in genere caratterizzata da un cambiamento globale nell'attività cerebrale. Questo è evidente nell'emersione del alto-ampiezza, bassa frequenza delta (δ, 0,5-4 Hz) onde e la riduzione in alta frequenza, attività gamma (γ, 35-45Hz) nell'elettroencefalogramma (EEG), simile a onde lente dormire5,6 , nonché le riduzioni diffuse nel sangue cerebrale del glucosio e del flusso metabolismo5,6,7,8,9,10,11,12 . Boveroux et al. 13 aggiunto a tali osservazioni dimostrando una diminuzione significativa nella connettività funzionale stato sotto anestesia con propofol usando la formazione immagine a risonanza magnetica funzionale (fMRI) di riposo. Al contrario, anestetici dissociativi resa meno chiaro il profilo degli effetti sull'attività cerebrale. In alcuni casi, sono associati con gli aumenti in sanguigno cerebrale del glucosio e del flusso metabolismo14,15,16,17,18,19, 20,,21 , mentre gli studi di Rex e colleghi22 e Laitio e colleghi23,24 esaminando gli effetti di Xe fornito prova di entrambi aumentato e diminuito del cervello attività. Una simile irregolarità può essere visto negli effetti sui segnali EEG25,26,27,28. Johnson et al. 29 hanno dimostrato un aumento nel potere totale di bassa frequenza bande delta e theta pure come il più alta gamma di banda di frequenza in un'alta densità studio di EEG dell'anestesia Xe mentre avversarie osservazioni sono state fatte per N2O nel delta, theta e bande di frequenza alfa30,31 e per Xe nella maggiore di frequenze32. Tale variabilità negli effetti di Xe sull'attività elettrica del cuoio capelluto può essere osservato nell'alfa e gamme di frequenza beta con entrambi aumenta anche33 e riduzioni34 segnalanda.
Nonostante le discrepanze di cui sopra, l'immagine inizia a diventare più coerente attraverso agenti quando si cerca di guardare le alterazioni in connettività funzionale tra aree del cervello. Tuttavia, tali misure sono state principalmente limitati alle modalità che necessariamente fare concessioni per quanto riguarda la risoluzione spaziale o temporale. Mentre gli studi utilizzando l'EEG sembrano rivelare chiaro e in qualche misura coerenza, cambiamenti nella struttura topologica di reti funzionali durante anestesia/sedazione con propofol35, sevoflurano36 e N2O37, il ampiamente distanziati sensore livelli dati EEG hanno insufficiente risoluzione spaziale chiaramente definire e delineare i vertici delle reti funzionali corrispondenti. Al contrario, gli studi che utilizzano la risoluzione spaziale superiore del fMRI e tomografia a emissione di positroni (PET), trovare simili alterazioni topologiche in connettività su larga scala funzionale a quella dell'EEG13,38,39 ,40,41, possiedono tuttavia insufficiente risoluzione temporale a caratterizzare la fase-ampiezza di accoppiamento in Alfa (8-13 Hz) EEG band ed altri fenomeni dinamici che stanno emergendo come importanti firme di azione anestetica12,42. Inoltre, queste misure non valutare direttamente l'attività neurale elettromagnetica43.
Pertanto, al fine di progredire significativamente la comprensione dei processi macroscopici associata all'azione degli anestetici, le limitazioni delle indagini precedentemente menzionate devono essere affrontati; la copertura limitata di agenti anestetici e l'insufficiente risoluzione spazio-temporale delle misurazioni non invasive. Su questa base, gli autori delineano un metodo per registrare simultaneamente magnetoencephalogram (MEG) e attività di EEG in volontari sani che è stato sviluppato per la somministrazione degli agenti anestetici dissociativi gassosi, Xe e N2O.
Il MEG è utilizzato come è la tecnica neurofisiologica solo non-invasiva diverso da EEG che propone una risoluzione temporale della gamma di millisecondo. EEG ha il problema di sfocatura dei campi elettrici di cranio, che agisce come un filtro passa-basso su attività corticale generata, mentre MEG è molto meno sensibile a questo problema e la questione del volume di conduzione44. Si può argomentare che MEG ha superiore spaziale e precisione di localizzazione rispetto EEG 45,46di origine. EEG non consente registrazione vero riferimento37,47, tuttavia fa MEG. Sistemi di MEG anche in genere registrare attività corticale in una gamma molto più ampia di frequenza di EEG, tra cui alta gamma48(in genere 70-90 Hz), che sono stati suggeriti per essere coinvolto negli effetti ipnotici degli agenti anestetici compreso Xe29 e N 2 O28. Il MEG offre attività neurofisiologica che complimenta che veicolato da EEG, come attività EEG riguarda a correnti elettriche extracellulare, mentre MEG riflette principalmente i campi magnetici generati da correnti intracellulari46, 49. Inoltre, MEG è particolarmente sensibile alle attività elettrofisiologica tangenziale alla corteccia, mentre EEG registra principalmente attività extracellulare radiale per la corteccia49. Combinando così dati EEG e MEG ha vantaggi Super-additivo50.
Gli agenti gassosi dissociativi Xe e N2O sono stati scelti per i seguenti motivi di principio: sono inodore (Xe) o essenzialmente inodore (N2O) e così può facilmente essere utilizzati in presenza di condizioni di controllo quando impiegato presso concentrazioni sub-cliniche. Inoltre, si adattano bene per amministrazione remota e il monitoraggio in un ambiente di laboratorio a causa della loro debole cardio-respiratorio effetti depressivi61. Xeno e a una minore misura N2O, mantenere un minimo relativamente basso-alveolare - concentrazione-(MAC)-svegli alle quali il 50% dei pazienti diventano non risponde a un comando verbale con valori di 32,6 ± 6,1%51 e52 di 63,3 + - 7,1% rispettivamente. Nonostante Xe e N2O entrambi essendo antagonisti del recettore NMDA, si modulano l'EEG in modo diverso - Xe si comporta più come un tipico agente di GABAergic quando monitorati utilizzando il Bispectral Index33,53,54 (uno dei diversi approcci utilizzati per monitorare electroencephalographically profondità dell'anestesia). Al contrario, N2O produce un effetto di electroencephalographic molto meno apparente in quanto è male, se a tutti, monitorati utilizzando il Bispectral Index26. Perché Xe ha diverse proprietà electroencephalographic riferite agli altri agenti dissociativi, ma possiede caratteristiche simili agli agenti GABAergici più comunemente studiate, relativo studio elettrofisiologico ha il potenziale per rivelare importanti caratteristiche riguardanti i correlati neurali della coscienza e le modifiche di rete funzionale corrispondente. Gli agenti che agiscono presso il recettore NMDA sono probabili rivelano più circa le reti di cervello che subserve coscienza normale e alterata, dato il ruolo critico che recettore NMDA mediato attività svolge in apprendimento e memoria e il suo ruolo implicato in una gamma di disturbi psichiatrici che includono depressione e schizofrenia80.
Questa carta si concentra principalmente sulla procedura di raccolta dati esigenti e complessi connessa con la consegna degli agenti anestetici gassosi in un ambiente non ospedaliero mentre simultaneamente registrazione EEG e MEG. Analisi di dati di base a livello di sensore è delineata e sono forniti dati di esempio che illustrano che le registrazioni ad alta fedeltà possono essere ottenute con il minimo movimento della testa. Molti metodi di potenziali fonte successiva imaging e/o funzionali analisi connettività che verrebbe in genere eseguita utilizzando questo tipo di dati non sono descritte, come questi metodi sono descritti bene nella letteratura e dimostrano varie opzioni per analisi55,56.
Protocollo
Lo studio intitolato "Effetti di inalazione Xe e N2O su attività di cervello registrati usando EEG e MEG" è stato approvato (numero di omologazione: 260/12) dal comitato di etica di Swinburne University of Technology e Alfred Hospital e soddisfatto i requisiti del National Dichiarazione sulla condotta etica nella ricerca umana (2007).
1. partecipante selezione e requisiti di pre-studio
- Condurre un'intervista per selezionare sani, mani destra, adulti maschi fra le età di 20 e 40 anni.
- Confermare uno stato di buona salute generale ottenendo Body Mass Index (BMI del partecipante) e la mancanza di controindicazioni alla risonanza magnetica o MEG (ad esempio impiantati corpi estranei metallici), come pure di raccogliere un'anamnesi dettagliata, compresi eventuali precedenti interventi chirurgici, la cosa importante eventuali reazioni sfavorevoli all'anestesia generale che comporterebbe l'esclusione dallo studio.
- In particolare escludere qualsiasi assunzione recente di psicoattivi o altri farmaci prescritti nonché a garantire l'assenza di qualsiasi uso di droghe e la mancanza di qualsiasi disturbo neurologico, epilessia, malattie cardiache, apnea del sonno, malattia di movimento e claustrofobia. Come sarà successivamente importante ottenere una buona tenuta con una maschera anestetica esclude i partecipanti che hanno grandi barbe, a meno che non sono disposti a farsi la barba.
Nota: Escludere le femmine a causa degli effetti documentati di estremi di57 e/o età di mestruazioni il riposo segnale MEG/EEG, nonché la maggiore propensione alla nausea ed al vomito58.
- Seguire la procedura di anestesia generale del soggiorno di giorno come indicato in Australia e Nuova Zelanda College di anestesisti linee guida (ANZCA) (documento PS15).
- In linea con tali orientamenti, chiedere i soggetti di digiunare per almeno 6 ore e non consumare liquidi per almeno 2 ore prima dell'inizio dell'esperimento. Confermare la conformità avendo l'anestesista contattando il partecipante il giorno prima il test prende posto.
- Dopo il completamento dell'esperimento, sono soggetti sottoposti a controllo di anestesia post standard cure istruendoli di non operare alcun macchinario pesante o prendere importanti decisioni entro 24 ore dell'esperimento (dalla possibilità di livello basso residuo danno conoscitivo da Xe e N2O).
2. strutture e attrezzature
Nota: Le strutture sono in conformità con requisiti di ANZCA per la consegna dell'anestesia fuori una suite normale di funzionamento chirurgica (http://www.anzca.edu.au/resources/professional-documents. Documento PS55). In particolare, la camera soddisfa ingegneria regolamenti per l'amministrazione medica sicurezza e gas elettrico.
- Eseguire l'esperimento al laboratorio di Brain Imaging Swinburne avanzata tecnologia del centro, vale a dire la camera di MEG che contiene una camera magneticamente schermata (MSR) che ospita lo scanner di MEG. La stanza schermata si siede su un pavimento flottante isolato da movimenti ambientalisti come il passaggio dei treni.
- Fornire gas anestesia utilizzando una macchina per anestesia, situato fuori il MSR, capace di consegna e monitoraggio xeno gassoso. Questa macchina di anestesia è appositamente progettata per l'amministrazione di ciclo chiuso basso flusso gas Xe e per misurare le concentrazioni di Xe fine-di marea utilizzando katharometry (conduttività termica; precisione ± 1%), oltre a fornire standard di cura paziente monitoraggio. Questo include fine-di marea O2, CO2, misura di N2O (eventualmente), impulso oximetry, ECG a 3 derivazioni e misura la pressione sanguigna non invasiva (NIBP) secondo ANZCA Guida di riferimento documento PS18. Misurare le concentrazioni di2O N fine-di marea usando la spettroscopia a infrarossi implementata nella macchina di anestesia.
- Tubo gas a partecipanti tramite estesa 22 mm di diametro tubi passando attraverso condotti MSR di respirazione.
- Fornire standard di cura salvavita e monitoraggio pazienti secondo ANZCA Guida di riferimento documento PS18. Questo include fine-di marea O2, CO2, misura di N2O (eventualmente), impulso oximetry, ECG a 3 derivazioni e misurazione della pressione sanguigna non invasiva (NIBP).
- Monitor di pressione sanguigna secondo ANZCA Guida di riferimento documento PS18 utilizzando un monitor di pressione sanguigna non invasiva trova fuori il MSR e collegati da un tubo di gonfiaggio lungo a un bracciale posizionato sulla parte superiore del braccio.
- In tutto l'esperimento, registrare e documentare i parametri fisiologici tutto a intervalli di 1 min oltre una registrazione automatizzata di tutti i parametri ogni 30 s.
- Assicurarsi che i gas vengono reindirizzati ai partecipanti usando estesa 22 mm diametro tubi passando attraverso condotti MSR di respirazione. Un sistema di aspirazione si trova fuori il MSR e un tubo di consegna lunghi, collegato ad un Yankauer bacchetta aspirazione viene passato attraverso un condotto per essere collocati in prossimità dell'osservatore sia paziente e clinico.
- Inoltre, assicurarsi di bacini di emesi sono vicinissimi all'interno il MSR per consentire loro posizionamento rapido dall'osservatore al verificarsi dell'emesi. L'osservatore clinico entro il MSR sarà necessario rimanere vigili per qualsiasi ostruzione delle vie respiratorie, risponde inizialmente con un mento sollevare o sublussazione della mandibola e interrompere immediatamente il protocollo se imminente emesi sono segnalato dalla eccessiva deglutizione o conati di vomito o delle vie respiratorie l'ostruzione non viene risolta dal mento vita o sublussazione della mandibola.
- Registrazione EEG utilizzando un MEG compatibile 64 canali Ag/AgCl elettrodi cap collegato ad una batteria alimentata amplificatore all'interno il modulo MSR. L'amplificatore è collegato tramite un cavo in fibra ottica e un convertitore di mezzi idonei per un computer portatile in esecuzione un software di acquisizione compatibile.
- Attività di campo magnetico cerebrale record (MEG) ad un tasso di campionamento di 1000 Hz, utilizzando un sistema di MEG che ha una copertura di tutto il cervello e ha ben definito matrici di sensori che possono includere magnetometri e assiale/planare gradiometers; il presente studio che utilizza un sistema composto da 102 magnetometri e 204 gradiometers planare. Per evitare complessità non direttamente rilevanti per il protocollo o la configurazione del sistema di MEG, dati di esempio dai magnetometri da solo sono segnalati, anche se dati sia magnetometro e clinometro sono acquisiti come parte del protocollo.
- Posizione della pista testa continuamente utilizzando 5 bobine di indicatore (HPI) posizione della testa. Digitalizzare la posizione delle bobine, elettrodi EEG e marker fiduciali (nasion e punti di sinistro e destra preauricular) prima MEG scansione utilizzando appropriati digitalizzazione apparecchiatura.
- Perché l'obiettivo è quello di ottenere risultati nello spazio origine, disattivare qualsiasi sistema di schermatura attiva interno impiegato dal sistema MEG per cancellazioni rumore tridimensionale, al fine di rendere la pipeline di elaborazione flessibile per quanto riguarda l'uso dello spazio di segnale metodi di separazione (SSS) che sono in genere impiegati.
- Utilizzare uno scanner MRI per ottenere scansioni del cervello strutturale T1-weighted corrispondente per poi co-registrazione con registrazioni M/EEG.
3. studiare Design e protocollo
Nota: È seguito un protocollo sperimentale di crossover a due vie. Eseguire due sessioni di test separate per ogni soggetto separata da un massimo di quattro settimane tra sessioni di test. Un braccio dello studio è costituito da amministrazione Xe N2O si tengono nel secondo braccio. I partecipanti sono ciechi per il tipo di gas viene somministrato mentre il personale medico e i ricercatori sono non a causa di lievi differenze nella procedura seguiti per la loro amministrazione.
- Dopo l'ottenimento del consenso informato, confermare l'idoneità partecipante con un'intervista lunga storia medica e misurazioni dei segni vitali che comprendono la pressione sanguigna, frequenza cardiaca, temperatura e picco flusso espiratorio corpo. Dopo che il partecipante ammissibilità è confermato, il soggetto subisce una misura breve in MEG per garantire che non ci sono nessun imprevisti fonti di rumore.
- Posizionare il tappo di EEG sulla testa del soggetto e gel tutti gli elettrodi. Allegare le 5 bobine HPI sul cappuccio per registrare continuamente posizione della testa nel MEG.
- Digitalizzare i canali EEG, HPI bobina posizioni e punti extra sul naso del soggetto e memorizzare tutte le località utilizzando il pacchetto software accompagna di MEG.
- Spostare il soggetto per il MSR, collegare il cappuccio dell'elettrodo agli elettrodi EEG amplificatore e ri-gel se necessario affinché siano loro impedenze di contatto elettriche sotto 5 kΩ.
- Oltre al MEG ed EEG, fare tre bio-canale bipolare ulteriori registrazioni.
- Perché l'amministrazione agente anestetico è associata con i cambiamenti nel tono muscolare, registrare l'elettromiografia (EMG) utilizzando una coppia di Ag/AgCl elettrodi collocati submentally per registrare l'attività dei muscoli miloioideo e digastrico (ventre anteriore).
- Registrare il electro-oculogram (EOG) applicando una coppia di elettrodi sopra uno degli occhi, nei pressi della fronte e canthus laterale corrispondente ed eseguire registrazioni di tre derivazioni dell'elettrocardiogramma (ECG) usando elettrodi su ogni polso e un gomito a terra (Vedi Figura 1).
- Chiedere ai partecipanti di tenere gli occhi chiusi durante tutte le fasi di registrazione dell'esperimento.
- Eseguire Gestione clinica del soggetto con un anestesista e un infermiere di anestesia o altro osservatore clinica opportunamente addestrato. Sono l'infermiera/osservatore sedersi con il soggetto nel MSR al fine di monitorare continuamente la condizione del partecipante (in particolare la tenuta della maschera viso e delle vie respiratorie del soggetto) e l'anestesista, situato nella sala di controllo per gestire l'erogazione di gas ed elettronica monitoraggio.
- Raccogliere i dati in una squadra di tre: un membro di monitorare e controllare l'acquisizione del MEG del segnale, un altro controllo e l'acquisizione di EEG e un'altra a partire e fermare il compito di continuo uditiva computerizzato della prestazione mentre monitorare le risposte dei soggetti, coordinando tutte le sincronizzazioni sperimentale e registrazione minuta pressione del sangue e le concentrazioni di gas fine-di marea e portata del gas fornito dall'anestesista.
- Monitorare continuamente visivamente il partecipante in MSR tramite una macchina fotografica adatta, che registra anche tutte le fasi dell'esperimento per la successiva valutazione e revisione.
- Relativamente al comportamento di misurare il livello in corso di reattività in tutto l'esperimento utilizzando un compito uditivo continuo della prestazione (aCPT). Utilizzare cuffie compatibili MEG per consegnare un tono binaurale uditivo di frequenza di 1 o 3 kHz di ampiezza stereo fissa (circa 76 dBA), con un intervallo di Inter-stimolo di tra 2-4 secondi disegnata da una distribuzione uniforme.
- Chiedere al partecipante di rispondere il più rapidamente possibile utilizzando due caselle pulsante separato in ogni mano. Utilizzare la sinistra e tasti giusti su ogni casella corrispondono rispettivamente a una bassa o alta frequenza tono, caselle per il pulsante sinistro e destro, rispettivamente, per il partecipante a indicare l'assenza o la presenza di nausea.
- Monitorare attentamente la risposta in tutto l'esperimento. La latenza di tempo di reazione e l'accuratezza (percentuale di toni correttamente classificati) delle risposte vengono registrate automaticamente anche come visualizzato su un monitor fuori il MSR per i ricercatori ottenere un'indicazione in tempo reale dei partecipanti comportamentale stato.
- A seguito di molteplici risposte casella tasto destro sequenziale (che indica nausea), avvisare l'osservatore nel MSR e l'anestesista amministrando che amministrazione di gas potrebbe essere necessario essere terminato bruscamente per evitare emesi.
- Record occhi chiusi che riposa EEG e MEG per 5 min, seguito da una registrazione di EEG/MEG 5min occhi chiuso della linea di base con il soggetto che esegue l'attività di accettazione.
- Rimuovere l'oggetto dal MSR e consentono un cannula endovenoso di 20 calibro ad essere messi nella fossa antecubitale sinistra dall'anestesista. Amministrazione di anti-emetico, che si verificano lentamente nel corso di un periodo di 1-2 minuti, comprensivi di desametasone 4 mg e 4 mg di ondansetron59, segue per evitare qualsiasi emesi causata da inalazione di gas anestetico, che è spesso osservato con N2O presso il 60usati in concentrazioni più elevate.
- Fissare la maschera viso e respirazione circuito al soggetto che utilizza un imbrago di apnea del sonno modificate continua positiva delle vie aeree pressione (CPAP) e valutare per il comfort del soggetto e l'assenza di perdite di pressione positiva di 5 cm H2O.
- Tornare il soggetto il MSR rimanere seduti in MEG per il resto dello studio.
- Prendere un certo numero di misure preventive per garantire il movimento del soggetto limitato durante le registrazioni simultanee di EEG e MEG, poiché il movimento di testa e il corpo può causare grandi manufatti in registrazioni elettromagnetiche e si pensano che accadano durante l'amministrazione della gli anestetici dissociativi a causa della loro ben nota propensione a indurre agitazione psicomotoria.
- Mettere un tappo su misura fatto di una bassa densità schiuma colorata sulla testa che fissa la posizione della testa all'interno del casco di MEG dewar indipendentemente dalla forma e dimensioni della testa.
- Inoltre, uso una pettorina di panno avvolto intorno le cosce e i glutei e fissato alla parte posteriore della sedia MEG per ridurre al minimo eventuali cedimenti/dinoccolato che si verifica in posizione verticale del partecipante (Vedi Figura 1).
- Durante la registrazione, tenere traccia della posizione testa continuamente usando le bobine HPI, da visualizzare offline dopo il completamento dell'esperimento (vedere la sezione di analisi di dati per ulteriori dettagli).
- Una volta che il partecipante viene posizionato in modo sicuro, amministrare 100% ispirato O2 e continuate in questo modo fino a 30 minuti fino a quando la loro concentrazione di2 O fine-di marea è > 90% che indica sono in modo efficace de-azotate, un processo necessario per garantire misurazioni accurate delle concentrazioni di gas anestetico fine-di marea.
- Durante gli ultimi 5 minuti di denitrogenation, eseguire un occhi di finale 5 minuti chiuso riposo aCPT EEG/MEG di registrazione per garantire che eventuali effetti anti-emetico amministrazione e denitrogenation possono avere su attività di cervello successivamente può essere determinato e controllato per.
- Confrontare questa terza registrazione della linea di base per le linee di base precedente (occhi di resto chiusi senza anti-emetico e attività occhi chiusi senza anti-emetico) per determinare gli effetti antiemetici e aCPT avere sullo spontaneo/riposo M/EEG. Le linee di base sono denominati linee 1, 2 e 3 nel manoscritto di base per resto occhi chiusi senza anti-emetico, compito occhi chiusi senza anti-emetico e attività occhi chiusi con anti-emetico, rispettivamente.
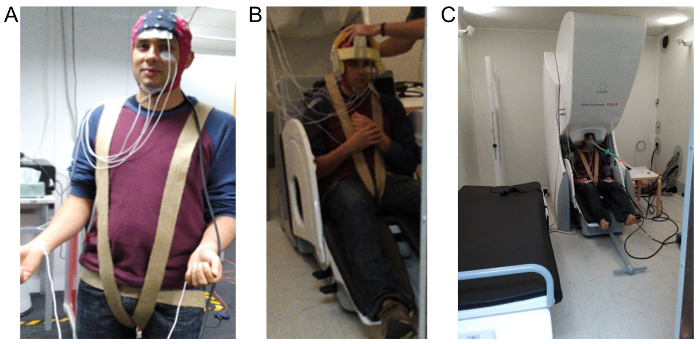
Figura 1 : Immagini che dimostrano di EEG, EOG, EMG ed ECG elettrodo layout e generale istituito in seno la MSR. (A) Mostra il tappo di compatibile MEG a 64 canali utilizzato per registrare l'EEG, EOG è registrato utilizzando i due elettrodi mostrati disposto sopra e sotto l'occhio sinistro, EMG viene registrata utilizzando i due elettrodi posizionati sotto la mascella ed ECG viene registrata utilizzando due elettrodi posizionati sul polso. (B) Mostra il cappello di schiuma su misura e imbrago usato per minimizzare il movimento del soggetto durante la registrazione. (C) dimostra la configurazione finale necessaria per l'amministrazione anestetica che comprende il posizionamento della testa all'interno del MEG e allegando una maschera antigas di stretto raccordo. Clicca qui per visualizzare una versione più grande di questa figura.
4. gas Administration Protocol Specification
Nota: Il protocollo di somministrazione del gas varia leggermente a seconda del braccio dello studio.
- Amministrare Xe alle quattro graduale aumento livelli e N2O alle tre graduale aumento livelli. I primi livelli di tre gas per ogni gas corrispondono ai livelli equi-MAC-awake di 0,25 (livello 1), 0,5 (livello 2) e 0,75 (livello 3) volte la concentrazione di MAC-awake. Queste concentrazioni sono 8%, 16%, 24% e 16%, 32%, 47% concentrazioni per Xe/O2 e N2O/O2, rispettivamente.
Nota: Il 4° livello per Xe corrisponde a 1,3 volte la concentrazione di MAC-awake. - Scegliere il 4° livello di gas per Xe in modo tale che 95% dei partecipanti sono attesi a perdere coscienza a questo livello (tutte le materie studiate fino ad oggi hanno raggiunto la completa perdita di reattività durante l'attività di aCPT). A causa della tendenza ben documentata di N2O di indurre nausea e vomito alle alte concentrazioni, non includere un N2O il livello ad una concentrazione sufficiente per indurre la perdita di coscienza nel 95% dei partecipanti (~ 75%). La figura 2 riassume i profili di amministrazione di gas.
- Seguire la stessa procedura sperimentale per tutti equi-MAC Xe e N2O i livelli ad eccezione di 42% Xe/O2, che richiederà una metodologia leggermente diversa (si veda 4.4. sotto).
- All'inizio di ogni livello, è necessario informare il soggetto e l'osservatore anestetico infermiera/clinico che amministrazione di gas sarà iniziare e iniziare la registrazione EEG e MEG, segnale per l'anestesista amministrando per iniziare la somministrazione di gas e avviare l'attività di accettazione. Gas di lavaggio-in poi si verifica per un periodo di 10 minuti che la concentrazione di gas fine-di marea di target è raggiunto alla fine di questo periodo e mantenuta per 5 minuti (fase allo steady-state di presupposto).
- Alla fine di questo periodo allo steady-state di 5 minuti, eseguire il wash-out con la somministrazione di 100% O2 per un periodo di 10 minuti durante il quale la concentrazione di gas fine-di marea torna a 0.
- Ripetere la procedura per il livello di gas passo successivo.
Nota: Perdita di reattività (LOR) per Xe dovrebbe essere raggiunto nel 95% dei partecipanti ad una concentrazione di 42% Xe/O261. L'amministrazione di questo livello si verifica per quanto riguarda i livelli inferiori, fino a quando sia l'osservatore anestetico infermiera/clinica e la perdita di pulsante risposte indicano LOR.
- Una volta ottenuta la LOR, mantenere il livello di gas Xe per 10 minuti o fino a quando l'anestesista o anestetico infermiera/clinica osservatore considera pericoloso continuare dopo prende quale wash-out con il 100% O2 posti. Istanze in cui l'anestesista può considerare pericoloso continuare includono frequente pressatura della casella tasto destro che indica nausea, rumori glottal, segni di emesi come salivazione eccessiva o reazioni di deglutizione e vaso-vagale.
Nota: A questo livello più alto, prestare attenzione significativa e impostare una bassa soglia clinica per l'interruzione di somministrazione di gas Xe. L'esperienza il authors' suggerisce che questo livello può essere associato con una riduzione nella deglutizione, ha permesso l'accumulo di saliva e la comparsa di conati di vomito-come comportamento, che se continuare maggio prefigurano rigurgito nella maschera. Naturalmente, le conseguenze di ciò potrebbero includere l'aspirazione in pericolo di vita. È anche possibile che le risposte meno intense possono verificarsi a livelli inferiori di gas e così esercitare un elevato livello di vigilanza durante l'amministrazione di tutti i livelli di gas graduale. Oltre a questi potenziali problemi delle vie respiratorie, essere consapevoli del potenziale per la sincope vasovagale, particolarmente in più giovani partecipanti maschii. Loro età e le limitazioni temporanee di fluido e il cibo sono tutti fattori di rischio62.

Figura 2 : Sintesi di somministrazione gas profili per Xe e N 2O. Concentrazioni di gas e Timeline durante il corso di somministrazione del farmaco per N2O (in alto) e Xe (in basso). I numeri sopra ciascuna timeline indicano il tempo in minuti dopo l'avvio della prima consegna di gas. Ogni livello di concentrazione del gas di picco equilibrato è raggiungibile attraverso un 10 minuti equilibrare periodo, seguito da uno stato di costante di 5 minuti durante il quale la concentrazione del gas di picco equilibrato è mantenuta, e poi un washout di 10 minuti. Il picco equilibrato gas le concentrazioni aumentano in sequenza nel tempo. Si noti che la sequenza temporale di preparazione per l'esperimento, come pure il periodo dopo la somministrazione di gas non vengono visualizzati. Clicca qui per visualizzare una versione più grande di questa figura.
5. strutturali scansione
- Prima la risonanza magnetica, posto capsule di vitamina E sulla testa del partecipante per essere utilizzati come indicatori per evidenziare i punti fiduciali digitalizzati per l'apice nasale e sinistro e destra preauricular punti. Questo assicura una migliore co-registrazione dei sensori MEG/EEG e le esplorazioni di MRI del cervello quando si tenta di mettere in relazione la formazione immagine di origine di MEG/EEG alla neuroanatomia basati su MRI.
- Ottenere una singola scansione di T1-weighted MRI strutturale, entrambi dopo il completamento di un braccio dello studio, se il partecipante si sente bene, altrimenti chiedere loro di tornare un giorno separato per l'analisi strutturale del cervello.
6. partecipante follow-up
Nota: Il soggetto è libero di andarsene quando accompagnato da un amico o un parente.
- Su scarico, chiedere al partecipante di completare una versione troncata del 5-dimensionale Altered States della scala di valutazione di coscienza (5D-ASC); un questionario che consenta di accedere a diverse differenze confrontando lo stato di coscienza normale e alterata per mezzo di una scala analogica visiva63,64.
- Inoltre, chiedere l'invio di un breve racconto della loro esperienza durante l'esperimento, nonché i dettagli specifici circa gli effetti qualitativi dipendente dal livelli.
- Hanno entrambi questi documenti completato e inviato ai ricercatori 24 ore dopo ogni sessione di registrazione.
7. analisi dei dati
Nota: Questa sezione descrive analisi di dati di base a livello di sensore MEG/EEG che coprono i passaggi coinvolti nella generazione di esempi di pre-elaborati dati MEG/EEG, la topografia spettrale, movimenti della testa, segnando la reattività e le risposte evocate uditive. Il focus di questo articolo è sull'illustrazione di esempi tipici affinché il lettore possa capire le caratteristiche importanti dei dati registrati. Nessuna analisi statistica intra-individuale o group-wise vengono eseguita come l'obiettivo principale in questa sezione di analisi è al dettaglio importante pre-elaborazione passi che attestano la qualità e l'integrità dei dati raccolti. Nessuna informazione sono fornita per le analisi una miriade che potrebbero essere eseguite su questo dati55,56 , mentre cadono fuori dell'ambito della descrizione del metodo.
- Completare l'analisi dei dati non in linea su un computer desktop utilizzando software di analisi di dati appropriato e utilizzare cassette attrezzi pertinenti per l'elaborazione di dati EEG e MEG. Nella pipeline degli autori, utilizzare la versione 20160801 della casella degli strumenti Fieldtrip65 .
- Calcolare il movimento della testa durante ogni MEG registrazione innanzitutto ottenere le posizioni di testa continue come una sequenza di coordinate quaternione analizzando i 5 segnali di bobina HPI salvati come parte di ogni livello dipendente e basale registrazioni di MEG. Convertire le posizioni di testa dal quaternione in coordinate cartesiane.
- Assemblare il 6 e 7 per N2O e Xe di studio braccia (linee 1, 2 e 3, livelli 1-3 o 1/4 di gas rispettivamente). Tempo spostamento EEG crudo rispetto ai dati di MEG al fine di sincronizzare i due tipi di segnale basato su un canale comune di innesco. Questa forma di sincronizzazione nasce dalla scelta del sistema di registrazione EEG.
Nota: Molti sistemi di MEG contengono una costruito nel sistema di EEG che offre molto accurata sincronizzazione di livello elettronica del MEG & EEG, ma spesso hanno quantizzazione DAC bassa risoluzione di 16 bit. Per questo motivo, utilizzare un sistema esterno di EEG (Vedi punto 2.3) avendo maggiore risoluzione di ampiezza EEG di 24-bit per consentire una maggiore tolleranza all'elettrodo di compensata potenziali, la misura di informazioni a bassa frequenza e una risposta in frequenza piatta attraverso tutti i canali. - Per tutte le registrazioni che coinvolgono l'erogazione di gas e prestazioni aCPT, ridefinire tempo zero per l'inizio del compito/gas aCPT.
- Dati grezzi di MEG di ispezionare visivamente ed escludere qualsiasi canali cattivi da ulteriori analisi. Successivamente, filtrare i dati utilizzando un algoritmo di separazione temporale del segnale-spazio76 implementato nel software di MEG-sistema. L'algoritmo sopprime fonti di interferenze magnetiche fuori dalla matrice del sensore e quindi si traduce in una riduzione di artefatti di movimento del corpo rigido o esterno. Importare il set di dati di output del software di analisi di dati da utilizzare con il magnetometro (102 canali) selezionata per l'ulteriore elaborazione.
- Passa-banda filtro MEG a 2 fino a 50 Hz e applicare i filtri di rumore di linea a 50, 100 e 150 Hz. Visual artefatto rilevamento e una procedura di rilevamento automatico artefatto implementato nel software Fieldtrip consentono la rimozione di eventuali elementi artifactual. Ispezionare visivamente tutti i segmenti contenenti occhio lampeggia, battiti cardiaci o artefatti muscolari ed esclusione dai dati, come pure eventuali segmenti correlati con i cambiamenti significativi nel movimento della testa supera a 5 mm (Vedi sotto).
Nota: Movimenti di maggiore di 5 mm rispetto all'inizio di ogni previsione di 5 minuti o gas equilibrato periodo vengono utilizzati per respingere dati MEG continuamente acquisiti dal source di immagini di MEG ha in genere una risoluzione spaziale dell'ordine di 5 mm (ad es. per MEG/EEG beamformers55). È tuttavia possibile eseguire la compensazione del movimento dei dati MEG66 , invece di rifiutare i segmenti di dati correlati con significativo movimento della testa, tuttavia, tali metodi sono oltre la portata di questa carta. - Come con i dati di MEG, 64 canali EEG grezzi di ispezionare visivamente ed escludere qualsiasi canali cattivi da ulteriore analisi di dati. Passa-banda filtrare i dati utilizzando le stesse gamme di frequenza per quanto riguarda la MEG. Ri-fare riferimento l'EEG di una comune media come è standard per origine approcci di imaging. Infine, rimuovere eventuali segmenti contenenti elementi contemporanei con quelli del corrispondente MEG.
- Per visualizzare le proprietà spettrali dei dati MEG/EEG, calcolare gli spettri di ampiezza singola lungo la linea mediana anteriore-posteriore per i canali EEG FPz, Cz e Oz e midline frontale, centrale ed occipital magnetometro canali di MEG ( Figura 3 ).
- Calcolare la mappa topografica del livello del sensore di potenza banda alfa (8-13 Hz) per MEG/EEG, dato che forte banda alfa sono stati osservati cambiamenti in precedenza per N2O e GABAergici anestetici25,31,67 .
- Per i dati di EEG, utilizzare il canale di FPz come riferimento per calcolare la potenza di banda Alfa rilievo topografico al fine di meglio evidenziare le modifiche alfa potere.
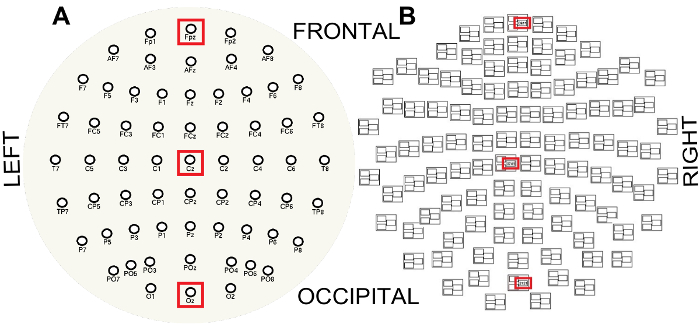
Figura 3 : Layout sensore EEG (A) e MEG (B) visto dalla cima della testa e appiattiti in un aereo. Si noti la struttura del tripletto di MEG dove sono sensori che termina in # # # 1 magnetometro e sensori che termina in # # # 2 o # # # 3 sono gradiometers. Caselle rosse indicano i canali lungo la linea mediana anteriore-posteriore permette di visualizzare le proprietà spettrali dei canali EEG e MEG, FPz (frontale), Cz (centrale) e Oz (occipitale) e frontale, centrale e occipitale magnetometro rispettivamente. Clicca qui per visualizzare una versione più grande di questa figura.
- Ottenere le risposte evocate uditive per dati EEG e MEG priva di artefatti filtrati per ogni registrazione che coinvolgono l'attività di accettazione. Epoca i segnali da ms-1000 a + 2000 ms rispetto il tono innescano volte e media artefatto disponibile tutte le epoche. Prendere la latenza tra stimolo trigger generazione e consegna del suono all'orecchio in considerazione, in questo caso 190,5 ms.
Risultati
Questa sezione utilizza i dati ottenuti da un soggetto al fine di dimostrare le caratteristiche tipiche delle registrazioni simultanee e il potenziale di tali informazioni per contribuire a una migliore comprensione di anestetico indotto stati alterati di coscienza. Per semplificare l'esposizione, risultati sono mostrati per i) registrazioni della linea di base amministrazione post-anti-emetico (linea di base 3), ii) 0,75 equi-MAC-awake picchi di concentrazione di gas (livello 3) di N
Discussione
Questa carta ha delineato un protocollo completo per la registrazione simultanea di EEG e MEG durante la consegna di gas anestetico con N2O e Xe. Tale protocollo sarà prezioso per lo studio delle correlazioni neurali elettromagnetiche di anestetico-indotto riduzioni nella coscienza. Il protocollo prevede inoltre di generalizzare per la consegna di altri gas anestetici quali sevoflurano o isoflurano. Questo faciliterà una maggiore comprensione dei meccanismi comuni, specifiche e distinte macroscopici che sott...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori vorrei ringraziare meloni Cameron Bradley, Rachel Anne Batty e Johanna Stephens per assistenza tecnica preziosa con raccolta dati MEG. Grazie sono inoltre esteso a Dr. Steven Mcguigan per supporto come un secondo anestesista. Paige Pappas se inestimabile infermiera anestetico svista. Markus Stone gentilmente offerto suo tempo e la competenza in editing e riprese il protocollo. Dottor Suresh Muthukumaraswamy ha dato consulenza specifica in materia di analisi dei dati e l'interpretazione dei risultati. Infine, Jarrod Gott molti hanno contribuito a stimolare la discussione, aiutato nell'esecuzione di una serie di esperimenti pilota e fu centrale nella progettazione della schiuma testa tutore.
Questa ricerca è stata sostenuta da una sovvenzione collaborativa James S. McDonnell #220020419 "Ricostruire la coscienza" assegnata a George Mashour, Michael Avidan, Max Kelz e David Liley.
Materiali
| Name | Company | Catalog Number | Comments |
| Neuromag TRIUX 306-channel MEG system | Elekta Oy, Stockholm, SWEDEN | N/A | |
| Polhemus Fastrak 3D system | Polhemus, VT, USA | N/A | |
| MEG compatible ER-1 insert headphones | Etymotic Research Inc., IL, USA | N/A | |
| Low Density foam head cap, MEG compatible | N/A | N/A | Custom made by research team |
| Harness, MEG compatible | N/A | ~3 m long, ~ 5 cm wide, cloth/jute strip to secure participant position on MEG chair | |
| Ambu Neuroline 720 Single Patient Surface Electrodes | Ambu, Copenhagen, Denmark | 72015-K10 | |
| 3.0T TIM Trio MRI system | Siemens AB, Erlangen, GERMANY | N/A | |
| Asalab amplifier system | ANT Neuro, Enschede, NETHERLANDS | N/A | this system is no longer manufactured and has been deprecated to 64 channel eego EEG amplifier |
| 64-channel Waveguard EEG cap, MEG compatible | ANT Neuro, Enschede, NETHERLANDS | CA-138 | size Medium |
| Magnetically shielded cordless battery box | ANT Neuro, Enschede, NETHERLANDS | N/A | Magnetic shielding not provided by manufacturer – Modified by research team |
| OneStep ClearGel Electrode gel | H+H Medizinprodukte GbR, Munster, GERMANY | 154547 | |
| Akzent Xe Color Anesthesia Machine | Stephan GmbH, Gackenbach, GERMANY | N/A | |
| Omron M6-Comfort Blood Pressure Monitor | Omron Healthcare, Kyoto, JAPAN | N/A | |
| Xenon gas (99.999% purity) | Coregas, Thomastown, VIC, AUSTRALIA | N/A | we estimate that we use approx 40 L (SATP) per participant |
| Medical Nitrous Oxide | Coregas, Thomastown, VIC, AUSTRALIA | N/A | x2 G size cylinders |
| Medical Oxygen | Coregas, Thomastown, VIC, AUSTRALIA | N/A | x2 G size cylinders |
| Medical Air | Coregas, Thomastown, VIC, AUSTRALIA | N/A | x2 G size cylinders |
| Filter Respiratory & HMES with Capno Port Hypnobag | Medtronic, MN, USA | 352/5805 | |
| Yankauer High Adult | Medtronic, MN, USA | 8888-502005 | |
| Quadralite EcoMask anaesthetic masks | Intersurgical Australia Pty Ltd | 7093000/7094000 | size 3 and size 4 |
| Suction Canister Disp 1200 mL Medival Guardian | Cardinal Health, OH, USA | 65651-212 | |
| Catheter Mount Ext 4-13 cm with 90A elbow | Medtronic, MN, USA | 330/5667 | |
| Catheter IV Optiva 24g x 19 mm Yellow St Su | Smiths Medical, MN, USA | 5063-INT | |
| Dexamethasone Mylan Injection Vials (4 mg/1 mL) | Alphapharm Pty Ltd, Sydney, AUSTRALIA | 400528517 | |
| Ondasetron (4 mg/2 mL) | Alphapharm Pty Ltd, Sydney, AUSTRALIA | 400008857 | |
| Medical resuscitation cart | The medical resuscitation cart is configured according to the suggested minimal requirements for Adult resuscitation recommended in the document "Standards for Resuscitation: Clinical Practice and Education; June 2014) by the Australian and New Zealand Resuscitation councils and specifically endorsed by multiple professional health care organizations including the Australian and New Zealand College of Anaesthetists. It includes all the necessary airway and circulatory equipment, as well as the associated pharmacuetical agents to enable full cardio-respiratory resuscitation and support in a non-clinical environment. Full details can be found at https://resus.org.au/standards-for-resuscitation-clinical-practice-and-education/ | ||
| Maxfilter Version 2.2 | Elekta Oy, Stockholm, SWEDEN | N/A | Data analysis software provided with Elekta's Neuromag TRIUX MEG system |
Riferimenti
- Hudetz, A., Hudetz, A., Pearce, R. . Suppressing the Mind. , 178-189 (2010).
- Franks, N. P., Dickinson, R., de Sousa, S. L., Hall, A. C., Lieb, W. R. How does xenon produce anaesthesia?. Nature. 396 (6709), 324 (1998).
- Jevtović-Todorović, V., Todorović, S. M., Mennerick, S., Powell, S., Dikranian, K., Benshoff, N., Zorumski, C. F., Olney, J. W. Nitrous oxide (laughing gas) is an NMDA antagonist, neuroprotectant and neurotoxin. Nat Med. 4 (4), 460-463 (1998).
- Alkire, M. T., Hudetz, A. G., Tononi, G. Consciousness and Anesthesia. NIH Public Access. 322 (5903), 876-880 (2009).
- Fiset, P., et al. Brain Mechanisms of Propofol-Induced Loss of Consciousness in Humans: a Positron Emission Tomographic Study. The J Neurosci. 19 (13), 5506-5513 (1999).
- Schlünzen, L., et al. Effects of subanaesthetic and anaesthetic doses of sevoflurane on regional cerebral blood flow in healthy volunteers. A positron emission tomographic study. Acta Anaesthesiologica Scandinavica. 48 (10), 1268-1276 (2004).
- Alkire, M. T., et al. Cerebral Metabolism during Propofol Anesthesia in Humans Studied with Positron Emission Tomography. Anesthesiology. 82, 393-403 (1995).
- Alkire, M. T., Haier, R. J., Shah, N. K., Anderson, C. T. Positron Emission Tomography Study of Regional Cerebral Metabolism in Humans during Isoflurane Anesthesia. Anesthesiology. 86, 549-557 (1997).
- Alkire, M. T., et al. Functional Brain Imaging during Anesthesia in Humans. Effects of Halothane on Global and Regional Cerebral Glucose Metabolism. Anesthesiology. 90, 701-709 (1999).
- Kaike, K. K., et al. Effects of surgical levels of propofol and sevoflurane anesthesia on cerebral blood flow in healthy subjects studied with positron emission tomography. Anesthesiology. 6, 1358-1370 (2002).
- Prielipp, R. C., et al. Dexmedetomidine-induced sedation in volunteers decreases regional and global cerebral blood flow. Anesthesia and analgesia. 95 (4), 1052-1059 (2002).
- Mukamel, E. A., et al. A transition in brain state during propofol-induced unconsciousness. J Neurosci. 34 (3), 839-845 (2014).
- Boveroux, P., Vanhaudenhuyse, A., Phillips, C. Breakdown of within- and between-network Resting State during Propofol-induced Loss of Consciousness. Anesthesiology. 113 (5), 1038-1053 (2010).
- Pelligrino, D. A., Miletich, D. J., Hoffman, W. E., Albrecht, R. F. Nitrous oxide markedly increases cerebral cortical metabolic rate and blood flow in the goat. Anesthesiology. 60 (5), 405-412 (1984).
- Hansen, T. D., Warner, D. S., Todd, M. M., Vust, L. J. The role of cerebral metabolism in determining the local cerebral blood flow effects of volatile anesthetics: evidence for persistent flow-metabolism coupling. J Cereb Blood Flow Metab. 9, 323-328 (1989).
- Roald, O. K., Forsman, M., Heier, M. S., Steen, P. A. Cerebral effects of nitrous oxide when added to low and high concentrations of isoflurane in the dog. Anesth Analg. 72 (1), 75-79 (1991).
- Algotsson, L., Messeter, K., Rosén, I., Holmin, T. Effects of nitrous oxide on cerebral haemodynamics and metabolism during isoflurane anaesthesia in man. Acta Anaesthesiol Scand. 36 (1), 46-52 (1992).
- Field, L. M., Dorrance, D. E., Krzeminska, E. K., Barsoum, L. Z. Effect of nitrous oxide on cerebral blood flow in normal humans. Br J Anaesth. 70 (2), 154-159 (1993).
- Matta, B. F., Lam, A. M. Nitrous oxide increases cerebral blood flow velocity during pharmacologically induced EEG silence in humans. J Neurosurg Anesthesiol. 7 (2), 89-93 (1995).
- Langsjo, J. W., et al. Effects of subanesthetic doses of ketamine on regional cerebral blood flow, oxygen consumption, and blood volume in humans. Anesthesiology. 99 (3), 614-623 (2003).
- Reinstrup, P., et al. Regional cerebral metabolic rate (positron emission tomography) during inhalation of nitrous oxide 50% in humans. Br J Anaesth. 100 (1), 66-71 (2008).
- Rex, S., et al. Positron emission tomography study of regional cerebral blood flow and flow-metabolism coupling during general anaesthesia with xenon in humans. Br J Anaesth. 100 (5), 667-675 (2008).
- Laitio, R. M., et al. Effects of xenon anesthesia on cerebral blood flow in humans. Anesthesiology. 106 (6), 1128-1133 (2007).
- Laitio, R. M., et al. The effects of xenon anesthesia on the relationship between cerebral glucose metabolism and blood flow in healthy subjects: A positron emission tomography study. Anesthesia and Analgesia. 108 (2), 593-600 (2009).
- Yamamura, T., Fukuda, M., Takeya, H., Goto, Y., Furukawa, K. Fast oscillatory EEG activity induced by analgesic concentrations of nitrous oxide in man. Anesth Analg. 60 (5), 283-288 (1981).
- Rampil, I. J., Kim, J. S., Lenhardt, R., Negishi, C., DI, S. Bispectral EEG index during nitrous oxide administration. Anesthesiology. 89 (3), 671-677 (1998).
- Maksimow, A., et al. Increase in high frequency EEG activity explains the poor performance of EEG spectral entropy monitor during S-ketamine anesthesia. Clinical Neurophysiology. 117 (8), 1660-1668 (2006).
- Foster, B. L., Liley, D. T. J. Effects of nitrous oxide sedation on resting electroencephalogram topography. Clinical Neurophysiology. 124 (2), 417-423 (2013).
- Johnson, B. W., Sleigh, J. W., Kirk, I. J., Williams, M. L. High-density EEG mapping during general anaesthesia with Xenon and propofol: A pilot study. Anaesthesia and Intensive Care. 31 (2), 155-163 (2003).
- Foster, B. L., Bojak, I., Liley, D. T. J. Population based models of cortical drug response: Insights from anaesthesia. Cognitive Neurodynamics. 2 (4), 283-296 (2008).
- Kuhlmann, L., Liley, D. T. J. Assessing nitrous oxide effect using electroencephalographically-based depth of anesthesia measures cortical state and cortical input. J Clin Monit Comput. , (2017).
- Goto, T., et al. Bispectral analysis of the electroencephalogram does not predict responsiveness to verbal command in patients emerging from xenon anaesthesia. Br J Anaesth. 85 (3), 359-363 (2000).
- Laitio, R. M., Kaskinoro, K., Maksimow, A., Kangas, K., Scheinin, H. Electroencephalogram during Single-agent Xenon. Anesthesiology. 18 (1), 63-70 (2008).
- Hartmann, A., Dettmers, C., Schuier, F. J., Wassmann, H. D., Schumacher, H. W. Effect of stable xenon on regional cerebral blood flow and the electroencephalogram in normal volunteers. Stroke. 22 (2), 182-189 (1991).
- Lee, U., Müller, M., Noh, G. J., Choi, B., Mashour, G. a Dissociable network properties of anesthetic state transitions. Anesthesiology. 114 (4), 872-881 (2011).
- Ku, S. W., Lee, U., Noh, G. J., Jun, I. G., Mashour, G. A. Preferential inhibition of frontal-to-parietal feedback connectivity is a neurophysiologic correlate of general anesthesia in surgical patients. PLoS ONE. 6 (10), 1-9 (2011).
- Kuhlmann, L., Foster, B. L., Liley, D. T. J. Modulation of Functional EEG Networks by the NMDA Antagonist Nitrous Oxide. PLoS ONE. 8 (2), (2013).
- Greicius, M. D., et al. Persistent default-mode network connectivity during light sedation. Human Brain Mapping. 29 (7), 839-847 (2008).
- Deshpande, G., Sathian, K., Hu, X. Assessing and compensating for zero-lag correlation effects in time-lagged granger causality analysis of fMRI. IEEE Transactions on Biomedical Engineering. 57 (6), 1446-1456 (2010).
- Schrouff, J., et al. Brain functional integration decreases during propofol-induced loss of consciousness. NeuroImage. 57 (1), 198-205 (2011).
- Langsjo, J. W., et al. Returning from Oblivion: Imaging the Neural Core of Consciousness. J Neurosci. 32 (14), 4935-4943 (2012).
- Mukamel, E. A., Wong, K. F., Prerau, M. J., Brown, E. N., Purdon, P. L. Phase-based measures of cross-frequency coupling in brain electrical dynamics under general anesthesia. Conf Proc IEEE Eng Med Biol Soc, EMBS. 6454, 1981-1984 (2011).
- Logothetis, N. K. What we can do and what we cannot do with fMRI. Nature Reviews Neuroscience. 453 (June), 869-878 (2008).
- Nunez, P. L., Srinivasan, R. . Electric fields of the brain: the neurophysics of EEG. , (2006).
- Hämäläinen, M. S., Hari, R., Ilmoniemi, R. J., Knuutila, J., Lounasmaa, O. V. Magnetoencephalography - theory, instrumentation, and applications to noninvasivee studies of the working human brain. Rev Modern Physics. 65 (2), 413-505 (1993).
- Nunez, P. L., Srinivasan, R. A theoretical basis for standing and traveling brain waves measured with human EEG with implications for an integrated consciousness. Clinical Neurophysiology. 117 (11), 2424-2435 (2006).
- Kayser, J., Tenke, C. E. In search of the Rosetta Stone for scalp EEG: Converging on reference-free techniques. Clinical Neurophysiology. 121 (12), 1973-1975 (2010).
- Barkley, G. L., Baumgartner, C. MEG and EEG in epilepsy. J Clin Neurophysiol. 20 (3), 163-178 (2003).
- Parra, L. C., Bikson, M. Model of the effect of extracellular fields on spike time coherence. . , 4584-4587 (2004).
- Liu, A. K., Dale, A. M., Belliveau, J. W. Monte Carlo simulation studies of EEG and MEG localization accuracy. Human Brain Mapping. 16 (1), 47-62 (2002).
- Cullen, S. C., Eger, E. I., Cullen, B. F., Gregory, P. Observations on the anesthetic effect of the combination of xenon and halothane. Anesthesiology. 31 (4), 305-309 (1969).
- Hornbein, T. F., et al. The minimum alveolar concentration of nitrous oxide in man. Anesth Analg. 61 (7), 553-556 (1982).
- Fahlenkamp, A. V., et al. Evaluation of bispectral index and auditory evoked potentials for hypnotic depth monitoring during balanced xenon anaesthesia compared with sevoflurane. Br J Anaesth. 105 (3), 334-341 (2010).
- Stoppe, C., et al. AepEX monitor for the measurement of hypnotic depth in patients undergoing balanced xenon anaesthesia. Br J Anaesth. 108 (1), 80-88 (2012).
- Huang, M. X., et al. Commonalities and Differences among Vectorized Beamformers in Electromagnetic Source Imaging. Brain Topography. 16 (3), 139-158 (2004).
- Bastos, A. M., Schoffelen, J. M. A Tutorial Review of Functional Connectivity Analysis Methods and Their Interpretational Pitfalls. Frontiers in systems neuroscience. 9 (January), 175 (2015).
- Bazanova, O. M., Nikolenko, E. D., Barry, R. J. Reactivity of alpha rhythms to eyes opening (the Berger effect) during menstrual cycle phases. International Journal of Psychophysiology. , 0 (2017).
- Schaefer, M. S., et al. Predictors for postoperative nausea and vomiting after xenon-based anaesthesia. Br J Anaesth. 115 (1), 61-67 (2015).
- Gan, T. J., et al. Consensus guidelines for the management of postoperative nausea and vomiting. Anesthesia and Analgesia. 118 (1), 85-113 (2014).
- De Vasconcellos, K., Sneyd, J. R. Nitrous oxide: Are we still in equipoise? A qualitative review of current controversies. Br J Anaesth. 111 (6), 877-885 (2013).
- Sanders, R. D., Ma, D., Maze, M. Xenon: Elemental anaesthesia in clinical practice. British Medical Bulletin. 71, 115-135 (2004).
- da Silva, R. M. Syncope: Epidemiology, etiology, and prognosis. Frontiers in Physiology. 5 (DEC), 8-11 (2014).
- Dittrich, A., Lamparter, D., Maurer, M. 5D-ASC: Questionnaire for the assessment of altered states of consciousness. A short introduction. , (2010).
- Studerus, E., Gamma, A., Vollenweider, F. X. Psychometric evaluation of the altered states of consciousness rating scale (OAV). PLoS ONE. 5 (8), (2010).
- Oostenveld, R., Fries, P., Maris, E., Schoffelen, J. M. FieldTrip: Open source software for advanced analysis of MEG, EEG, and invasive electrophysiological data. Computational Intelligence and Neuroscience. 2011, (2011).
- Stolk, A., Todorovic, A., Schoffelen, J. M., Oostenveld, R. Online and offline tools for head movement compensation in MEG. NeuroImage. 68, 39-48 (2013).
- Cimenser, A., et al. Tracking brain states under general anesthesia by using global coherence analysis. Proc Natl Acad Sci. 108 (21), 8832-8837 (2011).
- Hall, S. D., et al. GABA(A) alpha-1 subunit mediated desynchronization of elevated low frequency oscillations alleviates specific dysfunction in stroke - A case report. Clinical Neurophysiology. 121 (4), 549-555 (2010).
- Hall, S. D., et al. The role of GABAergic modulation in motor function related neuronal network activity. NeuroImage. 56 (3), 1506-1510 (2011).
- Cornwell, B. R., et al. Synaptic potentiation is critical for rapid antidepressant response to ketamine in treatment-resistant major depression. Biological Psychiatry. 72, 555-561 (2012).
- Saxena, N., et al. Enhanced Stimulus-Induced Gamma Activity in Humans during Propofol-Induced Sedation. PLoS ONE. 8 (3), 1-7 (2013).
- Quaedflieg, C. W. E. M., Munte, S., Kalso, E., Sambeth, A. Effects of remifentanil on processing of auditory stimuli: A combined MEG/EEG study. J Psychopharmacol. 28 (1), 39-48 (2014).
- Muthukumaraswamy, S. D., Shaw, A. D., Jackson, L. E., Hall, J., Moran, R., Saxena, N. Evidence that Subanesthetic Doses of Ketamine Cause Sustained Disruptions of NMDA and AMPA-Mediated Frontoparietal Connectivity in Humans. J Neurosci. 35 (33), 11694-11706 (2015).
- Bruhn, J., Myles, P. S., Sneyd, R., Struys, M. M. R. F. Depth of anaesthesia monitoring: What's available, what's validated and what's next?. Br J Anaesth. 97 (1), 85-94 (2006).
- Punjasawadwong, Y., Phongchiewboon, A., Bunchungmongkol, N. Bispectral index for improving anaesthetic delivery and postoperative recovery (Review) Bispectral index for improving anaesthetic delivery and postoperative recovery. Cochrane Library. 10, 10-12 (2010).
- Taulu, S., Kajola, M., Simola, J. Suppression of interference and artifacts by the Signal Space Separation Method. Brain Topography. 16 (4), 269-275 (2004).
- Purdon, P. L., et al. Electroencephalogram signatures of loss and recovery of consciousness from propofol. Proc Natl Acad Sci U S A. 110 (12), 1142-1151 (2013).
- Mhuircheartaigh, R. N., et al. Cortical and Subcortical Connectivity Changes during Decreasing Levels of Consciousness in Humans: A Functional Magnetic Resonance Imaging Study using Propofol. J Neurosci. 30 (27), 9095-9102 (2010).
- Pandit, J. J., et al. 5th National Audit Project (NAP5) on accidental awareness during general anaesthesia: summary of main findings and risk factors. Br J Anaesth. 113 (4), 549-559 (2014).
- Lakhan, S. E., Caro, M., Hadzimichalis, N. NMDA Receptor Activity in Neuropsychiatric Disorders. Frontiers in Psychiatry. 4 (Junne), 52 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon