Method Article
Manipulación de ploidía en Caenorhabditis elegans
En este artículo
Resumen
Este método permite la generación de nematodos Caenorhabditis tetraploides y triploides de cualquier cepa diploide. Las cepas poliploides generadas por este método se han utilizado para estudiar las interacciones de cromosoma en profase meiótica, y este método es útil para examinar importantes cuestiones fundamentales, del desarrollo, evolutiva, biología celular y cáncer.
Resumen
Mecanismos que involucran todo el genoma polyploidy desempeñan papeles importantes en el desarrollo y evolución; también, una generación anormal de las células tetraploides se ha asociado con la progresión del cáncer y el desarrollo de resistencia a los medicamentos. Hasta ahora, no ha sido posible manipular fácilmente la ploidía de un animal multicelular sin generar progenie sobre todo estéril. Presenta aquí un protocolo simple y rápido para generar tetraploide Caenorhabditis elegans animales de cualquier cepa diploide. Este método permite al usuario crear un sesgo en la segregación cromosómica durante la meiosis, en última instancia aumento de ploidía en C. elegans. Esta estrategia se basa en la reducción transitoria de la expresión del gen rec-8 para generar gametos diploides. Un mutante de rec-8 produce gametos diploides que pueden potencialmente producir tetraploides en fertilización. Este esquema manejable se ha utilizado para generar variedades tetraploides con mutaciones y los cambios del cromosoma para profundizar en la dinámica cromosómica e interacciones durante el apareamiento y sinapsis en la meiosis. Este método es eficiente para la generación de variedades tetraploides estables sin marcadores genéticos puede aplicarse a cualquier cepa diploide y se puede utilizar para derivar triploide C. elegans. Este sencillo método es útil para la investigación de otras cuestiones biológicas fundamentales pertinentes a inestabilidad genómica, gene dosificación, escala biológica, señalización extracelular, adaptación al estrés, desarrollo de resistencia a las drogas, y mecanismos de especiación.
Introducción
Genoma entero polyploidy existe en toda la naturaleza y es a menudo un paso necesario en la adaptación, especiación, organogénesis, cicatrización de la herida y la escala biológica; también es conocido por promover el cáncer y la resistencia a drogas1,2,3,4,5,6,7,8, 9 , 10 , 11 , 12. industrias de la agricultura y la pesca generan plantas poliploides, pescados y mariscos por tratamiento químico (p. ej., colchicina y orzalin) para obtener las tasas de crecimiento más rápidas y más voluminosas cosechas y el ganado13, 14,15. Experimental e ineficiente producción de tetraploides existe para el ratón y pez cebra modelo sistemas16,17. Sin embargo, la mayoría o todos poliploides animales multicelulares generados son catequizador letal o estéril y por lo tanto no es lo ideal para los estudios de laboratorio sobre los efectos de polyploidy en un organismo multicelular. En consecuencia, cualquier comprensión de la poliploidización del genoma en organismos pluricelulares se ha limitado a especies estrechamente relacionadas de evolutivo reciente poliploidización eventos18,19,20 . Un camino para avanzar en las consultas de la función biológica o consecuencias del polyploidization es el uso del sistema de modelo de C. elegans . Lo importante, C. elegans es un sistema genético tratable que normalmente existe como un diploide, contiene sólo cinco autosomas (A) y un cromosoma sexual (X) por genoma, es transparente para la observación en vivo de los procesos biológicos, y tiene un corto ciclo de vida de 3-4 días (de huevo a adulto sexualmente maduro). C. elegans ha demostrado ser capaz de reproducir como un tetraploide, que es el tipo más común de todo el genoma poliploidía en la naturaleza. Animales triploides pueden ser generados por cruzar tetraploides con diploides, pero su ploidía no es estable, y las cepas se vuelven diploides dentro de un par de generaciones.
En las últimas décadas sólo un puñado de viable y fértil C. elegans variedades tetraploides se aislaron en el laboratorio, usando una estrategia que es laborioso y genera sólo limitados tipos de cepas21,22, 23. esta estrategia genera tetraploides de C. elegans mediante tratamientos de choque térmico, que probablemente afecta a la segregación de cromosomas en los gametos, seguido por una investigación por supuesto animales poliploides utilizando marcadores genéticos. Estos tetraploides eran extremadamente útiles en la investigación de cómo este nematodo determina si se macho o hermafrodita. Estudios posteriores utilizan las cepas disponibles para investigar el crecimiento, la dosis de gen y regulación de la sinapsis durante la meiosis en este nematodo21,24,25,26. Desafortunadamente, estos estudios estuvieron limitados por la dificultad para generar nuevas variedades tetraploides y los marcadores genéticos de fondo estas cepas contenidas. Se muestra a continuación es un protocolo simple y rápido para generar tetraploides estables, que se ha utilizado para generar cepas para estudiar la regulación de la sinapsis durante la meiosis27.
Como en la naturaleza, poliploidización puede surgir por la formación de diploide en vez de gametos haploides. Nuestro hallazgo de que un componente de cohesina específica de meiosis mutante rec-8 genera espermatozoides diploides y ovocitos tumbaron el gen rec-8 resultaría en la producción de descendencia tetraploide (figura 1)27, 28,29. Generación de variedades tetraploides simplemente implica derribar 8 rec por ARN de interferencia (ARNi) para dos generaciones en orden a la fenocopia rec-8 gametos diploides mutantes. Supuesta poliploides pueden ser fácilmente identificados por su más que el tamaño normal del cuerpo. Poliploides son confirmados como tetraploides total o parciales por contando el número de cromosomas por núcleo una vez que se establecen líneas estables.
La estrategia aquí descrita permite la generación de estable tetraploides cepas NEMATODAS Caenorhabditis de fondo genético diploide inicial o cariotipo sin el uso de marcadores genéticos. Puesto que este protocolo es más eficiente, versátil y simple que el esquema anteriormente utilizado, ampliará las herramientas necesarias para consultar los roles de poliploidización en procesos fundamentales de desarrollo, la estabilidad del genoma y la evolución en pluricelulares organismos. La limitación sólo previsible en el uso de este protocolo es en fondos genéticos resistentes a ARNi.
Protocolo
1. ajuste rec-8 RNAi (día 1-3 en la figura 2)
Este protocolo se ha modificado de Kamath y Ahringer30.
- Para la inducción de la rec-8 dsARN expresión en Escherichia coli, preparar medio de crecimiento de nematodos (NGM) agar placas31 suplementado con una concentración final de 1 mM Isopropil-β-D-2-tiogalactopiranósido (IPTG) y 100 μg/mL ampicilina. Almacenar en la oscuridad a 4 ° C hasta su utilización, hasta por 4 semanas.
- Bacterias HT115 racha lleva el rec-8 (W02A2.6) clon del clon Ahringer laboratorio biblioteca30 rec 8 en platos de caldo Luria (LB) suplementado con 100 μg/mL ampicilina y tetraciclina μg/mL 50. Crecen durante la noche en un agitador a 37 ° C.
- El día 1, inocular las colonias individuales de las colonias solo recién veteadas de las bacterias e. coli de HT115 llevar el clon de ARNi rec 8 en 4 mL LB que contiene 100 μg/mL ampicilina y tetraciclina μg/mL 50. Cultivar la cultura de las bacterias durante la noche en un agitador o un tambor de rodillo a 37 ° C.
- A la mañana siguiente (día 2), inducen la producción de doble cadena (ds) RNA para rec-8 W02A2.6 en el cultivo bacteriano HT115 añadiendo una concentración final de 1 mM IPTG y agitándolo durante 40 min a 37 ° C.
- Después de la inducción, semilla planchas NGM/IPTG con 100-200 μL de HT115 rec-8 bacterias y almacenar las placas a temperatura ambiente en la noche oscura (día 3).
- A la mañana siguiente (día 4), añadir la tensión deseada de nematodos a las placas de bacterias inducidas HT115 rec-8 como se describe en el paso 2.1 a continuación.
2. generar y aislar tetraploides (día 4-16 en la figura 2)
- En el día 4, colocar 3-4 jóvenes hermafroditas (cuarto) estado larvario de L4 de la cepa diploide deseada en las placas de la NMG/IPTG sembradas con HT115 rec-8 bacterias que habían sido inducidas el día antes (paso 1.5, arriba). Crecen nematodos a 15 ° C en la oscuridad.
- Repita los pasos 1.3 y 1.4 a partir de 3 días después del paso 2.1, que tres días antes de la primera progenie (F1s) de ese paso se L4s. Los tiempos de este paso dependerá de cuán rápido crece una cepa Nematoda a 15 ° C. Algunas cepas mutantes diploides son cultivadores lentos, y este momento se necesita fina sintonización para aislar tetraploides.
- Día 8 (después de 4 días de tratamiento de alimentación de ARNi rec-8 ), 20 (2 hermafroditas/placa Petri) de las F1 (primera generación filial) L4 hermafroditas en las HT115 rec-8 bacterias en recién inducido HT115 rec-8 ARNi de transferencia y permite que fertilizarse.
- Por otra parte, transferencia 20 de los hermafroditas F1 L4 crecido en las HT115 rec-8 bacterias en recién inducida por HT115 rec-8 ARNi bacterias junto con machos no tratados de la misma cepa (2 hermafroditas machos/placa de 4-6).
- El día 13, Inicio detección F2 (segunda generación filial) progenie que aparecen largo (Lon) o en general mayor que el tipo salvaje; luego se transfieren los animales Lon en regular OP50 o HB101 cepas de bacteria e. coli . Continuar investigación F3 progenie (tercer filial); sin embargo, progenie F3 de la misma placa no puede considerarse cepas independientes si ellos establecidos, porque podían ser hermanos del mismo establecieron ya madre de F2.
Nota: Supuestos tetraploides son fácilmente identificables porque son claramente más largos que los diploides. Hermafroditas de tipo salvaje son dos tercios menos de tetraploides. Porque es más largo, un organismo tetraploide hace un giro extra mientras se mueve hacia adelante generando ondas sinusoidales cuerpo-flexión de la cabeza a la cola (Figura 3A). - Permiten Lon gusanos para fertilizarse y propagan escogiendo Lon progenie hasta sólo Lon progenie se engendró en la ausencia de rec-8 tratamiento de RNAi. Esto puede tardar dos o tres generaciones más. LON gusanos a menudo son estériles y no producen progenie.
3. verificación de variedades tetraploides (película 1 y Figura 3A, B)
Nota: Variedades tetraploides pueden validarse contando el número de cromosomas en los óvulos no fecundados. Microscopía fluorescente se puede utilizar para detectar el número de pares de cromosomas en ovocitos no fecundados diploides (antes de la división meiótica), si la cepa tiene un marcador fluorescente de los cromosomas. En la ausencia de marcadores de cromosoma fluorescente, pueden proyectará tetraploides nematodos los nematodos de fijación y tinción con un colorante de ADN; Vea a continuación un protocolo para la fijación de etanol y 4′ de todo animal, coloración diclorhidrato 6-Diamidine-2′-phenylindole (DAPI).
- Todo animal de la coloración de DAPI
Nota: Variedades tetraploides con 12 pares de cromosoma conectado pueden ser validadas por DAPI tinción de estos animales y contar el número de cuerpos DAPI en sus ovocitos no fecundados.- Lugar de 5 a 10 μl de buffer M931 en un portaobjetos de microscopio, luego transferencia 6-10 nematodos a la caída.
- Con un microscopio de disección, sacar la mayor parte de la M9 de la gota sin eliminar los nematodos con un pañuelo de limpieza sin pelusa. Luego, añadir una gota de 10 μl de etanol al 90% en los gusanos. Permitir a los gusanos que se seque completamente, pero para no más de un par de segundos.
- Tan pronto como el etanol se evapora (esto se puede ver como ocurre con el microscopio de disección), agregar un adicional 10 μl de etanol al 90% en los gusanos.
- Repita el paso 3.1.3 tres veces más.
- Una vez que se haya evaporado la última gota de etanol, agregue 6 μl de colorante DAPI o Hoechst en la concentración final recomendada en los medios de montaje de elección (por ejemplo, una dilución de la 1:1,000 de una concentración stock de 2 ng/μl DAPI en M9). Para almacenamiento a largo plazo de las diapositivas, 0.5% p-fenilenodiamina disuelto en 20 mM Tris-HCl, pH 8,8, en 90% de glicerol como solución antifade, en lugar de M9, puede utilizarse.
- Cubrir los gusanos en el portaobjetos con un cubreobjetos y sellar los bordes del cubreobjetos con esmalte de uñas. Puntuación en un microscopio de fluorescencia (paso 3.1.7) por lo menos 10 minutos después de agregar el cubreobjetos. Diapositivas sin preservador de fluorescencia pueden almacenarse durante unos días a 4 ° C antes de anotar, pero la calidad de fluorescencia comienza a disminuir después de algunos días.
- Utilizando un microscopio de fluorescencia con 100 aumentos, anotar el número de cuerpos solo de DAPI (pares de cromosomas probablemente único) en el oocito sin fertilizar más maduro, que es inmediatamente adyacente a la espermateca y aún no ha entrado en la espermateca o el útero.
- Para conseguir cuerpos DAPI individuales dentro de un núcleo de ovocito, usar foco fino del microscopio a moverse lentamente desde la parte superior del núcleo del ovocito al fondo durante la cuenta. Entonces, narran el mismo núcleo mientras se mueve el foco en la dirección opuesta (es decir, desde el fondo hasta la parte superior del núcleo) para confirmar el número contado de cuerpos DAPI.
- Anotar la más madura ovocitos no fecundados en cada una de las dos gónadas en por lo menos diez hermafroditas por cepa Lon estable. Ovocitos de tipo salvaje tienen 6 cuerpos DAPI en promedio, 5 pares de autosome y el par de cromosomas sexuales. La presencia de 12 cuerpos DAPI en el ovocito de cepas Lon estables indica que los animales en esta cepa son parciales (4 juegos de autosomas, 3 X-cromosomas) o completadas (4 juegos de autosomas, 4 X-cromosomas) tetraploides.
- Calcular el número promedio de DAPI cuerpos observados desde múltiples ovocitos (por lo menos 10) por cepa. Se tocarán algunos pares de cromosomas o en top de otro, por lo que el número de DAPI cuerpos en un oocito es a menudo más pequeño que el número real de pares de cromosomas.
- (Opcional) Validar otras cepas de Lon estables donde el número promedio de organismos DAPI es 12 para probar si son full (4A, 4 X) o parcial (4A, 3 X) tetraploides por la inmunofluorescencia que manchaba contra proteínas de eje del cromosoma como HTP-332. Esta coloración distinguir pares de cromosomas, mostrando un patrón cruciforme de cromosomas solo presentes en el tetraploide parcial.
Resultados
Deterioro de la rec-8 meiótica cohesina componente función resultados en gametos diploides:
Proyección de imagen de las divisiones meióticas de cohesina componente mutante rec-8 espermatozoides y ovocitos revelaron posibles mecanismos para la generación de animales tetraploides (figura 1)27,29,33. Mecánico, los defectos de la división meiótica de la rec-8 mutante esperma y ovocitos son diferentes; sin embargo, gametos diploides masculinos y femeninos son producidos por el mutante de rec-8 .
En la meiosis de tipo salvaje, los cromosomas homólogos se convierten temporalmente conectados entre sí por la recombinación de crossover y entrar en la primera división meiótica como una unidad o bivalente (figura 1A)34. Durante la primera división, los cromosomas homólogos (homólogos) segregan lejos de uno a otro, mientras que hermana cromátidas hermanas de cada homólogo permanecen juntos hasta la segunda división. Aunque el patrón de segregación cromosómica es el mismo en gametos femeninos y masculinos, las divisiones de ovocitos son asimétricas mientras que espermatocito divisiones son simétricas y se someten a una citocinesis especializados. En cada división, el ovocito descarta la mitad del producto de la división en un pequeño cuerpo polar. Así, cada precursor del óvulo da lugar a un único ovocito haploide y dos cuerpos polares (figura 1B, C)35. Por el contrario, un precursor solo espermatocito da lugar a cuatro espermátidas funcionales por que experimenta dos divisiones simétricas. La segunda división culmina con cuatro espermátides el florecimiento fuera de un cuerpo residual. Este citocinesis es especial en que el patrón y el número de espermátides se determina por los centrosomas36.
En el precursor de los gametos mutantes 8 rec , recombinación de cruce entre los cromosomas homólogos no tiene lugar y homólogos no están conectadas como un bivalente al principio de la primera división meiótica29,34. Cromátida hermana de cada homólogo segregar lejos de uno a otro en la primera división en lugar de permanecer juntos hasta la segunda división, como lo hacen en gametos de tipo salvaje. Curiosamente, el fenotipo mutante de rec-8 durante la segunda división es diferente en gametos masculinos y femeninos en que ovocitos no someterse a la citocinesis que espermatocitos sufren una citocinesis relativamente normal (figura 1B– F) 27 , 28 , 29. óvulos diploides surgen porque en la segunda división no segregación cromosómica y citocinesis, por lo tanto, no saca el segundo cuerpo polar (figura 1B, C). Espermatocitos en germlines rec-8 experimentar el florecimiento del spermatid o citocinesis, pero a menudo segregan ambos conjuntos de cromosomas a una de las espermátides a ceder un spermatid diploide y un spermatid carecer de cromatina (figura 1– F)27. Cuantificación de la proporción de espermatozoides rec-8 carecer de cromatina se muestra en la Figura 1F.
La formación de los gametos diploides femeninas y masculinas en mutantes de rec-8 sugiere que este fenotipo mutante podría utilizarse potencialmente para generar variedades tetraploides de genoma completo.
Generación de cepas de C. elegans de tetraploides:
Puede evitarse la presencia de una mutación en el gene de rec-8 en todas las variedades tetraploides generados transitoriamente derribando 8 rec por ARNi29,37. Esto supone que la reducción de la función rec-8 por ARNi podría generar gametos diploides que potencialmente podrían dar lugar a animales tetraploides de todo el genoma, como mutantes de rec-8 29,37. Esencial de este protocolo es que rec 8 mutantes dan lugar a gametos diploides tanto Señor a un número razonablemente grande de jóvenes, al contrario de otros mutantes meióticas, que dan lugar a gametos aneuploides y son sobre todo estéril o embrionario/larvas letal.
Múltiples variedades tetraploides se generaron por la alimentación de las bacterias C. elegans expresando dsARN rec-8 usando una de dos estrategias (ver Protocolo, figura 2y tabla 1)27. Tetraploides pueden ser generadas por hermafroditas autofértiles para dos a tres generaciones en placas de Petri con las bacterias expresan dsARN rec-8 . Por esta estrategia hermafrodita se coloca en recién hecho rec-8 placas de RNAi y su progenie se transfiere unos días más tarde sobre placas nuevas con recién inducido rec-8 ARNi expresa bacterias (ver Protocolo). Además, tetraploides pueden generarse a través del cruce de la primera generación de hermafroditas alimentada las bacterias expresando dsARN rec-8 con machos no tratados del mismo genotipo en cajas Petri con bacterias expresando rec-8 dsRNA ( Figura 2). En este caso, los varones en la Cruz están expuestos a las bacterias de ARNi rec-8 desde la etapa de L4, durante el apareamiento. Ambos sistemas dan lugar a animales tetraploides27. La tabla 1 muestra variedades tetraploides obtenidos mediante el esquema presentado aquí. Triploides y tetraploides C. elegans son más grandes en tamaño que los diploides y triploides cepas son inestables y tienden a ser diploides en una o dos generaciones, mientras que las variedades tetraploides son relativamente estable22,23. Supuestas variedades tetraploides se identificaron como más grande que el original hermafroditas de cepa (Lon) que engendró sólo progenie de Lon (Figura 3A). LON animales son fácilmente identificables - tipo salvaje los animales diploides son dos tercios de la longitud de tetraploides y sus cuerpos no hacen una curva adicional, que puede ser notada durante su movimiento hacia adelante de sinusoidal (Figura 3A).
Variedades tetraploides fueron confirmados por la investigación de la presencia de 12 pares de cromosomas en ovocitos de los hermafroditas tetraploides en comparación con seis pares de cromosomas en ovocitos de hermafroditas diploides (figura 3B, Cy 1 película).
Clases de tetraploides:
Se identificaron dos tipos de hermafroditas tetraploides: varones deseado uno en frecuencias similares como hermafroditas diploides y el otro engendrado varones en mucho las frecuencias más altas (tabla 1). Estos dos tipos de hermafroditas tetraploides se ha demostrado que se diferencian en que las frecuencias de clase produciendo similares a los de los machos diploides son tetraploides de todos sus cromosomas (4A, 4 X), mientras que la clase producción de altas frecuencias de los machos son hermafroditas que son tetraploides para los autosomas pero triploide para el cromosoma del sexo (4, 3 X). La clase más tarde de tetraploides es estable y produce 4A, hermafroditas de X 3 y 4A, 2 machos de X.
Variedades tetraploides crecen más lentamente y producen tamaño cría reducido en comparación con los diploides que se derivan, como se ve por las tensiones generadas con el método anterior22,23. Madl y Herman22 sugiere que podría deberse a la mayor proporción de embriones muertos en las variedades tetraploides aneuploide en el ovocito, sin embargo la inspección superficial de variedades tetraploides no revelan suficientemente elevados números de aneuploides ovocitos ni ovocitos anormales o espermatocito divisiones para tener en cuenta la reducción observada en tamaño cría (película 2y figura 3, D).
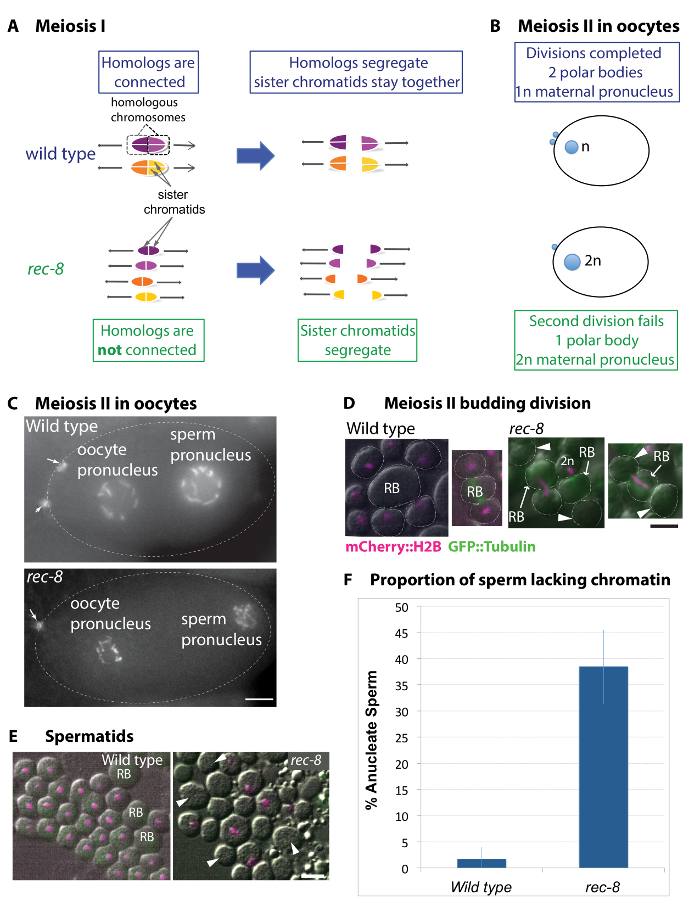
Figura 1: Gametogénesis en rec-8 mutante implica mecanismos posibles para generar manchas poliploides estables. (A) diagrama del patrón de organización y segregación de cromosomas en divisiones meióticas mutantes tipo salvaje y rec-8 . En la meiosis de tipo salvaje, los cromosomas homólogos se separan en la primera división meiótica. Cromátida hermana de cada homólogo Oriente hacia el mismo polo del huso y permanece juntos hasta la segunda división. En rec-8 mutantes, homólogos no forman cruces y por lo tanto no están conectadas. En contraste a salvaje tipo rec-8 hermana cromátides hermanas orientan de uno con el otro y se separan en la primera división meiótica. (B) diagrama de tipo salvaje y mutantes ovocitos mostrando el pronúcleo femenino y sacados cuerpos polares (pronúcleo masculino no está representado). En ovocitos de tipo salvaje, dos divisiones meióticas asimétricas resultan en la extrusión de dos cuerpos polares. En mutantes de rec-8 sin embargo, el segundo cuerpo polar extrusión no dando como resultado un ovocito diploide. (C) las imágenes de tipo salvaje y rec-8 ovocitos mutantes expresando mCherry::histone H2B. Las flechas indican dos cuerpos polares en el ovocito de tipo salvaje y uno en el mutante rec-8 . Barra de escala es de 5 μm. (D y E) en vivo imágenes de espermátides de tipo salvaje y rec-8 animales mutantes expresar mCherry::histone H2B (magenta). Puntas de flecha indican anucleados espermátides. Barra de escala es 2 μm. (D) espermatocitos que experimenta la segunda división (incipiente) en el tipo salvaje y mutante de rec-8 . Los espermatocitos de tipo salvaje sufren divisiones simétricas dando por resultado cuatro espermátides incipiente, cada uno con un complemento de cromosomas haploides. En rec-8 mutante espermatocitos, segregación cromosómica es deteriorada en la segunda división. Más a menudo posible una sola masa de cromatina permanece en el cuerpo residual (RB) o en uno de los dos hermanos espermátides en la segunda división meiótica. Esto da lugar a espermatozoides mutante de la rec-8 anucleados (indicados por las puntas de flecha) o esperma diploide. (E) imágenes en vivo de espermátides post-brotación de tipo salvaje y mutantes de rec-8 visualizadas con microscopia de fluorescencia y contraste de interferencia diferencial (DIC). Tipo salvaje espermátides todos tienen masas similares de cromátidas hermanas. espermátides mutante REC-8 forman espermatozoides anucleados. (F) cuantificación de espermatozoides anucleados mutante de tipo salvaje y rec-8 . REC-8 mutantes producen 38.5% de esperma anucleados en comparación con menos de 1,6% en el tipo salvaje. Prueba exacta de Fisher indica que un mutante de rec-8 tiene una incidencia significativamente mayor de esperma anucleados (p ≤0.0001) comparada con el tipo salvaje. Barras de error representan desviaciones estándar. Haga clic aquí para ver una versión más grande de esta figura.
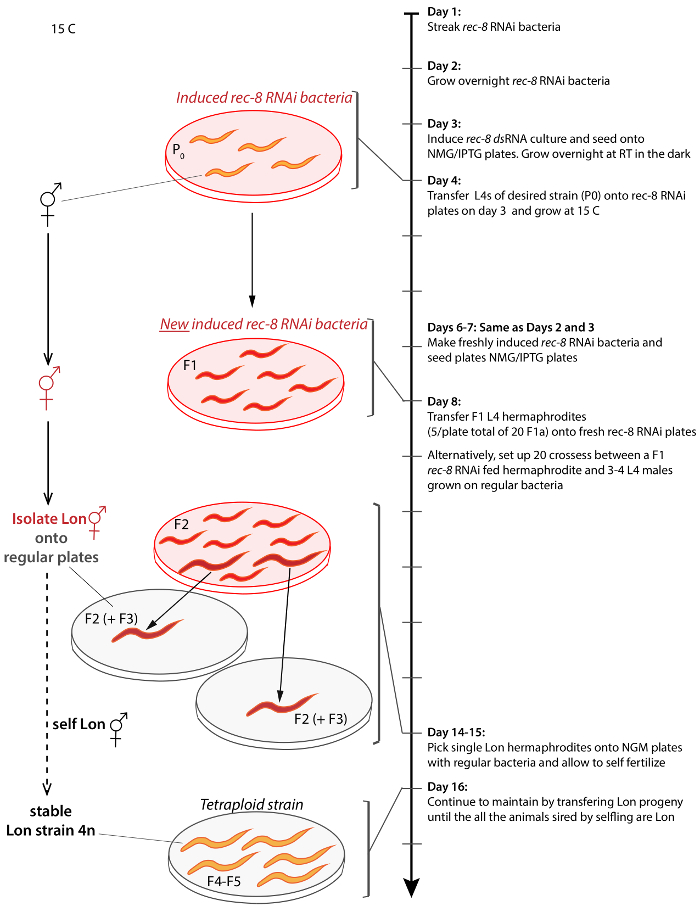
Figura 2: Esquema para la generación y aislamiento tetraploide C. elegans de cualquier cepa. Flecha de la derecha representa la línea de tiempo del Protocolo a partir de día 1 y progresando a día 17. Resultados similares se pueden lograr por hermafroditas de cruce a los varones no tratados el día 9. Soportes de conectan la representación de un paso a la línea de tiempo. Animales no tratados son de color naranja, los animales tratados son de color rojos, Lon animales son más grandes en tamaño, rec 8 dsARN expresando las bacterias aparece como placas transparentes con fondo rojo transparente y regulares bacterias OP50 es representado en gris transparente placas de fondo. Procedimiento se realiza a 15 ° C a menos que se indique lo contrario. Haga clic aquí para ver una versión más grande de esta figura.
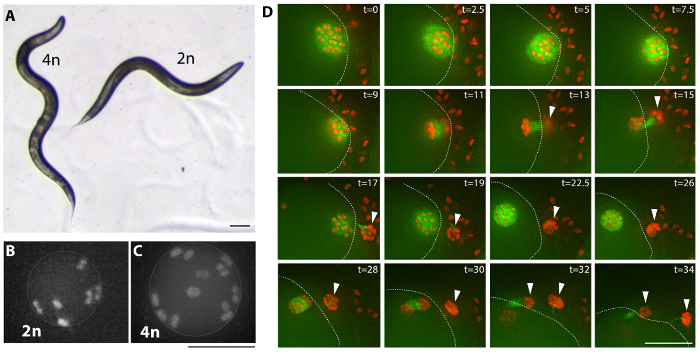
Figura 3: ejemplos tetraploides. Imagen de campo brillante (A) de un animal (MSC2) tetraploide y la cepa diploide que fue derivado de (AV740). Tetraploide de C. elegans son en general más grande y más largo (Lon) que el diploide. Esta diferencia en tamaño de cuerpo da lugar a una curva sinusoidal adicional del cuerpo de la mudanza tetraploide y puede ser utilizada como un criterio a la pantalla para derivados tetraploides. Barra de escala es 0,1 mm. (B, C) imágenes de fluorescencia de diploide (AV740) y tetraploides (MSC1) más madura ovocitos no fecundados nulcei, antes de las divisiones meióticas. Inspección secundaria se realiza mediante la observación del número de pares de cromosomas en ovocitos no fecundados de las cepas Lon establecidas, como se muestra en la película 1 de una cepa de MSC1 expresando Mcherry::H2B y GFP::β-tubulina en la línea germinal. Barra de escala es 5 μm. (D) las imágenes de un lapso de tiempo (película 2) divisiones meiótica ovocito tetraploide que representan una meiosis normal generalmente. Cabezas de la flecha marcan cuerpos polares y una línea de puntos marca la corteza del ovocito en la espermateca y rodeado por los espermatozoides; t = tiempo transcurrido en minutos. Barra de escala es 10 μm. haga clic aquí para ver una versión más grande de esta figura.
| Genotipo | Derivado de tetraploide (juegos de autosomas: # de X-cromosomas) * | Cepa parental (diploide) |
| meIs16 [pie-1p::mCherry:: su-58 + unc-119(+)]; | MSC1 (4A:4 X) | MSC0 |
| ruIs57 [pie-1p::GFP::b-tubulina + unc-119(+)] | MSC2 (4A:3 X) | |
| MSC3 (4A:4 X) | ||
| MSC5 (4A:3 X) | ||
| MSC6 (4A:4 X) | ||
| MSC8 (4A:4 X) | ||
| UNC-119(ED3) III; ddIs6; ddIs6 [tbg-1::GFP + unc-119(+)]; ltIs37; ltIs37 [pAA64; pie-1p::mCherry::HIS-58 + unc-119(+)] IV | MSC14 (4A:3 X) | TMR17 |
| MSC15 (4A:3 X) | ||
| MSC16 (4A:4 X) | ||
| SPO-11 (me44) / nT1 IV; + / nT1 [qIs51 [myo-2::gfp Epis-10::gfp, PF22B7.9::gfp]] V | AV800& | AV776 |
| meIs8 [pie-1p::gfp::cosa-1 + unc-119(+)] II. | AV809y | AV727 |
| ltIs37 [pie-1p::mCherry:: su-58 + unc-119(+)] IV; | ||
| ltIs38 [pie-1p::gfp::ph(PLC1delta1) + unc-119(+)] | ||
| meIs8 [pie-1p::gfp::cosa-1 + unc-119(+)] II. mnT12 (X; IV) | AV826y | AV695 |
| mIn1 [dpy-10(e128) mIs14 [myo-2::gfp pes-10::gfp]] / | AV810y | DR2078 |
| bli-2(e768) unc-4(e120) II | ||
| ruIs32 [pie-1::GFP::H2B + unc-119(+)] III | AV822y | AZ212 |
| AV823y | ||
| C. briggsae - mfIs42 [Cel-sid-2 + Cel-myo-2::DsRed] | AV824y | JU1018 |
Tabla 1: variedades tetraploides generadas. * Deducir al anotar el número de bivalentes (pares homólogos conectados) y univalents (homólogos individuales) en ovocitos antes de las divisiones meióticas además la proporción de varones engendrado.
1 de película: proyección a confirmar si cepas Lon estables completas o parciales tetraploides. Película comienza con un diagrama de un hermafrodita de tipo salvaje destacando la región reflejada (ovocitos no fecundados) para identificar los tetraploides contando los pares de cromosomas. Siguiendo el diagrama, una serie de películas de Z-stack y proyecciones muestran las gónadas de los animales diploides y tetraploides fijados y teñido DAPI o vivir imágenes de cepas expresando Mcherry::H2B histona. Proyección se realiza contando el número de pares de cromosomas homólogos conectados en ovocitos no fecundados. Conteo de MCherry o DAPI manchados cuerpos se realiza en el oocito sin fertilizar más cercano a la esperma almacenar espermateca (el "ovocito-1"). Los cromosomas en este ovocito más condensados y separados uno del otro, para permitir más precisa homólogo pares de cuentas. Se revisaron más de 10 animales por cepa para asegurar las cuentas de cromosoma-1 ovocito eran precisas. Espesor de pila es de 0,2 μm. haga clic aquí para ver este video. (Clic derecho para descargar)
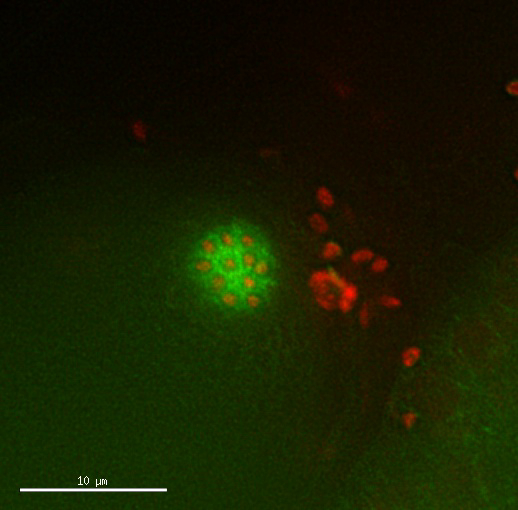
Película 2: divisiones de ovocitos tetraploides aparecerán normales. Lapso de tiempo de dividir ovocitos de una cepa tetraploide expresando Mcherry::H2B histonas y tubulina GFP::β. Tiempo y patrón de las divisiones parecen normales. Imágenes tomadas cada 2,5 minutos por favor haga clic aquí para ver este video. (Clic derecho para descargar)
Discusión
Producción de haploides gametos (n) es clave para generar un cigoto diploide (2n) en la fertilización. Esta reducción del genoma se logra durante la meiosis con dos divisiones celulares consecutivas después de una duplicación del genoma individual. Generar haploides gametos, C. elegans, como con la mayoría de los metazoos, segregan homólogos maternal y paternal-derivados de la primera división, mientras que hermana cromátidas hermanas de cada homólogo se segregan en la segunda división. Una manera genoma polyploidy se presenta en la naturaleza es a través de la generación de gametos que no a la mitad su tamaño del genoma durante la meiosis.
Ha sido conocido por más de 50 años que tetraploide nematodos C. elegans son viables y fértiles. Nigon23y más adelante Madl y Herman22generado e identificó un puñado de C. elegans tetraploides interrumpiendo segregación cromosómica meiótica usando tratamientos de shock térmico y uso de marcadores genéticos, respectivamente. Un solo adicional C. briggsae variedad tetraploide se derivó usando este protocolo más de 30 años más adelante24. Estos tetraploides se utilizaron para investigar cómo C. elegans determinar si masculina o hermafrodita, cómo regula la ploidía y el crecimiento y analizar el apareamiento y sinapsis en meiosis25,26, 38 , 39 , 40. sin embargo, estos y otros estudios que requieren el uso de específicas tetraploides o variedades triploides fueron limitados por la dificultad en la generación de variedades tetraploides por este método.
El protocolo aquí descrito permite la generación de 4A completo estable, 4 X y parcial 4A, 3 X tetraploide Caenorhabditis NEMATODAS cepas de cualquier inicial fondo genético diploide o karyotype sin el uso de marcadores genéticos.
Tetraploidy puede presentarse en más de un mecanismo en la C. elegans:
Madl y Herman sugirieron que las variedades tetraploides que generó probablemente derivan de un estado intermedio triploide. Sus cepas fueron obtenidas por selección durante varias generaciones o cruzando el triploide supuesto intermedio con machos diploides22. Los defectos en el cromosoma repartir en rec-8 mutantes que da lugar a óvulos diploides y a esperma sugieren otro posible mecanismo por el cual animales tetraploides pueden surgir con la rec-8 esquema de ARNi27.
Las rec-8 ARNi tratado hermafroditas podrían producir diploides ovocitos y espermatocitos, que darían lugar a animales tetraploides en fertilización. Es consistente con esta posibilidad el hecho de que algunos de los clonados hermafroditas F2 dieron lugar a cepas Lon estables en la próxima generación, que sugiere que el clonado hermafroditas Lon F2 donde ya tetraploide. En el esquema de cruce, la primera generación de rec-8 ARNi tratado hermafroditas se cruza con machos no tratados. Espermatocitos diploides todavía podrían surgir en los hombres porque la Cruz se hace en presencia de bacterias expresando dsARN rec-8 y por lo tanto, los machos están expuestos a rec-8 ARNi durante el apareamiento durante al menos 3 días. Por lo tanto, los poliploides Lon en el esquema cross-fertilizing también pudieran haber formado de la fertilización de ovocitos diploides por un espermatozoide diploide. Estables variedades tetraploides pueden surgir de cualquier fecundación entre gametos diploides o de cruzar animales triploides que contengan ovocitos de ploidia variable con animales diploides producen espermatozoides haploides.
Consideraciones importantes:
Uno mismo-frente a esquemas de intercambio de ideas:
El esquema de la uno mismo-fertilización rec-8 ARNi tratados F1 hermafroditas y el régimen de cruce de hermafroditas tratadas con los varones no tratados dieron lugar a 4A, 4 X y 4A, 3 variedades tetraploides de X. Aunque poliploides más fueron aislados inicialmente del sistema uno mismo-fertilización, más de estos animales poliploides fueron estériles y así ambos sistemas son igualmente eficientes en producir cepas estables tetraploides. La razón para el éxito y la esterilidad en el esquema autofértiles sigue siendo desconocida. Aunque ambos sistemas son igualmente eficientes, el esquema autofértiles es más fácil que no requiere el aislamiento de machos para el apareamiento. Además, cuando la cepa de interés es ineficiente o defectuosa en el apareamiento, el esquema autofértiles sería preferible. El esquema de cross-fertilizing puede utilizarse para generar complejos tetraploides que contiene más de dos versiones de un solo cromosoma.
Modificaciones y limitaciones:
Actualmente, este protocolo trata de rec-8 tratamiento de ARNi alimentando bacterias expresando dsRNA para el gen de la rec-8 . Así, este Protocolo no funciona en la especie Caenorhabditis insensible a ARNi de alimentación, o en mutantes defectuosos en difusión ambiental o sistémica de ARNi entre tejidos41,42,43. Potencialmente, este problema podría solucionarse mediante la introducción de ARNi tratamiento por inyección directa de dsRNA de interés directamente en la línea germinal.
Animales triploides deben generarse un tetraploide, cruzando a un animal diploide del que se deriva, porque este esquema no genera variedades triploides estable44,45. Sólo el 15% de los huevos deseada por triploides portilla y su progenie es sobre todo estéril descendencia debido a aneuploide. Además, la progenie fértil sobreviviente pocos tiende a ser completa o cerca de diploides dentro de un par de generaciones. Esto es probable, al menos en parte, porque los ovocitos corrigen parcialmente trisomía por segregar el tercer cromosoma en el cuerpo polar en la primera división meiótica.
Una limitación insuperable de este protocolo es que no funciona para hacer tetraploides de mutantes que afectan a los componentes de la maquinaria de RNAi porque son resistentes a ARNi tratamiento46.
Solución de problemas:
REC-8 ARNi:
Algunas consideraciones son cruciales para este protocolo tenga éxito. La primera es utilizar IPTG fresco y recién hechas placas de IPTG NMG para la inducción de la rec-8 producción de dsRNA en las bacterias las bacterias HT115 llevar el clon de rec-8 (W02A2.6). IPTG es sensible a la luz y es importante reducir la exposición a la luz a las placas. Placas IPTG pueden almacenarse un mes a 4 ° C en la oscuridad. En segundo lugar, el rec-8 (W02A2.6) ARNi HT115 las cepas bacterianas de la biblioteca de Ahringer (Kamath y Ahringer 2003) rindieron un fenotipo rec-8 más fuertes que otros disponibles rec-8 clones HT115.
Mantenimiento de la variedad tetraploide:
Tetraploides cepas crecen muy lentamente y producen a más de 50 progenies por generación47. Todas las variedades tetraploides identificadas son relativamente estables, pero puede romper y convertirse en diploide cuando subrayó (comunicación personal de Jonathan Hodgkin y nuestras observaciones no publicadas). Por lo tanto, es importante tener en cuenta cuando crecen variedades tetraploides a 25 ° C, calor-dio una sacudida eléctrica, de hambre, o congelados y descongelados, rápidamente puede volver a Diploidia, por lo que es importante seguir escoger los animales Lon cuando estas cepas de descongelación o cuando exposición de estas cepas a condiciones estresantes que pueden causar a revertir.
Posibles aplicaciones:
Investigación del efecto o el papel de la poliploidización del genoma entero en evolución, ciclo celular, expresión génica y el desarrollo en organismos pluricelulares ha dependido de las comparaciones entre: las células en un organismo que contienen diferente ploidía, la misma célula estrechamente relacionada con los tipos de especies con diferente ploidía o especies que han sufrido eventos de poliploidización evolutivamente reciente y aislamiento físico3,5,6,7,8 ,11,18,19,20,48,49,50. Aunque tetraploides pueden derivarse de sistemas modelo de pez cebra y el ratón, sus crías son estériles o catequizador letal16,17. Además, estos sistemas de modelo tienen ciclos de vida largo en comparación con el C. elegans, y los métodos disponibles para generar animales poliploides son complejos e ineficientes. Por lo tanto, las cepas de C. elegans obtenidas por este método será fundamental para impulsar las investigaciones sobre los efectos y funciones de todo el genoma polyploidy en los organismos multicelulares.
Puesto que un triploide puede derivarse de un tetraploide cruzando el tetraploide para la diploide original, una comparación entre diploides, triploides y tetraploides que sólo difieren en el número de copias del genoma, provee una oportunidad única y sin precedentes para evaluar el equivalente animales/órganos/células con genoma diferente tamaño (o dosis de gen). La flexibilidad y facilidad del esquema aquí descrito nos ha permitido generar docenas de variedades tetraploides de diferentes genéticas diploides o cariotipos. Algunas de estas cepas fueron utilizados ya a mecanismos de consulta del cromosoma homólogo apareamiento y sinapsis durante la meiosis27.
Las cepas tipo salvaje y mutante tetraploides con marcadores fluorescentes proporciona nuevas vías de investigación para entender las relaciones entre la relación de tamaño y nuclear/citosol genoma animal intracelular/celular/órgano y toda escala, todo el genoma poliploidización en adaptación, especiación, dosis del gen, expresión y desarrollo de órganos y tejidos. Además del estudio de la escala biológica, la generación de variedades tetraploides será significativamente más consultas de cuestiones biológicas fundamentales pertinentes a extracelular señalización, inestabilidad del genoma, endorreduplicación, genoma duplicación, dosificación del gene, adaptación al estrés, desarrollo de resistencia a las drogas y especiación del mecanismo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos al centro de genética de Caenorhabditis (financiado por el Instituto Nacional de salud (NIH) Oficina de investigación infraestructura programas P40 OD010440) para las cepas. Los autores desean agradecer a Baptiste Roelens y Eli Lessman, por facilitarnos el laboratorio Mano CCNY, CUNY para el uso de su laboratorio por parte de la película y por su ayuda y comentarios constructivos. Este trabajo fue financiado por una concesión de PSC-CUNY TRADB-46-113 y NIH grant 1SC2GM118275-01. M.S. fue apoyada parcialmente por un Instituto canadiense de beca postdoctoral de la salud (CIHR) y E.K. fue apoyada por la subida de NIH/NIGMS conceder GM062981.
Materiales
| Name | Company | Catalog Number | Comments |
| Dissecting Microscope | Motic Microscopy | SMZ171 | |
| Name | Company | Catalog Number | Comments |
| NGM agar plates | |||
| 60 mm x 15 mm Petri Dishes, Sterile | Tritech Research | T3305 | |
| 35 mm x 15 mm Petri Dishes, Sterile | Tritech Research | T3500 | |
| Bacteriological Agar, 5 kg | VWR | 89140-850 | |
| Sodium Chloride, Biotechnology Grade | VWR | 97061-278 | |
| Peptone, BD Bacto | VWR | 90000-368 | |
| Ampicillin Trihydrate | VWR | 97062-300 | |
| IPTG, dioxane-free | Thermo Scientific | R0391 | |
| Name | Company | Catalog Number | Comments |
| Growth Culture | |||
| LB Lennox Broth | IBI Scientific | 89126-176 | |
| Name | Company | Catalog Number | Comments |
| LB Agar plates | |||
| LB Agar Lennox | IBI Scientific | 89126-182 | |
| Name | Company | Catalog Number | Comments |
| Antibiotics | |||
| Ampicillin Trihydrate | VWR | 97062-300 | |
| Tetracycline Hydrochloride | Fisher Scientific | BP912-100 | |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Hoechst 33258, Pentahydrate | Biotium | 40045 | |
| DAPI | Biotium | 40011 | |
| Name | Company | Catalog Number | Comments |
| Ethanol Fixation | |||
| Ethanol, Pure, 190 Proof (95%), USP | Koptec, VWR | 89125-166 | |
| Name | Company | Catalog Number | Comments |
| M9 Buffer | |||
| Sodium chloride, Biotechnology Grade | VWR | 97061-278 | |
| Potassium phosphate, Monobasic Anhydrous Grade | VWR | 97062-346 | |
| Sodium phosphate, monobasic dihydrate | Fisher Scientific | AC271750025 | |
| Name | Company | Catalog Number | Comments |
| RNAi Clones | |||
| HT115 bacteria expressing rec-8 dsRNA | Source Bioscience | W02A2.6 | |
| HT115 bacteria expressing rec-8 dsRNA | Dharmacon | RCE1182-202299820 |
Referencias
- Ricke, R. M., van Ree, J. H., van Deursen, J. M. Whole chromosome instability and cancer: a complex relationship. Trends Genet. 24, 457-466 (2008).
- Frawley, L. E., Orr-Weaver, T. L. Polyploidy. Curr Biol. 25, R353-R358 (2015).
- Orr-Weaver, T. L. When bigger is better: the role of polyploidy in organogenesis. Trends Genet. 31, 307-315 (2015).
- Otto, S. P. The evolutionary consequences of polyploidy. Cell. 131, 452-462 (2007).
- Davoli, T., de Lange, T. The Causes and Consequences of Polyploidy in Normal Development and Cancer. Annu Rev Cell Dev Biol. 27, 585-610 (2011).
- Adams, K., Wendel, J. Novel patterns of gene expression in polyploid plants. Trends Genet. 21, 539-543 (2005).
- Adams, K. L., Wendel, J. F. Polyploidy and genome evolution in plants. Curr Opin Plant Biol. 8, 135-141 (2005).
- Berman, J. Ploidy plasticity: a rapid and reversible strategy for adaptation to stress. FEMS Yeast Res. 16, (2016).
- Levy, D. L., Heald, R. Mechanisms of Intracellular Scaling. Annu Rev Cell Dev Biol. 28, 113-135 (2012).
- Breneman, A., Cande, J., Dunn, J., Burbank, K., O'toole, E. Genome-wide genetic analysis of polyploidy in yeast. Nature. 443, 541-547 (2006).
- Kuznetsova, A. Y., et al. Chromosomal instability, tolerance of mitotic errors and multidrug resistance are promoted by tetraploidization in human cells. Cell Cycle. 14, 2810-2820 (2015).
- Taylor, J. S., Van de Peer, Y., Meyer, A. Genome duplication, divergent resolution and speciation. Trends Genet. 17, 299-301 (2001).
- Younis, A., Hwang, Y. -. J., Lim, K. -. B. Exploitation of induced 2n-gametes for plant breeding. Plant Cell Rep. 33, 215-223 (2014).
- Ihssen, P. E., McKay, L. R., McMillan, I., Phillips, R. B. Ploidy Manipulation and Gynogenesis in Fishes: Cytogenetic and Fisheries Applications. Trans Am Fish Soc. 119, 698-717 (2011).
- Stanley, J. G., Allen, S. K., Hidu, H. Polyploidy induced in the American oyster, Crassostrea virginica, with cytochalasin B. Aquaculture. 23, 1-10 (1981).
- Eakin, G. S., Behringer, R. R. Tetraploid development in the mouse. Dev Dyn. 228, 751-766 (2003).
- Heier, J., Takle, K. A., Hasley, A. O., Pelegri, F. Ploidy manipulation and induction of alternate cleavage patterns through inhibition of centrosome duplication in the early zebrafish embryo. Dev Dyn. 244, 1300-1312 (2015).
- Arnold, B., Kim, S. -. T., Bomblies, K. Single Geographic Origin of a Widespread Autotetraploid Arabidopsis arenosa Lineage Followed by Interploidy Admixture. Mol Biol Evol. 32, 1382-1395 (2015).
- Session, A. M., et al. Genome evolution in the allotetraploid frog Xenopus laevis. Nature. 538, 336-343 (2016).
- Gallardo, M. H., Bickham, J. W., Honeycutt, R. L., Ojeda, R. A., Köhler, N. Discovery of tetraploidy in a mammal. Nature. 401, 341 (1999).
- Hodgkin, J. Primary sex determination in the nematode C. elegans. Development. 101, 5-16 (1987).
- Madl, J. E., Herman, R. K. Polyploids and sex determination in Caenorhabditis elegans. Genetics. 93, 393-402 (1979).
- Nigon, V. Polyploidie experimentale chez un nematode libre, Rhabditis elegans maupas. Bull Biol Fr Belg. 95, 187-225 (1951).
- Woodruff, G. C., Eke, O., Baird, S. E., Félix, M. -. A., Haag, E. S. Insights Into Species Divergence and the Evolution of Hermaphroditism From Fertile Interspecies Hybrids of Caenorhabditis Nematodes. Genetics. 186, 997-1012 (2010).
- Mlynarczyk-Evans, S., Roelens, B., Villeneuve, A. M. Evidence That Masking of Synapsis Imperfections Counterbalances Quality Control to Promote Efficient Meiosis. PLoS Genet. 9, e1003963 (2013).
- Lozano, E., Sáez, A. G., Flemming, A. J., Cunha, A., Leroi, A. M. Regulation of Growth by Ploidy in Caenorhabditis elegans. Curr Biol. 16, 493-498 (2006).
- Roelens, B., Schvarzstein, M., Villeneuve, A. M. Manipulation of Karyotype in Caenorhabditis elegans Reveals Multiple Inputs Driving Pairwise Chromosome Synapsis During Meiosis. Genetics. 201, 1363-1379 (2015).
- Martinez-Perez, E., et al. Crossovers trigger a remodeling of meiotic chromosome axis composition that is linked to two-step loss of sister chromatid cohesion. Genes Dev. 22, 2886-2901 (2008).
- Severson, A. F., Ling, L., van Zuylen, V., Meyer, B. J. The axial element protein HTP-3 promotes cohesin loading and meiotic axis assembly in C. elegans to implement the meiotic program of chromosome segregation. Genes Dev. 23, 1763-1778 (2009).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30, 313-321 (2003).
- Wood, W. B. . The Nematode Caenorhabditis Elegans. , (1988).
- MacQueen, A. J., et al. Chromosome Sites Play Dual Roles to Establish Homologous Synapsis during Meiosis in C. elegans. Cell. 123, 1037-1050 (2005).
- Martinez-Perez, E., et al. Crossovers trigger a remodeling of meiotic chromosome axis composition that is linked to two-step loss of sister chromatid cohesion. Genes Dev. 22, 2886-2901 (2008).
- Schvarzstein, M., Wignall, S. M., Villeneuve, A. M. Coordinating cohesion, co-orientation, and congression during meiosis: lessons from holocentric chromosomes. Genes Dev. 24, 219-228 (2010).
- Kim, S., Spike, C., Greenstein, D. . Germ Cell Development in C. elegans. , 277-320 (2013).
- Peters, N., et al. Control of mitotic and meiotic centriole duplication by the Plk4-related kinase ZYG-1. J Cell Sci. 123, 795-805 (2010).
- Pasierbek, P. A Caenorhabditis elegans cohesion protein with functions in meiotic chromosome pairing and disjunction. Genes Dev. 15, 1349-1360 (2001).
- Hodgkin, J. Primary sex determination in the nematode C. elegans. Development. 101, 5-16 (1987).
- Flemming, A. J., Shen, Z. -. Z., Cunha, A., Emmons, S. W., Leroi, A. M. Somatic polyploidization and cellular proliferation drive body size evolution in nematodes. Proc Natl Acad Sci U S A. 97, 5285-5290 (2000).
- Meneely, P. M. Sex determination in polyploids of Caenorhabditis elegans. Genetics. 137, 467-481 (1994).
- Whangbo, J. S., Hunter, C. P. Environmental RNA interference. Trends Genet. 24, 297-305 (2008).
- Imae, R., Dejima, K., Kage-Nakadai, E., Arai, H., Mitani, S. Endomembrane-associated RSD-3 is important for RNAi induced by extracellular silencing RNA in both somatic and germ cells of Caenorhabditis elegans. Sci Rep. 6, 28198 (2016).
- Tijsterman, M., May, R. C., Simmer, F., Okihara, K. L., Plasterk, R. H. A. Genes required for systemic RNA interference in Caenorhabditis elegans. Curr Biol. 14, 111-116 (2004).
- Cortes, D. B., McNally, K. L., Mains, P. E., McNally, F. J. The asymmetry of female meiosis reduces the frequency of inheritance of unpaired chromosomes. Elife. 4, e06056 (2015).
- Vargas, E., et al. Autosomal Trisomy and Triploidy Are Corrected During Female Meiosis in Caenorhabditis elegans. Genetics. 207, 911-922 (2017).
- Tabara, H., et al. The rde-1 gene, RNA interference, and transposon silencing in C. elegans. Cell. 99, 123-132 (1999).
- Hodgkin, J. . Karyotype, ploidy, and gene dosage. , (2005).
- Schoenfelder, K. P., Fox, D. T. The expanding implications of polyploidy. J Cell Biol. 209, 485-491 (2015).
- Levy, D. L., Heald, R. Biological Scaling Problems and Solutions in Amphibians. Cold Spring Harb Perspect Biol. 8, a019166 (2015).
- Taylor, J. S., Van de Peer, Y., Braasch, I., Meyer, A. Comparative genomics provides evidence for an ancient genome duplication event in fish. Philos Trans Royal Soc B. 356, 1661-1679 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados