Method Article
Manipulação de ploidia em Caenorhabditis elegans
Neste Artigo
Resumo
Este método permite a geração de tetraploide e triploide nemátodos Caenorhabditis de qualquer estirpe diploide. Poliploides tensões geradas por esse método tem sido usadas para estudar interações do cromossomo em prófase meiótica, e esse método é útil para examinar questões básicas importantes no, desenvolvimento, evolução, biologia celular e câncer.
Resumo
Mecanismos que envolvem o genoma inteiro poliploidia desempenham um papel importante no desenvolvimento e evolução; Além disso, uma geração anormal de células tetraploide tem sido associada com o desenvolvimento de resistência às drogas e a progressão do câncer. Até agora, não foi viável para facilmente manipular a ploidia de um animal multicelular sem gerar principalmente progênie estéril. Apresentado aqui é um protocolo simples e rápido para gerar tetraploide Caenorhabditis elegans animais de qualquer estirpe diploide. Este método permite ao usuário criar um viés em segregação de cromossomas durante a meiose, em última análise, aumentar a ploidia em c. elegans. Esta estratégia baseia-se na redução transitória da expressão do gene para gerar gametas diploides rec-8 . Um mutante de rec-8 produz gametas diploides que potencialmente podem produzir tetraploids após a fertilização. Este regime tractable tem sido usado para gerar cepas tetraploide carregando mutações e rearranjos cromossômicos para ganhar a introspecção em dinâmica cromossômica e interações durante o emparelhamento e synapsis em meiose. Este método é eficiente para gerar tensões tetraploide estáveis sem marcadores genéticos, pode ser aplicado a qualquer estirpe diploide e pode ser usado para derivar triploide c. elegans. Este método simples é útil para investigar outras questões fundamentais biológicas relevantes para a instabilidade do genoma, dosagem de gene, escala biológica, sinalização extracelular, adaptação ao estresse, desenvolvimento de resistência às drogas, e mecanismos de especiação.
Introdução
Genoma poliploidia existe em toda a natureza e é muitas vezes um passo necessário na adaptação, especiação, organogênese, cicatrização de feridas e dimensionamento biológico; também é conhecido por promover o câncer e a resistência a drogas1,2,3,4,5,6,7,8, 9 , 10 , 11 , 12. agricultura e pesca Indústrias geram plantas poliploides, peixes e frutos do mar pelo tratamento químico (por exemplo, colchicina e orzalin) para obter taxas de crescimento mais rápidas e mais volumoso colheitas e gado13, 14,15. Produção experimental e ineficiente de tetraploids existe para o rato e o zebrafish modelo sistemas16,17. No entanto, a maioria ou todos os poliploides animais multicelulares gerados são embryonically letal ou estéril e, portanto, não é o ideal para estudos de laboratório sobre os efeitos da poliploidia em um organismo multicelular. Por conseguinte, qualquer compreensão do polyploidization do genoma inteiro em organismos multicelulares foi limitado para espécies estreitamente relacionadas de evolucionária recente polyploidization eventos18,19,20 . Um caminho para avançar a consultas da função biológica ou consequências de polyploidization é o uso do sistema de modelo c. elegans . Importante, c. elegans é um sistema genético tractable que normalmente existe como um diploides, contém apenas cinco autossomos (A) e um cromossomo sexual (X) por genoma, é transparente permitindo uma observação na vivo de processos biológicos, e tem um curto ciclo de vida de 3-4 dias (a partir de ovo a adulto sexualmente maduro). C. elegans foi mostrado para ser capaz de reproduzir-se como um tetraploide, qual é o tipo mais comum de todo genoma poliploidia na natureza. Triploide animais podem ser gerados pelo cruzamento de tetraploids com diploides, mas sua ploidia não é estável, e as tensões tornam-se diploide dentro de algumas gerações.
Nas últimas décadas apenas um punhado de viáveis e férteis c. elegans cepas tetraploids foram isoladas em laboratório, usando uma estratégia que é trabalhoso e gera apenas limitados tipos de cepas21,22, 23. esta estratégia gera tetraploids de c. elegans por tratamentos de choque do calor, que presumivelmente afecta a segregação do cromossomo em gametas, seguido por uma triagem para animais poliploides putativos, usando marcadores genéticos. Estes tetraploids foram extremamente útil para a investigação de como este nematódeo determina-se a tornar-se macho ou hermafrodita. Estudos posteriores usado as tensões disponíveis para investigar o crescimento, a dose do gene e regulamento da sinapse durante a meiose neste nematódeo21,24,25,26. Infelizmente, estes estudos foram limitados pela dificuldade na geração de novas cepas tetraploide e os marcadores genéticos de fundo destas tensões contidas. Mostrado aqui é um protocolo simples e rápido para gerar tetraploids estáveis, que tem sido usado para gerar tensões para estudar o Regulamento de sinapse durante a meiose,27.
Como na natureza, polyploidization podem surgir pela formação de diploides em vez de gametas haploides. Nossa constatação de que um mutante de componente específico meiose cohesin rec-8 gera espermatozoide diploide e oócitos indicaram que derrubando o gene rec-8 resultaria na produção de descendência tetraploide (Figura 1)27, 28,29. Gerar tensões tetraploide envolve simplesmente derrubando rec-8 por RNA de interferência (RNAi) para duas gerações em ordem a fenocópia da rec-8 gametas diploides mutantes. Putativos poliploides podem ser facilmente identificados por seus mais tempo do que o tamanho normal do corpo. Os poliploides são confirmados como tetraploids completo ou parciais pela contagem do número de cromossomas por núcleo uma vez estáveis sejam estabelecidas.
A estratégia descrita aqui permite a geração de estável nemátode Caenorhabditis cepas tetraploide de qualquer fundo genético diploide inicial ou cariótipo sem o uso de marcadores genéticos. Como este protocolo é mais eficiente, versátil e simples do que o esquema usado anteriormente, vai expandir as ferramentas necessárias para consultar os papéis de polyploidization em processos fundamentais do desenvolvimento, a estabilidade do genoma e evolução em multicelulares organismos. A limitação apenas previsível na utilização desse protocolo é em planos de fundo genéticos resistentes a RNAi.
Protocolo
1. configuração rec-8 RNAi (dia 1-3 na Figura 2)
Este protocolo é modificado de agar e Ahringer30.
- Indução da expressão de dsRNA rec-8 em Escherichia coli, preparar o nematódeo crescimento médio (NGM) ágar placas31 suplementado com uma concentração final de 1 mM isopropil-β-D-2-thiogalactopyranoside (IPTG) e 100 µ g/mL ampicilina. Armazenar no escuro a 4 ° C até o uso, por até 4 semanas.
- Bactérias de HT115 raia carregando o clone de rec-8 (W02A2.6) do Ahringer laboratório biblioteca30 rec-8 clone nas chapas de caldo Luria (LB), suplementado com 100 µ g/mL ampicilina e tetraciclina 50 de µ g/mL. Crescer durante a noite em uma coqueteleira a 37 ° C.
- No dia 1, inocule colônias única das colônias recém listras única das HT115 Escherichia coli bactérias carregando o clone de RNAi rec-8 em ampicilina contendo de µ g/mL 100 mL 4 LB e 50 µ g/mL tetraciclina. Crescer a cultura de bactérias durante a noite em um agitador ou um rolo de tambor a 37 ° C.
- Na manhã seguinte (dia 2), induzir a produção de duplo stranded do RNA (ds) para rec-8 W02A2.6 na cultura bacteriana HT115, adicionando uma concentração final de 1 mM IPTG e agitação por 40 min a 37 ° C.
- Após a indução, placas NGM/IPTG com 100-200 µ l de HT115 rec-8 bactérias de sementes e armazenar as placas à temperatura ambiente no escuro durante a noite (dia 3).
- Na manhã seguinte (dia 4), adicione a estirpe de nematoides desejada para as placas de bactérias de rec-8 HT115 induzidas conforme descrito no passo 2.1 abaixo.
2. gerar e isolando Tetraploids (dia 4-16 na Figura 2)
- No dia 4, coloque 3-4 jovens hermafroditas de palco (quarta larval) L4 da estirpe diploide desejado nas placas NMG/IPTG inoculadas com bactérias de rec-8 HT115 que havia sido induzidas no dia anterior (etapa 1.5, acima). Cresce nematoides a 15 ° C, no escuro.
- Repita as etapas 1.3 e 1.4 a partir de 3 dias após o passo 2.1, que serão três dias antes da primeira progênie (F1s) essa etapa se tornar L4s. O timing dessa etapa vai depender de quão rápido uma nematódeo tensão cresce a 15 ° C. Algumas cepas mutantes diploides são cultivadores lentos, e neste momento será precisa boa afinação para isolar tetraploids.
- No dia 8 (após 4 dias de tratamento alimentação de RNAi rec-8 ), 20 (2 hermafroditas/placa de Petri) das F1 (primeira geração filial) L4 hermafroditas crescidas nas bactérias para recém induzida HT115 rec-8 RNAi rec-8 HT115 de transferência e permitir que Eles auto-fertilização.
- Alternativamente, transferência 20 de hermafroditas a F1 L4 crescida nas bactérias HT115 rec-8 em recém induzida HT115 rec-8 RNAi bactérias juntamente com machos não tratados da mesma estirpe (2 hermafroditas com machos/placa de 4-6).
- No dia 13, início de triagem para F2 (segunda geração filial) progênie que aparecem longo (Lon) ou em geral maior do que o tipo selvagem; depois transferi os animais individuais Lon para regular OP50 ou HB101 cepas da bactéria e. coli . Continuar a triagem F3 progênie (terceira filial); no entanto, progênie F3 do mesmo prato não pode ser consideradas cepas independentes se eles se estabeleceram, porque eles podem ser irmãos da mesma já estabeleceram mãe F2.
Nota: Tetraploids putativos são facilmente identificados pois são claramente mais de diploides. Tipo selvagem hermafroditas são dois terços menor do que tetraploids. Porque é mais longo, um corpo tetraploide faz uma curva extra enquanto se move para a frente gerando ondas senoidais corpo de flexão da cabeça à cauda (Figura 3A). - Permitir que Lon vermes auto-fertilização e propagar escolhendo Lon progênie até apenas Lon progênie é procriou na ausência de rec-8 tratamento de RNAi. Isso pode levar dois ou três gerações adicionais. Lon worms, muitas vezes, são estéreis e não se rende a descendência.
3. verificar as estirpes tetraploide (Movie 1 e Figura 3A, B)
Nota: Tetraploide cepas podem ser validadas pela contagem do número de cromossomos em seus oócitos não fertilizados. Microscopia fluorescente pode ser usada para a tela para o número de pares de cromossomos em oócitos diploides não fertilizados (antes as divisões meióticas), se a tensão tem um marcador fluorescente por cromossomos. Na ausência de marcadores fluorescentes cromossomo, tetraploide nematoides podem ser rastreados pelos nematoides de fixação e coloração com um corante de ADN; Veja a seguir um protocolo para a fixação de etanol e 4 ' todo-animal, coloração de dicloridrato de 6-Diamidine-2 '-phenylindole (DAPI).
- Todo animal DAPI coloração
Nota: Cepas tetraploide carregando 12 pares de cromossomos conectado podem ser validadas pelo DAPI coloração desses animais e contando o número de corpos DAPI em seus oócitos não fertilizados.- Lugar de 5 a 10 µ l de M9 reserva31 em uma corrediça do microscópio, então transfira nematoides de 6-10 para a gota.
- Sob um microscópio de dissecação, desenhe a maioria do M9 da lista suspensa sem remover os nematódeos com um tecido de limpeza de fiapos. Imediatamente, adicione uma gota de 10 µ l de etanol a 90% para os vermes. Permitir que os vermes secar completamente, mas para não mais do que alguns segundos.
- Tão logo o etanol evapora (isto pode ser visto como acontece sob o microscópio de dissecação), adicionar um adicionais 10 µ l de etanol a 90% para os vermes.
- Repita a etapa 3.1.3 mais três vezes.
- Uma vez que a última gota de álcool tiver evaporado, adicione 6 µ l de tintura DAPI ou Hoechst na concentração final recomendada na mídia montagem de escolha (por exemplo, uma diluição de 1:1,000 de uma concentração de estoque DAPI 2 ng / µ l em M9). Para armazenamento a longo prazo dos slides, 0,5% p-fenilenodiamina dissolvido em 20 mM Tris-HCl, pH 8,8, em 90% de glicerol como uma solução antidesgaste, em vez de M9 só, pode ser utilizado.
- Cobrir os vermes no slide com uma lamela e selar as bordas da lamela com unhas polonês. Pontuação em um microscópio de fluorescência (etapa 3.1.7) pelo menos 10 min após a adição da lamela. Slides sem Media podem ser armazenados por alguns dias a 4 ° C antes de marcar, mas a qualidade da fluorescência começa a diminuir depois de alguns dias.
- Usando um microscópio fluorescente na ampliação de X 100, marcar o número de corpos DAPI simples (pares de cromossomos presumivelmente único) no oócito não fertilizado mais maduro, que é imediatamente adjacente a espermateca e ainda não entrou a espermateca ou o útero.
- Para marcar os corpos DAPI individuais dentro de um núcleo do ovócito, use foco fino do microscópio para mover-se lentamente da parte superior do núcleo do ovócito ao fundo durante a contagem. Então, recontar o núcleo mesmo enquanto se move o foco para o lado oposto (isto é, da parte inferior à parte superior do núcleo) para confirmar o número contado de DAPI corpos.
- Marca o oócito mais maduro não fertilizado em cada uma das duas gônadas pelo menos dez hermafroditas por tensão estável de Lon. Oócitos de tipo selvagem tem 6 corpos DAPI, em média, 5 pares autosome e o par de cromossomo sexual. A presença de 12 corpos DAPI no oócito de cepas de Lon estáveis indica que os animais nesta estirpe são parcial (4 conjuntos de autossomos, cromossomos 3 x) ou (4 jogos completos de autossomos, cromossomos 4 x) tetraploids.
- Calcule o número médio de corpos DAPI observado a partir de múltiplos (pelo menos 10) oócitos por estirpe. Estar a tocar alguns pares de cromossomos, ou em cima um do outro, então o número de DAPI corpos em um oócito é muitas vezes menor do que o real número de pares de cromossomos.
- (Opcional) Validar ainda mais estável Lon cepas, onde o número médio de corpos DAPI é 12 para testar se eles são full (4A, 4x) ou parcial (4A, 3 X) tetraploids pela mancha contra proteínas de eixo cromossomo como HTP-332. Esta mancha irá distinguir pares de cromossomos, mostrando um padrão cruciforme de cromossomos sem ligação único presentes no tetraploide parcial.
Resultados
Imparidade do rec-8 meiótica Cohesin componente função resultados em gâmetas diploides:
Imagem das divisões meióticas do cohesin componente mutante rec-8 espermatozoides e ovócitos revelaram mecanismos possíveis para a geração de29,de27,de animais tetraploide (Figura 1)33. Mecanicamente, os defeitos da divisão meiótica de rec-8 esperma mutante e oócito são diferentes; no entanto, tanto masculinas como femininas gametas diploides são produzidas pelo mutante rec-8 .
Em tipo selvagem meiose, cromossomos homólogos tornam-se temporariamente conectados um ao outro por recombinação de cruzamento em Insira a primeira divisão meiótica como uma unidade ou forma bivalente (figura 1A)34. Durante a primeira divisão, os cromossomos homólogos (homologs) segregam longe um do outro, Considerando que a irmã cromátides irmãs de cada homólogo permanecem juntos até a segunda divisão. Embora o padrão de segregação do cromossomo é o mesmo em gâmetas masculinas e femininas, divisões do oócito são assimétricas, Considerando que as divisões de maturação são simétricas e submeter-se a citocinese especializado. Em cada divisão, o oócito descarta metade do produto divisão em um pequeno corpo polar. Assim, cada precursor do oócito dá origem a um único ovócito haploide e dois corpos polares (figura 1B, C)35. Por outro lado, um precursor de maturação único dá origem a quatro espermátides funcionais através de duas divisões simétricas. A segunda divisão culmina com quatro espermátides brotamento fora de um corpo residual. Esta citocinese é especial em que o padrão e o número de espermátides é determinado pelo centrossomas36.
No precursor para os gametas mutantes rec-8 , recombinação de cruzamento entre cromossomos homólogos não se verifica e homologs não são conectados como um forma bivalente no início da primeira divisão meiótica29,34. Irmã cromátides irmãs de cada homólogo segregam longe um do outro na primeira divisão em vez de permanecendo juntos até a segunda divisão, como fazem em gametas do tipo selvagem. Curiosamente, o fenótipo mutante rec-8 durante a segunda divisão é diferente em gâmetas masculinas e femininas nesse oócitos falharem submeter-se a citocinese Considerando que espermatócitos submeter-se a citocinese relativamente normal (figura 1B– F) 27 , 28 , 29. diploides oócitos surgem porque na segunda divisão falham tanto a segregação do cromossomo e citocinese, daí eles não expulsar o segundo corpo polar (figura 1B, C). Espermatócitos no rec-8 germlines passam por brotamento nucleologênese ou citocinese, mas muitas vezes segregar os dois conjuntos de cromossomas que dentre as espermátides para produzir um nucleologênese diploide e um nucleologênese carente da cromatina (Figura 1– F)27. Quantificação da proporção de esperma rec-8 faltando cromatina é mostrada na Figura 1F.
A formação de gametas diploides femininas e masculinas em rec-8 mutantes sugeriu que este fenótipo mutante poderia ser potencialmente usado para gerar tensões tetraploid do genoma completo.
Geração de cepas tetraploide c. elegans :
A presença de uma mutação no gene rec-8 em todas as cepas tetraploide gerados pode ser evitada pelo transitoriamente derrubando rec-8 por RNAi29,37. Isso pressupõe que a redução da função rec-8 por RNAi geraria gâmetas diploides que potencialmente poderiam dar origem a animais tetraploid do genoma, como rec-8 mutantes do29,,37. Essenciais para este protocolo é que rec-8 mutantes dão origem aos gâmetas diploides e sire um número razoavelmente grande de jovens, ao contrário de outros mutantes meióticos, que dão origem a gametas aneuploid e são principalmente estéril ou embrionárias/larval letal.
Múltiplas variedades tetraploide foram geradas pela alimentação de c. elegans bactérias expressando dsRNA rec-8 utilizando qualquer uma das duas estratégias (ver tabela 1, Figura 2e protocolo)27. Tetraploids podem ser gerados por fertilização Self hermafroditas por duas a três gerações em placas de Petri com bactérias expressando dsRNA rec-8 . Por esta estratégia hermafrodita é colocada na recém feito rec-8 placas de RNAi e sua descendência é transferido alguns dias mais tarde em novas placas com recém induzido rec-8 RNAi expressando bactérias (ver protocolo). Além disso, o tetraploids podem ser gerados através do cruzamento da primeira geração de hermafroditas alimentados bactérias expressando dsRNA rec-8 com machos não tratados com o mesmo genótipo em placas de Petri com bactérias expressando dsRNA rec-8 ( Figura 2). Neste caso, os machos em Cruz são expostos a bactérias RNAi rec-8 desde a fase de L4 em diante, durante o acasalamento. Ambos os esquemas dão origem a animais tetraploide27. A tabela 1 mostra tetraploide cepas obtidas usando o esquema aqui apresentado. Triploide e tetraploide c. elegans são maiores em tamanho que diploides, mas cepas triploide são instáveis e tendem a se tornar diploide em uma ou duas gerações, Considerando que cepas tetraploide são relativamente estáveis22,23. Putativos tetraploide estirpes foram identificadas como maior do que o original hermafroditas estirpe (Lon) que procriou progênie de Lon só (Figura 3A). Lon animais são facilmente identificados - tipo selvagem animais diploides são dois terços do comprimento do tetraploids e seus corpos não fazem uma curva extra, que pode ser percebida durante seu movimento senoidal (Figura 3A).
Tetraploide estirpes foram confirmadas por triagem para a presença de 12 pares de cromossomos em oócitos das hermafroditas tetraploide comparadas com seis pares de cromossomos em oócitos de diploides hermafroditas (Figura 3B, Ce 1 filme).
Tetraploide Classes:
Foram identificados dois tipos de hermafroditas tetraploide: um touro machos em frequências semelhantes como hermafroditas diploides e o outro touro machos em muito frequências mais altas (tabela 1). Estes dois tipos de hermafroditas tetraploide têm sido mostrados para diferem em que as frequências de classe produzindo semelhantes dos machos diploides são tetraploide por todos os seus cromossomos (4A, 4x), enquanto as classe produzir altas frequências de machos são hermafroditas que são tetraploide de autossomos mas triploide para o cromossomo sexual (4, 3, X). A classe posterior de tetraploids é estável e produzir 4A, 4A, 2 machos de X e 3 hermafroditas X.
Tetraploide cepas crescem mais devagar e produzem tamanho ninhado reduzido em comparação com as diploides que eles foram derivados, como visto para as tensões geradas com o anterior método22,23. MADL e Herman22 sugeriu que a maior percentagem dos embriões mortos em cepas tetraploide poderia ser devido à aneuploidia no oócito, no entanto inspeção superficial de tetraploide cepas não revelou suficientemente elevados números de aneuploid oócitos nem anormal oócito ou divisões de maturação para contabilizar a redução observada no tamanho de ninhada (Movie 2e Figura 3, D).
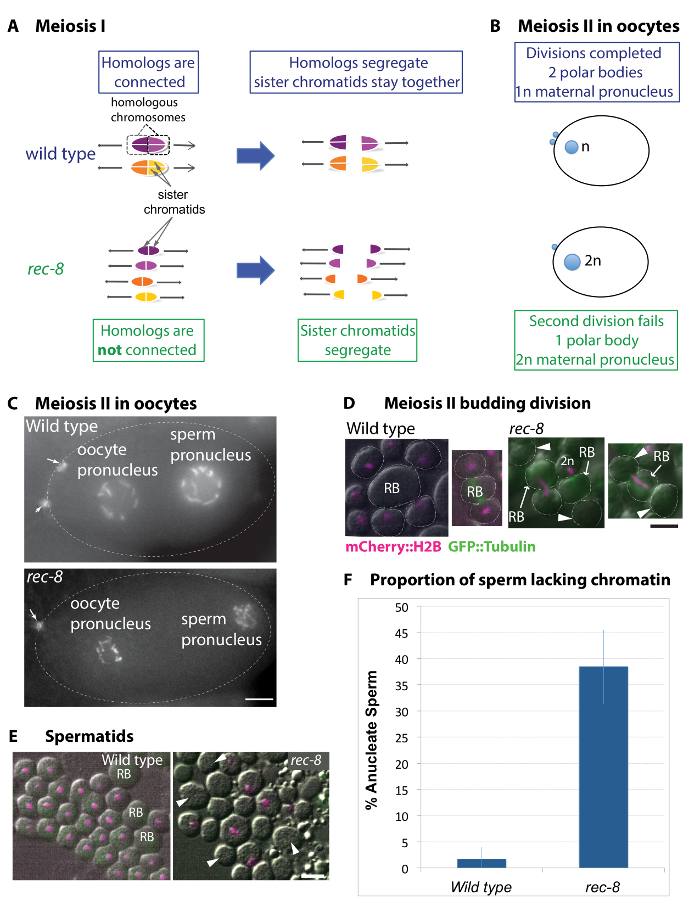
Figura 1: Gametogênese em rec-8 mutante implica mecanismos possíveis para gerar manchas poliploides estáveis. (A) diagrama do padrão de organização e segregação de cromossomos no tipo selvagem e rec-8 divisões meióticas mutantes. Em tipo selvagem meiose, cromossomos homólogos separam-se na primeira divisão meiótica. Irmã cromátides irmãs de cada homólogo orientam-se para o mesmo polo do eixo e permanecem juntos até a segunda divisão. Em mutantes rec-8 , homologs não fazem os cruzamentos e, portanto, não estão conectados. Em contraste ao selvagem tipo, irmã de rec-8 cromátides irmãs orientam longe um do outro e separam na primeira divisão meiótica. (B) diagrama de tipo selvagem e mutantes oócitos mostrando o pronucleus feminino e corpos de polar extrudidos (pronucleus masculino não é retratado). Em oócitos de tipo selvagem, duas divisões meióticas assimétricas resultam em extrusão de dois corpos polares. Em mutantes rec-8 , no entanto, o segundo corpo polar extrusão falha resultando em um ovócito diploide. (C) imagens de tipo selvagem e rec-8 ovócitos mutantes, expressando mCherry::histone H2B. As setas indicam dois corpos polares no oócito de tipo selvagem e um no mutante rec-8 . Barra de escala é de 5 µm. (D e E) ao vivo imagens de espermátides de tipo selvagem e rec-8 animais mutantes, expressando mCherry::histone H2B (magenta). Setas indicam anucleate espermátides. Barra de escala é de 2 µm. (D) espermatócitos submetidos à segunda divisão (brotamento) no tipo selvagem e mutante rec-8 . Os tipo selvagem espermatócitos passam por divisões simétricas, resultando em quatro espermátides de brotamento, cada um com um complemento haploide de cromossomos. Em espermatócitos mutante rec-8 , segregação do cromossomo é prejudicada na segunda divisão. Mais frequentemente uma única massa de cromatina permanece no corpo residual (RB) ou em uma das duas irmã espermátides na segunda divisão meiótica. Isto dá origem a rec-8 de anucleate de esperma mutante (indicado por setas) ou espermatozoide diploide. (E) imagens ao vivo de espermátides pós brotação no tipo selvagem e mutantes rec-8 visualizados usando microscopia de fluorescência e contraste de interferência diferencial (DIC). Tipo selvagem espermátides todos têm massas de cromátides irmãs semelhantes. REC-8 mutantes espermátides formam anucleate esperma. (F) quantificação de tipo selvagem e rec-8 esperma mutante anucleate. REC-8 mutantes produziram 38,5% de esperma anucleate comparada com menos de 1,6% no tipo selvagem. Teste exato de Fisher indica que um mutante de rec-8 tem incidência significativamente maior de esperma de anucleate (≤0.0001p ) em comparação com o tipo selvagem. Barras de erro representam desvios-padrão. Clique aqui para ver uma versão maior desta figura.
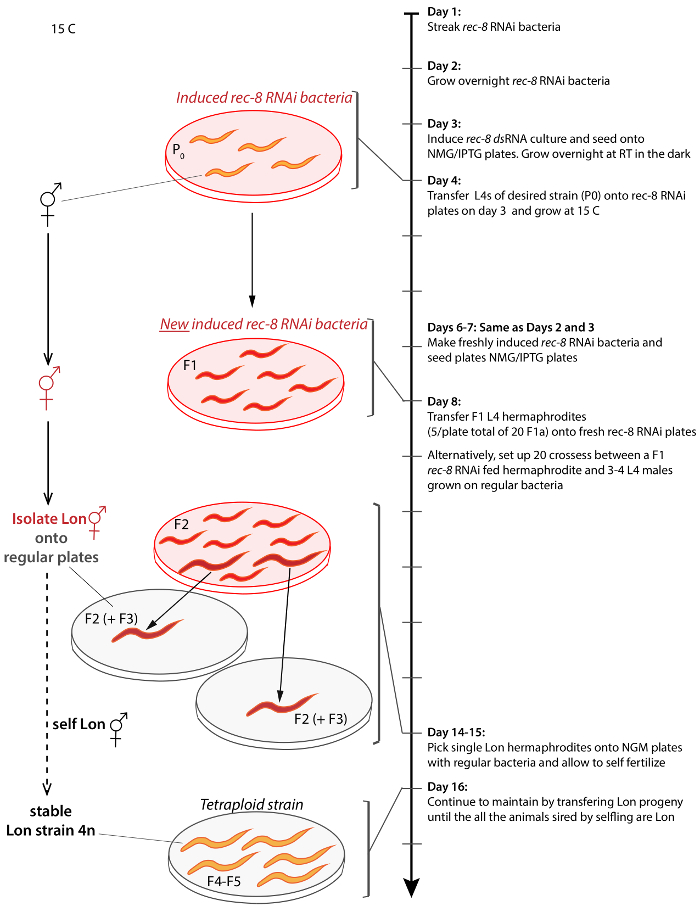
Figura 2: Esquema para gerar e isolando tetraploide c. elegans de toda a tensão. Seta à direita representa a linha do tempo do protocolo a partir de dia 1 e progredindo para dia 17. Resultados semelhantes podem ser conseguidos hermafroditas cruzamento com machos não tratados no dia 9. Suportes de conectem a representação de uma etapa para a linha do tempo. Animais não tratados são laranja, animais tratados são vermelhos, Lon animais são maiores em tamanho, rec-8 dsRNA expressando bactérias é retratado como placas transparentes com fundo vermelho transparente e regular OP50 bactérias é retratado no cinza transparente placas de fundo. Procedimento é feito a 15 ° C a menos que indicado o contrário. Clique aqui para ver uma versão maior desta figura.
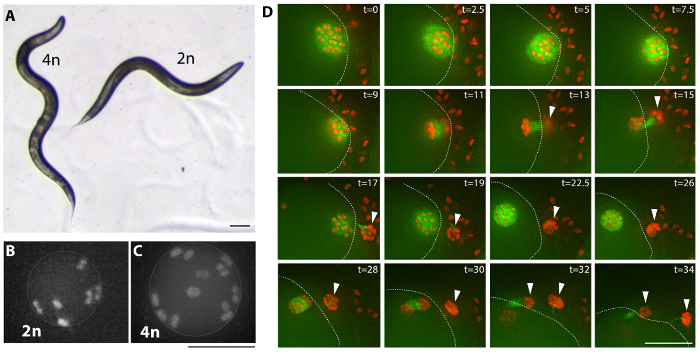
Figura 3: exemplos de tetraploide. (A) imagem de campo brilhante de um tetraploide animal (MSC2) e a estirpe diploide (AV740) o nome foi derivado. Tetraploide c. elegans são em geral maior e mais longo (Lon) do que os diploides. Esta diferença no tamanho do corpo resulta em uma curva sinusoidal adicional do corpo do tetraploide em movimento e pode ser usada como um critério para a tela para derivados tetraploide. Barra de escala é 0,1 mm. (B, C) imagens de fluorescência de diploides (AV740) e tetraploide (MSC1) mais madura ovócitos não fertilizados nulcei, antes das divisões meióticas. Triagem secundária é realizada observando-se o número de pares de cromossomos em oócitos não fertilizados das estirpes Lon estabelecidas, como mostrado no filme 1 para uma estirpe de MSC1 expressando o germline Mcherry::H2B e GFP::β-tubulina. Barra de escala é de 5 µm. (D) imagens de um lapso de tempo (filme 2) das divisões meióticas tetraploid do oócito, retratando uma meiose normal geralmente. Cabeças de seta marcam polar corpos e uma linha pontilhada marca o córtex do oócito dentro da espermateca e rodeado de espermatozoides; t = tempo caducado em minutos. Barra de escala é 10 µm. clique aqui para ver uma versão maior desta figura.
| Genótipo | Derivado tetraploide (conjuntos de autossomos: n º de cromossomos x) * | Estirpe parental (diploides) |
| meIs16 [torta-1p::mCherry:: sua-58 + unc-119(+)]; | MSC1 (4A:4 X) | MSC0 |
| ruIs57 [torta-1p::GFP::b-tubulina + unc-119(+)] | MSC2 (4A:3 X) | |
| MSC3 (4A:4 X) | ||
| MSC5 (4A:3 X) | ||
| MSC6 (4A:4 X) | ||
| MSC8 (4A:4 X) | ||
| UNC-119(ED3) III; ddIs6; ddIs6 [tbg-1::GFP + unc-119(+)]; ltIs37; ltIs37 [pAA64; torta-1p::mCherry::HIS-58 + unc-119(+)] IV | MSC14 (4A:3 X) | TMR17 |
| MSC15 (4A:3 X) | ||
| MSC16 (4A:4 X) | ||
| SPO-11 (me44) / nT1 IV; c++ /CLI nT1 [qIs51 [myo-2::gfp EPIs-10::gfp, PF22B7.9::gfp]] V | AV800& | AV776 |
| meIs8 [torta-1p::gfp::cosa-1 + unc-119(+)] II; | AV809& | AV727 |
| ltIs37 [torta-1p::mCherry:: sua-58 + unc-119(+)] IV; | ||
| ltIs38 [pie-1p::gfp::ph(PLC1delta1) + unc-119(+)] | ||
| meIs8 [torta-1p::gfp::cosa-1 + unc-119(+)] II; mnT12 (X; IV) | AV826& | AV695 |
| mIn1 [dpy-10(e128) mIs14 [myo-2::gfp pes-10::gfp]] / | AV810& | DR2078 |
| bli-2(e768) unc-4(e120) II | ||
| ruIs32 [torta-1::GFP::H2B + unc-119(+)] III | AV822& | AZ212 |
| AV823& | ||
| C. briggsae - mfIs42 [Cel-sid-2 + Cel-myo-2::DsRed] | AV824& | JU1018 |
Tabela 1: estirpes tetraploide geradas. * Deduzida ao marcar o número de bivalents (pares homólogos conectados) e univalents (homologs individuais) em oócitos antes as divisões meióticas além da proporção de machos procriado.
Filme 1: triagem para confirmar se estável Lon cepas são completa ou parciais tetraploids. Filme começa com uma diagrama de um hermafrodita de tipo selvagem, destacando a região fotografada (oócitos não fertilizados) para identificar tetraploids pela contagem de pares de cromossomos. Seguindo o esquema, uma série de filmes Z-pilha e projeções mostram gônadas de animais diploides e tetraploide fixados e DAPI manchado ou imagens de cepas expressando histona Mcherry::H2B ao vivo. Triagem é feita pela contagem do número de pares de cromossomos homólogos conectado em oócitos não fertilizados. Contagem de MCherry ou DAPI corpos manchados é feito no oócito não fertilizado mais próximo ao esperma armazenar espermateca "(o oócito-1"). Cromossomos neste oócito são mais condensados e separados uns dos outros, permitindo contagens de pares homólogo mais preciso. Mais de 10 animais por estirpe foram projectados para garantir que as contagens do cromossoma-1 oócito eram precisas. Espessura da pilha é de 0,2 µm. por favor clique aqui para ver este vídeo. (Botão direito do mouse para fazer o download.)
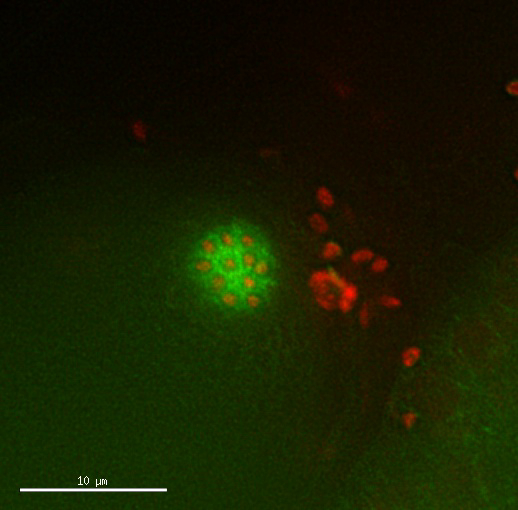
Movie 2: divisões tetraploid do oócito aparecem normais. Lapso de tempo de dividir o oócito de uma estirpe tetraploide expressando histona Mcherry::H2B e GFP::β-tubulina. Sincronismo e padrão das divisões parecem normais. Imagens tiradas a cada 2,5 min. por favor clique aqui para ver este vídeo. (Botão direito do mouse para fazer o download.)
Discussão
Produção de gametas haploides (n) é a chave para gerar um zigoto diploides (2n) na fecundação. Esta redução do genoma é realizada durante a meiose, com duas divisões celulares consecutivas após uma duplicação do genoma único. Para gerar haploid gâmetas, c. elegans, tal como acontece com a maioria dos outros metazoários, segregam maternalmente e paternalmente derivada de homologs na primeira divisão, Considerando que a irmã cromátides irmãs de cada homólogo segregam na segunda divisão. Um caminho que todo genoma poliploidia surge na natureza é através da geração de gâmetas que deixam de metade do seu tamanho do genoma durante a meiose.
Ele foi conhecido por mais de 50 anos que tetraploide nemátodo c. elegans é viáveis e férteis. Nigon23e mais tarde Madl e Herman22, gerado e identificado um punhado de tetraploids de c. elegans por perturbar a segregação de cromossomas usando tratamentos de choque do calor e usando marcadores genéticos, respectivamente. Um único adicional estirpe tetraploide de c. briggsae foi derivado usando esse protocolo de mais de 30 anos mais tarde24. Estes tetraploids foram utilizadas para investigar como o c. elegans determinar se tornar masculino ou hermafrodita, como a ploidia regula o crescimento e tamanho e para analisar o emparelhamento e synapsis em meiose25,26, 38 , 39 , 40. no entanto, estes e outros estudos que exijam a utilização de tetraploids específicos ou triploide estirpes foram limitados pela dificuldade em gerar cepas tetraploide por esse método.
O protocolo descrito aqui permite a geração de estável 4A completo, 4 X e 4A parcial, 3 X tetraploide Caenorhabditis nematoides cepas de qualquer inicial diploide fundo genético ou cariotípica sem o uso de marcadores genéticos.
Tetraploidy podem ocorrer em mais de um mecanismo em c. elegans:
MADL e Herman sugeriram que as estirpes tetraploide que eles gerados provavelmente derivado de um estado intermediário triploide. As suas estirpes foram obtidas através de seleção ao longo de várias gerações, ou atravessando o putativo triploide intermediário com machos diploides22. Os defeitos no cromossomo particionamento em rec-8 mutantes que dá origem ao diploides oócitos e esperma sugerem outro possível mecanismo pelo qual animais tetraploide podem surgir com o rec-8 RNAi esquema27.
As rec-8 RNAi Tratado hermafroditas poderiam produzir oócitos diploides e espermatócitos, que daria origem aos animais tetraploide após a fertilização. Consistente com esta possibilidade é o fato de que alguns das hermafroditas F2 clonadas deram origem a cepas de Lon estáveis na próxima geração, que sugere que o clonado hermafroditas Lon F2 onde já tetraploide. No regime de cruzamento, a primeira geração de rec-8 RNAi Tratado hermafroditas é cruzada com machos não tratados. Diploides espermatócitos ainda poderão surgir nos machos, porque a Cruz é feita na presença de bactérias expressando dsRNA rec-8 , e assim, os machos estão expostos a rec-8 RNAi durante o acasalamento durante pelo menos 3 dias. Portanto, os Lon poliploides em regime de cross-fertilizing podem também ter formado a partir fertilização de ovócitos diploides por espermatozoide diploide. Estirpes tetraploide estáveis podem surgir de qualquer fecundação entre gametas diploides ou de cruzar animais triploide contendo ovócitos de ploidia variável com animais diploides, produção de espermatozoides haploides.
Considerações importantes:
Autocontra regimes de fertilização cruzada:
O esquema de adubação auto rec-8 RNAi tratados F1 hermafroditas e o esquema envolvendo a travessia de hermafroditas tratadas com machos não tratados ambos deu origem a 4A, 4x e 4A, 3 cepas tetraploide de X. Embora mais poliploides foram inicialmente isolados do regime self fertilização, mais destes animais poliploides foram esterilizados e assim, ambos os esquemas são similarmente eficientes em produzir tetraploide estirpes estáveis. A razão para o maior sucesso e esterilidade em regime de self fertilização permanece desconhecida. Embora ambos os esquemas são da mesma forma eficientes, o esquema Self fertilização é mais fácil porque não exige o isolamento dos machos para o acasalamento. Além disso, quando a tensão de interesse é ineficiente ou com defeito no acasalamento, o regime de fertilização seria preferível. O esquema de cross-fertilizing pode ser usado para gerar tetraploids complexas, contendo mais de duas versões de um único cromossomo.
Modificações e limitações:
Atualmente, este protocolo envolve rec-8 tratamento de RNAi, alimentando as bactérias expressando dsRNA para o gene de rec-8 . Assim, este protocolo não funciona em espécie Caenorhabditis não respondem a RNAi, alimentando ou em mutantes defeituosos em propagação ambiental ou sistêmica de RNAi entre tecidos41,42,43. Este problema potencialmente poderia ser resolvido através da introdução de RNAi tratamento por injeção direta do dsRNA de interesse diretamente para da linha germinal.
Triploide animais devem ser gerados através do cruzamento de um tetraploide de um animal diploide, da qual foi derivada, porque este regime não gera tensões triploide estável44,45. Apenas 15% dos ovos sired por triploides escotilha, e seus descendentes são principalmente uma progênie estéril devido à aneuploidia. Além disso, alguns descendentes férteis sobreviventes tendem a ser completa ou perto diploides dentro de algumas gerações. Isto é provável, pelo menos em parte, porque os oócitos são parcialmente corrigindo trissomia segregando o terceiro cromossomo no corpo polar na primeira divisão meiótica.
Uma limitação insuperável deste protocolo é que ele não funciona para fazer tetraploids de mutantes que afetam componentes da maquinaria de RNAi porque são resistentes ao tratamento de RNAi46.
Solução de problemas:
RNAi REC-8:
Algumas considerações são cruciais para este protocolo para ser bem sucedido. A primeira é usar IPTG fresco e placas de IPTG NMG feitas recentemente para a indução da produção de dsRNA rec-8 em bactérias bactérias HT115 carregando o clone de rec-8 (W02A2.6). IPTG é sensível à luz, e é importante reduzir a exposição à luz para placas. Placas IPTG podem ser armazenadas a um mês a 4 ° C, no escuro. Em segundo lugar, as rec-8 (W02A2.6) RNAi HT115 cepas bacterianas da biblioteca Ahringer (agar e Ahringer 2003) renderam um fenótipo de rec-8 mais forte do que outros disponíveis rec-8 HT115 clones.
Manutenção da variedade tetraploide:
Tetraploide cepas crescem muito lentamente e produzem no máximo 50 progênies por geração47. Todas as cepas tetraploide identificadas são relativamente estáveis, mas podem quebrar e se tornar diploide quando estressado (comunicação pessoal de Jonathan Hodgkin e nossas observações não publicadas). Portanto, é importante notar que, quando cepas tetraploide são cultivadas em 25 ° C, calor-chocado, fome, ou congelados e descongelados, pode reverter rapidamente a Diploidia, portanto, é importante continuar a escolher os animais Lon quando estas linhagens de degelo ou quando expondo estas linhagens de condições estressantes que podem levá-los a reverter.
Aplicações possíveis:
Investigação do efeito ou o papel de polyploidization do genoma inteiro em evolução, ciclo celular, expressão gênica e desenvolvimento em organismos multicelulares dependeu de comparações entre: células em um organismo que contêm ploidia diferente, a mesma célula tipos em intimamente relacionado de espécies com diferente ploidia, ou que foram submetidos a evolutivamente recentes eventos polyploidization e isolamento físico3,5,6,7,8 ,11,18,19,20,,48,,49,50. Embora tetraploids podem ser derivados do zebrafish e mouse sistemas modelo, seus descendentes são estéreis ou letal embryonically16,17. Além disso, estes sistemas de modelo têm ciclos de vida longos em comparação com c. elegans, e os métodos disponíveis para gerar animais poliploides são complexas e ineficiente. Portanto, as cepas de c. elegans obtidas por este método será fundamental para promover qualquer investigação sobre os efeitos e funções do genoma inteiro poliploidia em organismos multicelulares.
Desde que um triploide pode ser derivado de um tetraploide, atravessava o tetraploide para o original diploides, uma comparação entre diploides, triploides e tetraploids que só diferem no número de cópias do genoma, proporciona uma oportunidade única e sem precedentes de Avalie o equivalentes animais/órgãos/células com tamanho diferente do genoma (ou dose do gene). A flexibilidade e a facilidade do esquema descrito aqui nos permitiu gerar dezenas de cepas tetraploide de diferentes origens genéticas de diploides ou cariótipos. Algumas destas tensões já foram usadas para mecanismos de consulta de emparelhamento de cromossomos homólogos e sinapse durante a meiose,27.
Estirpes tetraploid do tipo selvagem e mutante, carregando marcadores fluorescentes fornecerá novas vias de investigação para compreender as relações entre a relação do genoma tamanho e nuclear/citosol intracelular/celular/órgão e todo animal dimensionamento, genoma polyploidization na adaptação, especiação, dose do gene e expressão e desenvolvimento de tecidos e órgãos. Além do estudo da escala biológica, a geração de cepas tetraploide será significativamente mais consultas de fundamentais questões biológicas relevantes para extracelular sinalização, instabilidade de genoma, Endoreduplicação, genoma duplicação, dosagem de gene, adaptação ao estresse, desenvolvimento de resistência às drogas e mecanismo de especiação.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos ao centro de genética Caenorhabditis (financiado pelo National Institute of Health (NIH) escritório de pesquisa infra-estrutura programas P40 OD010440) cepas. Os autores gostaria agradecer Baptiste Roelens e Eli Lessmann, por nos fornecer feedback construtivo e o laboratório de Mano em CCNY, CUNY para a utilização de seu laboratório para parte das filmagens e por sua assistência. Este trabalho foi apoiado por um prêmio de PSC-CUNY TRADB-46-113 e NIH conceder 1SC2GM118275-01. M.S. foi parcialmente apoiado por um Instituto canadense de bolsa pós-doutorado saúde (CIHR) e Sergio Eduardo foi apoiado por subir o NIH/NIGMS conceder a GM062981.
Materiais
| Name | Company | Catalog Number | Comments |
| Dissecting Microscope | Motic Microscopy | SMZ171 | |
| Name | Company | Catalog Number | Comments |
| NGM agar plates | |||
| 60 mm x 15 mm Petri Dishes, Sterile | Tritech Research | T3305 | |
| 35 mm x 15 mm Petri Dishes, Sterile | Tritech Research | T3500 | |
| Bacteriological Agar, 5 kg | VWR | 89140-850 | |
| Sodium Chloride, Biotechnology Grade | VWR | 97061-278 | |
| Peptone, BD Bacto | VWR | 90000-368 | |
| Ampicillin Trihydrate | VWR | 97062-300 | |
| IPTG, dioxane-free | Thermo Scientific | R0391 | |
| Name | Company | Catalog Number | Comments |
| Growth Culture | |||
| LB Lennox Broth | IBI Scientific | 89126-176 | |
| Name | Company | Catalog Number | Comments |
| LB Agar plates | |||
| LB Agar Lennox | IBI Scientific | 89126-182 | |
| Name | Company | Catalog Number | Comments |
| Antibiotics | |||
| Ampicillin Trihydrate | VWR | 97062-300 | |
| Tetracycline Hydrochloride | Fisher Scientific | BP912-100 | |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Hoechst 33258, Pentahydrate | Biotium | 40045 | |
| DAPI | Biotium | 40011 | |
| Name | Company | Catalog Number | Comments |
| Ethanol Fixation | |||
| Ethanol, Pure, 190 Proof (95%), USP | Koptec, VWR | 89125-166 | |
| Name | Company | Catalog Number | Comments |
| M9 Buffer | |||
| Sodium chloride, Biotechnology Grade | VWR | 97061-278 | |
| Potassium phosphate, Monobasic Anhydrous Grade | VWR | 97062-346 | |
| Sodium phosphate, monobasic dihydrate | Fisher Scientific | AC271750025 | |
| Name | Company | Catalog Number | Comments |
| RNAi Clones | |||
| HT115 bacteria expressing rec-8 dsRNA | Source Bioscience | W02A2.6 | |
| HT115 bacteria expressing rec-8 dsRNA | Dharmacon | RCE1182-202299820 |
Referências
- Ricke, R. M., van Ree, J. H., van Deursen, J. M. Whole chromosome instability and cancer: a complex relationship. Trends Genet. 24, 457-466 (2008).
- Frawley, L. E., Orr-Weaver, T. L. Polyploidy. Curr Biol. 25, R353-R358 (2015).
- Orr-Weaver, T. L. When bigger is better: the role of polyploidy in organogenesis. Trends Genet. 31, 307-315 (2015).
- Otto, S. P. The evolutionary consequences of polyploidy. Cell. 131, 452-462 (2007).
- Davoli, T., de Lange, T. The Causes and Consequences of Polyploidy in Normal Development and Cancer. Annu Rev Cell Dev Biol. 27, 585-610 (2011).
- Adams, K., Wendel, J. Novel patterns of gene expression in polyploid plants. Trends Genet. 21, 539-543 (2005).
- Adams, K. L., Wendel, J. F. Polyploidy and genome evolution in plants. Curr Opin Plant Biol. 8, 135-141 (2005).
- Berman, J. Ploidy plasticity: a rapid and reversible strategy for adaptation to stress. FEMS Yeast Res. 16, (2016).
- Levy, D. L., Heald, R. Mechanisms of Intracellular Scaling. Annu Rev Cell Dev Biol. 28, 113-135 (2012).
- Breneman, A., Cande, J., Dunn, J., Burbank, K., O'toole, E. Genome-wide genetic analysis of polyploidy in yeast. Nature. 443, 541-547 (2006).
- Kuznetsova, A. Y., et al. Chromosomal instability, tolerance of mitotic errors and multidrug resistance are promoted by tetraploidization in human cells. Cell Cycle. 14, 2810-2820 (2015).
- Taylor, J. S., Van de Peer, Y., Meyer, A. Genome duplication, divergent resolution and speciation. Trends Genet. 17, 299-301 (2001).
- Younis, A., Hwang, Y. -. J., Lim, K. -. B. Exploitation of induced 2n-gametes for plant breeding. Plant Cell Rep. 33, 215-223 (2014).
- Ihssen, P. E., McKay, L. R., McMillan, I., Phillips, R. B. Ploidy Manipulation and Gynogenesis in Fishes: Cytogenetic and Fisheries Applications. Trans Am Fish Soc. 119, 698-717 (2011).
- Stanley, J. G., Allen, S. K., Hidu, H. Polyploidy induced in the American oyster, Crassostrea virginica, with cytochalasin B. Aquaculture. 23, 1-10 (1981).
- Eakin, G. S., Behringer, R. R. Tetraploid development in the mouse. Dev Dyn. 228, 751-766 (2003).
- Heier, J., Takle, K. A., Hasley, A. O., Pelegri, F. Ploidy manipulation and induction of alternate cleavage patterns through inhibition of centrosome duplication in the early zebrafish embryo. Dev Dyn. 244, 1300-1312 (2015).
- Arnold, B., Kim, S. -. T., Bomblies, K. Single Geographic Origin of a Widespread Autotetraploid Arabidopsis arenosa Lineage Followed by Interploidy Admixture. Mol Biol Evol. 32, 1382-1395 (2015).
- Session, A. M., et al. Genome evolution in the allotetraploid frog Xenopus laevis. Nature. 538, 336-343 (2016).
- Gallardo, M. H., Bickham, J. W., Honeycutt, R. L., Ojeda, R. A., Köhler, N. Discovery of tetraploidy in a mammal. Nature. 401, 341 (1999).
- Hodgkin, J. Primary sex determination in the nematode C. elegans. Development. 101, 5-16 (1987).
- Madl, J. E., Herman, R. K. Polyploids and sex determination in Caenorhabditis elegans. Genetics. 93, 393-402 (1979).
- Nigon, V. Polyploidie experimentale chez un nematode libre, Rhabditis elegans maupas. Bull Biol Fr Belg. 95, 187-225 (1951).
- Woodruff, G. C., Eke, O., Baird, S. E., Félix, M. -. A., Haag, E. S. Insights Into Species Divergence and the Evolution of Hermaphroditism From Fertile Interspecies Hybrids of Caenorhabditis Nematodes. Genetics. 186, 997-1012 (2010).
- Mlynarczyk-Evans, S., Roelens, B., Villeneuve, A. M. Evidence That Masking of Synapsis Imperfections Counterbalances Quality Control to Promote Efficient Meiosis. PLoS Genet. 9, e1003963 (2013).
- Lozano, E., Sáez, A. G., Flemming, A. J., Cunha, A., Leroi, A. M. Regulation of Growth by Ploidy in Caenorhabditis elegans. Curr Biol. 16, 493-498 (2006).
- Roelens, B., Schvarzstein, M., Villeneuve, A. M. Manipulation of Karyotype in Caenorhabditis elegans Reveals Multiple Inputs Driving Pairwise Chromosome Synapsis During Meiosis. Genetics. 201, 1363-1379 (2015).
- Martinez-Perez, E., et al. Crossovers trigger a remodeling of meiotic chromosome axis composition that is linked to two-step loss of sister chromatid cohesion. Genes Dev. 22, 2886-2901 (2008).
- Severson, A. F., Ling, L., van Zuylen, V., Meyer, B. J. The axial element protein HTP-3 promotes cohesin loading and meiotic axis assembly in C. elegans to implement the meiotic program of chromosome segregation. Genes Dev. 23, 1763-1778 (2009).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30, 313-321 (2003).
- Wood, W. B. . The Nematode Caenorhabditis Elegans. , (1988).
- MacQueen, A. J., et al. Chromosome Sites Play Dual Roles to Establish Homologous Synapsis during Meiosis in C. elegans. Cell. 123, 1037-1050 (2005).
- Martinez-Perez, E., et al. Crossovers trigger a remodeling of meiotic chromosome axis composition that is linked to two-step loss of sister chromatid cohesion. Genes Dev. 22, 2886-2901 (2008).
- Schvarzstein, M., Wignall, S. M., Villeneuve, A. M. Coordinating cohesion, co-orientation, and congression during meiosis: lessons from holocentric chromosomes. Genes Dev. 24, 219-228 (2010).
- Kim, S., Spike, C., Greenstein, D. . Germ Cell Development in C. elegans. , 277-320 (2013).
- Peters, N., et al. Control of mitotic and meiotic centriole duplication by the Plk4-related kinase ZYG-1. J Cell Sci. 123, 795-805 (2010).
- Pasierbek, P. A Caenorhabditis elegans cohesion protein with functions in meiotic chromosome pairing and disjunction. Genes Dev. 15, 1349-1360 (2001).
- Hodgkin, J. Primary sex determination in the nematode C. elegans. Development. 101, 5-16 (1987).
- Flemming, A. J., Shen, Z. -. Z., Cunha, A., Emmons, S. W., Leroi, A. M. Somatic polyploidization and cellular proliferation drive body size evolution in nematodes. Proc Natl Acad Sci U S A. 97, 5285-5290 (2000).
- Meneely, P. M. Sex determination in polyploids of Caenorhabditis elegans. Genetics. 137, 467-481 (1994).
- Whangbo, J. S., Hunter, C. P. Environmental RNA interference. Trends Genet. 24, 297-305 (2008).
- Imae, R., Dejima, K., Kage-Nakadai, E., Arai, H., Mitani, S. Endomembrane-associated RSD-3 is important for RNAi induced by extracellular silencing RNA in both somatic and germ cells of Caenorhabditis elegans. Sci Rep. 6, 28198 (2016).
- Tijsterman, M., May, R. C., Simmer, F., Okihara, K. L., Plasterk, R. H. A. Genes required for systemic RNA interference in Caenorhabditis elegans. Curr Biol. 14, 111-116 (2004).
- Cortes, D. B., McNally, K. L., Mains, P. E., McNally, F. J. The asymmetry of female meiosis reduces the frequency of inheritance of unpaired chromosomes. Elife. 4, e06056 (2015).
- Vargas, E., et al. Autosomal Trisomy and Triploidy Are Corrected During Female Meiosis in Caenorhabditis elegans. Genetics. 207, 911-922 (2017).
- Tabara, H., et al. The rde-1 gene, RNA interference, and transposon silencing in C. elegans. Cell. 99, 123-132 (1999).
- Hodgkin, J. . Karyotype, ploidy, and gene dosage. , (2005).
- Schoenfelder, K. P., Fox, D. T. The expanding implications of polyploidy. J Cell Biol. 209, 485-491 (2015).
- Levy, D. L., Heald, R. Biological Scaling Problems and Solutions in Amphibians. Cold Spring Harb Perspect Biol. 8, a019166 (2015).
- Taylor, J. S., Van de Peer, Y., Braasch, I., Meyer, A. Comparative genomics provides evidence for an ancient genome duplication event in fish. Philos Trans Royal Soc B. 356, 1661-1679 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados