Method Article
カエノラブディティス ・ エレガンスにおける倍数性の操作
要約
このメソッドは、任意の二倍体のひずみから四倍体、三倍体線虫寄生線虫の生成できます。このメソッドによって生成される倍数体の系統は、減数分裂の前期では、染色体の相互作用の研究に使用されているし、このメソッドはセル、発達、進化、および癌生物学の重要な基本的な質問を調べる際に役立ちます。
要約
全ゲノム倍数体を含む機構開発と進化に重要な役割を再生します。また、四倍体細胞の異常発生は両方の癌の進行と薬剤耐性の開発に関連付けられています。今までは、ほとんど無菌子孫を生成することがなく、多細胞動物の倍数性を簡単に操作することはなかった。四倍体線虫を生成するための簡単かつ迅速なプロトコルは、ここで提示された任意の二倍体のひずみからの動物。このメソッドでは、最終的にc. の elegansの倍数性を増加、減数分裂期の染色体分離のバイアスを作成することができます。この戦略は、二倍体の配偶子を生成するrec 8遺伝子の発現の一時的な減少に依存します。Rec 8変異体には、受精時に四倍体を作り出すことができる可能性のある二倍体の配偶子が生成されます。この扱いやすいスキームは、四倍体株の突然変異とのペアリングと減数分裂におけるシナプスの間に染色体の動態と相互作用への洞察力を得るために染色体の語順換えを運ぶを生成する使用されています。このメソッドは、遺伝マーカーなし安定した四倍体菌株を生成する効率的です、任意の二倍体のひずみに適用することができます、使用、三倍体のc. の elegansを派生できます。この直接的な方法はゲノムの不安定性、遺伝子量、生物学的スケーリング、細胞シグナル伝達、適応ストレス、薬剤への抵抗の開発に関連するその他の基本的な生物学的質問を調査するため役に立つと種分化の機構。
概要
全ゲノム倍数体が自然界に存在する、適応、種分化、器官形成、創傷治癒および生物学的スケーリング; 必要なステップで多くの場合がんと薬1,2,3,4,5,6,7,8,への抵抗を促進するために知られているも9,10,11,12. 農業・水産業化学処理 (例えばコルヒチン、orzalin) より高速な成長率とかさばる作物と家畜13,を取得する倍数性植物、魚および貝を生成する14,15。四倍体の実験と非効率的な生産は、マウスやゼブラフィッシュ モデル システム16,17に存在します。ただし、生成されるほとんどまたはすべての倍数性の多細胞動物は強肩致死または生殖不能およびこうして多細胞の有機体の倍数性の影響に関する実験的研究には適していません。その結果、多細胞生物におけるゲノム polyploidization のいずれかを理解されている限られた密接に関連種に進化最近 polyploidization イベント18,19,20 から.生物学的役割のクエリまたは polyploidization の結果を事前にパス線虫モデル システムの使用であります。重要なは、線虫は通常、二倍体として存在するのみ 5 常染色体 (A) とゲノムあたり 1 つの性染色体 (X) が含まれている、生物学的過程の生体内観察用透明になりますが扱いやすい遺伝的システムと(性的に成熟した大人に卵) から 3-4 日の短いライフ サイクルがあります。線虫ゲノム自然に倍数性の最も一般的なタイプは、四倍体として再現できるように示されています。三倍体の動物は、二倍体と四倍体を交配することによって生成できます、その倍数性が不安定で、世代のカップル以内に二倍体系統になります。
最後の数十年でほんの一握り実行可能、肥沃な線虫の四倍体系統で分離された研究室は骨の折れるし系統21,22,限られた種類のみを生成する戦略を使用して23. この戦略はおそらく遺伝マーカーを用いた推定の倍数性動物のためのスクリーニングに続いて、配偶子の染色体分配に影響を与える熱ショック処理による線虫の四倍体を生成します。これらの四倍体は、この線虫が男性または両性具有になるかどうかを決定する方法のお問い合わせに非常に有益だった。その後の研究は、成長、遺伝子量とこの線虫21,24,25,26の減数分裂期にシナプスの規制を検討するのに利用可能な系統を使用しました。残念ながら、これらの研究は、これらの系統に含まれる新しい四倍体系統と背景遺伝子マーカーを生成するの難しさによって限られていた。ここに示す、減数分裂27の間にシナプスの制御を勉強する菌株を生成するために使用されている安定した四倍体を生成する簡単かつ迅速なプロトコルです。
自然、半数体の配偶子ではなく二倍体の形成によって polyploidization が発生します。四倍体の子孫 (図 1)27の生産に減数分裂固有コヒーシン コンポーネント変異rec 8倍精子を生成して、 rec 8遺伝子ノックダウン卵母細胞が示された私達の見つけることになります 28,29。四倍体菌株を生成する単にノックダウンrec 8 RNA 干渉 (RNAi) phenocopy rec 8に 2 つの世代のために突然変異体の二倍体の配偶子が含まれます。彼らの長いによって推定される倍数体を簡単に識別できます通常の体のサイズよりも。倍数体は、安定したラインが確立されたら核あたりの染色体の数を数えることによって完全または部分的な四倍体で確認しています。
ここで説明されている方法では、初期の二倍体遺伝的背景または遺伝標識を使用せず核型から安定した四倍体の線虫線虫の系統の生成を可能。 にします。このプロトコルはより効率的、汎用性の高い、かつ以前を使用する方式よりも単純なため、拡大する開発、ゲノムの安定性と多細胞の進化の基本的なプロセスで polyploidization の役割を照会するために必要なツール生物。このプロトコルの使用で唯一可能な制限は、RNAi に耐性の遺伝的背景です。
プロトコル
1. セットアップrec 8 RNAi (図 2の 1-3 日)
このプロトコルは、Kamath および Ahringer30から変更されます。
- エシェリヒア属大腸菌のrec 8 dsRNA 式の誘導、準備最終濃度 1 mM イソプロピル-β-D-2-thiogalactopyranoside (IPTG) と 100 μ g/mL を添加した線虫成長媒体 (NGM) 寒天培地プレート31アンピシリン。4 週間までの使用まで 4 ° C で暗闇の中で保管します。
- ストリーク HT115 細菌が 100 μ g/mL アンピシリン 50 μ G/ml テトラサイクリンと補われるルリア スープ (LB) プレートの上に Ahringer 研究所図書館30 rec 8クローンからrec 8 (W02A2.6) クローンを運ぶします。37 ° C でシェーカーで一晩成長します。
- 1 日目に 4 mL LB 含む 100 μ g/mL アンピシリンと 50 μ G/ml テトラサイクリンにrec 8 RNAi クローンを行う HT115エシェリヒア属大腸菌細菌のたてすじ状シングル コロニーからシングル コロニーを接種します。シェーカーや 37 ° C でローラー ドラムで一晩細菌文化を成長します。
- 次の朝 (日 2)、二本鎖 (ds) RNA rec 8 W02A2.6 37 ° C で 40 分間揺れを最終濃度 1 mM IPTG を追加して HT115 の細菌文化のための生産を誘発します。
- 誘導後、NGM/IPTG HT115 rec 8細菌の 100-200 μ L をシードし、暗い一晩 (日 3) で室温でプレートを格納します。
- 翌朝 (日 4) は、手順 2.1 以下で説明するよう誘導 HT115 rec 8細菌プレートに希望の線虫のひずみを追加します。
2. 生成および四倍体 (図2 4 16 日) を分離すること
- 4 日目の 3-4 ヤング NMG/IPTG プレート二倍体ひずみの L4 (4) 幼虫の両性具有は前日に誘導されていた HT115 rec 8細菌とシードを配置 (上記 1.5 を手順)。暗闇の中で 15 ° C で線虫を成長します。
- 3 日前に最初の子孫 (F1s) そのステップからなる L4s となる 1.3 と 1.4 の手順 2.1 後、3 日を開始手順を繰り返します。このステップのタイミングどれだけ速く線虫のひずみは、15 ° C での成長に依存します。遅い栽培者であり、このタイミングは微調整が必要ないくつかの二倍体の突然変異系統四倍体を隔離するためのチューニングします。
- (4 日後rec 8 RNAi 摂食治療) は 8 日、F1 (雑種第一代) L4 の両性具有をたて誘導 HT115 rec 8 RNAi に HT115 rec 8細菌の成長の 20 (2 の両性具有/シャーレ) を転送でき、self-fertilize へのそれら。
- また、転送 20 F1 L4 の両性具有のたてに HT115 rec 8細菌の成長は、同じひずみ (両性具有 2 4 6 男性/プレート) の未処理の男性と一緒に HT115 rec 8 RNAi 細菌を誘導しました。
- 日 13 日スタート表示長い子孫 F2 (雑種第二世代) のスクリーニング (Lon) にまたは全体的に野生型よりも大きい大腸菌の細菌の正規 OP50 や HB101 系統に経度個体を転送します。F3 (第三孝) 子孫; をスクリーニングを継続します。しかし、同じプレートから F3 子孫が定着する場合独立した系統は考慮できません、同じ兄弟で既に F2 母なる可能性があります。
注: 切片よりも明らかに長いので、推定四倍体、簡単に識別されます。野生型の両性具有は、四倍体より短い 3 分の 2 です。長いので、4 倍体になります余分なターン (図 3 a) の尾に頭から体曲げ波の正弦波を生成することによって進みます。 - Self-fertilize、経度子孫のみがrec 8 RNAi 治療の不在で子までイオンの子孫を選択することにより伝達する経度ワームを許可します。これは、2、3 追加世代をかかることがあります。経度ワームしばしば無菌のものであり、子孫に譲歩しません。
3. 四倍体系統 (映画 1 および図 3 a, B) を確認します。
注: 自分の卵子の染色体の数を数えることによって四倍体系統を検証できます。蛍光顕微鏡を使用することができますひずみに染色体の蛍光マーカーがある場合、卵子 (前に減数分裂の部門) では、二倍体の染色体対の数の画面に。蛍光染色体マーカーがない場合は、四倍体線虫は線虫を固定および DNA 色素で染色によって選別することができます。エタノールを修正し、全体の動物 4 ′ のためのプロトコルについては後述 6-Diamidine-2-phenylindole 二塩酸塩 (DAPI) 染色します。
- 全体の動物 DAPI 染色
注: これらの動物を染色し、その卵子の DAPI 体の数を数える DAPI によって 12 接続された染色体のペアを運ぶ四倍体系統を検証できます。- M9 バッファー31顕微鏡スライド上の 10 μ L を場所 5 ドロップ 6-10 線虫を転送します。
- 解剖顕微鏡の下で糸くずクリーニング ティッシュで線虫を削除せずドロップから M9 のほとんどを描画します。すぐにワームに 90% のエタノールの 10 μ L のドロップを追加します。もはや秒のカップルよりも完全に、しかしのために乾燥するワームを許可します。
- エタノールが蒸発すると同時に (これともいえる解剖顕微鏡の下でそれが起こる)、ワームに 90% のエタノールの追加の 10 μ L を追加。
- 3.1.3 のステップを 3 回繰り返します。
- エタノールの最後の一滴が蒸発した後の選択 (たとえば、M9 の 2 ng/μ L の DAPI ストック濃度の縮尺希釈) マウント メディア推奨の最終濃度に DAPI やヘキスト染料 6 μ L を追加します。スライドの長期保管は、0.5 %p-フェニレンジアミン M9 のみではなく 20 mM antifade ソリューションとして 90% のグリセロールの pH 8.8, トリス塩酸に溶解を使用する可能性があります。
- 観察のスライドにワームをカバーし、マニキュア液をカバーガラスの端を密封します。蛍光顕微鏡 (ステップ 3.1.7) のスコア、coverslip を追加した後、少なくとも 10 分。4 ° C で数日間、得点する前に antifade することがなくスライドを格納できますが、蛍光性は数日後減少を開始します。
- 100 倍の倍率で蛍光顕微鏡を用いた、交尾に隣接し、まだ入力していない、交尾、最も成熟した未受精卵細胞単一 DAPI ボディ (おそらく単一の染色体のペア) の数をスコアまたは子宮。
- 卵母細胞の核内にある個々 の DAPI 体をスコア、カウント中に底に卵母細胞核の上からゆっくりと移動する顕微鏡のファインフォーカスを使用します。次に、DAPI ボディのカウント数を確認する反対の方向 (すなわち、下核の上から) にフォーカスを移動しながら同じ核を再集計します。
- 安定したイオン株あたり少なくとも 10 個の両性具有の 2 つの生殖腺の最も成熟した未受精卵をスコアします。野生型の卵母細胞は、平均、5 型のペア、および性染色体のペアに 6 の DAPI のボディを持っています。安定したイオン株の卵母細胞に 12 の DAPI 体の存在ことを示しますこのひずみの動物部分 (3 より座位の 4 セット) または完全な (座位、4 よりの 4 セット) 四倍体。
- DAPI 体ひずみあたり複数の (少なくとも 10) 卵から観察の平均数を計算します。いくつかの染色体のペアになるでしょうか、右側 1 つ別、DAPI の数体の卵のための上部が染色体ペアの実際の数よりも小さい頻繁。
- (省略可能)DAPI 体の平均数が 12 (4 a, 4 X) の全体または一部 (4 a、3 X) であるかどうかをテストするのには安定したイオン株をさらに検証 HTP 332など染色体軸蛋白質に対して染色蛍光抗体法によって四倍体。この染色は、単一の接続されていない染色体部分の四倍体で存在から十字形パターンを示すことによって染色体のペアを区別します。
結果
Rec 8二倍体の配偶子の減数分裂コヒーシン コンポーネント関数の結果の障害:
コヒーシン コンポーネント変異rec 8減数分裂部門イメージング精子と卵子は四倍体動物 (図 1)27,29,33を生成するための可能なメカニズムを明らかにしました。機械論的に、 rec 8変異精子と卵母細胞の減数分裂欠陥が異なります。ただし、両方の男性と女性の二倍体の配偶子は、 rec 8変異によって生成されます。
野生型の減数分裂における相同染色体一時的にクロス オーバーの再結合によって互いに接続になるし、単位または 2価 (図 1 a) として第一減数分裂を入力34。最初分裂の間に相同染色体 (同族体)、互いに離れてを分離するのに対し各相同物の染色分け体は 2 部まで一緒にままの妹。染色体分配のパターンでは、雌性および雄性配偶子で同じですが、精母細胞の分裂は対称、専門にされた細胞質分裂を経るに対し、卵分割は非対称です。各部門の卵母細胞は小さな極体に事業商品の半分を破棄します。したがって、1 つの半数体の卵母細胞および 2 つの極体 (図 1 bC)35を生じさせる各卵母細胞の前駆体。逆に、単一状態の前駆体は 2 つの対称の分割を受けることによって 4 つの機能細胞に上昇を与えます。第 2 部残留の体から新進のオフ 4 細胞で絶頂に達する。この分裂は、特別なパターンおよび細胞数36中心によって決定されます。
Rec 8変異体配偶子への前駆物質で相同染色体間のクロス オーバーの組換えが行われないと同族体は第一減数分裂29,34の初めに 2価とは接続していません。それぞれの相同物の姉妹染色分け体は 1部 2 部まで一緒に残りの代わりに互いに離れて分離野生型配偶子のよう。第二分裂の間にrec 8突然変異形質は雄性と雌性の配偶子の異なる卵母細胞は精母細胞が比較的正常細胞質分裂 (図 1 b-を受けるに対し、細胞質分裂を経るに失敗するという点で興味深いことに、F)27,28,29します。 2 番目の部門の彼らは染色体分配と細胞質分裂を失敗するために二倍体の卵母細胞が発生する、それ故に彼らは第二極体 (図 1 b、C) を押し出すいません。Rec 8 germlines 精母細胞 spermatid 出芽または分裂を受けるが、多くの場合二倍体 spermatid とクロマチンを欠けている spermatid を生成する細胞のいずれかに染色体の両方のセットを分離 (図 1- F)27。図 1 階にクロマチンに欠けているrec 8精子の割合の数量を示します。
Rec 8変異体の雌性および雄性の二倍体の配偶子の形成は、この突然変異体の表現型が全ゲノムの 4 倍体菌株を生成する潜在的使用することが示唆されました。
四倍体線虫株の生成:
すべての生成された四倍体系統でrec 8遺伝子の突然変異の存在は、一過性のrec 8ノックダウン RNAi29,37によって回避できます。これはrec 8変異体は29,37RNAi によるrec 8機能の低下が全ゲノムの四倍体動物に上昇を与えることができる可能性のある二倍体の配偶子を生成すると想定しています。このプロトコルに不可欠なrec 8変異両方二倍体の配偶子を生じさせる合理的に多数の配偶子異数性とほとんど滅菌または胚・仔致死に上昇を与える他の減数分裂変異体に反して若い種牡馬します。
(プロトコル図 2、および表 1を参照) の 2 つの方法のいずれかを使用してrec 8 dsRNA を表現する線虫菌を供給することにより生成された複数の四倍体系統27。四倍体は、 rec 8 dsRNA を表現する細菌をシャーレで 2 〜 3 世代の自家受精の両性具有によって生成できます。両性具有者はたてに配置されますこの戦略によって作られたrec 8 RNAi プレートとその子孫にたて誘導rec 8 RNAi 発現細菌 (プロトコルを参照してください)、新しいプレートの上に後数日は転送されます。さらに、四倍体 dsRNA rec 8 (を表現する細菌をシャーレに同じ遺伝子型の未処理の男性とrec 8 dsRNA を表現する細菌を供給の両性具有の第一世代を交差を通して生成できます。図 2)。この場合、十字架の雄は交尾中に L4 段階以降からrec 8 RNAi 細菌に公開されます。両方の方式は、四倍体動物27に上昇を与えます。表 1は、ここで提示された計画を使用して得られた四倍体系統を示しています。三倍体と四倍体線虫は二倍体より大きいサイズでが、三倍体系統は不安定であり、四倍体系統は比較的安定している22,23に対し 1 つまたは 2 つの世代の二倍体になる傾向があります。推定四倍体系統は、経度の子孫 (図 3 a) のみを子オリジナルのひずみ (Lon) 両性具有を超えると同定されました。イオン動物は識別簡単に - 野生型二倍体動物四倍体の長さの 3 分の 2、自分の体がその前方の正弦波の動き (図 3 a) 中に気づくことができます余分な曲げを行わない。
四倍体系統は、二倍体の両性具有 (図 3 b、Cと映画 1) 卵母細胞における染色体 6 組と比較して 4 倍の両性具有の卵母細胞の 12 の染色体対の存在のためのスクリーニングによって確認されました。
四倍体のクラス:
四倍体の両性具有の 2 つのタイプが識別された: 他二倍体の両性具有とほぼ同じ頻度で 1 つ子男性子男性、非常に高い周波数 (表 1)。男性の生産クラスの高周波に対し、二倍体の男性のそれらに類似の生産クラス周波数がすべてのの染色体 (4 a, 4 X) の四倍体とは異なりに四倍体の両性具有のこれらの 2 つの種類が示されています。両性具有であり、常染色体、性染色体 (4, 3 X) の三倍体の四倍体です。四倍体の後のクラスは安定している、4 a、両性具有 X 3、4 a、2 X 男性します。
四倍体系統は遅い成長、前法22,23で生成された系統のよう彼らから派生した切片に比べてひな縮小します。Madl とハーマン22示唆四倍体系統死胚の割合が増加する可能性があります、卵母細胞における異数性異数性の数字の上昇しかし四倍体系統の表面的な検査を明らかにしなかった十分に卵子も異常卵やひなサイズ (映画 2、および図 3D) で観察される減少を考慮する状態部門。
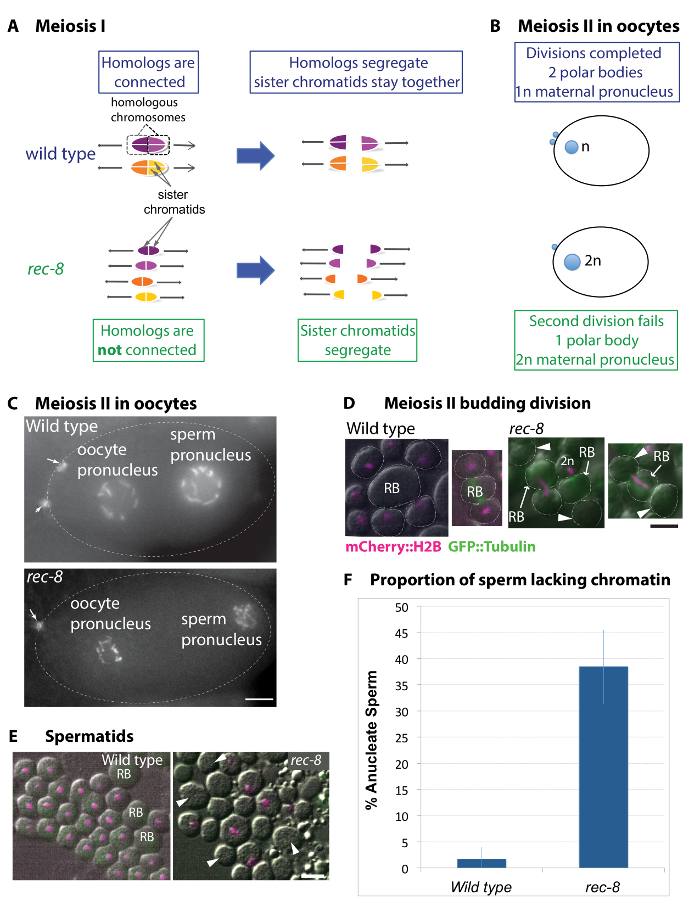
図 1: rec 8変異体の配偶子形成を意味する安定した倍数体汚れを生成するための可能なメカニズムです。(A) 野生型とrec 8変異減数分裂部門における染色体組織と偏析パターンの図。野生型の減数分裂における相同染色体は第一減数分裂で区切ります。それぞれの相同物で姉妹染色分け体の向きに向かって同じスピンドル極と第二部まで一緒に。Rec 8変異体における同族体はクロス オーバーを形成しないし、このように接続されていません。対照的に野生型、 rec 8姉妹染色分け体は離れて一から別の方向し、第一減数分裂で分離します。(B) 野生型と雌性前核と押し出し極体 (雄性前核は描かれていない) を示す変異体の卵母細胞の図。野生型の卵 2 つ非対称減数分裂の分裂は 2 つの極体の押出になります。Rec 8変異体ただし、第 2 極体押出は、二倍体の卵母細胞の結果として失敗します。(C) mCherry::histone H2B を表現する野生タイプおよびrec 8変異卵の画像。矢印は、野生型の卵子に 2 つの極体とrec 8変異体の 1 つを示しています。スケール バーは、5 μ m. (DおよびE) ライブ画像 mCherry::histone H2B (マゼンタ) を表現する野生タイプおよびrec 8の変異動物から細胞の。矢印は、anucleate 細胞を示します。スケール バーは、2 μ m。 (D) 精母細胞rec 8変異体と野生型の 2 番目の (新進) 分裂です。野生型精母細胞を受ける対称部門 4 新進の細胞があり、それぞれ半数染色体の補数が。Rec 8変異実験で染色体は 2 部で損なわれます。よくクロマチンの単一のマスのまま体内残留 (RB) または 2 人の姉妹のいずれかで第二減数分裂の細胞です。これは (矢印によって示されます) anucleate rec 8変異精子や精子の二倍体に上昇を与えます。(E) 野生型と変異体rec 8後出芽細胞のライブ映像は、差動干渉の対照 (DIC) と蛍光顕微鏡を用いた可視化。野生型細胞すべて同様の染色分け体の固まりがあります。rec 8変異細胞は、anucleate 精子を形成します。(F) 野生型とrec 8変異 anucleate 精子の定量化。rec 8変異は、野生型で 1.6% 未満と比較して anucleate 精子の 38.5% を生産しました。フィッシャーの正確確率検定は、 rec 8変異が anucleate 精子 (p ≤0.0001) 野生型と比較して有意に高い率を持っていることを示します。エラーバーは標準偏差を表しています。この図の拡大版を表示するのにはここをクリックしてください。
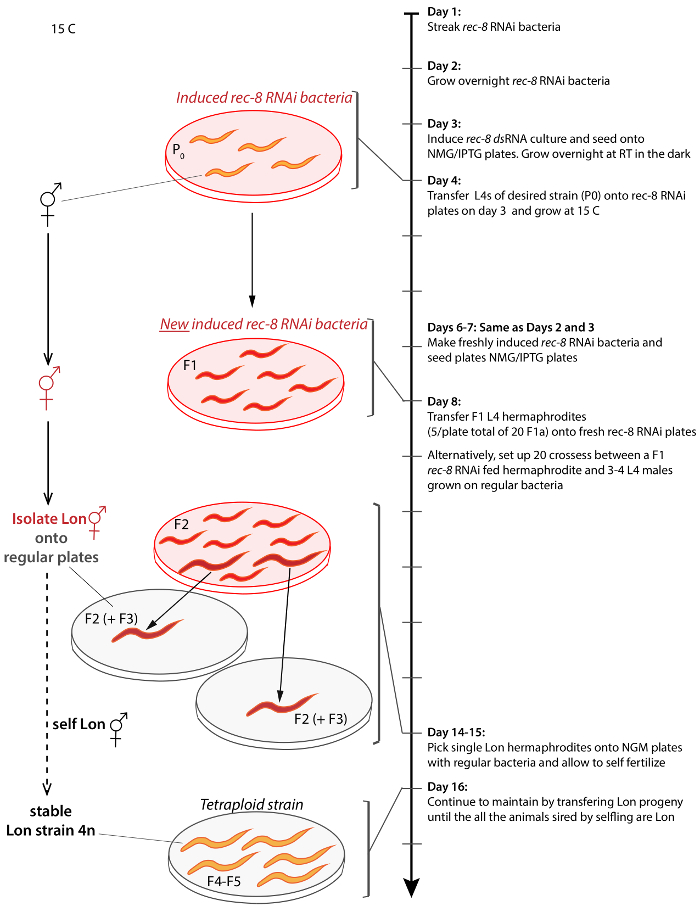
図 2: スキームを生成し、任意のひずみから四倍体線虫を分離します。プロトコルでは、1 日目から開始日 17 に進むのタイムラインが横軸で、右側にある矢印。日 9 に未処理の男性に交差の両性具有では、同様の結果を実現できます。角かっこは、ステップの描写をタイムラインに接続します。未処理動物、オレンジ、扱われた動物が赤、経度動物はサイズが大きく、透明な赤い背景と通常 OP50 細菌透明板が透明な灰色に描かれていると、細菌を表現するrec 8 dsRNA が描かれています。背景プレート。手順は、特に明記しない限り、15 ° C で行われます。この図の拡大版を表示するのにはここをクリックしてください。
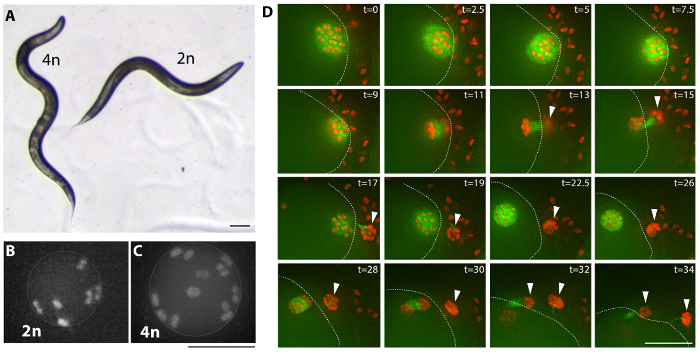
図 3: 四倍体例。(A) 四倍体 (MSC2) 動物、それは (AV740) から派生した二倍体ひずみの明視野像。四倍体の線虫は全体的に大きくなり、長い (Lon) 二倍体より。この体の大きさの違いは移動の四倍体の正弦曲線の結果し、四倍体誘導体の画面に条件として使用することができます。スケール バーは、0.1 ミリメートル。 (B, C) 蛍光 (AV740) 二倍体と四倍体 (MSC1) 最も成熟した未受精卵アジアカブトエビ、減数分裂の分裂前の画像です。第二次審査は、生殖細胞で Mcherry::H2B と GFP::β-チューブリンを表現する MSC1 ひずみの映画 1のようの確立された経度系統の未受精卵母細胞における染色体ペアの数を観察することによって実行されます。スケール バーは 5 μ m。 (D) 画像の時間経過 (映画 2) から一般に通常の減数分裂を描いた四倍体の卵母細胞減数分裂部門です。矢印マーク極体と点線、交尾中卵母細胞の皮質をマークし、囲まれて精子です。t = 時間分を経過します。スケール バーは、10 μ mこの図の拡大版を表示するにはここをクリックしてください。 。
| 遺伝子型 | 四倍体の派生物 (常染色体のセット: よりの #) * | 親株 (二倍体) |
| meIs16 [パイ 1p::mCherry:: 彼 58 + unc-119(+)]; | MSC1 (4A:4 X) | MSC0 |
| ruIs57 [パイ 1p::GFP::b-チューブリン + unc-119(+)] | MSC2 (4A:3 X) | |
| MSC3 (4A:4 X) | ||
| MSC5 (4A:3 X) | ||
| MSC6 (4A:4 X) | ||
| MSC8 (4A:4 X) | ||
| unc-119(ed3) III;ddIs6;ddIs6 [tbg 1::GFP + unc-119(+)];ltIs37;ltIs37 [pAA64; パイ-1p::mCherry::HIS-58 + unc-119(+)] IV | MSC14 (4A:3 X) | TMR17 |
| MSC15 (4A:3 X) | ||
| MSC16 (4A:4 X) | ||
| spo 11 (me44)/nT1 IV;+ nT1 [qIs51 [墓 2::gfp 委託-10::gfp、PF22B7.9::gfp] V | AV800・ | AV776 |
| meIs8 [パイ-1p::gfp::cosa-1 + unc-119(+)] II; | AV809・ | AV727 |
| ltIs37 [パイ 1p::mCherry:: 彼 58 + unc-119(+)] IV; | ||
| ltIs38 [pie-1p::gfp::ph(PLC1delta1) + unc-119(+)] | ||
| meIs8 [パイ-1p::gfp::cosa-1 + unc-119(+)] II;mnT12 (X;IV) | AV826・ | AV695 |
| mIn1 [dpy-10(e128) mIs14 [墓 2::gfp pes-10::gfp]/ | AV810・ | DR2078 |
| bli-2(e768) unc-4(e120) II | ||
| ruIs32 [パイ-1::GFP::H2B + unc-119(+)] III | AV822・ | AZ212 |
| AV823・ | ||
| C. briggsae - mfIs42 [Cel-シド-2 + Cel-墓-2::DsRed] | AV824・ | JU1018 |
表 1: 生成された四倍体系統。* 子男性の割合に加え、減数分裂の部門の前に卵の出現 (相同の接続された組) と univalents (個々 の同族体) の数を得点で推定されます。
映画 1: 安定した経度系統が完全かどうかまたは部分的な四倍体を確認するスクリーニング。強調表示する、野生型両性具有の図から始まる映画は、染色体のペアをカウントすることによって四倍体を識別するために (未受精卵) をイメージしました。ダイアグラムで、z 映画と予測のシリーズ二倍体と四倍体の動物を固定と染色 DAPI の生殖腺を表示したり、Mcherry::H2B ヒストンを表現する系統のライブ画像。スクリーニングは、卵子に接続されている相同染色体のペアの数をカウントすることによって行われます。MCherry または DAPI のカウント染色体は交尾 (「-1 卵」) を格納する精子に最も近い未受精卵で行われます。この卵母細胞における染色体は凝縮なより正確な相同物のペアのカウントすること、互いに区切られました。ひずみあたり 10 以上の動物は、-1 卵母細胞の染色体数が正確なように上映されました。スタックの厚さは、0.2 μ mしてくださいここをクリックしてビデオを見ることです。(右クリックしてダウンロード)
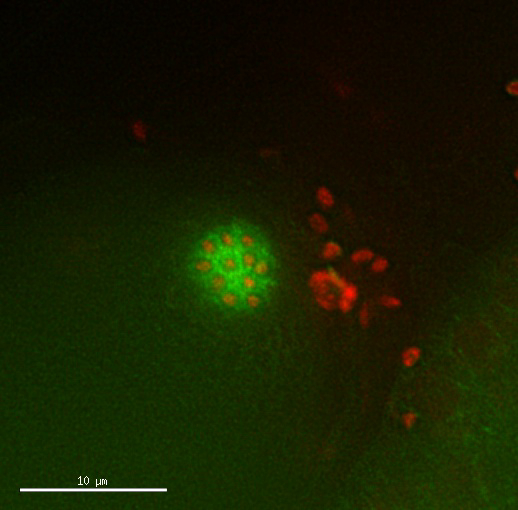
映画 2: 四倍体の卵母細胞の分裂が通常表示されます。Mcherry::H2B ヒストンやチューブリン GFP::β を表現する四倍体株の卵を割ることの時間の経過。部門のタイミングとパターンが通常表示されます。画像ごとの 2.5 分してくださいこのビデオを表示するにはここをクリックします。(右クリックしてダウンロード)
ディスカッション
半数体 (n) 配偶子の受精で二倍体 (2 n) の受精卵を生成するキーです。ゲノムのこの減少は、2 つ連続して細胞分裂と減数分裂の間単一ゲノム重複後に達成されます。半数体を生成する配偶子、線虫、他のほとんどのリザーバーと分離第一部門で母性と父性の由来同族体に対し妹各相同から染色分け体は 2 部で分離します。ゲノムの倍数性が自然に発生する方法 1 つはゲノムのサイズの半分に減数分裂に失敗した配偶子の生成です。
その倍が 50 年以上にわたって知られているC. elegans線虫が実行可能、肥沃な。ニゴン:23と後から Madl とハーマン22、生成され、減数分裂期染色体分離を中断することによって線虫四倍体の一握りを識別熱ショック療法を使用して、それぞれ遺伝子マーカーを使用します。追加シングルc. briggsae四倍体株は 30 年以上このプロトコルを使用して派生した後24。これらの四倍体は線虫を調べるになったり男性両性、倍数性成長とサイズを調節する方法とペアリングと減数分裂25,26,でシナプスを分析するかどうかを調査を利用しました。38,39,40。 まだこれらと他の研究は、特定の四倍体、三倍体系統を使用する必要がこのメソッドによって四倍体菌株を生成する難易度が限られていた。
ここで説明されているプロトコルは安定したフル 4 a, 4 X の生成を有効化や二倍体遺伝的背景の初期部分 4 a、3 X 4 倍体線虫線虫株いずれかから遺伝標識を使用せず核型
Tetraploidy線虫のメカニズムの 1 つ以上発生します。
Madl とハーマンは、彼らは可能性があります生成された四倍体系統が三倍体中間状態から派生したことを示唆しました。彼らの緊張は、複数世代にわたって、推定三倍体、二倍体雄22の中間を交差選択により得られました。染色体が二倍体の卵細胞と精子を生じrec 8変異体の分割の欠陥は、 rec 8 RNAi 方式27四倍体の動物を生じる別の可能な機構を提案します。
二倍体の卵母細胞、精母細胞、受精時に四倍体の動物に上昇を与える、 rec 8 RNAi 扱われる両性具有は作り出すことができます。この可能性と一貫性のあることクローンとして作られた F2 の両性具有のいくつかに上昇した安定した経度系統示唆している次世代のクローンの経度 F2 両性具有という事実は、ここで既に四倍体。交差方式でrec 8 RNAi 扱われる両性具有の第一世代は未処理の男性と交差します。二倍体精母細胞まだ男性十字架はrec 8 dsRNA を表現する細菌の存在下で行われ、したがって、男性、少なくとも 3 日間交尾中にrec 8 RNAi にさらされているので起こることができます。したがって、cross-fertilizing 方式で経度倍数体にも二倍体の卵母細胞の受精から形成二倍体精子があること。安定した四倍体系統は、二倍体の配偶子の間どちら施肥や半数体精子を生産 2 倍体の動物と変数の倍数性の卵母細胞を含む三倍体の動物の交差から生じることがあります。
重要な考慮事項:
自己・受精と:
Rec 8 RNAi を自殖性の方式は、F1 の両性具有を扱われ、未処理男性両方で扱われる両性具有の交差を含むスキームは、4 a、4 X に上昇を与えた、4 a、3 X 4 倍体系統。多くの倍数体が自家受精のスキームから最初に分離されたものの、これらの倍数性動物の多くが滅菌された、両方の方式ある同様に効率的に生産四倍体の安定株。高められた成功と自己肥やすスキームにおける不稔発生の理由は不明のまま。両方の方式が同様に効率的、自家受精方式交配のため男性の分離を必要としない簡単です。さらに、関心のひずみが非能率的なかで嵌合不良、自家受精方式が望ましかった。Cross-fertilizing スキームは、単一の染色体の 2 つ以上のバージョンを含む複雑な四倍体を生成に使用する可能性があります。
変更と限界:
現在、このプロトコルには、 rec 8遺伝子の dsRNA を表現する細菌を供給することによりrec 8 RNAi 治療が含まれます。したがって、このプロトコルでは働きません線虫種 RNAi に応答しない給電、または変異体組織41,42,43の RNAi の環境または全身性のスプレッド。生殖に直接関心の dsRNA の直接注入による RNAi 治療を導入することによりこの問題を解決可能性があります可能性があります。
三倍体の動物は、この方式は、安定した三倍体系統44,45を生成しませんので、派生した二倍体動物に四倍体を交配することによって生成されなければなりません。卵の 15% だけは、三倍体ハッチによって気もち、彼らの子孫は異数性による滅菌子孫主です。さらに、ほとんどの存続の肥沃な子孫は数世代以内完了前後の切片をする傾向がありません。これはおそらく、少なくとも部分的には、卵母細胞が第一減数分裂で極体に 3 番目の染色体を分離してトリソミーを部分的に修正されているので。
このプロトコルの克服できない制限は、RNAi 治療46にくいので RNAi 機械のコンポーネントに影響を与える突然変異体の四倍体を作るため働かないことです。
トラブルシューティング。
rec 8 RNAi:
いくつかの考慮事項が成功するためにこのプロトコルの重要です。最初は、 rec 8 dsRNA rec 8 (W02A2.6) クローンを行う細菌 HT115 細菌産生の誘導に新鮮な IPTG とたて IPTG NMG プレートを使用することです。IPTG は光に敏感とプレートに光の露出を減らすことが重要です。IPTG プレートは、暗闇の中で 4 ° C で 1 ヶ月分保存できます。第二に、Ahringer ライブラリ (Kamath および Ahringer 2003) からのrec 8 (W02A2.6) の RNAi 細菌 HT115 の緊張は他の利用可能なrec 8よりも強いrec 8表現型の HT115 クローンをもたらした。
四倍体のひずみのメンテナンス:
四倍体系統は非常にゆっくりと成長し、世代47あたりせいぜい 50 後代を生成します。すべての識別された四倍体系統が比較的安定しているが、打破でき、二倍体のとき強調 (ジョナサン ・ ホジキン個人的なコミュニケーションと未発表察) になります。したがって、餓死、25 ° c で熱ショックによる四倍体系統が栽培されてまたは冷凍、吉濱彼ら急速に戻すことがクラシファイヤシステム、これらの系統を解凍するときにイオン動物を選ぶを継続する上で重要なまたはときに注意することが重要です。これら系統に戻すそれらを引き起こす可能性がありますストレスの多い状況を公開します。
可能なアプリケーション:
効果の調査または多細胞生物における遺伝子発現、細胞周期進化ゲノム polyploidization の役割の比較に依存している: 同じセル異なる倍数を含む有機体のセル種類に密接に関連して異なる倍数性種や進化的近況 polyploidization および物理的な分離3,5,6,7,8 を受けた種 ,11,18,19,20,48,49,50。四倍体は、ゼブラフィッシュおよびマウスのモデル システムから派生することができます、彼らの子孫は滅菌または致命的な強肩16,17。また、これらのモデル システムc. の elegansに比べて長いライフ サイクル、倍数体の動物を生成する使用可能なメソッドは、複雑で非効率的な.したがって、このメソッドによって派生した線虫の系統は効果と全ゲノム多細胞生物における倍数性のロールに任意の調査を促進するため尽力されます。
三倍体は、元の二倍に、四倍体を交配することによって四倍体から派生することができます、ので二倍体、三倍体、四倍体ゲノムのコピーの数の表記だけが異なると比較がユニークで前例のない機会を提供します異なるゲノムのサイズ (または遺伝子投与) の等価動物、器官、細胞を評価します。柔軟性とここで説明した方式の容易さ二倍体の異なる遺伝的背景や染色体から四倍体株の多数を生成することができました。これらの系統の一部は既に減数分裂27の間に相同染色体対とシナプスのクエリ メカニズムに使用されました。
蛍光マーカーを運ぶ野生型と変異体の四倍体系統はスケーリング、全ゲノム細胞内/携帯/オルガンと全体の動物のゲノムのサイズと核/細胞質比の間の関係を理解するための調査の新しい道を提供します。適応、種分化、遺伝子量と表現、および組織と器官の開発に polyploidization。生物学的スケーリングに関する研究、ほか四倍体系統の世代が大幅さらに細胞外シグナル、ゲノム不安定性、表現、全ゲノムに関連する基本的な生物学的質問のクエリ重複、遺伝子量、ストレス、医薬品、および種分化の機構への抵抗の開発に適応。
開示事項
著者が明らかに何もありません。
謝辞
私たちは緊張のため (国立衛生研究所 (NIH) 事務所の研究基盤プログラム P40 OD010440 出資) 線虫の遺伝学センターを感謝します。著者は、建設的なフィードバック、ccny、撮影の部分と彼らの支援のための彼らの実験室の使用のためニューヨーク市立大学真野研究室をご提供するバティスト Roelens と Eli Lessman を感謝したいです。この作品は、PSC CUNY 賞 TRADB-46-113 支えられて、NIH 付与 1SC2GM118275-01。社は、NIH/日の出の上昇によって支えられ、修士は健康 (機構) サキヤマ, のカナダの研究所によって部分的に支持された GM062981 を付与します。
資料
| Name | Company | Catalog Number | Comments |
| Dissecting Microscope | Motic Microscopy | SMZ171 | |
| Name | Company | Catalog Number | Comments |
| NGM agar plates | |||
| 60 mm x 15 mm Petri Dishes, Sterile | Tritech Research | T3305 | |
| 35 mm x 15 mm Petri Dishes, Sterile | Tritech Research | T3500 | |
| Bacteriological Agar, 5 kg | VWR | 89140-850 | |
| Sodium Chloride, Biotechnology Grade | VWR | 97061-278 | |
| Peptone, BD Bacto | VWR | 90000-368 | |
| Ampicillin Trihydrate | VWR | 97062-300 | |
| IPTG, dioxane-free | Thermo Scientific | R0391 | |
| Name | Company | Catalog Number | Comments |
| Growth Culture | |||
| LB Lennox Broth | IBI Scientific | 89126-176 | |
| Name | Company | Catalog Number | Comments |
| LB Agar plates | |||
| LB Agar Lennox | IBI Scientific | 89126-182 | |
| Name | Company | Catalog Number | Comments |
| Antibiotics | |||
| Ampicillin Trihydrate | VWR | 97062-300 | |
| Tetracycline Hydrochloride | Fisher Scientific | BP912-100 | |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Hoechst 33258, Pentahydrate | Biotium | 40045 | |
| DAPI | Biotium | 40011 | |
| Name | Company | Catalog Number | Comments |
| Ethanol Fixation | |||
| Ethanol, Pure, 190 Proof (95%), USP | Koptec, VWR | 89125-166 | |
| Name | Company | Catalog Number | Comments |
| M9 Buffer | |||
| Sodium chloride, Biotechnology Grade | VWR | 97061-278 | |
| Potassium phosphate, Monobasic Anhydrous Grade | VWR | 97062-346 | |
| Sodium phosphate, monobasic dihydrate | Fisher Scientific | AC271750025 | |
| Name | Company | Catalog Number | Comments |
| RNAi Clones | |||
| HT115 bacteria expressing rec-8 dsRNA | Source Bioscience | W02A2.6 | |
| HT115 bacteria expressing rec-8 dsRNA | Dharmacon | RCE1182-202299820 |
参考文献
- Ricke, R. M., van Ree, J. H., van Deursen, J. M. Whole chromosome instability and cancer: a complex relationship. Trends Genet. 24, 457-466 (2008).
- Frawley, L. E., Orr-Weaver, T. L. Polyploidy. Curr Biol. 25, R353-R358 (2015).
- Orr-Weaver, T. L. When bigger is better: the role of polyploidy in organogenesis. Trends Genet. 31, 307-315 (2015).
- Otto, S. P. The evolutionary consequences of polyploidy. Cell. 131, 452-462 (2007).
- Davoli, T., de Lange, T. The Causes and Consequences of Polyploidy in Normal Development and Cancer. Annu Rev Cell Dev Biol. 27, 585-610 (2011).
- Adams, K., Wendel, J. Novel patterns of gene expression in polyploid plants. Trends Genet. 21, 539-543 (2005).
- Adams, K. L., Wendel, J. F. Polyploidy and genome evolution in plants. Curr Opin Plant Biol. 8, 135-141 (2005).
- Berman, J. Ploidy plasticity: a rapid and reversible strategy for adaptation to stress. FEMS Yeast Res. 16, (2016).
- Levy, D. L., Heald, R. Mechanisms of Intracellular Scaling. Annu Rev Cell Dev Biol. 28, 113-135 (2012).
- Breneman, A., Cande, J., Dunn, J., Burbank, K., O'toole, E. Genome-wide genetic analysis of polyploidy in yeast. Nature. 443, 541-547 (2006).
- Kuznetsova, A. Y., et al. Chromosomal instability, tolerance of mitotic errors and multidrug resistance are promoted by tetraploidization in human cells. Cell Cycle. 14, 2810-2820 (2015).
- Taylor, J. S., Van de Peer, Y., Meyer, A. Genome duplication, divergent resolution and speciation. Trends Genet. 17, 299-301 (2001).
- Younis, A., Hwang, Y. -. J., Lim, K. -. B. Exploitation of induced 2n-gametes for plant breeding. Plant Cell Rep. 33, 215-223 (2014).
- Ihssen, P. E., McKay, L. R., McMillan, I., Phillips, R. B. Ploidy Manipulation and Gynogenesis in Fishes: Cytogenetic and Fisheries Applications. Trans Am Fish Soc. 119, 698-717 (2011).
- Stanley, J. G., Allen, S. K., Hidu, H. Polyploidy induced in the American oyster, Crassostrea virginica, with cytochalasin B. Aquaculture. 23, 1-10 (1981).
- Eakin, G. S., Behringer, R. R. Tetraploid development in the mouse. Dev Dyn. 228, 751-766 (2003).
- Heier, J., Takle, K. A., Hasley, A. O., Pelegri, F. Ploidy manipulation and induction of alternate cleavage patterns through inhibition of centrosome duplication in the early zebrafish embryo. Dev Dyn. 244, 1300-1312 (2015).
- Arnold, B., Kim, S. -. T., Bomblies, K. Single Geographic Origin of a Widespread Autotetraploid Arabidopsis arenosa Lineage Followed by Interploidy Admixture. Mol Biol Evol. 32, 1382-1395 (2015).
- Session, A. M., et al. Genome evolution in the allotetraploid frog Xenopus laevis. Nature. 538, 336-343 (2016).
- Gallardo, M. H., Bickham, J. W., Honeycutt, R. L., Ojeda, R. A., Köhler, N. Discovery of tetraploidy in a mammal. Nature. 401, 341 (1999).
- Hodgkin, J. Primary sex determination in the nematode C. elegans. Development. 101, 5-16 (1987).
- Madl, J. E., Herman, R. K. Polyploids and sex determination in Caenorhabditis elegans. Genetics. 93, 393-402 (1979).
- Nigon, V. Polyploidie experimentale chez un nematode libre, Rhabditis elegans maupas. Bull Biol Fr Belg. 95, 187-225 (1951).
- Woodruff, G. C., Eke, O., Baird, S. E., Félix, M. -. A., Haag, E. S. Insights Into Species Divergence and the Evolution of Hermaphroditism From Fertile Interspecies Hybrids of Caenorhabditis Nematodes. Genetics. 186, 997-1012 (2010).
- Mlynarczyk-Evans, S., Roelens, B., Villeneuve, A. M. Evidence That Masking of Synapsis Imperfections Counterbalances Quality Control to Promote Efficient Meiosis. PLoS Genet. 9, e1003963 (2013).
- Lozano, E., Sáez, A. G., Flemming, A. J., Cunha, A., Leroi, A. M. Regulation of Growth by Ploidy in Caenorhabditis elegans. Curr Biol. 16, 493-498 (2006).
- Roelens, B., Schvarzstein, M., Villeneuve, A. M. Manipulation of Karyotype in Caenorhabditis elegans Reveals Multiple Inputs Driving Pairwise Chromosome Synapsis During Meiosis. Genetics. 201, 1363-1379 (2015).
- Martinez-Perez, E., et al. Crossovers trigger a remodeling of meiotic chromosome axis composition that is linked to two-step loss of sister chromatid cohesion. Genes Dev. 22, 2886-2901 (2008).
- Severson, A. F., Ling, L., van Zuylen, V., Meyer, B. J. The axial element protein HTP-3 promotes cohesin loading and meiotic axis assembly in C. elegans to implement the meiotic program of chromosome segregation. Genes Dev. 23, 1763-1778 (2009).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30, 313-321 (2003).
- Wood, W. B. . The Nematode Caenorhabditis Elegans. , (1988).
- MacQueen, A. J., et al. Chromosome Sites Play Dual Roles to Establish Homologous Synapsis during Meiosis in C. elegans. Cell. 123, 1037-1050 (2005).
- Martinez-Perez, E., et al. Crossovers trigger a remodeling of meiotic chromosome axis composition that is linked to two-step loss of sister chromatid cohesion. Genes Dev. 22, 2886-2901 (2008).
- Schvarzstein, M., Wignall, S. M., Villeneuve, A. M. Coordinating cohesion, co-orientation, and congression during meiosis: lessons from holocentric chromosomes. Genes Dev. 24, 219-228 (2010).
- Kim, S., Spike, C., Greenstein, D. . Germ Cell Development in C. elegans. , 277-320 (2013).
- Peters, N., et al. Control of mitotic and meiotic centriole duplication by the Plk4-related kinase ZYG-1. J Cell Sci. 123, 795-805 (2010).
- Pasierbek, P. A Caenorhabditis elegans cohesion protein with functions in meiotic chromosome pairing and disjunction. Genes Dev. 15, 1349-1360 (2001).
- Hodgkin, J. Primary sex determination in the nematode C. elegans. Development. 101, 5-16 (1987).
- Flemming, A. J., Shen, Z. -. Z., Cunha, A., Emmons, S. W., Leroi, A. M. Somatic polyploidization and cellular proliferation drive body size evolution in nematodes. Proc Natl Acad Sci U S A. 97, 5285-5290 (2000).
- Meneely, P. M. Sex determination in polyploids of Caenorhabditis elegans. Genetics. 137, 467-481 (1994).
- Whangbo, J. S., Hunter, C. P. Environmental RNA interference. Trends Genet. 24, 297-305 (2008).
- Imae, R., Dejima, K., Kage-Nakadai, E., Arai, H., Mitani, S. Endomembrane-associated RSD-3 is important for RNAi induced by extracellular silencing RNA in both somatic and germ cells of Caenorhabditis elegans. Sci Rep. 6, 28198 (2016).
- Tijsterman, M., May, R. C., Simmer, F., Okihara, K. L., Plasterk, R. H. A. Genes required for systemic RNA interference in Caenorhabditis elegans. Curr Biol. 14, 111-116 (2004).
- Cortes, D. B., McNally, K. L., Mains, P. E., McNally, F. J. The asymmetry of female meiosis reduces the frequency of inheritance of unpaired chromosomes. Elife. 4, e06056 (2015).
- Vargas, E., et al. Autosomal Trisomy and Triploidy Are Corrected During Female Meiosis in Caenorhabditis elegans. Genetics. 207, 911-922 (2017).
- Tabara, H., et al. The rde-1 gene, RNA interference, and transposon silencing in C. elegans. Cell. 99, 123-132 (1999).
- Hodgkin, J. . Karyotype, ploidy, and gene dosage. , (2005).
- Schoenfelder, K. P., Fox, D. T. The expanding implications of polyploidy. J Cell Biol. 209, 485-491 (2015).
- Levy, D. L., Heald, R. Biological Scaling Problems and Solutions in Amphibians. Cold Spring Harb Perspect Biol. 8, a019166 (2015).
- Taylor, J. S., Van de Peer, Y., Braasch, I., Meyer, A. Comparative genomics provides evidence for an ancient genome duplication event in fish. Philos Trans Royal Soc B. 356, 1661-1679 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved