Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Sondeo de la célula mecánica con pinzas ópticas libres de grano en el embrión de Drosophila
* Estos autores han contribuido por igual
En este artículo
Resumen
Presentamos una instalación de pinza óptica acoplada a un microscopio de la ficha técnica de iluminación y su aplicación a la punta de prueba mecánica de la célula sin cuentas en el embrión de Drosophila .
Resumen
Morfogénesis requiere coordinación entre patrones genéticos y las fuerzas mecánicas a robusta forma de las células y los tejidos. Por lo tanto, es un reto entender procesos morfogenéticos directamente medir fuerzas celulares y propiedades mecánicas en vivo durante la embriogénesis. Aquí, presentamos un programa de instalación de pinza óptica acoplada a un microscopio de la ficha técnica de iluminación, que permite para aplicar directamente las fuerzas en los contactos de la célula del embrión temprano de Drosophila , mientras que la proyección de imagen a una velocidad de varios fotogramas por segundo. Esta técnica tiene la ventaja que no requiere la inyección de granos en el embrión, generalmente utilizado como sondas intermedias en el cual se ejercen las fuerzas ópticas. Detalle paso a paso la aplicación de la configuración y proponer herramientas para extraer información mecánica de los experimentos. Mediante el control de los desplazamientos de los contactos de la célula en tiempo real, uno puede realizar mediciones de tensión e investigar la reología de los contactos de la célula.
Introducción
Desarrollo embrionario es un proceso altamente reproducible durante el cual las células y los tejidos se deforman para dar forma a los futuros animales. Tales deformaciones han demostrado requerir la generación activa de las fuerzas de la célula nivel1,2. Para entender procesos morfogenéticos durante el cual las células y los tejidos cambian su forma, por lo tanto es clave para evaluar las propiedades mecánicas de las células involucradas y para medir las fuerzas dentro del tejido durante el proceso3,4 . Capas epiteliales, especialmente en Drosophila, se han estudiado ampliamente debido a su geometría de quasi-2D y a su fácil manipulación.
Así, un número de técnicas ha sido desarrollado por nosotros y otros para evaluar mecánica epitelial en vivo durante el desarrollo. Daremos un repaso rápido de las tres principales técnicas utilizadas en los tejidos epiteliales. Ablación con láser, un método ampliamente utilizado, permite revelar la tensión mecánica local en célula ensambladuras5,6,7,8 o en mayor escala9,10,11 mediante la realización de cortes locales que alteran la integridad mecánica del objetivo. La dinámica de la apertura tras el corte proporciona información sobre la ablación previa de estrés tanto en la reología del tejido12,13. Un inconveniente de la ablación láser es que es invasiva, ya que requiere la interrupción local de la corteza de la célula. Por lo tanto, sólo uno puede realizar un número limitado de ablaciones, si quiere preservar la integridad del tejido. Otro inconveniente es que ablaciones sólo proporcionan estimaciones relativas de la tensión en los contactos del celular, ya que la velocidad de apertura depende de la fricción viscosa, que generalmente no se conoce. Manipulación magnética también ha desarrollado y utilizado en Drosophila, que implican el uso de ferrofluidos14 o liposomas ultramagnetic15. Puede proporcionar medidas absolutas16,17, pero también son invasoras en el sentido que requieren la inyección de las puntas de prueba en el lugar deseado. Esto puede ser muy complicado dependiendo del sistema, que no siempre es sensible a las inyecciones precisas. Una tercera técnica, completamente no-invasivo, es fuerza de inferencia18,19,20. Fuerza de inferencia se basa en la suposición de equilibrio mecánico en puntos triples (tricellular nudos o vértices) y permite para deducir las tensiones en todo célula contactos (y posiblemente, las presiones en todas las células) por resolver un problema inverso. Para las tensiones, cada vértice proporciona dos ecuaciones (X e Y). Esto produce un gran sistema de ecuaciones lineales que puede ser invertida bajo ciertas condiciones para evaluar la tensión en todos los contactos de la célula. Mientras que este método es muy atractivo, ya que sólo no requiere una imagen segmentada y experimento adicional o configuración, su exactitud está aún por determinar, y otra vez sólo proporciona valores relativos, a menos que una medida de calibración absoluta se realiza.
Para superar algunas de estas limitaciones, presentamos en este artículo la configuración de pinza óptica acoplada a un microscopio de la ficha técnica de iluminación a aplicar fuerzas controladas a escala celular en el epitelio embrionario de Drosophila melanogaster. Pinza óptica se han utilizado para numerosas aplicaciones biológicas incluyendo las mediciones de proteínas solo y la manipulación de células y organelos21. Aquí, Divulgamos a fuerzas aplicadas en la gama de algunos docena pN, que es pequeño pero suficiente para inducir deformaciones locales de contacto y realizar mediciones mecánicas en vivo. Por lo general, utilizamos desviación perpendicular de contacto, monitoreados a través del análisis de kymographs, relacionarse con fuerza a la deformación. Lo importante, nuestro programa de instalación no requiere la inyección de granos en el lugar deseado en el tejido, pinzas ópticas son capaces de ejercer directamente las fuerzas en los contactos célula-célula. El acoplamiento de las pinzas ópticas para un microscopio de luz hoja permite realizar rápida proyección de imagen (varios fotogramas por segundo), que es muy apreciable para un análisis mecánico en escalas de tiempo corto y con menor fototoxicidad, desde la iluminación de la muestra se limita al plano de proyección de imagen22.
Pinzas en generales, ópticas son una forma no invasiva para aplicar fuerzas controladas en contacto in vivo en el embrión de Drosophila y extraer información mecánica como rigidez y tensión en celular contactos23, propiedades reológicas 24y gradiente o anisotropía de tensión23.
Protocolo
1. establecer el microscopio de luz hoja
- Consulte la descripción de la configuración de publicación anterior25.
Nota: La configuración se compone de una etapa de microscopio vertical y un módulo de ficha técnica de iluminación produciendo una ficha técnica de iluminación en el plano horizontal. 10 X objetivo de excitación dirige la ficha técnica de iluminación en una cubeta de vidrio (figura 4). El objetivo de detección tiene una alta NA (1.1), que es necesario para tweezing eficiente (véase abajo).
2. establecer la ruta de pinzas ópticas
Nota: La figura 1 presenta un esquema general de la configuración óptica.
- Coloque la unidad de láser del nm de 1070 y fijar la fibra sobre la mesa óptica con montura V-clamp. Asegurar que el colimador de la fibra es paralela a la mesa óptica (por lo tanto, horizontal) y que la altura seleccionada aquí será la altura de todos los componentes ópticos alineadas sobre la mesa óptica.
Nota: 100 mm puede ser una buena opción para esta altura. - Gire la llave de la unidad de láser infrarrojo y presione el botón "Select" para encender el indicador de alineación. La luz tiene que ser horizontal saliente de la fibra.
- Colocar el obturador en la trayectoria óptica y fijarlo a la tabla óptica, para que el rayo láser pasa a través de la abertura de la persiana. Asegurar que la distancia entre la tabla óptica y el centro de la abertura de la persiana es la altura escogida en el paso 2.1.
- Gire la llave de la controlador de disparo, seleccione el modo manual con las flechas y pulse el botón "Activar" para abrir el obturador.
- Colocar, alinear y fijar el primer espejo del galvanómetro.
Nota: Los dos espejos del galvanómetro debe ser conjugado con la abertura posterior del objetivo de la detección, por lo que cuando uno de los espejos está girando, el rayo láser no se le fuera de la abertura posterior del objetivo. Nota que la distancia entre el primer galvanómetro y la posterior apertura del objetivo tiene que ser calculado para evaluar la posición de este galvanómetro en relación con el objetivo (f1 + f1 + f2 + f2 + f3 + f3 + f4 + f4 = 30 + 30 + 30 + 30 + 30 + 200 + 200 + 500 + 500 = 1550 mm; fi = longitud focal del objetivo n ° i). - Encienda el suministro de corriente del galvanómetro. Asegúrese que los galvanómetros son para el resto del Protocolo de alineación.
- Establecer los galvanómetros a cero desviación (con NIMAX o pinzas ópticas software - vea el paso 3 para las conexiones del galvanómetro).
- Colocar, alinear y fijar el telescopio relé compuesto de dos lentes con una distancia focal de 30 mm.
- Colocar, alinear y fijar el segundo espejo de galvanómetro. Tenga en cuenta que la distancia entre los dos galvanómetros es 4f = 4 x 30 = 120 mm (f = longitud focal).
- Colocar y fijar el telescopio.
Nota: El telescopio está compuesto por dos lentes que amplían la viga a una anchura al menos igual al diámetro de la abertura posterior de la lente del objetivo. La lente con la distancia focal más pequeña debe venir primera. - Colocar, alinear y fijar el periscopio llevar hacia arriba el camino óptico más cerca a la entrada del riel de espejo dicroico.
- Fijar el espejo caliente en el riel, coloque el travesaño en el microscopio. Asegúrese de que el riel se asierra en el lado derecho para permitir la entrada del láser infrarrojo (figura 2).
- Compruebe que la luz del láser va fuera del microscopio, primero sin el objetivo y con el objetivo. Corregir la posición del láser antes del objetivo con el espejo de la parte inferior del periscopio. Corregir la posición del láser después del objetivo con el espejo superior del periscopio.
- Poner 1 μl de 500 granos fluorescentes de nm en la cubeta de vidrio y añadir 10 mL de agua destilada. Ponga la cubeta bajo el objetivo en el portacubetas y ajuste el enfoque del objetivo (posición de la Z) para que el objetivo toca la superficie del agua.
- Inicie el software casero de adquisición controla la AOTF, la cámara y el escenario piezoeléctrico. También puede utilizarse un software libre como microgerente. Activar el modo de adquisición vivo presionando el "Live" botón.
- Ajustar la potencia del láser de IR a 1 w.
-
Poner en las gafas (y no la retire antes del final del experimento) y encender el láser. Un grano debe quedar atrapado en el foco del láser.
- Si no tira es atrapado en el foco del láser, compruebe si el puntero de láser rojo (que es colineal con el láser IR) sale el objetivo. Si no, empezar de nuevo los pasos de la alineación, en particular el paso 2.13. O aumentar la potencia del láser IR.
- Si el grano es atrapado fuera de foco (del plano imagen), mueva la posición del objetivo último de la última a lo largo del eje óptico para traer el grano en foco con el plano de proyección de imagen del telescopio (L4 en la figura 1). Si no es suficiente, mover la primera lente de la última a lo largo del eje óptico del telescopio (L3 en la figura 1).
- Si grano atrapado no se centra en la imagen, utilice los espejos 2 periscopio para ajustar la posición de la trampa. Si la posición del talón se cambia cambiando el ángulo del primer espejo, compensar también la dirección del haz cambiando el ángulo correspondiente del segundo espejo. Corregir la posición de X solamente (1 tornillo para cada espejo), y luego corregir la posición Y (1 tornillo para cada espejo).
- Si es necesario, ajuste la posición de la lente del telescopio de 2nd para observar el grano en foco.
- Si es necesario, ajuste el ángulo de los espejos periscopio que el grano en la imagen.
3. interfaz del instrumento
Nota: La figura 3 da un esquema general de las conexiones de la tarjeta de National Instruments (NI).
- Inserte la tarjeta de salida (NI-9263) en la primera ranura del chasis (cDAQ-9178). Tenga en cuenta que se pueden utilizar otros modelos de tarjetas NI con 3 entradas analógicas y 2 salidas analógicas.
- Inserte la tarjeta de entrada (NI-9215) en la segunda ranura del chasis.
- Conectarse el primer galvanómetro de la analógica AO0 y la analógica AI0 entrada con cables BNC de salida. Tenga en cuenta que un adaptador T se puede utilizar para conectar 2 cables BNC a uno. Consulte el manual del galvanómetro para localizar los pines en la tarjeta de conductor del galvanómetro.
- De la misma manera, conectar el segundo galvanómetro OA1 y AI1.
- Conectar PFI1 al gatillo de la persiana (la parte trasera del controlador).
- Conectar PFI0 el fuego de la cámara y AI2.
- Conectarse AI3 el gatillo de la persiana (la parte trasera del controlador).
- Ajuste el control del obturador. Usa las flechas para cambiar los valores de parámetro y presione el botón "Select" para validar la elección y pasar al siguiente parámetro. Que el parámetro de "tiempo abierto sec" 000.000, "sec tiempo cerrada" a 000.000, "modo" sola y «desencadenante» en EXT. permitir el control de la persiana al presionar el botón "Habilitar".
- Abra QtCreator (descargada de https://www.qt.io/, versión gratuita).
Nota: QtCreator es el entorno de desarrollo integrado para desarrollar en C++ el software pinzas ópticas. Biblioteca QT se utiliza aquí para crear widgets. - Abra el archivo OT.pro (incluido en los archivos de código Qt). Esta acción abrirá el proyecto. Cambiar el nombre de la entrada y salida en el archivo de AOGenerator.cpp según las tarjetas NI utilizado.
- Compilar y ejecutar el software de OT.
4. calibración de la posición de la trampa óptica con los granos
-
Grabación de una película de calibración
- Poner 1 μl de perlas fluorescentes de 500 nm rojo en la cubeta de vidrio, luego llene la cubeta con 10 mL de agua destilada. Figura 4 da una vista de la cubeta en el contexto de observación.
- Fijar la cubeta en el escenario piezoeléctrico.
- Ajustar la posición de Z de la cubeta para que el objetivo de detección se sumerge en el agua.
- Active el láser infrarrojo y ajuste la potencia a 1 w.
- Abra el software de adquisición de imagen.
- Para adquirir imágenes de lapso de tiempo, seleccione el tiempo de exposición, la ganancia, el tiempo entre dos imágenes, el número de imágenes que se adquirirán y la potencia del láser. Tenga en cuenta que para la calibración de pinzas ópticas con los granos, la iluminación del laser (561 nm) no es necesario. El efecto de 2 fotones inducido por láser infrarrojo es suficiente para excitar la fluorescencia de un grano atrapado.
- Inicie el software casero de pinzas ópticas.
- Configure los parámetros de pinzas ópticas para trazar un círculo. Sistema SamplingRate como 250 samp/s, bufferSize como 1000, Waveform1 parámetros (galvo 1) Offset como Sinusoidal, nbPeriod 1, amplitud 0,5 V, fase rad 0.0, 0.0 V, parámetros de forma de onda 2 (galvo 2) Sinusoidal, nbPeriod 1, amplitud 0,5 V, fase 1,57 rad, Offset 0.0 V.
- Revise el cuadro "Parámetros de AI" y el "esperar"... caja.
- Iniciar la adquisición de imágenes (500 o 1000 imágenes con una velocidad de fotogramas alta, como 10 fps).
- Conectar las pinzas ópticas pulsando el botón de "Generación!".
- Permitir que el grano atrapado completar al menos dos círculos completos y dejar la pinza óptica por no presionar la "generación!" botón.
- Detener la adquisición de la imagen. Tenga en cuenta que una película de tiff y un archivo de texto con tensiones del galvanómetro se crean en el valor por defecto "C:/TEMP /" carpeta (salvo que se especifique una ubicación personalizada). Tenga en cuenta que varias películas de calibración con los archivos de datos asociados se pueden crear si es necesario.
- Si el círculo no está completo, el grano se pierde durante la trayectoria del círculo. Tal vez la velocidad es demasiado alta. Disminuir al disminuir la frecuencia de muestreo en el programa de OT. O, usando el puntero láser rojo del laser infrarrojo, compruebe si el láser está saliendo el objetivo durante la trayectoria del círculo entero. Si no, los espejos del galvanómetro no pueden ser conjugados con el plano focal detrás de la lente del objetivo. Corregir las posiciones de los galvanómetros en relación con el plano focal detrás del objetivo, a partir otra vez los pasos de la alineación de paso 2.5.
- Ponga las amplitudes a cero y encienda el láser para atrapar una gota en una posición de corrección. Colocar un punto de referencia en la ubicación de la trampa.
-
Interpolación de posición con análisis de imagen
- Abrir Matlab, vaya a la carpeta de calibración y ejecutar el script "position2tension" (disponible en los archivos de código Matlab). Esta secuencia de comandos calcula la función de interpolación traducir voltajes del galvanómetro a la posición de la trampa óptica.
- Elegir el número de películas de calibración. Pueden seleccionarse varias películas con trayectorias diferentes, como dos elipses perpendiculares. Generalmente, basta con una película de calibración único con una trayectoria circular.
- La imagen primera y la última los números en el cuadro de diálogo (cuadro de una diálogo por película), secuencias con una trayectoria clara y buena relación señal a ruido.
- Proporcione la ruta del archivo de texto que contiene las tensiones durante la adquisición de cada película. Tenga en cuenta que la secuencia de comandos lee el archivo y calcula las tensiones medias de los dos galvanómetros para cada imagen.
- Proporcione la ruta de la película de calibración correspondiente.
Nota: El script detecta el grano para cada fotograma con una resolución de subpíxeles encajando un Gaussian 2D para el grano, uso de funciones extraídas del MTT26y funciones personalizadas. Muestra un gráfico que muestra la trayectoria de grano. - Eliminar cualquier punto mal detectado (outliers) haciendo clic en él.
- Verifica si la interpolación se mapa de x posiciones de láser y calcula y muestra la secuencia de comandos, es completa. Si hay muchos valores faltantes (regiones blanco en el mapa), repetir la operación con una nueva película de calibración, con una mejor relación señal a ruido, o / y con una velocidad más lenta de los galvanómetros.
Nota: Estas imágenes y los valores de interpolación se guardan automáticamente en la misma carpeta que la imagen, con el nombre convertFct.mat.
5. montaje de Drosophila embriones27
- Recoger embriones de Drosophila en una jaula, que se incubó a 25 ° C.
- Quitar la levadura, pasa el contenido de la placa a través de un tamiz (tamaño de los poros debe ser cerca de 100 μm).
- Lavar los embriones con 100% blanqueador (hipoclorito de sodio 2,6%) para 45 s para quitar el corion.
- Lavar los embriones con agua durante 2 minutos.
- Coloque los embriones en una almohadilla de agar con un cepillo.
- Seleccionar 10 embriones según la etapa deseada y alinee los embriones con un Lucio o un pincel húmedo.
Nota: La alineación debe hacerse según la región de interés (región de interés tan cerca como sea posible con el objetivo de detección). - Con un marcador de diamante, corte un pedazo de un portaobjetos de vidrio de 10 x 20 x 1 mm3.
- Agregar el pegamento en un lado de la pieza cortada y déjelo secar por 20 s.
- Voltee la pieza cortada y colóquelo en la línea de embriones, para pegarlo en el borde de la diapositiva.
- Instale esta preparación en el sostenedor de la muestra y colóquela en la cubeta. Figura 4 da una vista de la cubeta en el contexto de observación.
- Colocar la cubeta en el escenario piezoeléctrico.
6. captura experimento In Vivo
-
Captura de los contactos de la célula — oscilaciones (figura 5)
- Encontrar el lugar de interés en el tejido.
Nota: Uso de moscas en las que se etiquetan caderinas puede ser útil si uno tiene que trabajar en el plano de las uniones. - Mover el punto medio de cruce de destino en la posición de la trampa (señal de paso 4.1.14) con la etapa de piezo.
- Configure los parámetros de la trampa para lograr las oscilaciones perpendiculares a la línea de contacto. Establecer las fases como cero. Establecer las amplitudes en X y Y direcciones para tener un movimiento perpendicular a la línea de contacto. La amplitud debe ser típicamente 0.1 V.
- Empezar la adquisición (con una tasa de marco rápido, como 10 fps).
- Conectar las pinzas ópticas pulsando el botón de "Generación!".
- Cuando termine, apague la adquisición de la imagen parada y pinzas. Una película y un archivo de texto que contiene voltajes del galvanómetro durante la adquisición deberían aparecer ahora en la carpeta especificada.
- Captura de los contactos del celular, liberación de extracción (figura 6)
- Encontrar el lugar de interés en el tejido.
- Pasar al cruce de blanco con la etapa de piezo para que su punto medio sea típicamente 1 μm a la posición de la trampa (señal de paso 4.1.14).
- Las amplitudes se establece en 0 para tener una trampa constante.
- Iniciar la adquisición de la imagen (con una tasa de marco rápido, como 10 fps).
- Conectar las pinzas ópticas pulsando el botón de "Generación!".
- Después de la hora deseada, apague la trampa y esperar para que la relajación que se producen.
- Detener la adquisición de la imagen. Una película y un archivo de texto que contiene voltajes del galvanómetro durante la adquisición deberían aparecer ahora en la carpeta especificada.
- Encontrar el lugar de interés en el tejido.
-
Generación de kymograph semi automática y detección de la posición de la interfaz.
- En la ventana de comandos de Matlab, carga el mapa de interpolación generado durante el procedimiento de calibración (4b): load('convertFct.mat'). Esto proporciona las variables de fx y fy.
- En la ventana de comandos de Matlab, ejecute autokymo(fx,fy), en los archivos de código Matlab. El propósito de esta función es generar un kymograph a lo largo de la trayectoria del laser y para detectar la posición de la línea de contacto con la resolución de subpíxeles de cada fotograma.
- Seleccione la ruta del archivo de texto incitado que contiene los valores de tensión.
- Seleccione los números del primer y último fotograma de la película a analizar.
- Seleccione el archivo tiff. Se mostrarán dos nuevas figuras: la primera es una imagen de la kymograph. La segunda es una gráfica de la detección de las posiciones línea y laser contacto, versus el número de la imagen.
Nota: La función guarda el gráfico que representa la posición de la muestra y la posición del láser versus el número de la imagen (figura de matlab, jpg), kymograph (imagen tiff) y el kymograph con la posición del láser (imagen tiff). Para los experimentos de trampa constante, la kymograph debe hacerse manualmente, por ejemplo con ImageJ. Entonces es posible la detección de la interfaz de la kymograph utilizando el mismo algoritmo.
7. mecánicas medidas
-
Medidas de rigidez y tensión
- Realizar un experimento de oscilación (paso 6.1) y el análisis correspondiente (paso 6.3) de la película de lapso de tiempo.
- Trazar la posición de interfaz
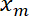 en función de la posición de la trampa
en función de la posición de la trampa 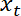 usando Matlab función de trama o datos software de trazado.
usando Matlab función de trama o datos software de trazado.
Nota: Esto debe ser aproximadamente lineal. - Realizar un linear fit, usando "ezfit" libre de MATLAB o cualquier software que permite ajustes. El inverso de la pendiente de la fit proporciona el ratio promedio
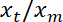 .
. - Realizar estimaciones de la rigidez de flexión aparente de la interfaz, que, suponiendo pequeñas deformaciones y una cuadrática potencial para la captura, se da por
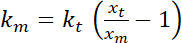 .
. 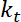 es la rigidez de la trampa (consulte el paso 8 para calibración rigidez de trampa).
es la rigidez de la trampa (consulte el paso 8 para calibración rigidez de trampa). - Realizar cálculos de tensión, que puede definirse como23:
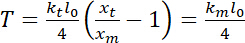 .
.
-
Mediciones reológicas
- Realizar experimentos de liberación de tirón (paso 6.2) y el análisis correspondiente (paso 6.3)
- Ajuste de la curva resultante con la custom modelo reológico.
8. calibración de la rigidez de la trampa
Nota: La determinación de las fuerzas absolutas requiere el conocimiento de la rigidez de la trampa en las interfaces. Esto puede tener acceso mediante cuentas a través de un procedimiento de dos pasos.
-
Determinación de la viscosidad del citosol
- Coloque los embriones en el aceite de halocarburos e inyecte a través de una configuración de microinyección con granos del poliestireno fluorescente (1:1, 000 dilución de stock, 0,46 μm de diámetro)23,27.
- Coloque los embriones inyectados bajo el microscopio.
- Seguir el movimiento de granos solo encuentra en el citosol. Extraiga el desplazamiento cuadrático medio de granos (utilizar un gran número de cuentas de > 100 trayectorias). Determinar la constante de difusión del grano desde la ladera del desplazamiento cuadrático medio. Relacionadas con la constante de difusión a la viscosidad de la ecuación de Stokes-Einstein, deducir la viscosidad efectiva del cytosol. En el embrión temprano, una viscosidad de aproximadamente 3.5 Pa.s es reportado23.
-
Determinación de la rigidez de la trampa en granos
- Reventar los granos solo en el citosol con pinzas ópticas.
- Mover el grano de manera gradual entre las dos posiciones de trampa separados por 0.5 μm
- Determinar la rigidez de la trampa en los granos, como el cociente entre el coeficiente de arrastre y el tiempo de relajación de grano desde la posición de una trampa para el otro.
Nota: El coeficiente de arrastre es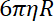 , donde
, donde 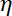 es la viscosidad determinada en (8.1) y
es la viscosidad determinada en (8.1) y 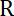 el radio de grano. El tiempo de relajación es obtenido ajustes exponenciales de la posición del grano, utilizando de Matlab o cualquier software que se adapta. Los valores típicos de la rigidez de la trampa son 120 ±50 pN.µm-1 excitación de laser de 200 mW.
el radio de grano. El tiempo de relajación es obtenido ajustes exponenciales de la posición del grano, utilizando de Matlab o cualquier software que se adapta. Los valores típicos de la rigidez de la trampa son 120 ±50 pN.µm-1 excitación de laser de 200 mW.
-
Determinación de la rigidez de la trampa de interfaz celular
- El láser se centran en una línea de contacto y desviar (como se describe en el paso 6). Medir la amplitud de la deformación. Esto debe repetirse en varias líneas de contacto para obtener un promedio representativo.
- Compara la deformación producida con el inducido por granos empujados contra líneas de contacto. Puesto que la deformación es inversamente proporcional a la rigidez de la trampa, deducir la rigidez de la trampa en contacto.
Nota: La rigidez de la trampa en contacto se encuentra normalmente 2 a 3 veces más pequeño que en granos (0,46 μm de diámetro).
Resultados
La figura 5 muestra los datos experimentales obtenidos mediante la imposición de un movimiento sinusoidal a la trampa. La trampa produce una desviación de la interfaz, como por las 3 instantáneas que muestran 3 interfaz sucesivas posiciones (figura 5A)23. Películas grabadas se utilizan para generar un kymograph (figura 5B) y además se analizan para determinar la posición...
Discusión
Pinzas ópticas permiten para realizar mediciones mecánicas absolutas directamente en el epitelio embrionario en desarrollo de una manera no invasiva. En ese sentido, presenta ventajas sobre otros métodos como la ablación del laser, que son invasivos y proporcionan mediciones relativas, fuerzas magnéticas, que requieren inyecciones, o fuerza de inferencia, que se basa en suposiciones fuertes y también proporcionan relativa mediciones.
El protocolo incluye algunos pasos críticos. En prime...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por un FRM Equipe beca FRM DEQ20130326509, Agence Nationale de la Recherche de ANR-Blanc de Grant, Morfor ANR-11-BSV5-0008 (al P.-F.L.). Reconocemos Francia-Bioimagen infraestructura apoyado por el francés Agencia Nacional de investigación (ANR-10-INBS-04-01, «Las inversiones para el futuro»). Agradecemos a Brice Detailleur y Claude Moretti de la infraestructura de PICSL-FBI para asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| Ytterbium Fiber Laser LP, 10 W, CW | IPG Laser | YLM-10-LP-SC | including collimator LP : beam D=1.6 mm and red guide laser |
| Ø1/2" Optical Beam Shutter | Thorlabs | SH05 | |
| Small Beam Diameter Galvanometer Systems | Thorlabs | GVS001 | 1 for X displacement, 1 for Y displacement |
| 1D or 2D Galvo System Linear Power Supply | Thorlabs | GPS011 | galvanometers power supply |
| 2 lenses f = 30mm | Thorlabs | LB1757-B | relay telescope between 2 galva |
| Lens f = 200mm | Thorlabs | LB1945-B | 2.5X telescope |
| Lens f = 500mm | Thorlabs | LB1869-B | 2.5X telescope |
| Right-Angle Kinematic Elliptical Mirror Mount with Tapped Cage Rod Holes | Thorlabs | KCB1E | Periscope |
| Laser Safety Glasses, Light Green Lenses, 59% Visible Light Transmission, Universal Style | Thorlabs | LG1 | |
| 45° AOI, 50.0mm Diameter, Hot Mirror | Edmund Optics | #64-470 | |
| Multiphoton-Emitter HC 750/S | AHF | HC 750/SP | |
| CompactDAQ Chassis | National Instruments | cDAQ-9178 | |
| C Series Voltage Output Module | National Instruments | NI-9263 | Analog output module |
| C Series Voltage Input Module | National Instruments | NI-9215 | Analog input module |
| FluoSpheres Carboxylate-Modified Microspheres, 0.5 µm, red fluorescent (580/605), 2% solids | ThermoFisher Scientific | F8812 | calibration beads |
| C++ (Qt) home made optical tweezers software | developed by Olivier Blanc and Claire Chardès. Alternative solution: labview |
Referencias
- Lecuit, T., Lenne, P. -. F., Munro, E. Force generation, transmission, and integration during cell and tissue morphogenesis. Annual review of cell and developmental biology. 27 (1), 157-184 (2011).
- Heisenberg, C. -. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Sugimura, K., Lenne, P. -. F., Graner, F. Measuring forces and stresses in situ in living tissues. Development. 143 (2), 186-196 (2016).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in cell & developmental biology. 55, 119-130 (2016).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. Journal of Cell Biology. 149 (2), 471-490 (2000).
- Farhadifar, R., Roper, J. C., Aigouy, B., Eaton, S., Julicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Rauzi, M., Verant, P., Lecuit, T., Lenne, P. F. Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nature Cell biology. 10 (12), 1401-1410 (2008).
- Ma, X., Lynch, H. E., Scully, P. C., Hutson, M. S. Probing embryonic tissue mechanics with laser hole drilling. Physical Biology. 6 (3), 036004 (2009).
- Hutson, M. S., Tokutake, Y., et al. Forces for morphogenesis investigated with laser microsurgery and quantitative modeling. Science. 300 (5616), 145-149 (2003).
- Bonnet, I., Marcq, P., Bosveld, F., Fetler, L., Bellaïche, Y., Graner, F. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface / the Royal Society. 9 (75), 2614-2623 (2012).
- Etournay, R., Popović, M., et al. Interplay of cell dynamics and epithelial tension during morphogenesis of the Drosophila pupal wing. eLife. 4, e07090 (2015).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current topics in developmental biology. 95, 93-144 (2011).
- Saha, A., Nishikawa, M., Behrndt, M., Heisenberg, C. -. P., Jülicher, F., Grill, S. W. Determining Physical Properties of the Cell Cortex. Biophysical journal. 110 (6), 1421-1429 (2016).
- Desprat, N., Supatto, W., Pouille, P. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental cell. 15 (3), 470-477 (2008).
- Mitrossilis, D., Röper, J. -. C., et al. Mechanotransductive cascade of Myo-II-dependent mesoderm and endoderm invaginations in embryo gastrulation. Nature Communications. 8, 13883 (2017).
- Campàs, O., Mammoto, T., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2013).
- Serwane, F., Mongera, A., et al. In vivo quantification of spatially varying mechanical properties in developing tissues. Nature Methods. 14 (2), 181-186 (2017).
- Chiou, K. K., Hufnagel, L., Shraiman, B. I. Mechanical stress inference for two dimensional cell arrays. PLoS computational biology. 8 (5), e1002512 (2012).
- Ishihara, S., Sugimura, K. Bayesian inference of force dynamics during morphogenesis. Journal of theoretical biology. 313, 201-211 (2012).
- Brodland, G. W., Veldhuis, J. H., Kim, S., Perrone, M., Mashburn, D., Hutson, M. S. CellFIT: a cellular force-inference toolkit using curvilinear cell boundaries. PLoS ONE. 9 (6), e99116 (2014).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23, 247-285 (1994).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. -. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences of the United States of America. , (2015).
- Clément, R., Dehapiot, B., Collinet, C., Lecuit, T., Lenne, P. -. F. Viscoelastic Dissipation Stabilizes Cell Shape Changes during Tissue Morphogenesis. Current biology: CB. 27 (20), (2017).
- Chardès, C., Ménélec, P., Bertrand, V., Lenne, P. -. F. Setting-up a simple light sheet microscope for in toto imaging of C. elegans development. Journal of visualized experiments. 87, e51342 (2014).
- Serge, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nature Methods. 5 (8), 687-694 (2008).
- Cavey, M., Lecuit, T. Imaging Cellular and Molecular Dynamics in Live Embryos Using Fluorescent Proteins. Drosophila. 420, 219-238 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados