JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
초파리 배아에 구슬 없는 광학 핀셋으로 셀 역학 조사
요약
선물이 빛 시트 현미경을 초파리 태아에 구슬 없이 셀 역학을 구현 결합 광학 족집게의 설치.
초록
Morphogenesis 유전 패턴화와 견고 하 게 모양 세포와 조직에 기계적인 힘 사이 협력을 요구 한다. 따라서, 전체적 프로세스를 이해 하는 도전 직접 embryogenesis 동안 세포 세력과 vivo에서 기계적 성질을 측정 하는. 여기, 우리 초기 초파리 배아의 세포-세포 연락처에 군대를 직접 적용할 수 있는 가벼운 시트 현미경을 결합 하는 광학 족집게의 설정을 현재 초당 몇 프레임의 속도로 이미징 동안. 이 기술은 광학 힘 발휘는 중간 조사로 일반적으로 사용 되는 배아에 구슬의 주입을 요구 하지 않는 이점이 있다. 우리는 단계적으로 설치, 구현에 자세히 설명 하 고 실험에서 기계적인 정보를 추출 하는 도구를 제안. 실시간으로 셀 연락처의 변위를 모니터링 함으로써 한 긴장 측정을 수행 하 고 셀 연락처 유동성 조사 수 있습니다.
서문
배아 개발 기간 동안 세포와 조직 미래 동물 모양 변형 매우 재현 과정 이다. 같은 개 악 셀 수준1,2에서 세력의 적극적인 세대를 요구 하도록 표시 되었습니다. 세포와 조직 그들의 모양을 변경 하는 전체적 프로세스 이해, 그것은 따라서 키 참여, 세포의 기계적 특성을 평가 하 고 과정3,4 동안 조직 내의 힘을 측정 하 . 특히 초파리, 상피 레이어 인해 그들의 유사 2D 형상 및 그들의 쉬운 조작에 널리 공부 되었습니다.
다양 한 기술 따라서 우리가 다른 사람에 의해 개발 중 상피 역학에 vivo에서 평가 하기 위해 개발 되었습니다. 우리는 상피 조직에서 사용 하는 세 가지 주요 기술에 대 한 빠른 개요를 줄 것 이다. 레이저 제거, 널리 사용 되는 방법은 로컬 기계적 스트레스 세포 접속점5,6,,78 또는 더 큰 규모9,10,11 허용 로컬 인하 대상의 기계적 무결성 중단을 수행 하 여. 오프닝 컷 다음의 역학 관계와 조직12,13의 유동성 스트레스 이전 절제에 정보를 제공 합니다. 레이저 절제의 단점은 그것이 침략, 셀 피 로컬 중단을 필요로입니다. 하나 조직의 무결성을 유지 하 고 싶은 경우에 따라서, 하나만 제한 된 수의 제거를 수행할 수 있습니다. 또 다른 단점은 오프닝 속도 점성 마찰, 일반적으로 알려져 있지에 따라 달라 집니다 이후 제거 셀 연락처에서 긴장의 상대 견적 제공. 마그네틱 조작 개발 고 초파리, ferrofluids14 의 사용 또는 ultramagnetic 리15포함 사용 또한 있다. 그들은 절대 측정16,17을 제공할 수 있습니다 하지만 그들은 원하는 위치에 프로브의 주입 필요로 하는 의미에서 침략 적 있습니다. 이것은 항상 정확한 주사 의무가 시스템에 따라 매우 어려울 수 있습니다. 세 번째 기술은, 완전히 비-침략 적, 힘 유추18,,1920이다. 힘 유추 트리플 포인트 (tricellular 접합, 또는 정점)에서 기계적 평형의 가정에 그리고 셀 연락처 (그리고, 모든 셀에 압력)에 의해 역 문제 해결 전혀 긴장을 유추할 수 있습니다. 긴장, 각 꼭지점 두 식을 (X 및 Y)를 제공합니다. 이 셀의 모든 접촉에서 긴장을 평가 하기 위해 몇 가지 조건 하에서 반전 될 수 있는 선형 방정식의 큰 시스템을 생성 합니다. 세그먼트 이미지를 아무런 추가 실험 또는 설치만 요구 하는 때이 방법은 매우 매력적인, 동안 그것의 정확도 아직 결정, 그리고 다시만 제공 상대 값, 절대 교정 측정 수행 하지 않는 한.
이러한 한계 들을 극복 하기 위해 우리 소개이 문서에서는 광학 족집게의 설치 제어 세력 초파리 melanogaster의 배아 상피에 셀 규모에 적용할 빛 시트 현미경에 결합. 광학 핀셋 단일 단백질 및 세포와 세포21의 조작에 측정을 포함 하 여 수많은 생물 학적 응용에 대 한 사용 되었습니다. 여기, 우리가 작은 몇 다스 pN의 범위에서 적용 된 힘을 보고 아직 셀 연락처의 로컬 변형 유발 하 고 vivo에서기계 측정을 수행 하기에 충분. 일반적으로, 셀 연락처, kymographs의 분석을 통해 모니터링의 수직 편향 사용 하 여 변형 힘 관계. 중요 한 것은, 우리의 설치 광학 핀셋 직접 셀 연락처에 힘을 발휘할 수 있는 조직에서 원하는 위치에 구슬의 주입을 요구 하지 않는다. 빛 시트 현미경 광학 족집게의 결합 수의 조명부터 매우 감소 된 phototoxicity와 짧은 시간 스케일에서 기계적인 분석에 대 한 감지할 수 있는 빠른 영상 (초당 몇 프레임)을 수행 하는 샘플 영상22의 비행기로 제한 됩니다.
전반적으로, 광학 족집게는 셀 연락처 초파리 태아에서 vivo에서에서 제어 힘을 적용 하 고 경직과 긴장 셀 연락처23, 유 변 학적 특성 기계 정보를 추출 하는 비-침략 적 방법 24, 그리고 그라데이션 또는 긴장23의 이방성.
프로토콜
1. 설정-최대 빛 시트 현미경
- 이전 발행물25에서 설정의 설명을 참조 하십시오.
참고: 설치는 똑바로 현미경 단계 및 수평 평면에 밝은 시트 생산 가벼운 시트 모듈의 구성 됩니다. 여기 렌즈 X 10 유리 베트 (그림 4)에 빛 시트를 지시합니다. 탐지 목표 렌즈는 높은 NA (1.1), 필요한 효율적인 tweezing (아래 참조)에 대 한 있습니다.
2. 설정-최대 광학 핀셋 경로
참고: 그림 1 광학 설치의 일반적인 구성표를 제공합니다.
- 1070 nm 레이저 단위 놓고 V-클램프 마운트 섬유 광학 테이블에 수정 합니다. 섬유 겨냥 틀은 광학 테이블에 병렬을 확인 (따라서, 수평) 여기에서 선택 하는 높이 모든 광학 부품에 대 한 높이 있을 것입니다 광학 테이블에 정렬.
참고: 100 m m이이 높이 대 한 좋은 선택이 될 수 있습니다. - 적외선 레이저 단위의 키 맞춤 포인터 설정 하려면 "선택" 단추를 누르고. 빛은 섬유의 가로 보내는 수 있다.
- 광학 경로에서 셔터를 놓고 적외선 레이저 빔 셔터의 조리개를 통해 전달 되도록 광학 테이블에 수정 합니다. 광학 테이블 사이의 거리를 확인 하 고 셔터의 조리개의 중심은 높이 2.1 단계에서 선택한.
- 셔터 컨트롤러의 키, 화살표 사용 하 여 수동 모드를 선택 하 고 셔터를 열을 "사용" 버튼을 누릅니다.
- 배치, 정렬 및 첫 번째 검 류 계 미러를 수정.
참고: 두 검 류 계 거울 해야 검색 목표의 다시 조리개를 활용 되도록 미러 중 하나는 회전 때 레이저 빔을 목표의 다시 조리개에서 가지 않습니다. 첫 번째 검 류 계는 목표의 뒤 조리개 사이의 거리 평가 목표에 관하여이 검 류이 계의 위치를 계산 하는 (f1 + f1 + f2 + f2 + f3 + f3 + f4 + f4 = 30 + 30 + 30 + 30 + 30 + 200 + 200 + 500 + 500 = 1550 mm, fi = 초점 거리 렌즈 n °의 난). - 검 류 계 전원 공급 장치를 켭니다. 비치 제공 맞춤 프로토콜의 나머지 부분에 대 한 확인 하십시오.
- 제로 편향에는 비치를 설정 (NIMAX 또는 광학 족집게 소프트웨어-검 류 계 연결에 대 한 3 단계 참조).
- 배치, 정렬 및 릴레이 망원경 초점 거리 30 m m의 두 렌즈의 구성된 수정.
- 배치, 정렬 및 두 번째 검 류 계 미러를 수정. 두 개의 비치 사이의 거리는 4 층 = 4 x 30 m m = 120 mm (f = 초점 거리).
- 놓고 망원경을 수정 합니다.
참고: 망원경 대물 렌즈의 후면 조리개의 직경에 적어도 크거나 너비에 광선을 확장 하는 두 개의 렌즈로 구성 되어 있습니다. 최소 초점 거리와 렌즈 먼저와 야 한다. - 배치, 정렬 및 잠 망 경 려 위쪽으로 광학 경로 가까이 dichroic 거울 레일의 입구를 수정.
- 레일에 뜨거운 미러 수정, 현미경에 레일을 놓습니다. 그 레일은 잘라 버 렸 군 적외선 레이저 (그림 2)의 입구를 수 있도록 오른쪽에 있는지 확인 합니다.
- 레이저 빛 것는 현미경에서 먼저 목표 없이 다음 목표를 확인 하십시오. 잠 망 경의 아래쪽 거울을 목표 하기 전에 레이저의 위치를 수정 합니다. 목표는 잠 망 경의 최고의 미러 후 레이저의 위치를 수정 합니다.
- 유리 베트에 500 nm 형광 구슬의 1 µ L를 넣고 증류수 10 mL을 추가. 멧 홀더에서 목표 아래 멧을 넣고 목표 접촉 물 표면 (Z 위치) 목표의 초점 조정.
- 수집 수 제 소프트웨어는 AOTF, 카메라 및 압 전 단계를 시작 합니다. 무료 소프트웨어를 마이크로 등도 사용할 수 있습니다. "라이브" 버튼 눌러 라이브 수집 모드를 켭니다.
- 1. IR 레이저 전원 조정
-
고글에 (그리고 실험의 끝에 전에 그것을 제거 하지 마십시오) 레이저에 전환. 구슬은 레이저 초점에 갇혀 야.
- 없는 구슬 레이저 초점에 갇혀, 빨간 레이저 포인터 (IR 레이저와 일 직선상이) 목적 나오는 경우 확인 합니다. 그렇지 않으면, 정렬 단계를 다시 시작, 특히에서 2.13 단계. 또는, IR 레이저 힘 증가.
- (이미징 비행기)의 초점 비드 갇혀, 마지막의 마지막 렌즈의 위치를 이동 부드럽게 초점을 이미지 평면 구슬 려 광학 축을 따라 ( 그림1에서 L4) 망원경. 하지 않을 경우, 이동 마지막의 첫 번째 렌즈 광학 축을 따라 ( 그림 1에 L3) 망원경.
- 갇혀 비드 하지 중심 이미지에, 트랩의 위치를 조정 하려면 2 잠 망 경 거울을 사용 합니다. 첫 번째 거울의 각도 변경 하 여 구슬의 위치를 변경 하는 경우 두 번째 거울의 해당 각도 변경 하 여 광선의 방향을 보상 또한. X 위치만 (각 미러 1 나사), 수정 후 정확한 Y 위치 (1 나사 각 거울에 대 한).
- 필요한 경우, 초점에서 비드 관찰 2nd 망원경 렌즈의 위치를 조정 합니다.
- 필요한 경우, 이미지에서 중심으로 비드를 잠 망 경 거울의 각도 조정 합니다.
3. 악기 인터페이스
참고: 그림 3 내셔널 인스트루먼트 (NI) 카드 연결의 일반적인 구성표를 제공합니다.
- 출력 카드 (NI 9263) 섀시 (cdaq-9178)의 첫 번째 슬롯에 삽입 합니다. 참고 적어도 2 개 아날로그 출력 및 3 아날로그 입력을 가진 NI 카드의 다른 모델을 사용할 수 있습니다.
- 입력된 카드 (NI 9215) 섀시 두 번째 슬롯에 삽입 합니다.
- 아날로그에 첫 번째 검 류 계를 연결 AO0와 BNC 케이블 아날로그 입력된 AI0 출력. Note 2 BNC 케이블 하나에 연결 하는 T 어댑터를 사용할 수 있습니다. 검 류 계 드라이버 보드에 핀을 지역화 하는 검 류 계 설명서를 참조 하십시오.
- 같은 방식으로, AO1 AI1를 두 번째 검 류 계를 연결 합니다.
- PFI1 (컨트롤러) 다시 셔터의 방 아 쇠에 연결 합니다.
- 카메라의 화재와 AI2 PFI0를 연결 하십시오.
- (컨트롤러) 다시 셔터에서 트리거 AI3 연결 합니다.
- 셔터 컨트롤러의 설정을 조정 합니다. 화살표를 사용 하 여 매개 변수 값을 변경 하 고 확인 선택 하 고 다음 매개 변수를 전달 하려면 "선택" 버튼을 눌러. 넣어 000.000 매개 변수 ""sec는 오픈 시간, 000.000 "닫히는 시간 초", "모드" 싱글, 그리고 "트리거" 내선 허용 셔터 컨트롤을 "활성화" 버튼을 누르면.
- QtCreator (https://www.qt.io/, 무료 버전에서에서 다운로드)를 엽니다.
참고: QtCreator c + +에서 광학 족집게 소프트웨어를 개발 하는 데 사용 하는 통합 개발 환경입니다. Qt 라이브러리는 위젯을 만들려고 여기 사용 됩니다. - (Qt 코드 파일에 제공 되는) OT.pro 파일을 엽니다. 이 작업은 프로젝트를 열 것 이다. 변경 입력 및 NI 카드에 따라 AOGenerator.cpp 파일에서 출력의 이름을 사용합니다.
- 컴파일하고 OT 소프트웨어를 실행 합니다.
4. 구슬 광학 트랩 위치 교정
-
보정 동영상의 기록
- 유리 베트에 500 nm 빨간 형광 구슬의 1 µ L를 넣어 다음 증류수 10 mL에는 베트를 채울. 그림 4 는 관찰에서 베트의 보기를 제공합니다.
- 압 전 단계에는 베트를 수정 합니다.
- 검색 목표 딥 물에는 베트의 Z 위치를 조정 합니다.
- 적외선 레이저를 켜고 전원을 W. 1로 설정
- 이미지 수집 소프트웨어 설정.
- 시간 경과 이미지를 수집, 노출 시간, 이득, 두 개의 이미지, 획득, 이미지의 수 및 레이저 힘 사이 시간을 선택 합니다. 참고는 구슬과 광학 족집게 교정에 대 한 조명 레이저 (561 nm)는 필요 하지 않습니다. 적외선 레이저에 의해 유도 된 2 광자 효과 갇혀 구슬의 형광을 흥분 시키기에 충분 하다.
- 광학 핀셋 만든 소프트웨어를 시작 합니다.
- 원을 추적 하 광학 핀셋 매개 변수를 설정 합니다. 250 samp/s, 1000, Waveform1 매개 변수 (galvo 1)으로 bufferSize로 사인, nbPeriod 1, 진폭 0.5 V, 단계 0.0 rad, 사인, nbPeriod 1, 진폭 0.5 V, 위상 오프셋 0.0 V 1.57 rad 0.0 V, 파형 2 매개 변수 (galvo 2) Offset으로 SamplingRate를 설정 합니다.
- ... "AI 매개 변수" 상자, 및 "그것에 대 한 대기" 확인 상자.
- 이미지 수집 (10 fps 같은 높은 프레임 속도, 500 또는 1000 이미지)를 시작 합니다.
- "생성!" 푸시 버튼을 눌러 광학 족집게에 전환 합니다.
- 적어도 두 개의 전체 동그라미를 완료 하 고 중지 해제 누르면는 "생성!"에 의해 광학 족집게에 갇혀 구슬 허용 버튼.
- 이미지 수집을 중지 합니다. Tiff 영화와 검 류 계 전압 텍스트 파일은 기본에 만들어집니다 "c: / TEMP /" 폴더 (하지 않는 한 사용자 지정 위치를 지정). 필요한 경우 연결 된 데이터 파일 여러 교정 영화를 만들 수 있습니다 note.
- 동그라미 완료 되지, 구슬 원 궤도 동안 손실 됩니다. 아마 속도 너무 높습니다. OT 소프트웨어의 샘플링 레이트를 감소 하 여 감소. 또는, 만약 레이저 나오는 목적은 전체 원형 궤도 동안 확인 적외선 레이저의 빨간 레이저 포인터를 사용 하 여. 그렇지 않은 경우에 검 류 계 거울 다시 대물 렌즈의 초점면와 활용 하지 않을 수 있습니다. 2.5 단계에서 정렬 단계를 다시 시작 하는 목표의 다시 초점 비행기에 관하여 비치의 위치를 수정 합니다.
- 0는 진폭을 설정 하 고 수정 위치에 구슬을 함정 레이저에 스위치. 함정 위치에 랜드마크를 배치 합니다.
-
이미지 분석 위치 보간
- Matlab, 교정 폴더 열고 (Matlab 코드 파일에 제공 되는) "position2tension" 스크립트를 실행 합니다. 이 스크립트는 광학 트랩 위치에 검 류 계 전압 변환 보간 함수를 계산 합니다.
- 교정 영화 수 사용 됩니다를 선택 합니다. 몇몇 영화는 2 개의 수직 타원 같은 다른 궤적을 선택할 수 있습니다. 일반적으로, 원형 궤도와 하나의 교정 영화 충분 하다.
- 첫 번째 및 마지막 이미지 제공 (영화 당 한 대화 상자), 대화 상자에서 명확한 궤도와 좋은 신호 대 잡음 비율에 시퀀스 번호.
- 각 영화에 대 한 수집 하는 동안 전압을 포함 하는 텍스트 파일의 경로 제공 합니다. 참고는 스크립트는 파일을 각 이미지에 대 한 두 개의 비치의 평균 전압을 계산 합니다.
- 해당 교정 동영상의 경로 제공 합니다.
참고: 스크립트는 구슬에 MTT26에서 추출 하는 기능과 사용자 지정 함수를 사용 하 여 2D 가우스를 피팅 하 여 픽셀 해상도 가진 각 프레임에 대 한 비드를 감지 합니다. 비드 궤적을 보여주는 그래프를 표시 합니다. - 그것을 클릭 하 여 잘못 검색 된 지점 (outliers)를 제거 합니다.
- X에 대 한 보간 지도 체크 y 레이저 위치 계산 하 고, 스크립트에 의해 표시 됩니다 완료 됩니다. 누락 된 값 (지도에 흰색 영역)을 많이 있는 경우에, 더 나은 신호 대 잡음 비율를 가진 새로운 교정 영화와 함께 작업을 반복 하거나 /와 비치의 느린 속도.
참고: 이름 convertFct.mat와 이미지와 같은 폴더에이 이미지와 보간 값 저장 자동으로 됩니다.
5. 장착 초파리 배아27
- 감 금 소, 25 ° c.에 인 큐베이 팅에서 초파리 배아를 수집
- 체 판 내용을 통과 하는 누 룩을 제거 (약 100 µ m 기 공 크기 되어야 함).
- 100% 표 백제 (2.6% 나트륨 차 아 염소 산) 45와 배아를 씻고는 chorion를 제거 하는 s.
- 배아를 2 분 동안 물으로 씻는 다.
- 브러시로 천 패드에 배아를 넣어.
- 원하는 단계에 따라 약 10 배아를 선택 하 고 정렬 한 파이크와 촉촉한 브러시 배아.
참고: 맞춤 관심 (검색 목적에 최대한 가까이 관심의 영역)의 지역에 따라 이루어져야 합니다. - 다이아몬드-마킹 펜을 사용 하 여, 1 m m3x 20 x 10의 유리 슬라이드의 한 조각 잘라.
- 한쪽 잘라 조각에 접착제를 추가 하 고 말리 면 20 s.
- 잘라 조각을 뒤집어 놓고 슬라이드의 가장자리에 붙어 배아의 줄에 배치 합니다.
- 샘플 홀더에이 준비를 설치 하 고는 베트에 배치. 그림 4 는 관찰 컨텍스트에서 베트의 보기를 제공합니다.
- 압 전 단계에는 베트를 넣어.
6. 트래핑 Vivo에서 실험
-
셀 연락처의 트래핑-진동 (그림 5)
- 조직에 대 한 관심의 위치를 찾아.
참고: 하나 외화 교차점의 평면에서 작업을 해야 하는 경우 도움이 될 수 있다 파리 cadherins 표시 됩니다를 사용 하 여. - 대상 연결의 중간점 트랩 위치 (랜드마크 단계 4.1.14에서 설정)에 이동 압 전 단계를 사용 하 여.
- 연락처 라인에 수직 진동 달성 하 트랩 매개 변수를 설정 합니다. 단계 0으로 설정 합니다. X에는 진폭을 설정 및 연락처 라인에 수직 움직임을 Y 방향. 진폭은 일반적으로 0.1 V 해야 합니다.
- (10 fps 같은 빠른 프레임 속도)와 수집을 시작 합니다.
- "생성!" 푸시 버튼을 누르면 광학 족집게에 전환 합니다.
- 완료 되 면, 족집게와 정지 이미지 수집 전환. 영화와 중 검 류 계 전압을 포함 하는 텍스트 파일 지정된 된 폴더에 표시 한다.
- 셀 연락처의 트래핑-풀-릴리스 (그림 6)
- 조직에 대 한 관심의 위치를 찾아.
- 그것의 중간점은 일반적으로 트랩 위치 (랜드마크 단계 4.1.14 설정)에서 1 µ m를 압 전 단계를 사용 하 여 대상 연결을 이동 합니다.
- 진폭 꾸준한 트랩을 0으로 설정 합니다.
- (10 fps 같은 빠른 프레임 속도)와 이미지 수집을 시작 합니다.
- "생성!" 푸시 버튼을 누르면 광학 족집게에 전환 합니다.
- 원하는 시간 후 함정을 끄고 하 고 발생 하는 휴식 기 다.
- 이미지 수집을 중지 합니다. 영화와 중 검 류 계 전압을 포함 하는 텍스트 파일 지정된 된 폴더에 표시 한다.
- 조직에 대 한 관심의 위치를 찾아.
-
자동 장전 식 kymograph 세대 고 인터페이스 위치 탐지.
- 교정 절차 (4b) 동안 생성 된 보간 지도 로드 Matlab 명령 창에서: load('convertFct.mat'). 이 fx, fy 변수를 제공합니다.
- Matlab 명령 창에서 autokymo(fx,fy), Matlab 코드 파일에 제공 된 실행 합니다. 이 함수의 목적은 레이저 궤적을 따라 kymograph를 생성 하 고 각 프레임에 대 한 픽셀 해상도 연락처 라인의 위치를 감지.
- 전압 값이 포함 된 프롬프트 텍스트 파일 경로 선택 합니다.
- 분석 동영상의 처음과 마지막 프레임 번호를 선택 합니다.
- Tiff 동영상 파일을 선택 합니다. 두 개의 새로운 숫자 표시 됩니다: 첫 번째는 kymograph의 이미지입니다. 두 번째는 연락처 및 레이저 위치, 이미지 번호 대의 탐지의 그래프입니다.
참고: 함수는 샘플의 위치와 레이저 위치 (tiff 이미지)와 대 이미지 번호 (matlab 그림, jpg), kymograph (tiff 이미지)는 kymograph 레이저의 위치를 나타내는 그래프를 저장 합니다. 꾸준한 함정 실험은 kymograph ImageJ를 사용 하 여 예를 들어, 수동으로 할 수 있다. 인터페이스는 kymograph에서의 탐지를 할 수 있습니다 다음 동일한 알고리즘을 사용 하 여.
7. 기계 측정
-
강성과 장력 측정
- 진동 실험 (단계 6.1)과 시간 경과 영화의 해당 분석 (6.3 단계)를 수행 합니다.
- 인터페이스 위치를 플롯
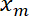 함정 위치의 기능으로
함정 위치의 기능으로 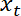 Matlab 플롯 기능 또는 소프트웨어 계획 데이터를 사용 하 여.
Matlab 플롯 기능 또는 소프트웨어 계획 데이터를 사용 하 여.
참고:이 약 선형 이어야 합니다. - Matlab "ezfit" 무료 도구 상자 또는 맞는 수 있도록 소프트웨어를 사용 하 여, 적합 한 선형을 수행 합니다. 적합의 기울기의 역 수는 평균 비율을 제공
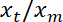 .
. - 수행 하는, 작은 개 악 및 이차는 트랩, 잠재적인 가정은 의해 주어진 인터페이스의 명백한 휨 강성의 견적
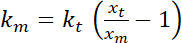 .
. 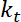 트랩 코리 (트랩 강성 구경 측정을 위한 8 단계 참조).
트랩 코리 (트랩 강성 구경 측정을 위한 8 단계 참조). - 23로 정의 될 수 있는 긴장의 추정을 수행:
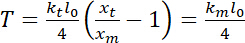 .
.
-
유 변 학적 측정
- 풀 릴리스 실험 (6.2 단계) 및 해당 분석 (6.3 단계) 수행
- 사용자 지정 유 변 학적 모델 결과 곡선에 맞게.
8입니다. 트랩 강성의 교정
참고: 절대 세력의 함정 강성 인터페이스에 지식이 필요합니다. 이 두 단계 절차를 통해 비즈를 사용 하 여 액세스할 수 있습니다.
-
Cytosol 점성의 결정
- Halocarbon 기름에 배아를 놓고 형광 폴리스 티 렌 구슬 (1:1, 000 재고 희석, 0.46 µ m 직경)23,27microinjection 설치를 사용 하 여 그들을 투입 합니다.
- 현미경 아래에서 주입 된 배아를 놓습니다.
- cytosol에서 발견 한 구슬의 움직임을 추적 합니다. 구슬 (궤도 > 100 구슬의 많은 수를 사용 하 여)의 제곱 변위를 추출 합니다. 제곱 변위의 사면에서 구슬 확산 상수를 확인 합니다. 스톡 스-아인슈타인 방정식에 의해 확산 상수 점도 관련는 cytosol의 효과적인 점성 추론할. 초기 배아에서 약 3.5 Pa.s의 점도 보고23입니다.
-
구슬에 트랩 강성의 결정
- 광학 핀셋으로는 cytosol에서 단일 구슬 트랩.
- 0.5 µ m으로 구분 된 두 개의 트랩 위치 사이 stepwise 방식에서 구슬 이동
- 끌기 계수와 다른 한 함정 위치에서 구슬 휴식 시간 사이의 비율으로 구슬에 트랩 강성을 결정 합니다.
참고: 끌기 계수는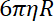 , 어디
, 어디 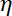 는 (8.1) 결정 하는 점도
는 (8.1) 결정 하는 점도  구슬 반경. 휴식 시간 Matlab 또는 맞는 수 있도록 소프트웨어를 사용 하 여 구슬 위치의 지 수 맞는에서 얻은 것입니다. 트랩 강성의 전형적인 값은 200 mW 레이저 여기에서 120 ± 50 pN.µm-1 .
구슬 반경. 휴식 시간 Matlab 또는 맞는 수 있도록 소프트웨어를 사용 하 여 구슬 위치의 지 수 맞는에서 얻은 것입니다. 트랩 강성의 전형적인 값은 200 mW 레이저 여기에서 120 ± 50 pN.µm-1 .
-
셀 인터페이스에 트랩 강성의 결정
- 연락처 선 레이저를 집중 하 고 (6 단계에 설명)으로 편향. 변형 진폭을 측정 합니다. 이 대표 평균을 얻기 위해 여러 연락처 줄에 반복 한다.
- 그 구슬 연락처 라인에 대 한 추진에 의해 유도 된 생산된 변형을 비교 합니다. 변형 트랩 강성에 반비례 이기 때문에, 셀 연락처에 트랩 강성 추론할.
참고: 셀 연락처에 트랩 강성 일반적으로 찾아냈다 2-에 3 배 보다 작은 구슬 (0.46 µ m 직경)에.
결과
그림 5 함정을 정현파 움직임을 부과 하 여 얻어진 실험 데이터를 보여 줍니다. 함정 3 연속 인터페이스 위치 (그림 5A)23보여주는 3 스냅샷에 의해 exemplified 인터페이스의 편향도 생성 합니다. 기록된 영화 kymograph (그림 5B)를 생성 하는 데 사용 됩니다. 그리고 각 프레임에 대 한 x 방향을 따...
토론
광학 족집게는 비-침략 적 방식으로 직접 개발 배아 상피에에서 절대 기계 측정을 수행 하실 수 있습니다. 그런 의미에서 그것은 침략 적 되 고 상대 측정, 주사를 요구 하는 자기 세력을 제공 또는 강한 가정에 의존 하는 유추를 강제로 제공 하 고 또한 상대 레이저 절제 등 다른 방법을 통해 장점을 제공합니다 측량입니다.
프로토콜은 몇 가지 중요 한 단계를 포함합니다. 첫?...
공개
저자는 공개 없다.
감사의 말
이 작품은 FRM Equipe 그랜트 FRM DEQ20130326509, 직원 회 드 라 검색 ANR 블랑 그랜트, Morfor ANR-11-BSV5-0008 (P.-플로리다)에 의해 지원 되었다. 우리는 프랑스 국립 연구 기관 (ANR-10-INBS-04-01, «미래에 대 한 투자»)에서 지 원하는 프랑스 BioImaging 인프라를 인정 합니다. 우리 기술 지원에 대 한 PICSL-FBI 인프라에서 브라이스 Detailleur와 클로드 모레티 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| Ytterbium Fiber Laser LP, 10 W, CW | IPG Laser | YLM-10-LP-SC | including collimator LP : beam D=1.6 mm and red guide laser |
| Ø1/2" Optical Beam Shutter | Thorlabs | SH05 | |
| Small Beam Diameter Galvanometer Systems | Thorlabs | GVS001 | 1 for X displacement, 1 for Y displacement |
| 1D or 2D Galvo System Linear Power Supply | Thorlabs | GPS011 | galvanometers power supply |
| 2 lenses f = 30mm | Thorlabs | LB1757-B | relay telescope between 2 galva |
| Lens f = 200mm | Thorlabs | LB1945-B | 2.5X telescope |
| Lens f = 500mm | Thorlabs | LB1869-B | 2.5X telescope |
| Right-Angle Kinematic Elliptical Mirror Mount with Tapped Cage Rod Holes | Thorlabs | KCB1E | Periscope |
| Laser Safety Glasses, Light Green Lenses, 59% Visible Light Transmission, Universal Style | Thorlabs | LG1 | |
| 45° AOI, 50.0mm Diameter, Hot Mirror | Edmund Optics | #64-470 | |
| Multiphoton-Emitter HC 750/S | AHF | HC 750/SP | |
| CompactDAQ Chassis | National Instruments | cDAQ-9178 | |
| C Series Voltage Output Module | National Instruments | NI-9263 | Analog output module |
| C Series Voltage Input Module | National Instruments | NI-9215 | Analog input module |
| FluoSpheres Carboxylate-Modified Microspheres, 0.5 µm, red fluorescent (580/605), 2% solids | ThermoFisher Scientific | F8812 | calibration beads |
| C++ (Qt) home made optical tweezers software | developed by Olivier Blanc and Claire Chardès. Alternative solution: labview |
참고문헌
- Lecuit, T., Lenne, P. -. F., Munro, E. Force generation, transmission, and integration during cell and tissue morphogenesis. Annual review of cell and developmental biology. 27 (1), 157-184 (2011).
- Heisenberg, C. -. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Sugimura, K., Lenne, P. -. F., Graner, F. Measuring forces and stresses in situ in living tissues. Development. 143 (2), 186-196 (2016).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in cell & developmental biology. 55, 119-130 (2016).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. Journal of Cell Biology. 149 (2), 471-490 (2000).
- Farhadifar, R., Roper, J. C., Aigouy, B., Eaton, S., Julicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Rauzi, M., Verant, P., Lecuit, T., Lenne, P. F. Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nature Cell biology. 10 (12), 1401-1410 (2008).
- Ma, X., Lynch, H. E., Scully, P. C., Hutson, M. S. Probing embryonic tissue mechanics with laser hole drilling. Physical Biology. 6 (3), 036004 (2009).
- Hutson, M. S., Tokutake, Y., et al. Forces for morphogenesis investigated with laser microsurgery and quantitative modeling. Science. 300 (5616), 145-149 (2003).
- Bonnet, I., Marcq, P., Bosveld, F., Fetler, L., Bellaïche, Y., Graner, F. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface / the Royal Society. 9 (75), 2614-2623 (2012).
- Etournay, R., Popović, M., et al. Interplay of cell dynamics and epithelial tension during morphogenesis of the Drosophila pupal wing. eLife. 4, e07090 (2015).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current topics in developmental biology. 95, 93-144 (2011).
- Saha, A., Nishikawa, M., Behrndt, M., Heisenberg, C. -. P., Jülicher, F., Grill, S. W. Determining Physical Properties of the Cell Cortex. Biophysical journal. 110 (6), 1421-1429 (2016).
- Desprat, N., Supatto, W., Pouille, P. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental cell. 15 (3), 470-477 (2008).
- Mitrossilis, D., Röper, J. -. C., et al. Mechanotransductive cascade of Myo-II-dependent mesoderm and endoderm invaginations in embryo gastrulation. Nature Communications. 8, 13883 (2017).
- Campàs, O., Mammoto, T., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2013).
- Serwane, F., Mongera, A., et al. In vivo quantification of spatially varying mechanical properties in developing tissues. Nature Methods. 14 (2), 181-186 (2017).
- Chiou, K. K., Hufnagel, L., Shraiman, B. I. Mechanical stress inference for two dimensional cell arrays. PLoS computational biology. 8 (5), e1002512 (2012).
- Ishihara, S., Sugimura, K. Bayesian inference of force dynamics during morphogenesis. Journal of theoretical biology. 313, 201-211 (2012).
- Brodland, G. W., Veldhuis, J. H., Kim, S., Perrone, M., Mashburn, D., Hutson, M. S. CellFIT: a cellular force-inference toolkit using curvilinear cell boundaries. PLoS ONE. 9 (6), e99116 (2014).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23, 247-285 (1994).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. -. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences of the United States of America. , (2015).
- Clément, R., Dehapiot, B., Collinet, C., Lecuit, T., Lenne, P. -. F. Viscoelastic Dissipation Stabilizes Cell Shape Changes during Tissue Morphogenesis. Current biology: CB. 27 (20), (2017).
- Chardès, C., Ménélec, P., Bertrand, V., Lenne, P. -. F. Setting-up a simple light sheet microscope for in toto imaging of C. elegans development. Journal of visualized experiments. 87, e51342 (2014).
- Serge, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nature Methods. 5 (8), 687-694 (2008).
- Cavey, M., Lecuit, T. Imaging Cellular and Molecular Dynamics in Live Embryos Using Fluorescent Proteins. Drosophila. 420, 219-238 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유