A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בודק את התא מכניקה עם מלקחיים אופטיים ללא חרוז בתוך העובר דרוזופילה
In This Article
Summary
אנו מציגים כיוונון של מלקחיים אופטיים מצמידים מיקרוסקופ אור גיליון, ואת יישומו כדי לחקור מכניקה תא בלי חרוזים ב העובר דרוזופילה .
Abstract
מורפוגנזה דורשת תיאום בין המתבנת גנטי וכוחות מכני robustly לעצב את תאים ורקמות. ומכאן, אתגר להבין תהליכים morphogenetic הוא למדוד ישירות כוחות הסלולר לבין תכונות מכניות ויוו במהלך מופרה. כאן, אנו מציגים את כיוונון של מלקחיים אופטיים מצמידים מיקרוסקופ אור גיליון, המאפשר ליישם ישירות כוחות על אנשי קשר תאים תאים של העובר דרוזופילה מוקדם, תוך כדי הדמיית במהירות של מספר פריימים לשניה. טכניקה זו יש יתרון כי הוא אינו דורש ההזרקה של חרוזים לתוך העובר, בדרך כלל נעשה שימוש הגששים ביניים שבו כוחות אופטי הם המופעל. אנחנו מפרטים שלב אחר שלב המימוש של ההתקנה, ולהציע כלים כדי לחלץ מידע מכני של הניסויים. על ידי ניטור של displacements של תא-תא אנשי הקשר בזמן אמת, אחד יכול לבצע מדידות מתח ולחקור rheology של אנשי הקשר של התא.
Introduction
התפתחות הוא תהליך מאוד לשחזור במהלכו תאים ורקמות לעוות לעצב את החיה לעתיד. דפורמציות כזה הוכחו דורשים הדור פעיל של כוחות ב ברמה1,תא2. כדי להבין תהליכים morphogenetic במהלכו תאים ורקמות לשנות את צורתם, לכן זה מפתח כדי להעריך את התכונות המכאניות של התאים המעורבים, וכדי למדוד את הכוחות בתוך רקמת במהלך תהליך3,4 . שכבות אפיתל, בפרט דרוזופילה, נחקרו באופן נרחב עקב הגיאומטריה קוואזי-2D שלהם וכדי שלהם טיפול קל.
מספר טכניקות ולכן פותחו על ידי, ואחרים כדי להעריך מכניקה אפיתל ויוו במהלך הפיתוח. אני אתן סקירה מהירה של שלושת הטכניקות העיקריות בשימוש ברקמות האפיתל. אבלציה לייזר, שיטה בשימוש נרחב, מאפשרת לחשוף את הלחץ מכני מקומי ברמת התא צמתי5,6,7,8 או גדולים בקנה מידה9,10,11 על-ידי ביצוע חתכים המקומי לשבש את תקינות מכנית של המטרה. הדינמיקה של הפתח בעקבות החתך מספק מידע על אבלציה מוקדמת מתח, וגם על rheology של12,רקמת13. החיסרון של אבלציה לייזר היא שזה פולשני, כפי שהוא דורש שיבוש קליפת תא מקומיים. לפיכך, אחת ניתן לבצע רק מספר מוגבל של ablations אם אדם רוצה לשמר את שלמות רקמות. חיסרון נוסף הוא כי ablations מספקים רק הערכות היחסי של מתח התא באנשי קשר, מאז פתיחת המהירות תלויה חיכוך צמיגה, אשר בדרך כלל אינו ידוע. מניפולציה מגנטי גם פותחה, בשימוש דרוזופילה, המערבים את השימוש ferrofluids14 או ליפוזומים ultramagnetic15. הם יכולים לספק מדידות מוחלטת16,17, אבל הם גם פולשני במובן שהן דורשות ההזרקה של הגששים-המיקום הרצוי. זה יכול להיות מסובך מאוד תלוי במערכת, וזה לא תמיד לבצע זריקות מדויקות. טכניקה שלישית, לחלוטין לא פולשנית, היא כוח היסק18,19,20. כוח היסק מסתמך על ההנחה של שיווי משקל מכני בנקודות טריפל (tricellular צמתים או קודקודים), מאפשר להסיק המתחים בכלל תא-תא אנשי קשר (ואולי, לחצים בכל תאי) על ידי פתירת בעיית ההופכי. מתחים, כל קודקוד מספק שתי משוואות (X ו- Y). זה מניב מערכת גדולה של משוואות לינאריות, אשר יכולה להיות הפוכה בתנאים מסוימים כדי להעריך את המתח על כל אנשי הקשר של התא. אמנם שיטה זו מושכת מאוד, כפי שהיא דורשת רק תמונה מקוטעת, לא ניסוי נוסף או את תוכנית ההתקנה, רמת הדיוק שלה היא עדיין לקבוע, שוב זה רק מספק ערכים יחסיים, אלא אם כן מתבצעת מדידה כיול מוחלטת.
כדי להתגבר על מגבלות אלה, נסקור במאמר זה כיוונון של פינצטה אופטית מצמידים מיקרוסקופ אור גיליון להחלת כוחות מבוקרת המידה תא ב האפיתל מתחלקים של melanogaster דרוזופילה. מלקחיים אופטיים שימשו עבור יישומים ביולוגיים רבים, כולל את המידות על חלבונים יחיד ומניפולציה של organelles ותאים21. כאן, אנחנו מדווחים כוחות יישומית בטווח של כמה עשרות pN, אשר קטן עדיין מספיק כדי לגרום העיוותים המקומיים אנשי תא ולבצע מדידות מכניות ויוו. בדרך כלל, אנו משתמשים הסטה אנכית של אנשי קשר תא, פיקוח באמצעות הניתוח של kymographs, להתייחס כוח דפורמציה. חשוב, ההתקנה שלנו לא דורשת ההזרקה של החרוזים על המיקום הרצוי בתוך הרקמה, כפי מלקחיים אופטיים מסוגלים להפעיל כוחות על התא-תא אנשי קשר ישירות. זיווג מלקחיים אופטיים כדי מיקרוסקופ אור גיליון מאפשרת לבצע הדמיה מהירה (מספר פריימים לשניה), וזה ניכר מאוד עבור ניתוח מכני-פרקי זמן קצרים, ועם phototoxicity מופחת, מאז איור מדגם הוא מוגבל למישור הדמיה22.
פינצטה אופטית, הכולל, הם דרך לא פולשנית כדי להחיל כוחות מבוקרת תא באנשי קשר ויוו ב העובר דרוזופילה , וכדי לחלץ מידע מכני כגון נוקשות ועל מתח התא אנשי קשר23, מאפייני rheological 24, ואת הדרגה או מתח23. בנוגע למקורו.
Protocol
1. הגדרה-up מיקרוסקופ אור גיליון
- להפנות התיאור של הגדרת הפרסום הקודם25.
הערה: ההגדרה מורכב שלב מיקרוסקופ זקוף ומודול גיליון אור בהפקת גיליון אור במישור האופקי. 10 X עדשה המטרה עירור מנחה את הגיליון אור לתוך cuvette זכוכית (איור 4). זיהוי המטרה העדשה יש נה גבוה (1.1), אשר הוא הכרחי עבור יעיל tweezing (ראו להלן).
2. הגדרת להמציא הנתיב מלקחיים אופטיים
הערה: איור 1 נותן ערכה הכללית של ההתקנה אופטי.
- למקם את יחידת הלייזר nm 1070 ותקן הסיבים על השולחן אופטי עם הר V-קלאמפ. להבטיח קולימטור סיבים מקבילים אל השולחן האופטי (ומכאן, אופקי) גובה שנבחרו כאן יהיו הגובה עבור כל הרכיבים אופטי של מיושרים על השולחן האופטי.
הערה: 100 מ מ יכול להיות בחירה טובה עבור הגובה הזה. - סובב את המפתח של יחידת לייזר אינפרא אדום ולחץ על הלחצן "בחר" כדי להפעיל את מצביע יישור. האור צריך להיות היוצא אופקי של סיבי.
- מקם את התריס בנתיב האופטי, לתקן את זה. לשולחן אופטי, כך קרן לייזר אינפרא אדום עובר הצמצם של הצמצם. להבטיח כי המרחק בין השולחן אופטי והוא מרכז הצמצם של הצמצם הגובה שבחרת בשלב 2.1.
- סובב את המפתח של בקר תריס, לבחור את מצב ידני עם החצים ולחץ על לחצן "הפעל" כדי לפתוח את התריס.
- המקום, ליישר ותקן המראה גלוונומטר הראשון.
הערה: המראות גלוונומטר שני חייב להיות מצומדת אל הפתח האחורי של המטרה זיהוי, כך כאשר באחד השיקופים מסתובב, קרן הלייזר לא נזוז הפתח האחורי של המטרה. שים לב כי המרחק בין גלוונומטר הראשון את הפתח האחורי של המטרה יש לחשב כדי להעריך את המיקום של זה גלוונומטר ביחס המטרה (f1 + f1 + f2 + f2 + f3 + f3 + f4 + f4 = 30 + 30 + 30 + 30 + 30 + 200 + 200 + 500 + 500 = 1550 מ"מ; פי = אורך המוקד של העדשה n ° אני). - הפעל את אספקת החשמל גלוונומטר. ודא כי galvanometers מופעל למשך שארית פרוטוקול יישור.
- הגדר את galvanometers אפס סטיה (עם NIMAX או תוכנה פינצטה אופטית - ראה שלב 3 עבור חיבורים גלוונומטר).
- המקום, ליישר ולתקן את הטלסקופ ממסר מורכב שתי עדשות עם אורך מוקד של 30 מ מ.
- המקום, ליישר ותקן המראה גלוונומטר השני. שימו לב כי המרחק בין galvanometers שני 4f = 4 x 30 מ"מ = 120 מ"מ (f = אורך המוקד).
- המקום ולתקן את הטלסקופ.
הערה: הטלסקופ מורכבת של שתי עדשות להרחיב את הקרן לרוחב לפחות שווה לקוטר של הפתח האחורי של העדשה אובייקטיבי. העדשה עם אורך המוקד הקטן ביותר צריכה לבוא קודם - המקום, ליישר ולתקן את הפריסקופ מביא כלפי מעלה את הנתיב אופטי קרוב לכניסה של המעקה מראה ודיקרואיק זוהר.
- לתקן את המראה חם המעקה, מקום המעקה במיקרוסקופ. ודא כי המעקה הוא בסכינים שבצד ימין כדי לאפשר כניסת לייזר אינפרא-אדום (איור 2).
- בדוק כי אור הלייזר הולך מחוץ המיקרוסקופ, קודם ללא המטרה ולאחר מכן עם המטרה. לתקן את המיקום של הלייזר לפני המטרה עם ראי למטה הפריסקופ. לתקן את המיקום של הלייזר אחרי המטרה עם המראה העליונה של הפריסקופ.
- 1 µL של 500 ננומטר חרוזים פלורסנט. תכניס cuvette זכוכית ולהוסיף 10 מ ל מים מזוקקים. להכניס את cuvette תחת המטרה cuvette מחזיק ולהתאים את המיקוד של המטרה (מיקום Z) כך המטרה נוגע פני המים.
- הפעל את התוכנה תוצרת בית רכישת שליטה על AOTF, המצלמה ועל הבמה פיזואלקטריים. תוכנה חופשית כמו micromanager יכול גם לשמש. הפעל את מצב רכישה בשידור חי על ידי לחיצה על "Live" בלחיצת כפתור.
- התאם את עוצמת הלייזר האינפרא-אדום 1 W.
-
שים את משקפי המגן (ואל תסיר אותו לפני תום הניסוי) ולעבור על הלייזר. חרוז צריך להיות לכוד על המוקד לייזר.
- אם אין חרוז הוא לכוד-המוקד לייזר, בדוק אם מצביע לייזר אדומה (וזה קוליניאריות עם לייזר אינפרא-אדום) יוצא המטרה. אם לא, תתחיל שוב את השלבים יישור, בשלב מסוים 2.13. לחלופין, להגביר את עוצמת הלייזר האינפרא-אדום.
- אם החרוז נלכד בפוקוס (של המטוס הדמיה), בעדינות העבר את המיקום של העדשה האחרונה של האחרון טלסקופ (L4 באיור1) לאורך ציר אופטי להביא את החרוז בפוקוס עם המטוס הדמיה. אם לא מספיק, להעביר העדשה הראשונה של האחרון טלסקופ (L3 באיור1) לאורך הציר האופטי.
- אם חרוז לכוד לא ממורכז בתמונה, להשתמש במראות פריסקופ 2 כדי לכוונן את המיקום של המלכודת. אם המיקום של החרוז משתנה על-ידי שינוי זווית המראה הראשון, גם לפצות את הכיוון של הקורה על-ידי שינוי הזווית המתאימה של המראה השני. לתקן את מיקום X בלבד (1 בורג עבור כל שיקוף) ולאחר מכן לתקן את מיקום Y (1 בורג עבור כל שיקוף).
- במידת הצורך, התאם את המיקום של עדשת הטלסקופ 2nd להתבונן החרוז בפוקוס.
- במידת הצורך, התאם את הזווית של המראות פריסקופ יש חרוז במרכז התמונה.
3. התממשקות המכשיר
הערה: איור 3 נותן ערכה כללי חיבורי כרטיס לאומי מכשירים (NI).
- הכנס את כרטיס פלט (NI-9263) בתוך החריץ הראשון של המארז (cDAQ-9178). שימו לב כי ניתן להשתמש מודלים אחרים של ני קלפים עם יציאות אנלוגיות לפחות 2 ו- 3 כניסות אנלוגיות.
- הכנס את כרטיס קלט (NI-9215) בתוך החריץ השני של המארז.
- את גלוונומטר הראשונה להתחבר אנלוגי פלט AO0, את AI0 קלט אנלוגי עם כבלי BNC. שימו לב כי מתאם T יכול לשמש כדי לחבר 2 כבלים BNC אחד. עיין במדריך גלוונומטר למקם את הסיכות על הלוח הנהג גלוונומטר.
- באותו אופן, לחבר את גלוונומטר השני AO1 ו- AI1.
- להתחבר PFI1 IN טריגר של הצמצם (האחורי של הבקר).
- להתחבר PFI0 לשריפה של המצלמה AI2.
- להתחבר AI3 ההדק מתוך הצמצם (האחורי של הבקר).
- התאם את ההגדרות של הבקר תריס. השתמש בחצים כדי לשנות את ערכי הפרמטרים, לחץ על הלחצן "בחר" כדי לאמת את הבחירה ולהעביר את הפרמטר הבא. לשים את פרמטר "פעם שניה פתוחה" 000.000, "הזמן סגור שניה" כדי 000.000, "מוד" יחיד, "טריגר" שלוחה אפשר השליטה של הצמצם על-ידי לחיצה על לחצן 'הפעל'.
- פתח QtCreator (שהורדו מ- https://www.qt.io/, הגרסה החינמית).
הערה: QtCreator היא סביבת פיתוח משולבת השתמשו לפתח ב- C++ את התוכנה מלקחיים אופטיים. לספריית qt משמש כאן כדי ליצור ווידג'טים. - פתח את הקובץ OT.pro (סיפקה בקבצי קוד של Qt). פעולה זו תפתח את הפרויקט. שינוי השם של קלט ולפלט בקובץ AOGenerator.cpp בהתאם לכרטיסים ני שימוש.
- בצע הידור, להפעיל את התוכנה בתנ ך.
4. כיול של העמדה מלכודת אופטי עם חרוזים
-
הקלטה של סרט כיול
- 1 µL של 500 ננומטר אדום פלואורסצנטי חרוזים cuvette הזכוכית, ואז למלא את cuvette עם 10 מ ל מים מזוקקים. איור 4 נותן cuvette בהקשר תצפית נוף.
- לתקן את cuvette על הבמה פיזואלקטריים.
- להתאים את מיקום Z cuvette כך המטרה זיהוי טובל במים.
- להפעיל את הלייזר האינפרא-אדום והגדר את הכוח 1 W.
- הפעל את התוכנה רכישת התמונה.
- כדי לרכוש זמן לשגות תמונות, בחר את זמן החשיפה, את הרווח, הזמן בין שתי תמונות, מספר תמונות כדי לרכוש את עוצמת הלייזר. שימו לב כי לצורך כיול פינצטה אופטית עם חרוזים, תאורה לייזר (561 ננומטר) אינה נדרשת. התוצאה 2-פוטון המושרה על ידי לייזר אינפרא אדום הוא מספיק כדי לעורר את זריחה של חרוז לכוד.
- הפעל את התוכנה תוצרת בית של מלקחיים אופטיים.
- להגדיר את הפרמטרים מלקחיים אופטיים לאתר עיגול. להגדיר SamplingRate כפי samp 250/s, bufferSize כמו 1000, Waveform1 פרמטרים (galvo 1) כפי הרמוניים וסינוסיים, nbPeriod 1, משרעת 0.5 V, שלב ראד 0.0, לקזז 0.0 V, פרמטרים Waveform 2 (galvo 2) הרמוניים וסינוסיים, nbPeriod 1, משרעת 0.5 V, שלב 1.57 ראד, היסט 0.0 V.
- בדוק את תיבת "AI פרמטרים", ואת "לחכות בשביל זה". התיבה.
- התחל את רכישת התמונה (500 או 1000 תמונות עם קצב מסגרות גבוה, כגון 10 fps).
- . הפעילי את מלקחיים אופטיים על-ידי לחיצה על כפתור push "Generating!"
- לאפשר החרוז לכוד להשלים לפחות שני מעגלים מלא ולעצור את מלקחיים אופטיים מאת משולחים שאינם pressing "Generating!" כפתור.
- להפסיק את ייבוא תמונות. שימו לב כי סרט tiff, קובץ טקסט עם המתחים גלוונומטר נוצרים כברירת מחדל "c: / זמני /" תיקיה (אלא אם כן צוין מיקום מותאם אישית). שימו לב כי ניתן ליצור מספר סרטים כיול עם קבצי הנתונים המשויכת במידת הצורך.
- אם המעגל לא הושלמה, החרוז אובד במהלך המסלול עיגול. אולי המהירות היא גבוהה מדי. להקטין את זה על ידי הפחתת קצב הדגימה בתוכנה בתנ ך. או, באמצעות מצביע לייזר אדומה לייזר אינפרא-אדום, בדוק אם הלייזר יוצא המטרה במהלך המסלול מעגל שלם. אם לא, לא יכול להיות מצומדת המראות גלוונומטר עם המטוס בחזרה מוקד של העדשה המטרה. תקן את העמדות של galvanometers ביחס למישור מוקד בחזרה המטרה, מתחיל שוב את השלבים יישור צעד 2.5.
- הגדר את amplitudes כאפס ולעבור על לייזר כדי ללכוד חרוז במיקום תיקון. מקם נקודת ציון מיקום השמנה.
-
מיקום אינטרפולציה עם ניתוח תמונות
- פתח Matlab, עבור אל התיקיה כיול ולאחר להריץ את הסקריפט "position2tension" (סיפקה בקבצי קוד Matlab). קובץ script זה מחשבת הפונקציה אינטרפולציה לתרגם את המתחים גלוונומטר למיקום מלכודת אופטי.
- בחר שמספר סרטים כיול ישמש. ניתן לבחור מספר סרטים עם מסלולים שונים, כגון שתי אליפסות בניצב. באופן כללי, סרט כיול יחיד עם מסלול מעגלי מספיקה.
- לספק את התמונה הראשונה והאחרונה מספרים בתיבת הדו-שיח (תיבת דו-שיח אחת לכל סרט), רצפים עם מסלול ברור, איתות טוב יחס הרעש.
- ספק את הנתיב של קובץ טקסט המכיל את המתחים במהלך רכישת עבור כל סרט. שימו לב כי הסקריפט קורא את הקובץ, מחשבת את המתחים אכזרי של galvanometers שני עבור כל תמונה.
- ספק את הנתיב של הסרט כיול המתאימים.
הערה: קובץ ה-script מזהה החרוז לכל מסגרת עם רזולוציה subpixel על ידי התאמה של Gaussian 2D על החרוז, שימוש בפונקציות מותאמות אישית ופונקציות מופק MTT26. הוא מציג גרף המציג את המסלול חרוז. - לחסל בכל נקודה לקוי שזוהו (ליניאריים) על ידי לחיצה עליו.
- תבדקי אם האינטרפולציה מפה עבור x ו- y לייזר עמדות מחושב ומוצג על-ידי קובץ ה-script, הושלם. אם יש הרבה ערכים חסרים (לבן אזורים במפה), לחזור על הפעולה עם סרט כיול חדש, עם קליטה טובה יותר ליחס רעש, או / ו עם מהירות איטית יותר של galvanometers.
הערה: התמונות האלה ואת הערכים אינטרפולציה נשמרים באופן אוטומטי באותה תיקיה של התמונה, עם convertFct.mat השם.
5. הרכבה עוברי דרוזופילה 27
- לאסוף את עוברי דרוזופילה מהכלוב, מודגרות ב 25 º C.
- הסר את השמרים, עובר את תוכן הלוח דרך מסננת (גודל הנקבוביות צריך להיות כ-100 מיקרומטר).
- לשטוף את העוברים עם 100% מלבין (2.6% נתרן תת-כלורי) 45 s כדי להסיר את chorion.
- לשטוף את העוברים עם מים למשך 2 דקות.
- לשים את העוברים על רכיב pad אגר עם מברשת.
- בחר בערך 10 העוברים על פי השלב הרצוי ויישר את העוברים עם כידון או מברשת לחה.
הערה: יישור צריך להיעשות בהתאם האזור של הריבית (אזור עניין קרוב ככל האפשר אל המטרה זיהוי). - באמצעות עט סימון יהלום, לחתוך חתיכה של שקופית מזכוכית של 10 x 20 x מ מ 13.
- להוסיף דבק בצד אחד של היצירה לחתוך, והנח לו להתייבש במשך 20 s.
- להפוך את פיסת חתך ומניחים אותו על הקו של העוברים, לתקוע את זה בקצה של השקופית.
- להתקין בתכשיר בעל מדגם ולמקם אותו cuvette. איור 4 נותן cuvette בהקשר תצפית נוף.
- לשים את cuvette על הבמה פיזואלקטריים.
6. השמנה ניסוי In Vivo
-
השמנה אנשי הקשר תא — תנודות (איור 5)
- למצוא את המיקום של עניין בתוך הרקמה.
הערה: שימוש זבובים שבה מסומנים cadherins יכול להיות מועיל אם צריך לעבוד במישור של צמתי adherens. - להזיז את נקודת האמצע של צומת היעד על מיקום השמנה (ציון דרך להגדיר בשלב 4.1.14) באמצעות השלב piezo.
- להגדיר את הפרמטרים מלכודת כדי להשיג את תנודות בניצב לקו ליצירת קשר. הגדר את שלבי כאפס. להגדיר את amplitudes ב X Y כיוונים יש תנועה בניצב לקו ליצירת קשר. משרעת בדרך כלל צריך להיות 0.1 V.
- התחל הרכישה (עם קצב מהיר מסגרות, כגון 10 fps).
- . הפעילי את מלקחיים אופטיים לחיצה על כפתור push "Generating!"
- כאשר תסיים, כבה את רכישת התמונה פינצטה ולהפסיק. סרט, קובץ טקסט המכיל גלוונומטר המתחים במהלך רכישת עכשיו אמור להופיע בתיקייה שצוינה.
- השמנה אנשי הקשר תא — משיכה-שחרור (איור 6)
- למצוא את המיקום של עניין בתוך הרקמה.
- העבר את צומת היעד באמצעות השלב piezo כך האמצע שלה היא בדרך כלל 1 מיקרומטר מן המיקום השמנה (ציון דרך להגדיר בשלב 4.1.14).
- הגדר את amplitudes 0 יש מלכודת יציב.
- התחל את רכישת התמונה (עם קצב מהיר מסגרות, כגון 10 fps).
- . הפעילי את מלקחיים אופטיים לחיצה על כפתור push "Generating!"
- לאחר הזמן המבוקש, כבה את המלכודת ולחכות הרפיה להתרחש.
- להפסיק את ייבוא תמונות. סרט, קובץ טקסט המכיל גלוונומטר המתחים במהלך רכישת עכשיו אמור להופיע בתיקייה שצוינה.
- למצוא את המיקום של עניין בתוך הרקמה.
-
דור kymograph חצי אוטומטי וזיהוי של העמדה ממשק.
- בחלון הפקודה Matlab, טעינת המפה אינטרפולציה שנוצר במהלך ההליך כיול (4b): load('convertFct.mat'). פעולה זו מספקת את המשתנים fx ו שנות כספים.
- בחלון הפקודה Matlab, להפעיל את autokymo(fx,fy), סיפק בקבצי קוד Matlab. המטרה של פונקציה זו היא לייצר את kymograph לאורך המסלול לייזר, וכדי לזהות את המיקום של קו קשר עם רזולוציה subpixel לכל מסגרת.
- בחר נתיב הקובץ טקסט ומתבקש המכילה את הערכים מתח.
- בחר את המספרים המסגרת הראשונה והאחרונה של הסרט כדי להיות מנותח.
- בחר את קובץ הסרט tiff. יוצגו שתי דמויות חדשות: הראשון הוא תמונה של kymograph. השני הוא גרף של הזיהוי של קשר קו ולייזר העמדות, לעומת מספר תמונות.
הערה: הפונקציה שומרת על הגרף המייצג את המיקום של המדגם ואת המיקום של הלייזר לעומת מספר תמונות (איור matlab, jpg), את kymograph (תמונה tiff), את kymograph עם העמדה לייזר (תמונה tiff). לניסויים השמנה קבועה, kymograph חייב להיעשות באופן ידני, למשל באמצעות ImageJ. זיהוי הממשק kymograph ואז ניתן לעשות שימוש באותו האלגוריתם.
7. מדידות מכניות
-
מדידות נוקשות ועל מתח
- לבצע ניסוי תנודה (שלב 6.1) וניתוח המתאים (שלב 6.3) של הסרט זמן לשגות.
- להתוות את המיקום ממשק
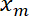 כפונקציה של העמדה מלכודת
כפונקציה של העמדה מלכודת 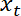 שימוש בפונקציה מגרש Matlab או תוכנה גרפית כלשהי.
שימוש בפונקציה מגרש Matlab או תוכנה גרפית כלשהי.
הערה: זה יהיה בקירוב לינארי. - לבצע פונקציה קווית מתאים, באמצעות Matlab "ezfit" ארגז כלים חינם או כל תוכנה המאפשר מתאים. ההופכי של השיפוע של fit מספקת היחס הממוצע
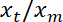 .
. - ביצוע הערכות של נוקשות כיפוף לכאורה של הממשק, אשר, בהנחה דפורמציות קטן ריבועית עם פוטנציאל להשמנה, ניתנת על ידי
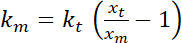 .
. 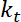 הוא הקשיחות השמנה (ראה שלב 8 לצורך כיול קשיות מלכודת).
הוא הקשיחות השמנה (ראה שלב 8 לצורך כיול קשיות מלכודת). - לבצע הערכות של מתח, אשר יכולה להיות מוגדרת כ-23:
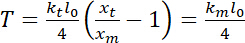 .
.
-
מדידות rheological
- לבצע משיכה שחרור ניסויים (שלב 6.2) וניתוח המתאים (שלב 6.3)
- מתאים העקומה המתקבלת עם המודל rheological מותאם אישית.
8. כיול של הקשיחות מלכודת
הערה: הקביעה של כוחות מוחלטת מחייבת את הידע של הקשיחות מלכודת בממשקים. זה ניתן לגשת באמצעות חרוזים דרך תהליך בן שני שלבים.
-
קביעת צמיגות ציטוזול
- מקם את העוברים בשמן halocarbon, להזריק אותם באמצעות מלכודת microinjection עם חרוזי פוליסטירן פלורסנט (1:1, 000 דילול מניות, קוטר 0.46 מיקרומטר)23,27.
- מקם את העוברים שהוחדר מתחת למיקרוסקופ.
- מסלול התנועה של חרוזים בודדים נמצאו ציטוזול. תמצית העקירה ממוצע הריבועים של חרוזים (להשתמש מספר רב של מסלולים > 100 חרוזים). לקבוע את קבוע דיפוזיה חרוז מן המדרון של העקירה ממוצע הריבועים. הנוגעים קבוע דיפוזיה צמיגות באמצעות המשוואה סטוקס-איינשטיין, להסיק את צמיגות יעיל ציטוזול. העובר מוקדם, צמיגות של 3.5 Pa.s הוא דיווח23.
-
קביעת השמנה נוקשות על חרוזים
- השמנה חרוזי יחיד ציטוזול עם מלקחיים אופטיים.
- לעבור החרוז אופנה stepwise בין שתי עמדות מלכודת המופרדות על-ידי 0.5 מיקרומטר
- לקבוע את הקשיחות השמנה על חרוזים, כיחס בין את מקדם החיכוך בזמן רגיעה חרוז מהמיקום מלכודת אחת לאחרת.
הערה: מקדם החיכוך הוא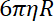 , איפה
, איפה 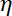 הוא צמיגות נקבע (8.1),
הוא צמיגות נקבע (8.1), 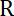 רדיוס חרוז. בזמן רגיעה המתקבל מתאים האקספוננציאלי של התנוחה חרוז באמצעות Matlab או כל תוכנה המאפשר מתאים. הערכים הטיפוסי של הקשיחות מלכודת הם 120 pN.µm ±50-1 ב 200 mW לייזר עירור.
רדיוס חרוז. בזמן רגיעה המתקבל מתאים האקספוננציאלי של התנוחה חרוז באמצעות Matlab או כל תוכנה המאפשר מתאים. הערכים הטיפוסי של הקשיחות מלכודת הם 120 pN.µm ±50-1 ב 200 mW לייזר עירור.
-
קביעת השמנה נוקשות בממשק תא
- להתמקד הלייזר קו קשר, להסיט אותו (כמפורט בשלב 6). למדוד את משרעת דפורמציה. זה יש לחזור על מספר קווי קשר כדי לקבל ממוצע של נציג.
- השווה להרכב המיוצר עם זה המושרה על ידי חרוזים דחף כנגד קווי קשר. מאז להרכב הוא ביחס הפוך ל הקשיחות מלכודת, להסיק הקשיחות מלכודת תא רשומות אנשי קשר.
הערה: הקשיחות השמנה על אנשי קשר תא בדרך כלל נמצא 2 - ל 3 פי קטן יותר מזה על חרוזים (0.46 מיקרומטר קוטר).
תוצאות
איור 5 מציג נתונים ניסיוני מתקבל על ידי הטלת תנועה sinusoidal למלכודת. ההשמנה מייצרת אפשרות סטיה של הממשק, למשל, הצילומים 3 מציג ממשק רצופים 3 עמדות (איור 5A)23. סרטים מוקלטים משמשים כדי ליצור את kymograph (איור 5B), עוד ניתוח ?...
Discussion
מלקחיים אופטיים מאפשרים לבצע מדידות מכניות מוחלטת ישירות בתוך האפיתל מתחלקים המתפתח בצורה לא פולשנית. במובן הזה, הוא מציג יתרונות על פני שיטות אחרות כגון אבלציה לייזר, אשר הינם פולשניים, לספק יחסי מדידות, כוחות מגנטיים, אשר דורשים זריקות, או להכריח היסק, אשר נשענת על הנחות חזק גם לספק יחסי ?...
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי עקרות Equipe גרנט עקרות DEQ20130326509, סוכנות הידיעות נאסיונאל דה לה רשרש גרנט ANR-בלאן, Morfor ANR-11-BSV5-0008 (ל פ-F.L.). אנו להכיר תשתית צרפת-BioImaging הנתמכים על ידי הצרפתי הלאומי לחקר הסוכנות (ANR-10-INBS-04-01, «השקעות לעתיד»). אנו מודים Brice Detailleur ו קלוד מורטי מן התשתית PICSL-בי-איי לקבלת סיוע טכני.
Materials
| Name | Company | Catalog Number | Comments |
| Ytterbium Fiber Laser LP, 10 W, CW | IPG Laser | YLM-10-LP-SC | including collimator LP : beam D=1.6 mm and red guide laser |
| Ø1/2" Optical Beam Shutter | Thorlabs | SH05 | |
| Small Beam Diameter Galvanometer Systems | Thorlabs | GVS001 | 1 for X displacement, 1 for Y displacement |
| 1D or 2D Galvo System Linear Power Supply | Thorlabs | GPS011 | galvanometers power supply |
| 2 lenses f = 30mm | Thorlabs | LB1757-B | relay telescope between 2 galva |
| Lens f = 200mm | Thorlabs | LB1945-B | 2.5X telescope |
| Lens f = 500mm | Thorlabs | LB1869-B | 2.5X telescope |
| Right-Angle Kinematic Elliptical Mirror Mount with Tapped Cage Rod Holes | Thorlabs | KCB1E | Periscope |
| Laser Safety Glasses, Light Green Lenses, 59% Visible Light Transmission, Universal Style | Thorlabs | LG1 | |
| 45° AOI, 50.0mm Diameter, Hot Mirror | Edmund Optics | #64-470 | |
| Multiphoton-Emitter HC 750/S | AHF | HC 750/SP | |
| CompactDAQ Chassis | National Instruments | cDAQ-9178 | |
| C Series Voltage Output Module | National Instruments | NI-9263 | Analog output module |
| C Series Voltage Input Module | National Instruments | NI-9215 | Analog input module |
| FluoSpheres Carboxylate-Modified Microspheres, 0.5 µm, red fluorescent (580/605), 2% solids | ThermoFisher Scientific | F8812 | calibration beads |
| C++ (Qt) home made optical tweezers software | developed by Olivier Blanc and Claire Chardès. Alternative solution: labview |
References
- Lecuit, T., Lenne, P. -. F., Munro, E. Force generation, transmission, and integration during cell and tissue morphogenesis. Annual review of cell and developmental biology. 27 (1), 157-184 (2011).
- Heisenberg, C. -. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Sugimura, K., Lenne, P. -. F., Graner, F. Measuring forces and stresses in situ in living tissues. Development. 143 (2), 186-196 (2016).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in cell & developmental biology. 55, 119-130 (2016).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. Journal of Cell Biology. 149 (2), 471-490 (2000).
- Farhadifar, R., Roper, J. C., Aigouy, B., Eaton, S., Julicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Rauzi, M., Verant, P., Lecuit, T., Lenne, P. F. Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nature Cell biology. 10 (12), 1401-1410 (2008).
- Ma, X., Lynch, H. E., Scully, P. C., Hutson, M. S. Probing embryonic tissue mechanics with laser hole drilling. Physical Biology. 6 (3), 036004 (2009).
- Hutson, M. S., Tokutake, Y., et al. Forces for morphogenesis investigated with laser microsurgery and quantitative modeling. Science. 300 (5616), 145-149 (2003).
- Bonnet, I., Marcq, P., Bosveld, F., Fetler, L., Bellaïche, Y., Graner, F. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface / the Royal Society. 9 (75), 2614-2623 (2012).
- Etournay, R., Popović, M., et al. Interplay of cell dynamics and epithelial tension during morphogenesis of the Drosophila pupal wing. eLife. 4, e07090 (2015).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current topics in developmental biology. 95, 93-144 (2011).
- Saha, A., Nishikawa, M., Behrndt, M., Heisenberg, C. -. P., Jülicher, F., Grill, S. W. Determining Physical Properties of the Cell Cortex. Biophysical journal. 110 (6), 1421-1429 (2016).
- Desprat, N., Supatto, W., Pouille, P. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental cell. 15 (3), 470-477 (2008).
- Mitrossilis, D., Röper, J. -. C., et al. Mechanotransductive cascade of Myo-II-dependent mesoderm and endoderm invaginations in embryo gastrulation. Nature Communications. 8, 13883 (2017).
- Campàs, O., Mammoto, T., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2013).
- Serwane, F., Mongera, A., et al. In vivo quantification of spatially varying mechanical properties in developing tissues. Nature Methods. 14 (2), 181-186 (2017).
- Chiou, K. K., Hufnagel, L., Shraiman, B. I. Mechanical stress inference for two dimensional cell arrays. PLoS computational biology. 8 (5), e1002512 (2012).
- Ishihara, S., Sugimura, K. Bayesian inference of force dynamics during morphogenesis. Journal of theoretical biology. 313, 201-211 (2012).
- Brodland, G. W., Veldhuis, J. H., Kim, S., Perrone, M., Mashburn, D., Hutson, M. S. CellFIT: a cellular force-inference toolkit using curvilinear cell boundaries. PLoS ONE. 9 (6), e99116 (2014).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23, 247-285 (1994).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. -. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences of the United States of America. , (2015).
- Clément, R., Dehapiot, B., Collinet, C., Lecuit, T., Lenne, P. -. F. Viscoelastic Dissipation Stabilizes Cell Shape Changes during Tissue Morphogenesis. Current biology: CB. 27 (20), (2017).
- Chardès, C., Ménélec, P., Bertrand, V., Lenne, P. -. F. Setting-up a simple light sheet microscope for in toto imaging of C. elegans development. Journal of visualized experiments. 87, e51342 (2014).
- Serge, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nature Methods. 5 (8), 687-694 (2008).
- Cavey, M., Lecuit, T. Imaging Cellular and Molecular Dynamics in Live Embryos Using Fluorescent Proteins. Drosophila. 420, 219-238 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved