Method Article
Jeringa inyectable malla electrónica para electrofisiología roedor crónico estable
En este artículo
Resumen
Malla electrónica sondas perfectamente integraran y proporcionan nivel estable, a largo plazo, solo-neurona grabación dentro del cerebro. Este protocolo utiliza malla electrónica para los experimentos en vivo , que implica la fabricación de la malla electrónica, carga en agujas, inyección estereotáctica, interfaces de entrada/salida, experimentos de la grabación y la histología del tejido con malla puntas de prueba.
Resumen
Puntas de prueba de electrofisiología cerebral implantable son herramientas valiosas en Neurociencia debido a su capacidad para grabar actividad neuronal con alta resolución espaciotemporal de regiones someras y profundas del cerebro. Su uso ha sido obstaculizado, sin embargo, por desajustes mecánicos y estructurales entre las sondas y cerebro tejido que comúnmente conducen a micromotion y gliosis con que señal de inestabilidad en los experimentos de grabación crónica. En contraste, después de la implantación de la ultraflexible malla electrónica vía la inyección de la jeringa, la malla de sondeos forma una interfaz transparente, libre de gliosis con el tejido de cerebro circundante que permite seguimiento estable de neuronas individuales en al menos un año escala de tiempo. Este detalles de protocolo los pasos clave en un experimento de grabación neuronal de ratón típico usando jeringa inyectable malla electrónica, incluyendo la fabricación de la malla electrónica en un estándar Fotolitografía proceso posible en muchas universidades, carga malla electrónica en agujas capilares estándar, inyección estereotáctica en vivo, conexión de la malla de entrada/salida para interfaces de instrumentación estándar, refrenados o mover libremente las sesiones de grabación e histológica de secciones del cerebro que contiene el tejido de malla electrónica. Se presentan grabaciones representativas de nervios y datos de la histología. Investigadores familiarizados con este protocolo tendrá los conocimientos necesarios para incorporar malla electrónica en sus propios experimentos y tomar ventaja de las oportunidades únicas que ofrece interconexión neuronal estable a largo plazo, tales como estudios de envejecimiento procesos, el desarrollo del cerebro y la patogenesia de la enfermedad cerebral.
Introducción
El desarrollo de herramientas capaces de cartografiar el cerebro con una resolución de la solo-neurona es de importancia central a la neurociencia y Neurología. Tecnologías no invasivas estudios neuronales tales como electroencefalografía (EEG) y magnetoencefalografía (MEG) la proyección de imagen de resonancia magnética funcional (fMRI) han demostrado ser valiosos para correlacionar actividad cerebral con el comportamiento de los seres humanos1, 2, pero falta la resolución espacio-temporal necesaria para estudiar la estructura y dinámica de redes neuronales en sus fundamental micrómetro y milisegundo escalas, respectivamente3,4. Cierta electrocorticography (ECoG) sondas y métodos de proyección de imagen ópticos con colorantes sensibles a la tensión han logrado en la grabación de una sola unidad spiking actividad en vivo5,6, pero son generalmente eficaces sólo cerca de la superficie del cerebro, limita la aplicabilidad a los estudios de regiones superficiales del cerebro. Por el contrario, sondeos eléctricos implantables pueden medir solo-neurona electrofisiología libremente pasar animales de prácticamente cualquier región del cerebro sin necesidad de etiquetado fluorescente, haciendo imprescindible a nivel de sistemas de neurociencia, sobre todo como técnicas de microfabricación de la industria de semiconductores han llevado cantidad de canales en los cientos y miles3,7,8,9. En virtud de estas capacidades, sondeos eléctricos implantables han hecho muchas contribuciones importantes a la neurociencia y Neurología, incluyendo estudios fundamentales de procesamiento en el sistema visual10, el tratamiento neurológico de la información trastornos como la enfermedad de Parkinson11y la demostración de las interfaces cerebro-máquina (IMC) para prótesis avanzada12,13.
Sin embargo, la inestabilidad a largo plazo que se manifiesta como disminución de las amplitudes de pico y señales inestables en escalas de tiempo de semanas a meses14,15 ha limitado la aplicabilidad de sondas implantables para el estudio de relativamente a corto plazo fenómenos, dejando cuestiones como el desarrollo y el envejecimiento del cerebro en gran medida sin respuesta. Las limitaciones en la inestabilidad a largo plazo son el resultado de un desajuste entre las sondas convencionales y tejido cerebral en tamaño, mecánica y topología14,15,16,17,18. En términos de tamaño, mientras que las sinapsis neuronales y Somas son aproximadamente de decenas de nanómetros a decenas de micrómetros en diámetro19, respectivamente, las puntas de prueba tradicionales son a menudo significativamente mayores, en el caso de arreglos de microelectrodos de silicio > 4 veces el tamaño de una sola neurona cuerpo celular7,8. El relativamente gran tamaño de estas puntas de prueba puede afectar la estructura y Conectividad del denso tejido neural, así contribuyendo a la respuesta inmune crónica y perturbando los circuitos neuronales que están estudiando. En cuanto a propiedades mecánicas, las puntas de prueba tradicionales son drásticamente más rígidos que el tejido neural muy suave en el que se implantan; incluso «flexible» de 10 – 20 μm espesor láminas de poliimida son al menos 100.000 veces más rígido que el cerebro tejido20,21. Este desajuste en la rigidez de flexión hace esquileo relativo movimiento entre la sonda y el cerebro tejido, llevando a poco fiables de una sola unidad seguimiento durante grabaciones extendidas e induciendo crónica gliosis en el sitio de implantación. Por último, la estructura topológica de las sondas convencionales cerebro excluye necesariamente un volumen sólido del tejido. Tal desajuste en topología interrumpe la conectividad de los circuitos neuronales, impide la distribución interpenetrada (3D) tridimensional natural de las neuronas, células gliales y vasos sanguíneos dentro del tejido de cerebro22y dificulta el transporte 3D de señalización de moléculas23. Juntos, estos defectos de las sondas convencionales han hecho están destituidos de la compatibilidad a largo plazo para aplicaciones clínicas y los estudios de Neurociencia longitudinal en el plano de la solo-neurona.
Para superar estas deficiencias, se intentó difuminar la línea entre los sistemas neuronales y electrónicas mediante el desarrollo de un nuevo paradigma de "tejido-como" sondas neuronales denominado malla electrónica16,21,24. Malla electrónica aborda los problemas que arriba en tamaño, mecánica y topología incorporando características (1) estructurales de la misma nanómetro a escala de tamaño micrométrico de tejido neural, (2) mecánicas similares a las de tejido cerebral y (3) 3D topología de macroporoso que es > 90% espacio abierto y así acomoda la interpenetración de las neuronas y la difusión de moléculas a través del ambiente extracelular. Malla electrónica sondas pueden entregarse precisamente a las regiones específicas del cerebro a través de una jeringa y una aguja, que causa mínimo daño agudo al implantar incluso en regiones de cerebro profundo21,25. Axones y soma neuronal se ha demostrado que se interpenetran la estructura de punta de prueba electrónica abierta con malla 3D dentro de semanas después de la inyección, creando una interfaz transparente, libre de gliosis entre grabación electrónica y alrededor del tejido de cerebro21 , 26 , 27. estas características únicas han permitido malla electrónica sondas rastrear estable actividad clavaba de las mismas neuronas individuales en al menos un año de plazo27. Por otra parte, la fabricación de la electrónica de malla basada en Fotolitografía (PL) proporciona alta escalabilidad del número de electrodos que pueden ser incorporados, con canal demostrado cuenta hasta 128 electrodos por sonda mediante litografía simple mascarilla contacto 28 y un diseño de (E/S) de entrada/salida de plug-and-play que permite la rápida conexión eléctrica electrónica periférica sin equipo especializado29.
Una amplia gama de estudios puede beneficiarse incorporando malla electrónica en protocolos de medición. Mayoría de grabación intracortical los experimentos podría beneficiarse del procedimiento de implantación mínimamente invasiva malla electrónica vía la inyección de la jeringa, la respuesta inmune drásticamente reducida después de la implantación, y la capacidad de dejar de malla electrónica en la tejido durante la histología subsecuente y el immunostaining para el análisis preciso del ambiente biológico alrededor de cada sitio de grabación. Experimentos de grabación crónica en particular serán obtener el valor de la capacidad única de la malla electrónica para seguimiento de gran número de neuronas individuales por meses o años. Esta capacidad crea oportunidades de estudios con la resolución de la solo-neurona que fueron previamente impráctico, tales como estudio longitudinal de envejecimiento de circuitos neuronales, las investigaciones del cerebro en desarrollo y consultas en la patogenesia de encefalopatías transmisibles16.
En este protocolo, describimos todos los pasos de la llave en un experimento de grabación neuronal de ratón típico usando jeringa inyectable malla electrónica (véase figura 1). Pasos descritos incluyen la fabricación de la malla electrónica en un posible proceso de PL estándar en muchas universidades, cargar malla electrónica en agujas capilares estándar, inyección estereotáctica de malla electrónica en vivo, respecto de la interfaces estándar de instrumentación, las sesiones de grabación restringida o libremente móvil y secciones histológicas del tejido de cerebro que contienen malla electrónica del acoplamiento I/O. Algunos investigadores usando malla electrónica sólo para estudios de histología no requieran interfaces eléctricos y de grabación, en cuyo caso pueden omitir estos pasos. Después de familiarizarse con este protocolo, los investigadores deben tener todos los conocimientos necesarios para utilizar malla electrónica en sus propios experimentos.
Protocolo
Todos los procedimientos realizados en sujetos animales vertebrados fueron aprobados por el institucional cuidado Animal y el Comité uso (IACUC) de la Universidad de Harvard.
1. fabricación de la malla electrónica
Nota: El procedimiento descrito en esta sección debe usarse dentro de una instalación de sala limpia Universidad estándar, como el centro para sistemas a nanoescala (CNS) en la Universidad de Harvard. Esta instalación, así como instalaciones similares son accesibles para usuarios externos en los Estados Unidos, por ejemplo, como parte de la red de infraestructura de nanotecnología nacional (NNIN) apoyado por la National Science Foundation (NSF). En estas instalaciones, muchas de las herramientas, equipos y materiales descritos en esta sección se proporcionan junto con el acceso a las instalaciones de sala limpia y no requiere compra por separado.
PRECAUCIÓN: Muchos de los productos químicos utilizados en la fabricación de la malla electrónica son peligrosos, como resiste, CD-26, removedor PG, SU-8 desarrollador, Ni solución de la aguafuerte. Consulte las hojas de datos de seguridad de materiales (MSDS) para estos productos químicos antes de usar y aplicar y seguir las medidas de seguridad adecuadas en todo momento.
- Térmicamente se evaporan 100 nm de Ni sobre una oblea de Si limpiarla.
Nota: Parámetros de deposición típica son presión base de 5 x 10-7 T y tasa de 1 – 2 Å/s. La fina capa de Ni sirve como una capa sacrificial que se disolverá más adelante para liberar la malla electrónica de la oblea. - Utilice la primera máscara de PL (máscara de PL-1) para definir el fondo pasivado de capa de la malla electrónica con SU-8 photoresist negativo (figura 2A).
Nota: PL es una técnica de microfabricación estándar en que luz ultravioleta (UV) es brilló en una máscara que se llevó a cabo sobre un sustrato fotosensible. Luz o hace insoluble (resistencia negativa) o soluble (resistente a positivo) las zonas expuestas sobre el sustrato. Las máscaras son dibujadas en software de diseño asistido por ordenador y ordenó entonces por lo general de un vendedor. Un alineador de máscara se utiliza para alinear máscaras a patrones existentes en un substrato y exponerlos a la luz UV. Fabricación de la malla electrónica requiere cuatro diferentes máscaras (máscara PL-1 a través de la máscara de PL-4). Nuestros diseños de la máscara están disponibles por solicitud o desde el sitio de recursos, meshelectronics.org.- Spin-capa SU-8 2000.5 photoresist negativo sobre la oblea a 4.000 rpm para un espesor aproximado de SU-8 de 400-500 nm.
- Cocer al horno suave la oblea sobre una placa durante 1 min a 65 ° C seguido de 1 min a 95 ° C.
- Cargar la oblea en un alineador de máscara para exponer SU-8 con máscara de PL-1 correspondiente a la capa inferior de malla SU-8. Exponga a una dosis de i-line (longitud de onda 365 de nm) de 100 mJ/cm2.
- Puesto cueza al horno la oblea sobre una placa durante 1 min a 65 ° C seguido por 1 min a 95 ° C.
- Sumerja la oblea en una bandeja del revelador de SU-8. Frote suavemente la solución por 2 minutos hasta que el patrón de malla en el SU-8 ha sido completamente desarrollado. Enjuagar en una bandeja de alcohol isopropílico por 1 min y golpe seco.
- Duro, cueza al horno la oblea en la placa caliente a 180 ° C durante 1 hora.
Nota: SU-8 cuesta normalmente al horno entre 150 ° C y 250 ° C después de desarrollo. El duro cuece al horno recuece cualquier grieta en la superficie que se puede formar durante el desarrollo y vínculos cruzados más la SU-8 para asegurar la estabilidad mecánica. Duro para hornear a 180 ° C para la capa inferior de SU-8 y 190 ° C para la parte superior capa SU-8 rinde buenos resultados para la malla electrónica.
- Interconexiones de use PL máscara-2 definir metal y placas de I/O (figura 2B).
- LOR3A capa Spin sobre la oblea a 4000 rpm para un grosor aproximado de 300 nm.
Nota: LOR3A es un polydimethylglutarimide basado en resistir que velocidades socavando durante el procedimiento de metalización posterior. - Cueza al horno la oblea en la placa caliente a 180 ° C durante 5 minutos.
- Spin-capa S1805 photoresist positivo a 4000 rpm para un espesor aproximado de 500 nm.
- Cueza al horno la oblea en una placa caliente a 115 ° C durante 1 minuto.
- Cargar la oblea en un alineador de máscara a exponer S1805 con máscara de PL-2 correspondiente al metal interconecta y almohadillas de I/O. Exponga a una dosis de la línea h (longitud de onda 405 de nm) de 40 mJ/cm2.
- Sumerja la oblea en una bandeja de CD-26 fotoresistencia desarrollador. Frote suavemente la solución por 1 minuto hasta que el metal interconecta patrón ha sido completamente desarrollado. Enjuague en una bandeja de agua desionizada (DI) durante 1 min y golpe seco.
- Térmicamente se evaporan 3 nm de Cr seguido de 80 nm de Au.
Nota: Una presión base de a más 5 x 10-7 T y tasa de deposición de 1 Å/s típicamente producen la mejor calidad de la película. - Sumerja la oblea en un vaso plano de removedor de PG de aproximadamente 3 h hasta que el metal ha socavado completamente, dejando el metal sólo en las regiones de almohadilla de I/O de la malla electrónica e interconexión deseada. Enjuague en alcohol isopropílico y golpe seco.
- LOR3A capa Spin sobre la oblea a 4000 rpm para un grosor aproximado de 300 nm.
- Usar máscara de PL-3 definir electrodos de Pt (figura 2).
- Repita los pasos 1.3.1 a través de 1.3.4.
- Cargar la oblea en el alineador de máscara para exponer la S1805 con máscara de PL-3 correspondiente a los electrodos de Pt. Exponga a una dosis de la línea h de 40 mJ/cm2.
- Sumerja la oblea en una bandeja de CD-26 fotoresistencia desarrollador. Frote suavemente la solución durante 1 minuto hasta que el patrón de los electrodos de Pt se ha desarrollado completamente. Enjuagar en una bandeja de DI de 1 min y golpe seco.
- Utilizar un evaporador de haz de electrones al depósito 3 nm de Cr seguido de 50 nm de Pt.
Nota: Parámetros de deposición típicos son una presión base de 5 x 10-7 T y la frecuencia de 2 Å / s. - Sumerja la oblea en un vaso plano de removedor de PG de aproximadamente 3 h hasta que el metal ha socavado completamente, dejando el Pt sólo en los sitios de electrodo deseada de la red electrónica. Enjuague en alcohol isopropílico y golpe seco.
- Utilice máscara de PL-4 para definir la parte superior pasivado de capa de la malla electrónica con SU-8 photoresist negativo (Figura 2D).
- Repita los pasos 1.2.1 a través de la 1.2.5, excepto exponer con máscara de PL-4 correspondiente a la capa superior de la malla de apaciguamiento de SU-8.
- Duro, cueza al horno la oblea en la placa caliente a 190 ° C durante 1 hora.
Nota: Esta temperatura es 10 ° C más alta que para el duro cuece al horno de la parte inferior SU-8 (paso 1.2.6). Esta elevada temperatura ligeramente ajusta la parte inferior SU-8, haciendo que se funden con la capa superior de SU-8 y así formar una sola estructura continua SU-8.
- Malla electrónica están ahora completos (Figura 2E y figura 3); liberarlas de la oblea de Si disolviendo la capa sacrificial Ni.
- Tratar la oblea con plasma de oxígeno 50 W durante 1 minuto. Esto oxida la superficie de SU-8, lo que es hidrofílico y permitiendo la malla ser fácilmente suspendido en una solución acuosa.
- En un recipiente plano, combinan ácido clorhídrico, cloruro férrico y DI en una proporción volumétrica de 1:1:20, respectivamente, para hacer una solución de reactivo Ni.
- Sumerja la oblea en un recipiente plano de la solución de reactivo Ni para aproximadamente 3 h hasta que la malla electrónica totalmente ha sido liberada de la oblea de Si.
- Utilice una pipeta Pasteur transferir la malla lanzada sondas electrónica de grabador Ni un vaso de precipitados de 100 mL de DI. Transferir la malla electrónica a un vaso de fresco de DI por lo menos 3 veces para enjuagar.
- Utilice una pipeta Pasteur transferir la malla electrónica a una solución de 70% / 30% etanol/agua para la desinfección, luego use la pipeta para transferir la malla electrónica al agua estéril para enjuagar.
Nota: Después de la esterilización, la malla electrónica puede transferirse a otras soluciones para la funcionalización. Por ejemplo, para promover la adhesión celular, la malla electrónica puede transferirse a una solución acuosa de poly-D-lisina (1 mg/mL) durante 24 h. - Uso una pipeta Pasteur transferir la malla electrónica sondas un vaso de precipitados de 100 mL de fosfato estéril 1 x tampón salino (PBS) antes de la inyección en vivo.
2. carga de la malla electrónica en agujas
- El titular de pipeta como comprada es abierto en ambos extremos del flujo. Selle el extremo opuesto el sujetador de tornillo redondo con resina epóxica, por lo que no hay fugas durante la inyección (Figura 4A). Que el epóxico endurezca antes de proceder.
- Inserte una aguja capilar de vidrio en el soporte de la pipeta. Fijarlo con el tornillo de apriete redondo y arandela cónica (Figura 4B). Se utiliza una 400 μm diámetro interior (diámetro externo de 650 μm) vidrio capilar aguja de este protocolo. Otros materiales de aguja capilar (e.g., metal) y diámetros pueden utilizarse pero podrían requerir cambios en el diseño de la malla electrónica para inyectabilidad.
Nota: Las agujas capilar desde 150 μm hasta 1,17 mm de diámetro interior (250 μm a 1,5 mm de diámetro externo) se han utilizado en nuestro laboratorio. Inyección a través de agujas más pequeñas puede ser promovida por haciendo el ángulo de intersección entre los elementos de acoplamiento de SU-8 transversales y longitudinales más agudos, disminuyendo la anchura de los elementos de la malla de SU-8, con SU más delgado-8 y usando un más grueso (es decir., celda más grande) estructura de malla. Patrones de mallas diseñadas para pequeñas agujas capilares están disponibles por solicitud o desde el sitio de recursos, meshelectronics.org. Agujas capilares de vidrio con un diámetro interior de 400 μm y diámetro exterior de 550 μm están también disponibles comercialmente. Estos reducen el daño de tejido aguda causado por la inyección mientras que mantiene la compatibilidad con mallas que requieren 400 μm de diámetro interno, pero no fueron utilizados para los estudios descritos aquí. - Conecte una jeringa de 1 mL a la salida del titular de la pipeta con una longitud de 2-4 cm de tubo capilar.
- Inserte la aguja capilar de vidrio en el vaso de precipitados de 100 mL de PBS con la malla electrónica. Coloque el extremo de la aguja cerca de los topes de I/O de una malla electrónica probe y retrae manualmente la jeringa para extraer una sonda electrónica de malla dentro de la aguja (figura 5 y complementario 1 de Video).
Nota: Los pads de I/O, vástago interconectar región y región del dispositivo de acoplamiento son fácilmente identificables por el ojo desnudo las malla electrónica sondas suspendidas en solución. Esto permite cargar sin ambigüedades de la malla electrónica las agujas con la orientación correcta. - Empuje/tire el émbolo de la jeringa mientras sigue inmerso en una solución salina para ajustar la posición de la malla electrónica dentro de la aguja.
Nota: Posición Ideal es con la malla ultraflexible dispositivo región cerca de la punta de la aguja como sea posible. Esta configuración reduce al mínimo el volumen de líquido que se inyecta en el cerebro al mismo tiempo garantizando que la región dispositivo se inyecta primero y las almohadillas de I/O última. - Separar con cuidado el tubo capilar de la salida del titular de la pipeta. Separe lentamente para evitar la creación de una fuerza de succión que podría alterar la posición de la malla electrónica dentro de la aguja.
3. estereotáxicas inyección de malla electrónica en cerebro de ratón vivo
Nota: Los ratones fueron anestesiados por inyección intraperitoneal con una mezcla de 75 mg/kg ketamina y 1 mg/kg de dexdomitor. El grado de anestesia fue verificado con el método del pellizco del dedo del pie antes de comenzar la cirugía. Temperatura corporal fue mantenida colocando el ratón sobre una manta homeotérmicos de 37 ° C mientras que bajo anestesia. Se implementó una técnica aséptica adecuada para la cirugía, incluyendo pero no limitado a autoclave todo metal instrumentos quirúrgicos para 1 h antes de su uso, utilizando guantes esterilizados, utilizando un esterilizador de bolas calientes a lo largo de la cirugía, el mantenimiento de un campo estéril alrededor del sitio quirúrgico, la desinfección de instrumentos de plástico con etanol al 70% y el cuero cabelludo depilado piel fue preparada con yodoforo antes de la incisión. Para las cirugías de sobrevivencia, después de la conclusión de la cirugía, ejemplo el ungüento se aplicó alrededor de la herida, y el ratón volvió a una jaula equipada con a 37 ° C cojín de calefacción. Ratones no quedaron sin vigilancia hasta que había recuperado la conciencia suficiente para mantener el recumbency esternal. Ratones recibieron analgesia de buprenorfina vía inyección intraperitoneal a dosis de 0,05 mg/kg de peso corporal cada 12 h hasta 72 h después de la cirugía. Ratones fueron aislados de otros animales después de la cirugía. Ratones fueron sacrificados o inyección intraperitoneal de pentobarbital en dosis de 270 mg/kg de peso corporal o mediante perfusión de transcardial (ver paso 6.1). Los investigadores pueden referirse a Geiger, et al. 30, Kirby, et al. 31y Gage, et al. 32 para más detalles sobre roedor cirugía estereotáctica.
- Anestesiar el ratón y colocarlo en un marco de estereotáctica.
- Aplicar lubricante ocular en ojos de ratón para prevenir sequedad mientras que bajo anestesia.
- Utilice un taladro dental y marco estereotáctica para abrir una craneotomía en las coordenadas deseadas en el cráneo. Abra una segunda craneotomía lejos del sitio de la inyección para la inserción de un tornillo de puesta a tierra de acero inoxidable o alambre.
- Fijar un sustrato de fijación al cráneo con cemento dental. Corte una amplia brecha de aproximadamente 1 mm en el sustrato para mejorar la fiabilidad de la plegable paso más adelante en el procedimiento.
Nota: Un cable plano flexible (FFC) corte a una "L" forma funciona bien (Figura 7A), aunque muchos materiales trabajaría como son del espesor correcto para el 32-canal cero conector de force (ZIF) de inserción (diseñada para cables gruesos de 0,18 ± 0,05 mm). - Monte el soporte de la pipeta con la aguja que contiene la malla electrónica en el armazón estereotáctica usando una abrazadera de ángulo recto final (figura 4 y figura 6A).
- Conecte la salida de la titular de la pipeta a una jeringa de 5 mL en una jeringa (figura 6) la bomba utilizando un aproximadamente 0,5 – 1 m de longitud de tubo capilar.
Nota: Asegúrese de que hay no hay burbujas en el tubo capilar antes de conectarlo al titular de la pipeta. Las burbujas pueden interrumpir el flujo durante la inyección y prevenir una entrega suave y controlada de la malla electrónica. - Utilizar el marco estereotáctica para colocar la punta de la aguja en la posición partida deseada dentro del cerebro.
Nota: Las malla electrónica sondas aquí están diseñadas con grabación electrodos extendió sobre una longitud de aprox. 2 mm de espesor y con el primer electrodo situado aprox. 0,5 mm desde el borde inicial de la electrónica de red (borde izquierdo en la Figura 3A). Por esta razón, se deben seleccionar las coordenadas estereotáxicas tales que la ubicación inicial es 0,5 mm más profunda que la región cerebral de interés. La extensión y ubicación de los electrodos de grabación dentro de malla electrónica pueden seleccionarse libremente durante el proceso de diseño de la máscara y deben seleccionarse para que los electrodos de grabación abarcan las regiones cerebrales de interés como se inyecta a lo largo de su estereotáctica trayectoria. - Posición de la cámara (Figura 6B) para mostrar la parte superior de la sonda electrónica de malla dentro de la aguja de vidrio. Un software permite al usuario dibujar una línea en la pantalla para marcar la posición original de la malla electrónica.
- Iniciar el flujo de la bomba de jeringa a una velocidad baja y oprimir Start. 10 mL/h es un caudal típico de partida una 400 μm de aguja capilar de diámetro interior. Poco a poco aumentar la velocidad de flujo si no se mueve la sonda electrónica de malla dentro de la aguja.
Nota: Es importante minimizar el volumen de líquido inyectado en el cerebro ya que puede dañar el tejido que rodea el sitio de inyección. Los mejores resultados se logran con volúmenes de inyección menos de 25 μl por 1 mm de longitud de malla inyectado. Valores ideales son menos de la mitad de este volumen; en nuestro laboratorio, se inyecta típicamente 10-50 μL por una longitud de malla de 4 mm inyectado. - La sonda de malla electrónica empieza a desplazarse la aguja, utilice la estereotáctica para retraer la aguja en la misma proporción con que se se inyecta la sonda electrónica de malla usando la posición original marcada de la malla electrónica como guía.
Nota: Este procedimiento, denominado el método de inyección de campo de visión (FoV) de25, permite precisa entrega de malla electrónica a una región específica del cerebro sin arrugándose o dislocación. A menudo el caudal puede reducirse una vez que la sonda electrónica de acoplamiento comienza moverse dentro de la aguja. En nuestro laboratorio, caudales de 20 a 30 mL/h a menudo se requieren para superar la fricción estática entre la malla y aguja capilar paredes, pero la tasa entonces puede reducirse a 10 mL/h una vez que se ha iniciado el proceso de inyección. Caudales y volúmenes de inyección son generalmente más pequeños para agujas capilar de menor diámetro. - Siguen fluyendo salina y retrayendo la aguja hasta que la aguja ha salido de la calavera. Detener el flujo de la bomba de jeringa.
4. interfaces de entrada/salida de
Nota: en este punto, la sonda electrónica de malla se ha inyectado desde el punto de partida deseado dentro del cerebro a lo largo de la trayectoria solicitada. La aguja ha sido retraída y es justo por encima de la craneotomía con la malla de interconexiones de electrónica que abarca desde el cerebro hasta la aguja y la entrada-salida pastillas dentro de la aguja (figura 7B). Esta sección utiliza una placa de circuito impreso (PWB; Figura 7, figura 8) para la interfaz a la sonda electrónica de malla. El PCB conecta un conector ZIF a un conector de amplificador estándar 32 canales a través de un sustrato aislante que se convierte en el escenario de cabeza para los experimentos de grabación neural. El PCB es personalizable para adaptarse a diversas configuraciones de etapa de cabeza. Nuestros archivos de diseño están disponibles por solicitud o desde el sitio web de recursos, meshelectronics.org y puede usarse para comprar PCB bajo costo de los proveedores de servicios de fabricación y montaje de PCB.
- Utilizar el marco estereotáctica para guiar cuidadosamente la aguja a la FFC sustrato de fijación y a través de la brecha, que fluye la solución con la bomba de jeringa para generar tensión en la malla electrónica interconecta (figura 7).
- Una vez que la aguja está sobre el sustrato de fijación y a través de la brecha, reanudar el flujo a un ritmo rápido para expulsar la malla electrónica cojines I/O sobre el substrato de fijación (figura 7).
- Usando unas pinzas y una pipeta de DI, se doblan los cojines I/O a aprox. ángulo de 90° como cerca de la primera tecla de I/O posible.
Nota: La flexión es necesaria dejar las pastillas ser insertado en el conector ZIF en un PCB en un paso posterior. El conector ZIF es exactamente la misma anchura como las 32 teclas de I/O de la sonda electrónica de malla, un imperfecto 90° curva, o una curva que no está ocurriendo justo antes de la primera tecla I/O, dará lugar a tener que cortar las almohadillas I/O (las teclas de izquierda en la figura 7E). - Una vez que las pastillas de I/O están alineadas, revelado y en un ángulo de 90° a la espiga de acoplamiento, seco en lugar con suavemente que fluye aire comprimen.
Nota: Se interfaza a malla electrónica sondas con menos de 32 canales con la misma tarjeta de interfaz de 32 canales. Por ejemplo, nuestro laboratorio utiliza comúnmente malla 16 canales electrónica sondas con PCB de 32 canales. Esto proporciona un espacio extra en el conector ZIF, facilitando la interconexión y los canales aislados adicionales son fácilmente identificables como circuitos abiertos por medio de impedancia pruebas durante las sesiones de grabación. - Corte del sustrato de fijación con abrazadera en un borde recto aproximadamente 0,5 – 1 mm del borde de las pastillas de I/O. También cortar partes extrañas del sustrato de fijación que le dificultan la inserción en el PCB montado 32 canales ZIF conector (figura 7F).
- Inserte las almohadillas de I/O en el conector ZIF en la placa y cierre el pestillo (figura 7). Interfaces de electrónica de medición de uso para medir la impedancia entre los canales y el tornillo de tierra para confirmar éxito. Si los valores de impedancia son demasiado altos, suelte el conector ZIF, ajustar la inserción y volver a probar hasta que se confirme la conexión exitosa.
- Cubra el conector ZIF y malla expuesta electrónica interconecta con cemento dental para protección. Flip el PCB en el boquete en el sustrato y fijar el PCB con cemento sobre el cráneo de ratón (figura 7 H).
Nota: El FFC en el boquete de flexión reduce la tensión mecánica que a veces puede romper la malla de interconexiones de electrónica. - Permita que el cemento fragüe, convirtiendo el PCB en una robusta y compactada-etapa para conectarse durante las sesiones de grabación posterior (figura 7I).
5. nervios grabación experimentos
- Coloque el ratón en un tailveiner u otro limitador33. Inserte el preamplificador PCB en el conector estándar amplificador en la placa de etapa de cabeza. Utilice un cable separado para el tornillo de la referencia de tierra.
- Para grabaciones refrenadas, deje el ratón en el limitador. Registro de datos utilizando el sistema de adquisición de datos para el período de tiempo deseado (figura 8A).
- Para mover libremente las grabaciones, suelte el ratón desde el limitador después de insertar el preamplificador PCB y el tornillo de referencia de puesta a tierra. Récord para la longitud deseada de tiempo utilizando el sistema de adquisición de datos mientras que el ratón se comporta libremente (figura 8B).
- Al final de la sesión de grabación, ponga el ratón en el limitador, si es necesario. Retire el cable de tierra y preamplificador, luego suelte el ratón de su jaula y volver al centro de animales hasta la siguiente sesión de grabación.
6. histológica de seccionamiento, tinción y la proyección de imagen
- Espere hasta después de la inyección de la hora deseada, luego anestesiar el ratón y transcardially perfusión con formaldehído. Retirar, congelación y criosección el cerebro en rodajas gruesas de 10 μm. Un protocolo detallado en inmunohistoquímica y cryosectioning de tejido cerebral de roedor puede encontrarse en Evilsizor, et al. 34.
Nota: Tejido fino del cerebro que contienen malla electrónica puede ser fijo y seccionado normalmente, a pesar de la vigilancia electrónica se queda dentro. Se trata de una funcionalidad única en comparación con el convencionales neurales las puntas de prueba, que debe eliminarse antes del seccionamiento y por lo tanto, pueden modificar el tejido o hacer difícil analizar la interfaz sonda-tejido. - Enjuague las secciones de tejido de cerebro congelado 3 veces en 1 x PBS.
- Bloquear las secciones en una solución de 0.3% Tritón X-100 y 5% de suero de cabra en PBS 1 x. Deje reposar a temperatura ambiente durante 1 hora.
- Incubar las secciones con la solución de anticuerpos primarios. Las soluciones de anticuerpo primario utilizadas aquí fueron rata anti-GFAP (dilución 1: 500) con 0.3% Tritón X-100 y 3% de suero de cabra, conejo anti-NeuN (dilución 1: 200) y Neurofilament anti ratón (dilución 1: 400). Incubar durante una noche a 4 ° C.
- Enjuague las secciones 9 veces para un total de 40 minutos con PBS 1 x.
- Incubar las secciones del cerebro con la solución de anticuerpos secundarios. Las soluciones de anticuerpo secundario utilizadas aquí fueron Alexa Fluor 488 cabra anti-conejo (dilución 1: 200), Alexa Fluor 568 cabra anti-ratón (dilución 1: 200) y Alexa Fluor 647 cabra anti-rata (dilución 1: 200). Incubar las secciones por 1 h a temperatura ambiente.
- Enjuague las secciones 9 veces para un total de 30 minutos con PBS 1 x.
- Monte las secciones sobre el portaobjetos con cubreobjetos usando mountant antifade. Dejo las diapositivas en la oscuridad durante al menos 24 h antes de la proyección de imagen.
- Las diapositivas de imágenes con un microscopio confocal con 488 nm, 561 nm y láseres de 633 nm como las fuentes de excitación para Alexa Fluor 488, Alexa Fluor 568 y Alexa Fluor 647, respectivamente. Utilizar contraste de interferencia diferencial (DIC) para la malla electrónica de la imagen en el mismo microscopio para posterior superposición de las imágenes y el análisis.
Resultados
Resultados variará según la especie animal en el estudio, la región cerebral específica, el tiempo transcurrido desde la inyección, la cantidad de daño agudo durante la inyección y el éxito de la entrada-salida interfaz de procedimiento, entre otros factores. Actividad spiking unitarios puede no aparecer hasta 1 día (en el caso de 150 μm agujas de diámetro interno) para 1 semana después de que las amplitudes de inyección y spike pueden variar hasta 4 – 6 semanas. La figura 9 muestra datos electrofisiológicos representativos de una punta de prueba de 32 canales malla electrónica inyectada en el hipocampo y la corteza somatosensorial primaria de un ratón C57BL/6J macho adulto. Aproximadamente 300 μV amplitud campo locales potenciales (LFPs) fueron registrados en todos los 32 canales y actividad clavaba una sola unidad se registró en 26 canales. El LFPs y picos aislados seguían siendo similares entre 2 y 4 meses, lo que sugiere una interfaz altamente estable entre grabación electrónica y las neuronas en este período de tiempo prolongado. La figura 10 muestra resultados representativos de secciones histológicas y el immunostaining del tejido de cerebro que contienen malla electrónica 1 año después de la inyección. Coloración para NeuN, marcador de Somas neuronales y neurofilament, un marcador para axones neuronales, no revela poco o ninguna pérdida de densidad del tejido en el sitio de inyección, implicando inconsútil interfaz entre el tejido de malla electrónica y el cerebro. Coloración para GFAP (marcador de astrocitos) más revela niveles de cerca de fondo de astrocitos en malla electrónica, indicando que su presencia provoca respuesta inmune poco crónica.
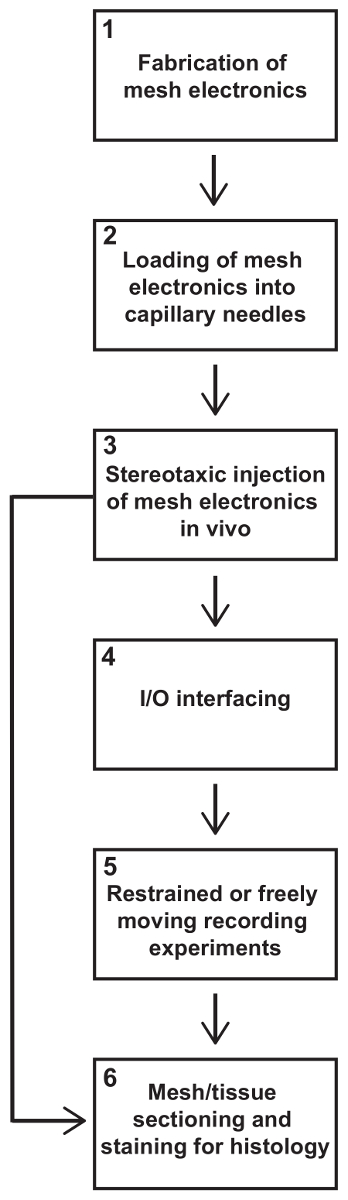
Figura 1: pasos en una jeringa inyectable malla electrónica experimento. Este protocolo describe todos los pasos claves en un experimento típico roedor grabación neuronales usando malla electrónica. Experimentos implican generalmente, en orden de ejecución, (1) fabricación de la malla electrónica, (2) carga de la malla electrónica en agujas capilares, inyección (3) estereotáxicas de malla electrónica en el cerebro, (4) eléctricos I/O interface para malla electrónica, grabaciones contenidas o libre movimiento (5) y (6) malla tejido seccionado y tinción para histología. En algunos estudios, sólo los datos de la histología pueden desear, en cuyo caso puede omitirse pasos (4) y (5). Haga clic aquí para ver una versión más grande de esta figura.
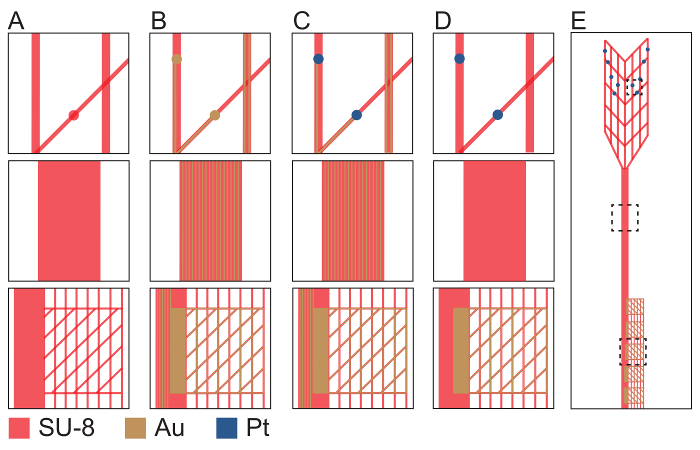
Figura 2: esquema que representa el procedimiento de fabricación de electrónica de red plug-and-play en la región de dispositivo ultraflexible (fila superior), madre interconecta la región (fila media) y región de I/O (fila inferior). (A) SU-8 photoresist negativo (rojo) es modelado con máscara de PL-1 para definir el fondo pasivado de capa de cada sonda electrónica de acoplamiento plug-and-play. (B) dibujo con máscara-2 PL, evaporación térmica y despegue metal definir Au interconecta y I/O (oro). (C) dibujo con máscara-3 PL, evaporación de viga del electrón y despegue metal definir electrodos de Pt (azul). (D) SU-8 photoresist negativo (rojo) es modelado con máscara de PL-4 para definir la capa de pasivación superior. Las aberturas en el SU-8 quedan en cada electrodo de Pt y la almohadilla de I/O. (E) A terminado malla sonda electrónica con cajas discontinuas que indica las posiciones ampliadas en la parte superior, media y filas de fondo. Archivos de diseño de fotomáscara están disponibles por petición de los autores o desde el sitio de recursos, meshelectronics.org. Haga clic aquí para ver una versión más grande de esta figura.
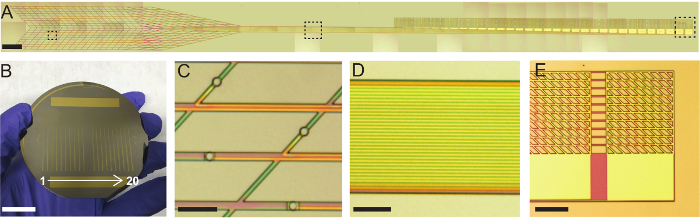
Figura 3: fotografías e imágenes de microscopio óptico de plug-and-play de malla electrónica. (A) imágenes de microscopio óptico de una sonda electrónica de malla jeringa inyectable con la entrada-salida del plug-and-play de baldosas. La sonda era reflejada después de la finalización de la fabricación los pasos en la figura 2 pero antes del lanzamiento del substrato Ni revestido. Cajas discontinuas corresponden de izquierda a derecha a las secciones de la región de dispositivo ultraflexible, vástago, I/O región y magnificado en C, D y E, respectivamente. Barra de escala = 1 mm. (B) fotografía de una oblea de Si de 3 pulgadas que contiene 20 terminado malla electrónica sondas. Barra de escala = 20 mm. (C) imagen de microscopio óptico de electrodos grabación Pt 20 μm de diámetro en la región de dispositivo ultraflexible. Barra de escala = 100 μm. (D) imagen de microscopio óptico de alta densidad Au interconecta en la región del tallo. Cada interconexión de Au es aislada eléctricamente y conecta un solo electrodo de Pt con un solo botón I/O. Barra de escala = 100 μm. (E) óptico microscopio imagen de cojines I/O. Cada almohadilla se compone de una región de malla plegable y una región de película delgada continua ubicado en el tallo. Realización de no SU-8 cintas conectan las partes de acoplamiento de las pastillas para ayudar a mantener la alineación. Barra de escala = 200 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 4: montaje del aparato para sostener agujas capilares durante la inyección. (A) fotografía de los componentes del aparato. Los componentes incluyen (1) una aguja capilar de vidrio, (2) un soporte de pipeta, (3) un sujetador de tornillo circular portador de la pipeta y (4) una arandela conica para el titular de la pipeta. Artículos (2) a (4) se incluyen con la compra de un soporte de pipeta. La flecha marca la salida del titular de pipeta que se pega con epoxi. (B) fotografía del titular de la pipeta después de Asamblea y la inserción de una aguja capilar de vidrio. El agregado de epoxy es visible en la salida superior del porta pipeta (señalada con flecha) y tubo capilar conecta el soporte de la pipeta con una jeringa (no mostrada). (C) fotografía del titular de la pipeta y la aguja capilar después de la fijación al bastidor estereotáxicas con una abrazadera de ángulo recto final. Barras de escala son 1 cm. haga clic aquí para ver una versión más grande de esta figura.

Figura 5: carga de la malla electrónica en agujas de cristal. (A) Ilustración esquemática del procedimiento de carga de plug-and-play malla electrónica. Una aguja de vidrio se coloca cerca del extremo de I/O de una sonda electrónica de acoplamiento mientras que está suspendido en la solución. Émbolo de la jeringa luego se retrae manualmente para dibujar en la punta de prueba electrónica de malla. Posición ideal es con la región ultraflexible dispositivo justo en el extremo de la aguja. (B) fotografías correspondientes a (A) de una sonda electrónica de malla se cargue en una aguja de vidrio. Barras de escala = 2 mm. haga clic aquí para ver una versión más grande de esta figura.

Figura 6: esquema de la estación de cirugía estereotáctica. Un armazón estereotáxicas motorizado (A) con soporte para pipeta adjunta se utiliza para colocar la aguja en la región del cerebro deseada. La posición de la aguja y el acoplamiento de carga electrónica son monitoreados con un objetivo y adjunto cámara (B) y en un ordenador (C). Una bomba de jeringa (D) fluye precisa volúmenes de solución salina a través de la aguja, permitiendo para la inyección precisa y controlada de la malla electrónica en la región del cerebro deseado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Plug-and-play I/O interface procedimiento. (A) FFC un sustrato de fijación se asegura con cemento dental adyacente a la craneotomía. (B) Plug-and-play malla electrónica stereotaxically se inyecta en la región del cerebro deseada utilizando el método de campo de visión. (C) la aguja, con las almohadillas de I/O de la malla electrónica dentro de la punta de prueba, es reposicionado sobre FFC sustrato de fijación. (D) flujo se reasume a través de la aguja para extraer las pastillas de I/O en el FFC sustrato de fijación. (E) las almohadillas de I/O están doblados a 90 ° en relación con la madre, se desarrolló con la dirección hacia arriba y secar en lugar. Sustrato (F) la FFC se recorta con unas tijeras a una línea recta aprox. 0,5 mm desde el borde de las pastillas de I/O. Substrato sobrante se corta para permitir la inserción de un conector ZIF de 32 canales. (G) la entrada-salida pastillas se introducen en un conector ZIF de 32 canales montado sobre un PCB personalizado. El conector ZIF esté bien cerrada para hacer contacto con las almohadillas de I/O. Se cementa (H) el pestillo cerrado, la placa se voltea en el cráneo, y el PCB se fija en su lugar con cemento dental. () El PCB forma un headstage compacto con un conector de amplificador estándar para interfaces de fácil durante las sesiones de grabación. Barras de escala = 1 cm. haga clic aquí para ver una versión más grande de esta figura.

Figura 8: grabaciones contenidas y libremente móviles. (A) fotografía del macho ratón C57BL/6J un limitador durante una sesión de grabación. Un PCB de preamplificador de canal 32 se ha insertado en el conector del amplificador estándar. (B) fotografía del mismo ratón con 32 canales preamplificador PCB durante un experimento de grabación libremente móviles. Barras de escala = 1 cm. haga clic aquí para ver una versión más grande de esta figura.
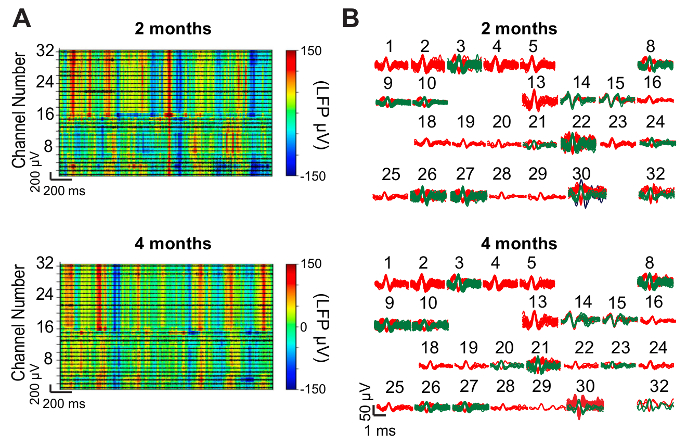
Figura 9: grabación neuronales representativas resultados. (A) representante LFP mapas de calor de 32 canales de malla de puntas de prueba electrónica inyectadas en el ratón hipocampo y la corteza somatosensorial. Los datos fueron registrados mientras que el ratón explora libremente su jaula en 2 meses (arriba) y después de la inyección 4 meses (parte inferior). Amplitud de la LFP es codificados por colores según la barra de color a la derecha. High-pass filtrados rastros (negro) que muestra actividad spiking son overlaid en el espectrograma para cada uno de los 32 canales. (B) espigas aisladas después de ordenar los datos trazados en (A). Se detectó actividad clavaba una sola unidad en 26 de los 32 canales ambos 2 meses posterior a la inyección (arriba) y 4 meses posterior a la inyección (parte inferior). Los números sobre cada racimo de picos corresponden a los números de canal en (A). Esta figura ha sido modificada de Fu, et al. 28. haga clic aquí para ver una versión más grande de esta figura.
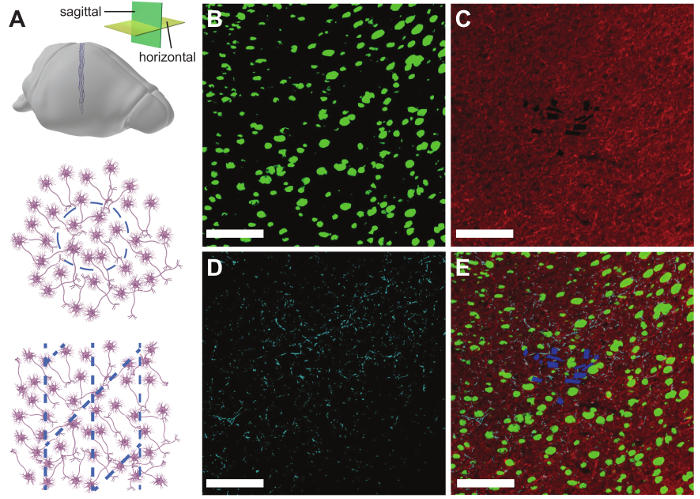
Figura 10: resultados de histología representativa. (A) diagrama esquemático que ilustra la orientación de la malla electrónica en horizontal (panel central) y sagital rebanadas de cerebro (panel inferior). (B) imagen de microscopio de fluorescencia de un trozo de cerebro cortical gruesa de 10 μm un año después de la inyección de una sonda electrónica de malla de 16 canales. El segmento ha sido immunostained para NeuN (verde). (C) el mismo segmento de cerebro immunostained para neurofilamentos (rojo). (D) el mismo cerebro rebanada immunostained para GFAP (cian). (E) A imagen compuesta (b) a (D) que muestra el tejido malla electrónica interfaz con etiquetado NeuN (verde), neurofilamentos (rojo), GFAP (cian) y malla electrónica (azul). Barras de escala = 100 μm. Esta figura ha sido modificada de Fu et al. 27. haga clic aquí para ver una versión más grande de esta figura.
1 Video complementario: repetida carga e inyección de malla electrónica en solución. Haga clic aquí para descargar este archivo.
Discusión
Todos los pasos en la fabricación y el uso de la malla electrónica son importantes, pero algunos son particularmente importantes. Antes de soltar la malla electrónica de su oblea, es esencial para la oxidación de la superficie para hacer las mallas fácilmente suspendidas en solución acuosa (paso 1.6.1). Si se omite este paso, las mallas generalmente flotan en la superficie del agua, que dificulta la carga en las agujas, y si pueden ser cargados, a menudo pegarse a las paredes de las agujas de vidrio, que requieren grandes volúmenes (> 100 μL) para la inyección. Falta para oxidar la superficie antes de lanzamiento, por lo tanto, normalmente significa que no se puede utilizar las mallas y la fabricación deben volver a realizarse desde el principio. Otro paso fundamental es doblar la malla electrónica "tallo" a ~ 90° durante la entrada-salida interfaz (paso 4.3). Si el ángulo es menor que 90°, entonces todos 32 cojines de I/O no cabrán en el conector ZIF; Algunos tendrán que cortar el extremo para permitir la inserción, reducción del número de electrodos conectados. El proceso también debe hacer suavemente para evitar que se rompa el tallo.
El diseño de la malla electrónica puede modificar para requisitos particulares para diversas aplicaciones modificando los photomasks y usando el mismo procedimiento de fabricación que se indica en la figura 2. Por ejemplo, mientras que la malla electrónica las puntas de prueba utilizados para grabar los datos en la figura 9 fueron diseñados para tener 32 electrodos de grabación abarcan el ratón hipocampo y la corteza somatosensorial primaria, puede ser la colocación de electrodos dentro de la malla ultraflexible seleccionado a prácticamente cualquier región o regiones del cerebro, o más electrodos para la estimulación pueden ser incorporado27. El mismo procedimiento de fabricación y estructura de la malla básica se mantienen, pero la colocación del electrodo y el diseño se ajustan a las necesidades del estudio. Los investigadores deben tenga cuidado, sin embargo y siempre prueba que diseños modificados se pueden inyectar fácilmente a través de las agujas previstas. Pequeños cambios en la flexión mecánica de la malla electrónica puede tener efectos sustanciales sobre la inyectabilidad. Un ejemplo de ello es que un ángulo de 45° entre cintas de SU-8 transversales y longitudinales produce una sonda electrónica de malla que suelen inyectarse pero uno que cae y se obstruyen con agujas21produce un ángulo de 90°.
Medición de la impedancia de los electrodos de registro es útil para solucionar problemas. Un electrodo de Pt de 20 μm de diámetro circular debe tener un magnitud de impedancia cerca de 1 MΩ cuando se mide a una frecuencia de 1 kHz en vivo o en 1 x PBS29. Una impedancia significativamente más grande que esto implica que el electrodo no es expuesto, como puede ocurrir si se contamina con photoresist residuo o no eléctricamente conectado. Este último puede ocurrir si, por ejemplo, hay polvo en la máscara de la foto durante la PL que interconecta resultados en una desconexión en la UA, o si uno de los botones de I/O de malla no es contactado por los pines del conector ZIF en interfaces de I/O. Una magnitud de la impedancia aproximadamente la mitad del valor esperado indica que el canal puede estar en corto circuito a la adyacente, creando un circuito de dos impedancias de electrodos en paralelo. Los valores de la impedancia medida actúan como guía durante la solución de problemas; combinado con microscopía óptica de las sondas de electrónica de red, la fuente del problema puede generalmente ser identificada y corregida por consiguiente en la siguiente fabricación ejecutar o intento de interconexión de I/O.
El uso de la jeringa inyectable malla electrónica para estudios agudos se limita en que actividad spiking unitarios generalmente no se observa hasta 1 semana post inyección27, aunque trabajos recientes (inédito) muestran que este problema es fácilmente vencido. Determinantes del tiempo requerido para ver actividad de clavar la malla de diseño, el volumen de líquido inyectado en el cerebro junto con malla electrónica y el diámetro de la aguja utilizada para la inyección, como éstos afectan el grado de daño de tejido durante el inyección y la tasa de curación. Volúmenes de inyección grandes pueden ser necesarios si la malla electrónica no se trata con plasma de oxígeno antes de la liberación en Ni grabador; es decir, si la malla no es hidrofílica, puede adherirse a la aguja de vidrio. En ocasiones, las mallas tienen defectos que llevan a la flexión mecánica que los hacen difíciles de inyectar. Durante la carga de la malla electrónica, es importante comprobar que mallas se desplazan fácilmente y sin problemas dentro de la aguja (como se muestra en el Video complementario 1). Si no es así, puede usarse una sonda electrónica de malla diferentes. Con los volúmenes de inyección ideal de 10-50 μL por 4 mm de longitud de malla inyectado se logrará mejores resultados para la perfecta interconexión neuronal. Los resultados más recientes con fina malla electrónica sondas inyección o menor diámetro capilar las agujas (tan pequeñas como 150 μm de diámetro interior, diámetro exterior de 250 μm) muestran que clavar la unidad solo puede ser observada desde poco después de la inyección (medidas agudas) a través del tiempo. Archivos de diseño de máscara para estas estructuras de malla más finas están disponibles por solicitud o desde la Web de recursos, meshelectronics.org. Se estima el rendimiento global de nuestros vivo malla inyección procedimientos utilizando agujas de (diámetro exterior 650 μm) de diámetro interno de μm 400 a 70%, aunque el rendimiento es más cercano a 80-90% de nuestros trabajos más recientes con diámetro interior de 150 μm (250 μm de diámetro exterior ) agujas. Las razones más comunes para el fracaso son (1) que la malla no inyectar suavemente, dando por resultado edema cerebral desde los volúmenes de inyección inesperadamente grande en el cerebro, (2) malla roturas durante la manipulación manual requerida en la entrada-salida interfaz de procedimiento y (3) el sangrar de dañar un vaso sanguíneo durante la inyección. Dañar un vaso sanguíneo durante la inyección es raro (la causa de menos del 10% de fracasos) y podría reducirse aún más mediante cirugía guiada por imágenes. Además tenemos en cuenta que el daño de los vasos sanguíneos es una limitación común de todos los procedimientos que implica la penetración del tejido del cerebro, incluyendo la inyección de partículas virales para la transfección, implantación de sondas cerebro rígido y la inyección de la malla electrónica.
Malla electrónica son capaces de estable grabar de y seguimiento de las mismas neuronas individuales en menos meses a año plazos y no evocar casi ninguna respuesta inmune crónica, como se muestra en la figura 9 y figura 10, respectivamente. Esto representa una ventaja significativa en comparación con electrodos de profundidad de Convención, que comúnmente sufren de disminución de las amplitudes de pico, señales inestables e inflamación crónica en el transcurso de grabación experimentos14, a largo plazo 15. Adicionalmente, la malla electrónica tienen la ventaja que puede dejar en el tejido durante el corte histológico, coloración, y la proyección de imagen, en contraste con las sondas convencionales, que son demasiado rígidas y por lo tanto deben ser removida antes de histología Análisis. Por lo tanto, malla electrónica permite la capacidad única de usar el análisis de immunohistochemical para estudiar precisamente el entorno celular que rodea cada sitio de la grabación.
El protocolo presentado aquí se abre para arriba emocionantes nuevas oportunidades en la neurociencia. El método mínimamente invasivo y la integración de la electrónica de malla con tejido cerebral reduce al mínimo la interrupción de circuitos neuronales y evita respuesta inmune crónica, que podría beneficiar a casi todos los tipos de experimentos de grabación neuronal crónica. La capacidad de la malla electrónica para registrar y rastrear las mismas neuronas solo por largos períodos de tiempo sobre todo será de interés para los investigadores buscando correlacionar actividad spiking milisegundo-escala con procesos de meses a años de duración como el envejecimiento, la patogenia de la enfermedad cerebral, o cerebro desarrollo16,18. Además, existen importantes oportunidades para ampliar y personalizar este protocolo, como la adición de una electrónica activa al PCB cabeza-escenario para implementar la funcionalidad como digital multiplexado8,35, inalámbrico comunicación35,36,37y35, conjuntamente inyectar las células madre o polímeros con la malla electrónica ayuda en tejido regeneración18,38, de procesamiento de señales 39e incorporando nanocable transistores efecto de campo (NW-FETs) en malla electrónica para muy localizada y cerebro multifuncional sondas24,29,40,41 ,42.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
C.M.L. reconoce apoyo de esta obra por la oficina de investigación científica de la fuerza aérea (FA9550-14-1-0136) y un premio acelerador ingeniería y Ciencias de física de la Universidad de Harvard () Premio pionero nacional institutos de salud del Director 1DP1EB025835-01). T.G.S. agradece apoyo por el Departamento de defensa (DoD) a través del programa nacional de defensa de ciencia e Ingeniería Graduate Fellowship (NDSEG). G.H. reconoce apoyo de beca de la American Heart Association (16POST27250219) y el camino al premio independencia (padre K99/R00) del Instituto Nacional sobre el envejecimiento de los institutos nacionales de salud. Este trabajo fue realizado en parte en el centro de la Universidad de Harvard para sistemas a nanoescala (CNS), un miembro de la nacional nanotecnología coordinada infraestructura red (NNCI), que es apoyado por la National Science Foundation bajo NSF CEC Award no. 1541959.
Materiales
| Name | Company | Catalog Number | Comments |
| Motorized stereotaxic frame | World Precision Instruments | MTM-3 | For mouse stereotaxic surgery |
| 512-channel recording controller | Intan Technologies | C3004 | A component of the neural recording system |
| RHD2132 amplifier board | Intan Technologies | C3314 | A component of the neural recording system |
| RHD2000 3 feet ultra thin SPI interface cable | Intan Technologies | C3213 | A component of the neural recording system |
| Mouse restrainer | Braintree Scientific | TV-150 STD | Standard 1.25 inch inner diameter; used to restrain the mouse during restrained recording sessions. |
| Si wafers | Nova Electronic Materials | 3" P <100> .001-.005 ohm-cm 356-406 μm Thick Prime Grade SSP Si wafers w/2 Semi-Std. Flats & 6,000 A°±5% Wet Thermal Oxide on both sides. | |
| Photomasks (chrome on soda lime glass) | Advance Reproductions | Advance Reproductions and other vendors manufacture photomasks from provided design files. Our photomask design files are available by request or from the resource website, meshelectronics.org. Alternatively, some university clean rooms have mask writers for making photomasks on site. | |
| AutoCAD software | Autodesk Inc. | Design software for drawing photomasks. A free alternative is LayoutEditor. Our photomask design files are available by request or from the resource website, meshelectronics.org. | |
| Thermal evaporator | Sharon Vacuum | Used to evaporate Ni, Cr, and Au onto mesh electronics during fabrication. Many university clean rooms have this or a similar tool. | |
| SU-8 2000.5 negative photoresist | MicroChem Corp. | Negative photoresist used to define the bottom and top passivating layers of mesh electronics. | |
| MA6 mask aligner | Karl Suss Microtec AG | Used to align each photomask to the pattern on the wafer and expose the wafer to UV light. Most university clean rooms have this or a similar tool. | |
| SU-8 developer | MicroChem Corp. | Used to develop SU-8 negative photoresist following exposure to UV light. | |
| LOR3A lift-off resist | MicroChem Corp. | Used with Shipley 1805 photoresist to promote undercutting during metal lift-off processes | |
| Shipley 1805 positive photoresist | Microposit, The Dow Chemical Company | Positive photoresist used to define metal interconnects and Pt electrodes in mesh electronics | |
| MF-CD-26 positive photoresist developer | Microposit, The Dow Chemical Company | To develop S1805 positive photoresist after exposure in a mask aligner. Many university clean rooms stock this chemical. | |
| Spin coater | Reynolds Tech | For coating wafers with positive and negative resists. Most university clean rooms have spin coaters. | |
| PJ plasma surface treatment system | AST Products, Inc. | Used to oxidize the surface of mesh electronics prior to release into aqueous solution. Most university clean rooms have this or a similar tool. | |
| Electron beam evaporator | Denton Vacuum | For evaporating Cr and Pt during fabrication of mesh electronics. Many university clean rooms have this or a similar tool. | |
| Remover PG | MicroChem Corp. | Used to dissolve LOR3A and Shipley S1805 resists during metal lift-off | |
| Ferric chloride solution | MG Chemicals | 415-1L | A component of Ni etching solution |
| 36% hydrochloric acid solution | Kanto Corp. | A component of Ni etching solution | |
| Glass capillary needles | Drummond Scientific Co. | Inner diameter 0.40 mm, outer diameter 0.65 mm. Other diameters are available. | |
| Micropipette holder U-type | Molecular Devices, LLC | 1-HL-U | Used to hold the glass capillary needles during stereotaxic injection |
| 1 mL syringe | NORM-JECT®, Henke Sass Wolf | Used for manual loading of mesh electronics into capillary needles | |
| Polyethylene intrademic catheter tubing | Becton Dickinson and Company | Inner diameter 1.19 mm, outer diameter 1.70 mm | |
| 5 mL syringe | Becton Dickinson and Company | Used in the syringe pump for injection of mesh electronics in vivo | |
| Eyepiece camera | Thorlabs Inc. | DCC1240C | Used to view mesh electronics within capillary needles during injection |
| ThorCam uc480 image acquisition software for USB cameras | Thorlabs Inc. | Used to view mesh electronics within capillary needles during injection | |
| Syringe pump | Harvard Apparatus | PHD 2000 | Used to flow precise volumes of solution through capillary needles during injection of mesh electronics |
| EXL-M40 dental drill | Osada | 3144-830 | For drilling the craniotomy |
| 0.9 mm drill burr | Fine Science Tools | 19007-09 | For drilling the craniotomy |
| Hot bead sterilizer 14 cm | Fine Science Tools | 18000-50 | Used to sterlize surgical instruments |
| CM1950 cryosectioning instrument | Leica Microsystems | Used to slice frozen tissue into sections. Many universities have this or a similar tool available in a shared facility. | |
| 0.3% Triton x-100 | Life Technologies | Used for histology | |
| 5% goat serum | Life Technologies | Used for histology | |
| 3% goat serum | Life Technologies | Used for histology | |
| Rabbit anti-NeuN | Abcam | ab177487 | Used for histology |
| Mouse anti-Neurofilament | Abcam | ab8135 | Used for histology |
| Rat anti-GFAP | Thermo Fisher Scientific Inc. | PA516291 | Used for histology |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific Inc. | P36930 | Used for histology |
| Poly-D-lysine | Sigma-Aldrich Corp. | P6407-5MG | Molecular weight = 70-150 kDA |
| Right-angle end clamp | Thorlabs Inc. | RA180/M | Used to attach the pipette holder to the stereotaxic frame |
| Printed circuit board (PCB) | Advanced Circuits | Used to interface between mesh electronics and peripheral measurement electronics such as the Intan recording system. Advanced Circuits and other vendors manufacture and assemble PCBs based on provided design files. Our PCB design files are available by request or at the resource site meshelectronics.org | |
| 32-channel standard amplifier connector | Omnetics Connector Corp. | A79024-001 | Component assembled onto the PCB |
| 32-channel flat flexible cable (FFC) | Molex, LLC | 152660339 | Used as a clamping substrate when interfacing to mesh electronics I/O pads with the PCB-mounted ZIF connector |
| 32-channel zero insertion force (ZIF) connector | Hirose Electric Co., LTD | FH12A-32S-0.5SH(55) | Component assembled onto the PCB |
Referencias
- Lopes da Silva, F. EEG and MEG: relevance to neuroscience. Neuron. 80 (5), 1112-1128 (2013).
- Logothetis, N. K. What we can do and what we cannot do with fMRI. Nature. 453 (7197), 869-878 (2008).
- Seymour, J. P., Wu, F., Wise, K. D., Yoon, E. State-of-the-art MEMS and microsystem tools for brain research. Microsystems & Nanoengineering. 3, 16066 (2017).
- Buzsaki, G. . Rhythms of the Brain. , (2006).
- Khodagholy, D., et al. NeuroGrid: recording action potentials from the surface of the brain. Nature Neuroscience. , (2014).
- Hamel, E. J., Grewe, B. F., Parker, J. G., Schnitzer, M. J. Cellular level brain imaging in behaving mammals: an engineering approach. Neuron. 86 (1), 140-159 (2015).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Berenyi, A., et al. Large-scale, high-density (up to 512 channels) recording of local circuits in behaving animals. Journal of Neurophysiology. 111 (5), 1132-1149 (2014).
- Scholvin, J., et al. Close-Packed Silicon Microelectrodes for Scalable Spatially Oversampled Neural Recording. IEEE Transactions on Biomedical Engineering. 63 (1), 120-130 (2016).
- Schiller, P. H. The Central Visual System. Vision Research. 26 (9), 1351-1386 (1986).
- Benabid, A. L., Chabardes, S., Mitrofanis, J., Pollak, P. Deep brain stimulation of the subthalamic nucleus for the treatment of Parkinson's disease. The Lancet Neurology. 8 (1), 67-81 (2009).
- Hochberg, L. R., et al. Reach and grasp by people with tetraplegia using a neurally controlled robotic arm. Nature. 485 (7398), 372-375 (2012).
- Lebedev, M. A., Nicolelis, M. A. Brain-Machine Interfaces: From Basic Science to Neuroprostheses and Neurorehabilitation. Physiological Reviews. 97 (2), 767-837 (2017).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Perge, J. A., et al. Intra-day signal instabilities affect decoding performance in an intracortical neural interface system. Journal of Neural Engineering. 10 (3), 036004 (2013).
- Hong, G., Yang, X., Zhou, T., Lieber, C. M. Mesh electronics: a new paradigm for tissue-like brain probes. Current Opinion in Neurobiology. 50, 33-41 (2017).
- Dai, X., Hong, G., Gao, T., Lieber, C. M. Mesh Nanoelectronics: Seamless Integration of Electronics with Tissues. Accounts of Chemical Research. 51 (2), 309-318 (2018).
- Feiner, R., Dvir, T. Tissue-electronics interfaces: from implantable devices to engineered tissues. Nature Reviews Materials. 3 (1), 17076 (2017).
- Kandel, E. R., Schwartz, J. H., Jessell, T. M., Siegelbaum, S. A., Hudspeth, A. J. . Principles of Neural Science. , (2013).
- Rousche, P. J., et al. Flexible polyimide-based intracortical electrode arrays with bioactive capability. IEEE Transactions on Biomedical Engineering. 48 (3), 361-371 (2001).
- Liu, J., et al. Syringe-injectable electronics. Nature Nanotechnology. 10 (7), 629-636 (2015).
- Kasthuri, N., et al. Saturated Reconstruction of a Volume of Neocortex. Cell. 162 (3), 648-661 (2015).
- Saxena, T., Bellamkonda, R. V. A sensor web for neurons. Nature Materials. 14, 1190-1191 (2015).
- Xie, C., et al. Three-dimensional macroporous nanoelectronic networks as minimally invasive brain probes. Nature Materials. 14 (12), 1286-1292 (2015).
- Hong, G., et al. Syringe Injectable Electronics: Precise Targeted Delivery with Quantitative Input/Output Connectivity. Nano Letters. 15 (10), 6979-6984 (2015).
- Zhou, T., et al. Syringe-injectable mesh electronics integrate seamlessly with minimal chronic immune response in the brain. Proceedings of the National Academy of Sciences. 114 (23), 5894-5899 (2017).
- Fu, T. M., et al. Stable long-term chronic brain mapping at the single-neuron level. Nature Methods. 13 (10), 875-882 (2016).
- Fu, T. M., Hong, G., Viveros, R. D., Zhou, T., Lieber, C. M. Highly scalable multichannel mesh electronics for stable chronic brain electrophysiology. Proceedings of the National Academy of Sciences. 114 (47), E10046-E10055 (2017).
- Schuhmann, T. G., Yao, J., Hong, G., Fu, T. M., Lieber, C. M. Syringe-Injectable Electronics with a Plug-and-Play Input/Output Interface. Nano Letters. 17 (9), 5836-5842 (2017).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable stereotaxic surgery in rodents. Journal of Visualized Experiments. (20), (2008).
- Kirby, E. D., Jensen, K., Goosens, K. A., Kaufer, D. Stereotaxic surgery for excitotoxic lesion of specific brain areas in the adult rat. Journal of Visualized Experiments. (65), e4079 (2012).
- Gage, G. J., et al. Surgical implantation of chronic neural electrodes for recording single unit activity and electrocorticographic signals. Journal of Visualized Experiments. (60), (2012).
- . Lab Animal Research. Rodent Handling and Restraint Techniques Available from: https://www.jove.com/science-education/10221/rodent-handling-and-restraint-techniques (2018)
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for immunohistochemistry on cryosectioned rat brain tissue: example staining for microglia and neurons. Journal of Visualized Experiments. 10 (99), e52293 (2015).
- Sodagar, A. M., Perlin, G. E., Yao, Y., Najafi, K., Wise, K. D. An Implantable 64-Channel Wireless Microsystem for Single-Unit Neural Recording. IEEE Journal of Solid-State Circuits. 44 (9), 2591-2604 (2009).
- Wentz, C. T., et al. A wirelessly powered and controlled device for optical neural control of freely-behaving animals. Journal of Neural Engineering. 8 (4), 046021 (2011).
- Harrison, R. R., et al. Wireless neural recording with single low-power integrated circuit. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 17 (4), 322-329 (2009).
- Landa, N., et al. Effect of injectable alginate implant on cardiac remodeling and function after recent and old infarcts in rat. Circulation. 117 (11), 1388-1396 (2008).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Zhang, A., Lieber, C. M. Nano-Bioelectronics. Chemical Reviews. 116 (1), 215-257 (2016).
- Zhou, W., Dai, X., Lieber, C. M. Advances in nanowire bioelectronics. Reports on Progress in Physics. 80 (1), 016701 (2017).
- Dai, X., Zhou, W., Gao, T., Liu, J., Lieber, C. M. Three-dimensional mapping and regulation of action potential propagation in nanoelectronics-innervated tissues. Nature Nanotechnology. 11 (9), 776-782 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados