Method Article
Spritze-injizierbaren Mesh Elektronik für stabile chronische Nagetier Elektrophysiologie
In diesem Artikel
Zusammenfassung
Netz-Elektronik-Sonden nahtlos integrieren und sorgen für stabile, langfristige, Single Neuron Aufnahmen innerhalb des Gehirns. Dieses Protokoll verwendet Netz Elektronik für in Vivo Experimente, an denen die Herstellung von Mesh-Elektronik, laden in Nadeln, stereotaktischen Injektion ein-/Ausgabe-Schnittstellen, Aufnahme Experimente und Histologie des Gewebes mit Netz Sonden.
Zusammenfassung
Implantierbaren Gehirn Elektrophysiologie Sonden sind wertvolle Werkzeuge in den Neurowissenschaften aufgrund ihrer Fähigkeit zu Rekord neuronale Aktivität mit hoher räumlich-zeitliche Auflösung von flachen und tiefen Hirnregionen. Ihr Einsatz behindert worden, jedoch durch mechanische und strukturelle Diskrepanzen zwischen den Sonden und das Gehirn Gewebe führen, häufig zum Integrationsprozess und Gliosis mit daraus resultierenden signal Instabilität in chronische Aufnahme Experimente. Im Gegensatz dazu nach der Implantation der ultraflexible Netz Elektronik mittels Spritze Injektion Sonden das Netz bilden eine nahtlose, Gliosis-freie Schnittstelle mit dem umliegenden Hirngewebe, das es stabile Tracking einzelner Neuronen auf mindestens ein Jahr ermöglicht Zeitskala. Dieses Protokolldetails die wichtigsten Schritte in einem typischen Maus neuronalen Aufnahme Experiment mit Spritze-injizierbaren mesh-Elektronik, einschließlich der Herstellung von Mesh-Elektronik in einem standard Photolithographie-basierten Prozess möglich an vielen Universitäten, be- Mesh-Elektronik in Kapillare Standardnadeln, stereotaktischen Injektion in Vivo, Verbindung des Netzes ein-/Ausgabe auf standard-Instrumentierung Schnittstellen, zurückhaltend oder frei beweglichen Aufnahme-Sessions und histologischen Schnitt des Gehirns mesh-Gewebe mit Elektronik. Repräsentative neuronale Aufnahmen und Histologie Daten werden vorgestellt. Ermittler vertraut mit diesem Protokoll werden die notwendigen Kenntnisse zur Netz-Elektronik in eigenen Experimenten integrieren und nutzen Sie die einzigartigen Möglichkeiten langfristig stabile neuronale Schnittstellen, wie Studien des Alterns haben Prozesse, die Entwicklung des Gehirns und der Pathogenese der Erkrankung des Gehirns.
Einleitung
Die Entwicklung von Werkzeugen in der Lage, die Kartierung des Gehirns mit Single-Neuron Auflösung ist von zentraler Bedeutung für Neurowissenschaft und Neurologie. Nicht-invasive Technologien für neuronale Studien z. B. Elektroenzephalographie (EEG) Magnetoenzephalographie (MEG) und funktionelle Kernspintomographie (fMRI) haben für die Korrelation der Hirnaktivität mit Verhalten im Menschen1bewährt, 2, aber sie ermangeln die räumlich-zeitliche Auflösung erforderlich für die Untersuchung der Struktur und Dynamik von neuronalen Netzen in ihren grundlegenden Mikrometer und Millisekunde skaliert bzw.3,4. Bestimmte Electrocorticography (ECoG) Sonden und optische bildgebende Verfahren, die Spannung-empfindlichen Farbstoffen gelungen Aufnahme Monoblock-spiking Aktivität in Vivo5,6, doch sie gelten in der Regel nur in der Nähe der Gehirn-Oberfläche, Begrenzung der Anwendbarkeit auf Studien von flachen Hirnregionen. Im Gegensatz dazu können implantierbare elektrische Sonden Messen Single Neuron Elektrophysiologie im frei beweglichen Tieren aus nahezu jeder Region des Gehirns ohne die Notwendigkeit einer fluoreszierenden Etikettieren, macht sie unverzichtbar auf Systemebene Neurowissenschaften, vor allem als Microfabrication Techniken aus der Halbleiterindustrie geschoben haben zählt Kanal in die Hunderte und Tausende3,7,8,9. Aufgrund dieser Funktionen haben implantierbare elektrische Sonden viele wichtige Beiträge geleistet, Neurowissenschaften und Neurologie, einschließlich grundlegende Untersuchungen der Informationsverarbeitung in das visuelle System10, die Behandlung von neurologischen Erkrankungen wie der Parkinson-Krankheit11und die Demonstration von Gehirn-Maschine-Schnittstellen (BMIs) für fortgeschrittene Prothetik12,13.
Jedoch hat langfristige Instabilität manifestiert sich vermindernden Spike Amplituden und instabilen Signale auf Zeitskalen von Wochen bis Monaten14,15 die Anwendbarkeit der implantierbaren Sonden zur Erforschung der relativ kurzfristigen begrenzt. Phänomene, Fragen zu verlassen, wie z. B. Hirnalterung und Entwicklung weitgehend unbeantwortet. Die Einschränkungen in langfristige Instabilität resultieren aus einem Missverhältnis zwischen herkömmlichen Sonden und Hirngewebe in Größe, Mechanik und Topologie14,15,16,17,18. In Bezug auf Größe, während neuronalen Synapsen und Somata etwa zehn Nanometern bis zu zehn Mikrometer im Durchmesser19, bzw. traditionellen Sonden sind oft deutlich größer, bei Silizium Mikroelektrode Arrays > 4 mal die Größe eines einzelnen Neurons Zellkörper7,8. Die relativ große Größe der diese Sonden zur Beeinträchtigung der natürlichen Struktur und Vernetzung von dichten Nervengewebe, damit einen Beitrag zur chronischen Immunreaktion und stören die neuralen Schaltkreis untersucht. In Bezug auf die mechanischen Eigenschaften sind traditionelle Sonden erheblich stabiler als die extrem weiche Nervengewebe, in denen sie eingepflanzt werden; auch "flexible" Sonden aus 10 – 20 µm dicken Platten aus Polyimid hergestellt sind mindestens 100.000 Mal stabiler als Gehirn Gewebe20,21. Diese Diskrepanz in der Biegesteifigkeit bewirkt, dass relative scher Bewegung zwischen der Sonde und Gehirn Gewebe führt zu unzuverlässigen Monoblock-tracking bei längeren Aufnahmen und chronische Gliosis bei den Implantationsort induzieren. Schließlich schließt die topologische Struktur des konventionellen Gehirn Sonden unbedingt ein solides Volumen des Gewebes. Diese Diskrepanz in Topologie stört die Konnektivität des neuronalen Schaltkreise, schließt die natürliche dreidimensionale (3D) interpenetrated Verteilung von Neuronen, Gliazellen und Blutgefäßen im Gehirn Gewebe22und behindert 3D Transport von Signalisierung Moleküle23. Gemeinsam haben diese Unzulänglichkeiten der konventionellen Sonden sie unterschreiten die langfristige Kompatibilität für klinische Anwendungen und längs neurowissenschaftlichen Studien auf der Ebene der einzelnen Neuron gesucht gemacht.
Um diese Mängel zu überwinden, haben wir versucht, die Grenze zwischen den neuronalen und elektronischen Systemen durch die Entwicklung eines neuen Paradigmas der "Gewebe-Like" neuronale Sonden bezeichnet Netz Elektronik16,21,24zu verwischen. Netz-Elektronik befasst sich oben passende Größe, Mechanik und Topologie durch den Einbau von (1) strukturelle Merkmale der gleichen Nanometer Größe maßstabsgetreu Mikrometer von neuronalem Gewebe (2) mechanische Eigenschaften ähnlich denen von Hirngewebe und (3) ein 3D makroporöse-Topologie ist > 90 % offener Raum und beherbergt somit Durchdringung von Neuronen und Diffusion von Molekülen durch die extrazelluläre Umgebung. Netz-Elektronik-Sonden können gerade in bestimmten Gehirnregionen durch eine Spritze und Nadel, minimale akute Schäden während der Implantation auch in tiefen Regionen21,25geliefert werden. Neuronale Soma und Axone haben gezeigt, dass die offene 3D Mesh Sonde elektronikstruktur innerhalb von Wochen nach der Injektion, wodurch eine nahtlose, Gliosis-freie Schnittstelle zwischen Aufnahme Elektronik und den umliegenden Gehirn Gewebe21 durchdringen , 26 , 27. diese einzigartigen Eigenschaften ermöglichten Netz Elektronik Sonden stabil spiking Aktivität von der gleichen einzelnen Neuronen über mindestens ein Jahr Zeitskala27verfolgen. Darüber hinaus bietet die Herstellung von der Netz-Elektronik basierend auf Photolithographie (PL) hohen Skalierbarkeit der Anzahl von Elektroden, die eingebaut werden können, mit nachgewiesenen Kanal zählt bis zu 128 Elektroden pro Sonde mit einfachen Kontakt Maske Lithographie 28 und ein Plug-and-Play-Eingabe/Ausgabe (e/a) Design, die ermöglicht eine schnelle elektrische Verbindung zum peripheren Elektronik ohne Spezialausrüstung29.
Ein breites Spektrum an Studiengängen kann profitieren von Mesh-Elektronik in Messprotokolle zu integrieren. Die meisten intracortical Aufnahme Experimente könnten davon profitieren Mesh Elektronik minimalinvasive Implantationsverfahren mittels Spritze Injektion, die drastisch reduzierten Immunantwort nach der Implantation, und die Fähigkeit zu verlassen mesh-Elektronik in der Gewebe während nachfolgende Histologie und Immunostaining für die präzise Analyse der biologischen Umgebung jeder Aufnahme-Standort. Chronische Aufnahme Experimente werden vor allem die einzigartige Fähigkeit der Netz-Elektronik, große Anzahl von einzelnen Neuronen für Monate bis Jahre verfolgen Wert abgeleitet. Diese Möglichkeit schafft Chancen für Studien mit Single-Neuron-Auflösung, die zuvor nicht praktikabel, wie z. B. longitudinal Aging Studien der neuronalen Schaltkreise, Untersuchungen der entwickelnden Gehirn und Untersuchungen über die Pathogenese der waren Enzephalopathien16.
In diesem Protokoll beschreiben wir alles, was die wichtige in einem typischen Maus neuronalen Aufnahme Experiment mit Spritze-injizierbaren Netz Elektronik Schritte (siehe Abbildung 1). Beschriebenen Schritte umfassen die Herstellung von Mesh-Elektronik in eine standard-PL-basierten Prozess möglich an vielen Universitäten, laden Netz Elektronik in Kapillare Standardnadeln stereotaktischen Injektion von Mesh Elektronik in Vivo, Verbindung von der Mesh-I/O standard-Instrumentierung Schnittstellen, zurückhaltend oder frei beweglichen Aufnahmesessions und histologischen Schnitt des Gehirngewebes mit Mesh-Elektronik. Einige Forscher mit Netz Elektronik nur für Histologie Studien erfordern nicht unbedingt Elektrische Anbindung und Aufzeichnung, in welchem Fall sie diese Schritte überspringen können. Nachdem sich vertraut zu machen mit diesem Protokoll, müssen Ermittler alle notwendigen Kenntnisse zur Netz-Elektronik in ihre eigenen Experimente verwenden.
Protokoll
Alle Verfahren, die auf Wirbeltiere tierische Themen durchgeführt stimmten die institutionellen Animal Care und Nutzung Committee (IACUC) von der Harvard University.
1. Herstellung von Mesh-Elektronik
Hinweis: In diesem Abschnitt beschriebene Verfahren dient für den Einsatz in einem standard Universität Reinraum, z. B. die Mitte für Nanoscale Systems (ZNS) an der Harvard University. Diese Anlage sowie ähnlichen Einrichtungen sind für externe Benutzer in den Vereinigten Staaten, zum Beispiel im Rahmen von der nationalen Nanotechnologie Infrastruktur Netzwerk (NNIN) unterstützt von der National Science Foundation (NSF) zugänglich. In diesen Einrichtungen viele der Werkzeuge, Geräte und Materialien, die in diesem Abschnitt beschriebenen dienen zusammen mit Zugriff auf den Reinraum und bräuchten nicht separat erworben.
Achtung: Viele der Chemikalien verwendet bei der Herstellung von Mesh-Elektronik sind gefährlich, einschließlich widersteht, CD-26 PG-Entferner, SU-8 Entwickler und Ni Radierung Lösung. Konsultieren Sie die Materialien Sicherheitsdatenblätter (MSDS) für diese Chemikalien vor Gebrauch und implementieren und geeignete Sicherheitsmaßnahmen zu allen Zeiten zu folgen.
- Thermisch verdunsten 100 nm Ni auf eine saubere Si-Wafer.
Hinweis: Typische Ablagerung Parameter sind Basisdruck von 5 x 10-7 T und Rate von 1 – 2 Å/s. Die dünne Schicht aus Ni dient als eine Opferschicht, die später aufgelöst werden wird, um Netz-Elektronik aus dem Wafer zu lösen. - Verwenden Sie die erste PL-Maske (PL-Maske-1), um unten Passivierung Schicht der Netz-Elektronik mit SU-8 negativer Photoresist (Abbildung 2A) definieren.
Hinweis: PL ist eine standard Microfabrication Technik in der ultraviolettes (UV) Licht auf eine Maske über eine lichtempfindliche Substrat gehalten gerichtet ist. Licht entweder macht unlöslich (negative Lacke) oder löslich (positive Lacke) die belichteten Bereiche auf dem Substrat. Die Masken sind in Computer-aided Design (CAD) Software gezeichnet und dann in der Regel von einem Lieferanten bestellt. Ein Mask Aligner wird verwendet, um Masken bestehenden Muster auf einem Substrat ausrichten und sie UV-Licht aussetzen. Herstellung von Mesh Elektronik erfordert vier verschiedene Masken (PL-Maske-1 bis PL Maske-4). Unsere Maske Designs sind auf Anfrage oder bei der Ressourcen-Site meshelectronics.org.- Spin-Mantel SU-8 2000.5 negativer Photoresist auf dem Wafer bei 4.000 u/min für eine ungefähre Dicke von SU-8 von 400 – 500 nm.
- Backen Sie weiche die Wafer auf eine Herdplatte für 1 min bei 65 ° C, gefolgt von 1 min bei 95 ° C.
- Laden Sie die Wafer in einem Mask Aligner, SU-8 mit PL-Maske-1 entspricht der Unterschicht Netz SU-8 verfügbar zu machen. Setzen Sie bei einer i-Linie (365 nm Wellenlänge) Dosis von 100 mJ/cm2.
- Post Backen die Wafer auf eine Herdplatte für 1 min bei 65 ° C, gefolgt von 1 min bei 95 ° C.
- Tauchen Sie die Wafer in einer Schale mit SU-8 Entwickler. Schütteln Sie die Lösung für 2 min sanft bis die Mesh-Muster in der SU-8 voll entwickelt worden. Spülen Sie in einer Schale mit Isopropyl-Alkohol für 1 min und fönen.
- Backen Sie hart die Wafer auf eine Herdplatte bei 180 ° C für 1 h.
Hinweis: SU-8 ist normalerweise schwer zwischen 150 ° C und 250 ° C nach Entwicklung gebacken. Die harte Backen glüht Oberfläche Risse, die während der Entwicklung und weitere Querverbindungen SU-8 mechanische Stabilität zu gewährleisten bilden können. Hart backen bei 180 ° C für die Unterschicht SU-8 und 190 ° C für die Top SU-8 Schicht ergibt gute Ergebnisse für Netz-Elektronik.
- Verwendung PL-Maske-2 Metall definieren miteinander verbindet und I/O Pads (Abb. 2 b).
- Spin-Mantel LOR3A auf dem Wafer bei 4000 u/min für eine ungefähre Dicke von 300 nm.
Hinweis: LOR3A ist ein Polydimethylglutarimide-basiertes widerstehen, welche Geschwindigkeiten während des anschließenden Metallisierung Verfahrens unterboten. - Backen Sie die Wafer auf eine Herdplatte bei 180 ° C für 5 min.
- Spin-Mantel S1805 positiven Photoresist bei 4000 u/min für eine ungefähre Dicke von 500 nm.
- Backen Sie die Wafer auf eine Herdplatte bei 115 ° C für 1 min.
- Laden Sie die Wafer in einer Mask Aligner, Expose, die S1805 mit PL-Maske-2 entspricht das Metall verbindet, und I/O-Pads. Setzen Sie bei einer h-Linie (405 nm Wellenlänge) Dosis von 40 mJ/cm2.
- Tauchen Sie die Wafer in einer Schale mit CD 26 Photoresist Entwickler. Schütteln Sie sanft die Lösung für 1 min bis das Metall Muster verbindet wurde voll entwickelt. Spülen Sie in einer Schale mit entionisiertem Wasser (DI) für 1 min und fönen.
- Thermisch verdunsten 3 nm Cr gefolgt von 80 nm Au.
Hinweis: Ein Basisdruck von höchstens 5 x 10-7 T und Abscheiderate 1 Å/s ergeben in der Regel die beste Filmqualität. - Tauchen Sie den Wafer in einem flachen Becher Entferner PG für ca. 3 h ein, bis das Metall vollständig unterboten hat, verlassen das Metall nur in den gewünschten Interconnect und I/O Pad Regionen der Netz-Elektronik. Spülen Sie mit Isopropyl-Alkohol und fönen.
- Spin-Mantel LOR3A auf dem Wafer bei 4000 u/min für eine ungefähre Dicke von 300 nm.
- Verwenden Sie PL Maske-3, um Pt-Elektroden (Abbildung 2) zu definieren.
- Wiederholen Sie die Schritte 1.3.1 durch 1.3.4.
- Laden Sie die Wafer in die Mask Aligner, die S1805 mit PL-Maske-3 entspricht der Pt-Elektroden verfügbar zu machen. Setzen Sie bei einer h-Line-Dosis von 40 mJ/cm2.
- Tauchen Sie die Wafer in einer Schale mit CD 26 Photoresist Entwickler. Schütteln Sie die Lösung für 1 min sanft bis Pt-Elektroden-Muster voll entwickelt worden. Spülen Sie in einer Schale mit DI für 1 min und fönen.
- Verwenden Sie einen Elektron Lichtstrahl Verdampfer, Kaution 3 nm Cr gefolgt von 50 nm von Pt.
Hinweis: Typische Ablagerung Parameter sind einem Basisdruck von 5 x 10-7 T und Rate von 2 Å / s. - Tauchen Sie die Wafer in einen flachen Becher Entferner PG für ca. 3 h, bis das Metall vollständig unterboten hat, verlassen Pt nur an den gewünschten Elektrode Standorten der Netz-Elektronik. Spülen Sie mit Isopropyl-Alkohol und fönen.
- Verwenden Sie PL-Maske-4 zur Passivierung Schicht der Netz-Elektronik mit SU-8 negativer Photoresist (Abb. 2D) oben Definition.
- Wiederholen Sie die Schritte 1.2.1 bis 1.2.5, außer mit PL-Maske-4 entspricht die passivierende Netz Deckschicht von SU-8 auszusetzen.
- Backen Sie hart die Wafer auf eine Herdplatte bei 190 ° C für 1 h.
Hinweis: Diese Temperatur ist 10 ° C höher als die für den harten Backen des Bodens SU-8 (Schritt 1.2.6). Dieser erhöhte Temperatur fließt leicht unten SU-8, wodurch es zu verschmelzen mit der SU-8-Deckschicht und bilden so eine einzige, kontinuierliche SU-8-Struktur.
- Mesh-Elektronik sind nun (Abb. 2E und Abbildung 3) abschließen; lassen Sie sie aus dem Si-Wafer durch Auflösen der Ni Opferschicht.
- Die Wafer mit Sauerstoffplasma bei 50 W für 1 min zu behandeln. Dieses oxidiert die SU-8-Oberfläche, damit hydrophil und ermöglicht das Netz leicht in wässriger Lösung ausgesetzt werden.
- In einem flachen Becher, Salzsäure, Eisenchlorid und DI kombinieren in einem Volumenverhältnis von 1:1:20, bzw. zu einer Lösung von Ni Ätzmittel.
- Tauchen Sie den Wafer in einem flachen Becher Ni Ätzmittel Lösung für ca. 3 h ein, bis die Netz-Elektronik komplett aus dem Si-Wafer freigegeben wurden.
- Mithilfe einer Pasteurpipette übertragen veröffentlichte Mesh, die Elektronik-Sonden aus Ni Ätzmittel, eine 100-mL-Becherglas von DI. Die Netz-Elektronik zum Übertragen eines frischen Bechers DI mindestens 3 Mal spülen sicherzustellen
- Verwenden Sie eine Pasteurpipette übertragen die Netz-Elektronik auf eine 70 % / 30 % Ethanol/Wasser-Lösung für die Desinfektion, dann verwenden Sie die Pipette übertragen die Netz-Elektronik auf sterilem Wasser zum Spülen.
Hinweis: Nach der Sterilisation, die Netz-Elektronik zu anderen Lösungen zur Funktionalisierung übertragbar. Zum Beispiel können zelluläre Adhäsion zu fördern, die Netz-Elektronik zu einer wässrigen Lösung von Poly-D-Lysin (1 mg/mL) für 24 h übertragen werden. - Verwenden Sie eine Pasteurpipette übertragen die Netz-Elektronik, eine 100-mL-Becherglas von sterilen 1 X Phosphat Sonden gepufferte Kochsalzlösung (PBS) vor der Injektion in Vivo.
2. Laden des Mesh-Elektronik in Nadeln
- Der Pipette Inhaber als erworben richtet sich an beiden Enden zu fließen. Dichtung am Ende gegenüber der kreisförmigen Schraube Verschluss mit Epoxy, so gibt es keine Leckage beim Einspritzen (Abb. 4A). Lassen Sie das Epoxidharz Aushärten, bevor Sie fortfahren.
- Die Pipette Inhaber stecken Sie einer Kapillare glasnadel. Befestigen Sie es mit der kreisförmigen Spannschraube und Cone Unterlegscheibe (Abbildung 4 b). Ein 400 µm Innendurchmesser (650 µm Außendurchmesser) Kapillare glasnadel wurde für dieses Protokoll verwendet. Andere Materialien Kapillare Nadel (zB., Metall) und Durchmessern verwendet werden, sondern erfordern möglicherweise Änderungen am Design der Netz-Elektronik Injectability zu sicherzustellen.
Hinweis: Kapillare Nadeln von 150 µm bis hin zu 1,17 mm Innendurchmesser (250 µm bis 1,5 mm Außendurchmesser) wurden in unserem Labor verwendet. Injektion durch kleinere Nadeln kann gefördert werden, indem der Schnittwinkel zwischen der Transversale und longitudinale SU-8 Netzelemente akuter, verringern die Breite der SU-8-Netzelemente, Verwendung dünner SU-8 und unter Verwendung einer gröberen (i.e., größere Elementarzelle) mesh-Struktur. Fotomasken für Meshes konzipiert für kleinere Kapillare Nadeln verfügbar auf Wunsch oder aus der Ressourcen-Site sind meshelectronics.org. Glas Kapillare Nadeln mit einem Innendurchmesser von 400 µm und äußeren Durchmesser von 550 µm sind auch im Handel erhältlich. Diese reduzieren die akute Gewebeschädigung durch Injektion verursacht, während gleichzeitig die Kompatibilität mit Maschen erfordern einen Innendurchmesser von 400 µm, aber sie waren nicht für die hier beschriebenen Studien verwendet. - Legen Sie eine 1 mL Spritze auf den seitenauslass von der Pipette Inhaber mit einer 2-4 cm Länge der Kapillare Schläuche.
- Legen Sie die Kapillare glasnadel in 100-mL-Becherglas von PBS, enthält die Netz-Elektronik. Positionieren Sie das Ende der Nadel in der Nähe von die I/O-Pads eines Netzes Elektronik Sonde und manuell einfahren die Spritze um eine Netz-Elektronik-Sonde in die Nadel (Abb. 5 und ergänzende Video 1) zu zeichnen.
Hinweis: Die I/O-Pads, Stamm vernetzen Region und Netz Gerät Region sind mit bloßem Auge leicht erkennbar, wenn die Netz-Elektronik-Sonden in Lösung ausgesetzt sind. Dies ermöglicht eindeutige Laden der Netz-Elektronik in die Nadeln mit der richtigen Ausrichtung. - Klemm-/Abschieber Spritzenkolbens während noch in Kochsalzlösung getaucht um die Position des Netzes Elektronik innerhalb der Nadel einstellen.
Hinweis: Ideale Positionierung mit der ultraflexible Netz Gerät Region nahe dem Ende der Nadel wie möglich ist. Diese Konfiguration wird das Volumen der Flüssigkeit, die injiziert wird in das Gehirn während der Gewährleistung, dass die Gerät Region zuerst injiziert wird und die I/O-Pads letzten minimiert. - Trennen Sie sorgfältig die Kapillare Schläuche aus den seitenauslass des Inhabers Pipette. Lösen Sie es langsam, um zu vermeiden, erstellen eine Saugkraft, die die Position der Netz-Elektronik innerhalb der Nadel verändern könnte.
(3) stereotaktischen Injektion von Mesh-Elektronik in Live Mäusegehirn
Hinweis: Mäuse wurden durch intraperitoneale Injektion mit einer Mischung aus 75 mg/kg Ketamin und 1 mg/kg Dexdomitor betäubt. Der Grad der Narkose wurde mit der Zehe-Pinch-Methode vor Beginn der Operation überprüft. Körpertemperatur wurde beibehalten, indem Sie die Maus auf eine 37 ° C homöotherm Decke unter Narkose. Richtige steriler Technik wurde für die Chirurgie, einschließlich aber nicht beschränkt auf Autoklavieren alle chirurgische Instrumente aus Metall für 1 h vor der Verwendung, Verwendung steriler Handschuhe, mit einem heißen Perle Sterilisator während der Operation, die Wartung von einem sterilen Bereich umgesetzt. rund um die Operationsstelle, die Desinfektion von Kunststoff Instrumente mit 70 % Ethanol und enthaarten Kopfhaut war Haut mit jodophor vor dem Schnitt vorbereitet. Für Überleben Operationen, nach Abschluss der Operation Antibiotikum-Salbe wurde angewendet, um die Wunde herum, und die Maus an einem Käfig ausgestattet mit einem 37 ° C Heizkissen zurückgegeben wurde. Mäuse wurden nicht unbeaufsichtigt gelassen, bis sie zur Aufrechterhaltung der sternalen liegen ausreichend aufwachte hatte. Mäuse erhielten Buprenorphin Analgesie durch intraperitoneale Injektion in einer Dosierung von 0,05 mg/kg Körpergewicht alle 12 h für bis zu 72 h nach der Operation. Mäuse wurden isoliert von anderen Tieren, die nach der Operation. Mäuse wurden eingeschläfert, entweder intraperitoneale Injektion von Pentobarbital bei einer Dosis von 270 mg/kg Körpergewicht oder über Transcardial Perfusion (siehe Punkt 6.1). Ermittler folgender Geiger, Et al. 30, Kirby, Et al. 31und Gage, Et Al. 32 für Details auf Nagetier stereotaktischen Chirurgie.
- Die Maus zu betäuben und in einem stereotaktischen Rahmen befestigen.
- Wenden Sie okuläre Schmiermittel auf der Maus Augen gegen Trockenheit während Narkose an
- Verwenden Sie ein Zahnbohrer und stereotaktischen Rahmen um eine Kraniotomie an die gewünschten Koordinaten auf den Schädel zu öffnen. Öffnen Sie eine zweite Kraniotomie entfernt von der Einstichstelle für die Einfügung eines Edelstahl-Erdungsschraube oder Draht.
- Befestigen Sie eine Spannvorrichtung Substrat an den Schädel mit dental Zement. Schneiden Sie eine ca. 1 mm breite Lücke in das Substrat zur Verbesserung der Zuverlässigkeit der klappbaren Schritt später in der Prozedur.
Hinweis: Ein flexibles Kabel (FFC) geschnitten, ein "L" Form funktioniert gut (Abb. 7A), obwohl viele Materialien funktionieren würde, solange sie die richtige Stärke für den 32-Kanal NULL Insertion Force (ZIF) Stecker (ausgelegt für 0,18 ± 0,05 mm dicke Kabel) sind. - Befestigen Sie die Pipette-Halterung, mit der Nadel mit Maschen-Elektronik auf der stereotaktischen Rahmen mit einem rechten Winkel Ende Schelle (Abbildung 4 und Abbildung 6A).
- Legen Sie seitenauslass des Inhabers Pipette auf eine 5 mL Spritze befestigt in einer Spritze-Pumpe (Abbildung 6) mit einer etwa 0,5 – 1 m Länge der Kapillare Schläuche.
Hinweis: Stellen Sie sicher, gibt es keine Luftblasen in die Kapillare Schläuche vor Anschluss an die Pipette Halter. Luftblasen können unterbrechen den Fluss beim Einspritzen und verhindern eine glatte, kontrollierte Lieferung von Mesh-Elektronik. - Verwenden Sie den stereotaktischen Rahmen um die Spitze der Nadel in die gewünschte Startposition innerhalb des Gehirns zu positionieren.
Hinweis: Die Netz-Elektronik-Sonden verwendet hier sollen mit der Aufnahme von Elektroden verteilt auf eine Länge von ca. 2 mm und die erste Elektrode befindet sich ca. 0, 5 mm aus der vordere Rand der Netz-Elektronik (äußerste linke Flanke in Abbildung 3A). Aus diesem Grund sollte der stereotaktischen Koordinaten werden so gewählt, dass der kleinste 0,5 mm tiefer als die Region des Gehirns von Interesse ist. Die Verbreitung und Standort der Aufnahme Elektroden im Netz Elektronik während des Entwurfsprozesses Maske frei wählbar und sollte ausgewählt werden, so dass die Aufnahme Elektroden Gehirn Region(en) Sehenswürdigkeiten erstrecken, wie sie entlang ihrer stereotaktischen injiziert werden Flugbahn. - Positionieren Sie die Kamera (Abb. 6 b) um die Spitze des Prüfpunkts Netz Elektronik innerhalb der glasnadel anzuzeigen. Einige Software kann der Benutzer zum Zeichnen einer Linie auf dem Bildschirm, um die ursprüngliche Position der Netz-Elektronik zu markieren.
- Initiieren Sie den Fluss durch Einstellung der Spritzenpumpe auf eine niedrige Drehzahl und Start drücken. 10 mL/h ist eine typische Start Durchflussmenge 400 µm Innendurchmesser Kapillare Nadel. Steigern Sie langsam die Durchflussmenge, wenn die Netz-Elektronik-Sonde nicht innerhalb der Nadel bewegt.
Hinweis: Es ist wichtig, das Volumen der Flüssigkeit, die ins Gehirn injiziert werden, da dies das Gewebe rund um die Injektionsstelle beschädigen kann zu minimieren. Besten Ergebnisse erzielen Sie mit Injektionsvolumina weniger als 25 µL pro 1 mm des injizierten Maschenlänge. Ideale Werte sind weniger als die Hälfte dieses Bandes; in unserem Labor injizieren wir in der Regel 10 – 50 µL pro eine Maschenlänge 4 mm injiziert. - Als die Netz-Elektronik-Sonde innerhalb der Nadel zu bewegen beginnt, verwenden Sie den stereotaktischen Rahmen, die Nadel mit der gleichen Rate zurückzuziehen, womit die Netz-Elektronik-Sonde mit der markierten Ausgangsposition der Netz-Elektronik als Leitfaden eingespritzt wird.
Hinweis: Dieses Verfahren, genannt das Sichtfeld (FoV) Injektion Methode25, ermöglicht präzise Anlieferung Netz Elektronik um eine gezielte Gehirnregion ohne zerknitterte oder Dislokation. Oft kann der Volumenstrom reduziert werden, sobald die Netz-Elektronik-Sonde beginnt innerhalb der Nadelöhrs. In unserem Labor Flussraten von 20-30 mL/h sind oft erforderlich, um die Überwindung der Haftreibung zwischen Netz und Kapillare Nadel Wänden, aber die Rate kann dann auf 10 mL/h reduziert werden, sobald der Einspritzvorgang eingeleitet wurde. Durchflussraten und Einspritzmengen sind in der Regel kleiner für kleinere Durchmesser Kapillare Nadeln. - Weiterhin fließen Kochsalzlösung und zurückziehen der Nadelöhrs, bis die Nadel den Schädel beendet wurde. Stoppen Sie die Strömung von der Spritzenpumpe.
4. Input/Output Schnittstelle
Hinweis: an dieser Stelle hat die Netz-Elektronik-Sonde aus der gewünschten Ausgangspunkt innerhalb des Gehirns entlang der gewählten Flugbahn injiziert. Die Nadel hat zurückgezogen worden und ist oberhalb der Kraniotomie mit dem Netz, die Elektronik verbindet – vom Gehirn bis hin zu der Nadel und die i/o Pads noch in die Nadel (Abbildung 7). In diesem Abschnitt wird eine Leiterplatte (PCB; Abbildung 7, Bild 8) an die Netz-Elektronik-Sonde eine Schnittstelle. Die PCB verbindet einen ZIF-Anschluss an einen standard 32-Kanal-Verstärker-Anschluss durch eine isolierende Substrat, das die Kopf-Bühne für neuronale Aufnahme Experimente wird. Die Platine ist anpassbar an verschiedenen Kopf-Bühne Konfigurationen beherbergen. Unsere Design-Dateien gibt es auf Wunsch oder aus der Ressource-Website, meshelectronics.org, und kann verwendet werden, um PCB von Anbietern von PCB Fertigung und Montage Dienstleistungen kostengünstig erwerben.
- Verwenden des stereotaktischen Rahmens vorsichtig die Nadel zum Substrat Klemm-FFC führen und über die Lücke, fließt die Lösung mit der Spritzenpumpe locker in die Netz-Elektronik zu generieren (Abbildung 7) verbindet.
- Sobald die Nadel über dem Spann Substrat und über die Lücke ist, fortsetzen Sie, den Fluss mit einer schnellen Rate zum Auswerfen der Netz-Elektronik I/O-Pads auf dem Spann Substrat (Abbildung 7).
- Mit einer Pinzette und einer Pipette DI, biegen Sie die I/O-Pads um ca. 90°-Winkel als in der Nähe der ersten I/O Pad wie möglich.
Hinweis: Die Biegung ist erforderlich, damit die Pads in den ZIF-Anschluss auf einer Leiterplatte in einem nachfolgenden Schritt eingefügt werden soll. Der ZIF Connector ist genau die gleiche Breite wie die 32 I/O-Pads der Netz-Elektronik-Sonde, so eine unvollkommene 90° biegen, oder einer Kurve nicht direkt vor dem ersten I/O-Pad, vorkommenden führt zu I/O-Pads (die am weitesten links Pads in Abbildung 7E) abgeschnitten. - Sobald die I/O Pads ausgerichtet sind, Druckluft entfaltet, und in einem 90° Winkel an den Netz-Stamm, trocken sie mit sanft fließenden.
Hinweis: Mesh Elektronik mit weniger als 32 Kanäle Sonden kann, mit der gleichen 32-Kanal Interface-Platine angeschlossen werden. Unser Labor verwendet beispielsweise häufig 16-Kanal-Netz, die Elektronik-Sonden mit 32-Kanal-PCB. Dies bietet zusätzlichen Platz innerhalb der ZIF-Anschluss, Anbindung erleichtert, und die zusätzlichen unkontaktierten Kanäle sind leicht zu identifizieren als offene Stromkreise mittels Impedanz testen während der Aufnahme-Sessions. - Schneiden Sie das Spannmittel Substrat an einer geraden Kante ca. 0,5 – 1 mm von der Kante der I/O Pads. Schneiden Sie auch überflüssige Teile des Spann Substrat, das das Einfügen in die PCB-mounted 32-Kanal ZIF Connector (Abbildung 7F) behindern.
- Legen Sie die I/O-Pads in den ZIF-Anschluss auf der Platine und schließen Sie die Verriegelung (Abbildung 7). Einsatz-Mess-Elektronik zur Messung der Impedanz zwischen den Kanälen und der Erdungsschraube erfolgreich bestätigen Anbindung. Wenn die Impedanzwerte zu hoch sind, das ZIF Steckverbinder entriegeln, stellen Sie die Einfügemarke, und testen Sie erneut bis erfolgreicher Verbindung bestätigt wird.
- Decken die ZIF Steckverbinder und exponierten Netz Elektronik verbindet mit dental Zement für Schutz. Drehen der PCB an der Lücke im Substrat, und befestigen Sie die Platine mit Zement auf der Maus-Schädel (Abbildung 7 H).
Hinweis: Biegung der FFC am Spalt reduziert die mechanische Beanspruchung, die manchmal das Netz brechen kann, die Elektronik verbindet. - Ermöglichen Sie den Zement zu Härten, die PCB in einer robusten, kompakten Kopf-Bühne für Schnittstellen während der anschließenden Aufnahme-Sessions (Abbildung 7I) zu verwandeln.
(5) neuronale Aufnahme Experimente
- Platzieren Sie den Mauszeiger in eine Tailveiner oder andere einschränkende33. Fügen Sie der Vorverstärker PCB in den standard Verstärker-Anschluss auf der Platine Kopf-Bühne. Verwenden Sie ein separates Kabel, um die Referenz-Schraube zu Boden.
- Lassen Sie für zurückhaltende Aufnahmen die Maus in die Restrainer. Notieren Sie die Daten mit dem Datenerfassungssystem für den gewünschten Zeitraum (Abb. 8A).
- Lassen Sie für die frei beweglichen Aufnahmen die Maustaste aus dem Restrainer nach dem Einlegen der Vorverstärker PCB und Erdung der Referenz-Schraube. Rekord für die von Ihnen gewünschte Zeitspanne das Datenerfassungssystem mit, während die Maus frei verhält sich (Abb. 8 b).
- Am Ende der Aufnahme-Session setzen Sie die Maus wieder in die Restrainer bei Bedarf. Entfernen Sie die Erdung und Vorverstärker, dann lassen Sie die Maustaste wieder in seinen Käfig und schicken Sie es an der Tierhaltung bis zur nächsten Aufnahme-Sitzung.
6. histologischen Schnitt, Färbung und Imaging
- Warten Sie, bis die gewünschte Zeit nach der Injektion, dann die Maus zu betäuben und Transcardially durchspülen mit Formaldehyd. Entfernen, Einfrieren und Cryosection des Gehirns in 10 µm dicke Scheiben schneiden. Ein detailliertes Protokoll auf Immunohistochemistry und Kryoschneiden von Nagetier Gehirngewebe finden Sie in Evilsizor, Et Al. 34.
Hinweis: Hirngewebe mit Mesh-Elektronik werden festgelegt und geschnitten normalerweise, obwohl die Überwachungselektronik innen gelassen werden. Dies ist eine einzigartige Fähigkeit, im Vergleich zu herkömmlichen neuronale Sonden, die muss entfernt werden, bevor Sie schneiden und daher das Gewebe zu ändern oder machen es schwierig, die Sonde-Gewebe-Schnittstelle zu analysieren. - Spülen Sie die gefrorene Gehirn Gewebeschnitte 3 Mal in 1 X PBS.
- Blockieren Sie die Abschnitte in einer Lösung von 0,3 % Triton x-100 und 5 % ziegenserum in 1 X PBS. 1 h bei Raumtemperatur stehen lassen.
- Inkubieren Sie die Abschnitte mit der Lösung des primären Antikörper. Die hier verwendeten Primärantikörper-Lösungen wurden Kaninchen Anti-NeuN (Verdünnung 1: 200), Maus Anti-Neurofilamente (1: 400 Verdünnung) und Ratte Anti-GFAP (Verdünnung 1: 500) mit 0,3 % Triton x-100 und 3 % ziegenserum. Über Nacht bei 4 ° c inkubieren
- Spülen Sie die Abschnitten 9 Mal für eine Gesamtmenge von 40 min mit 1 X PBS.
- Inkubieren Sie die Gehirn-Abschnitte mit der Lösung der Sekundärantikörper. Der Sekundärantikörper Lösungen hier verwendet wurden Alexa Fluor 488 Ziege Anti-Kaninchen (Verdünnung 1: 200), Alexa Fluor 568 Ziege Anti-Maus (Verdünnung 1: 200) und Alexa Fluor 647 Ziege Anti-Ratte (Verdünnung 1: 200). Inkubieren Sie die Abschnitte für 1 h bei Raumtemperatur.
- Spülen Sie die Abschnitten 9 Mal für eine Gesamtmenge von 30 min mit 1 X PBS.
- Montieren Sie die Abschnitte auf dem Objektträger mit Deckgläsern mit antifade Eindeckmedium. Verlassen Sie die Folien in der Dunkelheit für mindestens 24 h vor der Bildgebung.
- Bild der Folien mit einem konfokalen Mikroskop mit 488 nm, 561 nm, und 633 nm Laser als der Anregungsquellen für Alexa Fluor 488, Alexa Fluor 568 und Alexa Fluor 647, beziehungsweise. Verwenden Sie differential Interferenz-Kontrast (DIC) zum Bild der Netz-Elektronik auf dem gleichen Mikroskop für nachfolgende Überlagerung der Bilder und der Analyse.
Ergebnisse
Ergebnisse variieren je nach Tierart in der Studie, die gezielte Hirnregion, die verstrichene Zeit seit Injektion, die Menge des akuten Schadens während der Injektion und der Erfolg der i/o-Anbindung Verfahren, unter anderem. Monoblock-spiking Tätigkeit möglicherweise nicht angezeigt, bis 1 Tag (bei 150 µm Innendurchmesser Nadeln) bis 1 Woche nach der Injektion und Spike Amplituden für bis zu 4 – 6 Wochen variieren können. Abbildung 9 zeigt repräsentative elektrophysiologische Daten aus einer 32-Kanal-Netz Elektronik-Sonde in den Hippocampus und primären somatosensorischen Cortex eines erwachsenen männlichen C57BL/6J Maus injiziert. Ca. 300 µV Amplitude lokales Feld Potentiale (drängendere) wurden auf allen 32 Kanälen und Monoblock-spiking Aktivität wurde auf 26 Sender aufgenommen. Die drängendere und isolierten Spitzen zwischen 2 und 4 Monaten, eine hochstabile Schnittstelle zwischen Aufnahme Elektronik und Neuronen über diesen längeren Zeitraum vorschlagen ähnlich geblieben. Abbildung 10 zeigt repräsentative Ergebnisse der histologischen Schnitt und Immunostaining des Gehirngewebes mit Netz Elektronik 1 Jahr nach der Injektion. Für NeuN, ein Marker für die neuronalen Somata und Neurofilament, ein Marker für die neuronalen Axone Färbung zeigt wenig bis gar kein Verlust der Dichte Gewebe an der Injektionsstelle, was bedeutet nahtlose Anbindung zwischen dem Netz Elektronik und Gehirn Gewebe. Färbung für GFAP (ein Marker für Astrozyten) weiter offenbart in der Nähe von Hintergrundkonzentrationen von Astrozyten rund um die Netz-Elektronik, darauf hinweist, dass seine Anwesenheit wenig chronischen Immunreaktion hervorruft.
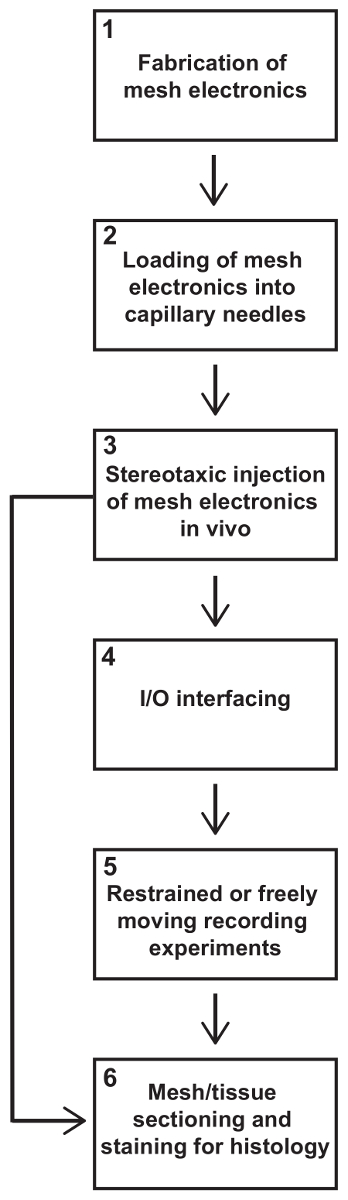
Abbildung 1: Schritte in eine Spritze-injizierbaren mesh Elektronik Experiment. Dieses Protokoll beschreibt alle wichtigen Schritte in einem typischen Nagetier neuronalen Aufnahme-Experiment mit Mesh-Elektronik. Experimente in der Regel mit sich bringen, in der Reihenfolge ihrer Durchführung, (1) Herstellung von Mesh-Elektronik, (2) Laden der Netz-Elektronik in Kapillare Nadeln (3) stereotaktischen Injektion von Mesh-Elektronik in das Gehirn, (4) Elektrische I/O Netz Anbindung Elektronik, (5) zurückhaltend oder frei beweglichen Aufnahmen und (6) Netz/Gewebe-Schnitt und Färbung für Histologie. In einigen Studien können nur die histologischen Daten erwünscht sein, in diesem Fall die Schritte (4) und (5) übersprungen werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
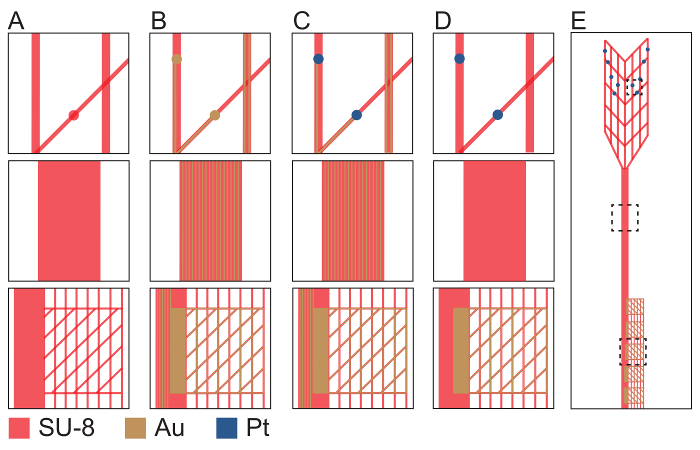
Abbildung 2: Schematische Darstellung der Herstellung Verfahren für Plug & Play Netz Elektronik im Großraum ultraflexible Gerät (obere Reihe), Stiel verbindet, Region (mittlere Reihe) und I/O Region (untere Reihe). (A) SU-8 negativer Photoresist (rot) ist gemustert mit PL-Maske-1 unten Passivierung Schicht jedes Plug & Play Netz-Elektronik-Sonde zu definieren. (B) Musterung mit PL-Maske-2, thermische Verdampfung und Metalldeckel definieren Au verbindet und I/O Pads (Gold). (C) Musterung mit PL-Maske-3, Electron Beam Verdunstung und Metalldeckel definieren Pt-Elektroden (blau). (D) SU-8 negativer Photoresist (rot) ist gemustert mit PL-Maske-4, die oberste passivierende Schicht zu definieren. Öffnungen in der SU-8 sind an jeder Pt-Elektrode und I/O Pad Links. (E) A abgeschlossen mesh Elektronik Sonde mit gestrichelten Boxen unter Angabe der Standorte in der oberen, mittleren und unteren Zeilen vergrößert. Fotomaske Design-Dateien sind auf Anfrage von den Autoren oder von der Ressource-Website meshelectronics.org. Bitte klicken Sie hier für eine größere Version dieser Figur.
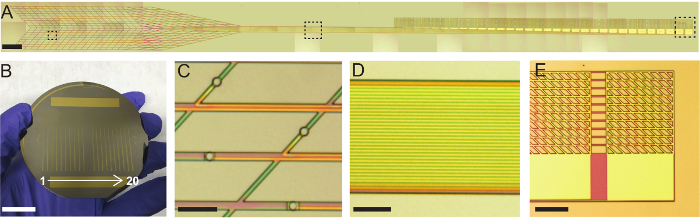
Abbildung 3: Fotos und optischen Mikroskopbilder von Plug-and-Play-mesh Elektronik. (A) gefliest Lichtmikroskop Bilder einer Spritze-injizierbaren Netz Elektronik Sonde mit Plug-and-Play-i/o. Die Sonde wurde nach der Fertigstellung der Fabrikation in Abbildung 2 aber vor der Veröffentlichung von Ni-beschichteten Substrats Schritte abgebildet. Gestrichelte Kästchen entsprechen von links nach rechts, um die Abschnitte der ultraflexible Gerät Region, Stamm und I/O Region in C, D und E, bzw. vergrößert. Maßstabsleiste = 1 mm. (B) Foto von einem 3-Zoll-Si-Wafer mit 20 abgeschlossen mesh Elektronik Sonden. Maßstabsleiste = 20 mm. (C) optische Mikroskopbild von 20 µm Durchmesser Pt Aufnahme Elektroden im Großraum ultraflexible Gerät. Maßstabsleiste = 100 µm. (D) optische Mikroskopbild von High-Density-Au in der Stamm-Region verbindet. Jede Au Interconnect ist galvanisch getrennt und eine einzige Pt-Elektrode zu einem einzigen I/O Pad verbindet. Maßstabsleiste = 100 µm. (E) optische Mikroskopbild der I/O-Pads. Jedes Pad besteht aus einer zusammenklappbaren Mesh-Region und eine kontinuierliche Dünnschicht-Region auf dem Stamm. Non-Durchführung von SU-8 Bänder verbinden die Netz-Portionen der Pads zusammen zur Aufrechterhaltung des Ausrichtung. Maßstabsleiste = 200 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Montage der Apparate für die Abhaltung der kapillarer Nadeln beim Einspritzen. (A) Foto der Komponenten des Geräts. Die Komponenten umfassen (1) eine Kapillare glasnadel, (2) eine Pipette Halter, (3) einer kreisförmigen Schraube Schraube für Inhaber der Pipette und (4) ein Kegel-Waschmaschine für die Pipette-Halter. Artikel (2) bis (4) sind mit Kauf von einer Pipette Halterung enthalten. Der Pfeil markiert das Outlet von der Pipette-Inhaber muss geschlossen mit Epoxy geklebt werden. (B) Lichtbild des Inhabers Pipette nach Montage und Einfügung einer Glas-Kapillare-Nadel. Die zusätzliche Epoxy ist sichtbar am oberen Ausgang des Pipette Halter (durch Pfeil markiert) und Kapillare Schläuche verbindet die Pipette-Halter mit einer Spritze (nicht dargestellt). (C) Foto von der Pipette-Inhaber und die Kapillare Nadel nach dem Anbau der stereotaktischen Rahmen mit einer rechtwinkligen Ende Klammer. Maßstabsleisten sind 1 cm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5: der Netz-Elektronik in Glas Nadeln laden. (A) schematische Darstellung der Ladevorgang für Plug & Play Netz Elektronik. Eine glasnadel ist nahe dem I/O Ende einer Netz-Elektronik-Sonde positioniert, während es in Lösung ausgesetzt ist. Der Spritzenkolben ist dann manuell zurückgezogen, um in der Netz-Elektronik-Sonde zu zeichnen. Ideale Positionierung ist mit der ultraflexible Gerät Region gleich hinter dem Ende der Nadel. (B) Fotos (A) entspricht einer Netz-Elektronik-Sonde in einer glasnadel geladen werden. Skalieren von Balken = 2 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6: Schematische der stereotaktischen Chirurgie Station. Ein motorisierte stereotaktischen Rahmen (A) mit beiliegenden Pipette Halter wird verwendet, um die Nadel in die gewünschte Hirnregion zu positionieren. Die Position der Nadel und geladene Gitter Elektronik überwacht mit einem Objektiv und Kamera (B) angeschlossen und am Computer (C) angezeigt. Eine Spritzenpumpe (D) durchfließt genaue Mengen Kochsalzlösung die Nadel ermöglicht präzise, kontrollierte Einspritzung von Mesh-Elektronik in der gewünschten Hirnregion. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 7: Plug & Play I/O Anbindung Verfahren. (A) eine FFC spannen Substrat mit dental Zement angrenzend an die Kraniotomie gesichert wird. (B) Plug & Play Netz Elektronik in der gewünschten Hirnregion, die mit der FoV-Methode stereotaxically eingespritzt werden. (C) die Nadel, mit der I/O-Pads des Netzes Elektronik Sonde noch drinnen, wird über den FFC spannen Substrat verschoben. (D) Strömung wird durch die Nadel, die I/O-Pads auf der FFC spannen Substrat auszuwerfen fortgesetzt. (E) sind die I/O-Pads gebogen 90 ° bezogen auf Stamm, entfaltet mit der Durchführung von Seite nach oben, und im Ort getrocknet. (F) die FFC-Substrat wird mit einer Schere auf eine geradlinige ca. 0,5 mm von der Kante der I/O Pads getrimmt. Überschüssige Substrat schneiden entfernt, um das Einfügen in eine 32-Kanal-ZIF-Anschluss ermöglichen. (G) die i/o-Pads werden in eine 32-Kanal ZIF Steckverbinder montiert auf einer benutzerdefinierten Leiterplatte eingefügt. ZIF Connector ist verriegelt zu geschlossenen Kontakt mit den I/O-Pads. (H) die Verriegelung wird zementiert geschlossen, ist die Platine umgedreht auf den Schädel, und die Platine ist mit dental Zement fixiert. (ich) die Leiterplatte bildet eine kompakte Headstage mit einem standard Verstärker-Anschluss für die einfache Anbindung während der Aufnahme-Sessions. Skalieren von Balken = 1 cm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 8: zurückhaltend und frei beweglichen Aufnahmen. (A) Foto von einem männlichen C57BL/6J Maus in eine einschränkende während einer Aufnahme-Session. Eine 32-Kanal Vorverstärker-Platine wurde in den standard Verstärker Anschluss eingefügt. (B) Foto von der gleichen Maus mit 32-Kanal Vorverstärker PCB während eines frei beweglichen Aufnahme-Experimentes. Skalieren von Balken = 1 cm. Bitte klicken Sie hier für eine größere Version dieser Figur.
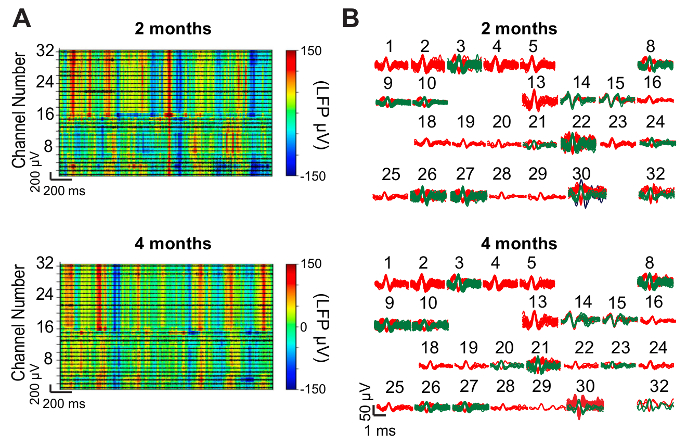
Abbildung 9: Repräsentative neuronalen Aufnahme Ergebnisse. (A) Vertreter LFP Heatmaps von 32-Kanal Elektronik-Sonden in der Maus Hippocampus und somatosensorischen Cortex injiziert Mesh. Daten wurden aufgenommen, während die Maus frei seinen Käfig auf 2 Monate (oben) und 4 Monate (unten) nach der Injektion untersucht. LFP-Amplitude ist farbkodiert entsprechend der farbigen Leiste auf der rechten Seite. Hochpass-gefilterte Spuren (schwarz) zeigt einen Aktivität sind für jede der 32 Kanäle das Spektrogramm überlagert. (B) Spikes isoliert nach Sortierung der Daten in (A) aufgetragen. Monoblock-spiking Aktivität wurde auf 26 der beiden 32 Kanäle 2 Monate nach der Injektion (oben) und 4 Monate nach der Injektion (unten) entdeckt. Die Zahlen über jedem Cluster Spitzen entsprechen die Kanalnummern in (A). Diese Zahl wurde von Fu, Et Al. modifiziert 28. Bitte klicken Sie hier für eine größere Version dieser Figur.
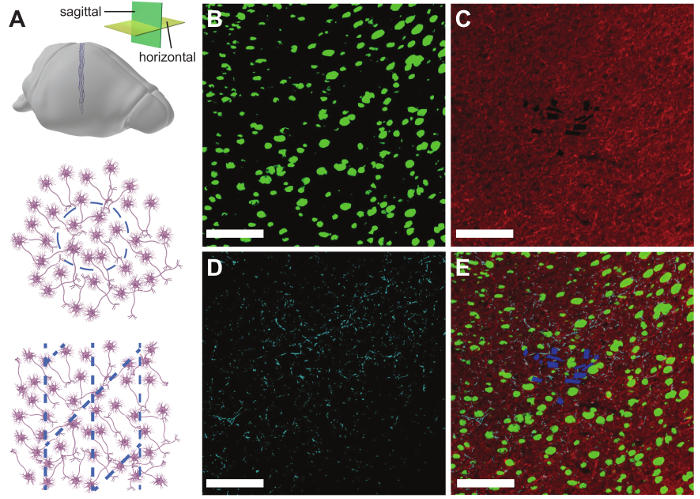
Abbildung 10: Repräsentative Histologie Ergebnisse. (A) Schema veranschaulicht die Ausrichtung des Mesh-Elektronik im Horizontal (mittlere Panel) und sagittale Gehirnscheiben (Bodenplatte). (B) Fluoreszenz Mikroskopbild eines 10 µm dicken kortikalen Gehirn Slice ein Jahr nach der Injektion ein 16-Kanal-Netz-Elektronik-Sonde. Die Scheibe wurde Immunostained für NeuN (grün). (C) die gleichen Gehirn-Scheibe Immunostained für Neurofilamente (rot). (D) das gleiche Gehirn Scheibe Immunostained für GFAP (Cyan). (E) ein zusammengesetztes Bild (b) bis (D) zeigt das Netz Elektronik/Gewebe mit beschrifteten NeuN (grün), Neurofilament (rot), GFAP (Cyan), Schnittstelle und mesh-Elektronik (blau). Skalieren von Balken = 100 µm. Diese Zahl wurde von Fu Et Al. modifiziert 27. Bitte klicken Sie hier für eine größere Version dieser Figur.
Ergänzende Video 1: wiederholt be- und Injektion von Mesh-Elektronik in Lösung. Bitte klicken Sie hier, um diese Datei herunterladen.
Diskussion
Alle Schritte in der Herstellung und der Einsatz von Mesh-Elektronik sind wichtig, aber ein paar sind besonders kritisch. Vor der Freigabe der Netz-Elektronik aus ihren Wafer, unbedingt oxidieren die Oberfläche um die Gitter leicht ausgesetzt in wässriger Lösung (Schritt 1.6.1) zu machen. Wenn dieser Schritt übersprungen, die Netze in der Regel auf der Oberfläche des Wassers Schwimmen, so dass sie schwer in die Nadeln zu laden, wenn sie geladen werden können, sie oft an den Seiten des Glas-Nadeln bleiben erfordern große Mengen (> 100 µL) für die Injektion. Nichtbeachtung die Oberfläche oxidieren vor Release, daher in der Regel bedeutet, dass die Maschen nicht verwendet werden können und die Herstellung muss von Anfang an erneut durchgeführt. Ein weiterer wichtiger Schritt ist die Netz-Elektronik biegen "Stamm", ~ 90° während das i/o Schnittstellen (Schritt 4.3). Wenn der Winkel kleiner als 90° ist, dann passt alle 32 I/O Pads in den ZIF-Anschluss nicht; Einige haben Ende erlauben das Einfügen, Verringerung der Zahl der angeschlossenen Elektroden abgeschnitten werden. Der Prozess muss auch sanft erfolgen, um die Stängel brechen zu verhindern.
Das Design des Netzes Elektronik kann für verschiedene Anwendungen angepasst werden, durch Ändern der Fotomasken und der gleichen Fertigung Verfahren in Abbildung 2dargestellt. Z. B. während die Netz-Elektronik-Sonden verwendet, um den Datensatz in Abbildung 9 32 Aufnahme Elektroden die Maus Hippocampus und primären somatosensorischen Cortex span haben sollen, kann die Platzierung der Elektrode innerhalb der ultraflexible Netz sein zu nahezu jedem Gehirn Region(en) gezielt ausgewählt können, oder größere Elektroden zur Stimulation eingebaute27. Das gleiche grundlegende Netz-Struktur und Herstellung-Verfahren werden beibehalten, aber die Platzierung der Elektrode und das Design werden angepasst, um den Bedürfnissen der Studie. Ermittler sollten vorsichtig, aber, und immer testen, ob die geänderte Designs leicht durch die beabsichtigte Nadeln injiziert werden können. Kleine Veränderungen an der Biegung Mechanik der Netz-Elektronik können erhebliche Auswirkungen auf die Injectability haben. Ein Beispiel dafür ist, dass ein Winkel von 45° zwischen Quer- und längs-SU-8-Bänder ergibt eine Netz-Elektronik-Sonde, die facilely eingespritzt werden kann aber ein 90° Winkel ergibt sich eine, zerknüllt und clogs Nadeln21.
Messung der Impedanz der Aufnahme Elektroden ist hilfreich für die Problembehandlung. Eine 20 µm Durchmesser kreisförmige Pt-Elektrode sollte eine Impedanz-Helligkeit in der Nähe von 1 MΩ, wenn bei einer Frequenz von 1 kHz in Vivo oder in 1 x PBS29gemessen haben. Eine Impedanz deutlich größer als das impliziert, dass die Elektrode nicht ausgesetzt, wie geschehen kann, wenn es mit Fotolack Rückständen kontaminiert ist, oder nicht elektrisch verbunden. Letzteres kann auftreten, zum Beispiel gibt es Staub auf der Foto-Maske während PL, die Ergebnisse in eine Trennung in der Au verbindet, ob eines der Gitter I/O Pads nicht durch das ZIF-Anschluss-Pins während I/O Schnittstellen kontaktiert wird. Eine Impedanz Helligkeit etwa die Hälfte der erwartete Wert legt nahe, dass der Kanal auf die angrenzenden, erstellen eine Schaltung von zwei Elektroden Impedanzen parallel zueinander kurzgeschlossen werden kann. Die gemessenen Impedanzwerte handeln als Leitfaden bei der Fehlersuche; in Kombination mit optischen Mikroskopie der Netz-Elektronik-Sonden, die Ursache des Problems kann in der Regel identifiziert und korrigiert werden entsprechend in der nächsten Fertigung laufen oder I/O Schnittstellen Versuch.
Der Einsatz von Spritze injizierbaren Netz Elektronik für akute Studien beschränkt sich insofern Monoblock-spiking Aktivität in der Regel nicht bis 1 Woche Post Injektion27 beobachtet ist, obwohl neuere Arbeiten (unveröffentlicht) zeigt, dass dieses Problem leicht überwinden ist. Wichtige Determinanten der Zeitaufwand zu sehen, Spick Aktivität sind die Maschen zu entwerfen, das Volumen der Flüssigkeit im Gehirn sowie Netz-Elektronik und der Durchmesser des verwendeten zur Injektion Nadel injiziert, wie diese der Gewebeschädigung während beeinflussen die Injektion und die Rate der Heilung. Große Einspritzmengen sein erforderlich, wenn die Netz-Elektronik nicht mit Sauerstoffplasma vor der Veröffentlichung in Ni Ätzmittel behandelt werden; Das heißt, wenn das Netz nicht hydrophil ist, kann es die glasnadel einhalten. Gelegentlich müssen die Maschen Mängel, die auf Biegung Mechanik die sie injizieren erschweren führen. Während des Ladens der Netz-Elektronik ist es wichtig zu überprüfen, dass Netze einfach und reibungslos in die Nadel bewegen (siehe ergänzende Video 1). Wenn dies nicht der Fall ist, sollte eine anderes Netz elektronische Sonde verwendet werden. Beste Ergebnisse für nahtlose neuronale Schnittstellen werden mit der ideale Einspritzmengen von 10 – 50 µL pro 4 mm der injizierten Maschenlänge erreicht werden. Neuere Ergebnisse mit feineren Netz Elektronik Sonden injiziert und/oder kleinere Durchmesser Kapillare Nadeln (so klein wie 150 µm Innendurchmesser, Außendurchmesser der 250 µm) zeigen, dass diese Einheit Spick von kurz nach der Injektion (akute Messungen) beobachtet werden können durch längere Zeiten. Maske-Design-Dateien für diese feineren Netz-Strukturen stehen auf Wunsch oder aus der Ressource-Website meshelectronics.org. Wir schätzen die Gesamtausbeute von unserer in-Vivo Netz Injektionsverfahren mit 400 µm Innendurchmesser (Außendurchmesser 650 µm) Nadeln bei etwa 70 %, obwohl die Ausbeute näher an 80-90 % für unsere neueren Arbeiten mit 150 µm Innendurchmesser (250 µm Außendurchmesser ) Nadeln. Die häufigsten Gründe für das Scheitern sind (1), dass das Netz injizieren nicht reibungslos, wodurch Hirnödem von unerwartet große Einspritzmengen in das Gehirn, (2) Netz Bruch während der manuellen Bearbeitung benötigt die i/o-Anbindung Verfahren und (3) Blutungen aus Beschädigung ein Blutgefäß während der Injektion. Ein Blutgefäß zu beschädigen, während der Einspritzung ist selten (die Ursache von weniger als 10 % der Ausfälle) und konnte reduziert werden weitere mithilfe von Image-guided-Surgery. Wir stellen auch fest, dass Schäden der Blutgefäße eine gemeinsame Einschränkung für alle Verfahren, die Durchdringung des Hirngewebes, einschließlich Injektion von viralen Partikel zur Transfektion, Implantation von starren Gehirn Sonden und Injektion von der Netz-Elektronik ist.
Mesh Elektronik Sonden sind stabil aus erfassen und verfolgen die gleichen einzelnen Neuronen auf mindestens Monate, Jahr Fristen und fast keine chronischen Immunantwort hervorrufen, wie in Abbildung 9 und Abbildung 10, bzw. demonstriert. Dies bietet erhebliche Vorteile im Vergleich zur Konvention Tiefe Elektroden, die häufig Leiden verringern Spike Amplituden, instabilen Signale und chronischen Entzündungen im Laufe des langfristigen Aufnahme Experimente14, 15. Darüber hinaus die Netz-Elektronik haben den Vorteil, dass sie in das Gewebe Links können während der histologischen Schnitt, Färbung, und bildgebende Verfahren, im Gegensatz zu herkömmlichen Sonden, die sind zu starr und müssen daher vor der Histologie entfernt werden Analysen. Daher erlauben Netz Elektronik für die einzigartige Fähigkeit, immunhistochemische Analyse verwenden, um die zelluläre Umgebung jeder Aufnahme Standort genau zu studieren.
Das Protokoll präsentiert hier öffnet-Up aufregende neue Möglichkeiten in den Neurowissenschaften. Die minimal-invasive Methode und nahtlose Integration von Netz-Elektronik mit Hirngewebe minimiert Unterbrechungen für neuronale Schaltkreise und vermeidet chronische Immunantwort, die meisten Arten von chronischen neuronalen Aufnahme Experimente profitieren könnten. Die Fähigkeit des Netzes Elektronik zu erfassen und verfolgen die gleichen einzelnen Neuronen für längere Zeit besonders von Interesse für die Ermittler wollen Millisekunde-Skala spiking Aktivität korrelieren mit Monat-Jahr-langen Prozessen wie Alterung, werden die Pathogenese der Erkrankung des Gehirns oder Gehirn Entwicklung16,18. Darüber hinaus gibt es erhebliche Möglichkeiten zu erweitern und passen Sie dieses Protokoll, z. B. die PCB Kopf-Bühne zu implementieren Funktionen wie digitale Multiplexen8,35, aktive Elektronik hinzugefügt wireless Kommunikation35,36,37und Signalverarbeitung35, Co Injektion von Stammzellen oder Polymere mit der Netz-Elektronik in Tissue Regeneration18,38Hilfe, 39und Einbeziehung Nanodraht – Feldeffekt-Transistoren (NW-FETs) in mesh Elektronik für stark lokalisiert und multifunktionale Gehirn Sonden24,29,40,41 ,42.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
C.M.L. räumt Unterstützung dieser Arbeit durch die Air Force Office of Scientific Research (FA9550-14-1-0136), Harvard University Physik und Engineering Accelerator Award und eine nationale Institute der Gesundheit Direktor Pioneer Award ( 1DP1EB025835-01). T.G.S räumt Unterstützung durch das Department of Defense (DoD) durch das National Defense Science & Engineering Graduate Fellowship (NDSEG) Programm. G.h. entnimmt Gemeinschaft Unterstützung aus der American Heart Association (16POST27250219) und der Weg zur Unabhängigkeit Award (übergeordnete K99/R00) das National Institute on Aging von den National Institutes of Health. Diese Arbeit wurde teilweise an der Harvard University Center für Nanoscale Systems (ZNS), ein Mitglied von der nationalen Nanotechnologie abgestimmte Infrastruktur Netzwerk (NNCI), durchgeführt, der von der National Science Foundation unter NSF ECCS Award Nr. unterstützt wird 1541959.
Materialien
| Name | Company | Catalog Number | Comments |
| Motorized stereotaxic frame | World Precision Instruments | MTM-3 | For mouse stereotaxic surgery |
| 512-channel recording controller | Intan Technologies | C3004 | A component of the neural recording system |
| RHD2132 amplifier board | Intan Technologies | C3314 | A component of the neural recording system |
| RHD2000 3 feet ultra thin SPI interface cable | Intan Technologies | C3213 | A component of the neural recording system |
| Mouse restrainer | Braintree Scientific | TV-150 STD | Standard 1.25 inch inner diameter; used to restrain the mouse during restrained recording sessions. |
| Si wafers | Nova Electronic Materials | 3" P <100> .001-.005 ohm-cm 356-406 μm Thick Prime Grade SSP Si wafers w/2 Semi-Std. Flats & 6,000 A°±5% Wet Thermal Oxide on both sides. | |
| Photomasks (chrome on soda lime glass) | Advance Reproductions | Advance Reproductions and other vendors manufacture photomasks from provided design files. Our photomask design files are available by request or from the resource website, meshelectronics.org. Alternatively, some university clean rooms have mask writers for making photomasks on site. | |
| AutoCAD software | Autodesk Inc. | Design software for drawing photomasks. A free alternative is LayoutEditor. Our photomask design files are available by request or from the resource website, meshelectronics.org. | |
| Thermal evaporator | Sharon Vacuum | Used to evaporate Ni, Cr, and Au onto mesh electronics during fabrication. Many university clean rooms have this or a similar tool. | |
| SU-8 2000.5 negative photoresist | MicroChem Corp. | Negative photoresist used to define the bottom and top passivating layers of mesh electronics. | |
| MA6 mask aligner | Karl Suss Microtec AG | Used to align each photomask to the pattern on the wafer and expose the wafer to UV light. Most university clean rooms have this or a similar tool. | |
| SU-8 developer | MicroChem Corp. | Used to develop SU-8 negative photoresist following exposure to UV light. | |
| LOR3A lift-off resist | MicroChem Corp. | Used with Shipley 1805 photoresist to promote undercutting during metal lift-off processes | |
| Shipley 1805 positive photoresist | Microposit, The Dow Chemical Company | Positive photoresist used to define metal interconnects and Pt electrodes in mesh electronics | |
| MF-CD-26 positive photoresist developer | Microposit, The Dow Chemical Company | To develop S1805 positive photoresist after exposure in a mask aligner. Many university clean rooms stock this chemical. | |
| Spin coater | Reynolds Tech | For coating wafers with positive and negative resists. Most university clean rooms have spin coaters. | |
| PJ plasma surface treatment system | AST Products, Inc. | Used to oxidize the surface of mesh electronics prior to release into aqueous solution. Most university clean rooms have this or a similar tool. | |
| Electron beam evaporator | Denton Vacuum | For evaporating Cr and Pt during fabrication of mesh electronics. Many university clean rooms have this or a similar tool. | |
| Remover PG | MicroChem Corp. | Used to dissolve LOR3A and Shipley S1805 resists during metal lift-off | |
| Ferric chloride solution | MG Chemicals | 415-1L | A component of Ni etching solution |
| 36% hydrochloric acid solution | Kanto Corp. | A component of Ni etching solution | |
| Glass capillary needles | Drummond Scientific Co. | Inner diameter 0.40 mm, outer diameter 0.65 mm. Other diameters are available. | |
| Micropipette holder U-type | Molecular Devices, LLC | 1-HL-U | Used to hold the glass capillary needles during stereotaxic injection |
| 1 mL syringe | NORM-JECT®, Henke Sass Wolf | Used for manual loading of mesh electronics into capillary needles | |
| Polyethylene intrademic catheter tubing | Becton Dickinson and Company | Inner diameter 1.19 mm, outer diameter 1.70 mm | |
| 5 mL syringe | Becton Dickinson and Company | Used in the syringe pump for injection of mesh electronics in vivo | |
| Eyepiece camera | Thorlabs Inc. | DCC1240C | Used to view mesh electronics within capillary needles during injection |
| ThorCam uc480 image acquisition software for USB cameras | Thorlabs Inc. | Used to view mesh electronics within capillary needles during injection | |
| Syringe pump | Harvard Apparatus | PHD 2000 | Used to flow precise volumes of solution through capillary needles during injection of mesh electronics |
| EXL-M40 dental drill | Osada | 3144-830 | For drilling the craniotomy |
| 0.9 mm drill burr | Fine Science Tools | 19007-09 | For drilling the craniotomy |
| Hot bead sterilizer 14 cm | Fine Science Tools | 18000-50 | Used to sterlize surgical instruments |
| CM1950 cryosectioning instrument | Leica Microsystems | Used to slice frozen tissue into sections. Many universities have this or a similar tool available in a shared facility. | |
| 0.3% Triton x-100 | Life Technologies | Used for histology | |
| 5% goat serum | Life Technologies | Used for histology | |
| 3% goat serum | Life Technologies | Used for histology | |
| Rabbit anti-NeuN | Abcam | ab177487 | Used for histology |
| Mouse anti-Neurofilament | Abcam | ab8135 | Used for histology |
| Rat anti-GFAP | Thermo Fisher Scientific Inc. | PA516291 | Used for histology |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific Inc. | P36930 | Used for histology |
| Poly-D-lysine | Sigma-Aldrich Corp. | P6407-5MG | Molecular weight = 70-150 kDA |
| Right-angle end clamp | Thorlabs Inc. | RA180/M | Used to attach the pipette holder to the stereotaxic frame |
| Printed circuit board (PCB) | Advanced Circuits | Used to interface between mesh electronics and peripheral measurement electronics such as the Intan recording system. Advanced Circuits and other vendors manufacture and assemble PCBs based on provided design files. Our PCB design files are available by request or at the resource site meshelectronics.org | |
| 32-channel standard amplifier connector | Omnetics Connector Corp. | A79024-001 | Component assembled onto the PCB |
| 32-channel flat flexible cable (FFC) | Molex, LLC | 152660339 | Used as a clamping substrate when interfacing to mesh electronics I/O pads with the PCB-mounted ZIF connector |
| 32-channel zero insertion force (ZIF) connector | Hirose Electric Co., LTD | FH12A-32S-0.5SH(55) | Component assembled onto the PCB |
Referenzen
- Lopes da Silva, F. EEG and MEG: relevance to neuroscience. Neuron. 80 (5), 1112-1128 (2013).
- Logothetis, N. K. What we can do and what we cannot do with fMRI. Nature. 453 (7197), 869-878 (2008).
- Seymour, J. P., Wu, F., Wise, K. D., Yoon, E. State-of-the-art MEMS and microsystem tools for brain research. Microsystems & Nanoengineering. 3, 16066 (2017).
- Buzsaki, G. . Rhythms of the Brain. , (2006).
- Khodagholy, D., et al. NeuroGrid: recording action potentials from the surface of the brain. Nature Neuroscience. , (2014).
- Hamel, E. J., Grewe, B. F., Parker, J. G., Schnitzer, M. J. Cellular level brain imaging in behaving mammals: an engineering approach. Neuron. 86 (1), 140-159 (2015).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Berenyi, A., et al. Large-scale, high-density (up to 512 channels) recording of local circuits in behaving animals. Journal of Neurophysiology. 111 (5), 1132-1149 (2014).
- Scholvin, J., et al. Close-Packed Silicon Microelectrodes for Scalable Spatially Oversampled Neural Recording. IEEE Transactions on Biomedical Engineering. 63 (1), 120-130 (2016).
- Schiller, P. H. The Central Visual System. Vision Research. 26 (9), 1351-1386 (1986).
- Benabid, A. L., Chabardes, S., Mitrofanis, J., Pollak, P. Deep brain stimulation of the subthalamic nucleus for the treatment of Parkinson's disease. The Lancet Neurology. 8 (1), 67-81 (2009).
- Hochberg, L. R., et al. Reach and grasp by people with tetraplegia using a neurally controlled robotic arm. Nature. 485 (7398), 372-375 (2012).
- Lebedev, M. A., Nicolelis, M. A. Brain-Machine Interfaces: From Basic Science to Neuroprostheses and Neurorehabilitation. Physiological Reviews. 97 (2), 767-837 (2017).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Perge, J. A., et al. Intra-day signal instabilities affect decoding performance in an intracortical neural interface system. Journal of Neural Engineering. 10 (3), 036004 (2013).
- Hong, G., Yang, X., Zhou, T., Lieber, C. M. Mesh electronics: a new paradigm for tissue-like brain probes. Current Opinion in Neurobiology. 50, 33-41 (2017).
- Dai, X., Hong, G., Gao, T., Lieber, C. M. Mesh Nanoelectronics: Seamless Integration of Electronics with Tissues. Accounts of Chemical Research. 51 (2), 309-318 (2018).
- Feiner, R., Dvir, T. Tissue-electronics interfaces: from implantable devices to engineered tissues. Nature Reviews Materials. 3 (1), 17076 (2017).
- Kandel, E. R., Schwartz, J. H., Jessell, T. M., Siegelbaum, S. A., Hudspeth, A. J. . Principles of Neural Science. , (2013).
- Rousche, P. J., et al. Flexible polyimide-based intracortical electrode arrays with bioactive capability. IEEE Transactions on Biomedical Engineering. 48 (3), 361-371 (2001).
- Liu, J., et al. Syringe-injectable electronics. Nature Nanotechnology. 10 (7), 629-636 (2015).
- Kasthuri, N., et al. Saturated Reconstruction of a Volume of Neocortex. Cell. 162 (3), 648-661 (2015).
- Saxena, T., Bellamkonda, R. V. A sensor web for neurons. Nature Materials. 14, 1190-1191 (2015).
- Xie, C., et al. Three-dimensional macroporous nanoelectronic networks as minimally invasive brain probes. Nature Materials. 14 (12), 1286-1292 (2015).
- Hong, G., et al. Syringe Injectable Electronics: Precise Targeted Delivery with Quantitative Input/Output Connectivity. Nano Letters. 15 (10), 6979-6984 (2015).
- Zhou, T., et al. Syringe-injectable mesh electronics integrate seamlessly with minimal chronic immune response in the brain. Proceedings of the National Academy of Sciences. 114 (23), 5894-5899 (2017).
- Fu, T. M., et al. Stable long-term chronic brain mapping at the single-neuron level. Nature Methods. 13 (10), 875-882 (2016).
- Fu, T. M., Hong, G., Viveros, R. D., Zhou, T., Lieber, C. M. Highly scalable multichannel mesh electronics for stable chronic brain electrophysiology. Proceedings of the National Academy of Sciences. 114 (47), E10046-E10055 (2017).
- Schuhmann, T. G., Yao, J., Hong, G., Fu, T. M., Lieber, C. M. Syringe-Injectable Electronics with a Plug-and-Play Input/Output Interface. Nano Letters. 17 (9), 5836-5842 (2017).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable stereotaxic surgery in rodents. Journal of Visualized Experiments. (20), (2008).
- Kirby, E. D., Jensen, K., Goosens, K. A., Kaufer, D. Stereotaxic surgery for excitotoxic lesion of specific brain areas in the adult rat. Journal of Visualized Experiments. (65), e4079 (2012).
- Gage, G. J., et al. Surgical implantation of chronic neural electrodes for recording single unit activity and electrocorticographic signals. Journal of Visualized Experiments. (60), (2012).
- . Lab Animal Research. Rodent Handling and Restraint Techniques Available from: https://www.jove.com/science-education/10221/rodent-handling-and-restraint-techniques (2018)
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for immunohistochemistry on cryosectioned rat brain tissue: example staining for microglia and neurons. Journal of Visualized Experiments. 10 (99), e52293 (2015).
- Sodagar, A. M., Perlin, G. E., Yao, Y., Najafi, K., Wise, K. D. An Implantable 64-Channel Wireless Microsystem for Single-Unit Neural Recording. IEEE Journal of Solid-State Circuits. 44 (9), 2591-2604 (2009).
- Wentz, C. T., et al. A wirelessly powered and controlled device for optical neural control of freely-behaving animals. Journal of Neural Engineering. 8 (4), 046021 (2011).
- Harrison, R. R., et al. Wireless neural recording with single low-power integrated circuit. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 17 (4), 322-329 (2009).
- Landa, N., et al. Effect of injectable alginate implant on cardiac remodeling and function after recent and old infarcts in rat. Circulation. 117 (11), 1388-1396 (2008).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Zhang, A., Lieber, C. M. Nano-Bioelectronics. Chemical Reviews. 116 (1), 215-257 (2016).
- Zhou, W., Dai, X., Lieber, C. M. Advances in nanowire bioelectronics. Reports on Progress in Physics. 80 (1), 016701 (2017).
- Dai, X., Zhou, W., Gao, T., Liu, J., Lieber, C. M. Three-dimensional mapping and regulation of action potential propagation in nanoelectronics-innervated tissues. Nature Nanotechnology. 11 (9), 776-782 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten