Method Article
Asamblea de nanobarras de oro en Metamolecules plasmónica quirales mediante plantillas de Origami de ADN
En este artículo
Resumen
Describimos el protocolo detallado para el montaje basado en origami ADN de nanobarras de oro en metamolecules plasmónica quirales con fuerte chiroptical respuestas. El Protocolo no se limita a configuraciones chiral y puede ser fácilmente adaptado para la fabricación de varias arquitecturas plasmónica.
Resumen
El direccionamiento inherente de las estructuras de origami de ADN hace plantillas ideales para el arreglo de las nanopartículas metálicas en complejas nanoestructuras plasmónica. La alta precisión espacial de un conjunto con plantilla de origami de ADN permite controlar el acoplamiento entre la resonancia plasmónica de partículas individuales y permite la adaptación de propiedades ópticas de nanoestructuras construidas. Recientemente, sistemas plasmónica quirales atrajeron la atención debido a la fuerte correlación entre la configuración espacial de los conjuntos plasmónica y sus respuestas ópticas (por ejemplo, dicroísmo circular [CD]). En este protocolo, se describe el flujo de trabajo completo para la generación de asambleas quirales basados en origami de ADN de nanobarras de oro (AuNRs). El protocolo incluye una descripción detallada de los principios de diseño y procedimientos experimentales para la fabricación de plantillas de origami de ADN, la síntesis de AuNRs y el montaje de estructuras de AuNR origami. Además, se incluye la caracterización de estructuras mediante microscopía electrónica de transmisión (TEM) y espectroscopia de la CD. El protocolo descrito no se limita a configuraciones chiral y puede ser adaptado para la construcción de varias arquitecturas plasmónica.
Introducción
Nanoestructuras de ADN, origami de ADN en particular, han sido ampliamente utilizados para organizar moléculas y otros componentes a nanoescala (por ejemplo, las proteínas y nanopartículas [NPs]), con precisión de nanómetros en geometrías casi arbitrario1,2 , 3 , 4 , 5. la capacidad de arreglar metal NPs en plantillas de origami de la DNA con un alto rendimiento y precisión permite la fabricación de plasmónica estructuras con nuevas propiedades ópticas6,7,8, 9 , 10. técnica de origami de ADN es especialmente útil para la generación de estructuras plasmónica quirales, que requieren arquitecturas realmente tridimensional11,12,13, 14 , 15 , 16 , 17 , 18 , 19 , 20.
Este protocolo describe detalladamente todo el proceso de la fabricación de asambleas quirales con plantilla de origami de ADN de AuNRs. El software utilizado para el diseño21 y estructura predicción22,23 de origami de ADN es intuitiva y libremente disponible. La fabricación de origami y la síntesis de AuNR utilizan equipo común de laboratorio de bioquímica (p. ej., termocicladores, electroforesis en gel, placas, centrifugadoras). Las estructuras son caracterizadas usando la espectroscopia TEM y CD estándar.
La fabricación de nanoestructuras plasmónica similares con métodos de arriba hacia abajo (p. ej., litografía por haz de electrones) requeriría algo complicado y costoso equipo. Además, ADN origami plantillas proporcionan la posibilidad de incorporar reconfigurabilidad estructural en plasmónica asambleas24,25,26,27,28,29 ,30,31,32,33, que es extremadamente difícil para las estructuras fabricadas con técnicas de litografía. En comparación con otros enfoques moleculares34,35,36,37, fabricación basada en el origami de ADN proporciona un alto nivel de precisión espacial y de programación.
Protocolo
1. diseño de origami de la DNA
- Identificar la disposición espacial relativa deseada de AuNRs y la forma adecuada de la plantilla del origami de ADN (figura 1A). Estimar los parámetros estructurales de la AuNRs y las plantillas de origami. Localizar la posición aproximada de grapas que necesitan modificación (figura 1B).
- Descargar e instalar caDNAno18 para diseñar una plantilla de origami de ADN. En caDNAno, los filamentos del andamio y grapa según la forma deseada de la plantilla de la ruta y generar la secuencia de hilos básicos haciendo clic en la Herramienta de la Seq. Haga clic en la Herramienta de pintura y marca los hilos básicos que requieren más modificación (figura 1C).
- Haga clic en Herramienta de exportación para exportar las secuencias de ADN básicas (figura 1C) a un archivo .csv.
- Diseño de cerraduras de doble cadena para fijar el ángulo Θ entre los dos haces de origami. Dependiendo de la orientación relativa de los dos paquetes, el constructo de origami puede adaptar - o mano derecha izquierda (LH/RH) quiral configuración espacial (figura 1B).
- Importar el archivo .csv de las grapas en una aplicación de hoja de cálculo. Agregar una secuencia de10 polyA en el final de las grapas utilizada para armar AuNR (asas). Modificar las hebras discontinuas en los sitios de cierre diseñados con secuencias de cierre.
Nota: Los conjuntos de resultados representativos contienen 36 tiradores que sobresalen en el extremo 3' de las hebras discontinuas, 18 en cada paquete de origami de ADN, distribuidos equitativamente en dos hélices en paralelo cada 21 nt. La distancia entre la primera y la última posición de la manija es de 168 nt, aproximadamente 57 nm (ver archivo adjunto caDNAno).
2. montaje de las plantillas de origami de ADN
- Preparar un stock trabajo de hebras discontinuas (SM), incluyendo filamentos con las manijas y cerraduras, mezclando cantidades iguales de oligonucleótidos básicos concentración normalizada (por ejemplo,, 100 μm).
Nota: Las estructuras de Origami suelen contengan varios cientos de líneas discontinuas. Grapas por lo general se compran de proveedores especializados en la síntesis química de oligonucleótidos de ADN en multiwell (p. ej., 96-well) placas. - Para 500 μl de origami nM 10, mezcle 50 μl de Tris-EDTA (TE, x 10), 100 μl de MgCl2 (100 mM), 25 μl de NaCl (100 mM), 175 μl de H2O, 100 μl de SM (0,5 μm), 5 μl de filamentos de bloqueo (5 μm) y un andamio 50 μl (100 nM).
- Cocer la mezcla en un termociclador de 80 ° C a 20 ° C como se describe en la tabla 1.
3. purificación de origami de ADN
Nota: Esta sección describe el protocolo para la purificación del gel de agarosa. Plantillas de origami de la DNA se pueden purificar mediante enfoques alternativos38,39.
- Para gel 1%, disolver 1 g de agarosa en 100 mL de Tris-borato-EDTA (TBE, 0.5 x) calentando la mezcla en un horno de microondas. Añadir 10 μl de 10.000 x ADN de la mancha según la especificación de la mancha. Para minimizar la exposición a la luz UV en la extracción paso (3.6), usar una tinción de DNA que puede visualizarse bajo excitación azul.
- Enfriar la solución a aproximadamente 40 ° C y añadir lentamente 1 mL de MgCl2 (1,3 M) agitando. Molde gel e incubar durante 30 min a temperatura ambiente.
- Ajustar el aparato de electroforesis y vierta el buffer corriente fría (4 ° C) (0,5 x TBE con 11 mM de MgCl2) en la caja de gel. Colocar el gel en un baño de agua helada.
- Añadir el tampón de carga a las muestras de origami (6 x carga búfer contiene 15% polysucrose 400 y 0.25% bromofenol azul en el agua). Cargar las muestras en los pozos con un volumen apropiado según el peine utilizado (e.g., 50 μl de un peine de 8 pozos de 1.5 mm de espesor).
- Correr la electroforesis durante 2 h a 80 V.
Nota: Para caracterizar el origami y separar la estructura abierta y cerrada, utilice gel 2% en vez del 1% y prolongar el tiempo de ejecución a 4 h. - Imagen del gel con el reproductor de imágenes de gel (figura 2). Usar un transiluminador de luz azul para visualizar las bandas, corte la banda de origami, romper el gel en un parafilm y extraer el líquido. El rendimiento de recuperación es aproximadamente 40%.
- Pipeta el líquido en una unidad de filtro centrífugo y centrifugado a 3.000 x g por 5 min medir la absorción de la solución de origami a 260 nm con un espectrómetro UV-visible (UV-VIS). Calcular la concentración de origami con un coeficiente de extinción de 1.3 x 108 M-1·cm-1.
Nota: La típica concentración de solución de origami después de purificación del gel de agarosa es 1-2 nM. - Guarde las plantillas de origami purificada a 4 ° C para su uso posterior.
4. síntesis de nanobarras de oro
Nota: El protocolo para síntesis de AuNR es adaptado de la anterior literatura40 con modificaciones menores.
- Lave toda la cristalería con agua regia por 5 min, enjuagar con agua, someter a ultrasonidos con agua ultrapura y seco antes de usar.
- Preparar 0,2 M bromuro de hexadeciltrimetilamonio (CTAB), 1 mM HAuCl4, 4 m m de AgNO3, 64 m m L (+)-ácido ascórbico y 6 mM NaBH4. Usar agua fría (4 ° C) para disolver NaBH4 y mantener en nevera a 4 ° C. Solución de ácido ascórbico debe ser recién preparado.
PRECAUCIÓN: CTAB es peligroso en caso de contacto con la piel (irritante), contacto con los ojos (irritante), ingestión e inhalación. Usar ropa protectora adecuada. En caso de ventilación insuficiente, úsese equipo respiratorio adecuado. NaBH4 es extremadamente peligroso en caso de contacto con la piel (irritante), contacto con los ojos (irritante), ingestión e inhalación. Usar gafas resistentes a salpicaduras, una bata, guantes y un respirador de vapor y polvo. Asegúrese de usar un respirador aprobado/certificado o equivalente. - Preparar las semillas de la Au.
- Añadir 500 μl de CTAB (0,2 M), 250 μl de agua ultrapura y 250 μl de HAuCl4 (1 mM) en un frasco de vidrio. Revuelva a 450 rpm a temperatura ambiente durante 5 minutos.
- Aumentar la velocidad de agitación a 1.200 rpm. Añada 100 μl de solución fría NaBH4 (6 mM, 4 ° C). Después de 2 minutos, detener la agitación e incubar la solución en un baño de agua a 30 ° C por 30 minutos antes de su uso.
- Preparar AuNRs.
- Disolver 0,55 g de CTAB y 0,037 g de ácido 2, 6-dihydroxybenzoic en 15 mL de agua caliente (60-65 ° C) en un matraz de fondo redondo. Enfriar la solución a 30 ° C, añadir 600 μl de AgNO3 (4 mM) y revuelva a 450 rpm por 2 minutos. Luego, deje la solución reposar por 15 min a 30 ° C.
- Añadir 15 mL de HAuCl4 mM (1) a la solución y revuelva a 450 rpm por 15 minutos agregue 120 μl de L (+)-ácido ascórbico (64 mM), entonces, inmediatamente, revuelva a 1.200 rpm durante 30 s. Añadir 12 μl de semillas Au y seguir revolviendo a 1.200 rpm durante 30 s.
- Incubar la solución en un baño de agua a 30 ° C por 18 h. No molestar a la solución y usar una tapa para cerrar el frasco.
- Transferir la solución resultante a tubos de centrífuga y centrifugue a 9.500 x g durante 12 minutos a 20 ° C. Eliminar el sobrenadante, dispersar el pellet en 20 mL de agua ultrapura y realizar un más paso de centrifugación.
- Dispersar el pellet final en 3 mL de agua destilada. Calcular la concentración de AuNRs de una medida de absorción UV-VIS utilizando el coeficiente de extinción para la resonancia del plasmon longitudinal. El coeficiente de extinción puede predecirse utilizando AuNR forma parámetros41. Almacenar AuNRs a 4 ° C para su uso posterior.
5. funcionalización de nanobarras de oro con ADN
Nota: Esta sección describe el protocolo para funcionalización de AuNR con ADN monocatenario (ssDNA), siguiendo la ruta de llamada bajo pH adaptada de la anterior literatura42. El AuNRs cubiertos con el ADN son purificados por centrifugación; Alternativamente, puede realizarse la purificación mediante electroforesis en gel de agarosa.
- Incubar 20 μl de filamentos de la DNA de polyT tiol funcionalizados (1 mM) con 20 μl de recién tris(2-carboxyethyl) clorhidrato de fosfina (TCEP, 14 mM) de 1 h reducir enlaces de disulfuro.
Nota: El formulario de grupos tiol bonos con AuNRs, y la secuencia polyT hibridiza con la manija10 de polyA en el origami, en el que demasiados o muy pocos pares de bases puede conducir a un mal funcionamiento o un conjunto inestable.
PRECAUCIÓN: TCEP puede causar quemaduras severas de la piel y daños oculares. Use guantes de protección/protección ropa/protección/cara protección. - Mezcla 150 μL de AuNRs (10 nM) y 40 μl de tratados TCEP tiol-ADN (0,5 mM). Agregue 1% sodio dodecil sulfato (SDS) a la solución de AuNR para alcanzar una concentración final de SDS de 0.05%. Ajustar el pH a 2.5-3 con ~ 1 μl de HCl (1 M).
- Incubar por 2 h agitando a 70 rpm.
Nota: La relación AuNR a ADN debe estar en el orden de 1:5, 000-15.000, dependiendo del tamaño de las barras. Para el AuNRs (70 nm x 30 nm) preparado siguiendo el protocolo descrito en el apartado 4, un exceso de 13.000 de tiol-ADN se recomienda. - Añadir NaCl para llegar a una concertación final de NaCl 0,5 m e incubar durante 4 h a temperatura ambiente agitando a 70 rpm.
Nota: Un cambio de color en este paso puede indicar un error funcionalización de ADN. - Ajustar el pH a ~8.5 con buffer TBE (x 10) e incubar durante la noche.
- Lavar el ADN-AuNRs 4 x mezclando las muestras con 1 mL de tampón de lavado (0,5 x TBE con 0.1% SDS) y centrifugar a 7.000 x g durante 30 minutos quite el sobrenadante y resuspender el ADN AuNRs en el líquido restante (~ 40 μL). Calcular la concentración de ADN-AuNRs de una medida de absorción UV-VIS como se describe en el paso 4.4.5.
Nota: La solución podría ser ligeramente turbia a pasos 5.3-5.4 debido a la sustitución de CTAB de la superficie de la AuNRs por tiol-DNA. La solución debe quedar clara al calentamiento hasta ~ 35 ° C durante 5 minutos.
6. montaje de nanobarras de oro en las plantillas de origami de ADN
- Agrega MgCl2 a la solución de ADN purificado-AuNRs, a una concentración final de 10 mM. Mezclar el ADN-AuNRs purificado y el origami en una relación 10:1.
Nota: Una relación baja puede disminuir el rendimiento producto del43. - Cocer la mezcla en un mezclador con un control de temperatura de 40 ° C a 20 ° C agitando a 400 rpm, siguiendo el procedimiento en la tabla 2.
Nota: Para la caracterización de la CD, la muestra puede ser medida después de este paso sin posterior purificación. - Utilizar la electroforesis del gel de agarosa de 0,7% (3,5 h a 80 V) para purificar las estructuras de origami-AuNR final.
- Usar un transiluminador de luz blanca para la proyección de imagen. Corte la banda de producto (origami AuNR dimer) (figura 3), romper el gel en un parafilm y extraer el líquido. Pipeta el líquido en una unidad de filtro centrífugo y centrifugado a 3.000 x g por 5 min Resuspender el origami-AuNRs en la solución. El rendimiento de recuperación del gel es aproximadamente 50%.
- Calcular la concentración de las estructuras de AuNR origami de una medida de absorción UV-VIS como se describe en el paso 4.4.5.
7. imágenes de microscopia electrónica de transmisión
Nota: Este formato de uranilo (OVNI) protocolo de tinción es adaptado de la literatura anterior44.
- Mezcla 200 μL de solución de OVNI (0,75%) y 1 μl de NaOH (5 M) de vortex inmediatamente durante 2-3 minutos y centrifugar la solución colorante durante 3-4 minutos a 14.000 x g. Proteger a la mancha de exposición a la luz (por ejemplo, envolviéndola en papel de aluminio).
PRECAUCIÓN: OVNI es tóxico si se inhala o se ingiere y puede causar irritación de los ojos. En el caso de exposición breve o poco contaminante, utilice un dispositivo de filtro respiratorio. En caso de exposición intensa o más, utilice un dispositivo de protección respiratorio autocontenido. Guantes. Material del guante debe ser impermeable y resistente al OVNI y sus soluciones. Gafas herméticos. - Descarga del resplandor rejillas TEM de carbón/formvar-cubierto para 6 s justo antes del uso para aumentar la hidrofilicidad y promover el pegarse de las estructuras. Pipeta de 5 μl muestra gotas de la rejilla TEM, incube durante 5-8 min y quitar la gota tocando suavemente un papel de filtro con el borde de la rejilla.
- Tomar con pipeta una gota grande (~ 20 μl) y otra pequeña (~ 10 μl) de la solución de tinción en un parafilm. Poner la rejilla en la gota de solución de pequeña mancha y seque inmediatamente al tocar el papel filtro con el borde de la cuadrícula. Luego, ponerlo en la gota de solución de la gran mancha para 30 s.
- Quite el líquido en la parrilla al tocar el papel filtro con el borde de la cuadrícula. Coloque la parrilla en el soporte de red. Espere a que la rejilla secar durante al menos 10 minutos.
- Caracterizan a las muestras de origami (figura 4), AuNRs (figura 5) y origami-AuNRs (figura 6) por TEM.
8. medida circulares del dicroísmo
- Purgar el espectrómetro del CD con N2 por 20 min.
Nota: La mayoría de los espectrómetros de CD requieren purga con N2 antes de la ignición de la lámpara. Consulta el manual de espectrómetro del CD. - Establecer el ancho de banda, la gama de la exploración y paso de adquisición.
Nota: La gama de la exploración depende de las propiedades ópticas de AuNRs, que depende del tamaño de la AuNRs. - Medida CD en blanco con el tampón.
- Medir los espectros de CD de origami-AuNR muestras (figura 7).
Nota: Utilice cuartos o cubetas de vidrio para la medida de CD. Cubetas de plástico son inadecuadas para la espectroscopia del CD. También, la mayoría espectrómetros de CD permiten la adquisición simultánea de datos de CD y absorción.
Resultados
Imágenes TEM de plantillas de origami de la DNA, AuNRs y conjuntos de origami-AuNR final se muestran en la figura 4, figura 5y figura 6A, respectivamente. Debido a su preferencia de unión a rejillas TEM, origami AuNR asambleas son vistos generalmente como paquetes de origami paralelas y barras (figura 6A). Recocido térmico es necesario para la correcta alineación de AuNRs en las plantillas de origami (figura 6A, B). El protocolo permite altos rendimientos de la Asamblea de AuNRs en metamolecules quirales con respuestas fuertes plasmónica de CD (figura 7).
| Temperatura (° C) | hora |
| 80 | 15 min |
| 79 - 71 | 1 ° C/1 minuto |
| 70 - 66 | 1 ° C/5min |
| 65 - 60 | 1 ° C/30 min |
| 59 - 37 | 1 ° C/60 min |
| 36 - 30 | 1 ° C/15 min |
| 29 - 20 | 1 ° C/5min |
| 20 | Mantenga |
Tabla 1: Temperaturas y tarifas para el recocido térmico de plantillas de origami de la DNA.
| Temperatura (° C) | Tiempo (min) |
| 40 | 130 |
| 36 | 180 |
| 32 | 180 |
| 22 | Mantenga |
Tabla 2: temperaturas y tiempos de espera para el recocido de AuNRs y ADN plantillas de origami. La velocidad de enfriamiento entre los pasos se establece en 0,1 ° C por minuto. Las muestras de ADN origami AuNR se recuecen agitando a 400 rpm.

Figura 1 : Diseño de ADN origami plantillas quirales metamolecules. (A) identificar la disposición espacial relativa deseada de nanobarras de oro (AuNRs) y una forma conveniente de la plantilla del origami de ADN. (B) estimar los parámetros estructurales de la AuNRs (DAuNR, LAuNR) y la plantilla del origami (origamide W, Lorigami, Θ). Localizar la posición aproximada de las grapas que necesitan modificación. (C) diseño de plantillas de origami de la DNA usando caDNAno. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : La electroforesis de gel de agarosa de origami. (A) purificación con electroforesis de gel de agarosa al 1% por 2 h a 80 V. (B) caracterización con electroforesis en agarosa al 2% durante 4 h a 80 V. haga clic aquí para ver una versión más grande de esta figura.
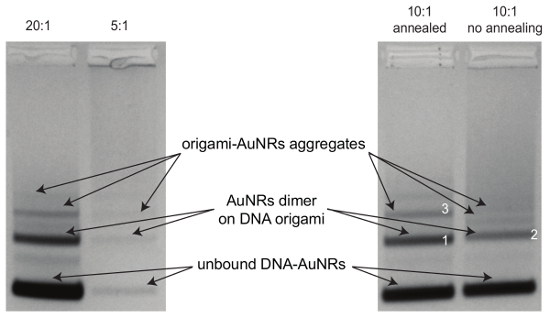
Figura 3 : La purificación de electroforesis en gel de agarosa de origami-AuNRs. Gel (0,7%) se corren por 3,5 h 80 V para las muestras preparadas siguiendo el procedimiento de montaje con diferentes ratios de AuNR ADN de origami (20:1, 5:1) y las muestras (proporción de DNA AuNRs para origami 10:1) con o sin procedimiento de recocido. Imágenes de TEM de las muestras en las bandas 1, 2 y 3, véase la figura 6. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Imagen de TEM representante de las plantillas de origami de la DNA. La estructura del origami consiste en dos paquetes de la hélice 14 (80 nm x 16 nm x 8 nm) Unidos entre sí por el filamento de andamio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5 : Imagen de TEM representante de la AuNRs. Las dimensiones promedio de AuNRs sintetizados son 70 x 30 nm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6 : Imágenes TEM de origami-AuNR asambleas. (A) AuNR dímeros de origami después de recocer (banda 1 en la figura 3). (B) AuNR dímeros en origami sin el recocido (banda 2 en la figura 3). (C) Origami-AuNR agregados (banda 3 en la figura 3). Haga clic aquí para ver una versión más grande de esta figura.
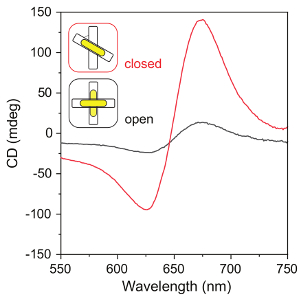
Figura 7 : Espectros de CD de las Asambleas de origami-AuNR. Los espectros de CD de las estructuras cerradas (las plantillas de origami fijadas por los filamentos de la cerradura en una configuración de diestra, con 50° entre los dos paquetes de origami) y la estructura abierta (las plantillas de origami sin hilos de la cerradura). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El Protocolo introduce el flujo de trabajo completo de diseño, montaje, purificación y caracterización de asambleas quirales basados en origami de ADN de AuNRs. Las plantillas de origami de ADN utilizadas en el protocolo son especialmente adecuadas para la fabricación de conjuntos de estímulos-respuesta. Varios tipos de respuestas y functionalizes pueden ser incorporados en los filamentos de la cerradura que definen el estado quiral de origami plantilla (figura 1B)24,25,26,31. Para montajes estáticos, plantillas más sencillas en forma de bloque son a menudo suficientes14,45,46,47.
El ADN origami enfoque basado en la fabricación de nanoestructuras plasmónica hereda limitaciones del ADN origami técnica48. El tamaño de las plantillas de origami es normalmente limitado por el tamaño del filamento del andamio. La estabilidad de las estructuras de ADN se reduce bajo condiciones ley sal. El costo de la grapa sintético hebras sigue siendo bastante alto. Sin embargo, se espera que los acontecimientos recientes en el campo de la nanotecnología de ADN estructural para superar estas limitaciones49,50,51,52,53,54 , 55.
En comparación con otros enfoques moleculares para la generación de asambleas quirales de AuNRs34,35,36,37, origami de ADN proporciona un alto nivel de precisión espacial y de programación.
Para lograr respuestas ópticas fiables y reproducibles de asambleas quirales, se recomienda adaptar los protocolos de AuNR síntesis40, ya que la calidad y propiedades ópticas de los productos comerciales pueden variar entre lotes. Adicional recocido (paso 6.2) es a menudo crucial para asegurar la correcta fijación de AuNRs a plantillas de origami de ADN (figura 6).
Por último, el protocolo descrito aquí no se limita a asambleas quirales. Origami de ADN proporciona una plataforma muy flexible para la fabricación de nanoestructuras plasmónica complejo9,10.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a S. Voutilainen su asistencia con el espectrómetro del CD. Los autores reconocen la prestación de servicios y soporte técnico por la Universidad de Aalto en OtaNano - Nanomicroscopy centro (Aalto-NMC). Este trabajo fue apoyado por la Academia de Finlandia (grant 308992) y programa de investigación e innovación a los horizonte 2020 de la Unión Europea bajo Marie Skłodowska-Curie conceder acuerdo Nº 71364.
Materiales
| Name | Company | Catalog Number | Comments |
| 2,6-Dihydroxybenzoic acid | Sigma-Aldrich | D109606-25 | 98+% |
| AgNO3 | Alfa Aesar | AA1141414 | 99.90% |
| Blue light transilluminator | Nippon Genetics | FG-06 | FastGene LED Transilluminator |
| Bromophenol Blue | Acros Organics | 403160050 | For agarorose gel loading buffer |
| Centrifugal filter units | Merck Millipore | 42600 | DNA extraction from agarose |
| Chirascan CD spectrometer | Applied Photophysics | ||
| Cuvette | Hellma | 105-202-85-40 | Quartz SUPRASIL |
| DNA lobind tubes | Eppendorf | 30108051 | |
| Eppendorf Biospectrometer | Eppendorf | 6135000904 | |
| Eppendorf ThermoMixer C | Eppendorf | 5382000015 | |
| Ficoll 400 | Thermo Fisher Scientific | BP525-10 | Polysucrose 400 (For agarorose gel loading buffer) |
| Gel electrophoresis sets | Thermo Fisher Scientific | ||
| Gel imager | Bio-Rad | Gel Doc XR+ System | |
| HAuCl4•3H2O | Alfa Aesar | AA3640006 | 99.99% |
| HCl | Scharlau | AC07441000 | 1M |
| Hexadecyltrimethylammonium bromide (CTAB) | Sigma-Aldrich | H9151-100 | BioXtra, 98+% |
| L(+)-ascorbic acid | Acros Organics | 401471000 | 99+% |
| M13p7560 scaffold strand | Tilibit nanosystems | ||
| MgCl2•6H2O | Sigma-Aldrich | M2670-500 | BioXtra, 99+% |
| NaBH4 | Acros Organics | 200050250 | 99% |
| NaCl | Sigma-Aldrich | S7653-500 | BioXtra, 99.5+% |
| NaOH | Sigma-Aldrich | S8045-500 | BioXtra, 98+% |
| Parafilm | Sigma-Aldrich | P7668-1EA | PARAFILM M |
| PBS buffer (10X) | Thermo Fisher Scientific | BP3991 | Molecular Biology |
| ProFlex PCR System | Thermo Fisher Scientific | 4484073 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | 74255-250 | 99+% |
| Staple strands | Thermo Fisher Scientific | ||
| Sybr Safe | Invitrogen | S33102 | For DNA stain |
| TBE buffer (10X) | Invitrogen | 15581-044 | Molecular Biology |
| TE buffer (10X) | Thermo Fisher Scientific | BP24771 | Molecular Biology |
| TEM | FEI | FEI Tecnai F12 | |
| Thiol-functionalized ssDNA | Biomers.net | ||
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP-HCl) | Thermo Fisher Scientific | PI20491 | |
| UltraPure Agarose | Invitrogen | 16500-100 | |
| Ultrapure water (Type 1) | Milli-Q Direct 8 system | ||
| Uranyl Formate | Tebu-bio | 24762-1 | |
| White light transilluminator | UVP | TW-26 |
Referencias
- Rothemund, P. W. K. Folding DNA to create nanoscale shapes and patterns. Nature. 440, 297-302 (2006).
- Wang, P., Meyer, T. A., Pan, V., Dutta, P. K., Ke, Y. The Beauty and Utility of DNA Origami. Chem. 2, 359-382 (2017).
- Hong, F., Zhang, F., Liu, Y., Yan, H. DNA Origami: Scaffolds for Creating Higher Order Structures. Chemical Reviews. 117, 12584-12640 (2017).
- Roller, E. -M., Argyropoulos, C., Högele, A., Liedl, T., Pilo-Pais, M. Plasmon-Exciton Coupling Using DNA Templates. Nano Letters. 16, 5962-5966 (2016).
- Acuna, G. P., et al. Fluorescence Enhancement at Docking Sites of DNA-Directed Self-Assembled Nanoantennas. Science. 338, 506-510 (2012).
- Roller, E. -M., et al. DNA-Assembled Nanoparticle Rings Exhibit Electric and Magnetic Resonances at Visible Frequencies. Nano Letters. 15, 1368-1373 (2015).
- Liu, Q., Song, C., Wang, Z. -G., Li, N., Ding, B. Precise organization of metal nanoparticles on DNA origami template. Methods. 67, 205-214 (2014).
- Roller, E. -M., et al. Hotspot-mediated non-dissipative and ultrafast plasmon passage. Nature Physics. 13, 761-765 (2017).
- Liu, N., Liedl, T. DNA-Assembled Advanced Plasmonic Architectures. Chemical Reviews. 118, 3032-3053 (2018).
- Kuzyk, A., Jungmann, R., Acuna, G. P., Liu, N. DNA Origami Route for Nanophotonics. ACS Photonics. 5, 1151-1163 (2018).
- Kuzyk, A., et al. DNA-based self-assembly of chiral plasmonic nanostructures with tailored optical response. Nature. 483, 311-314 (2012).
- Shen, X., et al. Three-Dimensional Plasmonic Chiral Tetramers Assembled by DNA Origami. Nano Letters. 13, 2128-2133 (2013).
- Liu, H., Shen, X., Wang, Z. -G., Kuzyk, A., Ding, B. Helical nanostructures based on DNA self-assembly. Nanoscale. 6, 9331-9338 (2014).
- Shen, X., et al. 3D plasmonic chiral colloids. Nanoscale. 6, 2077-2081 (2014).
- Urban, M. J., et al. Plasmonic Toroidal Metamolecules Assembled by DNA Origami. Journal of the American Chemical Society. 138, 5495-5498 (2016).
- Hentschel, M., Schäferling, M., Duan, X., Giessen, H., Liu, N. Chiral plasmonics. Science Advances. 3, 1602735(2017).
- Cecconello, A., Besteiro, L. V., Govorov, A. O., Willner, I. Chiroplasmonic DNA-based nanostructures. Nature Reviews Materials. 2, 17039(2017).
- Lan, X., Wang, Q. Self-Assembly of Chiral Plasmonic Nanostructures. Advanced Materials. 28, 10499-10507 (2016).
- Shen, C., et al. Spiral Patterning of Au Nanoparticles on Au Nanorod Surface to Form Chiral AuNR@AuNP Helical Superstructures Templated by DNA Origami. Advanced Materials. 29, 1606533(2017).
- Zhou, C., Duan, X., Liu, N. A plasmonic nanorod that walks on DNA origami. Nature Communications. 6, 8102(2015).
- Douglas, S. M., et al. Rapid prototyping of 3D DNA-origami shapes with caDNAno. Nucleic Acids Research. 37, 5001-5006 (2009).
- Kim, D. -N., Kilchherr, F., Dietz, H., Bathe, M. Quantitative prediction of 3D solution shape and flexibility of nucleic acid nanostructures. Nucleic Acids Research. 40, 2862-2868 (2012).
- Maffeo, C., Yoo, J., Aksimentiev, A. De novo reconstruction of DNA origami structures through atomistic molecular dynamics simulation. Nucleic Acids Research. 44, 3013-3019 (2016).
- Kuzyk, A., et al. Reconfigurable 3D plasmonic metamolecules. Nature Materials. 13, 862-866 (2014).
- Kuzyk, A., et al. A light-driven three-dimensional plasmonic nanosystem that translates molecular motion into reversible chiroptical function. Nature Communications. 7, 10591(2016).
- Kuzyk, A., Urban, M. J., Idili, A., Ricci, F., Liu, N. Selective control of reconfigurable chiral plasmonic metamolecules. Science Advances. 3, 1602803(2017).
- Gerling, T., Wagenbauer, K. F., Neuner, A. M., Dietz, H. Dynamic DNA devices and assemblies formed by shape-complementary, non-base pairing 3D components. Science. 347, 1446-1452 (2015).
- Zhou, C., Duan, X., Liu, N. DNA-Nanotechnology-Enabled Chiral Plasmonics: From Static to Dynamic. Accounts of Chemical Research. 50, 2906-2914 (2017).
- Ijäs, H., et al. Dynamic DNA Origami Devices: from Strand-Displacement Reactions to External-Stimuli Responsive Systems. International Journal of Molecular Sciences. 19, 2114(2018).
- Lan, X., et al. DNA-Guided Plasmonic Helix with Switchable Chirality. Journal of the American Chemical Society. 140, 11763-11770 (2018).
- Funck, T., Nicoli, F., Kuzyk, A., Liedl, T. Sensing Picomolar Concentrations of RNA Using Switchable Plasmonic Chirality. Angewandte Chemie International Edition. 57, 13495-13498 (2018).
- Zhou, C., Xin, L., Duan, X., Urban, M. J., Liu, N. Dynamic Plasmonic System That Responds to Thermal and Aptamer-Target Regulations. Nano Letters. 18, 7395-7399 (2018).
- Zhan, P., et al. Reconfigurable Three-Dimensional Gold Nanorod Plasmonic Nanostructures Organized on DNA Origami Tripod. ACS Nano. 11, 1172-1179 (2017).
- Ma, W., et al. Attomolar DNA detection with chiral nanorod assemblies. Nature Communications. 4, 2689(2013).
- Ma, W., et al. Chiral plasmonics of self-assembled nanorod dimers. Scientific Reports. 3, 1934(2013).
- Guerrero-Martínez, A., et al. Intense Optical Activity from Three-Dimensional Chiral Ordering of Plasmonic Nanoantennas. Angewandte Chemie International Edition. 50, 5499-5503 (2011).
- Kumar, J., et al. Detection of amyloid fibrils in Parkinson's disease using plasmonic chirality. Proceedings of the National Academy of Sciences. 115, 3225-3230 (2018).
- Stahl, E., Martin, T. G., Praetorius, F., Dietz, H. Facile and Scalable Preparation of Pure and Dense DNA Origami Solutions. Angewandte Chemie International Edition. 53, 12735-12740 (2014).
- Shaw, A., Benson, E., Högberg, B. Purification of Functionalized DNA Origami Nanostructures. ACS Nano. 9, 4968-4975 (2015).
- Ye, X., et al. Improved Size-Tunable Synthesis of Monodisperse Gold Nanorods through the Use of Aromatic Additives. ACS Nano. 6, 2804-2817 (2012).
- Near, R. D., Hayden, S. C., Hunter, R. E., Thackston, D., El-Sayed, M. A. Rapid and Efficient Prediction of Optical Extinction Coefficients for Gold Nanospheres and Gold Nanorods. The Journal of Physical Chemistry C. 117, 23950-23955 (2013).
- Shi, D., Song, C., Jiang, Q., Wang, Z. -G., Ding, B. A facile and efficient method to modify gold nanorods with thiolated DNA at a low pH value. Chemical Communications. 49, 2533-2535 (2013).
- Gür, F. N., Schwarz, F. W., Ye, J., Diez, S., Schmidt, T. L. Toward Self-Assembled Plasmonic Devices: High-Yield Arrangement of Gold Nanoparticles on DNA Origami Templates. ACS Nano. 10, 5374-5382 (2016).
- Castro, C. E., et al. A primer to scaffolded DNA origami. Nature Methods. 8, 221-229 (2011).
- Lan, X., et al. Bifacial DNA Origami-Directed Discrete, Three-Dimensional, Anisotropic Plasmonic Nanoarchitectures with Tailored Optical Chirality. Journal of the American Chemical Society. 135, 11441-11444 (2013).
- Lan, X., et al. Au Nanorod Helical Superstructures with Designed Chirality. Journal of the American Chemical Society. 137, 457-462 (2015).
- Zhu, C., Wang, M., Dong, J., Zhou, C., Wang, Q. Modular Assembly of Plasmonic Nanoparticles Assisted by DNA Origami. Langmuir. , (2018).
- Pinheiro, A. V., Han, D., Shih, W. M., Yan, H. Challenges and opportunities for structural DNA nanotechnology. Nature Nanotechnology. 6, 763-772 (2011).
- Ducani, C., Kaul, C., Moche, M., Shih, W. M., Högberg, B. Enzymatic production of 'monoclonal stoichiometric' single-stranded DNA oligonucleotides. Nature Methods. 10, 647-652 (2013).
- Praetorius, F., et al. Biotechnological mass production of DNA origami. Nature. 552, 84-87 (2017).
- Wagenbauer, K. F., Sigl, C., Dietz, H. Gigadalton-scale shape-programmable DNA assemblies. Nature. 552, 78-83 (2017).
- Zhang, T., et al. 3D DNA Origami Crystals. Advanced Materials. 30, 1800273(2018).
- Ong, L. L., et al. Programmable self-assembly of three-dimensional nanostructures from 10,000 unique components. Nature. 552, 72-77 (2017).
- Ponnuswamy, N., et al. Oligolysine-based coating protects DNA nanostructures from low-salt denaturation and nuclease degradation. Nature Communications. 8, 15654(2017).
- Agarwal, N. P., Matthies, M., Gür, F. N., Osada, K., Schmidt, T. L. Block Copolymer Micellization as a Protection Strategy for DNA Origami. Angewandte Chemie International Edition. 56, 5460-5464 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados