Method Article
Medición de la orientación y la motilidad del esperma dentro del tracto reproductivo de la Caenorhabditis elegans hermafrodita
En este artículo
Resumen
El esperma debe navegar con éxito a través del oviducto para fertilizar un ovocito. Aquí describimos un ensayo para medir la migración de espermatozoides dentro del útero hermafrodita de C. elegans . Este ensayo puede proporcionar datos cuantitativos sobre la distribución de espermatozoides dentro del útero después del apareamiento, así como sobre la velocidad, velocidades direccionales y frecuencia de reversión.
Resumen
La fertilización exitosa es fundamental para la reproducción sexual, pero se sabe poco sobre los mecanismos que guían los espermatozoides a los ovocitos dentro del tracto reproductivo femenino. Mientras que los estudios in vitro sugieren que los espermatozoides de animales fertilizantes internamente pueden responder a diversas señales de su entorno, la incapacidad para visualizar su comportamiento dentro del tracto reproductivo femenino crea un desafío para entender la migración de esperma y la movilidad en su entorno nativo. Aquí describimos un método usando C. elegans que supera esta limitación y aprovecha su epidermis transparente. Los machos C. elegans manchados con un tinte mitocondrial se aparearon con hermafroditas adultos, que actúan como hembras modificadas, y depositan el esperma con la etiqueta fluorescentemente en el útero hermafrodita. La migración y la motilidad del esperma etiquetado se pueden rastrear directamente usando un microscopio de epi-fluorescencia en un hermafrodita vivo. En animales de tipo silvestre, aproximadamente el 90% de los espermatozoides etiquetados se arrastran por el útero y alcanzan el sitio de fertilización, o Spermatheca. Las imágenes del útero se pueden tomar 1 h después del apareamiento para evaluar la distribución de los espermatozoides dentro del útero y el porcentaje de espermatozoides que han llegado a la Spermatheca. Alternativamente, las imágenes de lapso de tiempo se pueden tomar inmediatamente después del acoplamiento para evaluar la velocidad del esperma, la velocidad direccional y la frecuencia de reversión. Este método se puede combinar con otras herramientas genéticas y moleculares disponibles para la C. elegans para identificar nuevos mecanismos genéticos y moleculares que son importantes en la regulación de la orientación y la motilidad del esperma dentro del tracto reproductivo femenino.
Introducción
Los mecanismos moleculares por los cuales los espermatozoides (denominados esperma) navegan por el tracto reproductivo femenino hacia el ovocito no se entienden bien, pero son fundamentales para la reproducción sexual. La motilidad espermática es altamente dinámica y depende de señales de comunicación robustas que alteran la velocidad del esperma y la motilidad direccional1,2,3,4,5,6 , 7 , 8 , 9 , 10 , 11 , 12. C. elegans se ha convertido en un modelo poderoso para el estudio del movimiento de esperma en vivo porque la epidermis transparente del hermafrodita permite el rastreo de espermatozoides vivos en la resolución de una célula2,3, 8,10. El propósito de este documento es proporcionar métodos para evaluar el movimiento de los espermatozoides dentro del útero hermafrodita C. elegans .
En especies animales donde el esperma y el ovocito se reúnen en el entorno externo (es decir, ambientes de acuario), los espermatozoides responden a las señales chemotáctica secretadas por los ovocitos. Estas señales guían la dirección del movimiento de los espermatozoides, acercarlos a la fuente de la señal4,6,11. Sin embargo, se sabe mucho menos sobre el movimiento de esperma en especies que fertilizar internamente. Un gran desafío es la arquitectura del tracto reproductivo femenino, que es inaccesible a la microscopía en la mayoría de las especies. Estudios in vitro en humanos, ratones y cerdos, por ejemplo, proporcionan evidencia de que las subpoblaciones de espermatozoides pueden responder a quimioattractantes, flujo de fluidos y gradientes térmicos1,5,7,9, 12. Con estos sistemas, la incapacidad para visualizar y rastrear el movimiento de esperma in vivo impone serias limitaciones a las estrategias para descubrir los mecanismos clave que regulan estas funciones.
Para superar estas limitaciones, hemos desarrollado métodos utilizando los nematodos C. elegans para visualizar directamente los espermatozoides después de la inseminación, para medir los parámetros individuales de migración de espermatozoides in vivo, y para medir la capacidad de una población de esperma para apuntar a el sitio de fertilización. Estos métodos, junto con el conjunto de herramientas moleculares y genéticos C. elegans , facilitan el descubrimiento de las moléculas de señalización química y maquinaria molecular que regulan los comportamientos de motilidad del esperma. Por ejemplo, las pantallas genéticas se pueden llevar a cabo en hermafroditas o en varones para identificar genes que son esenciales para el movimiento eficiente de esperma in vivo13. Las moléculas se pueden inyectar en la gónada hermafrodita para probar los efectos sobre la activación del esperma, la velocidad de la migración y la motilidad direccional3. Además, los métodos descritos se pueden utilizar para monitorear la migración de esperma Rogue en ubicaciones de cuerpo ectópico y para evaluar la competencia de esperma10,14.
C. elegans existen en la naturaleza como hermafroditas y machos (ver figura 1). La gónada hermafrodita tiene dos brazos en forma de U que son imágenes de espejo el uno del otro. Durante la etapa larval L4, las células germinales más proximales (es decir, las células cercanas a la Spermatheca) se someten a la espermatogénesis. Cada espermatocito primario entra en la la meiosis y produce cuatro espermatidos haploides. Estos espermatozoides se empujan hacia la espermatheca junto con el primer ovocito maduro y se someten a la espermiogénesis15. Los hermafroditas adultos cambian de espermatogénesis a Oogénesis. Los ovocitos maduran en una línea de ensamble a lo largo de la gónada, con el ovocito más maduro en el extremo proximal de la gónada, junto a la Spermatheca. Se necesitan señales MSP del esperma para desencadenar la maduración MEIOTICA y la ovulación16,17. Los machos C. elegans, por otro lado, tienen una gónada en forma de J que produce sólo esperma. Los spermatidos se almacenan en la vesícula seminal. Al aparearse con el hermafrodita o hembra, el macho inserta las espículas cerca de la cola en la vulva. Las espermatidas se activan durante la eyaculación, cuando entran en contacto con el fluido seminal18. C. elegans esperma no nadar como no se flagellated. En su lugar, se arrastran a través del tracto reproductivo, usando el secretará para la locomoción. Está bien establecido que el esperma masculino, que son de mayor tamaño, tienen una ventaja competitiva sobre el esperma hermafrodita14.
En este método, el macho C. elegans actúa como el donante de esperma y se acopla a los hermarhoditas adultos. Los machos adultos se tiñen con un tinte mitocondrial fluorescente para producir espermatozoides etiquetados. Una vez depositado a través de la vulva hermafrodita, el esperma debe gatear alrededor de los embriones en el útero hacia la Spermatheca, o sitio de fertilización. La epidermis transparente del modelo C. elegans permite la visualización directa de cada esperma individual a medida que navega por el tracto reproductivo femenino. En los últimos años, nuestro laboratorio ha utilizado con éxito este método para demostrar la importancia de una clase de prostaglandinas de la serie F en la guía de esperma de la vulva a la espermateca19,20. Los mecánicos moleculares que rigen su síntesis por el hermafrodita y la respuesta de los espermatozoides todavía están bajo investigación. Sin embargo, este método para evaluar la motilidad y la migración del esperma facilita enormemente la identificación de los actores clave que controlan la comunicación de los espermatozoides y los ovocitos en los animales fertilizantes internamente. El siguiente protocolo describe paso a paso cómo realizar este ensayo.
Protocolo
Nota: todos los pasos de este protocolo se realizan a temperatura ambiente (~ 20-22 ° c) o en incubadoras de temperatura constante a 16 ° c o 20 ° c. Los machos y hermafroditas C. elegans se cultivan utilizando condiciones de cultivo estándar y NA22 o OP50 E. coli como fuente de alimento21,22. Los machos hermafroditas y Fog-2 (q71) de tipo salvaje se utilizan en el siguiente procedimiento.
1. día 1: selección de la etapa L4 hermafroditas para el apareamiento
- Para obtener resultados consistentes, todos los hermafroditas deben sincronizarse como adultos que reproducen activamente. Recoger 20-30 L4 en etapa hermafroditas a una placa de medio de crecimiento de Nemuro (NGM) de 6 cm de cabeza. Incubar los hermafroditas a 20 ° c durante 28-30 h.
Nota: Solo se utilizarán 12-15 hermafroditas para el apareamiento. Los hermafroditas restantes son excedentes.
2. día 1: tinción de machos con tinte mitocondrial fluorescente (tinte mito)
- Haga una placa de tinción masculina colocando un punto de E. coli (punto de comida) en el centro de una placa NGM no sembrada. Para hacer el punto de alimento, utilice el extremo de una varilla de agitación de vidrio para raspar e. coli del césped de la bacteria de una placa sembrada y deposite en la placa no sembrada. El punto debe ser ~ 5-7 mm de diámetro.
- Mezclar 2 μL de tinte mito de 1 mM (ver tabla de materiales) en DMSO y 10 μl de tampón M9 (3 g de KH2po4, 6 g de na2HPO4, 5 g de NaCl, 1 ml de 1 M MgSO4, H2O a 1 L. Añadir MgSO4 después de autoclave). Pipetear toda la solución de tinte mito en el punto alimenticio de la placa de tinción masculina. Dejar secar el plato en la oscuridad (~ 30 min).
Nota: El tinte mito es sensible a la luz. Proteja toda la solución, placas y gusanos que contengan un tinte de mito de la luz. Almacene el stock de 1 mM a-20 ° c. - Recoger ~ 100 1-3 día de edad adultos varones23 para el colorante mito de la comida manchada punto en la placa de mancha masculina. Envolver la placa en papel de aluminio e incubar durante la noche a 16 ° c. Para el apareamiento, utilice ~ 50-60 machos por 12-15 hermafroditas. Si se necesitan más de ~ 100 machos, hacer más placas de tinción para evitar el hacinamiento de los machos.
Nota: Los machos también se pueden teñir incubando en una solución de tinte de mito de 10 μM en tampón M9 durante 3 h en un vidrio de reloj. Mantenga los gusanos cubiertos para evitar la evaporación y la exposición a la luz. Después de 3 h, utilice una Pipet Pasteur para transferir los machos a una placa NGM de 10 cm de cabeza. Transfiera tan poco de la solución de tinte de mito como sea posible. Envolver la placa en papel de aluminio e incubar durante la noche en 16 ° c.
3. día 2: acoplamiento
- Escoja los machos manchados del día 1 en una nueva placa NGM sembrada. Deje el plato en la oscuridad hasta que se aparque. Este paso asegura que se eliminen las bacterias manchadas de tinte de mito alrededor de los machos. El arrastre excesivo de bacterias teñidas de mito en la placa de acoplamiento puede manchar el tejido hermafrodita.
- Hacer una placa de acoplamiento colocando 2 μL de una mezcla gruesa de E. coli en una placa NGM no sembrada. Deje secar las gruesas bacterias para hacer el punto de acoplamiento. Los machos y hermafroditas serán transferidos a este punto para el apareamiento. Para hacer grueso e. coli, gire hacia abajo 3 ml de e. coli durante la noche y resuspender el pellet de bacterias en 1 ml de M9. Esta mezcla puede almacenarse a 4 ° c y reutilizarse durante un máximo de 6 meses.
Nota: El espesor de la solución de E. coli puede ajustarse. Si la solución es demasiado delgada, los machos pueden arrastrarse lejos del punto de acoplamiento en lugar de agregar en él para el apareamiento. Los puntos de acoplamiento hechos de una solución de E. coli que es demasiado gruesa pueden disminuir la eficiencia de acoplamiento. - Mientras que la placa de acoplamiento del paso 3,2 se está secando, mezclar 300 μL de 1% (p/v) tricaína (Tri), 300 μL de 0,1% (p/v) Tetramisol (TET), y 900 μL de M9.
Nota: Almacenar 1% (p/v) Tricaine y 0,1% (p/v) Tetramisole como aliquotes a-20 ° c. Evite la congelación repetida. - Transferir 600 μL de la solución Tet/Tri a un cristal de reloj.
- Transferencia 12-15 hermafroditas recogidas en el día 1 a la solución Tet/Tri en el cristal del reloj. Incubar durante 30 minutos para inmovilizar los hermafroditas. Mantenga el cristal del reloj cubierto para evitar que la solución Tet/Tri se evada.
Nota: Es importante que los hermafroditas se anestesien durante al menos 30 minutos. menos tiempo podría resultar en un gusano en movimiento durante la adquisición de imágenes, que puede interefere con imágenes. - Mientras hermafroditas están incubando, recoger 50-60 machos manchados del paso 3,1 en el punto de acoplamiento (paso 3,2). Almacene la placa en la oscuridad hasta el paso 3,8.
- Después de la incubación de 30 minutos en la solución Tet/Tri, utilice un Pipet Pasteur de vidrio para transferir los hermafroditas inmovilizados desde el cristal del reloj a una placa NGM no sembrada. Retire tanto líquido como sea posible y deje secar el exceso de líquido.
Nota: No deje que los hermafroditas se sequen excesivamente. Tan pronto como se haya evaporado todo el líquido visible, comience el siguiente paso. - Transferir los hermafroditas anestesiados de la placa NGM no sembrada en el punto de acoplamiento con los machos manchados. Incubar en la oscuridad durante 30 minutos para permitir que los machos se aparean con los hermafroditas.
- Después de aparearse durante 30 minutos, Monte los hermafroditas inmediatamente para obtener imágenes de lapso de tiempo o transfiera los hermafroditas a una nueva placa NGM sembrada para reposar durante 1 h antes de la toma de imágenes.
Nota: Los videos de lapso de tiempo del útero hermafrodita se utilizan para cuantificar la velocidad del esperma y la frecuencia de reversión. Las imágenes fijas del útero tomadas 1 h después del apareamiento se utilizan para cuantificar la distribución de espermatozoides, o la guía de SPEM.
4. día 2: montaje de gusanos para visualización
-
Creación de una almohadilla de montaje con 2% de agarosa en H2O
Nota: el 2% de agarosa puede hacerse a granel, alicitarse en tubos de ensayo de vidrio y almacenarse a 4 ° c. Cuando es necesario, cada alícuota se puede en el microondas antes de cada uso y se almacena en un bloque de calor para evitar que se solidifica.- Para hacer la almohadilla de montaje, alinee tres diapositivas del microscopio de vidrio lado a lado con los bordes largos tocando. Coloque dos piezas de cinta adhesiva una encima de la otra en ambas diapositivas exteriores. Estos portaobjetos de vidrio exterior con cinta actuarán como el soporte, por lo que el espesor de la almohadilla de agarosa resultante será "dos cintas profundas".
- Colocar ~ 75 μl de agarosa derretido al 2% en la corredera central (esta es la diapositiva sin cinta adhesiva). Coloque inmediatamente un nuevo portaobjetos de cristal en la parte superior de la agarosa. Esta diapositiva de cristal superior debe ser perpendicular a las otras diapositivas, con cada extremo apoyado en la cinta de las dos diapositivas de soporte.
- Deje que la agarosa se endurezca (~ 30 s). Retire con cuidado la diapositiva superior de vidrio deslizándola fuera de la almohadilla de agarosa.
- Colocar 10-15 μL de la solución Tet/Tri en la almohadilla de agarosa al 2%. Transfiera los hermafroditas acoplados en la almohadilla. Tenga cuidado de transferir la menor bacteria posible.
- Coloque una tapa sobre los gusanos en la almohadilla de agarosa.
5. día 2: configuración de adquisición de imágenes
Nota: Cualquier miscroscope vertical equipado con objetivos de epi-fluorescencia, 10X y 60x, y una cámara digital se puede utilizar para adquirir imágenes para la distribución de espermatozoides. Es necesario un software capaz de adquirir imágenes caducadas para evaluar la velocidad del esperma, la velocidad direccional y la frecuencia de reversión.
-
Adquisición de imagen 1 h después del acoplamiento
- Monte la corredera en la etapa del microscopio. Mira a través de las piezas del ojo para buscar gusanos en la almohadilla de agarosa usando el objetivo 10x con el filtro de emisión de fluorescencia roja (filtro TRITC). Una vez que se ha encontrado un gusano, encienda brevemente la luz fluorescente para ver si el gusano se ha acoplado. Si el esperma es visible dentro del útero, cambie al objetivo 60x.
Nota: La presión creada por el objetivo de 60x en el resbalón puede dañar algunos gusanos frágiles, causando que el intestino o la gónada se extruir del animal. El escaneo para un acoplamiento exitoso usando el objetivo 10x puede minimizar la exposición de los gusanos a la presión añadida. No exponga los gusanos acoplados a periodos prolongados de luz fluorescente. - Utilizando la microscopía de contraste de interferencia diferencial (Dic), coloque el gusano de manera que tanto la vulva como una espermateca estén a la vista. Enfocar la imagen centrándose en el centro de la Spermatheca. Compruebe la exposición de los canales DIC y TRITC. En DIC, las estructuras internas de gusanos deben ser claramente visibles. En TRITC, el esperma individual debe ser visible como un puncta distinto.
Nota: Cada imagen debe capturar el útero de la vulva a uno de los espermatheca. Si el útero es demasiado largo para caber en una imagen, se pueden tomar dos imágenes separadas. No es necesario que todas las imágenes se tomen en el mismo nivel de exposición. Sin embargo, es importante que los espermatozoides individuales puedan distinguirse y cuantificarse en las imágenes de fluorescencia. - Adquiera imágenes de DIC y fluorescencia para cada útero.
- Repita los pasos 5.1.1-5.1.3 hasta que se hayan fotografiado todos los hermafroditas acoplados.
- Monte la corredera en la etapa del microscopio. Mira a través de las piezas del ojo para buscar gusanos en la almohadilla de agarosa usando el objetivo 10x con el filtro de emisión de fluorescencia roja (filtro TRITC). Una vez que se ha encontrado un gusano, encienda brevemente la luz fluorescente para ver si el gusano se ha acoplado. Si el esperma es visible dentro del útero, cambie al objetivo 60x.
-
La captura de vídeos Time-lapse
- Escanee la almohadilla de agarosa y localice hermafroditas que contengan espermatozoides etiquetados dentro del útero, como se describe en el paso 5.1.1 y 5.1.2
- Configure el software para adquirir imágenes de lapso de tiempo en canales DIC y TRITC. Generalmente, las imágenes de lapso de tiempo se toman a intervalos de 15-30 s para 10-20 min por útero.
6. cuantificación
-
Cuantificación de la distribución del esperma en las imágenes del útero tomadas 1 h después del apareamiento
- Comenzando con la vulva en un extremo y el espermateca por el otro, divida el útero en tercios. Estos representarán las tres zonas. La zona 1 (Z1) contiene la vulva y la zona 3 (Z3) contiene el Spermatheca.
- Cuente manualmente el número de espermatozoides dentro de cada tercio del útero, e informe el número en cada zona como un porcentaje del esperma total en todo el útero. A continuación se proporciona un ejemplo.
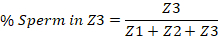
Nota: a veces, la intensidad de la señal de la imagen del canal TRITC debe ajustarse para que todos los espermatozoides capturados en la imagen puedan ser visibles y cuantificados.
-
Seguimiento de esperma en imágenes de lapso de tiempo
Nota: En este documento, usamos el software NIS-Elements para el análisis. En las secciones siguientes, damos instrucciones para el seguimiento manual de los espermatozoides utilizando este software (paso 6.2.1), así como el software de código abierto ImageJ/Fiji (paso 6.2.2).-
Seguimiento de esperma con NIS-Elements
- Abra el archivo. Nd2 con la serie Time-lapse que se debe rastrear. Para comenzar el seguimiento, abra el panel seguimiento haciendo clic con el botón derecho en el software y seleccionando controles de análisis | El rastreo.
- En el panel de seguimiento, seleccione definir nuevo ROI. Defina cada región de interés (ROI) haciendo clic sobre cada esperma que será rastreado. Una marca de color aparecerá sobre el espermatozoide seleccionado. Haga clic en Finalizar cuando se hayan seleccionado todos los Rois.
- Una vez identificados los ROIs, pasar al siguiente fotograma de la serie Time-lapse. Arrastre el marcador de ROI a la nueva posición de los espermatozoides en la imagen. Continúe haciendo esto hasta que el esperma ya no pueda ser rastreado. Aparecerán líneas de puntos que conectan cada una de las ubicaciones donde se ha colocado el marcador de ROI a través de todos los fotogramas de la imagen de lapso de tiempo.
Nota: Sólo los espermatozoides en la zona 2 deben ser rastreados como esperma en las zonas 1 y 3 tienden a moverse en un patrón circular, incluso en animales de tipo silvestre. - Exporte todos los datos cuantificables (p. ej., longitud de trayecto, tiempo, posición XY, etc.) de los espermatozoides rastreados a un documento de Excel haciendo clic en exportar en el panel seguimiento.
-
El rastreo de esperma con Fiji
- Convierta las imágenes del canal TRITC en la serie Time-lapse en archivos. tif. Guarde todos los archivos de una serie en una carpeta.
- Importe las imágenes a Fiji utilizando la función de importación de BioFormats. Importa imágenes de una serie de lapso de tiempo como una sola hiperpila.
- Abra TrackMate en Fiji24 Via plugins | Tracking | Seguimiento manual con TrackMate. Se abrirá un cuadro de abrirá.
- Seleccione la herramienta TrackMate en la barra de herramientas de Fiji. Haga doble clic en el esperma que será rastreado. Aparecerá un círculo verde con líneas discontinuas. Este círculo puede ser reposicionado haciendo clic dentro del círculo y arrastrando a la posición deseada. El tamaño de este círculo se puede cambiar pulsando simultáneamente la tecla Alt y desplazando el ratón.
- Una vez que el tamaño y la posición del rastreador se ha establecido, haga clic en el círculo de nuevo. Las líneas verdes discontinuas se convierten en una línea verde sólida. Pulse simultáneamente las teclas MAYÚS y L para activar el modo de rastreo. Esto se indicará en la barra de herramientas de Fiji.
- Pasar al siguiente fotograma de la serie Time-lapse. Para establecer la nueva ubicación de los espermatozoides rastreados en el nuevo marco, pase el ratón sobre el nuevo punto y presione la tecla a . El rastreador aparecerá ahora en la nueva ubicación y aparecerá una línea que conectará las ubicaciones en las que se ha colocado el rastreador en los fotogramas anteriores.
- Una vez completados los seguimientos, haga clic en analizar en el cuadro de diálogo trackmate para generar los datos necesarios.
- Para calcular la velocidad, divida la longitud total del trayecto de los espermatozoides por el tiempo transcurrido.
- Para calcular la velocidad vectorial, dibuje una línea a través del útero a partir de la vulva apuntando hacia la Spermatheca. Mida la distancia que el esperma ha migrado a lo largo de esta línea desde el principio hasta el final de la traza. Divida esta distancia por el tiempo transcurrido. Los valores negativos indican que el esperma ha migrado lejos de la Spermatheca.
- Para registrar la frecuencia de reversión, cuente el número de veces durante los cuales el rastro de esperma ha generado un ángulo inferior a 90 ° durante tres fotogramas consecutivos de lapso de tiempo.
-
Seguimiento de esperma con NIS-Elements
Resultados
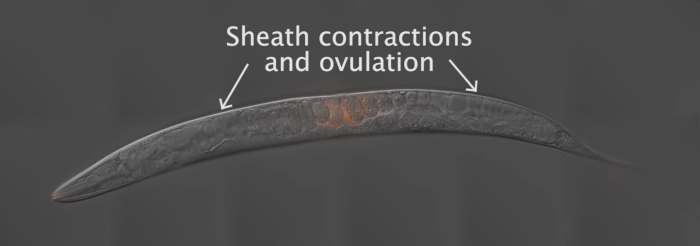
Para generar los resultados representados en este papel, los machos de Fog-2 (q71) fueron manchados con el tinte mito y apareados con el tipo salvaje, N2 hermafroditas. La figura 2 proporciona un esquema general para el método, incluida la preparación del gusano, el acoplamiento y el análisis. Como muestra la película 1 , el tracto reproductivo hermafroditas adulto tiene dos brazos que son imágenes de espejo uno del otro. Al aparearse, los espermatozoides etiquetados se depositan en el útero hermafrodita a través de la vulva. El esperma se desplaza alrededor de los embriones en desarrollo dentro del útero hacia la Spermatheca, donde se almacenan hasta la fertilización. A medida que las células germinales en el adulto hermafrodita se desarrollan en ovocitos, el ovocito proximal y maduro es empujado a la espermateca a través de las contraciones de las células de vaina. La fertilización ocurre mientras el ovocito está en la Spermatheca.
Para cuantificar la distribución de esperma y la migración a través del tracto reproductivo femenino, el útero hermafrodita se divide en tres zonas (película 1, Figura 3A). La zona 1 abarca el primer tercio del útero, comenzando por la vulva. La zona 2 abarca el tercio medio del útero, y la zona 3 abarca el último tercio del útero e incluye la espermatheca. La adecuada guía de esperma usando los machos de tipo salvaje, N2 hermafroditas y Fog-2 (q71) debe dar lugar a que aproximadamente el 90% de los espermatozoides etiquetados alcancen el Spermatheca, o la zona 3 (figura 3B). Los matings que resultan en muy pocos (Figura 3C, menos de 10-15 espermatozoides) o demasiados (figura 3D, útero lleno de esperma) esperma en el útero no deben ser contados. En los apareamientos que resultan en menos de 10-15 espermatozoides, 3-4 esperma pícaro puede sesgar fuertemente los datos. Del mismo modo, cuando el útero se llena completamente con esperma, el esperma no puede emigrar apropiadamente. Los espermatozoides pueden parecer dispersos por todo el uteri de algunos mutantes que muestran un fenotipo pobre en la orientación espermática. Sin embargo, en este caso, el esperma no debe llenar cada grieta del útero, como se ve en la figura 3D. La cuantificación de cada brazo de la gónada se considera una muestra, o una n.
Las imágenes de lapso de tiempo se toman para cuantificar la velocidad del esperma y la frecuencia de reversión. Sólo los espermatozoides en la zona 2 deben ser rastreados (figura 4a) porque los espermatozoides en las zonas 1 y 3 (película 1) tienden a moverse en un patrón circular incluso dentro de los animales de tipo salvaje. Imágenes de laspe de tiempo tomadas a intervalos de 15-30 s se utilizan generalmente para rastrear los espermatozoides. Solo se cuantifican los espermatozoides que se pueden seguir en fotogramas consecutivos durante más de 2,5-3 minutos. En la Figura 4B-M, los espermatozoides marcados por los puntos rojos y azules satisfacen este criterio, mientras que el espermatozoide marcado por el punto verde no lo hace. Por lo tanto, los valores definidos en la figura 4N se cuantifican para el esperma marcado por los puntos rojos y azules (figura 4o), mientras que aquellos para el esperma marcado por el punto verde no se cuantificaron.
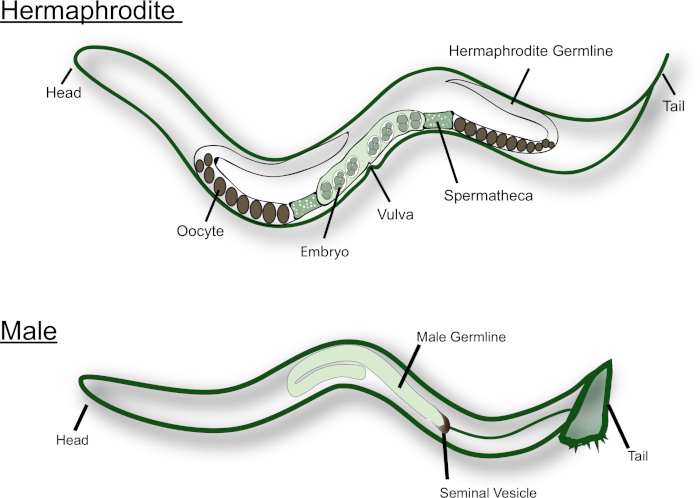
Figura 1: caricatura del adulto C. elegans hermafrodita y macho. Las principales estructuras reproductivas están etiquetadas en la figura. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2: diagrama esquemático de preparación de muestras y adquisición de datos. Los machos manchados con el tinte mito están acoplados a hermafroditas adultos sincronizados. Las imágenes de lapso de tiempo de hermafroditas acoplados se toman inmediatamente después del acoplamiento para capturar datos para la velocidad del esperma y la frecuencia de reversión. Las imágenes fijas de hermafroditas acoplados se toman 1 h después del apareamiento para evaluar la distribución del esperma dentro del útero. Consulte el texto para obtener más detalles. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 3: cuantificación de la distribución del esperma dentro del útero hermafrodita. (A). esquemático del útero hermafrodita C. elegans . V = vulva, E = embrión, S = Spermatheca, O = ovocito, Z1-Z3 = zonas 1-3 utilizadas para medir la distribución del esperma. (B-D). DIC + TRITC fusionó (paneles de la izquierda) y TRITC sólo (paneles de la derecha) imágenes del tipo salvaje hermafrodita uteri 1 h después de aparearse con niebla-2 (q71) machos manchados con el tinte mito. Los espermatozoides aparecen rojos. Los contornos amarillos indican la ubicación del Spermatheca. Barra de escala: 20 μm. Z1, Z2, Z3 cuantificación en B representan el porcentaje de espermatozoides en cada zona ± desviación estándar. Las imágenes en C y D representan los apareamientos que han dado lugar a muy pocos (c) o demasiados (D) espermatozoides para la cuantificación. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 4: cuantificación de la velocidad del esperma y la frecuencia de reversión durante la migración a través del útero. (A). dic + tritc imagen fusionada de un útero hermafrodita que contiene esperma fluorescente (rojo). V = vulva, amarillo = Spermatheca, Z1-Z3 = tres zonas del útero, caja negra: zona 2. (B-M). Imágenes de canal TRITC de lapso de tiempo ampliadas en la zona 2 (caja negra en A). Las imágenes se adquirieron a intervalos de 20 s. se rastrearon 3 espermatozoides individuales en cada imagen (puntos rojo, verde y azul). Los puntos de color en el panel M representan el camino de cada esperma de B-L. Barra de escala = 20 μm. (N). ecuaciones y definiciones para la velocidad del esperma, la velocidad del vector y la frecuencia de reversión. (O). velocidad, la velocidad vectorial y la frecuencia de reversión del esperma rastreado en los paneles B-L por los puntos rojos y azules. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Película 1: película de movimiento de esperma y migración. Un hermafrodita silvestre fue acoplado a los machos Fog-2 (q71) manchados con tinte mito. La película es un compuesto de imágenes de lapso de tiempo tomadas en intervalos de tiempo variados. Por favor, haga clic aquí para ver este video. (Haga clic con el botón derecho para descargar.)
Discusión
La capacidad de los espermatozoides para navegar por el tracto reproductivo femenino enretado y encontrar ovocitos es fundamental para la reproducción sexual. Estudios recientes que utilizan espermatozoides de animales fertilizantes internamente sugieren que responden activamente a diversas señales ambientales, incluidas las indicaciones químicas, el flujo de fluidos y los gradientes de temperatura1,5,7, 9 , 12. sin embargo, estas observaciones han resultado en gran medida de experimentos in vitro y poco se sabe sobre el comportamiento del esperma y la comunicación dentro del tracto reproductivo. Una de las principales barreras para la adquisición de datos in vivo sobre la migración y la motilidad de los espermatozoides es la falta de visibilidad en la mayoría de los tratados reproductivos femeninos. El método que hemos descrito aquí utilizando C. elegans supera esta limitación. Como demuestran los resultados representativos, la epidermis transparente permite la visualización directa y el seguimiento de cada esperma a la resolución de una sola célula en un organismo vivo e intacto.
C. elegans tiene dos sexos. Los machos, con un genotipo XO, producen sólo esperma, y en este método, se utilizan como los donantes de esperma. Los hermafroditas, con un genotipo XX, son hembras modificadas. Sus gónadas se someten primero a la espermatogénesis durante la cuarta etapa larvaria y cambian a la Oogénesis en la adultez25. Este ensayo utiliza hermafroditas adultas, cuyos tejidos reproductivos proporcionan un modelo para el tracto reproductivo femenino. La utilización de ambos sexos en este ensayo nos permite identificar vías genéticas y moleculares tanto en el macho como en la hembra que pueden regular la orientación y la motilidad del esperma. Combinado con toda la serie de técnicas genéticas y moleculares disponibles para C. elegans, este método puede conducir a nuevas percepciones sobre la migración de esperma y la motilidad, así como la comunicación de espermatozoides y ovocitos.
Algunos pasos críticos en este protocolo justifican una mayor consideración, además de los detalles proporcionados en la sección de protocolo.
Gusanos
los machos mutantes Fog-2 (q71), him-5 (e1490)o him-8 (e1489) se pueden utilizar en lugar de los machos N2. Estas mutaciones aumentan la frecuencia de los machos en las culturas, pero no afectan el apareamiento masculino o las funciones espermáticas13. Las hembras, como las hembras de Fog-2 (q71) , pueden utilizarse en lugar de hermafroditas. Sin embargo, las hembras deben ser pre-acoplados con los machos para permitir el desarrollo adecuado de ovocitos. La presencia de embriones fertilizados a partir de este pre-acoplamiento también asegura que el útero es lo suficientemente largo para evaluar adecuadamente la distribución de espermatozoides. Si se están evaluando hermafroditas mutantes o experimentales, incluya un grupo de control (s). Por ejemplo, los hermafroditas mutantes deben combinarse con hermafroditas de tipo wildtype N2 como control para otras variables en el ensayo. Los hermafroditas que han sido alimentados con bacterias que contienen plásmidos para los ensayos de interferencia de ARN también deben alimentarse con bacterias que contengan control vectorial vacío. La distancia de la vulva, donde se inseminan los espermatozoides, a la Spermatheca, el sitio de fertilización, puede variar dependiendo del número de óvulos en el útero (es decir, el útero se expande con el número creciente de óvulos). Si se realizan comparaciones entre genotipos, seleccione hermafroditas cuyos uteri contengan un número similar de huevos. No seleccione hermafroditas que contengan embriones de eclosión o larvas en movimiento. Se puede realizar un curso de tiempo para identificar la edad óptima a la que se deben atacar los hermafroditas.
Recogiendo hermafroditas y machos
Es importante que los hermafroditas escogidos para este ensayo no sean de placas sobrecultivadas o con hambre. Los alimentos y las señales de feromonas modulan la expresión de DAF-7, un homolog TGFß. La vía DAF-7 se ha demostrado regular la síntesis de las prostaglandinas de la serie F que desempeñan un papel importante en la guía de esperma a la espermateca20. La recolección de hermafroditas de placas sobrepobladas o hambrientas puede resultar en una mala orientación del esperma no relacionada con el objetivo de interés. La densidad de las placas no parece afectar el esperma masculino. Sin embargo, los machos que son demasiado jóvenes o demasiado viejos pueden resultar en una disminución de la eficiencia de acoplamiento (es decir, el porcentaje de hermafroditas en la placa de acoplamiento que tiene suficiente esperma en su uteri para cuantificar). los varones adultos de 1-3 días de edad son óptimos para este ensayo23.
Anestesiando hermafroditas
En nuestras manos, la combinación de Tetramisole y Tricaine asegura que los gusanos se inmovilizen y permanezcan vivos durante el apareamiento y la adquisición de imágenes. También se pueden utilizar otros anestésicos, como el azida sódico. Sin embargo, el azida de sodio es altamente tóxico y las condiciones deben ser estandarizadas. No se recomiendan las técnicas de inmovilización que utilizan microperlas, agarosa y cámaras de microfluidos, ya que interfieren con el apareamiento.
Coloración masculina
El tinte mito utilizado en este manuscrito, MitoTrackerCMXRos, ha sido ampliamente utilizado para el etiquetado de esperma, así como otras mitocondrias, en C. elegans. El esperma etiquetado con este tinte mito es totalmente funcional, conservando su capacidad para ser activado, migrar, fertilizar ovocitos, y producir progenie viable26,27. Otros tintes mitocondriales, como rodamina 6G y DiOC6 se han utilizado para teñir C. elegans mitocondria28,29. Sin embargo, las condiciones para estos tintes deben estandarizarse para etiquetar los espermatozoides en este ensayo. Además de los mecanismos de etiquetado mitocrondrial, las manchas de ADN, como la Syto17, también se pueden utilizar para etiquetar los espermatozoides para los ensayos de migración30. Si bien estas técnicas de etiquetado son relativamente fáciles y rápidas de realizar, las estrategias transgénicas también se pueden emplear para generar espermatozoides que expresan etiquetas fluorescentes bajo promotores específicos de espermatozoides31,32.
Apareamiento
Los puntos de acoplamiento que son demasiado gruesos pueden disminuir la eficiencia de acoplamiento. Se debe tener cuidado de transferir las pequeñas bacterias posibles al transferir los machos y anestesiarse hermafroditas en el punto de acoplamiento.
Hacer almohadillas de agarosa y colocar el resguardo de la cubierta
Las burbujas de aire se pueden generar en las almohadillas de agarosa. Pueden refracar la luz durante la adquisición de imágenes o, cuando sea lo suficientemente grande, causar la caída de los gusanos, lo que hace imposible adquirir la imagen (s). Del mismo modo, se pueden crear burbujas de aire a lo largo de los hermafroditas cuando el resguardo de la cubierta se coloca sobre ellos en la almohadilla de agarosa. Estas burbujas refractan la luz y conducen a una calidad de imagen disminuida. La práctica ayudará a disminuir la ocurrencia de burbujas de aire.
Cuantificación
Al cuantificar la distribución de espermatozoides, diferentes planos z a través del útero de un gusano pueden tener ligeras diferencias en la distribución de espermatozoides. Nos encontramos con que tomar una sola imagen centrada en el espermateca nos da resultados reproducibles que son similares a los resultados obtenidos al promediar múltiples secciones z. Recomendamos enfocar la imagen en el centro de la Spermatheca, pero los planos focales se pueden alterar ligeramente en función de las necesidades del experimentante. Sin embargo, es fundamental que todas las imágenes se tomen de la misma manera. Además, es importante que solo se cuenten los espermatozoides que están en foco. Es la discreción del contador en la determinación de los criterios para el esperma en el foco. Sin embargo, es fundamental que los criterios se apliquen sistemáticamente a cada gusano que se cuantifica. Para el seguimiento de espermatozoides, muchos programas ofrecen capacidades de rastreo automático. Sin embargo, encontramos que el seguimiento manual supera el algoritmo de seguimiento automático del software por dos razones principales: 1) la abundancia de núcleos de tamaño similar dentro del espacio confinado hace que sea difícil para el software distinguir entre los espermatozoides individuales y crear ROIs definidos para cada esperma. 2) como el esperma entra y sale de foco, sus intensidades cambian, por lo que es difícil para el software para mantener un registro de los espermatozoides durante largos períodos de tiempo.
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Agradecemos sinceramente a nuestro difunto mentor, el Dr. Michael Miller, por su inspiradora y desinteresada tutoría y creación de este método como una herramienta para comprender mejor la comunicación entre los espermatozoides y los ovocitos. Su repentina muerte ha sido una tremenda pérdida para su familia, su laboratorio y la comunidad científica. Este estudio fue apoyado por el NIH (R01GM085105 a MAM y F30HD094446 a MH). El contenido es exclusivamente responsabilidad de los autores y no representa necesariamente las opiniones oficiales de los institutos nacionales de salud.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagents and Material | |||
| 60 mm x 15 mm Petri dish | Fisher | FB0875713A | |
| Agar | Fisher | BP1423-500 | |
| Sodium Chloride | Fisher | S671-3 | |
| Peptone | Fisher | BP1420-500 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB broth, Miller | Fisher | 1426-2 | |
| Escherichia coli strain NA22 | Caenorhabditis Genetics Center (CGC) | NA22 | Either this or OP50 E. coli can be used for C. elegans maintenance and assay. Both may be purchased at the CGC |
| N2 | CGC | N2 | |
| fog-2(q71) | CGC | CB4108 | |
| Platinum wire 0.25 mm dia | Alfa Aesar | 10288 | |
| 5 3/4" Disposable Pasteur pipet | Fisher | 13-678-20A | |
| Watch glass | Fisher | 02-612A | |
| 5 mm Dia. Glass rod | Fisher | 50-121-5269 | |
| MitoTracker CMXRos (Mito-dye) | Fisher | M7512 | Shield from light, store at -20 °C |
| Monopostassium phosphate | Fisher | P285-500 | |
| Disodium phosphate | Fisher | S374-1 | |
| Magnesium sulfate | Fisher | M63-500 | |
| Dimethyl sulfoxide | Fisher | BP231-1 | DMSO |
| Aluminum foil | Fisher | 01-213-102 | |
| Ethyl 3-aminobenzoate methanesulfonate | Sigma | E10521-10G | Tricaine is the common name. Store in aliquotes at -20 °C. |
| Tetramisole hydrochloride | Sigma | L9756-5G | Store in aliquotes at -20 °C |
| Agarose | Fisher | BP1356-100 | |
| Coverslips | Fisher | 12-548-A | 18 x 18-1 |
| Frosted microscope slides | Fisher | 12-552-3 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 16 °C and 20 °C incubators | Fisher | 97-990E | Same model, set at different temperatures. |
| Upright Microscope with epi-fluorescence illuminator, camera, and 10x and 60x objectives | Nikon | ||
| Software with image acquisition and tracking capabilities | Nikon | NIS-elements AR | |
| Stereo-microscope | Nikon | SMZ800N | Any stereo-microscope that can be used to visualize C. elegans may be used with this protocol |
Referencias
- Boryshpolets, S., Perez-Cerezales, S., Eisenbach, M. Behavioral mechanism of human sperm in thermotaxis: a role for hyperactivation. Human Reproduction. 30 (4), 884-892 (2015).
- Edmonds, J. W., McKinney, S. L., Prasain, J. K., Miller, M. A. The gap junctional protein INX-14 functions in oocyte precursors to promote C. elegans sperm guidance. Developmental Biology. 359 (1), 47-58 (2011).
- Edmonds, J. W., et al. Insulin/FOXO signaling regulates ovarian prostaglandins critical for reproduction. Developmental Cell. 19 (6), 858-871 (2010).
- Espinal-Enriquez, J., Priego-Espinosa, D. A., Darszon, A., Beltran, C., Martinez-Mekler, G. Network model predicts that CatSper is the main Ca(2+) channel in the regulation of sea urchin sperm motility. Scientific Reports. 7 (1), 4236 (2017).
- Hunter, R. H., Nichol, R. A preovulatory temperature gradient between the isthmus and ampulla of pig oviducts during the phase of sperm storage. Journal of Reproduction and Fertility. 77 (2), 599-606 (1986).
- Hussain, Y. H., Guasto, J. S., Zimmer, R. K., Stocker, R., Riffell, J. A. Sperm chemotaxis promotes individual fertilization success in sea urchins. Journal of Experimental Biology. 219 (Pt 10), 1458-1466 (2016).
- Kantsler, V., Dunkel, J., Blayney, M., Goldstein, R. E. Rheotaxis facilitates upstream navigation of mammalian sperm cells. Elife. 3, e02403 (2014).
- Kubagawa, H. M., et al. Oocyte signals derived from polyunsaturated fatty acids control sperm recruitment in vivo. Nature Cell Biology. 8 (10), 1143-1148 (2006).
- Miki, K., Clapham, D. E. Rheotaxis guides mammalian sperm. Current Biology. 23 (6), 443-452 (2013).
- Ting, J. J., Tsai, C. N., Schalkowski, R., Cutter, A. D. Genetic Contributions to Ectopic Sperm Cell Migration in Caenorhabditis Nematodes. G3. 8 (12), 3891-3902 (2018).
- Yanagimachi, R., et al. Chemical and physical guidance of fish spermatozoa into the egg through the micropyledagger, double dagger. Biology of Reproduction. 96 (4), 780-799 (2017).
- Zhang, Y., et al. Generation of Gradients on a Microfluidic Device: Toward a High-Throughput Investigation of Spermatozoa Chemotaxis. PloS One. 10 (11), e0142555 (2015).
- Hoang, H. D., Miller, M. A. Chemosensory and hyperoxia circuits in C. elegans males influence sperm navigational capacity. PLoS Biology. 15 (6), e2002047 (2017).
- Hansen, J. M., Chavez, D. R., Stanfield, G. M. COMP-1 promotes competitive advantage of nematode sperm. Elife. 4, (2015).
- L'Hernault, S. W. Spermatogenesis. WormBook: The Online Review of C. Elegans Biology. , 1-14 (2006).
- Miller, M. A., et al. A sperm cytoskeletal protein that signals oocyte meiotic maturation and ovulation. Science. 291 (5511), 2144-2147 (2001).
- Greenstein, D. Control of oocyte meiotic maturation and fertilization. WormBook: The Online Review of C. Elegans Biology. , 1-12 (2005).
- O'Hagan, R., Wang, J., Barr, M. M. Mating behavior, male sensory cilia, and polycystins in Caenorhabditis elegans. Seminars in Cell & Developmental Biology. 33, 25-33 (2014).
- Hoang, H. D., Prasain, J. K., Dorand, D., Miller, M. A. A heterogeneous mixture of F-series prostaglandins promotes sperm guidance in the Caenorhabditis elegans reproductive tract. PLoS Genetics. 9 (1), e1003271 (2013).
- McKnight, K., et al. Neurosensory perception of environmental cues modulates sperm motility critical for fertilization. Science. 344 (6185), 754-757 (2014).
- Chaudhuri, J., Parihar, M., Pires-daSilva, A. An introduction to worm lab: from culturing worms to mutagenesis. Journal of Visualized Experiments. (47), (2011).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. Elegans Biology. , 1-11 (2006).
- Chatterjee, I., et al. Dramatic fertility decline in aging C. elegans males is associated with mating execution deficits rather than diminished sperm quality. Experimental Gerontology. 48 (11), 1156-1166 (2013).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. , 80-90 (2017).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent Window into Biology: A Primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Sato, M., Sato, K. Degradation of paternal mitochondria by fertilization-triggered autophagy in C. elegans embryos. Science. 334 (6059), 1141-1144 (2011).
- Wang, Y., et al. Kinetics and specificity of paternal mitochondrial elimination in Caenorhabditis elegans. Nature Communications. 7, 12569 (2016).
- Wolke, U., Jezuit, E. A., Priess, J. R. Actin-dependent cytoplasmic streaming in C. elegans oogenesis. Development. 134 (12), 2227-2236 (2007).
- Mottram, L. F., Forbes, S., Ackley, B. D., Peterson, B. R. Hydrophobic analogues of rhodamine B and rhodamine 101: potent fluorescent probes of mitochondria in living C. elegans. Beilstein Journal of Organic Chemistry. 8, 2156-2165 (2012).
- Singson, A., Hill, K. L., L'Hernault, S. W. Sperm competition in the absence of fertilization in Caenorhabditis elegans. Genetics. 152 (1), 201-208 (1999).
- Wu, J. C., et al. Sperm development and motility are regulated by PP1 phosphatases in Caenorhabditis elegans. Genetics. 190 (1), 143-157 (2012).
- Seidel, H. S., et al. A novel sperm-delivered toxin causes late-stage embryo lethality and transmission ratio distortion in C. elegans. PLoS Biology. 9 (7), e1001115 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados