Method Article
Preparación y caracterización de nanoliposomas para el atrapamiento de proteínas globulares hidrofílicas bioactivas
En este artículo
Resumen
Este estudio describe la hidratación clásica utilizando el método de película lipídica delgada para la preparación de nanoliposomas seguido de caracterización de nanopartículas. Una proteína hidrofílica y globular de 47 kDa, la alcina, se encapsula con éxito como una estrategia para mejorar la estabilidad, evitar el aclaramiento rápido y promover la liberación controlada. El método se puede adaptar a la encapsulación de moléculas hidrofóbicas.
Resumen
Las nanocápsulas liposoma se han aplicado para muchos propósitos en las industrias farmacéutica, cosmética y alimentaria. Los atributos de los liposomas incluyen su biocompatibilidad, biodegradabilidad, no inmunogenicidad, no toxicidad, y la capacidad de atrapar compuestos hidrófilos e hidrófobos. La hidratación clásica de películas lipídicas delgadas en un disolvente orgánico se aplica aquí como una técnica para encapsular la alcina, una lectina vegetal, en nanoliposomas. El tamaño del nanoliposoma, la estabilidad, la eficiencia del atrapamiento y la caracterización morfológica se describen en detalle. Los nanoliposomas se preparan utilizando 1,2-dioleoyl-sn-glicerol-3-fosfoethanolamine (DOPE), 1,2-distearoyl-sn-glycero-3-fosfoetanolamina-N-[amino(polietilenglicol)-2000] (sal de amonio; DSPE-MPEG 2000), y el colesterylhemisuccinate (CHEMS) como los principales componentes. Los lípidos se disuelven primero en cloroformo para obtener una fina película lipídica que posteriormente se rehidrata en solución de sulfato de amonio que contiene la proteína que se va a atrapar e incubar durante la noche. A continuación, se aplican técnicas de sonicación y extrusión para generar vesículas unilamelares de tamaño nanométrico. El tamaño y el índice de polidispersidad de las nanovesículas se determinan mediante la dispersión dinámica de la luz, mientras que la morfología de la nanovesícula se evalúa mediante la exploración de microscopía electrónica. La eficiencia del atrapamiento viene determinada por la relación entre la cantidad de proteína no encapsulada y la cantidad original de proteína cargada inicialmente. Los liposomas homogéneos se obtienen con un tamaño medio de 155 nm y un valor de índice de polidispersidad de 0,168. Se logra una alta eficiencia de atrapamiento del 83%.
Introducción
El número de estudios que investigan sistemas eficientes de administración de medicamentos ha aumentado en los últimos años. Sin embargo, todavía es necesario superar limitaciones como el aclaramiento rápido, la mala biodistribución y la solubilidad en el pH fisiológico y la ingesta celular insuficiente. El uso de nanosistemas ha surgido como un progreso reciente en las terapias contra el cáncer, aplicada para aumentar la concentración intracelular de fármacos dentro de las células cancerosas mientras se minimiza la toxicidad en las células sanas. Además, las nanopartículas obtenidas de una gama diferente de materiales (es decir, polímeros, dendrímeros, liposomas, virus, nanotubos de carbono y metales como el óxido de hierro y el oro) se están aplicando actualmente para mejorar los efectos anticancerígenos y reducir los efectos sistémicos toxicidad1. Las nanocápsulas liposoma en particular se han aplicado para muchos propósitos en las industrias farmacéutica, cosmética y alimentaria. En los últimos años, varios productos nutracéuticos como vitaminas, enzimas y extractos herbarios han sido formulados utilizando la tecnología de liposomas2.
Los liposomas son vesículas esféricas que consisten en una o más bicapas lipídicas concéntricas formadas espontáneamente por la dispersión de fosfolípidos en medios acuosos3,4. Las cabezas polares de los fosfolípidos se encuentran en las superficies externas e internas de las membranas, en contacto con el ambiente acuoso. Por el contrario, las cadenas de ácidos grasos formanel núcleo hidrófobo de las membranas y están protegidas del agua 5. Algunos atributos de los liposomas que los hacen atractivos sistemas de administración de fármacos incluyen su biocompatibilidad, biodegradabilidad, no inmunogenicidad, no toxicidad, y la capacidad de atrapar compuestos hidrófilos e hidrófobos6.
Los liposomas se pueden preparar utilizando varios pasos de procesos como agitación, sonicación, extrusión, liofilización, congelación y descongelación. Los métodos clásicos incluyen evaporación de fase inversa, inyección de disolvente y diálisis detergente. El método más aplicado es la hidratación delgada de la película lipídica, también conocida como el método de Bangham, que se utiliza para obtener formas de lípidos vesiculares7,8,9,10,11. Lamelaridad (el número de bicapas de fosfolípidos) y el tamaño de las partículas son parámetros clásicos utilizados para caracterizar liposomas como 1) vesículas unilamelares (Ultv), formadas por una bicapa de fosfolípidos única y que varían en tamaño de la siguiente manera: i) pequeñas vesículas unilamellar vesículas (SUVs, 0,02-0,20 m), ii) vesículas unilamelares grandes (LUVs, 0,2-1,0 m) y iii) vesículas unilamelares gigantes (GUVs, >1 m); o 2) vesículas multilamelar (MlVs, >0,1 ám)3,12. El tamaño de la vesícula es un parámetro importante a la hora de considerar para uso terapéutico, como en el tratamiento del cáncer, en elque los tamaños de <200 nm son ideales para permitir que las nanovesículas crucen la barrera endotelial y alcancen los tejidos tumorales 4.
En este documento, el procedimiento de encapsulación después de la hidratación clásica de una técnica de película lipídica delgada7 se describió utilizando tarin, una lectina vegetal caracterizada como una proteína globular hidrófila13,14,15 . Las vesículas nanométricas se producen mediante la inclusión de pasos de sonicación y extrusión en la técnica principal, lo que resulta en nanovesículas liposómicas estables con alta eficiencia de atrapamiento16.
Protocolo
1. Preparación de nanocápsulas liposomales de altina16
NOTA: Todas las preparaciones deben prepararse por triplicado para obtener un volumen mayor (7 ml) y permitir que la muestra se centrifuga en una ultracentrífuga (ver detalles a continuación).
- Pesar los componentes liposomas utilizando un balance analítico, como se muestra en la Tabla 1.
- Disolver los componentes lipídicos en cloroformo utilizando un matraz volumétrico de 250 ml que cabe en un evaporador rotatorio para evitar la pérdida de material.
- Revuelva la mezcla a 150 rpm durante 15 min.
- Retire el cloroformo utilizando un evaporador rotatorio en las siguientes condiciones:
- Ajustar la boca del matraz volumétrico a la posición estándar (25o) para una eficiencia óptima, mientras está en contacto con el agua del baño de calefacción.
NOTA: El brazo del equipo debe inclinarse a 25o para mantener el contacto entre el matraz volumétrico y el baño de agua, sin afectar la eficiencia de evaporación ni dañar la muestra. La posición estándar puede variar según la marca del equipo. - Ajuste la temperatura del condensador a un mínimo de 3 oC.
- Ajuste la temperatura del baño de calefacción a 40 oC.
- Ajuste la rotación a 120 rpm.
- Ajustar la aspiradora a 207 mbar y punto de ebullición a 20 oC.
- Después de 25 minutos, retire el matraz y deseche el disolvente evaporado, quedando en el condensador, adecuadamente.
NOTA: Una película delgada y opaca, que consiste en los componentes liposoma, se forma en este paso y se puede visualizar fácilmente. El disolvente evaporado que queda en el condensador debe almacenarse en recipientes de eliminación (clorados) para ser manipulado por una empresa especializada para su descarte adecuado.
- Ajustar la boca del matraz volumétrico a la posición estándar (25o) para una eficiencia óptima, mientras está en contacto con el agua del baño de calefacción.
- Hidratar la película lipídica para alcanzar una concentración de lípidos de 0,01 M en una solución de sulfato de amonio de 0,3 M (pH a 7,4) que contiene alras a 1 mg/ml a un volumen final de 10 ml.
- Revuelva la mezcla durante 40 minutos e incubar durante la noche a 4oC.
NOTA: Este paso se puede considerar un punto de parada. La incubación durante la noche no es obligatoria.
- Revuelva la mezcla durante 40 minutos e incubar durante la noche a 4oC.
- Después de la incubación, sonicar la suspensión durante 1 min a 25 oC (temperatura ambiente; RT) para reducir el tamaño de la vesícula y evitar la agregación.
NOTA: La reducción de tamaño se realizó en un sonicador ultrasónico en las siguientes condiciones: 130 W y 40 kHz. - Realizar una extrusión de 12 ciclos a través de una membrana de policarbonato de 0,2 m.
NOTA: Antes del proceso de extrusión, pruebe el conjunto de miniextrusor con agua para evitar fugas de muestras. También es adecuada una membrana de poro de 0,1 m. En este caso, precalienta el soporte del miniextrusor por encima de la temperatura de transición lipídica para facilitar la extrusión, manteniendo al mismo tiempo las características fisicoquímicas tanto de lípidos como de proteínas.- Ajuste las piezas del mini extrusor, como se describe en el manual del fabricante.
- Coloque la membrana de policarbonato entre dos soportes de filtro prehúmedos y colóquela en el soporte.
- Inserte una jeringa vacía de 1 ml en el dispositivo, llene la otra jeringa a su volumen total con la suspensión liposomal e insértela en el lado opuesto.
- Realizar una extrusión de 12 ciclos a través de una membrana de policarbonato de 0,2 m. Empuje la muestra de una jeringa a otra, lentamente. Recoja la suspensión extruida en un tubo preenfriado.
NOTA: La membrana de policarbonato debe sustituirse únicamente cuando la transferencia de la muestra de una jeringa a otra se vuelva difícil. La suspensión liposomal debe ser clara durante el proceso de extrusión como resultado de la reducción del tamaño debido a la formación de SUV. Durante este paso se pueden perder aproximadamente 0,2 ml de la muestra.
- Separe los liposomas por ultracentrifugación.
NOTA: Mantenga las muestras en un baño de hielo hasta que la ultracentrífuga esté lista para ser utilizada. Separe los SUV de los componentes restantes y el sulfato de amonio por ultracentrifugación utilizando un ultracentrífugo con un rotor oscilante (consulte los detalles a continuación).- Pesar la muestra en el tubo de titanio que se ajusta al rotor y equilibrar los tubos. Compruebe el volumen mínimo requerido de acuerdo con el rotor utilizado para evitar dañar los tubos, y ajuste el volumen de la suspensión liposomal con sulfato de amonio, si es necesario.
NOTA: El cucharón basculante siempre debe estar apoyado en el soporte cuando está fuera de la centrífuga para evitar rayar las "rayas de cebra" (es decir, las rayas blancas y negras en la parte inferior), que son utilizadas por la centrífuga para determinar la velocidad de rotación. - Encienda la aspiradora antes de usar la centrífuga para permitir que se refrigerara.
- Coloque los tubos de titanio en el cubo de oscilación.
NOTA: Levante los tubos a la posición que asumen al correr para asegurarse de que están perfectamente instalados. - Suelte el vacío, abra la puerta de la centrífuga y coloque el rotor dentro.
NOTA: Preste atención a la marca de círculo en la parte inferior del rotor, que debe caber en la dirección opuesta de la misma marca de círculo en la propia centrífuga. - Cierre la puerta de centrífuga, presione Vacío y espere hasta que el vacío alcance de 200 a 20 micras o de 26 Pa a <3 Pa.
- Ajuste los parámetros en la pantalla de ultracentrífuga a 150.000 x g (el equivalente a 29.600 rpm para el cucharón de oscilación antes mencionado) durante 90 min a 4 oC (aceleración: máx., desaceleración: máx.).
NOTA: Convierta siempre la velocidad a x g si la centrífuga específica está establecida en rpm. Utilice el sitio web de la centrífuga para convertir la unidad de acuerdo con el rotor utilizado. - Pulse Recuperar, compruebe las condiciones y pulse Iniciar para ejecutar.
NOTA: Espere hasta que la centrífuga alcance la velocidad deseada. - Después de 90 minutos, suelte el vacío pulsando el botón Vacuum y abra la puerta de la centrífuga cuando el vacío alcance los 200-700 micras (equivalente a 26-93 Pa).
- Apague la centrífuga, retire el rotor del interior y déjelo en el banco con los cubos para secar.
- Mantenga las muestras ultracentrificaradas en hielo.
- Pesar la muestra en el tubo de titanio que se ajusta al rotor y equilibrar los tubos. Compruebe el volumen mínimo requerido de acuerdo con el rotor utilizado para evitar dañar los tubos, y ajuste el volumen de la suspensión liposomal con sulfato de amonio, si es necesario.
- Con cuidado, separe el sobrenadante del pellet girando el tubo boca abajo en un tubo de centrífuga desechable de 15 ml para separar el sobrenadante y el pellet.
NOTA: Almacene el sobrenadante que contiene la proteína no encapsulada a 4 oC. Se utilizará para determinar la eficiencia de encapsulación. El pellet aparece como una jalea translúcida. - Suspenda el pellet que contiene la proteína encapsulada en la solución salina tamponada HEPES (3 ml de 1x HBS).
NOTA: El HBS 2x (solución en stock) se prepara diluyendo las siguientes cantidades de reactivos en agua destilada: 140 mM NaCl, 1,5 mM Na2HPO4,50 mM HEPES, luego ajustando el pH a 7,4 y el volumen final a 100 ml. Na2HPO4 puede ser reemplazado por NaHCO3u omitido para evitar interferencias si se quiere determinar la concentración de liposomas. La solución de HBS 2x en stock debe diluirse en agua destilada para obtener HBS 1x antes de su uso.
2. Eficiencia de encapsulación
NOTA: Determine la eficiencia de encapsulación utilizando el protocolo17de Peterson para evitar interferencias de lípidos en la cuantificación de proteínas. Todas las muestras (estándares BSA y sobrenadante liposoma) deben analizarse por triplicado. También prepare un tubo en blanco.
- Preparación de reactivos de stock y soluciones de trabajo17
- Para los reactivos de stock, prepare el carbonato de tartrato de cobre (CTC) mezclando 10 ml de carbonato sódico al 20%, 200 ml de sulfato de cobre al 0,1%, 200 ml de tartrato de potasio al 0,2% con 9,6 ml de agua destilada. Preparar 100 ml de sulfato de dodecilo 10% sódico (SDS) y 0,8 N de hidróxido de sodio (NaOH).
- Para soluciones de trabajo, prepare 10 ml de desoxicolato de sodio al 0,15% (DOC) y 72% de ácido tricloroacético (TCA). Disolver 10 mg de albúmina sérica bovina (BSA) en 10 ml de agua destilada para obtener una solución estándar de 1 mg/ml. Preparar el reactivo A añadiendo partes iguales de CTC, NaOH, SDS y H2O. Preparar el reactivo B diluyendo el reactivo de fenol Folin-Ciocalteu 1:5 en agua destilada.
NOTA: El reactivo A requiere 1 ml para cada tubo de reacción, mientras que el reactivo B requiere 0,5 ml. Para determinar los volúmenes finales de los reactivos A y B, defina primero el número de tubos de reacción que se utilizarán, teniendo en cuenta tres concentraciones distintas de BSA, en blanco y muestras en triplicado. El reactivo A debe estar bien homogeneizado antes de su uso y puede almacenarse a 25 oC (RT) durante 2 semanas. El reactivo B también es estable a 25 oC (RT) si se almacena en un frasco de ámbar.
- Precipitación
NOTA: Este paso se realiza en tubos de microcentrífuga.- Diluir el sobrenadante liposoma con agua a un volumen final de 1 ml que contenga 5-100 g de proteína.
NOTA: El tubo en blanco debe llenarse con 1 ml de agua destilada. - Añadir 0,1 mL de 0,15% DOC, homogeneizar por vórtice e incubar durante 10 min en RT.
- Añadir 0,1 ml de 72% de TCA, mezclar bien y centrifugar a 3.000 x g y RT durante 15 min.
NOTA: DOC-TCA promueve la precipitación proteica, formando dos fases distintas. La proteína diana se puede recuperar mediante centrifugación, evitando interferencias lipídicas. - Deseche cuidadosamente el sobrenadante verndo el tubo hacia abajo y poniéndolo sobre un papel absorbente. Guarde el pellet para el paso siguiente.
NOTA: El pellet puede ser muy difícil de ver, pero el tubo debe girarse al revés incluso si no es visible.
- Diluir el sobrenadante liposoma con agua a un volumen final de 1 ml que contenga 5-100 g de proteína.
- Espectrofotometría
- Suspenda el pellet obtenido del paso 2.2.4 en 1 ml de agua destilada. Mezclar bien para asegurarse de que el pellet está disuelto y transferir la muestra a un nuevo tubo de ensayo.
- Preparar las diluciones de los estándares de albúmina (BSA) a un volumen final de 1 ml.
NOTA: Las normas proteicas deben prepararse entre 5-100 g/ml. - Añadir 1 ml de reactivo A a los tubos de los pasos 2.3.1 y 2.3.2 sin excepción, mezclar bien e incubar durante 10 minutos en RT.
NOTA: SDS puede aliviar posibles interferencias lipídicas mientras ayuda en la solubilización de proteínas. - Añadir 0,5 ml de reactivo B a los tubos de los pasos 2.3.1 y 2.3.2, mezclar bien e incubar durante 30 minutos a RT mientras está protegido de la luz.
NOTA: El reactivo de fenol Follin-Ciocalteu es una mezcla de fosfomolibdato y fosfotungstate utilizados para ensayos colorimétricos de algunos compuestos que contienen nitrógeno, como proteínas. La complejidad del cobre aumenta la reactividad de los fenoles hacia este reactivo, produciendo un complejo azul/púrpura según la concentración de proteínas. - Determinar las absorbancias a 750 nm utilizando un espectrofotómetro.
- Calcule la concentración de proteínas en el sobrenadante basándose en la curva estándar de la siguiente manera.
- Valor de absorción de parcela (Abs) frente a la concentración de BSA (mg/ml) para obtener el coeficiente angular (k) teniendo en cuenta una línea de tendencia lineal.
- Determinar la concentración de proteína sobrenadante (C) por la relación entre el valor de absorbancia y el coeficiente angular (k), y luego multiplicar por el volumen total de la siguiente manera:
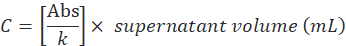
- Determine la eficiencia de encapsulación de acuerdo con la siguiente fórmula:
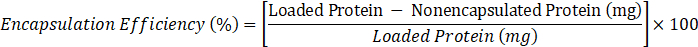
- en los casos en que la proteína cargada es de 10 mg, proteína no encapsulada, valor de C obtenido en el paso 2.3.6.2.
NOTA: En este caso, se utiliza un total de 10 mg de tarína disuelto en solución de sulfato de amonio (1 mg/ml) para realizar el procedimiento de encapsulación, ya que esta concentración es suficiente para obtener efectos in vitro satisfactorios13,16, 18.
3. Determinación del tamaño y la estabilidad
NOTA: La distribución del tamaño y el índice de polidispersidad (PdI) de las preparaciones liposomales se evalúan mediante dispersión de luz dinámica (DLS). Una PdI cercana a 0.1 indica una preparación homogénea. Para la determinación de la estabilidad, almacene los liposomas a 4 oC y compruebe la distribución del tamaño y el tamaño promedio regularmente.
- Encienda el equipo DLS 30 minutos antes de usarlo para calentar la lámpara láser.
- Transfiera la preparación liposomal obtenida en el paso 1.10 a una cubeta de tamaño desechable.
- Establezca los parámetros del equipo de la siguiente manera: tipo de dispersante : agua (RI - 1,33); material - lípidos (RI 1,45); y RT.
- Pulse Iniciar y espere mientras el equipo termina su lectura.
- Retire la cubeta y apague el equipo.
NOTA: Transfiera la muestra de la cubeta de nuevo al tubo de centrífuga desechable de 15 ml para análisis posteriores, o deséchela si hay una cantidad suficiente para nuevas lecturas.
4. Caracterización morfológica
NOTA: La caracterización liposoma se realiza de acuerdo con Murtey y Ramasamy19. Las muestras que contienen nanoliposomas obtenidos en el paso 1.10 se preparan por triplicado.
- Fije los tapones de vidrio (13 mm de diámetro) en la parte inferior de una placa Petri con cinta adhesiva de doble cara. Corta la cinta en trozos pequeños (tamaño adecuado para fijar los labios de las cubiertas), retira el papel protector debajo y arréglalo en la parte inferior de la placa Petri. Con la ayuda de pinzas, retire el papel protector en la parte superior de la cinta y fije los cubreobjetos en ella.
NOTA: Tenga cuidado en los siguientes pasos para no soltar los cubreobjetos y utilice una cinta fuerte. - Recubrir los cubrecubiertas con poli-L-lisina. Coloque los papeles de filtro húmedos dentro de la placa Petri para mantener la humedad e incubar durante 1 h a RT (25 oC).
- Después del recubrimiento, enjuague los labios con agua destilada.
- Llene los labios con una gota de la muestra del paso 1.10 y déjelos secar durante 1 h en RT.
- Para fijar las muestras, cúbralas con un 4% de glutaraldehído preparado en tampón de fosfato de 0,1 M, pH a 7,2. Coloque los papeles de filtro húmedos dentro de la placa Petri y selle el plato para mantener los niveles de humedad. Incubar a 4oC durante 48 h.
- Enjuague los labios de las cubiertas 3x durante 5 min con el mismo tampón de fosfato.
- Deshidratar muestras de la siguiente manera: 35% etanol 1x para 15 min, 50% etanol 1x para 15 min, 75% etanol 1x para 15 min, 95% etanol 2x para 15 min, y etanol absoluto 3x para 20 min.
- Seque químicamente las muestras por inmersión 2x en 1 x 2 ml de hexametildisilazane (HMDS) durante 10 min.
NOTA: El HMDS debe manipularse cuidadosamente dentro de una campana de humos. Se debe permitir que las muestras se sequen durante la noche dentro de un desecador o dentro de la campana de humos en RT. - Monte las muestras secas en un talón con una cinta adhesiva conductora de carbono.
- Sputter la superficie de la cubierta en un vacío con una capa conductora eléctrica (20 nm de espesor) de oro-paladio.
- Grabe imágenes con un microscopio electrónico de barrido (SEM) en modo de vacío bajo y baja tensión (20 kV).
Resultados
La Figura 1 describe la preparación nanoliposoma16,20,21. Fosfolípidos, 1,2-dioleoilo-sn-glicerol-3-fosfoetanolamina (DOPE), 1,2-distearoyl-sn-glicero-3-fosfoethanolamine-N-[amino(polietilenglicol)-2000] (sal de amonio; DSPE-MPEG 2000), y el colesterylhemisuccinate (CHEMS), los principales componentes liposomas, se disolvieron por primera vez en cloroformo para obtener la película lipídica. La película lipídica se rehidrató en solución de sulfato de amonio que contenía la proteína hidrófila (tarina) que se iba a atrapar, y la incubación se realizó durante la noche. Luego, se aplicaron técnicas de sonicación y extrusión para generar pequeñas vesículas unilamelares. El paso de ultracentrifugación separó la preparación liposomal de lípidos libres y proteínas no encapsuladas, mientras que el sobrenadante se utilizó para la determinación de la eficiencia de atrapamiento.
Los nanoliposomas producidos utilizando la metodología antes mencionada exhibieron una distribución de tamaño que oscilabaentre 51 y 396 nm y un tamaño medio de 155 nm (Tabla 2). La preparación fue homogénea, ya que el índice de polidispersidad fue de 0,168. Se puede alcanzar una alta eficiencia de atrapamiento del 83% si los liposomas se extruyen a través de una membrana de tamaño de poro de 0,2 m (Tabla2).
Las características morfológicas del nanoliposoma fueron evaluadas por SEM. Figura 2A,B muestra vesículas liposómicas de forma redonda en el rango de 121 nm y analizadas a 20 kV, mientras que la Figura 2 C,D muestra velas liposómicas de forma redonda en el rango de 121 nm y analizadas a 20 kV, mientras que la Figura 2C,D muestra muestra sin embargo preparado Muestras. Los nanoliposomas se secaron simplemente al aire sin fijación previa o cualquier otro tratamiento descrito en este estudio. Como resultado, se observaron vesículas más grandes y dañadas en el rango de 332 m y analizadas a 5 kV.
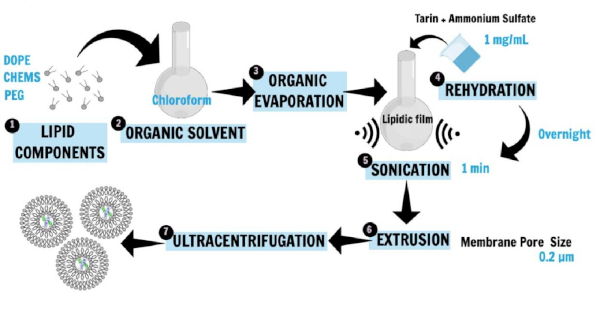
Figura 1: Representación esquemática de la preparación nanoliposoma. DOPE, PEG y CHEMS, los principales componentes liposomas, se disolvieron por primera vez en cloroformo para obtener la película lipídica (1, 2, 3). La película lipídica se rehidrató en un tampón salino que contiene la proteína hidrófila (tarina) que se va a atrapar, y la incubación se realizó durante la noche (4). Luego, se aplicaron técnicas de sonicación y extrusión para generar SUV (5, 6). El paso de ultracentrifugación separó la preparación liposomal de lípidos libres y proteínas no encapsuladas, mientras que el sobrenadante se utilizó para la determinación de la eficiencia de atrapamiento (7). Esta cifra ha sido modificada de Correa et al.16. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Fotomicroscopía nanoliposoma por SEM. (A,B) Imágenes de vesículas liposomales de forma redonda en el rango de 121 nm y analizadas a 20 kV. (C,D) Imágenes de muestras preparadas inadecuadamente. Las muestras mal tratadas permitieron la observación de vesículas más grandes y/o dañadas, que no pueden resistir las condiciones de vacío y/o tensión a 5 kV. Esta cifra ha sido modificada de Correa et al.16. Haga clic aquí para ver una versión más grande de esta figura.
| Componentes liposoma | Peso (g) | Concentración (mM) | Volumen final |
| Droga | 0.0420 | 5.7 | 10 mL |
| MPEG 2000-DSPE | 0.1059 | 3.8 | |
| Chems | 0.0024 | 0.5 |
DOPE - 1,2-dioleoyl-sn-glicerol-3-fosfoetanolamina); MPEG 2000-DSPE - 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N- [amino (polietilenglicol)-2000] (sal de amonio); CHEMS – colesterylhemisuccinato.
Tabla 1: Preparación de nanocápsulas liposómicas de altina.
| Tamaño de los poros de membrana (m) | Distribución del tamaño (nm) | Tamaño medio (nm) | Indice de polidispersidad (PdI) | Pico (nm) | Eficiencia de atrapamiento |
| 0.2 | 51 - 396 | 155 | 0. 168 | 94 x 39 | 0.83 |
El tamaño y el índice de polidispersidad se evaluaron mediante dispersión dinámica de la luz, mientras que la eficiencia de encapsulación se determinó de acuerdo con Peterson17.
Tabla 2: Tamaño, índice de polidispersidad y eficiencia de atrapamiento de la preparación de nanoliposoma.
Discusión
El protocolo descrito en este documento fue probado por Correa et al.16 para encapsular la alcina, una lectina inmunomoduladora y antitumoral purificada de Colocasia esculenta22. La metodología dio resultados exitosos, permitiendo la producción de nanoliposomas estables de tamaño adecuado para aplicaciones terapéuticas. La formulación presenta liberación controlada a diferentes niveles de pH bajo condiciones fisiológicas. También potencia las propiedades farmacológicas de la tarína, como la inhibición del glioblastoma humano U-87 MG y el cáncer de mama Líneas celulares MDA-MB-231 y la estimulación de las células de la médula ósea de ratones. La preparación liposomal no mostró efectos tóxicos en células de ratones sanos16.
El método clásico, descrito por primera vez por Bangham et al.7, permite la producción de grandes vesículas liposomas multilamelares, heterogéneas en tamaño y forma. Las adaptaciones de este método, como se ha informado en el presente estudio, se aplican con éxito mediante la inclusión de pasos adicionales como sonicación y extrusión a través de una membrana de policarbonato de 0,2 m. Esto permite la producción de una dispersión más homogénea con respecto al tamaño en el rango de nanómetros16,23,24. Por lo tanto, para asegurar los resultados exitosos, el protocolo de encapsulación y la formulación liposomal descritos aquí deben seguirse estrictamente.
La composición nanoliposoma fue cuidadosamente seleccionada con el fin de asegurar la formación de una membrana bicapa con DOPE, MPEG 2000-DSPE, y CHEMS como los principales componentes. Estos son componentes bicapa de membrana animal natural y este último puede conferir fluidez a la arquitectura nanoliposoma, asegurando una amplia aplicación para la entrega de compuestos bioactivos en seres humanos.
La pegilación nanoliposoma es esencial para garantizar la estabilidad de la estructura de liposoma. La ausencia de PEG conduce a la ampliación del tamaño, un alto índice de polidispersidad y una baja eficiencia de atrapamiento. Los resultados óptimos se pueden obtener con DOPE como componente principal de liposomas. Sin embargo, este es un fosfolípido de alto costo. Los costos financieros de la producción de nanoliposomas se pueden lograr reemplazando DOPE con otros lípidos similares como DOPC (1,2-dioleoyl-sn-glicero-3-fosfocolina). CHEMS es una molécula de colesterol que se encuentra naturalmente en las membranas celulares animales, que no debe excluirse de la formulación, ya que es importante garantizar la fluidez bicapa lipídica y maleabilidad16.
Otros aspectos del protocolo de encapsulación también se pueden adaptar. El cloroformo utilizado para disolver los componentes liposomales puede ser reemplazado fácilmente por metanol sin efectos sobre el tamaño promedio, homogeneidad y eficiencia de atrapamiento. Sin embargo, algunas fugas de proteínas pueden ocurrir en el almacenamiento a menos de 4 oC16. El paso de incubación durante la noche con solución de sulfato de amonio que contiene altina no es obligatorio; sin embargo, por conveniencia se puede realizar sin dañar las características biofísicas nanoliposomales, encapsulación, o pérdidas de eficiencia de estabilidad, como lo demuestra Correa y otros16. El paso de extrusión se realiza a temperatura ambiente, lo que puede disminuir el caudal entre las jeringas si se utiliza una membrana de tamaño de poro de 0,1 m.
Para superar este problema, se debe considerar el uso de una membrana de tamaño de poro de 0,2 m o el calentamiento del soporte del extrusor por encima de la temperatura de transición lipídica. El analista debe tener cuidado de no dañar los lípidos o proteínas que se pueden desactivar y perder actividad biológica. Alternativamente, la preparación liposomal se puede dializar contra HBS en lugar de ultracentrifugación, utilizando una membrana de corte según el peso molecular de la proteína. La elección de la naturaleza química del tampón en el que se suspenden los nanoliposomas después de la ultracentrifugación está directamente relacionada con su aplicación posterior. Dado que las perspectivas de este estudio incluyen ensayos in vivo e in vitro, la suspensión en la solución salina tamponada HEPES fue adecuada para garantizar que no haya efectos citotóxicos y un rango de pH cercano a las condiciones fisiológicas.
Los liposomas deben ser tratados finamente, similares a las células vivas, para obtener imágenes SEM de mayor calidad. Los procedimientos de fijación y secado son importantes para garantizar la visualización de vesículas intactas más pequeñas que soportan valores superiores a 20 kV en condiciones de vacío. Figura 2 A,B muestra vesículas nanométricas compatibles con el procedimiento de extrusión. La visualización de vesículas de 51-396 nm es posible si se realiza una preparación adecuada de la muestra después de este procedimiento. Los pasos incluyen la fijación, el secado mediante el aumento de las concentraciones de etanol y la deshidratación química para evitar la formación de agregados y vesículas rotas causadas por el vacío y el haz de electrones. Por otro lado, la Figura 2C,D muestra vesículas liposomas secas a temperatura ambiente y no sometidas a ningún tratamiento descrito aquí, lo que significa que se prepararon inadecuadamente. Como resultado del procedimiento inadecuado, se forman vesículas gigantes, incluso después de la extrusión a través de una membrana de tamaño de poro de 0,2 m. Las vesículas rotas también se observan en ambos paneles como resultado del daño al vacío y al haz de electrones.
Las vesículas nanoliposomas se han explorado como un sistema de encapsulación y administración de moléculas hidrófobas, incluyendo resveratrol (3,5,4'-trihidroxistilbeno), un compuesto bioactivo contra las células cancerosas colorrectales. El procedimiento de encapsulación puede superar la baja solubilidad de los compuestos lipofílicos, además de proporcionar biocompatibilidad, biodegradabilidad, no inmunogenicidad y características no toxicidadinherentes a las nanocápsulas liposófilas25. Las adaptaciones del protocolo deben tenerse en cuenta en función de la vía y el propósito de administración, como el desarrollo de nuevas formulaciones de liposomas para la administración oral.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores están agradecidos a las instalaciones de COPPE/UFRJ, Electronic Microscopy Laboratory y Multiuser Materials Characterization Laboratory; al Dr. Adalberto Vieyra, A la Dra. Jennifer Lowe y Rafael Lindoso, profesores de la Universidad Federal de Río de Janeiro, UFRJ, Brasil, para el uso de la ultracentrífuga; al Dr. Alexandre Guedes Torres y Daniel Perrone, profesores de la Universidad Federal de Río de Janeiro, UFRJ, Brasil, para el uso del evaporador rotatorio; al profesor Roland Bodmeier y al Dr. Andriy Dashevskiy de la Universidad Freie de Berlín, quienes ayudaron con los recursos, proporcionaron nuevas metodologías y supervisaron acNTF durante una beca Erasmus+ de 6 meses en Alemania; a la Dra. Rossana Thiré y Aline Fernandes, profesora y técnico de la Universidad Federal de Río de Janeiro, UFRJ, Brasil, para el uso de Zetasizer Malvern; a Bluma Guenther y Taissa Rodrigues, profesora y técnico de la Universidad Federal de Río de Janeiro, UFRJ, Brasil, para el uso del SEM; a la Dra. Rachel Ann Hauser Davis, investigadora de la Fundación Oswaldo Cruz, para su narración. Este estudio fue financiado en parte por la Coordenao de Aperfei-oamento de Pessoal de Nível Superior, Brasil (CAPES) - Código Financiero 001 (concesión No 1627392; 1811605); por la Fundación Carlos Chagas Filho de Amparo á Pesquisa do Estado do Rio de Janeiro (FAPERJ) (concesión No. E-26/202.815/2018; E-26/202.815/2018; E-26/203.039/2015 y E-26/202.860/2016); por Conselho Nacional de Desenvolvimento Científico y Tecnológico (CNPq) (concesión No 406601/2018-6), y Financiadora de Estudos e Projetos (FINEP).
Materiales
| Name | Company | Catalog Number | Comments |
| Ammonium Sulfate | Sigma-Aldrich Co | A4418 | |
| Analitycal Ballance Mettler H10Tw | Mettler Inc. | 417870 | |
| Beckman DU-640 Spectrophotometer | Beckman Coulter | 8043-30-1090 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich Co | 5470 | |
| BUCHI Rotavapor R-300 Rotary Evaporator with Controller and V-300 Pump | Thermo Fischer Scientific | 05-001-022PM | |
| CHEMS (cholesterylhemisuccinate) | Sigma-Aldrich Co | C6512 | |
| Chloroform | Sigma-Aldrich Co | 48520-U | CAUTION |
| Copper (II) Sulfate (Pentahydrate) | Sigma-Aldrich Co | 209198 | |
| Coverslips (13mm diameter) | Thermo Scientific Nunc | EW-01839-00 | |
| DOPE(1,2-dioleoyl-sn-glycerol-3-phosphoethanolamine) | Lipoid GMBH | 565600.1 | |
| Ethanol Absolute | Sigma-Aldrich Co | 32205 | |
| Folin -Ciocalteu phenol reagent | Sigma-Aldrich Co | F9252 | |
| Glutaraldehyde | Sigma-Aldrich Co | G5882 | |
| HEPES | Sigma-Aldrich Co | H3375 | |
| Hexamethyldisilazane (HMDS) | Sigma-Aldrich Co | 440191 | CAUTION |
| JEOL JSM-6460 LV Sacnning Electron Microscope | JEOL LTD | ||
| Mini Extruder 7 | Avanti Polar Lipids | 610000 | |
| MPEG 2000-DSPE 1,2-distearoyl-sn-glycero-3- phosphoethanolamine-N-[amino(polyethylene glycol)-2000] (ammonium salt) | Lipoid GMBH | 588200.1 | |
| Optima L-90k Ultracentrifuge | Beckman Coulter | PN LL-IM-12AB | |
| Phosphate Buffer | Sigma-Aldrich Co | P3619 | |
| Poli-L-lysine | Sigma-Aldrich Co | P8920 | |
| Potassium L-tartrate monobasic | Sigma-Aldrich Co | 243531 | |
| Sodium Carbonate | Sigma-Aldrich Co | S7795 | |
| Sodium chloride | Sigma-Aldrich Co | S7653 | |
| Sodium Deoxycholate (DOC) | Sigma-Aldrich Co | D6750 | |
| Sodium Dodecyl Sulfate | Sigma-Aldrich Co | L3771 | |
| Sodium Hydroxide | Sigma-Aldrich Co | S8045 | |
| Sodium phosphate dibasic anhydrous | Sigma-Aldrich Co | RES20908-A7 | |
| TESCAN VEGA 3 Scanning Electron Microscope | Tescan | #657874 | |
| Trichloroacetic Acid (TCA) | Sigma-Aldrich Co | 91230 | |
| Zetasizer Nano ZSP | Malvern Panalytical LTD | ||
| Ultrasonic cleaning bath model 2510 | Branson |
Referencias
- Wang, X., Wang, Y., Chen, Z. G., Shin, D. M. Advances of cancer therapy by nanotechnology. Cancer Research and Treatment: Official Journal of Korean Cancer Association. 41 (1), 1(2009).
- Keller, B. C. Liposomes in nutrition. Trends in Food Science & Technology. 12 (1), 25-31 (2001).
- Frézard, F., Schettini, D. A., Rocha, O. G., Demicheli, C. Lipossomas: propriedades físico-químicas e farmacológicas, aplicações na quimioterapia à base de antimônio. Quimica Nova. 28 (3), 511-518 (2005).
- Ferreira, D. dS., Lopes, S. C. dA., Franco, M. S., Oliveira, M. C. pH-sensitive liposomes for drug delivery in cancer treatment. Therapeutic Delivery. 4 (9), 1099-1123 (2013).
- Papachristos, A., Pippa, N., Ioannidis, K., Sivolapenko, G., Demetzos, C. Liposomal forms of anticancer agents beyond anthracyclines: present and future perspectives. Journal of Liposome Research. 25 (2), 166-173 (2015).
- Akbarzadeh, A., et al. Liposome: classification, preparation, and applications. Nanoscale Research Letters. 8 (1), 102(2013).
- Bangham, A., Standish, M. M., Watkins, J. C. Diffusion of univalent ions across the lamellae of swollen phospholipids. Journal of Molecular Biology. 13 (1), 238-252 (1965).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proceedings of the National Academy of Sciences of the United States of America. 75 (9), 4194-4198 (1978).
- Batzri, S., Korn, E. D. Single bilayer liposomes prepared without sonication. Biochimica et Biophysica Acta (BBA) - Biomembranes. 298 (4), 1015-1019 (1973).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid/detergent mixed micelles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 640 (1), 252-262 (1981).
- Szebeni, J., et al. Oxidation and denaturation of hemoglobin encapsulated in liposomes. Biochimica et Biophysica Acta (BBA) - General Subjects. 798 (1), 60-67 (1984).
- Coelho, J. F., et al. Drug delivery systems: Advanced technologies potentially applicable in personalized treatments. EPMA Journal. 1 (1), 164-209 (2010).
- Pereira, P. R., et al. Purification and characterization of the lectin from taro (Colocasia esculenta) and its effect on mouse splenocyte proliferation in vitro and in vivo. The Protein Journal. 33 (1), 92-99 (2014).
- Pereira, P. R., et al. Structural analysis and binding properties of isoforms of tarin, the GNA-related lectin from Colocasia esculenta. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1854 (1), 20-30 (2015).
- Pereira, P. R., et al. High-resolution crystal structures of Colocasia esculenta tarin lectin. Glycobiology. 27 (1), 50-56 (2016).
- Correa, A., Vericimo, M. A., Dashevskiy, A., Pereira, P. R., Paschoalin, V. M. F. Liposomal Taro Lectin Nanocapsules Control Human Glioblastoma and Mammary Adenocarcinoma Cell Proliferation. Molecules. 24 (3), 471(2019).
- Peterson, G. L., et al. A simplification of the protein assay method of Lowry et al. which is more generally applicable. Analytical Biochemistry. 83 (2), 346-356 (1977).
- Merida, L. A., et al. Tarin stimulates granulocyte growth in bone marrow cell cultures and minimizes immunosuppression by cyclo-phosphamide in mice. PLoS ONE. 13 (11), e0206240(2018).
- Murtey, M. D., Ramasamy, P. Sample Preparations for Scanning Electron Microscopy - Life Sciences. Modern Electron Microscopy in Physical and Life Sciences. Janecek, M., Kral, R. , InTechOpen. (2016).
- Andrade, C. A., Correia, M. T., Coelho, L. C., Nascimento, S. C., Santos-Magalhães, N. S. Antitumor activity of Cratylia mollis lectin encapsulated into liposomes. International Journal of Pharmaceutics. 278 (2), 435-445 (2004).
- dos Santos Ferreira, D., et al. Development of a bone-targeted pH-sensitive liposomal formulation containing doxorubicin: physicochemical characterization, cytotoxicity, and biodistribution evaluation in a mouse model of bone metastasis. International Journal of Nanomedicine. 11, 3737(2016).
- Pereira, P. R., Corrêa, A. C. N. T. F., Vericimo, M. A., Paschoalin, V. M. F. Tarin, a Potential Immunomodulator and COX-Inhibitor Lectin Found in Taro (Colocasia esculenta). Comprehensive Reviews in Food Science and Food Safety. 17 (4), 878-891 (2018).
- Olson, F., Hunt, C., Szoka, F., Vail, W., Papahadjopoulos, D. Preparation of liposomes of defined size distribution by extrusion through polycarbonate membranes. Biochimica et Biophysica Acta (BBA) - Biomembranes. 557 (1), 9-23 (1979).
- Mui, B., Chow, L., Hope, M. J. Extrusion technique to generate liposomes of defined size. Methods in Enzymology. 367, 3(2003).
- Soo, E., et al. Enhancing delivery and cytotoxicity of resveratrol through a dual nanoencapsulation approach. Journal of Colloid and Interface Science. 462, 368-374 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados