Method Article
Подготовка и характеристика нанолипосомы для захвата биоактивных гидрофильных глобулярных белков
В этой статье
Резюме
Это исследование описывает классическую гидратацию с использованием тонкого метода липидной пленки для нанолипосомного препарата с последующей характеристикой наночастиц. 47 kDa-гидрофильных и шаровых белков, тарин, успешно инкапсулируется как стратегия для улучшения стабильности, избежать быстрого оформления, и способствовать контролируемому освобождению. Метод может быть адаптирован к инкапсуляции гидрофобных молекул.
Аннотация
Липосомы нанокапсулы были применены для многих целей в фармацевтической, косметической и пищевой промышленности. Атрибуты липосом включают их биосовместимость, биоразлагаемость, неиммуногенность, нетоксичность и способность заманивать как гидрофильные, так и гидрофобные соединения. Классическая гидратация тонких липидных пленок в органическом растворителе применяется в данном документе в качестве метода инкапсулирования тарина, растительного лектомного, в нанолипосомы. Нанолипосомного размера, стабильности, эффективности захвата и морфологической характеристики описаны в деталях. Нанолипосомы готовятся с использованием 1,2-диолеой-сн-глицерол-3-фосфоэтаноламин (DOPE), 1,2-дистеэроил-сн-глицеро-3-фосфоэтаноламин-N-амино (полиэтилен гликоль)-2000" (амммонная соляная) (амммонная соляная) (аммоновый соляной; DSPE-MPEG 2000) и холестерилхемисуцинат (CHEMS) в качестве основных составляющих. Липиды сначала растворяются в хлороформе, чтобы получить тонкую липидную пленку, которая впоследствии регидратируется в растворе сульфата аммония, содержащем белок, который будет захвачен и инкубирован на ночь. Затем, sonication и экструзии методы применяются для создания наноразмерных unilamellar пузырьков. Индекс размера и полиписперсии нановезиклов определяется динамическим рассеянием света, в то время как морфология нановсикулов оценивается с помощью сканирующей электронной микроскопии. Эффективность захвата определяется соотношением количества неинкапсулированного белка к первоначальному количеству первоначально загруженного белка. Однородные липосомы получаются со средним размером 155 нм и значением индекса полидисперсности 0,168. Достигается высокая эффективность захвата в 83%.
Введение
В последние годы возросло число исследований, посвященных эффективным системам доставки лекарств. Однако такие ограничения, как быстрое расчистка, плохое биораспределение и растворимость при физиологическом рН и недостаточное клеточное поглощение, все еще должны быть преодолены. Использование наносистем стало недавний прогресс в терапии рака, применяется для увеличения внутриклеточной концентрации наркотиков внутри раковых клеток при минимизации токсичности в здоровых клетках. Кроме того, наночастицы, полученные из различных материалов (например, полимеров, дендримеров, липосом, вирусов, углеродных нанотрубок и металлов, таких как оксид железа и золото), в настоящее время применяются для усиления противораковых эффектов и снижения системных токсичность1. Липосомы нанокапсулы, в частности, были применены для многих целей в фармацевтической, косметической и пищевой промышленности. В последние годы различные нутрицевтические продукты, такие как витамины, ферменты и растительные экстракты были разработаны с использованием липосомного технологии2.
Липосомы являются сферические пузырьки, состоящие из одного или нескольких концентрических липидных двухслойных спонтанно формируется дисперсии фосфолипидов в водном носителе3,4. Полярные головки фосфолипидов расположены на наружной и внутренней поверхностях мембран, в контакте с водной средой. В отличие от этого, цепи жирных кислот образуют гидрофобное ядро мембран и защищены от воды5. Некоторые атрибуты липосомы, которые делают их привлекательными системдоставки наркотиков включают их биосовместимость, биоразлагаемость, неиммуногенность, нетоксичность, и способность заманить как гидрофильные и гидрофобные соединения6.
Липосомы могут быть подготовлены с помощью различных процессов, таких как возбуждение, звукование, экструзия, лиофилизация, замораживание и оттаивание. Классические методы включают обратное испарение фазы, инъекцию растворителя и диализ моющего средства. Наиболее прикладным методом является тонкая гидратация липидной пленки, также известный как метод Бангама, который используется для получения везикулярно-липидных форм7,8,9,10,11. Ламелларитность (количество фосфолипидных двуслой) и размер частиц являются классическими параметрами, используемыми для характеристики липосом как 1) униламеллярных пузырьков (ULVs), образованных уникальным флосфолипидным двуслойным и меняющимся по размеру следующим образом: i) небольшой униламеллар vesicles (SUVs, 0.02-0.20 мкм), ii) большие unilamellar пузырьки (LUVs, 0,2-1,0 мкм), и iii) гигантские unilamellar пузырьки (GUVs, или 2) мультиламеллярные пузырьки (MLVs, 0,1 мкм)3,12. Размер Vesicle является важным параметром при рассмотрении для терапевтического использования, например, в лечении рака, в котором размеры lt;200 нм идеально подходят, чтобы позволить нановезики пересечь эндотелиальный барьер и достичь опухолевых тканей4.
При этом, инкапсуляция процедура после классической гидратации тонкой липидной пленки техника7 была описана с использованием тарина, лектин растений характеризуется как гидрофильный шаровой белок13,14,15 . Наноразмерные пузырьки производятся путем включения звуковой и экструзионной ступеней в основной технике, в результате чего стабильные липосомальные нановезики с высокой эффективностью захвата16.
протокол
1. Приготовление тариновых липосомальных нанокапсул16
ПРИМЕЧАНИЕ: Все препараты должны быть подготовлены в тройном для того, чтобы получить больший объем (7 мл) и позволить образец быть центрифуги в ультрацентрифуге (см. подробности ниже).
- Взвесьте липосомы, используя аналитический баланс, как показано в таблице 1.
- Растворите липидные компоненты в хлороформе с помощью объемной колбы объемом 250 мл, которая помещается в роторный испаритель, чтобы избежать потери материала.
- Перемешать смесь при 150 об/мин в течение 15 мин.
- Удалите хлороформ с помощью роторного испарителя при следующих условиях:
- Отрегулируйте рот объемной колбы до стандартного положения (25 ") для оптимальной эффективности, при контакте с водой из отопительной ванны.
ПРИМЕЧАНИЕ: Рука оборудования должна быть наклонена на 25 "для поддержания контакта между объемной колбой и водяной баной, не влияя на эффективность испарения или повреждения образца. Стандартная позиция может варьироваться в зависимости от марки оборудования. - Установите температуру конденсатора до минимума 3 градусов по Цельсию.
- Установите температуру обогрева ванны до 40 и 1 градусов по Цельсию.
- Установите вращение до 120 об/мин.
- Отрегулируйте вакуум до 207 мбар и точки кипения до 20 градусов по Цельсию.
- После 25 мин, удалить колбу и отбросить испаряется растворитель, оставаясь в конденсаторе, надлежащим образом.
ПРИМЕЧАНИЕ: Тонкая и непрозрачная пленка, состоящая из липосомного компонента, образуется в этом шаге и может быть легко визуализирована. Испаряемый растворитель, оставшийся в конденсаторе, должен храниться в получателях утилизации (хлорированных), которые должны обрабатываться специализированной компанией для соответствующего отбрасывания.
- Отрегулируйте рот объемной колбы до стандартного положения (25 ") для оптимальной эффективности, при контакте с водой из отопительной ванны.
- Увлажнять липидную пленку, чтобы достичь концентрации липидов 0,01 М в растворе сульфата аммония 0,3 М (рН No 7,4), содержащего тарин при 1 мг/мл до конечного объема 10 мл.
- Перемешать смесь в течение 40 минут и инкубировать на ночь при 4 градусах Цельсия.
ПРИМЕЧАНИЕ: Этот шаг можно считать стоп-пойнтом. Ночная инкубация не является обязательной.
- Перемешать смесь в течение 40 минут и инкубировать на ночь при 4 градусах Цельсия.
- После инкубации, sonicate подвески в течение 1 мин при температуре 25 градусов по Цельсию (комнатная температура; RT) уменьшить размер везикулы и избежать агрегации.
ПРИМЕЧАНИЕ: Уменьшение размера было выполнено в ультразвуковом звуковом элементе при следующих условиях: 130 Вт и 40 кГц. - Выполните 12-циклэксион через 0,2 мкм поликарбонатной поры мембраны.
ПРИМЕЧАНИЕ: Перед процессом экструзии, проверьте мини-экструдер сборки с использованием воды, чтобы избежать утечки образца. Мембрана пор0,1 мкм также подходит. В этом случае предварительно разогревайте держатель мини-экструдера выше температуры перехода липидов для облегчения экструзии, сохраняя при этом физикохимические характеристики как липидов, так и белков.- Подходит части мини экструдера, как описано в руководстве производителя.
- Поместите поликарбонатную мембрану между двумя предмокрыми опорами фильтра и поместите ее в держатель.
- Вставьте в устройство пустой шприц объемом 1 мл, заполните другой шприц до его общего объема липосомальной подвеской и вставьте его на противоположную сторону.
- Выполните 12-циклэксион через 0,2 мкм поликарбонатной поры мембраны. Медленно нажимайте образец с одного шприца на другой. Соберите экструдированную подвеску в предварительно охлажденный трубку.
ПРИМЕЧАНИЕ: Поликарбонатная мембрана должна быть заменена только тогда, когда перенос образца из одного шприца в другой становится трудно. Липосомальная суспензия должна стать ясной в процессе экструзии в результате уменьшения размера из-за образования внедорожников. Около 0,2 мл образца может быть потеряно во время этого шага.
- Отделить липосомы от ультрацентрифугации.
ПРИМЕЧАНИЕ: Поддерживайте образцы в ледяной ванне до тех пор, пока ультрацентрифуга не будет готова к использованию. Отделить внедорожники от остальных компонентов и сульфат аммония с помощью ультрацентрифуги с ротором скач-ковш (см. подробности ниже).- Взвесьте образец в титановой трубке, которая подходит ротору и уравновешить трубки. Проверьте минимальный объем, необходимый в соответствии с ротором, используемым, чтобы избежать повреждения труб, и настроить липосомальный объем подвески с сульфатом аммония, если это необходимо.
ПРИМЕЧАНИЕ: качели ведро всегда должны быть поддержаны на стенде, когда за пределами центрифуги, чтобы избежать царапин "зебра полосы" (т.е. черно-белые полосы на дне), которые используются центрифуги для определения скорости вращения. - Включите вакуум перед использованием центрифуги, чтобы позволить ему хранить в холодильнике.
- Приготовь титановые трубки в ведра качели.
ПРИМЕЧАНИЕ: Поднимите трубки в положение, которое они предполагают при запуске, чтобы убедиться, что они идеально приспособлены. - Отпустите вакуум, откройте дверь центрифуги и поместите ротор внутрь.
ПРИМЕЧАНИЕ: Обратите внимание на отметку круга в нижней части ротора, которая должна поместиться в противоположном направлении того же знака круга в саму центрифугу. - Закройте дверь центрифуги, нажмите Вакуум и подождите, пока вакуум не достигнет от 200 до 20 микрон или от 26 Па до Злт;3 Па.
- Отрегулируйте параметры в ультрацентрифуге дисплея до 150 000 х г (эквивалент 29 600 об/мин для вышеупомянутого ведра качели) на 90 мин при 4 кв.с (ускорение: макс, замедление: макс).
ПРИМЕЧАНИЕ: Всегда конвертировать скорость х г, если конкретные центрифуга установлена в об/ и с поторопинки. Используйте веб-сайт центрифуги для преобразования устройства в соответствии с ротором используется. - Напомним, проверьте условия, и нажмите Начало запуска.
ПРИМЕЧАНИЕ: Подождите, пока центрифуга не достигнет желаемой скорости. - После 90 минут, отпустите вакуум, нажав кнопку вакуума и открыть дверь центрифуги, когда вакуум достигает 200-700 микрон (эквивалент 26-93 Pa).
- Выключите центрифугу, снимите ротор изнутри и оставьте его на скамейке с ведрами, чтобы высохнуть.
- Поддерживайте ультрацентрифугные образцы на льду.
- Взвесьте образец в титановой трубке, которая подходит ротору и уравновешить трубки. Проверьте минимальный объем, необходимый в соответствии с ротором, используемым, чтобы избежать повреждения труб, и настроить липосомальный объем подвески с сульфатом аммония, если это необходимо.
- Осторожно, отделите супернатант от гранул, превратив трубку вверх дном в одноразовую центрифугу 15 мл, чтобы отделить супернатант и гранулы.
ПРИМЕЧАНИЕ: Храните супернатант, содержащий неинкапсулированный белок при 4 градусах Цельсия. Он будет использоваться для определения эффективности инкапсуляции. Гранулы предстает в виде полупрозрачного желе. - Приостановить гранулы, содержащие инкапсулированный белок в HEPES буферного сольения (3 мл 1x HBS).
ПРИМЕЧАНИЕ: HBS 2x (акционерное решение) готовится путем разбавления следующих количеств реагентов в дистиллированной воде: 140 мМ NaCl, 1,5 мм Na2HPO4, 50 мМ HEPES, затем регулировка рН до 7,4 и окончательный объем до 100 мл. Na2HPO4 может быть заменен NaHCO3или опущен, чтобы избежать вмешательства, если липосомомного концентрация должна быть определена. Раствор hBS 2x бульон ассоциированный должен быть разбавлен в дистиллированной воде для получения HBS 1x перед использованием.
2. Эффективность инкапсуляции
ПРИМЕЧАНИЕ: Определите эффективность инкапсуляции с помощью протокола Петерсона17,чтобы избежать вмешательства липидов в количественную оценку белка. Все образцы (стандарты BSA и липосомы супернатант) должны быть проанализированы в тройном. Также подготовьте пустую трубку.
- Подготовка биржевых реагентов и рабочих решений17
- Для стоковых реагентов подготовьте медно-тартратно-карбонат (КТК) путем смешивания 10 мл 20% карбоната натрия, 200 л 0,1% сульфата меди, 200 л 0,2% калия тартрат с 9,6 мл дистиллированной воды. Приготовьте 100 мл 10% сульфата натрия (SDS) и 0,8 N гидроксида натрия (NaOH).
- Для рабочих решений приготовьте 10 мл дезоксихолата натрия (DOC) и 72% трихлороацетической кислоты (ТЦА). Растворите 10 мг крупного сыворотки альбумина (BSA) в 10 мл дистиллированной воды, чтобы получить стандартное раствор 1 мг/мл. Подготовка реагента А, добавив равные части CTC, NaOH, SDS, и H2O. Подготовка реагента B путем разбавления Фолин-Ciocalteu фенол реагент 1:5 в дистиллированной воде.
ПРИМЕЧАНИЕ: Реагент А требует 1 мл для каждой реакционной трубки, в то время как реагент B требует 0,5 мл. Для определения окончательных объемов реагентов А и В сначала определите количество реакционных трубок, которые будут использоваться, учитывая три различные концентрации BSA, пустые и образцы в тройном. Реагент А должен быть хорошо гомогенизирован перед использованием и может храниться при 25 градусах Цельсия (RT) в течение 2 недель. Реагент B также стабилен при 25 градусах Цельсия (RT), если он хранится в янтарной бутылке.
- Осадков
ПРИМЕЧАНИЕ: Этот шаг выполняется в микроцентрифуговых трубках.- Разбавить липосомы супернатант водой до конечного объема 1 мл, содержащего 5-100 мкг белка.
ПРИМЕЧАНИЕ: Пустая трубка должна быть заполнена 1 мл дистиллированной воды. - Добавьте 0,1 мл 0,15% DOC, гомогенизируют вихрем и инкубируют в течение 10 минут на RT.
- Добавьте 0,1 мл 72% TCA, хорошо перемешайте и центрифугу на 3000 х г и RT в течение 15 минут.
ПРИМЕЧАНИЕ: DOC-TCA способствует протеиновые осадки, образуя две различные фазы. Целевой белок может быть восстановлен путем центрифугирования, избегая липидных помех. - Тщательно отбросьте супернатант, повернув трубку вниз и уложив ее на абсорбирующую бумагу. Сохраните гранулы для последующего шага.
ПРИМЕЧАНИЕ: Гранулы может быть очень трудно увидеть, но трубка должна быть перевернута вверх дном, даже если она не видна.
- Разбавить липосомы супернатант водой до конечного объема 1 мл, содержащего 5-100 мкг белка.
- Спектрофотометрии
- Приостановить гранулы, полученные от шага 2.2.4 в 1 мл дистиллированной воды. Тщательно перемешайте, чтобы убедиться, что гранулы растворяются и перенесите образец в новую пробирку.
- Приготовьте разбавления стандартов альбумина (BSA) до окончательного объема 1 мл.
ПРИМЕЧАНИЕ: Белковые стандарты должны быть подготовлены между 5-100 мкг/мл. - Добавьте 1 мл реагента А в трубки со ступени 2.3.1 и 2.3.2 без исключения, хорошо перемешайте и инкубируйте в течение 10 минут на RT.
ПРИМЕЧАНИЕ: SDS может облегчить возможные липидные вмешательства при оказании помощи в растворительизации белка. - Добавьте 0,5 мл реагента B в трубки со ступени 2.3.1 и 2.3.2, хорошо перемешайте и инкубируйте в течение 30 минут на РТ, защищаясь от света.
ПРИМЕЧАНИЕ: Фоллин-Ciocalteu фенол реагент представляет собой смесь фосфофлибдата и фосфотунгстата, используемого для колористовых анализов некоторых азотсодержащих соединений, таких как белки. Медный комплекс увеличивает реактивность фенолов к этому реагенту, производя синий/фиолетовый комплекс в соответствии с концентрацией белка. - Определите абсорбцию на уровне 750 нм с помощью спектрофотометра.
- Рассчитайте концентрацию белка в супернатанте на основе стандартной кривой следующим образом.
- Значение абсорбции участка (Abs) против концентрации BSA (мг/мл) для получения углового коэффициента (k) с учетом линейной линии тенденции.
- Определите сверхнатальнуюконцентрацию белка (C ) по соотношению между значением абсорбции и угловым коэффициентом (k), затем умножайте на общий объем следующим образом:
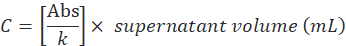
- Определить эффективность инкапсуляции по следующей формуле:
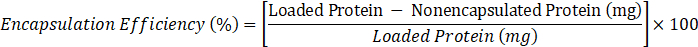
- где заряженный белок - 10 мг, неэнкапсулированный белок - значение С, полученное в шаге 2.3.6.2.
ПРИМЕЧАНИЕ: В этом случае, в общей сложности 10 мг тарина, растворенного в растворе сульфата аммония (1 мг/мл) используется для выполнения процедуры инкапсуляции, так как эта концентрация достаточна для получения удовлетворительных эффектов в пробирке13,16, 18.
3. Определение размера и стабильности
ПРИМЕЧАНИЕ: Индекс распределения размеров и полидспертность (PdI) липосомальных препаратов оценивается динамическим рассеянием света (DLS). PdI близко к 0.1 указывает на однородную подготовку. Для определения стабильности, хранить липосомы при 4 градусах Цельсия и регулярно проверять распределение размера и средний размер.
- Включите оборудование DLS за 30 минут до использования для разогрева лазерной лампы.
- Перенесите липосомальный препарат, полученный в шаге 1.10, в одноразовый размер cuvette.
- Установить параметры оборудования следующим образом: разослатель типа - вода (RI No 1.33); материал - липиды (РИ No 1,45); и RT.
- Нажмите на начало и подождите, пока оборудование закончит чтение.
- Снимите квет и выключите оборудование.
ПРИМЕЧАНИЕ: Либо перенести образец из кювета обратно в одноразовую 15 мл центрифуги трубки для последующего анализа, или отбросить его, если есть достаточное количество для новых читает.
4. Морфологические характеристики
ПРИМЕЧАНИЕ: Липосомы характеристика выполняется в соответствии с Муртей и Ramasamy19. Образцы, содержащие нанолипосомы, полученные в шаге 1.10, готовятся в тройном.
- Закрепите стеклянные крышки (диаметром 13 мм) на дне чашки Петри с помощью двусторонней ленты. Разрежьте ленту на мелкие кусочки (соответствующий размер, чтобы зафиксировать крышки), удалите защитную бумагу под ним и зафиксите ее на дне чашки Петри. С помощью пинцета, удалить защитную бумагу на верхней части ленты и зафиксировать крышки на нем.
ПРИМЕЧАНИЕ: Будьте осторожны в следующих шагах, чтобы не выпускать крышки, и использовать сильную ленту. - Пальто крышки с поли-L-лизин. Поместите влажные фильтрованные бумаги внутри чашки Петри для поддержания влаги и инкубировать в течение 1 ч на RT (25 градусов по Цельсию).
- После покрытия промойте крышки дистиллированной водой.
- Заполните крышки с каплей образца от шага 1.10 и дайте им высохнуть в течение 1 ч на RT.
- Чтобы исправить образцы, накройте их 4% глютаральдегидом, приготовленным в буфере фосфатов 0,1 м, рН 7,2. Поместите влажные фильтрованные бумаги внутри чашки Петри и запечатайте блюдо для поддержания уровня влаги. Инкубировать при 4 градусах по Цельсию на 48 ч.
- Промыть крышки 3x в течение 5 минут с тем же фосфатным буфером.
- Обезвоживание образцов следующим образом: 35% этанола 1x на 15 мин, 50% этанол 1x на 15 мин, 75% этанол 1x на 15 мин, 95% этанола 2x на 15 мин, и абсолютный этанол 3x на 20 мин.
- Химически высушите образцы путем погружения 2x в 1'2 мл гексаметилдизилаза (HMDS) в течение 10 мин.
ПРИМЕЧАНИЕ: HMDS следует тщательно манипулировать внутри дыма капот. Образцы должны быть разрешены для высыхания на ночь внутри сушилки или внутри дыма капот на RT. - Смонтировать высушенные образцы на заглушку с углеродной проводящей клейкой лентой.
- Распылите поверхность крышки в вакууме с электрически проводящим слоем (20 нм толщиной) золотистого палладия.
- Запись изображений с помощью сканирующего электронного микроскопа (SEM) в режиме низкого вакуума и низкого напряжения (20 кВ).
Результаты
Рисунок 1 описывает нанолипосому препарат16,20,21. Фосфолипиды, 1,2-диолеоил-сн-глицерол-3-фосфоэтаноламин (ДОПЕ), 1,2-дистеароил-сн-глицеро-3-фосфоэтаноламин-Н-амино (полиэтиленгликоль)-2000" (аммонийсоль; DSPE-MPEG 2000) и холестерилхемисуцинат (CHEMS), основные составляющие липосомы, были впервые растворены в хлороформе для получения липидной пленки. Липидная пленка затем была регидратирована в раствор сульфата аммония, содержащий гидрофильный белок (тарин), который был захвачен, и инкубация была выполнена в одночасье. Затем, sonication и экструзии методы были применены для создания небольших unilamellar пузырьков. Ультрацентррифегация шаг отделил липосомальный препарат от свободных липидов и неинкапсуляенных белков, в то время как супернатант был использован для определения эффективности захвата.
Нанолипосомы, произведенные с использованием вышеупомянутой методологии, продемонстрировали распределение размеров в диапазоне от 51–396 нм и средний размер 155 нм(таблица 2). Препарат был однородным, так как индекс полидисперсности составлял 0,168. Высокая эффективность захвата 83% может быть достигнута, если липосомы выдавливается через 0,2 мкм пор размер мембраны (Таблица 2).
Морфологические нанолипосомы характеристики были оценены SEM. Рисунок 2A,B отображает круглую форму липосомного пузырьков в диапазоне 121 нм и анализируется на 20 кВ, в то время как рисунок 2C,D отображает недостаточно подготовлены Образцы. Нанолипосомы были просто высушены воздухом без предыдущей фиксации или любого другого лечения, описанного в этом исследовании. В результате наблюдались более крупные и поврежденные пузырьки в диапазоне 332 мкм и проанализированы при 5 кВ.
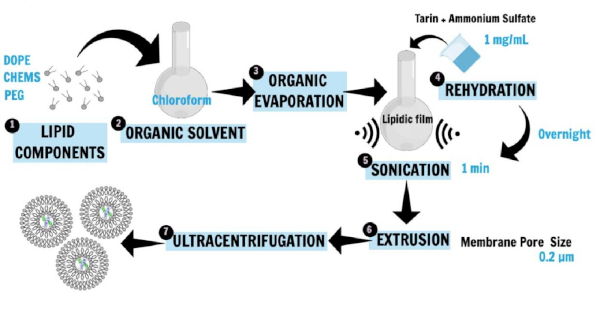
Рисунок 1: Схематическое представление нанолипосома. DOPE, PEG, и CHEMS, основные составляющие липосомы, были впервые растворены в хлороформ для получения липидной пленки(1, 2, 3). Липидная пленка затем регидратировалась в соленом буфер, содержащий гидрофильный белок (тарин), который будет захвачен, и инкубация была выполнена в одночасье (4). Затем, sonication и экструзии методы были применены для создания внедорожников (5, 6). Ультрацентррифифационный шаг отделил липосомальный препарат от свободных липидов и неинкапсуляемого белка, в то время как супернатант был использован для определения эффективности захвата (7). Эта цифра была изменена с Корреа и др.16. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Нанолипосомного фотомикроскопия SEM. (A, B) Изображения круглых липосомальных пузырьков в диапазоне 121 нм и проанализированы при 20 кВ. (C,D) Изображения недостаточно подготовленных образцов. Неправильные образцы допускают наблюдение за более крупными и/или поврежденными пузырьками, которые не могут противостоять вакуумным и/или напряжениям при 5 кВ. Эта цифра была изменена с Корреа и др.16. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Липосомы компоненты | Вес (г) | Концентрация (мМ) | Окончательный том |
| Наркотики | 0.0420 | 5.7 | 10 мл |
| MPEG 2000-DSPE | 0.1059 | 3.8 | |
| Таблетки | 0.0024 | 0.5 |
DOPE - 1,2-диолеоил-сн-глицерол-3-фосфоэтаноламин); MPEG 2000-DSPE - 1,2-дистеэроил-сн-глицеро-3-фосфоэтаноламин-Н-амино (полиэтиленгликоль)-2000 " (аммониевая соль); ЧЕМС - холестерилхемисуцинат.
Таблица 1: Приготовление тариновых липосомальных нанокапсул.
| Размер мембранной поры (мкм) | Распределение размера (nm) | Средний размер (нм) | Индекс полидисперсности (PdI) | Пик (нм) | Эффективность захвата |
| 0.2 | 51 - 396 | 155 | 0. 168 | 94 х 39 | 0.83 |
Индекс размера и полидисперсности оценивался по динамическому рассеянию света, в то время как эффективность инкапсуляции определялась в соответствии с Peterson17.
Таблица 2: Размер, индекс полидисперсности и эффективность захвата нанолипосом.
Обсуждение
Протокол, описанный здесь, был протестирован Correa et al.16 для инкапсулировать тарин, иммуномодулирующий и противоопухолевый лектин, очищенный от Колокасии esculenta22. Методология дала успешные результаты, что позволило выработать стабильные нанолипосомы соответствующего размера для терапевтического применения. Формула представляет контролируемое высвобождение на различных уровнях рН в физиологических условиях. Он также потенцирует тарин фармакологические свойства, такие как ингибирование глиобластомы человека U-87 MG и рака молочной железы MDA-MB-231 клеточные линии и стимуляции клеток костного мозга мышей. Липосомальный препарат не проявлял токсического воздействия в здоровых клетках мышей16.
Классический метод, впервые описанныйBangham et al. 7, позволяет выравливать крупные многоламеллярные липосомы пузырьков, неоднородные по размеру и форме. Адаптация этого метода, как сообщается в настоящем исследовании, успешно применяется путем включения дополнительных шагов, таких как соникация и экструзия через 0,2 мкм поликарбонатной мембраны. Это позволяет вывести более однородную дисперсию относительно размера в диапазоне нанометров16,23,24. Поэтому для обеспечения успешных результатов следует строго соблюдать описанный здесь протокол инкапсуляции и липосомную формулировку.
Нанолипосомы композиция была тщательно отобрана для того, чтобы обеспечить образование двухслойной мембраны с DOPE, MPEG 2000-DSPE и CHEMS в качестве основных компонентов. Это естественные компоненты мембраны животных, и последние могут придать текучесть нанолипосомой архитектуры, обеспечивая широкое применение для биологической доставки соединений у человека.
Нанолипосомы pegylation имеет важное значение для обеспечения стабильности липосомы структуры. Отсутствие ПЭГ приводит к увеличению размера, высокому индексу полидисперсности и низкой эффективности захвата. Оптимальные результаты могут быть получены с DOPE в качестве основного компонента липосомы. Однако это дорогостоящий фосфолипид. Финансовые затраты на производство нанолипосом могут быть достигнуты путем замены DOPE другими аналогичными липидами, такими как DOPC (1,2-диолеил-сн-глицеро-3-фосфохолин). CHEMS является молекула холестерина, естественно, в клетках животных мембран, которые не должны быть исключены из формулировки, так как важно обеспечить липидной двухслойной текучести и податливости16.
Другие аспекты протокола инкапсуляции также могут быть адаптированы. Хлороформ, используемый для растворения липосомных компонентов, может быть легко заменен метанолом без каких-либо последствий для среднего размера, однородности и эффективности захвата. Тем не менее, некоторые утечки белка может произойти при хранении под 4 КК16. Ночной инкубационный шаг с раствором сульфата аммония, содержащим тарин, не является обязательным; однако, для удобства это может быть выполнено без ущерба для нанолипосомальных биофизических характеристик, инкапсуляции или потери эффективности стабильности, как показано на Correa et al.16. Шаг экструзии выполняется при комнатной температуре, которая может уменьшить скорость потока между шприцев, если 0,1 мкм размер мембраны размера.
Для преодоления этой проблемы следует рассмотреть вопрос об использовании мембраны размером 0,2 мкм или нагревательного держателя экструдера над температурой перехода липидов. Аналитик должен быть осторожным, чтобы не повредить липиды или белок, которые могут быть инактивированы и потерять биологическую активность. Кроме того, липосомный препарат можно диализать против HBS вместо ультрацентрифугации, используя отсеченную мембрану в соответствии с молекулярным весом белка. Выбор химического характера буфера, в котором нанолипосомы приостанавливаются после ультрацентрифугации, напрямую связан с его последующим применением. Поскольку перспективы этого исследования включают in vivo и in vitro анализы, подвеска в HEPES буферного соливого раствора была адекватной для обеспечения никаких цитотоксических эффектов и диапазона рН, близкого к физиологическим условиям.
Липосомы должны быть мелко обработаны, подобно живым клеткам, чтобы получить более высокое качество SEM изображений. Процедуры фиксации и сушки важны для обеспечения визуализации более мелких неповрежденных пузырьков, поддерживающих значения выше 20 кВ в вакуумных условиях. Рисунок 2 A,B отображает наноразмерные пузырьки, совместимые с процедурой экструзии. Визуализация пузырьков в диапазоне от 51-396 нм возможна при надлежащей подготовке образца после этой процедуры. Шаги включают фиксацию, сушку путем увеличения концентрации этанола, и химическое обезвоживание, чтобы избежать образования агрегатов и разрыв пузырьков, вызванных вакуумным и электронным лучом. С другой стороны, на рисунке 2C,D показаны липосомы пузырьки, высушенные при комнатной температуре и не подвергшиеся описанному здесь лечению, что означает, что они были подготовлены неадекватно. В результате неадекватной процедуры образуются гигантские пузырьки даже после экструзии через мембрану размера поры 0,2 мкм. Разорванные пузырьки также наблюдаются в обеих панелях в результате повреждения вакуумного и электронного луча.
Нанолипосомы пузырьки были изучены в качестве инкапсуляции и доставки системы гидрофобных молекул, в том числе ресвератрол (3,5,4'-trihydroxystilbene), биоактивное соединение против колоректальных раковых клеток. Процедура инкапсуляции может преодолеть плохую растворимость липофильных соединений в дополнение к обеспечению биосовместимости, биоразлагаемости, неиммуногенности и нетоксичности характеристик, присущих липосоме нанокапсул25. Адаптация протокола должна приниматься во внимание в зависимости от маршрута и цели администрирования, таких, как разработка новых липосомформул для устного администрирования.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы благодарны COPPE/UFRJ, Лаборатории электронной микроскопии и лаборатории характеристик многопользовательских материалов; д-ру Адальберто Вьера, д-ру Дженнифер Лоу и Рафаэль Линдозу, профессора Федерального университета в Рио-де- д-ру Александру Гедесу Торресу и Даниэлю Перроне, профессорам Федерального университета в Рио-де- профессору Роланду Бодмайеру и д-ру Андрею Дашевскому из Университета Фрейе в Берлине, которые помогали с ресурсами, предоставляли новые методологии и руководили ACNTF в течение 6-месячного стипендий Erasmus в Германии; д-ру Россане Тире и Алине Фернандес, профессором и техником Федерального университета в Рио-де- Блума Гюнтер и Таисса Родригес, профессор и техник федерального университета в Рио-де- д-р Рейчел Энн Хаузер Дэвис, исследователь в Фандао Освальдо Крус, для повествования. Это исследование было частично профинансировано Корденаньо де Аперфейсоаменто де Пессоаль де Невель-Верховный, Бразилия (КАПЕС) - Финансовый кодекс 001 (грант No 1627392; 1811605); По Фандао Карлос Шагас Филью де Ампаро и Пескиса-ду-Эстадо-де-Рио-де- Е-26/202.815/2018; Е-26/202.815/2018; Е-26/203.039/2015 и Е-26/202.860/2016); Конселхо Насьональ де Десенволвименто Чиентифико электронной Tecnol'gico (cnPq) (грант No 406601/2018-6), и Financiadora де Эстудиос е Projetos (FINEP).
Материалы
| Name | Company | Catalog Number | Comments |
| Ammonium Sulfate | Sigma-Aldrich Co | A4418 | |
| Analitycal Ballance Mettler H10Tw | Mettler Inc. | 417870 | |
| Beckman DU-640 Spectrophotometer | Beckman Coulter | 8043-30-1090 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich Co | 5470 | |
| BUCHI Rotavapor R-300 Rotary Evaporator with Controller and V-300 Pump | Thermo Fischer Scientific | 05-001-022PM | |
| CHEMS (cholesterylhemisuccinate) | Sigma-Aldrich Co | C6512 | |
| Chloroform | Sigma-Aldrich Co | 48520-U | CAUTION |
| Copper (II) Sulfate (Pentahydrate) | Sigma-Aldrich Co | 209198 | |
| Coverslips (13mm diameter) | Thermo Scientific Nunc | EW-01839-00 | |
| DOPE(1,2-dioleoyl-sn-glycerol-3-phosphoethanolamine) | Lipoid GMBH | 565600.1 | |
| Ethanol Absolute | Sigma-Aldrich Co | 32205 | |
| Folin -Ciocalteu phenol reagent | Sigma-Aldrich Co | F9252 | |
| Glutaraldehyde | Sigma-Aldrich Co | G5882 | |
| HEPES | Sigma-Aldrich Co | H3375 | |
| Hexamethyldisilazane (HMDS) | Sigma-Aldrich Co | 440191 | CAUTION |
| JEOL JSM-6460 LV Sacnning Electron Microscope | JEOL LTD | ||
| Mini Extruder 7 | Avanti Polar Lipids | 610000 | |
| MPEG 2000-DSPE 1,2-distearoyl-sn-glycero-3- phosphoethanolamine-N-[amino(polyethylene glycol)-2000] (ammonium salt) | Lipoid GMBH | 588200.1 | |
| Optima L-90k Ultracentrifuge | Beckman Coulter | PN LL-IM-12AB | |
| Phosphate Buffer | Sigma-Aldrich Co | P3619 | |
| Poli-L-lysine | Sigma-Aldrich Co | P8920 | |
| Potassium L-tartrate monobasic | Sigma-Aldrich Co | 243531 | |
| Sodium Carbonate | Sigma-Aldrich Co | S7795 | |
| Sodium chloride | Sigma-Aldrich Co | S7653 | |
| Sodium Deoxycholate (DOC) | Sigma-Aldrich Co | D6750 | |
| Sodium Dodecyl Sulfate | Sigma-Aldrich Co | L3771 | |
| Sodium Hydroxide | Sigma-Aldrich Co | S8045 | |
| Sodium phosphate dibasic anhydrous | Sigma-Aldrich Co | RES20908-A7 | |
| TESCAN VEGA 3 Scanning Electron Microscope | Tescan | #657874 | |
| Trichloroacetic Acid (TCA) | Sigma-Aldrich Co | 91230 | |
| Zetasizer Nano ZSP | Malvern Panalytical LTD | ||
| Ultrasonic cleaning bath model 2510 | Branson |
Ссылки
- Wang, X., Wang, Y., Chen, Z. G., Shin, D. M. Advances of cancer therapy by nanotechnology. Cancer Research and Treatment: Official Journal of Korean Cancer Association. 41 (1), 1(2009).
- Keller, B. C. Liposomes in nutrition. Trends in Food Science & Technology. 12 (1), 25-31 (2001).
- Frézard, F., Schettini, D. A., Rocha, O. G., Demicheli, C. Lipossomas: propriedades físico-químicas e farmacológicas, aplicações na quimioterapia à base de antimônio. Quimica Nova. 28 (3), 511-518 (2005).
- Ferreira, D. dS., Lopes, S. C. dA., Franco, M. S., Oliveira, M. C. pH-sensitive liposomes for drug delivery in cancer treatment. Therapeutic Delivery. 4 (9), 1099-1123 (2013).
- Papachristos, A., Pippa, N., Ioannidis, K., Sivolapenko, G., Demetzos, C. Liposomal forms of anticancer agents beyond anthracyclines: present and future perspectives. Journal of Liposome Research. 25 (2), 166-173 (2015).
- Akbarzadeh, A., et al. Liposome: classification, preparation, and applications. Nanoscale Research Letters. 8 (1), 102(2013).
- Bangham, A., Standish, M. M., Watkins, J. C. Diffusion of univalent ions across the lamellae of swollen phospholipids. Journal of Molecular Biology. 13 (1), 238-252 (1965).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proceedings of the National Academy of Sciences of the United States of America. 75 (9), 4194-4198 (1978).
- Batzri, S., Korn, E. D. Single bilayer liposomes prepared without sonication. Biochimica et Biophysica Acta (BBA) - Biomembranes. 298 (4), 1015-1019 (1973).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid/detergent mixed micelles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 640 (1), 252-262 (1981).
- Szebeni, J., et al. Oxidation and denaturation of hemoglobin encapsulated in liposomes. Biochimica et Biophysica Acta (BBA) - General Subjects. 798 (1), 60-67 (1984).
- Coelho, J. F., et al. Drug delivery systems: Advanced technologies potentially applicable in personalized treatments. EPMA Journal. 1 (1), 164-209 (2010).
- Pereira, P. R., et al. Purification and characterization of the lectin from taro (Colocasia esculenta) and its effect on mouse splenocyte proliferation in vitro and in vivo. The Protein Journal. 33 (1), 92-99 (2014).
- Pereira, P. R., et al. Structural analysis and binding properties of isoforms of tarin, the GNA-related lectin from Colocasia esculenta. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1854 (1), 20-30 (2015).
- Pereira, P. R., et al. High-resolution crystal structures of Colocasia esculenta tarin lectin. Glycobiology. 27 (1), 50-56 (2016).
- Correa, A., Vericimo, M. A., Dashevskiy, A., Pereira, P. R., Paschoalin, V. M. F. Liposomal Taro Lectin Nanocapsules Control Human Glioblastoma and Mammary Adenocarcinoma Cell Proliferation. Molecules. 24 (3), 471(2019).
- Peterson, G. L., et al. A simplification of the protein assay method of Lowry et al. which is more generally applicable. Analytical Biochemistry. 83 (2), 346-356 (1977).
- Merida, L. A., et al. Tarin stimulates granulocyte growth in bone marrow cell cultures and minimizes immunosuppression by cyclo-phosphamide in mice. PLoS ONE. 13 (11), e0206240(2018).
- Murtey, M. D., Ramasamy, P. Sample Preparations for Scanning Electron Microscopy - Life Sciences. Modern Electron Microscopy in Physical and Life Sciences. Janecek, M., Kral, R. , InTechOpen. (2016).
- Andrade, C. A., Correia, M. T., Coelho, L. C., Nascimento, S. C., Santos-Magalhães, N. S. Antitumor activity of Cratylia mollis lectin encapsulated into liposomes. International Journal of Pharmaceutics. 278 (2), 435-445 (2004).
- dos Santos Ferreira, D., et al. Development of a bone-targeted pH-sensitive liposomal formulation containing doxorubicin: physicochemical characterization, cytotoxicity, and biodistribution evaluation in a mouse model of bone metastasis. International Journal of Nanomedicine. 11, 3737(2016).
- Pereira, P. R., Corrêa, A. C. N. T. F., Vericimo, M. A., Paschoalin, V. M. F. Tarin, a Potential Immunomodulator and COX-Inhibitor Lectin Found in Taro (Colocasia esculenta). Comprehensive Reviews in Food Science and Food Safety. 17 (4), 878-891 (2018).
- Olson, F., Hunt, C., Szoka, F., Vail, W., Papahadjopoulos, D. Preparation of liposomes of defined size distribution by extrusion through polycarbonate membranes. Biochimica et Biophysica Acta (BBA) - Biomembranes. 557 (1), 9-23 (1979).
- Mui, B., Chow, L., Hope, M. J. Extrusion technique to generate liposomes of defined size. Methods in Enzymology. 367, 3(2003).
- Soo, E., et al. Enhancing delivery and cytotoxicity of resveratrol through a dual nanoencapsulation approach. Journal of Colloid and Interface Science. 462, 368-374 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены