Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ensayo repetible de escalera para acceder al potencial alelopático del arroz weedy (Oryza sativa ssp.)
En este artículo
Resumen
La alelopatía ha demostrado ser prometedora como una estrategia de control suplementario de la hierba útil en los sistemas de cultivo. Para determinar el potencial alelopático de un espécimen vegetal deseado, se proporciona un método de cribado de escalera.
Resumen
La competencia de las weed contribuye significativamente a las pérdidas de rendimiento en los sistemas de cultivo en todo el mundo. La evolución de la resistencia en muchas especies de mala hierba según los herbicidas aplicados continuamente ha presentado la necesidad de métodos de gestión adicionales. La alelopatía es un proceso fisiológico que poseen algunas especies vegetales que proporcionan a la planta una ventaja sobre sus vecinos. Las variedades de cultivos alelopáticos estarían equipadas con la capacidad de suprimir el crecimiento de los competidores circundantes, reduciendo así la pérdida de rendimiento potencial debido a la interferencia de malezas. Este artículo se centra en la construcción y operación de un ensayo de escalera utilizado para el cribado del potencial alelopático de una especie de donante (Oryza sativa) contra una especie receptora de la hierba (Echinochloa crus-galli) en un entorno de invernadero. La estructura descrita en este documento sirve como soporte para las muestras de la planta e incorpora un sistema de riego cronometrado para la acumulación y distribución de aleloquímicos. Los aleloquímicos producidos por las raíces de la planta pueden fluir hacia abajo a través de una serie de cuatro macetas por separado en un tanque de recolección y reciclados de nuevo a la planta superior a través de bombas eléctricas. Este método de cribado proporciona una vía para que los aleloquímicos de la planta donante lleguen a las plantas receptoras sin ningún tipo de competencia de recursos, permitiendo así la medición cuantitativa del potencial alelopático de la planta donante seleccionada. El potencial alelopático es medible a través de la reducción de altura de las plantas receptoras. Los datos preliminares de cribado de la eficacia de este método demostraron la reducción de la altura en la especie receptora, barnyardgrass (E. crus-galli), y por lo tanto la presencia de residuos alelopáticos de la planta donante, arroz herbicida (Oryza sativa).
Introducción
La alelopatía es un fenómeno natural y complejo que ha sido el foco de muchos científicos de plantas en las últimas décadas. Los mecanismos relativos a la alelopatía para su uso en cultivos han sido objeto de mucha investigación desde la década de 1930, cuando Molisch observó que una planta tiene un efecto directo o indirecto sobre una planta vecina a través de la producción y secreción de compuestos químicos en el medio ambiente1. La alelopatía es la producción de metabolitos secundarios que tienen efectos inhibitorios en el crecimiento y la germinación de algunas especies vegetales. Los compuestos químicos alopáticos liberados ayudan a proporcionar a las plantas donantes una ventaja competitiva mediante la adición de fitotoxinas al medio ambiente a su alrededor2. Muchos factores contribuyen a la actividad alelopática. Es selectivo en su eficacia y varía entre variedades, condiciones ambientales, etapa de crecimiento, estrés, medio ambiente y disponibilidad de nutrientes3.
En los últimos años, la alelopatía se ha destacado en la investigación como un posible complemento a la constante y creciente crisis de control de las weed. Con la creciente población mundial, la demanda de producción sostenible de alimentos y fibra ha aumentado4. El control de las desudos es una de las mayores amenazas a la producción a las que se enfrentan los agrónomos5,6. Los métodos tradicionales de control de malas hierbas se centran en las prácticas mecánicas, químicas y culturales. El uso continuo de herbicidas, si bien es eficaz, útil y eficiente, ha promovido la evolución de las poblaciones de nohierbas resistentes a un ritmo alarmantemente rápido7. La ingeniería genética y las prácticas de cría se han utilizado eficazmente para dar a los cultivos ventajas competitivas sobre las malas hierbas al diseñarlas para soportar aplicaciones químicas que sus vecinos no pueden sobrevivir7,8. Aunque son eficaces, estas tecnologías no siempre son sostenibles y a veces plantean preocupaciones transversales9. Es necesario introducir prácticas suplementarias de gestión de malas hierbas si se quiere alcanzar el objetivo de aumentar la producción de alimentos10. La alelopatía muestra una excelente promesa como una nueva herramienta de defensa para que los cultivos mejoren su calidad y sobrevivan a sus competidores1,7.
Los aleloquímicos son a menudo productos secundarios, y debido a que su producción está muy influenciada por factores ambientales, los compuestos específicos asociados con la supresión de la planta pueden ser difíciles de identificar3. Los factores de producción incluyen la genética y la acción conjunta de los metabolitos secundarios que pueden actuar sinérgicamente11,12. Es difícil separar la actividad alelopática de la competencia que existe naturalmente dentro de las interacciones entre las cosechas, y debido a esto, cuando la detección de alelopatía debe haber un conjunto estándar de resultados que califiquen el ensayo como válido y repetible. A continuación se muestra un conjunto de criterios que califica los hallazgos de alelopatía como se describe en Olofsdotter et al.12 1) Una planta debe demostrar la supresión de otra planta en un patrón; 2) Los productos químicos que se liberan en el medio ambiente en cantidades bioactivas deben ser producidos por la planta donante; 3) Los productos químicos producidos deben ser transportables a la planta receptora; 4) Algún mecanismo de admisión debe estar presente en la planta receptora; 6) El patrón de inhibición observado no debe tener ninguna otra explicación exclusiva (por ejemplo, competencia por los recursos)12.
En un esfuerzo por superar la barrera entre el desconocimiento de los mecanismos de apoyo a la alelopatía y el desarrollo de variedades, se pueden identificar y seleccionar rasgos fenotípicos asociados con las variedades alelopáticas para su posterior investigación y uso. Algunas plantas conocidas por tener cualidades aleloppáticas son centeno, sorgo, arroz, girasol, colza y trigo13. Durante las primeras observaciones de la alelopatía en los cultivos, debido a las fronteras distinguidas del crecimiento de las malezas en los experimentos sobre el terreno, se propuso que los productos químicos estuvieran involucrados en lugar de la competencia por los recursos14. Sin embargo, la mayoría de los estudios fueron experimentos de campo que hacían imposible eliminar la competencia como factor14. Los esfuerzos de eliminación de la competencia dieron paso a experimentos de laboratorio e invernadero en los intentos de probar y cuantificar la actividad alelopática en el arroz y otros cultivos. Los métodos de campo e invernadero para detectar alelopatía en las plantas demuestran que las tendencias aleloppáticas están presentes en ambas condiciones de cultivo11,15. Algunos críticos creen que los exámenes de laboratorio sólo pueden tener un valor limitado debido a la falta de condiciones naturales, lo que puede afectar los resultados15.
El método propuesto para el cribado del potencial alelopático en las plantas proporciona recursos y espacio adecuados y elimina la competencia de recursos con el uso de una estructura de escalera11,17. El método fue adaptado y modificado de experimentos anteriores que exploran la alelopatía en hierba de césped y cebada17,18. Estos estudios encontraron que un sistema similar era capaz de producir resultados precisos sobre el potencial alelopático de una planta objetivo, al tiempo que eliminaba cualquier duda de que las observaciones pudieran atribuirse a la competencia natural. El método de paso de escalera crea un sistema circulatorio donde una solución nutritiva de un depósito puede recorrer cada planta hasta una bandeja de incubación a través de unos pocos pasos. Una bomba eléctrica entonces recicla la solución junto con cualquier aleloquímico producido18. Un método como este es eficaz tanto en tiempo como en espacio y recursos. También proporciona condiciones de campo similares para las plantas y elimina cualquier competencia de recursos. Los métodos y herramientas utilizados para el cribado se manipulan fácilmente para adaptarse a los objetivos de estudio deseados, condiciones y especies específicas. El objetivo de este estudio es confirmar la alelopatía del arroz weedy a través de mediciones de supresión de altura en el perceno con el uso del método de escalón.
Protocolo
1. Construcción de soportes
NOTA: Las medidas para la madera se enumeran como espesor (cm) x ancho (cm) x longitud (m).
- Corte la madera en tamaños y cantidades apropiados de la siguiente manera: cinco piezas de madera de 10,16 cm x 5,08 cm x 0,91 m, tres piezas de madera de 10,16 cm x 5,08 cm x 0,76 m, tres piezas de madera de 10,16 cm x 5,08 cm, cinco piezas de madera de 10,16 m, cinco piezas de madera de 10,16 cm x 5,08 cm x 0,46 m, tres piezas de madera de 10,16 m x 0,46 m, tres piezas de madera de 10,16 cm x 5,08 cm x 0,46 m , tres piezas de madera de 10,16 cm x 5,08 cm x 0,3 m, y tres piezas de madera de 10,16 cm x 5,08 cm x 0,15 m.
- Para el nivel más alto, soporte una placa de 2,44 m en dos piezas de 0,91 m en cada extremo en el borde y taladre dos tornillos verticalmente en cada una de las piezas de 0,91. Atornille una pieza más de 0,91 m 1,22 m de cada extremo para el soporte, y coloque una placa de 2,44 m a lo largo de la parte posterior de los soportes de 0,91 m y atornille en su lugar para el soporte.
NOTA: Los ocho de 3,175 cm x 15,24 cm x 2,44 m se mantienen tal cual y se descortan para servir como mesa de trabajo para cada nivel de banco. - Repita el paso 1.2 para el siguiente nivel de banco con las piezas de 0,76 m.
- Repita el paso 1.2 para el siguiente banco con las piezas de 0,61 m hasta el sexto banco a 0,15 m.
NOTA: No se necesita una placa de 2,44 m para los bancos 3–6. El soporte final tiene seis bancos con tres soportes verticales cada uno, uno en cada extremo y otro en el medio. - Bancos de línea en orden de altura descendente con el labio que sobresale mirando hacia la parte trasera tocando el banco por encima de él, lo que permite un espacio entre los niveles.
- Forre una tabla de 0,91 cm en cada uno de los bordes inferiores de los bancos a lo largo del suelo y atornille los bancos en su lugar.
- Atornille una placa de 0,46 m horizontalmente para apoyar los tres bancos más altos a cada lado de la estructura a 0,61 m del suelo.
- Atornille tres llaves de esquina en los extremos frontales y en el centro del banco más alto.
- Atornillar una pieza de madera de 2,54 cm x 5,08 cm x 20,32 cm a través de los frenos a 2,54 cm de la base del banco.
NOTA: Haga una estructura de 0,91 m por 0,91 m por 2,44 m. Refiera al cuadro 1 para el producto base final. Las dimensiones están sujetas a cambios con las necesidades experimentales. La estructura descrita fue diseñada para adaptarse a macetas de 15,24 cm. Las alturas entre los bancos fueron diseñadas para adaptarse a las macetas y al material vegetal utilizado en este experimento con el fin de mantener un flujo constante de aleloquímicos y solución de una olla a otra por los bancos por gravedad.

Figura 1: Vista frontal del soporte base de madera. Una base de madera sirve como soporte para las muestras de la planta. Los materiales para el sistema deben ensamblarse y añadirse en función del número de muestras necesarias para el experimento. En este estudio, dos soportes sirvieron como base para 31 muestras. Haga clic aquí para ver una versión más grande de esta figura.
2. Ensamblaje del sistema
- Retire la tapa de una botella de soda de 1 L y rocíe pintura con pintura negra.
NOTA: Las botellas de refresco servirán como depósito en la parte superior del sistema para una columna. La pintura proporciona un bloque para la luz, disminuyendo o previniendo el crecimiento de algas. - En la parte inferior de cada botella de refresco, taladre un pequeño agujero, lo suficientemente grande como para incrustar un diámetro interior de 0,35 cm (ID), 0,64 cm de diámetro exterior (OD), tubo de PVC de plástico de 5,08 cm de largo.
- Frotar una capa de sellador impermeable de silicona alrededor del borde del orificio después de la inserción para evitar fugas. Deja que se seque por completo.
- Repita los pasos 2.2 y 2.3 en cada uno de los platos de plástico utilizados para sujetar las ollas.
NOTA: Se necesitarán cuatro platos para una columna. - Retire la tapa y pinte en aerosol el exterior de los recipientes de plástico de 2,27 l con pintura negra. Estos botes servirán como tanques de recolección en la base de cada columna.
- Taladre un pequeño agujero en la parte superior de la parte posterior del contenedor.
NOTA: Los suministros enumerados en los pasos 2.1–2.6 hacen una columna. El número de columnas está sujeto al número de muestras necesarias para el experimento deseado. Se necesitan dos columnas para un ejemplo. Todas las dimensiones están sujetas a cambios dependiendo de las necesidades experimentales. - Después de que los suministros hayan sido preparados y secados, coloque la botella de refresco en el banco más alto para que el tubo de PVC se cuelgue sobre el borde que da a las escaleras.
- Justo debajo de la botella de refresco en el siguiente banco, coloque un plato de plástico con su tubo colgando sobre el borde del banco.
- Repita el paso 2.8 para los dos bancos siguientes.
- Coloque el contenedor en el banco inferior con el orificio mirando hacia la parte posterior.
- Conecte el recipiente con el plato por encima de él encadenando el tubo del plato a través del orificio en la parte posterior del recipiente.
- Desfrotar el sellador impermeable alrededor del borde del contenedor donde pasa el tubo para evitar fugas.
- Coloque una bomba eléctrica sumergible de 21 W 1.000 L/hr dentro del recipiente inferior.
- Conecte un tubo de PVC OD de 1,07 m de largo, 1,27 cm, 1,59 cm OD a la boquilla de la bomba eléctrica.
- Encadenar el tubo a través del hueco entre los bancos y sobre la parte posterior de la botella de refresco en la parte superior del sistema.
- Conecte la bomba a un temporizador digital y ajuste el ajuste del temporizador según sea necesario.
NOTA: El temporizador se ha configurado para ejecutarse durante 1 min cada 3 h a lo largo de todo el experimento. El tiempo seleccionado permitía que la cantidad máxima de líquido en el tanque de recolección se ciclorara y permitía un ciclo de aproximadamente 10 minutos de flujo cada vez que se encendía la bomba, evitando inundaciones y derrames.
3. Plantación
- Esterilice todas las semillas de arroz necesarias engrasando 70% etanol durante 30 s, empapando en 5% de lejía durante 20 min, y engrasando 6 veces con agua destilada.
- Pregerminar las semillas de arroz esterilizadas en platos Petri forrados con papel de filtro relleno con 5 ml de agua destilada en una cámara de crecimiento establecida a 25oC.
- Después de que las semillas germinen, alinee la parte inferior de cada olla con dos grandes filtros de café colocándolos dentro de las macetas en su forma natural.
- Llene cada olla hasta la parte superior del filtro (aproximadamente el 75% de la olla) con arena de cuarzo autoclaveda, lavada y con mosquiteros especialmente clasificados. Humedezca la arena con agua destilada vertiendo agua sobre la parte superior de la arena o colocando macetas en bandejas de plantación llenas ligeramente con agua destilada para permitir que las ollas absorban el agua y permanezcan húmedas. Trasplantar seis plántulas pregerminales de plantas de donante en arena, espaciadas uniformemente.
- Cubra las plántulas con arena.
- Deje que las plántulas se establezcan durante 3 semanas.
NOTA: La arena se seca muy rápidamente. Por lo tanto, la colocación de macetas en bandejas es una técnica de riego eficiente. Cambiar el agua constantemente ayudará a prevenir el moho. - Pregerminar las plántulas de la planta receptora (E. crus-galli) en platos Petri 3 semanas después de plantar plantas de donante relacionando la parte inferior del plato con papel de filtro y junto con 5 ml de agua destilada. Colocar los platos en una cámara de crecimiento a 25 oC durante 3-5 días.
- Prepare las ollas como se describe en los pasos 3.1–3.2.
- Después de que las plántulas germinen, trasplantar tres plántulas en las ollas preparadas y cubrir con arena.
NOTA: El experimento comienza un día después del tratamiento (DAT), o el día en que las plántulas de la planta receptora emergen y se trasplantan y se colocan en el sistema.
4. Colocación de muestras
- Coloque cuatro macetas de una adhesión de plantas de donantes en los cuatro platos de la columna 1, una sola olla por fila. La columna 1 consiste únicamente en plantas de donantes.
- Coloque dos macetas de la misma adhesión de plantas de donantes en los platos de la columna 2 en la primera y tercera fila de la columna.
- Coloque dos macetas de plantas receptoras en los platos de la columna 2 en la segunda y cuarta fila de la columna.
- Para cada replicación, asegúrese de que solo se agrega una fila de plantas receptoras. Dos columnas, la primera compuesta únicamente por plantas donantes y la segunda donantes y receptores alternos, realizan un tratamiento(Figura 2).
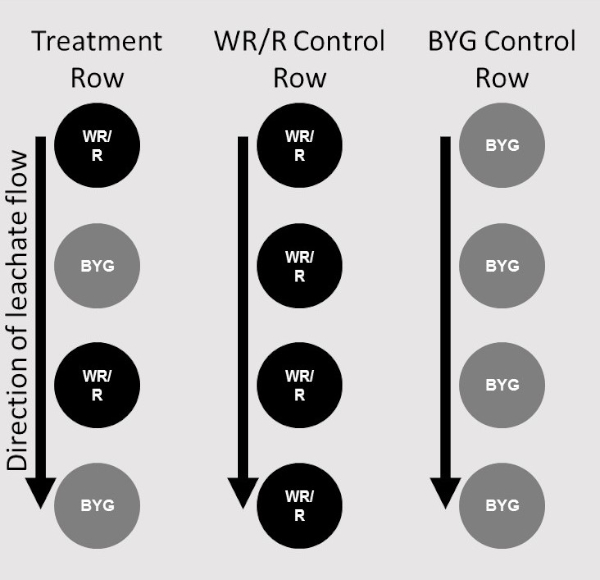
Figura 2: Mapa de ubicación. Diagrama que representa las ubicaciones de los donantes (WR/R) y las plantas receptoras (BYG) en las posiciones respectivas del sistema de paso de escalera. Dos columnas del sistema de escaleras con plantas en su lugar comprenden un tratamiento. Una sola columna de plantas receptoras servía como control para una réplica (extrema derecha), una sola columna de plantas donantes como control para cada adhesión (centro), y la columna de tratamiento consistía en plantas alternas de donantes y receptores (extrema izquierda). Haga clic aquí para ver una versión más grande de esta figura.
- Repita los pasos 4.1–4.4 para cada tratamiento o adhesión a la planta de donante(Figura 3).
NOTA: Cada replicación requiere una columna de muestras de planta receptora para servir como control para una replicación. Los tratamientos se replicaron 3 veces en un diseño de bloque completo aleatorio.

Figura 3: Estructura final del paso de escalera. El sistema de escaleras montado con las plantas en su lugar. El sistema contenía cuatro filas de muestras de plantas y un tanque de recolección en la parte inferior para que la solución se llevara a la botella superior y hacia abajo por gravedad a través de cada maceta respectiva. Haga clic aquí para ver una versión más grande de esta figura.
5. Operación
- En DAT 1, llene el tanque de recogida en la parte inferior de cada columna con la solución Hoagland de media resistencia17 en agua destilada, aproximadamente 1.500 ml.
- Ajuste los temporizadores para que se ejecuten como desee en el ajuste de apagado automático.
- Cubra los tanques de recogida con plástico negro para limitar la exposición a la luz y la evaporación.
- Llene los tanques cada 2 días con 500 ml de la solución de Hoagland para mantener el sistema fluyendo constantemente.
- Mantener las temperaturas del invernadero a 28oC durante el día y 24oC por la noche respectivamente con una división de 16/8 h y humedad al 53%.
6. Recopilación de datos
- Mida y registre las alturas de cada planta en el sistema de escaleras en DAT 1 y una vez cada semana hasta DAT 21 colocando una regla en la base de cada planta y observando el soporte de hoja más alto.
- Mida y registre los niveles de clorofila de cada planta en DAT 7 y 14 utilizando el medidor de contenido de clorofila.
- En el último día del experimento (es decir, DAT 21) etiquete una bolsa de papel para cada olla.
- Corte las muestras de la planta en la base y colóquelas en bolsas separadas.
- Colocar todas las muestras en un secador de horno a 60 oC durante 48 h16.
- Retire las muestras secas y el contenido vacío individualmente en una báscula y registre el peso en gramos.
7. Análisis de datos
- Calcular el potencial alelopático de las plantas donantes basándose en el porcentaje de inhibición de la planta receptora utilizando esta ecuación:
Reducción de la altura (%) - [altura de control (cm) – altura de tratamiento (cm)] a 100 - Calcule la reducción de la altura de la planta del donante como una comprobación de cualquier efecto inverso que la planta receptora pueda tener en las plantas objetivo.
- Analizar las adhesiones como el efecto fijo mientras que las replicaciones y ejecuciones son los efectos aleatorios18.
- Analice los datos utilizando un modelo lineal general con valores medios separados utilizando la diferencia menos significativa protegida de Fisher en o por debajo de un nivel de probabilidad de 0,05 en un software estadístico (por ejemplo, JMP 14).
- Visualice la correlación entre las variables originales mediante el análisis de componentes principales mediante la carga de datos.
- Seleccione la pestaña Analizar en la barra de herramientas, seleccione Ajustar Y por X. En Columnas, Resalte la respuesta (es decir, reducción de la altura porcentual) y, a continuación, haga clic en Y, respuesta para especificar el factor que se observa para Y ( es decir, reducción de la altura del porcentaje). Para el factor X, adhesión a Hightlight y haga clic en X, factor y,a continuación, seleccione Aceptar.
- Seleccione la flecha roja hacia abajo en la barra Análisis unidireccional, seleccione Medios/ANOVA. Vuelva a seleccionar la flecha hacia abajo en la barra Análisis unidireccional y resalte los medios de comparación y, a continuación, seleccione cada par, T del alumno.
Resultados
Se realizaron dos exámenes preliminares utilizando este método en nueve adhesiones de arroz de mosedaños (B2, S33, B83, S97, S94, B81, B8, B34, B14) y cinco líneas de arroz cultivado (PI338046, Rex, Rondo, PI312777, CL163). Las adhesiones de arroz weedy y las líneas de arroz se seleccionaron en función de su rendimiento en exámenes alelopáticos anteriores realizados por Shrestha (2018)18. Las semillas de arroz de la hierba fueron recolectadas de todo el estado de Arkansas. Las líneas de a...
Discusión
La explotación de la alelopatía puede servir potencialmente como un control biológico para las malas hierbas que son difíciles de manejar1,7,13. La alelopatía ha demostrado un gran potencial como posible solución a la crisis de las malas hierbas en el arroz y sirve como alternativa o suplemento a los productos químicos y las prácticas manuales de control de malas hierbas5,
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
La financiación de este proyecto fue proporcionada por la Beca de la Iniciativa de Investigación Especial patrocinada por la Estación Experimental Agrícola y Forestal de Mississippi y se basa en el trabajo que cuenta con el apoyo del Instituto Nacional de Alimentación y Agricultura, Departamento de Agricultura de los Estados Unidos Agricultura, proyecto Hatch con número de adhesión 230060.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.25 in by 6 in by 8 ft standard severe weather wood board | Lowe's, Mooresville, NC | 489248 | N/A |
| 2 in by 4 in by 8 ft white wood stud | Lowe's, Mooresville, NC | 6005 | Cut into appropriate sizes |
| 63 mm (2.5 in) corner braces | Lowe's, Mooresville, NC | 809449 | N/A |
| Asporto 16 oz Round Black Plastic To Go Box - with Clear Lid, Microwavable – 6.25 in by 6.25 in by 1.75 in - 100 count box | Restaurantware.com, Chicago, IL | RWP0191B | black |
| ATP vinyl-flex PVC food grade plastic tubing, clear, 0.125 in id by 0.25 in od, 100 ft | Amazon, Seattle WA | B00E6BCV0G | N/A |
| Ccm-300 chlorophyll content meter | Opti-Sciences, Inc. Hudson, NH | ccm/300 | N/A |
| Common 1 in by 2 in by 8 ft pine board | Lowe's, Mooresville, NC | 1408 | N/A |
| Contractors choice contractor 24-pack 42-gallon black outdoor plastic construction trash bag | Lowe's, Mooresville, NC | 224272 | Cut to cover collection tanks |
| EURO POTS | Greenhouse Megastore, Danville, IL | CN-EU | 15 cm short black 6 in diameter 4.25 in height 1.37 qt volume |
| Fisher brand petri dish with clear lid | Fisher Scientific, Waltham, MA | FB0857513 | N/A |
| Aexit Ac 220 V-240 V electrical equipment US plug 21 W 1,000 L/hr multipurpose submersible pump | Amazon, Seattle WA | B07MBMYQNT | Nozzle size should fit tubes and can be repaced |
| Woods 50015 WD outdoor 7 day heavy-duty digital outlet timer | Walmart, Bentonville, AR | 565179767 | 20 settings |
| GE silicone 2+ 10.1 oz almond silicone caulk | Lowe's, Mooresville, NC | 48394 | Sealant for edges of any attached tubing |
| Great Value Distilled Water | Walmart, Bentonville, AR | 565209428 | N/A |
| Great Value White Basket coffee filters 200 count | Walmart, Bentonville, AR | 562723371 | Size may vary |
| Grip-rite primgaurd plus #9-3 in pollimerdex screws | Lowe's, Mooresville, NC | 323974 | N/A |
| Hoagland’s No. 2 basal salt mixture | Caisson Laboratories, INC. Smithfield, UT | HOP01/50LT | ½ strength rate |
| JMP (14) | SAS Institute Inc. North Carolina State University, NC | N/A | |
| Project source flat black spray paint | Lowe's, Mooresville, NC | 282254 | N/A |
| Project source utility 1.88 in by 165 ft gray duct tape | Lowe's, Mooresville, NC | 488070 | N/A |
| Rubbermaid 2 qt square food storage canister clear | Walmart, Bentonville, AR | 555115144 | Collection tank discard lid |
| Sealproof unreinforced PVC clear vinyl tubing, food-grade .5 in id by .625 in od, 100 ft | Amazon, Seattle WA | B07D9CLGV3 | Connects to pump |
| Short Mountain Silica 50 lb Play sand | Lowe's, Mooresville, NC | 10392 | Sand should be purified |
| Steve Spangler's 1 L Soda Bottles - 6 Pack - For Science Experiment Use | Amazon, Seattle WA | UPC 192407667341 | Top step tank discard lid |
Referencias
- Weston, L. A. History and Current Trends in the Use of Allelopathy for Weed Management. HortTechnology. 15 (3), 529-534 (2005).
- Pratley, J. E. Allelopathy in annual grasses. Plant Protection Quarterly. 11, 213-214 (1996).
- Bertin, C., Yang, X., Weston, L. A. The role of root exudates and allelochemicals in the rhizosphere. Plant and Soil. 256 (1), 67-83 (2003).
- Stevenson, G. R. Pesticide Use and World Food Production: Risks and Benefits. Environmental Fate and Effects of Pesticides. American Chemical Society. , 261-270 (2003).
- Chopra, N., Tewari, G., Tewari, L. M., Upreti, B., Pandey, N. Allelopathic Effect of Echinochloa colona L. and Cyperus iria L. Weed Extracts on the Seed Germination and Seedling Growth of Rice and Soybean. Advances in Agriculture. 2017, 1-5 (2017).
- Jabran, K., Mahajan, G., Sardana, V., Chauhan, B. S. Allelopathy for weed control in agricultural systems. Crop Protection. 72, 57-65 (2015).
- Worthington, M., Reberg-Horton, C. Breeding Cereal Crops for Enhanced Weed Suppression: Optimizing Allelopathy and Competitive Ability. Journal of Chemical Ecology. 39, 213-231 (2013).
- Sudianto, E., et al. Corrigendum to "Clearfield (R) rice: Its development, success, and key challenges on a global perspective.". Crop Protection. 55, 142-144 (2014).
- Gressel, J., Valverde, B. E. A strategy to provide long-term control of weedy rice while mitigating herbicide resistance transgene flow, and its potential use for other crops with related weeds. Pest Management Science. 65, 723-731 (2009).
- Muthayya, S., Sugimoto, J. D., Montgomery, S., Maberly, G. F. An overview of global rice production, supply, trade, and consumption. Annals of the New York Academy of Sciences. 1324, 7-14 (2014).
- Chung, I. M., Kim, K. H., Ahn, J. K., Lee, S. B., Kim, S. H. Allelopathy Comparison of Allelopathic Potential of Rice Leaves, Straw, and Hull Extracts on Barnyardgrass. Agronomy Journal. 95 (4), 1063-1070 (2003).
- Olofsdotter, M., Jensen, L. B., Courtois, B. Improving crop competitive ability using allelopathy Ð an example from rice. Journal of Plant Breeding. 121, 1-9 (2002).
- Olofsdotter, M., Navarez, D., Rebulanan, M., Streibig, J. C. Weed-suppressing rice cultivars-does allelopathy play a role. Weed Research. 39 (6), 441-454 (1999).
- Jensen, L. B., et al. Locating Genes Controlling Allelopathic Effects against Barnyardgrass in Upland Rice. Agronomy Journal. 93 (1), 21-26 (2001).
- Kuijken, R. C., Eeuwijk, F. A. V., Marcelis, L. F., Bouwmeester, H. J. Root phenotyping: from component trait in the lab to breeding. Journal of Experimental Botany. 66 (18), 5389 (2015).
- Lickfeldt, D. W., Voigt, T. B., Branham, B. E., Fermanian, T. W. Evaluation of allelopathy in cool season turfgrass species. International Turfgrass Society. 9, 1013-1018 (2001).
- Liu, D. L., Lovett, J. V. Biologically active secondary metabolites of barley: Developing techniques and assessing allelopathy in barley. Journal of Chemical Ecology. 19, 2217-2230 (1993).
- Shrestha, S. . Evaluation of Herbicide Tolerance and Interference Potential among Weedy rice germplasm. , (2018).
- Kim, K. U., Shin, D. H., Olofsdotter, Rice allelopathy research in Korea. Allelopathy in Rice. IRRI. , (1998).
- Quasem, J. R., Hill, T. A. On difficulties with allelopathy. Weed Research. 29, 345-347 (1989).
- Singh, S., et al. Evaluation of mulching, intercropping with Sesbania and herbicide use for weed management in dry-seeded rice (Oryza sativa L.). Crop Protection. 26, 518-524 (2007).
- Kong, C. H., Li, H. B., Hu, F., Xu, X. H., Wang, P. Allelochemicals released by rice roots and residues in soil. Plant and Soil. 288 (1-2), 47-56 (2006).
- Ervin, G. N., Wetzel, R. G. Allelochemical autotoxicity in the emergent wetland macrophyte Juncus effusus (Juncaceae). American Journal of Botany. 87 (6), 853-860 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados