Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Повторяющиеся Лестница шаг Ассса для доступа к allelopathic потенциал Weedy Райс (Oryza sativa ssp.)
В этой статье
Резюме
Аллелопатия показала обещание как полезная дополнительная стратегия управления сорняками в системах земледелия. Для определения аллелопатического потенциала желаемого образца растения предусмотрен метод скрининга лестницы.
Аннотация
Конкуренция сорняков вносит значительный вклад в потери в системах земледелия по всему миру. Эволюция устойчивости многих видов сорняков к постоянно применяемым гербицидам и представляет необходимость дополнительных методов управления. Аллелопатия является физиологический процесс, что некоторые виды растений обладают, которые обеспечивают завод с преимуществом перед своими соседями. Аллелопатические сорта сельскохозяйственных культур будут оснащены возможностью подавлять рост окружающих конкурентов, тем самым уменьшая потенциальную потерю урожайности из-за помех сорняков. В настоящем документе основное внимание уделяется строительству и эксплуатации лестницы шаг анализ, используемый для скрининга аллелопатического потенциала донора видов(Oryza sativa) против приемника сорняков видов (Echinochloa crus-galli) в теплице настройки. Структура, описанная в настоящем документе, служит в качестве стенда для образцов растений и включает в себя приурочен системы полива для накопления и распределения аллелохимических веществ. Аллелохимические вещества, производимые корнями растений, могут стекать вниз через серию из четырех горшков отдельно в резервуар для сбора и перерабатываться обратно на верхнюю установку с помощью электрических насосов. Этот метод скрининга предоставляет аллелохимику от завода-донора достичь заводов-приемников без какой-либо ресурсной конкуренции, что позволяет количественно измерить аллелопатический потенциал выбранного донорского растения. Аллелопатический потенциал измеряется за счет уменьшения высоты приемника растений. Предварительные данные скрининга на эффективность этого метода продемонстрировали снижение высоты в приемник видов, скотничный двор (E. crus-galli), и, таким образом, наличие аллилопатических остатков от донорского растения, сорняков риса (Oryza sativa).
Введение
Аллелопатия является естественным и сложным явлением, которое было в центре внимания многих ученых завода в последние несколько десятилетий. Механизмы, связанные с аллелопатией для использования в сельскохозяйственных культурах были предметом многочисленных исследований с 1930-х годов, когда Molisch отметил, что растение имеет прямое или косвенное влияние на соседний завод через производство и секрецию химических соединений в окружающую среду1. Аллелопатия является производство вторичных метаболитов, которые оказывают ингибирующее воздействие на рост и прорастание некоторых видов растений. Выпущенные аллопатические химические соединения помогают предоставить растениям-донорам конкурентное преимущество, добавляя фитотоксины в окружающую среду вокруг них2. Многие факторы способствуют аллелопатической деятельности. Он селективный по своей эффективности и варьируется между сортами, условиями окружающей среды, стадией роста, стрессом, окружающей средой и наличием питательных веществ3.
В последние годы, аллелопатия была выделена в исследованиях в качестве возможного дополнения к постоянной и растущей сорняков кризиса контроля. С ростом населения в мире, спрос на устойчивое производство продуктов питания и волокон увеличилось4. Контроль сорняков является одной из самых больших угроз для производства, с которыми сталкиваются агрономы5,6. Традиционные методы борьбы с сорняками сосредоточены на механических, химических и культурных практиках. Непрерывное использование гербицидов, в то время как эффективные, полезные и эффективные, способствовало эволюции устойчивых популяций сорняков в тревожно быстрыми темпами7. Генетическая инженерия и методы разведения были эффективно использованы, чтобы дать сельскохозяйственным конкурентным преимуществам над сорняками, проектируя их, чтобы противостоять химическим применениям, что их соседи не могут выжить7,8. Хотя эти технологии являются эффективными, они не всегда являются устойчивыми и иногда создаютпроблемы,связанные с пересочностными. Дополнительные методы управления сорняками должны быть введены, если цель увеличения производства продуктов питания должна быть достигнута10. Аллелопатия показывает отличные перспективы в качестве нового инструмента обороны для сельскохозяйственных культур, чтобы улучшить их качество и пережить своих конкурентов1,7.
Allelochemicals часто вторичные продукты, и потому, что их производство в значительной степени зависит от факторов окружающей среды, конкретные соединения, связанные с подавлением растений может быть трудно определить3. Производственные факторы включают генетику и совместное действие вторичных метаболитов, которые могут действовать синергетически11,12. Это сложно отделить аллелопатической деятельности от конкуренции, которая, естественно, существует в сельскохозяйственных сорняков взаимодействий, и из-за этого, при скрининге на аллелопатию должен быть стандартный набор результатов, которые квалифицируют анализ как действительный и повторяемый. Ниже приведен набор критериев, которые квалифицируют выводы аллелопатии, изложенные Olofsdotter et al.12 1) Одно растение должно продемонстрировать подавление другого растения в шаблоне; 2) Химические вещества, выбрасываемые в окружающую среду в биологически активных количествах, должны производиться донорским растением; 3) Производимые химические вещества должны транспортироваться на приемник; 4) Некоторый механизм поглощения должен присутствовать на заводе приемника; 6) Модель наблюдаемого торможения не должна иметь никаких других эксклюзивных объяснений (например, конкуренция за ресурсы)12.
В попытке преодолеть барьер между отсутствием знаний о механизмах, поддерживающих аллелопатию и развитие разнообразия, фенотипические черты, связанные с аллелопатических сортов могут быть определены и отобраны для дальнейших исследований и использования. Некоторые растения, как известно, аллелопатических качеств ржи, сорго, риса, подсолнечника, рапса и пшеницы13. Во время ранних наблюдений аллелопатиии в сельскохозяйственных культурах, в связи с выдающимися границами роста сорняков в полевых экспериментах, было предложено, что химические вещества были вовлечены, а не конкуренция за ресурсы14. Тем не менее, большинство исследований были полевых экспериментов, которые сделали невозможным устранить конкуренцию в качестве фактора14. Усилия по ликвидации конкуренции уступили место лабораторным и тепличным экспериментам в попытках доказать и количественно определить аллелопатическую активность риса и других культур. Полевые и тепличные методы для проверки растений на аллелопатию показывают, что аллелопатические тенденции присутствуют в обоих условиях выращивания11,15. Некоторые критики считают, что лабораторные скрининги могут иметь только ограниченное значение из-за отсутствия природных условий, которые могут повлиять на результаты15.
Предлагаемый метод скрининга аллелопатического потенциала на заводах обеспечивает достаточные ресурсы и пространство и устраняет ресурсную конкуренцию с использованием лестнивого уклада11,17. Метод был адаптирован и изменен из предыдущих экспериментов, исследующих аллелопатию в дернтраву и ячмень17,18. Эти исследования показали, что аналогичная система была в состоянии дать точные результаты на аллелопатический потенциал целевого завода, устраняя при этом любые сомнения в том, что наблюдения могут быть отнесены к естественной конкуренции. Метод лестницы создает кровеносную систему, в которой питательный раствор из резервуара может проехать через каждое растение в инкубационный лоток через несколько шагов. Электрический насос затем перерабатывает раствор вместе с любыми аллелохимическими веществами, произведенными18. Такой метод эффективен как во времени, так и в пространстве и ресурсах. Он также обеспечивает аналогичные полевые условия для заводов и устраняет любую конкуренцию ресурсов. Методы и инструменты, используемые для скрининга, легко манипулируются в соответствии с желаемыми целями исследования, условиями и конкретными видами. Цель этого исследования заключается в подтверждении сорняков аллелопатии риса через измерения подавления высоты на скотный двор с использованием лестницы шаг метода.
протокол
1. Строительство стенда
ПРИМЕЧАНИЕ: Измерения для древесины перечислены как толщина (см) x ширина (см) x длина (м).
- Нарежьте древесину в соответствующих размерах и суммы: пять 10,16 см х 5,08 см х 0,91 м деревянные штуки, три 10,16 см х 5,08 см х 0,76 м деревянные штуки, три 10,16 см х 5,08 см деревянные штуки, пять 10,16 см х 5,08 см х 0,46 м деревянные штуки , три 10,16 см х 5,08 см х 0,3 м деревянных штук, и три 10,16 см х 5,08 см х 0,15 м деревянных штук.
- Для самого высокого уровня, стоять один 2,44 м борту через две 0,91 м штук на каждом конце на краю и сверлить два винта вертикально в каждом из 0,91 штук. Винт еще один 0,91 м кусок 1,22 м с каждого конца для поддержки, и место 2,44 м борту через заднюю часть 0,91 м стоит и винт на место для поддержки.
ПРИМЕЧАНИЕ: Восемь 3,175 см х 15,24 см х 2,44 м хранятся как есть и неподрезаны, чтобы служить в качестве скамейки для каждого уровня скамейки. - Повторите шаг 1.2 для следующего уровня скамейки с 0,76 м штук.
- Повторите шаг 1.2 для следующей скамейки с 0,61 м штук до шестой скамейке на 0,15 м.
ПРИМЕЧАНИЕ: Для скамейки 3-6 не требуется опорная доска 2,44 м. Окончательный стенд имеет шесть скамеек с тремя вертикальными опорами каждый, по одному на каждом конце и один в середине. - Линия скамейки в порядке убывания высоты с нависающей губой, обращенной к задней касаясь скамейки над ним, что позволяет разрыв между уровнями.
- Линия 0,91 см борту на каждом из нижних краев скамейки вдоль земли и винт скамейки на месте.
- Винт 0,46 м борту горизонтально для поддержки на самых высоких трех скамейках с каждой стороны структуры 0,61 м от земли.
- Винт три угловые скобки на передние концы и центр самой высокой скамейке.
- Винт один 2,54 см х 5,08 см х 20,32 см деревянный кусок через скобки 2,54 см от основания скамейки.
ПРИМЕЧАНИЕ: Сделайте один 0,91 м на 0,91 м на 2,44 м структуры. Обратитесь к рисунку 1 для конечного базового продукта. Размеры могут меняться с учетом экспериментальных потребностей. Описанная структура была разработана, чтобы соответствовать 15,24 см горшки. Высоты между скамейками были разработаны, чтобы соответствовать горшки и растительный материал, используемый в этом эксперименте для того, чтобы поддерживать устойчивый поток аллелохимических и раствор из одного горшка в другой вниз скамейки под действием силы тяжести.

Рисунок 1: Вид спереди деревянного базового стенда. Деревянное основание служит подставкой для образцов растений. Материалы для системы должны быть собраны и добавлены в зависимости от количества образцов, необходимых для эксперимента. В этом исследовании, два стенда служили базой для 31 образцов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
2. Сборка системы
- Снимите крышку с 1 l бутылки соды и распылите краску черной краской.
ПРИМЕЧАНИЕ: Бутылки соды будут служить резервуаром в верхней части системы для одной колонны. Краска обеспечивает блок для света, уменьшая или предотвращая рост водорослей. - В нижней части каждой бутылки соды, просверлить небольшое отверстие, просто достаточно большой, чтобы вставлять 0,35 см внутреннего диаметра (ID), 0,64 см внешнего диаметра (OD), 5,08 см в длину пластиковой трубки ПВХ.
- Смазать слой силиконового водонепроницаемого герметика по краю отверстия после вставки, чтобы предотвратить утечки. Дайте ему высохнуть полностью.
- Повторите шаги 2.2 и 2.3 на каждой из пластиковых посуды, используемой для хранения горшков.
ПРИМЕЧАНИЕ: Четыре блюда будут необходимы для одной колонки. - Снимите крышку и распылите покраску снаружи пластиковых канистр 2,27 л с черной краской. Эти канистры будут служить в качестве резервуаров для сбора в основании каждой колонны.
- Просверлите небольшое отверстие в верхней задней части канистры.
ПРИМЕЧАНИЕ: Поставки, перечисленные в шагах 2.1-2.6 сделать один столбец. Количество столбцов зависит от количества образцов, необходимых для желаемого эксперимента. Для одного образца необходимы две колонки. Все размеры могут меняться в зависимости от экспериментальных потребностей. - После поставки были подготовлены и высушены, поместите бутылку соды на самую высокую скамейку так, что пВХ трубка висит над ободом перед лестницей.
- Чуть ниже бутылки соды на следующей скамейке, место один пластиковый блюдо с трубкой висит над ободом скамейки.
- Повторите шаг 2.8 для следующих двух скамеек.
- Поместите канистру на нижнюю скамейку с отверстием, обращенным к спине.
- Соедините канистру с блюдом над ним, нанизывая трубку из тарелки через отверстие в задней части канистры.
- Мазок водонепроницаемый герметик вокруг края канистры, где трубка проходит через предотвратить утечки.
- Поместите 21 Вт 1000 л / ч погружной электрический насос внутри нижней канистры.
- Подключите 1,07 м в длину, 1,27 см ID, 1,59 см OD ПВХ трубки к сопло электрического насоса.
- Строка трубки через зазор между скамейками и над задней части бутылки соды в верхней части системы.
- Подключите насос в цифровой таймер и установите настройки таймер по мере необходимости.
ПРИМЕЧАНИЕ: Таймер был установлен для запуска в течение 1 минуты каждые 3 ч на протяжении всего эксперимента. Выбранные сроки позволили максимальное количество жидкости в резервуаре для сбора, чтобы циклически и позволило в течение примерно 10 минут потока каждый раз, когда насос был включен, избегая наводнений и побочных эффектов.
3. Посадка
- Стерилизовать все семена риса, необходимые путем промывки в 70% этанола в течение 30 с, замачивания в 5% отбеливателя в течение 20 минут, и промыть 6x с дистиллированной водой.
- Pregerminate стерилизованных семян риса в чашках Петри выстроились с фильтровальной бумагой заполнены 5 мл дистиллированной воды в камере роста, установленной на 25 градусов по Цельсию.
- После прорастения семян, линия нижней части каждого горшка с двумя большими фильтрами кофе, поместив их внутри горшки в их естественной форме cupped.
- Заполните каждый горшок в верхней части фильтра (примерно 75% от горшка) с автоклавированным, промытым и проверенным специально отчищенным кварцевым песком. Смочите песок дистиллированной водой, наливая воду поверх песка или поместив горшки в посадочные лотки заполнены чуть-чуть дистиллированной водой, чтобы горшки, чтобы впитать воду и оставаться влажным. Пересадите шесть предварительно прокорменных саженцев донора в песок, равномерно расставленные.
- Накрыть саженцы песком.
- Пусть саженцы установить в течение 3 недель.
ПРИМЕЧАНИЕ: Песок высыхает очень быстро. Таким образом, размещение горшков в лотки является эффективным методом полива. Изменение воды из постоянно поможет предотвратить плесень. - Pregerminate приемник саженцы растений (E. crus-galli) в чашках Петри 3 недели после посадки донорских растений, выстилая дно блюда с фильтровальной бумагой и вместе с 5 мл дистиллированной воды. Поместите посуду в камеру роста при 25 градусах по Цельсию в течение 3-5 дней.
- Подготовьте горшки, как описано в шагах 3.1-3.2.
- После рассады прорастают, пересадят три саженцы в подготовленные горшки и накройте песком.
ПРИМЕЧАНИЕ: Эксперимент начинается на следующий день после лечения (DAT), или в день, когда приемник растений саженцы возникают и пересаживаются и помещаются в систему.
4. Размещение выборки
- Поместите четыре горшка одного присоединения донорских растений в четыре блюда столбца 1, по одному горшку в ряд. Колонка 1 состоит только из растений-доноров.
- Поместите две кастрюли одного и того же присоединения донорских растений в блюда колонки 2 на первом и третьем ряду колонны.
- Поместите две кастрюли приемных растений в блюда столбца 2 на втором и четвертом ряду в колонке.
- Для каждой репликации убедитесь, что добавляется только один ряд приемника. Две колонны, первая состоящая только из донорских растений, а вторая чередующаяся доноры и приемники, делают одно лечение(рисунок 2).
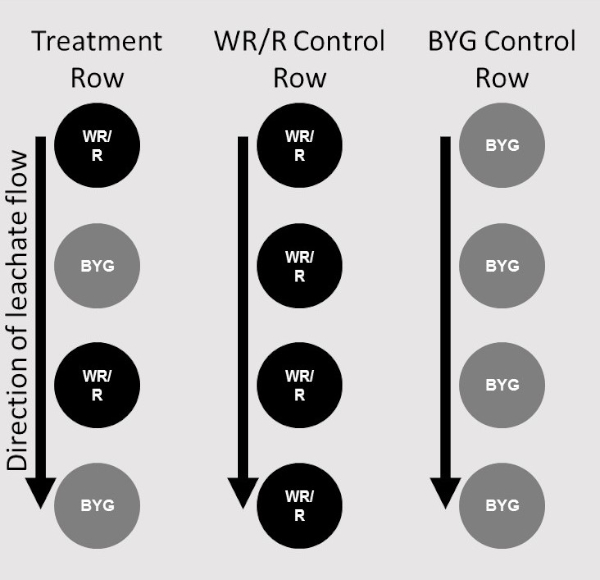
Рисунок 2: Карта размещения. Диаграмма, изображающая размещение донорских (WR/R) и приемных растений (BYG) в соответствующих положениях в системе лестницы. Две колонны лестнивив, а также растения на месте, включают в себя одну обработку. Один столбец заводов приемника служил элементом управления для одной репликации (крайний справа), одной колонки растений-доноров в качестве контроля для каждого присоединения (в центре), а колонка обработки состояла из чередующихся растений донора и приемника (крайний слева). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- Повторите шаги 4.1-4.4 для каждого лечения или присоединения донорского растения(рисунок 3).
ПРИМЕЧАНИЕ: Каждая репликация требует одной колонки образцов завода приемника, чтобы служить в качестве элемента управления для одного репликации. Лечение было реплицировано в 3x в рандомизированном полном блоке.

Рисунок 3: Заключительная структура лестницы. Лестница-шаг система собрана с растениями на месте. Система содержала четыре ряда образцов растений и резервуар для сбора в нижней части для раствора цикла к верхней бутылке и вниз по гравитации через каждый соответствующий горшок. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
5. Операция
- На DAT 1, заполнить сбор бака в нижней части каждой колонки с полупрочной Hoagland решение17 в дистиллированной воде, примерно 1500 мл.
- Установите таймеры для запуска по желанию в автоматическом от настройки.
- Обложка коллекции танков с черным пластиком, чтобы ограничить воздействие света и испарения.
- Заполните баки каждые 2 дня с 500 мл решения Hoagland, чтобы сохранить систему течет постоянно.
- Поддерживать температуру в теплице при температуре 28 градусов по Цельсию в дневное время и 24 градусов по Цельсию ночью, соответственно, с 16/8 ч раскол и влажность на 53%.
6. Сбор данных
- Измерьте и записывайте высоты каждого растения в системе лестницы-шаг на DAT 1 и один раз в неделю до DAT 21, поместив линейку у основания каждого растения и наблюдая за самой высокой листовой подставкой.
- Измерьте и запишите уровни хлорофилла каждого растения на DAT 7 и 14 с использованием счетчика содержания хлорофилла.
- В последний день эксперимента (т.е. DAT 21) этикетка один бумажный пакет для каждого горшка.
- Вырезать образцы растений на базе и поместить в отдельные мешки.
- Поместите все образцы в сушилку для духовки, установленную при температуре 60 градусов по Цельсию при 48 ч16.
- Удалите высушенные образцы и пустое содержимое индивидуально на шкалу и запишите вес в граммах.
7. Анализ данных
- Рассчитайте аллелопатический потенциал растений-доноров на основе процентного ингибирования растения приемника с помощью этого уравнения:
снижение высоты (%) - Рассчитайте уменьшение высоты растения донора в качестве проверки любого обратного эффекта, который завод приемника может оказать на целевые растения.
- Анализ присоединений как фиксированный эффект в то время как репликации и работает являются случайными эффектами18.
- Проанализируйте данные с помощью общей линейной модели со средними значениями, разделенными с использованием защищенной наименее значимой разницы Фишера на уровне или ниже уровня вероятности 0,05 в статистическом программном обеспечении (например, JMP 14).
- Визуализируйте корреляцию между исходными переменными, используя принципиальный компонентный анализ путем загрузки данных.
- Выберите вкладку «Анализ» в панели инструментов, выберите Fit Y by X. Под столбцы выделите ответ (т.е. снижение высоты процента), затем нажмите Y, откликаясь на указать фактор, наблюдаемый для Y,(т.е. снижение высоты процента). Для Фактора X, присоединение Hightlight и нажмите X, фактор,затем выберите OK.
- Выберите красную стрелку вниз на панели анализа Oneway, выберите средства/ANOVA. Снова выберите вниз стрелка на Oneway Анализ бар и выделить сравнить средства, то выберите каждую пару, студента T.
Результаты
Два предварительных скрининга с использованием этого метода были проведены на девяти сорняков риса присоединения (B2, S33, B83, S97, S94, B81, B8, B34, B14) и пять культивируемых рисовых линий (PI338046, Рекс, Рондо, PI312777, CL163). Сорняков риса присоединения и рисовые линии были выбраны на основе их выполнения в...
Обсуждение
Использование аллелопатии потенциально может служить в качестве биологического контроля для сорняков, которые трудно управлять1,7,13. Аллелопатия показала большой потенциал в качестве возможного решения кризиса сорняков в рисе и служ?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Финансирование этого проекта было предоставлено Грантом Специальной исследовательской инициативы, спонсируемой Научно-исследовательской экспериментальной станцией Миссисипи, и основано на работе, которая поддерживается Национальным институтом продовольствия и сельского хозяйства, Министерство сша Сельское хозяйство, Hatch проекта под присоединение номер 230060.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.25 in by 6 in by 8 ft standard severe weather wood board | Lowe's, Mooresville, NC | 489248 | N/A |
| 2 in by 4 in by 8 ft white wood stud | Lowe's, Mooresville, NC | 6005 | Cut into appropriate sizes |
| 63 mm (2.5 in) corner braces | Lowe's, Mooresville, NC | 809449 | N/A |
| Asporto 16 oz Round Black Plastic To Go Box - with Clear Lid, Microwavable – 6.25 in by 6.25 in by 1.75 in - 100 count box | Restaurantware.com, Chicago, IL | RWP0191B | black |
| ATP vinyl-flex PVC food grade plastic tubing, clear, 0.125 in id by 0.25 in od, 100 ft | Amazon, Seattle WA | B00E6BCV0G | N/A |
| Ccm-300 chlorophyll content meter | Opti-Sciences, Inc. Hudson, NH | ccm/300 | N/A |
| Common 1 in by 2 in by 8 ft pine board | Lowe's, Mooresville, NC | 1408 | N/A |
| Contractors choice contractor 24-pack 42-gallon black outdoor plastic construction trash bag | Lowe's, Mooresville, NC | 224272 | Cut to cover collection tanks |
| EURO POTS | Greenhouse Megastore, Danville, IL | CN-EU | 15 cm short black 6 in diameter 4.25 in height 1.37 qt volume |
| Fisher brand petri dish with clear lid | Fisher Scientific, Waltham, MA | FB0857513 | N/A |
| Aexit Ac 220 V-240 V electrical equipment US plug 21 W 1,000 L/hr multipurpose submersible pump | Amazon, Seattle WA | B07MBMYQNT | Nozzle size should fit tubes and can be repaced |
| Woods 50015 WD outdoor 7 day heavy-duty digital outlet timer | Walmart, Bentonville, AR | 565179767 | 20 settings |
| GE silicone 2+ 10.1 oz almond silicone caulk | Lowe's, Mooresville, NC | 48394 | Sealant for edges of any attached tubing |
| Great Value Distilled Water | Walmart, Bentonville, AR | 565209428 | N/A |
| Great Value White Basket coffee filters 200 count | Walmart, Bentonville, AR | 562723371 | Size may vary |
| Grip-rite primgaurd plus #9-3 in pollimerdex screws | Lowe's, Mooresville, NC | 323974 | N/A |
| Hoagland’s No. 2 basal salt mixture | Caisson Laboratories, INC. Smithfield, UT | HOP01/50LT | ½ strength rate |
| JMP (14) | SAS Institute Inc. North Carolina State University, NC | N/A | |
| Project source flat black spray paint | Lowe's, Mooresville, NC | 282254 | N/A |
| Project source utility 1.88 in by 165 ft gray duct tape | Lowe's, Mooresville, NC | 488070 | N/A |
| Rubbermaid 2 qt square food storage canister clear | Walmart, Bentonville, AR | 555115144 | Collection tank discard lid |
| Sealproof unreinforced PVC clear vinyl tubing, food-grade .5 in id by .625 in od, 100 ft | Amazon, Seattle WA | B07D9CLGV3 | Connects to pump |
| Short Mountain Silica 50 lb Play sand | Lowe's, Mooresville, NC | 10392 | Sand should be purified |
| Steve Spangler's 1 L Soda Bottles - 6 Pack - For Science Experiment Use | Amazon, Seattle WA | UPC 192407667341 | Top step tank discard lid |
Ссылки
- Weston, L. A. History and Current Trends in the Use of Allelopathy for Weed Management. HortTechnology. 15 (3), 529-534 (2005).
- Pratley, J. E. Allelopathy in annual grasses. Plant Protection Quarterly. 11, 213-214 (1996).
- Bertin, C., Yang, X., Weston, L. A. The role of root exudates and allelochemicals in the rhizosphere. Plant and Soil. 256 (1), 67-83 (2003).
- Stevenson, G. R. Pesticide Use and World Food Production: Risks and Benefits. Environmental Fate and Effects of Pesticides. American Chemical Society. , 261-270 (2003).
- Chopra, N., Tewari, G., Tewari, L. M., Upreti, B., Pandey, N. Allelopathic Effect of Echinochloa colona L. and Cyperus iria L. Weed Extracts on the Seed Germination and Seedling Growth of Rice and Soybean. Advances in Agriculture. 2017, 1-5 (2017).
- Jabran, K., Mahajan, G., Sardana, V., Chauhan, B. S. Allelopathy for weed control in agricultural systems. Crop Protection. 72, 57-65 (2015).
- Worthington, M., Reberg-Horton, C. Breeding Cereal Crops for Enhanced Weed Suppression: Optimizing Allelopathy and Competitive Ability. Journal of Chemical Ecology. 39, 213-231 (2013).
- Sudianto, E., et al. Corrigendum to "Clearfield (R) rice: Its development, success, and key challenges on a global perspective.". Crop Protection. 55, 142-144 (2014).
- Gressel, J., Valverde, B. E. A strategy to provide long-term control of weedy rice while mitigating herbicide resistance transgene flow, and its potential use for other crops with related weeds. Pest Management Science. 65, 723-731 (2009).
- Muthayya, S., Sugimoto, J. D., Montgomery, S., Maberly, G. F. An overview of global rice production, supply, trade, and consumption. Annals of the New York Academy of Sciences. 1324, 7-14 (2014).
- Chung, I. M., Kim, K. H., Ahn, J. K., Lee, S. B., Kim, S. H. Allelopathy Comparison of Allelopathic Potential of Rice Leaves, Straw, and Hull Extracts on Barnyardgrass. Agronomy Journal. 95 (4), 1063-1070 (2003).
- Olofsdotter, M., Jensen, L. B., Courtois, B. Improving crop competitive ability using allelopathy Ð an example from rice. Journal of Plant Breeding. 121, 1-9 (2002).
- Olofsdotter, M., Navarez, D., Rebulanan, M., Streibig, J. C. Weed-suppressing rice cultivars-does allelopathy play a role. Weed Research. 39 (6), 441-454 (1999).
- Jensen, L. B., et al. Locating Genes Controlling Allelopathic Effects against Barnyardgrass in Upland Rice. Agronomy Journal. 93 (1), 21-26 (2001).
- Kuijken, R. C., Eeuwijk, F. A. V., Marcelis, L. F., Bouwmeester, H. J. Root phenotyping: from component trait in the lab to breeding. Journal of Experimental Botany. 66 (18), 5389 (2015).
- Lickfeldt, D. W., Voigt, T. B., Branham, B. E., Fermanian, T. W. Evaluation of allelopathy in cool season turfgrass species. International Turfgrass Society. 9, 1013-1018 (2001).
- Liu, D. L., Lovett, J. V. Biologically active secondary metabolites of barley: Developing techniques and assessing allelopathy in barley. Journal of Chemical Ecology. 19, 2217-2230 (1993).
- Shrestha, S. . Evaluation of Herbicide Tolerance and Interference Potential among Weedy rice germplasm. , (2018).
- Kim, K. U., Shin, D. H., Olofsdotter, Rice allelopathy research in Korea. Allelopathy in Rice. IRRI. , (1998).
- Quasem, J. R., Hill, T. A. On difficulties with allelopathy. Weed Research. 29, 345-347 (1989).
- Singh, S., et al. Evaluation of mulching, intercropping with Sesbania and herbicide use for weed management in dry-seeded rice (Oryza sativa L.). Crop Protection. 26, 518-524 (2007).
- Kong, C. H., Li, H. B., Hu, F., Xu, X. H., Wang, P. Allelochemicals released by rice roots and residues in soil. Plant and Soil. 288 (1-2), 47-56 (2006).
- Ervin, G. N., Wetzel, R. G. Allelochemical autotoxicity in the emergent wetland macrophyte Juncus effusus (Juncaceae). American Journal of Botany. 87 (6), 853-860 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены