Method Article
Aislamiento y expansión de las neuroesferas de los nichos neurogénicos de ratón (P1-3)
En este artículo
Resumen
En este artículo, describimos, en detalle, un protocolo para la generación de cultivos de la neurosfera a partir de células madre neurales de ratón postnatal derivadas de los principales nichos neurogénicos del ratón. Las neuroesferas se utilizan para identificar las células madre neurales del tejido cerebral permitiendo la estimación de los números de células precursoras. Además, estas estructuras 3D se pueden placar en condiciones diferenciativas, dando lugar a neuronas, oligodendrocitos y astrocitos, permitiendo el estudio del destino celular.
Resumen
El ensayo de la neurosfera es una técnica in vitro extremadamente útil para estudiar las propiedades inherentes de las células neurales del tallo/progenitor (NSPC), incluida la proliferación, la autorenovación y la multipotencia. En el cerebro postnatal y adulto, los SCP están presentes principalmente en dos nichos neurogénicos: la zona subventricular (SVZ) que recubre los ventrículos laterales y la zona subgranular del giro dento del hipocampo (DG). El aislamiento de los nichos neurogénicos del cerebro postnatal permite obtener una mayor cantidad de SSPen en el cultivo con la consiguiente ventaja de mayores rendimientos. El estrecho contacto entre las células dentro de cada neuroesfera crea un microambiente que puede parecerse a nichos neurogénicos. Aquí, describimos, en detalle, cómo generar cultivos de neurosfera derivados de SVZ y DG a partir de ratones de 1 a 3 días de edad (P1-3), así como el passaging, para la expansión de la neuroesfera. Este es un enfoque ventajoso ya que el ensayo de la neurosfera permite una rápida generación de clones NSPC (6-12 días) y contribuye a una reducción significativa en el número de uso animal. Mediante la peuropación de chapado en condiciones diferenciativas, podemos obtener una pseudomonocapa de células compuestas de SCP y células diferenciadas de diferentes linajes neuronales (neuronas, astrocitos y oligodendrocitos) permitiendo el estudio de las acciones de factores intrínsecos o extrínsecos en la proliferación, diferenciación, supervivencia celular y neuritogénesis.
Introducción
El ensayo de la neurosfera (NSA) fue descrito en primer lugar en 19921,2 y sigue siendo una herramienta única y poderosa en la investigación de células madre neurales (NSC). El aislamiento de los SCN de las principales regiones neurogénicas tiene problemas desafiantes porque los requisitos para mantener estas células en condiciones fisiológicas siguen siendo poco comprendidos. En la NSA, las células se cultivan en un medio libre de suero definido químicamente con la presencia de factores de crecimiento, incluyendo el factor de crecimiento epidérmico (EGF) y el factor de crecimiento de fibroblastos básico (bFGF)1,2,3. Las células precursoras neuronales (stem y progenitores) se seleccionan mediante el uso de estos mitógenos ya que estas células son eGF y FGF-responsive entrar en un período de proliferación activa, mientras que otras células, a saber, células diferenciadas, mueren4. Las células precursoras neuronales crecen como neuroesferas, que luego se pueden pasar para ampliar aún más la reserva de estas células5. Es importante destacar que, dado que estas células progenitoras del tallo neural neural (SSPC) son multipotentes son capaces de diferenciarse en los tres tipos principales de células del sistema nervioso central (SNC): neuronas, oligodendrocitos y astrocitos5.
La NSA proporciona una fuente renovable de precursores indiferenciados del SNC, que se puede utilizar para estudiar varios procesos, incluyendo la proliferación y la autorenovación de la NSC, y la diferenciación neuronal y glial, tanto en el contexto fisiológico como de la enfermedad. Además, los estudios in vitro se pueden utilizar para evaluar el grado de especificación intrínseca presente en los precursores neuronales durante el desarrollo, así como para estudiar todo el potencial de las células, mediante la eliminación de señales extrínsicas asociadas con su entorno normal6. El modelo de la neuroesfera es valioso para evaluar los reguladores putativos ya que al mantener las células en un medio desprovisto de suero, las señales ambientales sólo son proporcionadas por las células circundantes6. Además, en la NSA, los NSCCP se expanden fácilmente en cultivo, la densidad de células por área es alta y la composición heterogénea de las neuroesferas tiene alguna similitud con nichos in vivo6. Estas ventajas bien establecidas son la razón por la que esta metodología ha sido ampliamente utilizada por muchos investigadores.
El siguiente protocolo describe en detalle todos los procesos desde el aislamiento de la población de NSPC posnatal de las dos regiones neurogénicas principales, la zona subventricular (SVZ) y el giro dentate hipocampal (DG), hasta la expansión de esas células como neuroesferas, así como la diferenciación en neuronas, astrocitos y oligodendrocitos. Por último, también se describen diferentes ensayos para acceder a las propiedades de la talla y la multipotencia de los SSCP derivados de las SVZ y la DG.
Protocolo
Todos los experimentos se realizaron de conformidad con la legislación de la Comunidad Europea (86/609/CEE; 2010/63/UE; 2012/707/UE) y portuguesa (DL 113/2013) para la protección de los animales utilizados con fines científicos. El protocolo fue aprobado por el "Organismo Institucional de Bienestar Animal - ORBEA-iMM y la autoridad nacional competente - DGAV (Direc-o Geral de Alimentao e Veterinária)."
1. Configuración básica y preparación del medio de cultivo
- El día de la disección, preparar la cantidad adecuada de medio de crecimiento correspondiente al medio libre de suero (SFM) compuesto por el medio águila modificado de Dulbecco [(DMEM)/F12 con L-glutamina](Tabla de Materiales)complementado con 100 U/ml de penicilina y 100 g/mL de estreptomicina (lápiz/estreptococo), 1% B27, con también 10 ng/mL EGF y 5 ng/mL bFGF. Calentar el medio de cultivo a 37 oC en un baño de agua.
NOTA: El volumen del medio de crecimiento depende del número de cachorros, para 5 cachorros preparan 100 ml (50 ml para SVZ y 50 ml para DG); sin embargo, después de contar el número de celdas (paso 5.1) el volumen exacto tendrá que ser ajustado. - Para la microdisección de SVZ y DG, prepare el medio de disección solución salina equilibrada (HBSS) libre de calcio y magnesio complementado con 100 U/ml de pluma/estreptococo.
NOTA: Prepare 50 a 100 ml de medio de disección. - Configure un microscopio de disección y prepare las herramientas necesarias para eliminar el cerebro (tijeras y espátulas pequeñas) y para microdisecciones SVZ y DG (tijeras pequeñas dumont, #7 fórceps, #5 fórceps, #5S fórceps) empapadando en 70% de etanol.
2. Cosecha de cerebros de ratón postnatal (P1-3) y microdisecciones SVZ/DG
- Preparar platos Petri de 60 mm (área de crecimiento 21 cm2) con HBSS complementado con bolígrafo/estreptococo y 2 tubos de muestra (uno para SVZ y otro para DG) con 500 ml de HBSS suplementado cada uno.
- Euthanizar cachorros de ratones (P1-3) de acuerdo con el protocolo aprobado por las instalaciones/directrices de cuidado de animales institucionales. Realizar la decapitación con una sola incisión con tijeras afiladas en la base del tronco encefálico.
- Sosteniendo la parte ventral del cuerpo en la base de la cabeza y usando pequeñas tijeras puntiagudas, hacer una incisión de línea media en la piel a lo largo de toda la longitud de la cabeza, revelando así la superficie del cráneo.
- Hacer una incisión longitudinal en la base del cráneo y continuar cortando a lo largo de la sutura sagital utilizando pequeñas tijeras con un ángulo poco profundo como sea posible con el fin de evitar dañar las estructuras cerebrales.
- Pelar el cráneo a los lados usando fórceps curvos y exponer el cerebro.
ADVERTENCIA: Asegúrese de que los instrumentos de diseción estén libres de etanol antes de tocar el cerebro. - Aislar el cerebro del cráneo usando una pequeña espátula, deslizándose debajo de la base del cerebro para cortar los nervios craneales y los vasos sanguíneos que están conectados a la base del cerebro, y transferir el cerebro en una placa Petri que contiene solución de HBSS suplementada en frío.
- Coloque la placa Petri que contiene el cerebro bajo un microscopio de disección con bajo aumento y coloque el cerebro en su superficie dorsal.
- Usando fórceps finos, retire las meninges del lado ventral del cerebro y las bombillas olfativas, mientras mantiene el cerebro en posición por el cerebelo. Gire el cerebro sobre el aspecto ventral y despegue el resto de las meninges.
NOTA: La eliminación de las meninges dorsales es un paso crucial para asegurar el corte correcto del cerebro. - Deseche el cerebelo haciendo un corte usando fórceps. Coloque un papel de filtro con un tamaño de poro de 11 m en un helicóptero de tejido(Tabla de materiales)y coloque el cerebro en el papel de filtro usando fórceps de punta curva. Corta el cerebro en secciones coronales de 450 m y usa una lámina húmeda para recoger el cerebro seccionado en un nuevo plato de Petri lleno de HBSS suplementado en frío.
- Para diseccionar la SVZ, usa fórceps para separar las rodajas coronales de una manera de anterior a posterior hasta llegar a las rodajas con los ventrículos laterales, bajo un microscopio de disección.
- Cortar la capa delgada de tejido que rodea la pared lateral de los ventrículos (que corresponde a la SVZ) con fórceps finos, excluyendo el parénquima estriado y el cuerpo calloso. Aislar la SVZ colocando la punta de los fórceps en las esquinas laterales del ventrículo lateral: uno inmediatamente debajo del cuerpo calloso y el otro en el tejido inmediatamente adyacente a la zona ventral del ventrículo lateral. Luego, corte una pequeña línea de tejido que rodea el ventrículo lateral.
- Recoger el tejido diseccionado en un tubo de muestra con solución suplementada de HBSS previamente identificada como SVZ.
NOTA: Excluya la SVZ en rodajas donde comiencen a aparecer tanto los ventrículos laterales como la formación del hipocampo. - Ir a través de todas las rebanadas después de la microdisección SVZ de una manera anterior a posterior y llegar a la formación del hipocampo. El uso de fórceps descarta la primera rebanada con hipocampo donde DG sigue siendo irreconocible.
- Para eliminar la DG, primero aísle el hipocampo de las rebanadas. Vuelva a enfocar el microscopio para visualizar los bordes alrededor de DG.
- Diseccionar la parte DG realizando un corte entre la región DG y CA1 seguido de un corte vertical entre la región DG y CA3 utilizando fórceps. Retire la fimbria y cualquier tejido adyacente.
NOTA: En los animales P1-3, la DG es casi indistinguible del cuerno de Ammón, pero muestra una pequeña punta. - Recoger el tejido diseccionado en un tubo de muestra que contenga soluciones suplementadas de HBSS previamente identificadas como DG.
NOTA: La lesión general en el hipocampo o en los alrededores hará más difícil aislar la DG. El uso de un atlas del cerebro del ratón postnatal es esencial cuando el usuario no está familiarizado con el aislamiento de la SVZ y el tejido DG de las secciones coronales.
3. Disociación de tejidos
- Para disociar el tejido SVZ y DG presente en sus respectivos tubos, agregue trippsin-EDTA 0,05% para tener una concentración final de 5-10% de trippsina-EDTA 0,05% en HBSS. Incubar durante aproximadamente 15 min a 37 oC, hasta que el tejido se agrupe.
- Lavar el tejido de la trippsina retirando el medio y añadiendo 1 ml de nueva solución suplementada de HBSS por 4 veces consecutivas.
- Retire el HBSS y resuspenda el tejido digerido en 1 ml de SFM complementado con 10 ng/ml de EGF y 5 ng/mL bFGF. Disociar mecánicamente el pellet pipeteando suavemente hacia arriba y hacia abajo aproximadamente 7 x 10 veces utilizando una pipeta P1000, hasta obtener una solución celular homogénea.
ADVERTENCIA: Una disociación mecánica excesiva puede conducir a un aumento de la muerte celular y afectará negativamente el crecimiento celular posterior.
4. Ensayo de par de células para estudiar el destino celular
- Antes del experimento, prepare placas recubiertas de 24 pocillos para cultivos monocapa adherentes de acuerdo con las secciones 8-10.
- Para contar el número de células SVZ o DG (obtenidas en la sección 3) que se van a chapar, utilice una solución que contenga 0.2% de color azul Trypan y cuente las células usando un hemogómetro.
- Diluir la suspensión celular disociada en SFM suplementada con 5 ng/ml EGF y 2,5 ng/mL bFGF (bajo EGF/bFGF) a una densidad de 11.300 células/cm2 y placarlas en cubiertas de vidrio recubierto.
- Después de las 24 h, fijar las células para la inmunocitoquímica contra marcadores NSC como sexo determinante región Y-caja 2 (Sox2) y nestin, así como con un marcador del linaje neuronal (a saber, doublecortin [DCX], para las neuronas inmaduras) (ver sección 14).
NOTA: Sox2 es un marcador de SCN que se someten a mitosis. Sox2+/+ pares celulares resultantes de una sola división celular progenitor a refleja la expansión de células madre7.
5. Expansión de las células madre neurales postnatales como neuroesferas
- Para determinar la densidad de la suspensión celular SVZ o DG disociada (obtenida en la sección 3), cuente las células utilizando un hematitómetro.
- Diluir SVZ y DG suspensión de células simples a una densidad de 2 x 104 células/ml en SFM complementado con 10 ng/mL EGF y 5 ng/mL bFGF. Células SVZ y DG de semillas en platos Petri de 60 mm sin recubrimiento con un volumen final de plato de 5 ml/Petri.
- Incubar células SVZ y DG durante 6 a 8 días y 10 a 12 días, respectivamente para formar neuroesferas primarias, a 37 oC con un 5% de CO2.
NOTA: Los días de incubación más que los mencionados pueden promover la agregación de las neuroesferas y mayores niveles de muerte celular en el centro de la neuroesfera. - Cuando la mayoría de las neuroesferas tienen un diámetro de 150-200 m, realizar el paso de la neuroesfera.
NOTA: El paso de las neuroesferas cuando no tienen un diámetro adecuado compromete todos los pasos siguientes.
6. El paso de las neuroesferas
NOTA: El siguiente protocolo se puede aplicar para ampliar las neuroesferas SVZ y DG.
- Para pasar las neuroesferas, recoger el SFM con factores de crecimiento que contienen neuroesferas de los platos Petri de 60 mm y centrífuga durante 5 min a 300 x g.
- Desechar el sobrenadante y resuspender el pellet de la neuroesfera utilizando un kit de disociación química (ratón) de acuerdo con las instrucciones del fabricante(Tabla de materiales).
NOTA: Observe los tiempos de incubación con precisión, ya que son cruciales para el rendimiento. - Centrífuga durante 5 min a 300 x g,retire el sobrenadante y agregue 1 ml de SFM complementado con 10 ng/mL EGF y 5 ng/mL bFGF.
- Triturar hacia arriba y hacia abajo aproximadamente 10 veces con una pipeta P1000 para disociar las neuroesferas.
- Cuente el número de células que utilizan una solución que contiene 0.2% de color azul Trypan y un hematómetro.
- Células resembradas a una densidad de 2 x 104 células/ml en platos Petri de 60 mm sin recubrimiento.
- Incubar células SVZ y DG durante 6 a 8 días y 10 a 12 días, respectivamente para obtener neuroesferas secundarias, a 37 oC con 5% de CO2.
NOTA: Se puede acceder a la capacidad de autorenovación de los SVZ y DG derivados de los SCCP siguiendo las secciones 5 y 6 del protocolo. Para ello, las células SVZ y DG de semillas a una densidad de 1,0 x 104 células/ml (en placas de 24 pocillos sin recubrimiento) en medio SFM de crecimiento que contiene 5 ng/mL EGF y 2,5 ng/mL bFGF (bajo EGF/bFGF). Cuente el número de neuroesferas primarias y secundarias resultantes.
7. Almacenamiento de neuroesferas
- Recoger el medio que contiene las neuroesferas (obtenido de los pasos 5.3 y 6.7) de los platos Petri de 60 mm.
- Centrífuga durante 5 min a 300 x g y desechar el sobrenadante.
- Lavar las células 2x con 1 ml de HBSS (5 min a 300 x g).
- Centrífuga durante 5 min a 300 x g,desechar el sobrenadante y almacenar el pellet de las neurosferas a -20 oC para el análisis de la biología molecular.
8. Procedimiento de placa de recubrimiento PDL
- Para preparar la solución 1 (tampón de borato de 0,1 M), pesar 3,92 g de ácido bórico y diluir en 400 ml de agua de alta pureza. Ajuste el pH a 8,2 y haga hasta 500 ml con agua de alta pureza.
- Para preparar la solución 2 (tampón de borato de 0,167 M), pesar 10,3 g de ácido bórico y diluir en 900 ml de agua de alta pureza. Ajuste el pH a 8,2 y haga hasta 1.000 ml con agua de alta pureza.
- Para reconstituir poli-D-lisina (PDL) (1 mg/ml en tampón de borato de 0,1 M), diluir 100 mg de PDL en 100 ml de solución 1.
- Hacer alícuotas de 10 ml para usar inmediatamente o congelar y almacenar a -20 oC.
- Bajo el flujo laminar, añadir 1 cubreobjetos por pozo y esterilizar bajo luz UV durante 15 min.
- Utilice la PDL reconstituida o el deshielo congelado de la PDL reconstituida.
- Prepare la solución final de 100 g/ml PDL en tampón de borato de 0,167 M añadiendo 10 ml de PDL reconstituido a 90 ml de solución 2.
- Añadir la solución final a los pozos durante un mínimo de 2 h a la noche a 37 oC.
NOTA: Para placas de 24 pocillos, añada un volumen de 500 ml en cada poca. - Retire la solución y lave 3veces con agua de alta pureza.
- Deje que los cubreobjetos se sequen en la campana de flujo laminar.
- Deje las placas de cultivo de varios pozos a 4oC.
9. Procedimiento de placa de recubrimiento PDL/Laminin
- En el día 1, cubra las placas con PDL como se describe en la sección 8.
- El día 2, retire la solución PDL y lave 3 veces con agua de alta pureza. Dejar secar.
- Preparar 5 g/ml de laminin en SFM frío carente de factores de crecimiento.
- Añadir laminina disuelta a las cubiertas y incubar a 37 oC durante la noche.
NOTA: Para placas de 24 pocillos, añada un volumen de 500 ml en cada poca. - Retire el laminin con una pipeta.
NOTA: No lave los labios de la minina. - Usar inmediatamente o almacenar a -20 oC.
10. Procedimiento de recubrimiento de poli-L-ornitina (PLO) /laminina
- Debajo del flujo laminar, añadir un cubreobjetos por pozo y esterilizar bajo luz UV durante 15 min.
- Añadir 0.01% de solución PLO a cada pozo durante 20 min a temperatura ambiente (RT).
NOTA: Para placas de 24 pocillos, añada un volumen de 500 ml en cada poca. - Retire la solución y lave 3 veces con PBS esterilizado 1x. Dejar secar.
- Preparar 5 g/ml de laminin en 1x PBS estéril.
- Incubar durante 2 h a 37oC.
- Retire el laminin.
NOTA: No lave los labios de la minina. - Utilícelo inmediatamente.
NOTA: Asegúrese de que el tapón esté completamente cubierto por la solución DeLP tocando suavemente el tapón con una punta de pipeta. Cuando se agitan, las placas multi-pozo no deben hacer ningún sonido.
11. Evaluación de la neuritogénesis mediante la generación de una monocapa diferenciada de células
- Recoger los medios que contengan neuroesferas de 60 mm de platos Petri (obtenidos de la sección 5) y centrífuga durante 5 min a 300 x g a RT.
- Desechar el sobrenadante y disociar el pellet de las neuroesferas en 1 ml de disociación PBS (es decir, PBS sin Mg2+/Ca2+ y con EDTA [2,7 mM KCl, 1,5 mM KH2PO4, 137 mM NaCl, 8,1 mM Na2HPO4 y 0,5 mM EDTA 4Na, a pH a 7,40]) incubando durante 15 min seguida de disociación mecánica. Alternativamente, disociar las neuroesferas utilizando un kit de disociación química (ratón) (Tabla de materiales).
- Centrífuga durante 5 min a 300 x g en RT y desechar el sobrenadante.
- Resuspender el pellet celular en 1 ml de SFM desprovisto de factores de crecimiento.
- Determinar la densidad celular utilizando un hematitómetro.
- Diluir la suspensión celular disociada en SFM carente de factores de crecimiento a una densidad de 3.766 células/cm2 y células de placa en cubiertas de vidrio recubiertas en placas de 24 pocillos.
- Después de 1 o 3 días, fijar las células para la inmunocitoquímica contra una proteína del citoesqueleto (ver sección 14).
12. Diferenciación de cultivos de la neuroesfera
NOTA: Las neuroesferas obtenidas de la expansión celular, ya sea a partir de neuroesferas primarias o pasajeras (obtenidas en las secciones 5 o 6) se pueden diferenciar en células de diferentes linajes neuronales.
- Cuando las neuroesferas tengan un diámetro de 150 a 200 m, recoja 25 ml de medio de suspensión de la neuroesfera y placa en cubiertas de vidrio recubiertas, en placas de 24 pocillos.
NOTA: Para recoger más neuroesferas, gire suavemente la placa Petri para concentrar las neuroesferas en el centro. Luego, pipeta del centro. - Poner las placas en una incubadora a 37 oC durante 15 minutos para que las neuroesferas se adhieran al sustrato. A continuación, añadir 500 s de SFM carente de factores de crecimiento (condiciones diferenciativas).
- Después de 24 h, reemplace el medio por un SFM fresco carente de factores de crecimiento.
- Diferenciar para diferentes puntos de tiempo (por ejemplo, 2 y 7 días in vitro, DIV2 y DIV7, respectivamente) con 5% co2 y 95% de aire atmosférico a 37 oC.
NOTA: La supervivencia celular, la proliferación y la diferenciación se pueden analizar utilizando diferentes ensayos celulares.
13. Ensayos de biología celular
- Ensayo de supervivencia celular
- Exponga las neuroesferas chapadas a un yoduro de propiduro (PI) de 3 g/ml durante 30 minutos antes de la fijación celular en la incubadora a 37 oC.
NOTA: PI es un agente autofluorescente que sólo es capaz de entrar en células con integridad de membrana comprometida8. Se pueden utilizar otros métodos para analizar la supervivencia celular, como la tinción de la caspasa 3 o el ensayo de etiquetado de punta de soroxinucleordendilar transferasa terminal (TUNEL).
- Exponga las neuroesferas chapadas a un yoduro de propiduro (PI) de 3 g/ml durante 30 minutos antes de la fijación celular en la incubadora a 37 oC.
- Ensayo de proliferación celular
- Exponga las neuroesferas chapadas a 10 m 5-bromo-2'-desoxiuridina (BrdU) durante 4 h antes de la fijación en la incubadora a 37 oC.
NOTA: BrdU es un análogo sintético de timidina que se puede incorporar durante la síntesis de ADN en células proliferantes9.
- Exponga las neuroesferas chapadas a 10 m 5-bromo-2'-desoxiuridina (BrdU) durante 4 h antes de la fijación en la incubadora a 37 oC.
- Ensayo de diferenciación celular
- Exponga las neuroesferas chapadas de 7 días de edad a 10 m de Brdu en las primeras 24 h, en la incubadora a 37 oC.
- Renovar el SFM desprovisto de factores de crecimiento (condiciones diferenciadoras) y permitir que las células se desarrollen en ausencia de BrdU durante los siguientes 6 días hasta la fijación.
NOTA: Estos experimentos de búsqueda de pulsos, mediante el etiquetado mediante el etiquetado mediante marcadores de células neuronales maduras, permiten la evaluación de células progenitoras que se diferencian en células maduras durante el protocolo.
14. Inmunomanchación de cultivos de la neurosfera
- Fijación celular
- Preparar un 4% de paraformaldehydo (PFA) en 1pbS y almacenar a 4 oC o -20 oC.
- Retire el SFM desprovisto de factores de crecimiento de los pozos y agregue, a cada pocal, 500 oL de 4% de PFA a 4 oC durante 20 min a RT.
- Lavar 3x con 1x PBS, durante 5 min cada vez, las cubiertas que contienen neuroesferas diferenciadas.
- Conservar los cubreobjetos hasta que se utilicen en 500 oC de 1pbS a 4 oC.
NOTA: Si el experimento no tiene BrdU, vaya al paso 14.3.
- Método de desnaturalización (solo para experimentos BrdU)
- Preparar 1 M HCl a 37oC.
- Enjuague los labios de las cubiertas 3veces en 1x PBS.
- Permeabilizar las células durante 30 minutos en PBS que contienen 1% de tensioactivo no iónico (por ejemplo, Tritón X-100).
- Desnaturalidad dsDNA con 1 M HCl precalentado a 37oC durante 30 o 40 min a 37 oC (300 oC/pozo).
- Lavar los pozos 4veces con 1x PBS.
- Permeabilización y bloqueo
- Enjuague los cubreobjetos en 1pbS durante 5 min.
- Incubar durante 1,5 h con un tensioactivo no iónico al 0,5% y una albúmina sérica bovina (BSA) al 3% en 1pbS (300 ol/pozo).
NOTA: Para NeuN, utilice 6% de BSA en 1pbS.
- Incubación y montaje
- En el día 1, sin lavar, incubar células con anticuerpos primarios(Tabla de Materiales)en tensioactivo no iónico al 0,1% y 0,3% de BSA en 1x PBS en la cámara de incubación (para placas de 24 pocillos utilizan 20 l/pozo). Deje los cubreobjetos incubando durante la noche a 4 oC de luz protegida si los anticuerpos se conjugan con un fluoróforo.
- En el día 2, devolver las tapasde los labios a sus respectivos pozos y enjuagar 3veces en 1x PBS durante 5 min.
- Contramancha con anticuerpos secundarios conjugados por fluorescencia apropiados (dilución 1:200) y con Hoechst 33342 de 12 o menospara la fluorescencia para 2 h a RT y luz protegida en la cámara de incubación (20 l/tapa).
- Lavar los labios de las cubiertas 3x en 1x PBS durante 5 min.
- Monte los cubreobjetos en las guías del microscopio utilizando 5 l/tapa de medio de montaje de fluorescencia.
- Deje que los cubreobjetos se sequen al aire en RT, protegidos de la luz, durante 1 día.
- Microscopía
- Vea y adquiera imágenes utilizando un microscopio de fluorescencia.
- Para cada condición, utilice tres réplicas. Realice recuentos celulares en cinco campos microscópicos independientes en cada cubreportada con un objetivo de 40x (100 células por campo).
15. Preparación de soluciones de stock de EGF y bFGF
- Solución de stock eGF
- Para reconstituir eGF liofilizado, diluir el producto en agua de alta pureza para alcanzar una concentración final de 20 g/ml.
- Aliquot y almacenar en microtubos a -5 a -20 oC.
- solución bursátil bFGF
NOTA: bFGF debe reconstituirse con una solución de 10 mM Tris, pH 7.6.- Centrifugar el vial brevemente antes de abrirlo para llevar el contenido al fondo.
- Preparar 50 mL de 10 mM Tris, pH 7.6. Para ello, pese 60,57 mg de Tris ((HOCH2)3CNH2) y diluya en 40 ml de agua de alta pureza. Ajuste el pH a 7,6 y haga hasta 50 ml con agua de alta pureza.
- Preparar 10 mL de 0,1% de BSA en Tris de 10 mM, pH 7,6. Para ello, pesar 10 mg de BSA y diluirlo en 10 ml de 10 mM Tris.
- Soluciones de filtro preparadas en los pasos 15.2.2 y 15.2.3 con un filtro de 0,22 m bajo una campana de flujo laminar.
- Reconstituir 10 g de bFGF en 1.000 éL de 0,1% de BSA en Tris de 10 mM con pH 7,6 para alcanzar una concentración final de 10 g/ml. Aliquot en microtubos a -20oC durante un máximo de 6 meses.
Resultados
Las neuroesferas SVZ y DG, obtenidas mediante el uso de la NSA, se componen de células indiferenciadas, positivas para Sox2, un factor de transcripción implicado en la capacidad de auto-renovación y positivo para la nestina, una proteína de filamento intermedio expresada en SSPCs(Figura 1A). Además, las neuroesferas derivadas de SVZ tienen dimensiones mayores que sus contrapartes DG(Figura 1A). Es importante destacar que, en condiciones diferenciadoras, los SSCP derivados de SVZ y DG migran fuera de las neuroesferas formando una pseudomonocapa de células(Figura 1B).
Para acceder a la capacidad de auto-renovación, el ensayo de par celular se realiza en base a la expresión de Sox2 y nestin que tiende a desaparecer en la división de células que inician el proceso de diferenciación con una combinación de un marcador del linaje neuronal a saber, DCX. En ambas regiones neurogénicas, es posible observar la presencia de divisiones simétricas Sox2+/+/nestin+/+/DCX-/- (autorenovación)(Figura 2A1,B1),Sox2-/+/nestin-/+/DCX+/- divisiones asimétricas(Figura 2A1,B2)y Sox2-/-/nestin-/-/DCX+/+ división simétrica(figura 2)A2,B1
El paso de las neuroesferas aumenta el rendimiento de los SSPS; sin embargo, la muerte celular en DIV2 cambia con el passaging. De hecho, el porcentaje de células PI-positivas se incrementa con el paso de la célula en SVZ (P0: 15,6% a 1,2% frente a P1: 19,2% a 2,7% frente a P2: 32,35% a 0,14% frente a P3: 39,6% a 4,0%) y en DG (P0: 16,31% a 0,95% frente a P1: 32,1% a 1,7% frente a P2: 27,42% frente a P3: 32,2% a 3,1%) (Figura 3).
La neuritogénesis se puede evaluar en neuronas obtenidas a partir de la diferenciación de SVZ y DG NSPCs al comienzo de la diferenciación: DIV1 (Figura 4A,D),DIV2(Figura 4B,E) y DIV3(Figura 4C,F). De hecho, como se observa en la Figura 4,la longitud y ramificación de los neurótesis aumenta con la diferenciación.
La proliferación celular se puede evaluar en las neuroesferas derivadas de SVZ y DG. Comparación de las neuroesferas diferenciadas primarias en DIV1 de SVZ(Figura 5A1) y DG(Figura 5A2), el porcentaje de células con positivo BrdU es mayor en SVZ que en DG (SVZ: 6,15% a 0,64% frente a DG: 3,27% a 0,13%; p < 0,05; n a 4; Figura 5A3). Además, también se puede acceder a la diferenciación celular combinando la tinción de BrdU con un fabricante maduro como los núcleos neuronales (NeuN) que identifica las neuronas maduras(Figura 5B1,B2). La Figura 5B3 muestra que el porcentaje de progenitores proliferantes que se diferencian en neuronas maduras es similar en SVZ y DG (SVZ: 12,04% a 1,58% vs DG: 13,56% a 0,48%; p > 0,05; n a 4).
Se puede acceder a la tallo y la multipotencia de los SVZ y DG derivados de los SSCP utilizando la NSA mediante la evaluación de la expresión de diferentes marcadores en diferentes días de diferenciación (DIV2 y DIV7). De hecho, las NSC (proteína ácida fibrilar nestin a glial [GFAP]-células dobles positivas) están presentes en ambas regiones neurogénicas(Figura 6A, G). Estas células son capaces de diferenciarse en neuronas inmaduras (células dCX-positivas)(Figura 6B,H),neuronas maduras (células neun-positivas)(Figura 6F,L),células precursoras de oligodendrocitos (antígeno nupcial-glial 2 [NG2] y factor de crecimiento derivado de plaquetas receptor [PDGFR]- células positivas)(Figura 6C,I), oligodendrocitos maduros (proteína básica de mielina [MBP]-células positivas)(Figura 6E,K)y astrocitos (células GFAP positivas)(Figura 6D,J).
Se pueden utilizar diferentes sustratos para recubrir los cubreobjetos para formar la pseudomonocapa de células en condiciones diferenciadoras. Como se muestra en la Figura Suplementaria 1, las células DG migran más cuando los revestimientos tienen recubrimiento adicional con laminina combinado con PLO o PDL que con PDL solo(Figura Suplementaria 1B-H). De hecho, cuando el PDL y la minin se utilizan juntos como sustratos(Figura Suplementaria 1C, G),las células DG forman una pseudomonocapa más confluente que las células SVZ para las que se utiliza PDL solo(Figura Suplementaria 1A,E).
Es importante destacar que estos resultados demuestran el potencial de la NSA para evaluar las propiedades de la talla y multipotencia de los NSC derivados de los dos nichos neurogénicos principales.
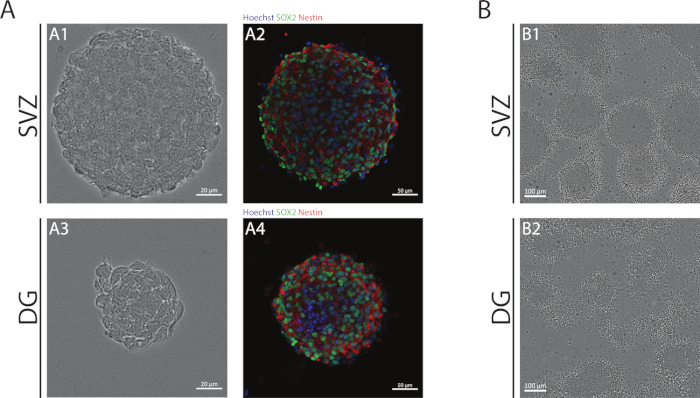
Figura 1: Zona subventricular y giso dentado derivado NSPC cultivado como neuroesferas o como pseudomonocapas. (A) Imágenes representativas de campo brillante (A1,A3) y fluorescencia (A2,A4) de las neuroesferas derivadas de SVZ y DG, donde los núcleos se tiñeron con Hoechst 33342 (azul) y NSCs para Sox2 (verde) y nestin (rojo). (B) Imágenes representativas de campos brillantes de pseudomonocapas generadas a partir de neuroesferas derivadas de SVZ y DG en condiciones diferenciadoras. Haga clic aquí para ver una versión más grande de esta figura.
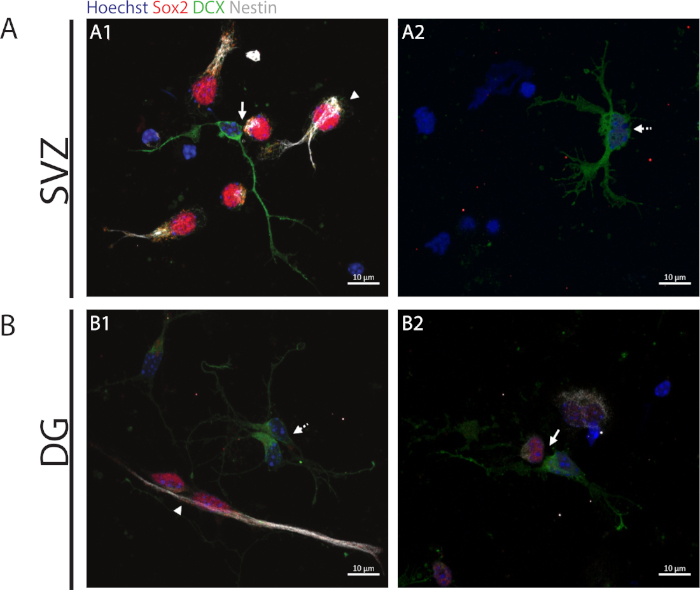
Figura 2: El ensayo del par de celdas. Imágenes representativas de fluorescencia de pares celulares derivadas de una división celular progenitora. Los núcleos SVZ y DG se teñieron con Hoechst 33342 (azul), células similares a tallos para Sox2 (rojo) y nestin (blanco), así como neuronas inmaduras con DCX (verde). Las puntas de flecha en los paneles A1 y B1 indican Sox2+/+/nestin+/+/DCX-/- divisiones auto-renuevas simétricas, Las flechas de los paneles A1 y B2 indican las divisiones asimétricas Sox2+/-/nestin+/-/DCX-/+, las flechas de línea discontinuas en los paneles A2 y B1 muestran Sox2-/-/nestin-/-/DCX+/+ divisiones diferenciadoras simétricas. Haga clic aquí para ver una versión más grande de esta figura.
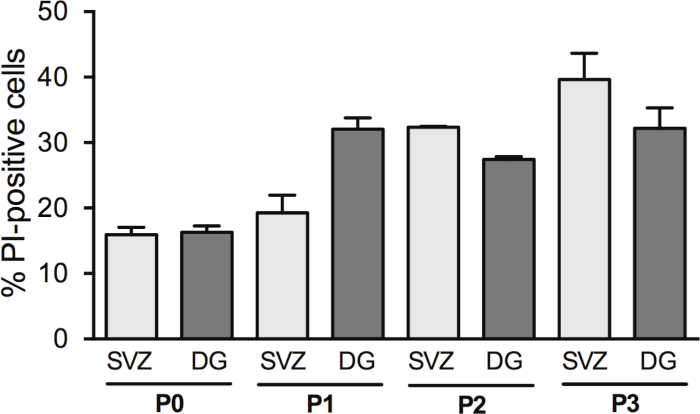
Figura 3: Análisis de supervivencia celular con paso celular. Análisis cuantitativo de células PI-positivas en DIV2 en el cultivo de neurosfera diferenciada de origen SVZ y DG, después de 0, 1, 2 y 3 pasajes (P0-P3). Los datos se expresan como medias: SEM, n.o 1 a 8. PI - Yoduro propidium. Haga clic aquí para ver una versión más grande de esta figura.
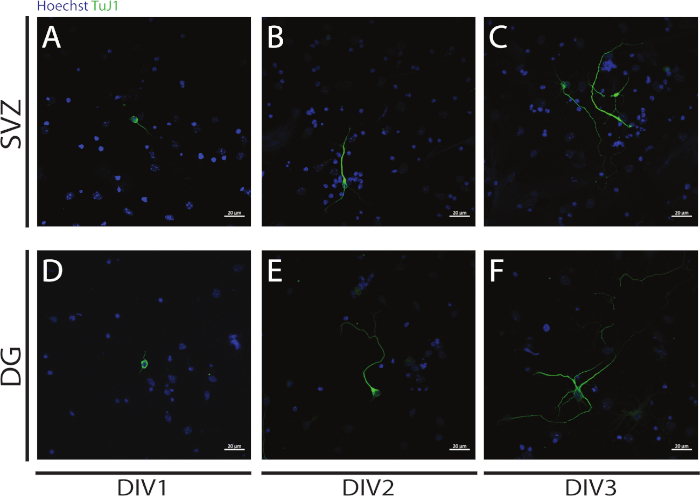
Figura 4: Análisis de neuritogénesis en DIV 1, 2 y 3. Imágenes representativas de fluorescencia confocal de neuritas, identificadas por la señal de tubulina III, en las neuronas SVZ y DG en (A,D) DIV1, (B,E) DIV2 y (C,F) DIV3. Haga clic aquí para ver una versión más grande de esta figura.
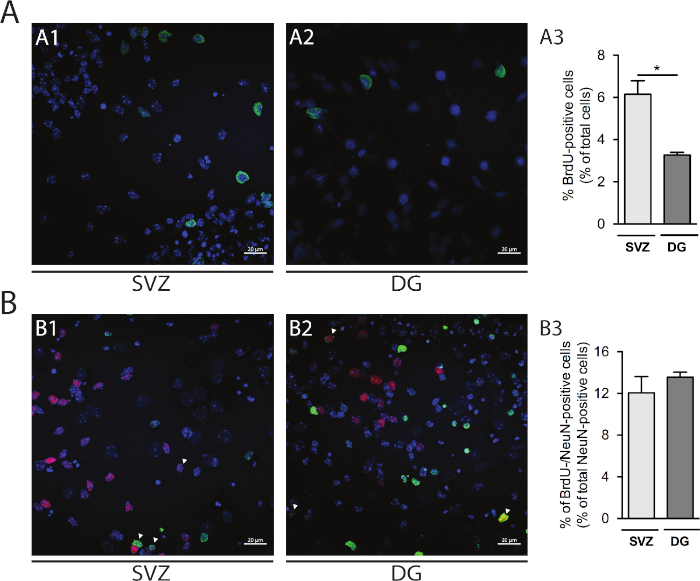
Figura 5: Ensayo de proliferación celular. Imágenes confocales representativas de células brdU positivas en DIV1 en (A1) SVZ y (A2) DG. (A3) Análisis cuantitativo de células BrédU positivas en DIV1 en el cultivo de neurosfera diferenciada derivado de DG y SVZ. Los datos se expresan como medias: SEM, n.o 4. *p < 0.05 por prueba t. Imágenes representativas de fluorescencia de células BrdU y NeuN-positivas en DIV7 in (B1) SVZ y (B2) DG. Las puntas de flecha indican células BrdU-/NeuN-positivas. (B3) Análisis cuantitativo de células BrdU-/NeuN-positivas en DIV7 en ambos nichos. Los datos se expresan como medias: SEM, n.o 4. BrdU: 5-bromo-2'-desoxiuridina, análogo de timidina sintética. Haga clic aquí para ver una versión más grande de esta figura.
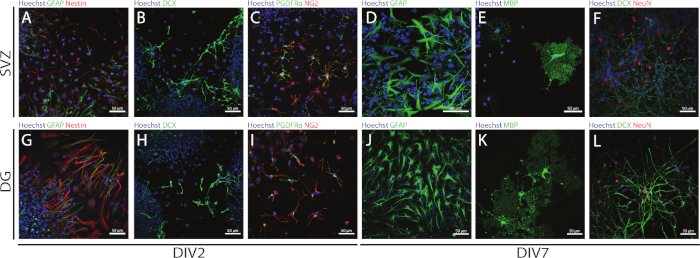
Figura 6: Tipos de células neuronales presentes en el cultivo de neurosfera diferenciada derivado de SVZ y DG. Imágenes representativas de fluorescencia de tipos de células derivadas de SVZ y DG después de 2 y 7 días de diferenciación neurosfera (DIV2 y DIV7), donde los núcleos celulares se manchaban con Hoechst 33342 (azul) y: (A,G) NSCs para GFAP (verde) y nestin (rojo), (B,H) inmaduros neuronas para DCX (verde), (C,I) células precursoras de oligodendrocitos para PDGFR (verde) y NG2 (rojo), (D,J) astrocitos para GFAP (verde), (E,K) oligodendrocitos maduros para MBP (verde), y (F,L) neuronas maduras para NeuN (rojo). Haga clic aquí para ver una versión más grande de esta figura.
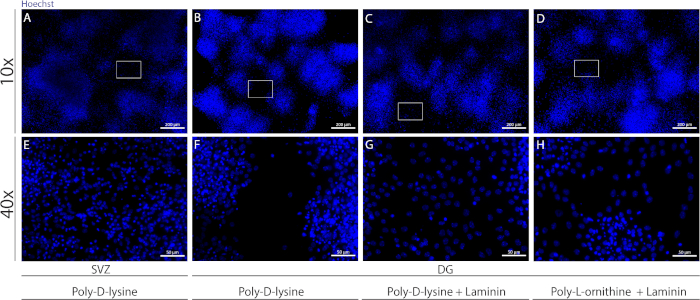
Figura Suplementaria 1: Probar diferentes sustratos para la adherencia y migración de la neurosfera para formar una pseudomonocapa. Imágenes representativas de fluorescencia de (A,E) pseudomonocapa derivada de SVZ utilizando poli-D-lisina como sustrato, (B,F) pseudomonocapa derivada de la DG utilizando poli-D-lisina como sustrato, (C,G) pseudomonocapa derivada de la DG utilizando poli-D-lisina con laminina como sustrato, y (D,H) pseudomonocapa derivada de la DG utilizando poli-D-lisina con poli-L-ornitina como sustrato. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los sistemas in vitro de SSPC permiten una mejor comprensión de los mecanismos celulares y moleculares, que pueden ser validados in vivo. La NSA es un método muy poderoso para imitar las condiciones fisiológicas debido a su estructura tridimensional. Además, este sistema de cultivo también es técnicamente más fácil de cultivar10,en comparación con otros sistemas in vitro como el sistema de cultivo monocapa. De hecho, con la NSA, es fácil controlar las señales extrínsicas expuestas durante el desarrollo celular, ya sea durante la expansión o la fase de diferenciación, añadiendo cantidades precisas y variables de factores de interés para los medios de comunicación, así como mediante el cultivo de neuroesferas con otros tipos de células6. Además, en comparación con los cultivos monocapa, en la NSA, es posible obtener una mayor densidad celular de una pequeña cantidad de tejido o con un pequeño número de células, permitiendo así realizar estudios paralelos, reduciendo así el número de animales1.
La NSA es el método más común para aislar y expandir los NSC11,12,13, se puede utilizar para estimar el número de células precursoras presentes en una muestra de tejido dada5 y la frecuencia celular precursora entre diferentes condiciones. Sin embargo, tanto las neuroesferas como los cultivos monocapa no representan las NSC14de reposo. Además, la NSA tiene algunas limitaciones11,12,13 y la frecuencia de la neurosfera resultante depende de muchos factores, incluyendo los componentes medios, el procedimiento de disección, el proceso de disociación11,12,13,y la agregación de la neuroesfera5. De hecho, en un cultivo de alta densidad, las neuroesferas tienden a acumularse. Por lo tanto, se debe tener precaución al estimar el número de células precursoras en una muestra. Para superar las limitaciones anteriores, los SSCCP aislados también se pueden ampliar y pasar en una monocapa5,,15. Es importante destacar que el uso de NSA para comparar la frecuencia de celda precursora entre diferentes condiciones es muy útil y preciso porque todas estas limitaciones son implícitas y similares entre todas las condiciones realizadas en el mismo experimento.
Hay pasos críticos en la cultura de la neuroesfera que necesitan atención. En el paso de recolección del cerebro, la eliminación completa de las meninges y el buen aislamiento de los nichos neurogénicos son esenciales para maximizar la pureza y el rendimiento de los SSPIC. Durante la disociación del tejido, debido a la actividad proteolítica de la tripsina, el uso excesivo de tripsina o tiempos de incubación más largos pueden conducir a la lisis celular. Además, el día del paso es fundamental para obtener una población sana de las neuroesferas. El paso de las neuroesferas con un diámetro superior a 200 m afecta en gran medida a la viabilidad, capacidad proliferativa y diferenciadora de6los SSPCE. Además, el recubrimiento con PDL y PLD/laminin para células SVZ y DG, respectivamente, es esencial para garantizar una buena migración celular de las neuroesferas sin comprometer el proceso de diferenciación. En términos del análisis de inmunocitoquímica, tiempos de incubación más largos con PFA pueden comprometer la tinción enmascarando los antígenos y aumentando el fondo.
La NSA es una poderosa herramienta para proporcionar una fuente consistente y ilimitada de SSP para estudios in vitro de desarrollo neuronal y diferenciación, así como para fines terapéuticos16,,17. De hecho, este ensayo se puede aplicar a los modelos genéticos y conductuales para comprender mejor los mecanismos moleculares y celulares involucrados en la proliferación y diferenciación de la NSPC18,,19. Este ensayo también es útil para probar diferentes fármacos y compuestos20,,21,,22 así como para realizar manipulaciones genéticas19,,23 para modular las propiedades de NSC. Además de la inmunocitoquímica, se pueden realizar reacciones en cadena de la polimerasa de transcripción inversa y análisis de manchas occidentales para acceder al ARN y a la expresión de proteínas, mientras que los estudios electrofisiológicos y las imágenes de calcio se pueden utilizar para evaluar la función de las neuronas recién nacidas21.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por IF/01227/2015 y UID/BIM/50005/2019, projeto financiado pela Fundación para la Ciencia y a la Tecnología (FCT)/ Ministério da Ciéncia, Tecnologia e Ensino Superior (MCTES) através de Fundos do Or-amento de Estado. R.S. (SFRH/BD/128280/2017, F.F.R. (IMM/CT/35-2018), D.M.L. (PD/BD/141784/2018), y R.S.R. (SFRH/BD/129710/2017) recibieron una beca de FCT. Los autores quieren agradecer a los miembros del centro de bioimagen del Instituto de Medicina Molecular Joao Lobo Antunes la asistencia en microscopía.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1X) | Gibco | 25300-054 | |
| 0.4% Trypan Blue solution | Sigma-Aldrich | T8154-20ML | |
| 12mm Glass coverslips | VWR | 631-1577 | |
| 15mL Centrifuge Tube | Corning | 430791 | |
| 5-bromo-2'-deoxyuridine | Sigma-Aldrich | B9285-1G | |
| 50 mL Centrifuge Tube | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira & Cª (Irmão) Sucrs, Lda | UN1170 | |
| Adhesion slides, Menzel Gläser, SuperFrost Plus | VWR | 631-9483 | |
| Alexa Fluor 488 donkey anti-chicken IgG (H+L) | Life Technologies | A11039 | |
| Alexa Fluor 488 donkey anti-rabbit IgG (H+L) | Life Technologies | A21206 | |
| Alexa Fluor 488 donkey anti-rat IgG (H+L) | Life Technologies | A21208 | |
| Alexa Fluor 568 donkey anti-mouse IgG (H+L) | Life Technologies | A10037 | |
| Alexa Fluor 568 donkey anti-rabbit IgG (H+L) | Life Technologies | A10042 | |
| Alexa Fluor 647 goat anti-mouse IgG (H+L) | Life Technologies | A21235 | |
| Anti-5-Bromo-2-Deoxyuridine | Dako | M0744 | |
| Anti-CD140a (PDGFRα) (rat) | BD Biosciences | 558774 | Dilute at a ratio 1:500. |
| Anti-Chondroitin Sulphate Proteoglycan NG2 (rabbit) | Merck Milipore | AB5320 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (rabbit) | Abcam | ab18723 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (chicken) | Synaptic Systems | 326006 | Dilute at a ratio 1:500. |
| Anti-Glial Fibrillary Acidic Protein (rabbit) | Sigma-Aldrich | G9269-.2ML | Dilute at a ratio 1:1000. |
| Anti-Myelin Basic Protein (rabbit) | Cell Signalling Technology | 78896S | Dilute at a ratio 1:200. |
| Anti-Nestin (mouse) | Merck Milipore | MAB353 | Dilute at a ratio 1:200. |
| Anti-Neuronal Nuclei (mouse) | Merck Milipore | MAB377 | Use 6% BSA in PBS 1X. Dilute at a ratio 1:400. |
| Anti-SOX2 (rabbit) | Abcam | ab97959 | Dilute at a ratio 1:500. |
| Anti-Tubulin β3 (rabbit) | BioLegend | 802001 | Dilute at a ratio 1:200. |
| Axiovert 200 wide field microscope | ZEISS | ||
| B-27 Supplement (50X), serum free | ThermoFisher | 17504044 | |
| Boric Acid | Sigma-Aldrich | B6768-500g | |
| Bovine Serum Albumin | NZYTech | MB04602 | |
| Cell counting chamber, Neubauer | Hirschmann | 8100104 | |
| Cell culture CO2 incubator | ESCO | CCL-170B-8 | |
| Corning Costar TC-Treated 24 Multiple Well Plate | Corning | CLS3524-100EA | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| DMEM/F-12, GlutaMAX Supplement | ThermoFisher | 31331028 | |
| Dumont #5 - Fine Forceps | FST | 11254-20 | |
| Dumont #5S Forceps | FST | 11252-00 | |
| Dumont #7 Forceps | FST | 11272-30 | |
| Epidermal growth factor | ThermoFisher | 53003018 | |
| Fibroblast growth factor | ThermoFisher | 13256029 | |
| Filter papers | Whatman | 1001-055 | |
| Fine Scissors - Sharp | FST | 14060-09 | |
| Gillete Platinum 5 blades | Gillette | ||
| HBSS, no calcium, no magnesium | ThermoFisher | 14175053 | |
| Hoechst 33342 | Invitrogen | 1399 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 (1L) | |
| Labculture Class II Biological Safety Cabinet | ESCO | 2012-65727 | |
| Laminin | Sigma-Aldrich | L2020 | |
| McILWAIN Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 450 μm |
| Micro Spatula - 12 cm | FST | 10091-12 | |
| Micro tube 0.5 mL | SARSTEDT | 72.699 | |
| Micro tube 1.5 mL | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL | SARSTEDT | 72.691 | |
| NeuroCult Chemical Dissociation Kit (Mouse) | Stem Cell | 5707 | |
| Olympus microscope SZ51 | Olympus | SZ51 | |
| Paraformaldehyde, powder | VWR | 28794.295 | |
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Petri dishes 60 mm | Corning | 430166 | |
| Phosphate standard solutions, PO43 - in water | BDH ARISTAR | 452232C | |
| Poly-D-Lysine 100mg | Sigma-Aldrich | P7886 | |
| Poly-L-ornithine solution | Sigma-Aldrich | P4957 | |
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide | Sigma-Aldrich | P4170-25MG | |
| Sodium chloride | VWR | 27800.360.5K | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Triton X-100 | BDH | 14630 | |
| VWR INCU-Line IL10 | VWR | 390-0384 |
Referencias
- Reynolds, B., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of Visualized Experiments. (45), e2393 (2010).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11 (5), 951-966 (1993).
- Rietze, R. L., Reynolds, B. A. Neural Stem Cell Isolation and Characterization. Methods in Enzymology. 419, 3-23 (2006).
- Walker, T. L., Kempermann, G. One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Journal of Visualized Experiments. (84), e51225 (2014).
- Jensen, J. B., Parmar, M. Strengths and Limitations of the Neurosphere Culture System. Molecular Neurobiology. 34 (3), 153-162 (2006).
- Xapelli, S., et al. Activation of Type 1 Cannabinoid Receptor (CB1R) Promotes Neurogenesis in Murine Subventricular Zone Cell Cultures. PLoS ONE. 8 (5), e63529 (2013).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Nowakowski, R. S., Lewin, S. B., Miller, M. W. Bromodeoxyuridine immunohistochemical determination of the lengths of the cell cycle and the DNA-synthetic phase for an anatomically defined population. Journal of Neurocytology. 18 (3), 311-318 (1989).
- Weinberg, D., Adams, C. F., Chari, D. M. Deploying clinical grade magnetic nanoparticles with magnetic fields to magnetolabel neural stem cells in adherent versus suspension cultures. RSC Advances. 5 (54), 43353-43360 (2015).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. Journal of Visualized Experiments. (47), e2457 (2011).
- Azari, H., Louis, S. A., Sharififar, S., Vedam-Mai, V., Reynolds, B. A. Neural-Colony Forming Cell Assay: An Assay To Discriminate Bona Fide Neural Stem Cells from Neural Progenitor Cells. Journal of Visualized Experiments. (49), e2639 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres-re-evaluating the relationship. Nature Methods. 2 (5), 333-336 (2005).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proceedings of the National Academy of Sciences. 106 (15), 6387-6392 (2009).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities?. Nature Reviews Neuroscience. 11 (3), 176-187 (2010).
- Ghate, P. S., Sidhar, H., Carlson, G. A., Giri, R. K. Development of a novel cellular model of Alzheimer's disease utilizing neurosphere cultures derived from B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J embryonic mouse brain. SpringerPlus. 3 (1), 161 (2014).
- Pluchino, S., et al. Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis. Nature. 422 (6933), 688-694 (2003).
- Ogawa, Y., Kaizu, K., Yanagi, Y., Takada, S., Sakuraba, H., Oishi, K. Abnormal differentiation of Sandhoff disease model mouse-derived multipotent stem cells toward a neural lineage. PLoS ONE. 12 (6), e0178978 (2017).
- Khacho, M., et al. Mitochondrial Dynamics Impacts Stem Cell Identity and Fate Decisions by Regulating a Nuclear Transcriptional Program. Cell Stem Cell. 19 (2), 232-247 (2016).
- Soares, R., et al. Tauroursodeoxycholic Acid Enhances Mitochondrial Biogenesis, Neural Stem Cell Pool, and Early Neurogenesis in Adult Rats. Molecular Neurobiology. 55 (5), 3725-3738 (2017).
- Rodrigues, R. S., Ribeiro, F. F., Ferreira, F., Vaz, S. H., Sebastião, A. M., Xapelli, S. Interaction between Cannabinoid Type 1 and Type 2 Receptors in the Modulation of Subventricular Zone and Dentate Gyrus Neurogenesis. Frontiers in Pharmacology. 8, 516 (2017).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin?. Frontiers in Cellular Neuroscience. 8, 59 (2014).
- Kim, H. J., et al. Dynamin-related protein 1 controls the migration and neuronal differentiation of subventricular zone-derived neural progenitor cells. Scientific Reports. 5 (1), 15962 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados