Method Article
בידוד והתרחבות של הנוירוספירות מפוסטנטאל (P1-3) העכבר גומחות נוירוגניים
In This Article
Summary
במאמר זה, אנו מתארים, בפרוטרוט, פרוטוקול עבור הדור של תרבויות נוירוספירה מתאי גזע העכבר הפוסט-לידתיים נגזר של נישות הראשי נוירוגניים העכבר. הנוירוספירות משמשות לזיהוי תאי גזע עצביים מרקמת מוח המאפשרים הערכה של מספרי תאים מקודמי. יתר על כן, אלה מבנים תלת-ממדיים יכול להיות מצופה בתנאים הדיפרנציאל, הענקת הנוירונים, oligodendrocytes הפוך ו astrocytes, המאפשר לימוד של הגורל התא.
Abstract
שיטת הנוירוספירה היא טכניקה שימושית ביותר לחקר המאפיינים הטבועים של תאי גזע/מחולל מעשה עצבי (NSPCs), כולל התפשטות, התחדשות עצמית וריבוי כדוריות. בתוך המוח לאחר לידה ובוגרים, nspcs נמצאים בעיקר בשני נישות נוירוגניים: אזור תת המוח (svz) רירית החללי הצדדיים ואת האזור התת הגרגירים של פיתול כישור היפוקמאל (DG). הבידוד של נישות הנוירוגניים מהמוח לאחר הלידה מאפשר קבלת כמות גבוהה יותר של NSPCs בתרבות עם יתרון מסוגר של תשואות גבוהות. המגע הקרוב בין התאים שבתוך כל נוירוספירה יוצר מיקרוסביבה שעשויה להידמות לגומחות נוירוגניים. כאן, אנו מתארים, בפרוטרוט, כיצד ליצור תרבויות NEUROSPHERE-ו-DG נגזרות מ-1-3 ימים (P1-3) עכברים, כמו גם מעבר החוצה, להרחבת נוירוספירה. זוהי גישה יתרון מאז שיטת הנוירוספירה מאפשרת דור מהיר של שיבוטים NSPC (6-12 ימים) ותורמת לירידה משמעותית במספר השימוש בבעלי חיים. על ידי ציפוי נוירוספירות בתנאים הדיפרנציאל, אנו יכולים להשיג פסבדו אקראי של תאים מורכב nspcs והבדיל תאים של שונות עצביים שונים (נוירונים, אסטרוציטים ו oligodendrocytes הפוך) המאפשר את המחקר של פעולות של גורמים פנימיים או חיצוניים על התפשטות nspc, בידול, הישרדות התא neuritogenesis.
Introduction
שיטת הנוירוספירההראשונהתוארה ב-1992 1,2 ועדיין נותרה כלי ייחודי ורב עוצמה במחקר של תא גזע עצבי (לאומי). הבידוד של NSCs מן האזורים הנוירוגניים הראשי יש בעיות מאתגרות, כי הדרישות לשמור על תאים אלה בתנאים פיסיולוגיים נשארים ברורים למדי. ב-לאומי, תאים הם מתורבתים במדיום מוגדר סרום-ללא כימית עם נוכחות של גורמי גדילה כולל גורם הגידול באפידרמיס (egf) ואת גורם הצמיחה פיברופיצוץ בסיסי (bfgf)1,2,3. תאים הקודמן העצבי (גזע ושלתי) נבחרים באמצעות אלה mitogens מאז תאים אלה הם EGF ו-FGF-תגובה הזנת תקופה של התפשטות פעילה בעוד תאים אחרים, כלומר תאים הבדיל, למות4. התאים המקודמים העצביים לצמוח כמו נוירוספירות, אשר יכול להיות אז החוצה כדי להרחיב עוד יותר את הבריכה של תאים אלה5. חשוב מכך, מאז אלה בתאי גזע העצביים (nspcs) הם רב עוצמה הם מסוגלים להבדיל לתוך שלושה סוגי תאים עיקריים של מערכת העצבים המרכזית (cn): נוירונים, oligodendrocytes הפוך ו אסטרוציטים5.
ה-סוכנות לבטחון לאומי מספקת מקור מתחדש של בלתי מובחן, שניתן להשתמש בו כדי ללמוד מספר תהליכים, כולל הפצת המועצה לבטחון לאומי והתחדשות עצמית, ובידול עצבי וגליאל, בהקשר הפיזיולוגי והמחלה. יתר על כן, במחקרים מחוץ לתחום ניתן להשתמש כדי להעריך את מידת המפרט של מפרט פנימי במהלך פיתוח, כמו גם ללמוד את הפוטנציאל המלא של התאים, על ידי הסרת רמזים חיצוניים הקשורים בסביבה הרגילה שלהם6. מודל הנוירוספירה הוא בעל ערך רב להערכת הרגולטורים הניתנים ליישום, מאחר שתחזוקת התאים בינונית נטולת סרום, הרמזים הסביבתיים מסופקים רק על-ידי התאים המקיפים6. יתר על כן, ב-לאומי, NSPCs מורחב בקלות בתרבות, צפיפות של תאים לאזור הוא גבוה ההרכב הטרוגנית של נוירוספירות יש כמה דמיון vivo נישות6. יתרונות אלה מבוססים היטב הם הסיבה לכך מתודולוגיה זו בשימוש נרחב על ידי חוקרים רבים.
הפרוטוקול הבא מתאר בפירוט את כל התהליכים מן הבידוד של אוכלוסיית nspc לאחר לידה משני אזורים נוירוגניים הראשי, אזור תת-המוח (svz) ו-היפוקמאליום פיתול כישור (DG), להרחבת התאים הללו כמו נוירוספירות, כמו גם לבידול לתוך נוירונים, אסטרוציטים ו oligodendrocytes הפוך. לבסוף, שונה שונים מתוארים גם לצורך גישה לשטיות ולתכונות רב עוצמה של SVZ-ו-DG-הנגזרות NSPCs.
Protocol
כל הניסויים נערכו בהתאם לקהילה האירופית (86/609/EEC; 2010/63/האיחוד האירופי; 2012/האיחוד האירופי) ו פורטוגזית (DL 113/2013) חקיקה להגנת בעלי חיים המשמשים למטרות מדעיות. הפרוטוקול אושר על ידי "iMM המוסד לרווחת בעלי חיים גוף-ORBEA iMM והרשות הלאומית המוסמכת-DGAV (המנהל הלאומי של הVeterinária)."
1. התקנה בסיסית והכנת מדיום לתרבות
- ביום של הניתוח, להכין את הכמות המתאימה של בינונית צמיחה המתאימה סרום ללא מדיום (SFM) המורכב בינונית נשר שונה של Dulbecco [(DMEM)/f12 עם L-גלוטמין] (טבלת חומרים) שיושלם עם 100 U/ml פניצילין 100 μg/ml סטרפטומיצין (עט/דלקת), 1% B27, עם גם 10 Ng/ML egf ו 5 Ng/Ml bFGF. חמם את מדיום התרבות עד 37 ° c באמבט מים.
הערה: הנפח של מדיום הצמיחה תלוי במספר הגורים, עבור 5 גורים להכין ~ 100 mL (50 mL עבור SVZ ו 50 mL עבור DG); עם זאת, לאחר ספירת מספר התאים (שלב 5.1) הנפח המדויק יהיה חייב להיות מותאם. - לקבלת מיקרוניתוח של SVZ ו-DG, להכין את הסידן ומגנזיום ללא הנקס מאוזנת פתרון תמיסת מלח (HBSS) ניתוח בינוני בתוספת עם 100 U/mL עט/דלקת.
הערה: הכינו 50 עד 100 מ ל של מדיום לחיתוך. - הגדרת מיקרוסקופ לנתיחה ולהכין את הכלים הדרושים כדי להסיר את המוח (מספריים ומרית קטנה) ועבור SVZ ו-DG מיקרו-מיקרוסקופ (דומונט מספריים קטנים, #7 מלקחיים, #5 מלקחיים, #5S מלקחיים) על ידי הספגת 70% אתנול.
2. קציר של לידה (P1-3) מוחות העכבר ו SVZ/DG מיקרובתר
- הכינו 60 מ"מ מנות פטרי (אזור גידול 21 ס מ2) עם HBSS בתוספת עט/דלקת ו 2 מדגם צינורות (אחד עבור svz ואחד עבור DG) עם 500 μl של תוספת hbss.
- כגורי עכברים (P1-3) בהתאם לפרוטוקול שאושר על ידי מתקן/הנחיות לטיפול בבעלי חיים מוסדיים. לבצע עריפת ראש עם חתך אחד עם מספריים חדים בבסיס של גזע המוח.
- החזקת החלק הגחוני של הגוף בבסיס הראש ושימוש במספריים מחודדים קטנים, הופכים את החיתוך בקו האמצע בעור על כל אורכו של הראש, ובכך חושפים את פני השטח של הגולגולת.
- לעשות חתך האורך בבסיס של הגולגולת ולהמשיך לחתוך לאורך תפר משונן באמצעות מספריים קטנים עם זווית רדודה ככל האפשר כדי למנוע פגיעה במבני המוח.
- מקלפים את הגולגולת לצדדים בעזרת מלקחיים מעוקלים וחושפים את המוח.
התראה: ודא שכלי הניתוח הינם חופשיים מאתנול לפני שנוגעים במוח. - לבודד את המוח מהגולגולת באמצעות מרית קטנה, על ידי הזזה מתחת לבסיס המוח כדי לחתוך את עצבי הגולגולת ואת כלי הדם המחוברים לבסיס המוח, ולהעביר את המוח לתוך צלחת פטרי המכילים קר בתוספת HBSS פתרון.
- מניחים את הצלחת פטרי המכילה את המוח תחת מיקרוסקופ מבתר בהגדלה נמוכה ומקמו את המוח על משטח הגב.
- באמצעות מלקחיים עדינים, להסיר את קרום המוח מהצד הגחוני של הראש והריח, תוך החזקת המוח במיקום על ידי המוח השני. סובב את המוח על ההיבט הגחוני. וקלף את שאר הקרום
הערה: הסרת קרום המוח היא צעד מכריע בכדי להבטיח את החיתוך המוחי הנכון. - להיפטר המוח עושה חתך באמצעות מלקחיים. מניחים נייר סינון עם גודל נקבובית של 11 יקרומטר על מסוק הרקמה (הטבלה של חומרים) ולהגדיר את המוח על נייר סינון באמצעות מלקחיים מחודדים מעוקל. קוצצים את המוח לתוך הסעיפים 450 יקרומטר ילתית ולהשתמש לאמנה רטוב לאסוף את המוח המחולק לצלחת פטרי חדש מלא עם הצטננות שנוספו hbss.
- כדי לנתח את svz, להשתמש מלקחיים להפריד פרוסות ילתית בצורה הקדמית לאחורי עד להגיע פרוסות עם החדרים לרוחב, תחת מיקרוסקופ מבתר.
- חותכים את שכבת הרקמה הדקה המקיפה את הקיר הצדדי של החדרים (אשר מתאים ל-SVZ) עם מלקחיים עדינים, למעט הסלאטלאטמה והגולוסום הקורפוס. לבודד את SVZ על ידי הצבת קצה של מלקחיים בפינות לרוחב של החדר לרוחב: אחד מיד תחת callosum קורפוס והשני לתוך הרקמה בסמוך לאזור הגחוני של החדר לרוחב. ואז, לחתוך קו קטן של רקמה סביב החדר לרוחב.
- לאסוף את רקמת לגזור לתוך שפופרת לדוגמה עם הפתרון HBSS שנוספו בעבר זיהה כמו SVZ.
הערה: הוצא את SVZ בפרוסות שבהן המבנה הצדדי והיווצרות ההיפוקמאל מתחילים להופיע. - לעבור את כל הפרוסות לאחר מיקרודיסקציה SVZ בצורה הקדמית לאחורי ולהגיע למערך ההיפוקמאל. באמצעות מלקחיים להשליך את הפרוסה הראשונה עם ההיפוקמפוס שבו DG עדיין לא מזוהה.
- כדי להסיר את ה-DG, לבודד תחילה את ההיפוקמפוס מן הפרוסות. מקדו את המיקרוסקופ כדי להמחיש את הגבולות סביב DG.
- לנתח את החלק DG על ידי ביצוע חיתוך בין האזור DG ו CA1 ואחריו חתך אנכי בין האזור DG ו CA3 באמצעות מלקחיים. הסר fimbria וכל הרקמה הסמוכה.
הערה: ב P1-3 בעלי חיים, ה-די. ג'י. כמעט ולא ניתן להבדיל מקרן אמון, אך מציג טיפ קטן. - לאסוף את רקמת לגזור לתוך שפופרת מדגם המכיל הפתרונות HBSS שזוהו בעבר כמו DG.
הערה: הפגיעה הכוללת בהיפוקמפוס או באזור הסובב תקשה יותר לבודד את ה-DG. באמצעות אטלס של מוח העכבר לאחר הלידה הוא חיוני כאשר המשתמש אינו מכיר את הבידוד של svz ו-DG רקמות מסעיפים ילתית.
3. הדיסוציאציה של הרקמה
- כדי לנתק את הרקמה SVZ ו-DG הקיימות בצינורות המתאימים להם, הוסיפו טריפסין-EDTA 0.05% כדי לקבל ריכוז סופי של 5-10% מטריפסין-EDTA 0.05% ב-HBSS. דגירה כ 15 דקות ב 37 ° c, עד הרקמה מצופפים יחד.
- רוחצים את הרקמה מטריפסין על ידי הסרת התקשורת והוספת 1 מ ל של הפתרון החדש HBSS שיושלם עבור 4 פעמים רצופות.
- להסיר את HBSS ולהשעות מחדש את הרקמה מתעכל ב 1 מ ל של SFM שיושלם עם 10 ng/mL EGF ו 5 ng/mL bFGF. מכנית הנתק את הגלולה על ידי ליטוף בעדינות למעלה ולמטה כ 7-10x באמצעות P1000, עד קבלת פתרון תאים הומוגנית.
התראה: דיסוציאציה מכנית מוגזמת עלולה לגרום למוות מוגבר של תאים ותשפיע לרעה על צמיחת התאים הבאים.
4. שיטת הזוג הסלולרי לחקר הגורל התאי
- לפני הניסוי, הכינו צלחות מצופות 24-לוחות לתרבויות מונאולייר לפי סעיפים 8-10.
- כדי לספור את מספר התאים SVZ או DG (שהושג בסעיף 3) להיות מצופה, השתמש בפתרון המכיל 0.2% טרילון כחול ולספור את התאים באמצעות המטציטוטומטר.
- לדלל את ההשעיה התא הושעה SFM שיושלם עם 5 ng/mL EGF ו 2.5 ng/mL bFGF (נמוך EGF/bFGF) בצפיפות של 11,300 תאים/cm2 ו לוחית אותם על מצופה זכוכית שמיכות.
- לאחר 24 שעות, לתקן את התאים עבור כימיה חיסונית כנגד סמני המועצה לבטחון לאומי כגון מין קביעת האזור Y-box 2 (Sox2) ו nestin, כמו גם עם סמן של השושלת העצבית (כלומר doublecortin [DCX], עבור נוירונים בוגרים) (ראה סעיף 14).
הערה: Sox2 הוא סמן של NSCs העוברים מיטוזיס. Sox2+/+ תא-זוגות הנובעים מחלוקה יחידה של תא מחולל שחור משקף את הרחבת תא הגזע7.
5. התרחבות תאי גזע הניולנטאל כספירות נוירודורים
- כדי לקבוע את הצפיפות של SVZ הושעה או השעיה תא DG (שהושג בסעיף 3), לספור את התאים באמצעות המטציטוטומטר.
- לדלל SVZ ו-DG השעיית תא יחיד בצפיפות של 2 x 104 תאים/ML ב sfm שיושלם עם 10 Ng/ML egf ו 5 Ng/Ml bFGF. זרעים SVZ ו-DG תאים בלתי מצופים 60 מ"מ מנות פטרי עם נפח סופי של 5 מ"ל/צלחת פטרי.
- מודטה SVZ ו-DG תאים עבור 6-8 ימים ו 10-12 ימים, בהתאמה לטופס נוירוספירות ראשיות, ב 37 ° צ' עם 5% CO2.
הערה: הדגירה של ימים יותר מאלה שהוזכרו יכול לקדם את הצבירה של נוירוספירות ורמות גבוהות יותר של מוות תאים במרכז הנוירוספירה. - כאשר לרוב התחומים יש קוטר של 150 עד 200 μm, בצע את מעבר הנוירוספירה.
הערה: כאשר אין ביניהם קוטר מתאים, יש להתפשר על כל השלבים הבאים.
6. התיישנות של נוירוספירות
הערה: ניתן להחיל את הפרוטוקול הבא כדי להרחיב הן את כדורי ה-SVZ ו-DG.
- כדי מעבר נוירוספירות, לאסוף את SFM עם גורמי גדילה המכילים נוירוספירות מ 60 מ"מ צלחת פטרי (es) ו צנטריפוגה עבור 5 דקות ב 300 x g.
- השמט את הסופרנטאנט והשהה מחדש את הגלולה הנוירוספירה באמצעות ערכת דיסוציאציה כימית (עכבר) לפי הוראות היצרן (טבלת חומרים).
הערה: התבונן בזמני הדגירה בדיוק כפי שהם חיוניים לביצועים. - צנטריפוגה עבור 5 דקות ב 300 x g, להסיר את supernatant ולהוסיף 1 מ ל של sfm שיושלם עם 10 Ng/ML egf ו 5 Ng/Ml bFGF.
- Triturate למעלה ולמטה בקירוב 10x עם P1000 tte כדי לנתק נוירוספירות.
- לספור את מספר התאים באמצעות פתרון המכיל 0.2% טריבן כחול והמטציטוטומטר.
- תאים משניים בצפיפות של 2 x 104 תאים/mL ב 60 מצופה מנות פטרי בלתי מצופות.
- מודטה SVZ ו-DG תאים עבור 6-8 ימים ו 10 עד 12 ימים, בהתאמה כדי להשיג נוירוספירות משניות, ב 37 ° c עם 5% CO2.
הערה: ניתן לגשת לקיבולת החידוש העצמי של SVZ-ו-DG NSPCs על-ידי ביצוע מקטעי פרוטוקול 5 ו-6. בשביל זה, זרעי SVZ ו-DG תאים בצפיפות של 1.0 x 104 תאים/mL (ב 24-באר לוחות מצופה) בינוני sfm צמיחה המכיל 5 Ng/ML egf ו 2.5 Ng/Ml bfgf (נמוך Egf/bfgf). לספור את מספר כמות הנוירודורים הראשיים והמשניים המתקבלים.
7. אחסנה של נוירוספירות
- לאסוף את המדיום המכיל נוירוספירות (שהתקבלו משלבים 5.3 ו 6.7) מתוך 60 מנות פטרי.
- צנטריפוגה עבור 5 דקות ב 300 x g ולהיפטר supernatant.
- שטוף את התאים 2x עם 1 מ ל של HBSS (5 דקות ב 300 x g).
- צנטריפוגה עבור 5 דקות ב 300 x g, למחוק את supernatant ולאחסן את הגלולה של נוירוספירות ב-20 ° c עבור ניתוח ביולוגיה מולקולרית.
8. לוחית ציפוי PDL הליך
- כדי להכין פתרון 1 (0.1 M מאגר בוראט), שוקל 3.92 g של חומצה בוראט ולדלל ב 400 mL של מי הטוהר הגבוהה. להתאים את ה-pH ל 8.2 ולפצות עד 500 mL עם מים הטוהר גבוה.
- כדי להכין פתרון 2 (0.167 M מאגר בוראט), שוקל 10.3 g של חומצה בוראט ולדלל ב 900 mL של מי הטוהר הגבוהה. להתאים את ה-pH ל 8.2 ולפצות עד 1,000 mL עם מים הטוהר גבוה.
- כדי להוות מחדש poli-D-ליזין (PDL) (1 מ"ג/mL ב 0.1 M בוראט מאגר), לדלל 100 mg של PDL ב 100 mL של פתרון 1.
- הפוך את המהירות של 10 מ ל לשימוש מיידי או הקפאה ואחסון ב-20 ° c.
- מתחת לזרם הלבינארי, הוסף שמיכות 1 לכל ועקר תחת אור UV עבור 15 דקות.
- השתמש באפשרות PDL או הפשרת הקפאת מחדש PDL.
- הכן את הפתרון הסופי של 100 μg/mL PDL ב 0.167 M מאגר בוראט על ידי הוספת 10 מ ל של PDL מחדש ל 90 mL של פתרון 2.
- הוסיפו את הפתרון הסופי לבארות למינימום של 2 שעות ללילה ב-37 ° c.
הערה: עבור לוחות 24-היטב, הוסף נפח של 500 μL בכל באר. - להסיר את הפתרון ולשטוף את 3x עם מים בטוהר גבוה.
- תנו לסרבל להתייבש. במכסה הזרימה הלבינארי
- השאירו את לוחיות התרבות הרב ב -4 ° c.
9. PDL/למינציה לוחית ציפוי הליך
- ביום 1, העילו את הצלחות עם PDL כמתואר בסעיף 8.
- ביום 2, להסיר את הפתרון PDL ולשטוף 3x עם מים הטוהר גבוה. . תן להתייבש
- הכינו 5 μg/mL למינציה ב-SFM קר נטול גורמי גדילה.
- הוסף מומס למינציה כדי שמיכות ו הדגירה ב 37 ° c בלילה.
הערה: עבור לוחות 24-היטב, הוסף נפח של 500 μL בכל באר. - מסירים מלמינציה באמצעות פיפטה.
הערה: אל תשטוף את הכיסויים מהלמינציה. - השתמש באופן מיידי או באחסון ב-20 ° c.
10. פולי-אל-אורלך (אש ף)/למינציה בתהליך הציפוי
- מתחת לזרם הלבינארי, הוסיפו שמיכות אחת בו ולעקר תחת אור UV במשך 15 דקות.
- הוסף את הפתרון 0.01% אש ל כל טוב עבור 20 דקות בטמפרטורת החדר (RT).
הערה: עבור לוחות 24-היטב, הוסף נפח של 500 μL בכל באר. - להסיר את הפתרון ולשטוף את 3x עם מעוקר 1x PBS. . תן להתייבש
- הכינו 5 μg/mL למינציה ב-1x הערוץ סטרילי.
- דגירה עבור 2 h ב 37 ° c.
- . הסירי מלמינציה
הערה: אל תשטוף את הכיסויים מהלמינציה. - . השתמש באופן מיידי
הערה: ודא שהכיסוי מכוסה במלואו בתמיסה של אש ף על ידי הקשה בעדינות על הכיסוי עם קצה הפיפטה. כאשר מזועזע, הצלחות רב-הטוב לא צריך להשמיע קול.
11. הערכה של neuritogenesis על ידי יצירת מונאולייר הבדיל של התא
- לאסוף מדיה המכילה נוירוספירות מ 60 מנות פטרי (שהתקבלו מסעיף 5) ו צנטריפוגה עבור 5 דקות ב 300 x g ב RT.
- השמט את הסופרנטאנט והנתק את הגלולה של הנוירוספירות ב-1 מ ל של הדיסוציאציה PBS (כלומר, PBS ללא Mg2 +/ca2 + ו עם Edta [2.7 mm KCL, 1.5 mm KH2PO4, 137 מ"מ הנאל, 8.1 mM NA2hpo4 ו 0.5 mm edta 4na, ב-pH = 7.40]) על ידי הדגירה עבור 15 דקות ואחריו דיסוציאציה מכנית. לחילופין, הנתק את הנוירוספירות באמצעות ערכת דיסוציאציה כימית (עכבר) (טבלת חומרים).
- צנטריפוגה עבור 5 דקות ב 300 x g ב RT ו להיפטר supernatant.
- השהה מחדש את הגלולה בתא 1 מ ל של SFM נטול גורמי גדילה.
- קבע את צפיפות התא. באמצעות המטציטוטומטר
- לדלל את השעיית התא הושעה SFM ללא גורמי גדילה בצפיפות של 3,766 תאים/cm2 ותאי צלחת על כיסוי זכוכית מצופה בצלחות 24-טוב.
- לאחר 1-3 ימים, תקן תאים עבור האימונוציטוכימיה נגד חלבון של שלד התא (ראה סעיף 14).
12. הבידול בתרבויות נוירוספירה
הערה: נוירוספירות שהתקבלו מהרחבת התא, בין אם מבין התחומים הראשוניים או הפסבניים (המתקבלים בסעיפים 5 או 6) ניתן לבדיל לתאים מתוך שונות שונים עצביים.
- כאשר כדורים נוירומטרים יש קוטר של 150 ליטר-200 μm, לאסוף 25 μL של בינוני ההשעיה נוירוספירה ואת הצלחת על מצופה שמיכות זכוכית, ב 24-טוב צלחות.
הערה: כדי לאסוף עוד כדורים עצביים, סובב בעדינות את צלחת פטרי כדי לרכז את הנוירוספירות במרכז. . ואז, פיפטה מהמרכז - שים את הצלחות בחממה ב 37 ° c עבור 15 דקות כך הנוירוספירות לדבוק מצע. לאחר מכן, להוסיף 500 μL של SFM נטול גורמי גדילה (תנאים דיפרנציאל).
- לאחר 24 שעות, להחליף את המדיום עם SFM טרי ללא גורמי גדילה.
- להבדיל בין נקודות זמן שונות (למשל, 2 ו -7 ימים ב מבחנה, DIV2 ו DIV7, בהתאמה) עם 5% CO2 ו 95% אוויר אטמוספרי ב 37 ° c.
הערה: הישרדות התא, התפשטות ובידול יכול להיות מנותח באמצעות שונים תא מאמר.
13. ביולוגיה של התא מוסר
- שיטת הישרדות התא
- לחשוף נוירוספירות מצופה 3 μg/mL propidium יודיד (PI) עבור 30 דקות לפני קיבוע התא בחממה ב 37 ° c.
הערה: PI הוא סוכן פלורסנט אוטומטי המסוגל רק להיכנס לתאים עם שלמות הממברנה הפרוצים8. שיטות אחרות כדי לנתח את ההישרדות התאים ניתן להשתמש כגון caspase 3 כתמים או מסוף deoxynucleotidyl מעביר dUTP התיוג ניק-end (TUNEL).
- לחשוף נוירוספירות מצופה 3 μg/mL propidium יודיד (PI) עבור 30 דקות לפני קיבוע התא בחממה ב 37 ° c.
- שיטת הפצת תאים
- לחשוף מצופה נוירוספירות עד 10 μM 5-bromo-2'-deoxyuridine (Bromo) עבור 4 h לפני קיבוע בחממה ב 37 ° c.
הערה: brdu היא אנלוגית תימידין סינתטי שניתן לשלב במהלך סינתזה DNA בתאים מתרבים9.
- לחשוף מצופה נוירוספירות עד 10 μM 5-bromo-2'-deoxyuridine (Bromo) עבור 4 h לפני קיבוע בחממה ב 37 ° c.
- שיטת בידול התא
- לחשוף 7-יום מצופה נוירוספירות הציפוי עד 10 μM BrdU ב 24 ה הראשון, בחממה ב 37 ° c.
- לחדש את SFM ללא גורמי צמיחה (תנאים דיפרנציאל) ולאפשר לתאים להתפתח בהעדר BrdU עבור 6 ימים הבאים עד הקיבעון.
הערה: ניסויים אלה מרדף דופק, על ידי תיוג משותף עם סמנים של תאים עצביים בוגרים, לאפשר הערכה של תאים מחולל משנה הבדיל לתוך תאים בוגרים במהלך הפרוטוקול.
14. כתמים חיסוני של תרבויות נוירוספירה
- קיבוע תאים
- הכינו 4% פאראפורמלדהיד (כיתה) ב-1x PBS והחנות ב -4 ° c או-20 ° c.
- הסר את SFM ללא גורמי גדילה מבארות ולהוסיף, לכל טוב, 500 μL של 4% בתחתית בתוך 4 ° c עבור 20 דקות ב-RT.
- לשטוף 3x עם PBS 1x, עבור 5 דקות בכל פעם, את הכיסויים מכיל נוירוספירות הבדיל.
- שמיכות חנות עד השימוש ב 500 μL של 1x PBS ב 4 ° c.
הערה: אם לניסוי אין BrdU, דלג לשלב 14.3.
- שיטת דנטורציה (עבור ניסויי BrdU בלבד)
- להכין הHCl 1 M ב 37 ° c.
- לשטוף כיסוי 3x ב 1x PBS.
- תאים הפרתוניים עבור 30 דקות ב-PBS המכיל 1% nonionic (למשל, טריטון X-100).
- הספרות עם HCl 1 M מחומם מראש עד 37 ° c עבור 30 לפחות 40 דקות ב 37 ° צ' (~ 300 μL/טוב).
- לשטוף את הבארות 4x עם 1x PBS.
- החדירות והחסימות
- לשטוף כיסוי ב-1x PBS עבור 5 דקות.
- מודדת עבור 1.5 h עם 0.5% nonionic החומרים ו-3% סרום כדור (BSA) ב-1x PBS (~ 300 μL/טוב).
הערה: עבור NeuN, השתמש ב-6% BSA ב-1x PBS.
- דגירה והרכבה
- ביום 1, ללא כביסה, בתאי הדגירה עם נוגדניםהעיקרי (הטבלה של חומרים) ב 0.1% nonionic סורסטנט ו 0.3% bsa ב-1X PBS בחדר הדגירה (עבור 24-היטב צלחות להשתמש 20 μl/טוב). השאירו את הכיסויים מודגנים לילה ב -4 מעלות צלזיוס מוגן אם הנוגדנים מצוגנת לפלואורופור.
- ביום 2, החזר שמיכות בארות המתאימות שלהם ולשטוף 3x ב-1x PBS עבור 5 דקות.
- כתם נגדי עם מצובת קרינה פלואורסצנטית מתאימה משני נוגדנים (דילול 1:200) עם 12 μg/mL Hoechst 33342 ב 1x PBS עבור 2 h ב RT ואור מוגן בחדר דגירה (20 μL/coverslip).
- שוטפים כיסוי 3x ב-1x PBS עבור 5 דקות.
- הר שמיכות על שקופיות מיקרוסקופ באמצעות 5 μL/coverslips של בינונית הרכבה הזריחה.
- . מוגן מפני אור, ליום אחד
- יקרוסקופ
- להציג ולרכוש תמונות באמצעות מיקרוסקופ פלואורסצנטית.
- עבור כל תנאי, השתמש בשלוש שכפול. בצע ספירת תאים בחמישה שדות מיקרוסקופיים עצמאיים בכל coverslip עם מטרה 40x (~ 100 תאים לכל שדה).
15. הכנת פתרונות מניות EGF ו-bFGF
- פתרון מלאי EGF
- כדי להוות מחדש את החומר, לדלל את המוצר במים הטוהר גבוה כדי להגיע לריכוז הסופי של 20 μg/mL.
- מחלקים ומאחסנים במיקרוצינוריות ב-5 עד 20 ° c.
- פתרון מניות bFGF
הערה: bFGF יש להיות מחדש עם פתרון של 10 מ"מ טריס, pH 7.6.- צנטריפוגה את המבחנה לזמן קצר לפני הפתיחה כדי להביא את התוכן לתחתית.
- הכינו 50 מ ל של טריס 10 מ"מ, pH 7.6. בשביל זה, שוקלים 60.57 מ"ג של טריס ((HOCH2)3cnh2) ולדלל אותו ב 40 mL של מים טוהר גבוהה. להתאים את ה-pH ל 7.6 ולפצות עד 50 mL עם מים הטוהר גבוה.
- הכינו 10 מ ל של 0.1% BSA ב 10 מ"מ טריס, pH 7.6. בשביל זה, שוקל 10 מ ג של BSA ולדלל אותו ב 10 מ מ של טריס 10 מ"מ.
- פתרונות סינון שהוכנו בשלבים 15.2.2 ו-15.2.3 עם פילטר מ0.22 יקרומטר מתחת למכסה זרימה למינארי.
- מרכיבים מחדש 10 μg של bFGF ב 1,000 μL של 0.1% BSA ב-10 מילימטר טריס עם pH 7.6 כדי להגיע לריכוז הסופי של 10 μg/mL. מחלק לתוך מיקרוצינורות ב-20 ° c למקסימום של 6 חודשים.
תוצאות
כדורי SVZ ו-DG, המתקבלים באמצעות ה-לאומי, מורכבים מתאים מובחן, חיובי עבור Sox2, גורם שעתוק מעורב ביכולת חידוש עצמי וחיובי עבור nestin, חלבון פילמנט ביניים ביטא NSPCs (איור 1א). בנוסף, ממדים שנגזרו על SVZ יש מימדים גדולים יותר מאשר עמיתיהם DG שלהם (איור 1א). וחשוב מכך, בתנאים מסוימים, SVZ-ו-DG נגזרות NSPCs לעבור מתוך כדורים נוירודוונייר של תאים (איור 1B).
כדי לגשת לקיבולת החידוש העצמי, מבוצעת הגישה של זוג התא מבוסס על הביטוי של Sox2 ו nestin אשר נוטה להעלם בחלוקת תאים המתחילים את תהליך הבידול עם שילוב של סמן של השושלת העצבית כלומר, DCX. באזורים נוירוגניים, ניתן להתבונן בנוכחות Sox2+/+/nestin+/+/dcx-/- מחלקות סימטריות (התחדשות עצמית) (איור 2A1, B1), Sox2/+/nestin-/+/dcx+/- מחלקות א-סימטריות (איור 2A1, B2) ו-Sox2-/-/nestin-/-/nestin+/+ מחלקות סימטריות (איור 2A2, B1).
הפסדות הנוירוספירות מגדילה את התשואה של NSPCs; עם זאת, מוות תאים ב DIV2 שינויים עם הפסמות. למעשה, אחוז התאים PI-חיוביים גדל עם מעבר תאים ב-SVZ (P0:15.6% ± 1.2% לעומת P1:19.2% ± 2.7% לעומת P2:32.35% ± 0.14% לעומת P3:39.6% ± 4.0%) ו-DG (P0:16.31% ± 0.95% לעומת P1:32.1% ± 1.7% לעומת P2:27.42% לעומת P3:32.2% ± 3.1%) (איור 3).
Neuritogenesis ניתן להעריך הנוירונים שהתקבלו מן הבידול של SVZ ו-DG NSPCs בתחילת בידול: DIV1 (איור 4A, D), DIV2 (איור4B, E) ו DIV3 (איור 4C, F). למעשה, כפי שנצפה באיור 4, האורך והרמיפיקציה של הניאוריטים מגדיל את הבידול.
ניתן להעריך את תפוצת התאים בתחומי הנוירוז-ו-DG נגזרות. השוואת נוירוספירות עיקריות הבדיל ב DIV1 מ SVZ (איור 5A1) ו-DG (איור 5A2), אחוז התאים BRDU-חיוביים גבוה יותר ב-SVZ מאשר ב-dg (svz: 6.15% ± 0.64% לעומת dg: 3.27% ± 0.13%; p < 0.05; n = 4; איור 5A3). יתר על כן, בידול התא ניתן גם לגשת על ידי שילוב BrdU מכתים עם יצרנית בוגרת כגון גרעינים עצביים (NeuN) המזהה נוירונים בוגרים (איור 5B1, B2). איור 5B3 מראה כי אחוז מתרבים ושלתי כי להבדיל לנוירונים בוגרים דומה svz ו-dg (svz: 12.04% ± 1.58% vs dg: 13.56% ± 0.48%; p > 0.05; n = 4).
את הסטטיות ואת רב העוצמה של SVZ-ו-DG נגזרות NSPCs ניתן לגשת באמצעות ה-לאומי על ידי הערכת הביטוי של סמנים שונים בימים בידול שונים (DIV2 ו DIV7). אכן, NSCs (nestin-ו גליה החלבון החומצי החומציות [gfap]-כפול-חיובי תאים) נמצאים שני באזורים נוירוגניים (איור 6A, G). תאים אלה מסוגלים להבדיל נוירונים בלתי בוגרים (התאים dcx-חיוביים) (איור 6B, H), נוירונים בוגרים (התאים neun-חיוביים) (איור 6F, L), אוליגודנדרוציטים התאים הקודמי (תא העצב, אנטיגן glial 2 [NG2] ו-טסיות נגזר גורם הצמיחהFigure 6הנגזרתα [pdgfrα] I), oligodendrocytes הפוך בוגרת (חלבון המיאלין בסיסי [mbp]-תאים חיוביים) (איור 6E, K) ו אסטרוציטים (התאים החיוביים gfap) (איור 6D, J).
מצעים שונים ניתן להשתמש כדי שמיכות מעילים כדי ליצור את הפסבדו של תאים תחת תנאים דיפרנציאל. כפי שמוצג באיור המשלים 1, תאי ה-DG להעביר יותר כאשר הכיסויים יש ציפוי נוסף עם למינציה בשילוב עם אש ף או PDL מאשר עם pdl בלבד (איור משלים 1B-H). למעשה, כאשר PDL ו-למינציה משמשים יחד כמו מצעים (המשלים איור 1C, G), התאים DG ליצור מדומה יותר בתאים מאשר בתאי svz אשר בשימוש PDL לבדה (איור המשלים 1C, E).
וחשוב מכך, תוצאות אלו מדגימות את הפוטנציאל של ה-אן. אס. איי להעריך את הסטטיות ואת תכונות רב העוצמה של NSCs הנגזרות משתי גומחות נוירוגניים הראשי.
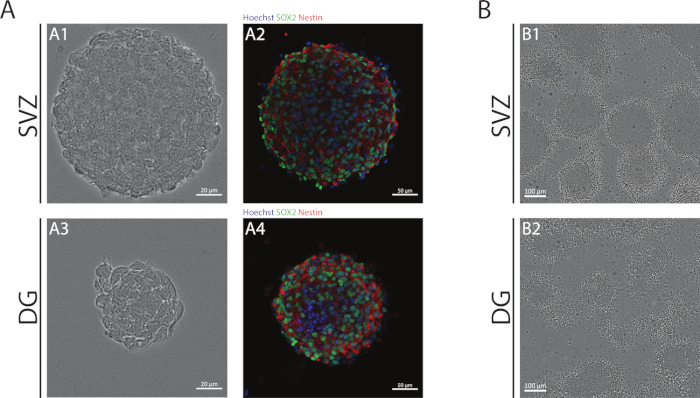
איור 1: אזור תת-חדרית ו-הדנטט פיתול כישור נגזר nspc תרבותי כמו נוירוספירות או כמו פסבדו. (א) הנציגה ברייטפילד (A1, A3) והתמונות הפלואורסצנטית (A2, A4) של svz-ו-DG, היכן שהגרעינים היו מוכתמים בצבע הואכסט 33342 (כחול) ו-NSCs עבור Sox2 (ירוק) ו-nestin (אדום). (ב) הנציג ברייטפילד דימויים של פסאודוונואולאיירס שנוצר מ-svz-ו-DG-הנגזרים בתנאים הדיפרנציאל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
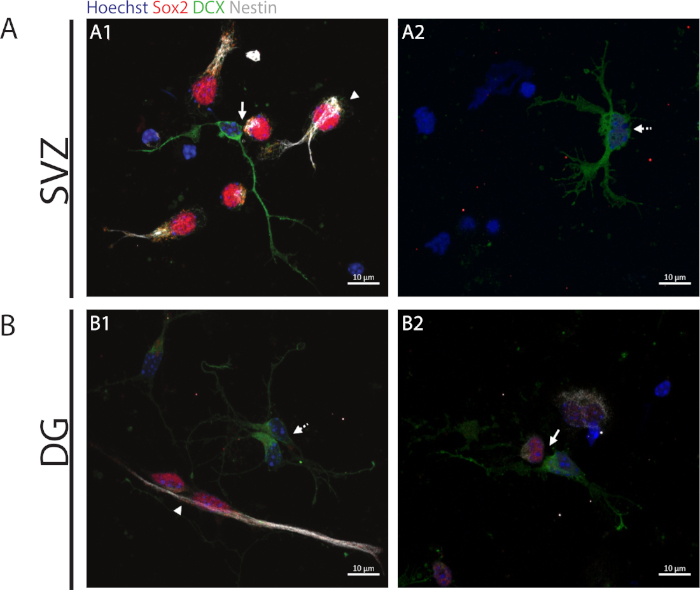
איור 2: שיטת הזוג התאים. מייצגים תמונות של זוגות תאים. שמקורם במחלקת תאים הגרעינים SVZ ו-DG היו מוכתמים עם Hoechst 33342 (כחול), תאים גזע כמו עבור Sox2 (אדום) ו nestin (לבן) כמו גם נוירונים בוגרים עם DCX (ירוק). ראשי חץ בפאנלים A1 ו-B1 מצביעים על Sox2+/+/nestin+/+/dcx-/- החלוקות לחידוש עצמי סימטרי, חיצים בחלוניות A1 ו-B2 מציינים Sox2+/-/nestin+/-/dcx-/+ מחלקות סימטריות, חיצי קו מקווקווים בחלוניות A2 ו-B1 מציגים Sox2-/-/nestin-/-/nestin+/+ מחלקות סימטריות ממבדילים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
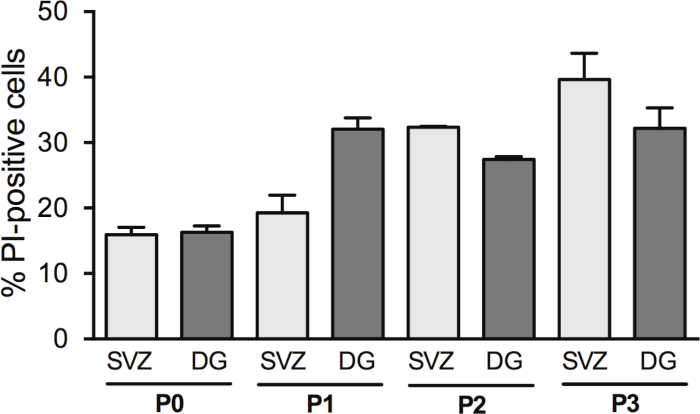
איור 3: ניתוח הישרדות התא עם הפסיית התא. ניתוח כמותי של תאים PI-חיוביים ב-DIV2 ב-SVZ-ו-DG-מובחנים בתרבות הנוירוספירה, לאחר 0, 1, 2 ו-3 קטעים (P0-P3). הנתונים מבוטאים כממוצע ± SEM, n = 1/8. PI = propidium יודיד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
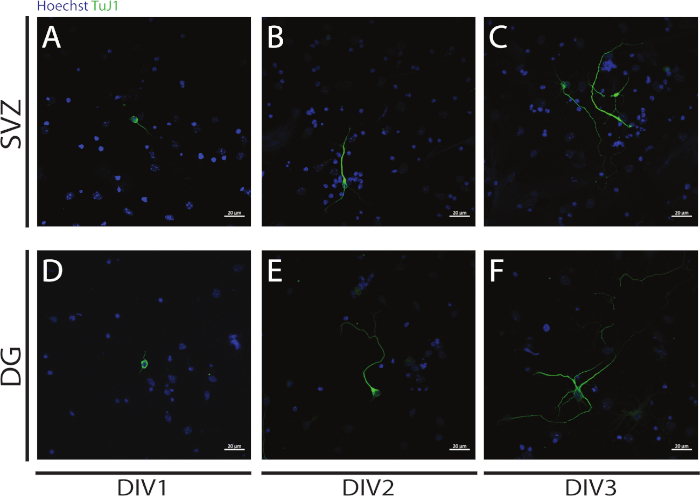
איור 4: ניתוח נוריטוגנזה בשנת DIV 1, 2 ו-3. הנציג ממוקד תמונות פלואורסצנטית של neurites, מזוהה על ידי βIII-טובולין האות, ב SVZ ו-DG נוירונים ב (A, D) DIV1, (ב, E) DIV2, ו (ג, F) DIV3. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
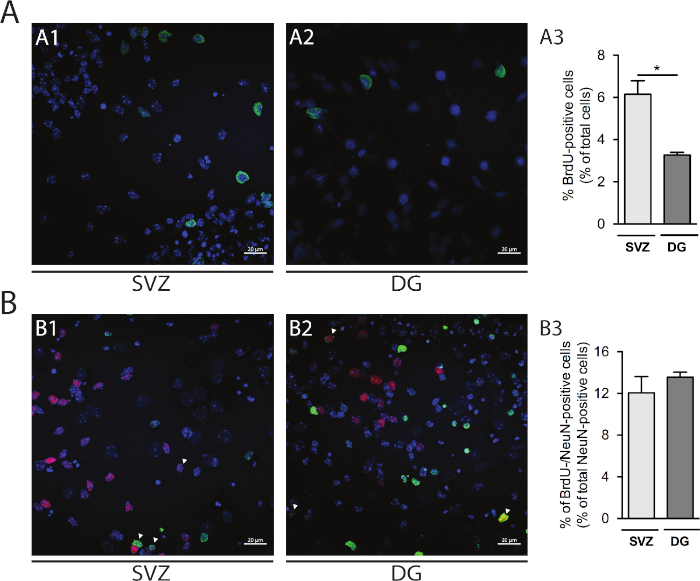
איור 5: שיטת הפצת תאים. מייצגים של תמונות מיקוד של תאים BrdU-חיוביים ב DIV1 (A1) svz ו (A2) DG. (A3) ניתוח כמותי של תאים BrdU-חיוביים ב DIV1 ב-DG-ו SVZ-נגזר הבדיל תרבות נוירוספירה. הנתונים מבוטאים כממוצע ± SEM, n = 4. * p < 0.05 על ידי t-test. מייצגים של תמונות זריחה של BrdU-ו NeuN-חיובי תאים ב DIV7 (B1) svz ו (B2) DG. ראשי חץ מציינים תאים BrdU-/Ne-. (B3) ניתוח כמותי של תאים BrdU-/Ne-DIV7 בשני גומחות. הנתונים מבוטאים כממוצע ± SEM, n = 4. Brdu: 5-brdu-2'-deoxyuridine, מלאכותי תימידין אנלוגי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
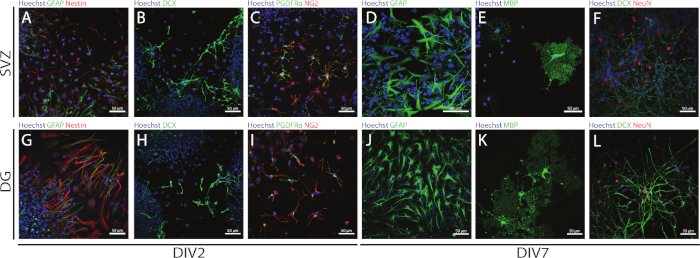
איור 6: סוגי תאים עצביים נמצאים SVZ-ו-DG-הבדיל בתרבות נוירוספירה. מייצגים של תמונות פלואורסצנטית של svz-ו-DG-נגזרות סוגי תאים לאחר 2 ו -7 ימים של בידול נוירוספירה (DIV2 ו DIV7), שבו גרעיני התא היו מוכתמים עם hoechst 33342 (כחול) ו: (A, G) NSCs עבור gfap (ירוק) ו nestin (אדום), (ב, H) נוירונים בוגרים עבור dcx (ירוק), (ג, I) אוליגודנדרוציטים תאים מקודכי עבור pdgfrα (ירוק) ו NG2 (אדום), (ד, J) אסטרוציטים עבור gfap (ירוק), (E, K) בוגרת oligodendrocytes הפוך עבור mbp (ירוק), ו (F, L) בוגרים נוירונים עבור nestin (אדום אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
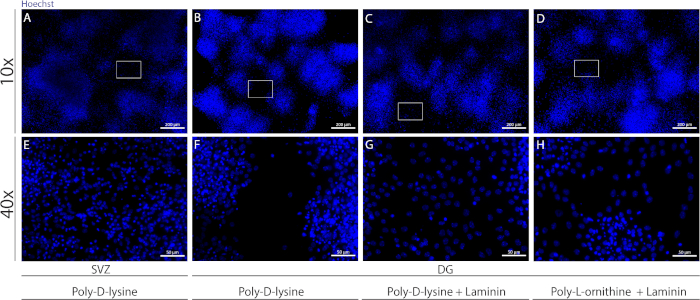
איור משלים 1: בדיקת מצעים שונים לדבקות נוירוספירה והגירה כדי ליצור פסבדו-מוח. מייצגים של תמונות פלואורסצנטית של (A, E) באמצעות פולי-ליזין כמצע, (ב, F) מפסאודוונוע באמצעות פולי-די-ליזין כמצע, (C, G) הפסאודוונוד dg-d באמצעות פולי-ליזין עם הלימינציה כמצע, ו (ד, ה) dg-D-משתמש באמצעות פולי-די-ליזין עם פולי-אל אורלך כמצע. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
במערכות חוץ-גופית של NSPCs מאפשרים הבנה טובה יותר של המנגנונים הסלולריים והמולקולריים, אשר ניתן לאימות נוסף בvivo. לחקות מצבים פיזיולוגיים. בשל המבנה התלת-מימדי שלהם כמו-כן, מערכת התרבות הזאת קלה יותר לתרבות10, לעומת אחרים במערכות מבחנה כגון מערכת התרבות המונאולייר. ואכן, עם ה-לאומי, קל לשלוט ברמזים חיצוניים חשופים במהלך פיתוח התא, או במהלך התפשטות או הבחנה, על ידי הוספת כמויות מדויקות ומשתנה של גורמי עניין למדיה, כמו גם על ידי נוירוטיורינג מדומה עם סוגי תאים אחרים6. יתר על כן, בהשוואה לתרבויות המונאולייר, בסוכנות לאומי, ניתן להשיג צפיפות תא גבוהה יותר מכמות קטנה של רקמה או עם מספר קטן של תאים, המאפשר למחקרים מקבילים להתבצע, ובכך להקטין את מספר בעלי החיים1.
ה-לאומי היא השיטה הנפוצה ביותר כדי לבודד ולהרחיב את NSCs11,12,13, ניתן להשתמש כדי להעריך את מספר התאים הקודמן הקיימים בדגם רקמות נתון5 ואת תדירות התא מקודמת בין תנאים שונים. עם זאת, גם הנוירוספירות ותרבויות המונרוייר אינן מתחשבות בשקט NSCs14. יתרה מזאת, לסוכנות המרכזית יש כמה מגבלות של11,12,13 ותדירות הנוירוספירה הנוצרת תלויה בגורמים רבים, כולל הרכיבים הבינוניים, הליך הניתוח, תהליך הדיסוציאציה11,12,13ומצבור נוירוספירה5. אכן, בתרבות בעלת צפיפות גבוהה, נוירוספירות נוטות לצבור. כתוצאה מכך, יש לנקוט זהירות בעת הערכת מספר התאים הקודמיים במדגם. כדי להתגבר על המגבלות הנ ל, ניתן גם להרחיב את nspcs בודדים ולעבור במונאולייר5,15. חשוב מכך, שימוש ב-לאומי להשוואת תדר התא הקודמי בין תנאים שונים הוא מאוד שימושי ומדויק משום שכל המגבלות הללו מפורשות ודומות בין כל התנאים המבוצעים באותו ניסוי.
ישנם צעדים קריטיים בתרבות נוירוספירה הזקוקים לתשומת לב. בשלב קצירת המוח, הסרה מלאה של קרום המח והבידוד הטוב של נישות הנוירוגניים חיוניים כדי למקסם את הטוהר והתשואה של NSPCs. במהלך הדיסוציאציה לרקמות, בשל פעילות הפרוטחרדה של טריפסין, שימוש מוגזם בטריפסין או בזמני דגירה ארוכים עלולים להוביל לפירוק תאים. יתרה מזאת, יום המעבר הוא קריטי להשגת אוכלוסיה בריאה של הנוירוספירות. הפסדות נוירוספירות עם קוטר גבוה יותר מ-200 יקרומטר משפיע מאוד על הכדאיות, יכולת ההתרבות והדיפרנציאל של nspcs. חשוב מכך, מחזורים ארוכים יותר של מעברים, יותר מ -10 יכול להגביר את חוסר היציבות הגנטית6. יתר על כן, ציפוי עם PDL ו PLD/למינציה עבור SVZ ו-DG תאים, בהתאמה, חיוני כדי להבטיח הגירה תא טוב מתוך נוירוספירות מבלי להתפשר על תהליך הבידול. מבחינת הניתוח האימונוציטוכימיה, זמני דגירה ארוכים יותר עם המישור הבינלאומי יכול לפגוע בצביעת על ידי מיסוך אנטיגנים והגדלת הרקע.
ה-לאומי הוא כלי רב עוצמה לאספקת מקור עקבי ובלתי מוגבל של nspcs למחקרים מחוץ לתחום של התפתחות עצבית ובידול, כמו גם למטרות טיפוליות16,17. ואכן, ניתן ליישם את האפשרות הזאת על מודלים גנטיים והתנהגותיים כדי להבין עוד יותר את המנגנונים המולקולריים והסלולאריים המעורבים בשגשוג nspc ובידול18,19. שיטת זה שימושית גם לבדיקת תרופות ותרכובות שונות20,21,22 וכן לבצע מניפולציות גנטיות19,23 לווסת נכסים לבטחון לאומי. בנוסף לאימונוציטוכימיה, תמלול הפוך תגובת שרשרת פולימראז וניתוח כתמי מערביות ניתן לבצע כדי לגשת RNA וביטוי חלבון, בעוד מחקרים אלקטרופיסיולוגיים והדמיה סידן ניתן להשתמש כדי להעריך את הפונקציה של הנוירונים נולד חדש21.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו נתמכה על ידי IF/01227/2015 ו UID/בים בם/50005/2019, הקסם הפיננסי העליון (FCT)/מיני-מיניריו דה-לוגי, Tecnoלוגיה a Ensino מעולה (מק) מפואר ביותר בצפון-מג (MCTES). R.S. (SFRH/BD/128280/2017, F.F.R. (IMM/CT/35-2018), D.M.L. (PD/BD/141784/2018), ו R.S.R. (SFRH/BD/129710/2017) קיבל מלגת מ-FCT. המחברים מתבקשים להודות לחברי מתקן הביודמיה ב-"המכון המולקולרי" לובו אנטז מולקולארי לסיוע במיקרוסקופ.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1X) | Gibco | 25300-054 | |
| 0.4% Trypan Blue solution | Sigma-Aldrich | T8154-20ML | |
| 12mm Glass coverslips | VWR | 631-1577 | |
| 15mL Centrifuge Tube | Corning | 430791 | |
| 5-bromo-2'-deoxyuridine | Sigma-Aldrich | B9285-1G | |
| 50 mL Centrifuge Tube | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira & Cª (Irmão) Sucrs, Lda | UN1170 | |
| Adhesion slides, Menzel Gläser, SuperFrost Plus | VWR | 631-9483 | |
| Alexa Fluor 488 donkey anti-chicken IgG (H+L) | Life Technologies | A11039 | |
| Alexa Fluor 488 donkey anti-rabbit IgG (H+L) | Life Technologies | A21206 | |
| Alexa Fluor 488 donkey anti-rat IgG (H+L) | Life Technologies | A21208 | |
| Alexa Fluor 568 donkey anti-mouse IgG (H+L) | Life Technologies | A10037 | |
| Alexa Fluor 568 donkey anti-rabbit IgG (H+L) | Life Technologies | A10042 | |
| Alexa Fluor 647 goat anti-mouse IgG (H+L) | Life Technologies | A21235 | |
| Anti-5-Bromo-2-Deoxyuridine | Dako | M0744 | |
| Anti-CD140a (PDGFRα) (rat) | BD Biosciences | 558774 | Dilute at a ratio 1:500. |
| Anti-Chondroitin Sulphate Proteoglycan NG2 (rabbit) | Merck Milipore | AB5320 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (rabbit) | Abcam | ab18723 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (chicken) | Synaptic Systems | 326006 | Dilute at a ratio 1:500. |
| Anti-Glial Fibrillary Acidic Protein (rabbit) | Sigma-Aldrich | G9269-.2ML | Dilute at a ratio 1:1000. |
| Anti-Myelin Basic Protein (rabbit) | Cell Signalling Technology | 78896S | Dilute at a ratio 1:200. |
| Anti-Nestin (mouse) | Merck Milipore | MAB353 | Dilute at a ratio 1:200. |
| Anti-Neuronal Nuclei (mouse) | Merck Milipore | MAB377 | Use 6% BSA in PBS 1X. Dilute at a ratio 1:400. |
| Anti-SOX2 (rabbit) | Abcam | ab97959 | Dilute at a ratio 1:500. |
| Anti-Tubulin β3 (rabbit) | BioLegend | 802001 | Dilute at a ratio 1:200. |
| Axiovert 200 wide field microscope | ZEISS | ||
| B-27 Supplement (50X), serum free | ThermoFisher | 17504044 | |
| Boric Acid | Sigma-Aldrich | B6768-500g | |
| Bovine Serum Albumin | NZYTech | MB04602 | |
| Cell counting chamber, Neubauer | Hirschmann | 8100104 | |
| Cell culture CO2 incubator | ESCO | CCL-170B-8 | |
| Corning Costar TC-Treated 24 Multiple Well Plate | Corning | CLS3524-100EA | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| DMEM/F-12, GlutaMAX Supplement | ThermoFisher | 31331028 | |
| Dumont #5 - Fine Forceps | FST | 11254-20 | |
| Dumont #5S Forceps | FST | 11252-00 | |
| Dumont #7 Forceps | FST | 11272-30 | |
| Epidermal growth factor | ThermoFisher | 53003018 | |
| Fibroblast growth factor | ThermoFisher | 13256029 | |
| Filter papers | Whatman | 1001-055 | |
| Fine Scissors - Sharp | FST | 14060-09 | |
| Gillete Platinum 5 blades | Gillette | ||
| HBSS, no calcium, no magnesium | ThermoFisher | 14175053 | |
| Hoechst 33342 | Invitrogen | 1399 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 (1L) | |
| Labculture Class II Biological Safety Cabinet | ESCO | 2012-65727 | |
| Laminin | Sigma-Aldrich | L2020 | |
| McILWAIN Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 450 μm |
| Micro Spatula - 12 cm | FST | 10091-12 | |
| Micro tube 0.5 mL | SARSTEDT | 72.699 | |
| Micro tube 1.5 mL | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL | SARSTEDT | 72.691 | |
| NeuroCult Chemical Dissociation Kit (Mouse) | Stem Cell | 5707 | |
| Olympus microscope SZ51 | Olympus | SZ51 | |
| Paraformaldehyde, powder | VWR | 28794.295 | |
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Petri dishes 60 mm | Corning | 430166 | |
| Phosphate standard solutions, PO43 - in water | BDH ARISTAR | 452232C | |
| Poly-D-Lysine 100mg | Sigma-Aldrich | P7886 | |
| Poly-L-ornithine solution | Sigma-Aldrich | P4957 | |
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide | Sigma-Aldrich | P4170-25MG | |
| Sodium chloride | VWR | 27800.360.5K | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Triton X-100 | BDH | 14630 | |
| VWR INCU-Line IL10 | VWR | 390-0384 |
References
- Reynolds, B., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of Visualized Experiments. (45), e2393 (2010).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11 (5), 951-966 (1993).
- Rietze, R. L., Reynolds, B. A. Neural Stem Cell Isolation and Characterization. Methods in Enzymology. 419, 3-23 (2006).
- Walker, T. L., Kempermann, G. One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Journal of Visualized Experiments. (84), e51225 (2014).
- Jensen, J. B., Parmar, M. Strengths and Limitations of the Neurosphere Culture System. Molecular Neurobiology. 34 (3), 153-162 (2006).
- Xapelli, S., et al. Activation of Type 1 Cannabinoid Receptor (CB1R) Promotes Neurogenesis in Murine Subventricular Zone Cell Cultures. PLoS ONE. 8 (5), e63529 (2013).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Nowakowski, R. S., Lewin, S. B., Miller, M. W. Bromodeoxyuridine immunohistochemical determination of the lengths of the cell cycle and the DNA-synthetic phase for an anatomically defined population. Journal of Neurocytology. 18 (3), 311-318 (1989).
- Weinberg, D., Adams, C. F., Chari, D. M. Deploying clinical grade magnetic nanoparticles with magnetic fields to magnetolabel neural stem cells in adherent versus suspension cultures. RSC Advances. 5 (54), 43353-43360 (2015).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. Journal of Visualized Experiments. (47), e2457 (2011).
- Azari, H., Louis, S. A., Sharififar, S., Vedam-Mai, V., Reynolds, B. A. Neural-Colony Forming Cell Assay: An Assay To Discriminate Bona Fide Neural Stem Cells from Neural Progenitor Cells. Journal of Visualized Experiments. (49), e2639 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres-re-evaluating the relationship. Nature Methods. 2 (5), 333-336 (2005).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proceedings of the National Academy of Sciences. 106 (15), 6387-6392 (2009).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities?. Nature Reviews Neuroscience. 11 (3), 176-187 (2010).
- Ghate, P. S., Sidhar, H., Carlson, G. A., Giri, R. K. Development of a novel cellular model of Alzheimer's disease utilizing neurosphere cultures derived from B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J embryonic mouse brain. SpringerPlus. 3 (1), 161 (2014).
- Pluchino, S., et al. Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis. Nature. 422 (6933), 688-694 (2003).
- Ogawa, Y., Kaizu, K., Yanagi, Y., Takada, S., Sakuraba, H., Oishi, K. Abnormal differentiation of Sandhoff disease model mouse-derived multipotent stem cells toward a neural lineage. PLoS ONE. 12 (6), e0178978 (2017).
- Khacho, M., et al. Mitochondrial Dynamics Impacts Stem Cell Identity and Fate Decisions by Regulating a Nuclear Transcriptional Program. Cell Stem Cell. 19 (2), 232-247 (2016).
- Soares, R., et al. Tauroursodeoxycholic Acid Enhances Mitochondrial Biogenesis, Neural Stem Cell Pool, and Early Neurogenesis in Adult Rats. Molecular Neurobiology. 55 (5), 3725-3738 (2017).
- Rodrigues, R. S., Ribeiro, F. F., Ferreira, F., Vaz, S. H., Sebastião, A. M., Xapelli, S. Interaction between Cannabinoid Type 1 and Type 2 Receptors in the Modulation of Subventricular Zone and Dentate Gyrus Neurogenesis. Frontiers in Pharmacology. 8, 516 (2017).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin?. Frontiers in Cellular Neuroscience. 8, 59 (2014).
- Kim, H. J., et al. Dynamin-related protein 1 controls the migration and neuronal differentiation of subventricular zone-derived neural progenitor cells. Scientific Reports. 5 (1), 15962 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved