Method Article
出生後(P1-3)マウス神経起源ニッチからの神経球の分離と拡大
要約
本稿では、主マウス神経原性ニッチ由来の出生後マウス神経幹細胞から神経球培養を生成するためのプロトコルについて詳細に述べる。神経球は、脳組織から神経幹細胞を同定するために使用され、前駆細胞数の推定を可能にする。さらに、これらの3D構造は分化条件でメッキすることができ、ニューロン、オリゴデンドロサイトおよびアストロサイトを生じさせ、細胞運命の研究を可能にする。
要約
神経球アッセイは、増殖、自己再生、多能性を含む神経幹細胞/前駆細胞(NCC)の固有の特性を研究するための非常に有用なインビトロ技術です。出生後および成人の脳では、NCCは主に2つの神経新生ニッチに存在する:側心室を裏打ちする脳室帯(SVZ)と海馬デンテート回(DG)のサブ顆粒帯。出生後の脳からの神経原性ニッチの分離は、より高い収率の結果的な利点を有する培養中のNCCのより高い量を得ることを可能にする。各神経圏内の細胞間の密接な接触は、神経起源のニッチに似ている可能性のある微小環境を作成します。ここでは、1-3日齢(P1-3)マウスからSVZおよびDG由来の神経球培養を生成する方法と、経大体による神経球の拡張について詳しく説明します。これは、神経圏アッセイにより、NSPCクローンの高速生成(6-12日)が可能であり、動物の使用数の大幅な減少に寄与するため、有利なアプローチです。分化条件で神経球をめっきすることにより、NSPCと異なる神経系統(ニューロン、アストロサイト、オリゴデンドロサイト)の分化細胞で構成される細胞の擬似単層を得ることができ、NSPC増殖、分化、細胞生存および腎生異に対する固有または外因性因子の作用の研究を可能にする。
概要
神経球アッセイ(NSA)は、1992年1年、22年に最初に説明され、神経幹細胞(NSC)研究におけるユニークで強力なツールのままです。主な神経原性領域からのNSCの分離は、生理学的状態でこれらの細胞を維持するための要件が十分に理解されていないので、困難な問題を抱えています。NSAにおいて、細胞は、表皮成長因子(EGF)および塩基性線維芽細胞増殖因子(bFGF)1、2、3を含む増殖因子の存在を有する化学的に定義1,2,3された無血清培地で培養される。神経前駆細胞(幹細胞および前駆細胞)は、これらの細胞がEGFおよびFGF応答性の期間に入り活性増殖の期間であるので、これらのマイトゲンを用いて選択され、他の細胞、すなわち分化した細胞は、死ぬ4である。神経前駆細胞は神経球として増殖し、その後、これらの細胞のプールをさらに拡大するために通過することができる5.重要なことに、これらの神経幹細胞前駆細胞(NCC)は多能であるため、ニューロン、オリゴデンドロサイトおよびアストロサイト5の3つの主要な細胞型(CNS)に分化することができる。
NSAは、生理学的および疾患の文脈の両方で、NSC増殖および自己再生、および神経およびグリア分化を含むいくつかのプロセスを研究するために使用することができる未分化CNS前駆体の再生可能な供給源を提供する。さらに、インビトロ研究は、開発中の神経前駆体に存在する固有の仕様の程度を評価し、細胞の全能力を研究し、それらの正常な環境6に関連する外因性の手がかりを除去することによって使用することができる。神経球モデルは、血清を欠いた培地中に細胞を維持することによって、環境キューが周囲の細胞6によってのみ提供されるので、推定調節因子を評価するのに価値がある。さらに、NSAでは、NSPCは培養中に容易に拡大され、領域あたりの細胞の密度が高く、神経圏の不均一な組成はインビボニッチ6といくつかの類似性を有する。これらの確立された利点は、この方法論が多くの研究者によって広く使用されている理由です。
以下のプロトコルは、2つの主要な神経原性領域(脳室領域(SVZ)および海馬樹状回(DG)からの出生後NSPC集団の単離から、神経球としての細胞の拡大、ならびにニューロン、星細胞およびオリゴデンドロサイトへの分化に関する全てのプロセスを詳細に記述する。最後に、SVZおよびDG由来のNCCsのステムおよび多能性特性にアクセスするために、異なるアッセイも記載されている。
プロトコル
すべての実験は、欧州共同体(86/609/EEC;2010/63/EU;2012/707/EU)およびポルトガル語(DL 113/2013)の法律に従って行われ、科学的目的で使用される動物の保護に関する法律です。この議定書は、「iMMの制度的動物福祉団体- ORBEA-iMMと国家管轄官庁 - DGAV(ディレクサン・ジェラル・デ・アリメンタサン・エ・ヴェテリナリア)」によって承認されました。
1. 培地の基本設定と準備
- 解剖の日に、100 U/mLペニシリンと100μg/mLストレプマイシン(ペン/ストレップ)を補ったDulbeccoの修飾ワシ培地((DMEM)/F12とL-グルタミン)で構成された無血清培地(SFM)に対応する適切な量の成長培地を調製する また、10 ng / mL EGFと5 ng / mL bFGFを持つ。水浴で37°Cに培地を温めます。
注:成長培地の量は子犬の数に依存し、5人の子犬は〜100 mL(SVZの場合は50 mL、DGの場合は50 mL)を準備します。ただし、セル数をカウントした後 (ステップ 5.1) 正確な体積を調整する必要があります。 - SVZとDGのマイクロディシブ分けのために、カルシウムとマグネシウムフリーハンクスのバランスのとれた生理液(HBSS)解剖媒体を100 U / mLペン/ストレップで補う準備をします。
注意:解剖媒体の50-100 mLを準備してください。 - 解剖顕微鏡を設置し、70%エタノールに浸すことによって、脳(はさみと小さなへら)とSVZとDGマイクロディセクション(デュモン小さみ、#7鉗子、#5鉗子、#5S鉗子)を取り除くために必要なツールを準備します。
2. 出生後(P1-3)マウス脳およびSVZ/DGマイクロディスセクションの収穫
- 60 mm ペトリ皿 (成長領域 21 cm2)をペン/ストレップで補った HBSS とサンプルチューブ 2 つ(SVZ 用と DG 用に 1 つずつ)を用意し、それぞれ 500 μL の HBSS を補充します。
- 施設動物ケア施設/ガイドラインによって承認されたプロトコルに従って、マウスの子犬(P1-3)を安楽死させます。脳幹の基部に鋭いはさみで単一の切開で切断を行う。
- 頭部の基部に体の腹側部分を保持し、小さな尖ったはさみを使用して、頭の全長にわたって皮膚に中線切開を行い、頭蓋骨の表面を明らかにする。
- 頭蓋骨の基部に縦切開を行い、脳構造を損傷しないように、可能な限り浅い角度の小さなはさみを使用して矢状縫合に沿って切断し続けます。
- 湾曲した鉗子を使用して頭蓋骨を側面に皮をむき、脳を露出させる。
注意:脳に触れる前に、解剖器具にエタノールが含まれているのを確認してください。 - 小さなへらを使用して頭蓋骨から脳を分離し、脳の基底下をスライドさせて脳の基部に接続された脳神経および血管を切断し、冷たい補充されたHBSS溶液を含むペトリ皿に脳を移す。
- 脳を含むペトリ皿を低倍率で解剖顕微鏡の下に置き、脳を後ろ面に置きます。
- 細かい鉗子を使用して、脳の腹側と嗅球から髄膜を取り除き、脳を小脳の位置に保持する。脳を腹側の側面に回転させ、残りの髄を剥がします。
注:後部髄膜を取り除くことは、正しい脳スライスを確保するための重要なステップです。 - 鉗子を使って切り傷を作る小脳を捨てる。11μmの細孔サイズのフィルターペーパーをティッシュチョッパー(材料表)に置き、湾曲した尖った鉗子を使って脳をフィルター用紙にセットします。450 μmのコロナセクションに脳を刻み、湿った薄層を使用して、冷たい補充されたHBSSで満たされた新しいペトリ皿に切り離された脳を収集します。
- SVZを解剖するには、鉗子を使用して、解剖顕微鏡の下で側心室でスライスに到達するまで、前から後の方法でコロナスライスを分離します。
- 腹腔の側壁(SVZに対応)を囲む組織の薄い層を、線条体の花脈腫と脳梁を除く細い鉗子で切断する。側室の側隅に鉗子の先端を置くことによってSVZを分離する:一方は、心室の腹側領域に隣接する組織に、一方は、心室の下に直ちに、もう一方の先端を置く。次に、側心室を囲む組織の小さなラインを切断する。
- 以前にSVZとして同定された補足されたHBSS溶液を含むサンプルチューブに解剖された組織を収集する。
注:横心室と海馬の形成の両方が現れ始めるスライスでSVZを除外します。 - SVZマイクロ解剖後の全てのスライスを前から後へ行き、海馬の形成に達する。鉗子を使用すると、DGがまだ認識できない海馬で最初のスライスを捨てます。
- DGを除去するには、まず海馬をスライスから分離する。顕微鏡を再び焦点を合わせ、DG の周囲の境界を視覚化します。
- DGとCA1領域間の切り取りを行い、続いて鉗子を用いてDGとCA3領域の間で垂直に切り取ってDG部分を解剖する。フィムリアと隣接する組織を取り除きます。
注:P1-3動物では、DGはアンモンの角とほとんど区別がつかないが、小さな先端を表示する。 - DGとして以前に同定された補充されたHBSS溶液を含むサンプルチューブに解剖された組織を集める。
注:海馬または周囲の全体的な損傷は、DGを分離することがより困難になります。出生後マウス脳のアトラスを使用することは、ユーザーがコロナ切片からのSVZおよびDG組織の分離に精通していない場合に不可欠である。
3. 組織解離
- それぞれのチューブに存在するSVZとDG組織を解離するには、トリプシン-EDTA 0.05%を加えて、HBSSでトリプシン-EDTA 0.05%の5-10%の最終濃度を有する。37°Cで約15分間インキュベートし、組織が凝集するまで。
- 培地を取り外し、新しいHBSS補充溶液を1 mL連続して添加してトリプシンからティッシュを洗浄します。
- HBSSを取り外し、10 ng / mL EGFと5 ng / mL bFGFを補充したSFMの1 mLで消化された組織を再中断します。P1000ピペットを使用して約7〜10倍の上下に穏やかにピペットを入れ、均質な細胞溶液になるまで、ペレットを機械的に解化します。
注意: 過度の機械的解離は細胞死の増加を招き、その後の細胞増殖に悪影響を及ぼす可能性があります。
4. 細胞の運命を研究するための細胞対アッセイ
- 実験の前に、セクション8-10に従って接着単層培養のためのコーティングされた24ウェルプレートを準備する。
- めっきするSVZまたはDG細胞(セクション3で得られる)の数を数えるために、0.2%トリパンブルーを含む溶液を使用し、血球計を使用して細胞を数える。
- 解約した細胞懸濁液を5 ng/mL EGFと2.5 ng/mL bFGF(低EGF/bFGF)を11,300セル/cm2の密度で補い、コーティングされたガラスカバースリップにプレートします。
- 24時間後、性決定領域Y-box 2(Sox2)およびネスチンなどのNSCマーカーに対する免疫細胞化学の細胞を、ニューロン系統のマーカー(すなわち、未熟なニューロンの場合はダブルコルチン[DCX])で固定する(セクション14参照)。
注:Sox2は、有糸分裂を起すNSCのマーカーです。単一の前駆細胞分裂から生じるSox2+/+細胞対は、幹細胞の拡張7を反映する。+/+
5. 神経球としての出生後神経幹細胞の拡大
- 解離されたSVZまたはDG細胞懸濁液(セクション3で得られる)の密度を決定するために、造液計を用いて細胞を数える。
- SVZおよびDG単細胞懸濁液は、10 ng/mL EGFおよび5 ng / mL bFGFを補ったSFM中の2 x 104細胞/mLの密度で希釈した。シード SVZ と DG 細胞をコーティングされていない 60 mm ペトリ皿に 5 mL/ペトリ皿の最終容積で。
- SVZ細胞とDG細胞をそれぞれ6-8日および10-12日間インキュベートし、5%CO2で37°Cでプライマリ神経球を2形成する。
注:前述の日数よりもインキュベーション日数は、神経球の中心における神経球およびより高いレベルの細胞死の凝集を促進することができる。 - 神経球の大部分が150-200 μmの直径を有する場合は、神経球の通過を行う。
注:適切な直径がない場合、神経球を通過すると、次のすべてのステップが妥協します。
6. 神経球の通過
注: SVZ と DG の両方の神経球を拡張するために、次のプロトコルを適用できます。
- 神経球を通過するには、60 mmペトリ皿から神経球を含む成長因子と、300 x gで5分間の遠心分離機を集める。
- 上清を捨て、メーカーの指示に従って化学解離キット(マウス)を使用して神経圏ペレットを再中断する(材料表)。
注意: インキュベーション時間は、パフォーマンスにとって重要な点で正確に観察してください。 - 300 x gで 5 分間の遠心分離機、上清を除去し、10 ng/mL EGF と 5 ng/mL bFGF を補った SFM の 1 mL を加えます。
- P1000ピペットで上下に約10倍の上下をトリチュレートして、神経球を解体します。
- 0.2%トリパンブルーとヘマトサイトメーターを含む溶液を使用して細胞の数を数えます。
- コーティングされていない60 mmペトリ皿の2 x 104細胞/mLの密度で細胞を再シードします。
- SVZおよびDG細胞をそれぞれ6-8日および10-12日間インキュベートし、2次神経球を得るために、37°Cで5%CO2を有する。
注: SVZ および DG 由来の NSPCs の自己更新容量は、プロトコル セクション 5 と 6 に従ってアクセスできます。そのために、5 ng/mL EGFおよび2.5 ng/mL bFGF(低EGF/bFGF)を含む増殖SFM培地において、SVZおよびDG細胞を1.0 x 104細胞/mL(コーティングされていない24ウェルプレート)の濃度でシードします。結果として生じる一次および二次神経球の数を数える。
7. 神経球の貯蔵
- 60 mm ペトリ皿から神経球(ステップ 5.3 および 6.7 から得られる)を含む培地を収集します。
- 遠心分離機は300xgで5分間g、上清を捨てる。
- HBSSの1 mLで細胞2倍を洗浄します(300 x gで5分)。
- 300 x gで5分間の遠心分離機は、上清を捨て、分子生物学解析のために-20°Cで神経球のペレットを保存します。
8. PDLコーティングプレート手順
- 溶液1(0.1 Mホウ酸緩衝液)を調製するために、ホウ酸の3.92gを秤量し、400mLの高純度水で希釈した。pHを8.2に調整し、純度の高い水で最大500 mLにします。
- 溶液2(0.167 Mホウ酸緩衝液)を調製するために、ホウ酸の10.3gを重量を量り、900mLの高純度水で希釈した。pHを8.2に調整し、純度の高い水で最大1,000 mLにします。
- ポリ-D-リジン(PDL)(0.1 Mホウ酸緩衝液中1mg/mL)を再構成し、100mLの溶液中で100mgのPDLを希釈する。
- すぐに使用するか、凍結し、-20°Cで保存するために10 mLのアリコートを作ります。
- 層流の下で、ウェルあたり1カバースリップを加え、15分間UV光の下で殺菌します。
- 再構成された PDL を使用するか、凍結された再構成された PDL を解凍します。
- 10 mLの再構成PDLを溶液2の90 mLに加えて、0.167 Mホレートバッファーで100 μg/mL PDLの最終溶液を調製します。
- 37°Cで一晩に2時間以上のウェルに最終溶液を追加します。
メモ:24ウェルプレートの場合は、各ウェルに500 μLのボリュームを追加します。 - 溶液を取り除き、3倍の高純度水で洗浄します。
- カバーリップを層流フードで乾燥させます。
- マルチウェル培養プレートは4°Cのままにしておきます。
9. PDL/ラミニンコーティングプレートの手順
- 1日目に、セクション8に記載されているようにPDLでプレートをコーティングします。
- 2日目にPDL溶液を取り出し、3倍の高純度水で洗浄します。乾かします。
- 成長因子を欠いた冷たいSFMで5μg/mLラミニンを準備してください。
- 溶解したラミニンをカバースリップに加え、一晩で37°Cでインキュベートします。
メモ:24ウェルプレートの場合は、各ウェルに500 μLのボリュームを追加します。 - ピペットを使用してラミニンを取り除く。
注:ラミニンからカバーリップを洗い流さないで下してください。 - すぐに使用するか、-20°Cで保管してください。
10. ポリ-L-オルニチン(PLO)/ラミニンコーティング手順
- 層流の下で、ウェルあたり1つのカバースリップを加え、15分間紫外線の下で殺菌する。
- 室温(RT)で20分間、各ウェルに0.01%のPLO溶液を加えます。
メモ:24ウェルプレートの場合は、各ウェルに500 μLのボリュームを追加します。 - 溶液を取り除き、殺菌した1x PBSで3倍洗います。乾かします。
- 滅菌1x PBSで5μg/mLラミニンを調製します。
- 37°Cで2時間インキュベートする。
- ラミニンを取り除く。
注:ラミニンからカバーリップを洗い流さないで下してください。 - すぐに使用してください。
注:カバースリップをピペットチップで軽くタップして、カバースリップがPLO溶液で完全に覆われていることを確認してください。振ると、マルチウェルプレートは音を出さないはずです。
11. 細胞の分化単層生成による腎細胞形成の評価
- 60 mm ペトリ皿(セクション5から得た)から神経球を含む培地を集め、遠心分離機をRTで300 x gで5分間回収します。
- 上清を捨て、神経球のペレットを解離PBSの1mLで解離する(すなわち、PBS(すなわち、 MG2+/Ca2+を含まないPBSおよびEDTA [2.7 mM KCl,1.5 mM KH2PO 4,137 mM NaCl,8.1 mM Na42HPO 4および0.5 mM EDTA4Na,pH = 7.40]で15分間インキュベートし、続いて機械的解離を行う。あるいは、化学解離キット(マウス)を用いて神経圏を解離する(材料表)。
- 遠心分離機はRTで300×gでg5分間、上清を捨てます。
- 増殖因子を欠いたSFMの1mLで細胞ペレットを再懸濁する。
- 造型計を用いて細胞密度を決定する。
- 3,766細胞/cm2の密度で増殖因子を欠いたSFMで解約細胞懸濁液を希釈し、24ウェルプレートのコーティングされたガラスカバーリップにプレートセルを塗布します。
- 1~3日後、細胞骨格のタンパク質に対して免疫細胞化学用の細胞を固定します(セクション14を参照)。
12. 神経球培養の分化
注:細胞の拡張から得られた神経球は、一次または通過した神経球(5条または6節で得られる)から得られ、異なる神経系統の細胞に分化することができる。
- 神経球の直径が150-200 μmの場合、24ウェルプレートに25μLの神経スフィア懸濁液およびプレートをコーティングされたガラスカバーリップに集めます。
注:より多くの神経球を収集するには、ペトリ皿をそっと回転させて神経球を中央に集中させます。次いで、中央からピペットを。 - 37°Cのインキュベーターにプレートを15分間入れて、神経球が基質に付着するようにします。その後、成長因子(分化条件)を欠いたSFMの500 μLを加えます。
- 24時間後、成長因子を欠いた新鮮なSFMで培地を交換してください。
- 37°Cで5%CO2と95%の大気空気で異なる時点(例えば、2日と7日間のインビ2トロ、DIV2およびDIV7、それぞれ)を区別します。
注:細胞の生存、増殖および分化は、異なる細胞アッセイを用いて分析することができる。
13. 細胞生物学のアッセイ
- 細胞生存アッセイ
- メッキされた神経球を3μg/mLヨウ化プロピジウム(PI)に30分間、培養器内の細胞固定の前に37°Cで曝露する。
注:PIは、侵害された膜の完全性8を持つ細胞に入ることができる自己蛍光剤です。細胞生存を分析する他の方法は、カスパーゼ3染色または末端デオキシヌクレオチジルトランスファーゼdUTPニックエンドラベリング(TUNEL)アッセイなどの使用することができる。
- メッキされた神経球を3μg/mLヨウ化プロピジウム(PI)に30分間、培養器内の細胞固定の前に37°Cで曝露する。
- 細胞増殖アッセイ
- メッキされた神経球を、37°Cのインキュベーターに固定する前に4時間、10 μM 5-bromo-2'-deoxyuridine (BrdU) に曝露します。
注:BrdUは、増殖細胞9でDNA合成中に組み込むことができる合成チミジン類似体である。
- メッキされた神経球を、37°Cのインキュベーターに固定する前に4時間、10 μM 5-bromo-2'-deoxyuridine (BrdU) に曝露します。
- 細胞分化アッセイ
- 7日間のめっきされた神経球を最初の24時間で10 μM BrdUに、インキュベーターで37°Cで曝露する。
- 成長因子(分化条件)を欠いたSFMを更新し、細胞が固定されるまでの次の6日間のBrdUの不在時に発症することを可能にする。
注:これらのパルス追跡実験は、成熟した神経細胞のマーカーと共に標識することにより、プロトコル中に成熟細胞に分化する前駆細胞の評価を可能にする。
14. 神経球培養の免疫染色
- 細胞固定
- 4%パラホルムアルデヒド(PFA)を1x PBSで調製し、4°Cまたは-20°Cで保管してください。
- ウェルから成長因子を欠いたSFMを取り除き、各井戸に4%PFAの500 μLを4°Cで20分間RTで追加します。
- 3xを1x PBSで洗浄し、毎回5分間、分化した神経球を含むカバースリップを洗う。
- カバースリップは、1x PBSの500 μLで4°Cで使用するまで保管してください。
メモ:実験にBrdUがない場合は、ステップ14.3に進んでください。
- 変性法(BrdU実験のみ)
- 37°Cで1M HClを準備する。
- 1x PBSで3倍のカバーリップをすすい。
- 1%の非イオン性界面活性剤を含有するPBS中の30分間の透過細胞(例えば、トリトンX-100)。
- 1 M HCl を 37 °C に 37°C (37°C)で 30~40 分間前加熱して dsDNA を変性させる(300 μL/ウェル)。
- 1x PBSで4倍の井戸を洗います。
- パーメビライゼーションとブロッキング
- 1x PBSで5分間のカバーリップをすすいでください。
- 1x PBS(約300 μL/well)で、0.5%の非イオン性界面活性剤と3%のウシ血清アルブミン(BSA)を用いて1.5時間インキュベートします。
メモ: NeuN の場合は、1x PBS で 6% BSA を使用してください。
- インキュベーションおよび取り付け
- 1日目、洗浄せずに、一次抗体(材料表)を用いたインキュベート細胞をインキュベーションチャンバー内の1x PBSで0.1%非イオン性界面活性剤でインキュベートし、BSAを0.3%インキュベーションチャンバーに用いた(24ウェルプレートの場合は20μL/well)。抗体がフルオロフォアに結合する場合は、4°C光で一晩培養するカバーリップを保護します。
- 2日目には、カバースリップをそれぞれの井戸に戻し、1x PBSで3xを5分間すすぎます。
- 適切な蛍光共役二次抗体(希釈1:200)と12 μg/mL Hoechst 33342を用いたカウンターステインは、RTで2時間、インキュベーションチャンバー(20 μL/カバースリップ)で保護された光を1x PBSで12 μg/mL Hoechst 33342と共に行った。
- 1x PBSでカバーリップ3倍を5分間洗浄します。
- 蛍光実装媒体の5 μL/カバースリップを使用して顕微鏡スライドにカバースリップを取り付けます。
- 1日間、光から保護されたRTで空気を乾かします。
- 顕微鏡
- 蛍光顕微鏡を使用して画像を表示および取得します。
- 条件ごとに 3 つのレプリケートを使用します。40xの目的(フィールドあたり100細胞まで)をカバースリップの5つの独立した顕微鏡フィールドで細胞数を実行します。
15. EGFおよびbFGFストックソリューションの調製
- EGFストックソリューション
- 凍結乾燥したEGFを再構成するには、高純度水で製品を希釈して20μg/mLの最終濃度に達します。
- アリコートとマイクロチューブで-5〜-20 °Cで保管してください。
- bFGF ストックソリューション
注: bFGF は、10 mM トリス、pH 7.6 の溶液で再構成する必要があります。- コンテンツを底に持ち込むために開く前に、バイアルを少し遠心分離します。
- 10 mMトリス、pH 7.6の50 mLを準備します。そのためには、60.57mgのトリス(HOCH2)3CNH2)を、40mLの高純度水で希釈します。pHを7.6に調整し、純度の高い水で最大50mLにします。
- 10 mMトリス、pH 7.6で0.1%BSAの10 mLを準備します。そのためには、10mgのBSAの重量を量り、10 mMトリスの10 mLで希釈します。
- ステップ 15.2.2 および 15.2.3 で準備されたフィルター ソリューションで、ラミナー フロー フードの下に 0.22 μm フィルターを使用します。
- 10 μg の最終濃度に到達するために、10 mM トリスで 0.1% BSA の 1,000 μL で 10 μg を再構成して、最終濃度 10 μg/mL に到達します。-20°Cでマイクロチューブにアリコートを最大6ヶ月間使用します。
結果
NSAを用いて得られたSVZおよびDG神経球は、未分化細胞で構成され、Sox2に対して陽性、ネスチンに対する自己再生能力および陽性に関与する転写因子である、NSPCsで発現する中間フィラメントタンパク質(図1A)。また、SVZ由来の神経球は、DGよりも大きな寸法を持っています(図1A)。重要なのは、分化条件において、SVZ由来およびDG由来のNCCsは、細胞の疑似単層を形成する神経球から移動する(図1B)。
自己再生能力にアクセスするために、細胞対アッセイは、分化プロセスを開始する分割細胞において消失する傾向があるSox2およびnestinの発現に基づいて行われる。両方の神経性領域で、 Sox2+/+/nestin+/+/DCX--対称分割(自己更新)、Sox2-/+Figure 2A1,B1/nestin-/+ / /の存在を観察することが可能です。 DCX+/-非対称分割 (図 2A1,B2) および Sox2-/-/nestin--/DCX+/+対称分割 (分化) (図 2A2,B1)。
神経球を通過すると、NCCの収率が増加します。しかし、DIV2での細胞死は、受け継ぎによって変化する。実際、Pi陽性細胞の割合はSVZの細胞通過に伴って増加する(P0:15.6%±1.2%対P1:19.2%±2.7%対P2:32.35%±0.14%対P3:39.6%±4.0%)DG(P0:16.31%±0.95%対P1:32.1%±1.7%対P2:27.42%対P3:32.2%±3.1%)(図3)
分化の開始時にSVZとDG NSPCsの分化から得られたニューロンで神経新しい遺伝子導入を評価することができます: DIV1 (図 4A,D),DIV2 (図 4B,E) および DIV3 (図 4C,F).実際、図4に示されているように、分化に伴って、神経突起の長さと影響が増加します。
細胞増殖は、SVZ由来およびDG由来の神経球において評価することができる。DIV1の一次分化された神経球をSVZ(図5A1)とDG(図5A2)と比較すると、BrdU陽性細胞の割合はDGよりもSVZで高い(SVZ:6.15%±0.64%対DG:3.27%±0.13%;p<0.05;n=4;図 5A3)。また、細胞分化は、成熟したニューロンを識別するニューロン核(NeuN)などの成熟したメーカーとBrdU染色を組み合わせることによってもアクセスすることができる(図5B1、B2)。図5B3は、成熟したニューロンに分化する増殖前駆物質の割合がSVZおよびDGで類似していることを示している(SVZ:12.04%±1.58%対DG:13.56%±0.48%;p>0.05;n=4)。
SVZおよびDG由来のNCCのステムおよび多能性は、異なる分化日(DIV2およびDIV7)で異なるマーカーの発現を評価することによってNSAを使用してアクセスすることができる。実際に、NSC(ネスチン及びグリア性フィブリリン酸性タンパク質[GFAP]-二重陽性細胞)は、両方の神経原性領域に存在する(図6A,G)。これらの細胞は、未熟なニューロン(DCX陽性細胞)(図6B,H)、成熟したニューロン(NeuN陽性細胞)(図6F,L)、オリゴデンドロビテ前駆細胞(ニューロングリア抗原2[NG2]および血小板由来増殖)に分化することができる 因子受容体α[PDGFRα]-陽性細胞)(図6C,I)、C,I成熟オリゴデンドロサイト(ミエリン塩基性タンパク質[MBP]陽性細胞)(図6E,K)およびアストロサイト(GFAP陽性細胞)(図6D,J)。
異なる基質は、分化条件下で細胞の擬似単層を形成するためにカバースリップをコーティングするために使用することができます。補助図 1に示すように、カバーリップが PDL 単独での場合よりも PLO または PDL と組み合わせたラミニンを使用したエクストラコーティングを持つ場合、DG 細胞の移行が多くなります (補助図 1B-H)。実際、PDLとラミニンを基質として一緒に使用すると(補助図1C、G)、DG細胞はPDLが単独で使用されるSVZ細胞よりもコンフルエントな擬似単層を形成する(補助図1A、E)。
重要なことに、これらの結果は、2つの主要な神経原性ニッチに由来するNSCの茎および多能性特性を評価するNSAの可能性を示す。
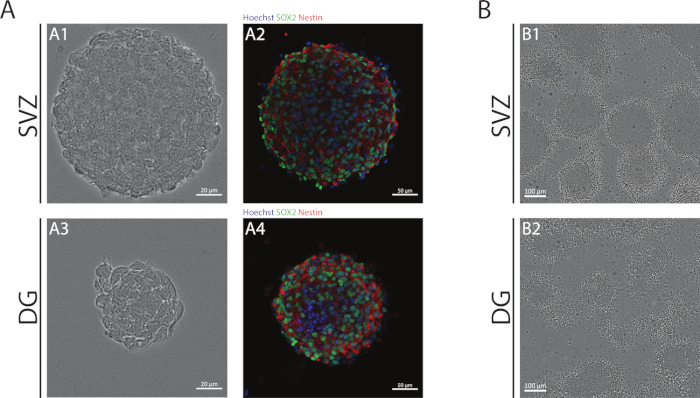
図1:神経球体または擬モノ層として培養した脳室下帯およびデンテート回由来NSPC。(A) SVZおよびDG由来の神経球の代表的な明視野(A1,A3)および蛍光(A2,A4)画像で、Hoechst 33342(青)とNSC(緑色)とネスチン(赤)の核が染色された。(B)分化条件下でSVZおよびDG由来の神経球から生成された擬似モノ層の代表的な明視野画像。この図の大きなバージョンを表示するには、ここをクリックしてください。
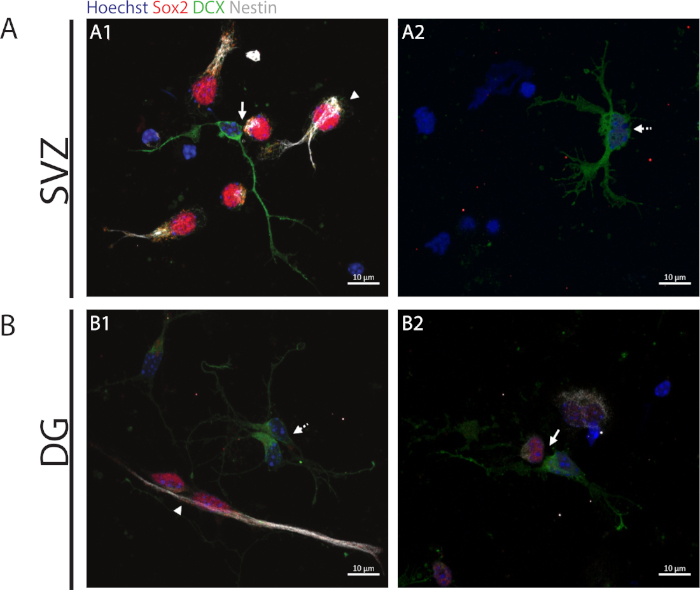
図2:細胞対アッセイ。前駆細胞分裂に由来する細胞対の代表的な蛍光画像。SVZおよびDG核をHoechst 33342(青)、Sox2(赤)およびネスチン(白)の幹細胞様細胞、ならびにDCX(緑色)を有する未熟なニューロンで染色した。パネルA1とB1の矢印は、Sox2+/+/nestin+/+/DCX-/-対称的な自己更新部門を示し、 パネル A1 と B2 の矢印は、Sox2+/-/nestin+/-/DCX-/+非対称分割を示し、パネル A2 および B1 の破線矢印は Sox2-/-/nestin-/-/DCX+/+対称的な分化分割を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
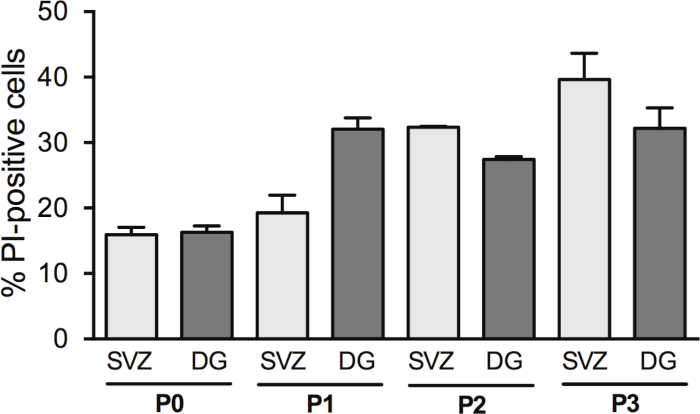
図3:細胞通過による細胞生存解析SVZおよびDG由来分化された神経球培養におけるDIV2におけるPI陽性細胞の定量分析を、0、1、2および3の通路後(P0−P3)した後に行った。データは平均値±SEM、n = 1-8で表されます。PI = ヨウ化プロピジウム。この図の大きなバージョンを表示するには、ここをクリックしてください。
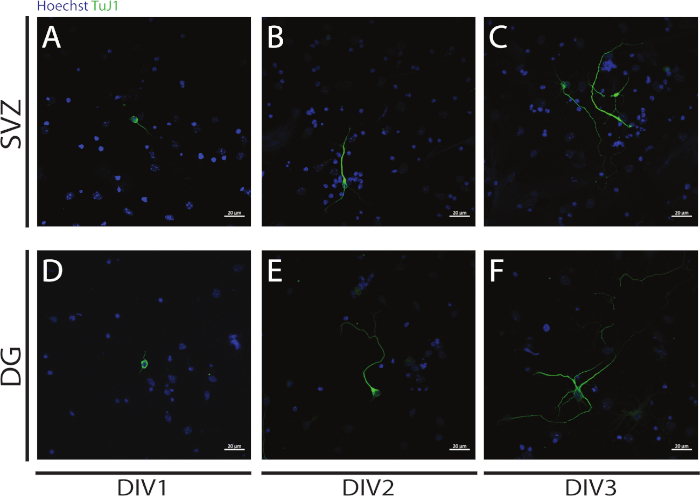
図4:DIV1、2および3における腎産生解析。神経突起の代表的な共焦点蛍光画像は、βIII-管内シグナルによって同定され、SVZおよびDGニューロンにおいて(A、D)DIV1、(B,E)DIV2、および(C,F)DIV3においてである。A,DB,Eこの図の大きなバージョンを表示するには、ここをクリックしてください。
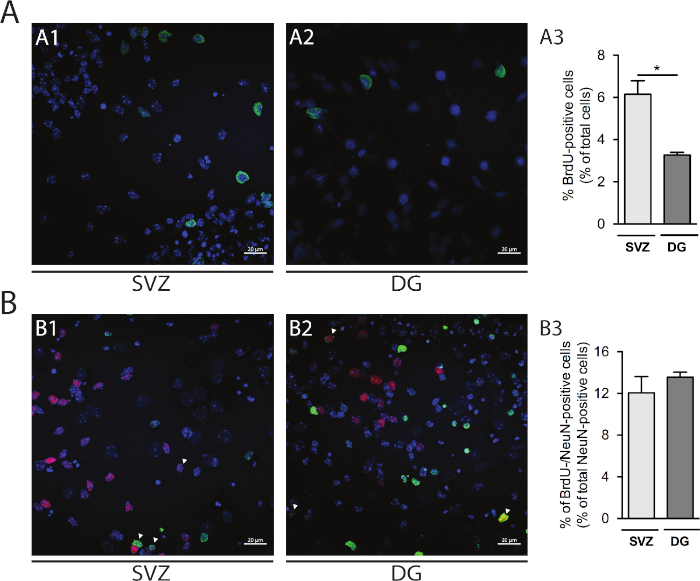
図5:細胞増殖アッセイ。DIV1におけるBrdU陽性細胞の代表的な共焦点像(A1)SVZおよび(A2)DG.(A3)DG-およびSVZ由来の分化された神経球培養におけるDIV1におけるBrdU陽性細胞の定量的分析データは平均値±SEM、n=4で表される。*p < 0.05 t検定による。DIV7におけるBrdU-およびNeuN陽性細胞の代表的な蛍光画像(B1)SVZおよび(B2)DG.矢印はBrdU-/NeuN陽性細胞を示す。(B3)DIV7におけるBRDU-ノイN陽性細胞の定量分析データは平均値±SEM、n=4で表される。BrdU: 5-ブロモ-2'-デオキシウリジン, 合成チミジンアナログ.この図の大きなバージョンを表示するには、ここをクリックしてください。
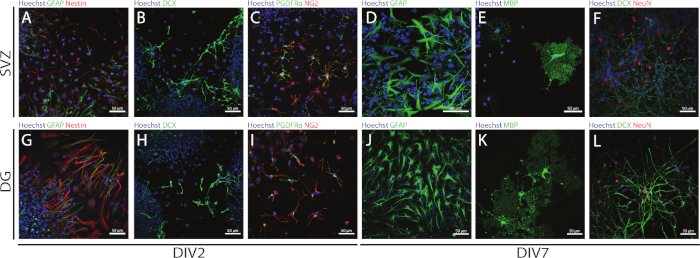
図6:SVZ由来およびDG由来の分化された神経球培養に存在する神経細胞型。SVZおよびDG由来細胞型の代表的な蛍光画像は、2日および7日後の神経圏分化(DIV2およびDIV7)で、細胞核をHoechst 33342(青)で染色し、GFAP(A,G緑)およびネスチン(赤)のNSC(B、H)未熟化B,HDCX(緑)、(C,I)PDGFRα(緑)およびNG2(赤)のオリゴデンドロサイト前駆細胞のニューロン、GFAP(緑)のアC,Iストロサイト(D,J)、MBP(緑)の成熟したオリゴデンドロサイト(緑色)、および(F,L)NeuN(赤)の成熟したニューロン。この図の大きなバージョンを表示するには、ここをクリックしてください。
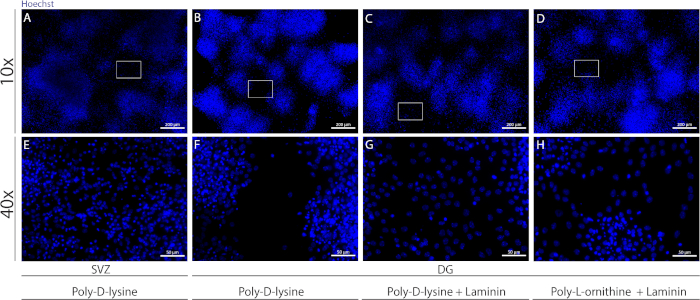
補足図1:神経球の付着と移行のための異なる基質をテストして、疑似単層を形成する。ポリD-リジンを基質として用いたSVZ由来擬似モノ層(A,E)の代表的な蛍光画像、(B,F)ポリD-リジンを基材として用いたDG由来擬似モノレイヤー、(C,G)ラミニンを基板としてポリDリジンを用いたDG由来擬似モノレイヤー、およびポリ-L-オルニチンを基材としてポリD-L-オルニチンを用いたDG由来擬似モノレイヤーC,Gこの図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
Nccsのインビトロシステムは、細胞および分子機構のより良い理解を可能にし、生体内でさらに検証することができる。NSAは、その三次元構造による生理学的状態を模倣する非常に強力な方法です。また、この培養系は、単層培養系などの他のインビトロ系と比較して、技術的に培養10に対しても容易である。実際、NSAを用いると、細胞の発達中に露出した外因性の手がかりを制御することは容易であり、拡張または分化段階の間に、メディアに関心のある因子の正確かつ可変量を加えるだけでなく、他の細胞タイプ6で神経球を培養することによって。さらに、単層培養と比較して、NSAでは、少量の組織から、または少数の細胞からより高い細胞密度を得ることができ、並行研究を行うことを可能にし、したがって動物の数を減少させる1。
NSAは、NSC11、12、1311を単離および拡張する最も一般的な方法であり、12,13異なる条件間の所定の組織サンプル5および前駆体細胞頻度に存在する前駆細胞の数を推定するために使用することができる。しかし、神経圏と単層培養はどちらも静止NSC14を考慮していない。また、NSAはいくつかの制限を有する11、12、1312,13および結果として生じる神経圏周波数は、培地成分を含む多くの要因に依存し、解剖手順、解11離プロセス1111、12、13、及び神経圏凝集,12,135。確かに、高密度培養では、神経球は凝集する傾向がある。したがって、サンプル内の前駆細胞の数を推定する際には注意が必要です。上記の制限を克服するために、単一層,5、15に分離されたNCCsを拡張し5、継代することもできる。重要なのは、NSAを使用して異なる条件間で前駆細胞周波数を比較することは非常に有用であり、正確であり、これらの制限はすべて同じ実験で行われるすべての条件の間で暗黙的かつ類似しているためです。
神経圏文化には注意が必要な重要なステップがあります。脳の収穫ステップでは、髄液の完全な除去と神経原性ニッチの良好な分離は、NCCsの純度と収率を最大化するために不可欠です。組織解離の間、トリプシンのタンパク質分解活性のために、トリプシンまたはより長いインキュベーション時間の過剰な使用は、細胞のライシスを引き起こす可能性がある。さらに、通過の日は、神経球の健全な集団を得るために重要です。直径が200μmを超える通過性神経球は、NCCsの生存率、増殖および分化能力に大きく影響する。6さらに、SVZ細胞およびDG細胞用PDLおよびPLD/ラミニンをコーティングすることは、分化プロセスを損なうことなく神経球から良好な細胞移動を確実にするために不可欠です。免疫細胞化学分析の観点から、PFAによるインキュベーション時間が長いと、抗原をマスキングし、背景を増加させることで染色を損なう可能性があります。
NSAは、神経発達と分化のインビトロ研究のためだけでなく、治療目的のために、一貫した無制限のNSPCsを提供するための強力なツールです16,,17.実際、このアッセイは、NSPC増殖および分化18,19,19に関与する分子および細胞機構をさらに理解するために、遺伝的および行動モデルに適用することができる。このアッセイはまた、異なる薬物および化合物20、21、2221,22を試験するとともに、NSC特性を調節するために遺伝子操作19、23,23を行う場合にも有用である。20免疫細胞化学に加えて、逆転写ポリメラーゼ連鎖反応およびウェスタンブロット分析はRNAおよびタンパク質発現にアクセスするために行うことができるが、一方、電気生理学的研究およびカルシウムイメージングは、新生ニューロン21の機能を評価するために使用することができる。
開示事項
著者らは開示するものは何もない。
謝辞
この作業は、IF/01227/2015 および UID/BIM/50005/2019 によってサポートされました。 プロジェト・フィナンシアド・ペラ・フンダソン・パラ・ア・シエンシア・エ・ア・テクノロジア(FCT)/ミニステリオ・ダ・シエンシア、テクノロジア・エ・エンシーノ・スーペリア(MCTES)アトラベス・デ・ファンドス・ド・オルサメント・デ・エスタド。R.S.(SFRH/BD/128280/2017、F.F.R.(IMM/CT/35-2018)、D.M.L.(PD/BD/141784/2018)、R.S.R.(SFRH/BD/129710/2017)から受け取りました。著者らは、医学研究所のバイオイメージング施設のメンバーに、顕微鏡の支援を求めて感謝したいと考えています。
資料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1X) | Gibco | 25300-054 | |
| 0.4% Trypan Blue solution | Sigma-Aldrich | T8154-20ML | |
| 12mm Glass coverslips | VWR | 631-1577 | |
| 15mL Centrifuge Tube | Corning | 430791 | |
| 5-bromo-2'-deoxyuridine | Sigma-Aldrich | B9285-1G | |
| 50 mL Centrifuge Tube | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira & Cª (Irmão) Sucrs, Lda | UN1170 | |
| Adhesion slides, Menzel Gläser, SuperFrost Plus | VWR | 631-9483 | |
| Alexa Fluor 488 donkey anti-chicken IgG (H+L) | Life Technologies | A11039 | |
| Alexa Fluor 488 donkey anti-rabbit IgG (H+L) | Life Technologies | A21206 | |
| Alexa Fluor 488 donkey anti-rat IgG (H+L) | Life Technologies | A21208 | |
| Alexa Fluor 568 donkey anti-mouse IgG (H+L) | Life Technologies | A10037 | |
| Alexa Fluor 568 donkey anti-rabbit IgG (H+L) | Life Technologies | A10042 | |
| Alexa Fluor 647 goat anti-mouse IgG (H+L) | Life Technologies | A21235 | |
| Anti-5-Bromo-2-Deoxyuridine | Dako | M0744 | |
| Anti-CD140a (PDGFRα) (rat) | BD Biosciences | 558774 | Dilute at a ratio 1:500. |
| Anti-Chondroitin Sulphate Proteoglycan NG2 (rabbit) | Merck Milipore | AB5320 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (rabbit) | Abcam | ab18723 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (chicken) | Synaptic Systems | 326006 | Dilute at a ratio 1:500. |
| Anti-Glial Fibrillary Acidic Protein (rabbit) | Sigma-Aldrich | G9269-.2ML | Dilute at a ratio 1:1000. |
| Anti-Myelin Basic Protein (rabbit) | Cell Signalling Technology | 78896S | Dilute at a ratio 1:200. |
| Anti-Nestin (mouse) | Merck Milipore | MAB353 | Dilute at a ratio 1:200. |
| Anti-Neuronal Nuclei (mouse) | Merck Milipore | MAB377 | Use 6% BSA in PBS 1X. Dilute at a ratio 1:400. |
| Anti-SOX2 (rabbit) | Abcam | ab97959 | Dilute at a ratio 1:500. |
| Anti-Tubulin β3 (rabbit) | BioLegend | 802001 | Dilute at a ratio 1:200. |
| Axiovert 200 wide field microscope | ZEISS | ||
| B-27 Supplement (50X), serum free | ThermoFisher | 17504044 | |
| Boric Acid | Sigma-Aldrich | B6768-500g | |
| Bovine Serum Albumin | NZYTech | MB04602 | |
| Cell counting chamber, Neubauer | Hirschmann | 8100104 | |
| Cell culture CO2 incubator | ESCO | CCL-170B-8 | |
| Corning Costar TC-Treated 24 Multiple Well Plate | Corning | CLS3524-100EA | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| DMEM/F-12, GlutaMAX Supplement | ThermoFisher | 31331028 | |
| Dumont #5 - Fine Forceps | FST | 11254-20 | |
| Dumont #5S Forceps | FST | 11252-00 | |
| Dumont #7 Forceps | FST | 11272-30 | |
| Epidermal growth factor | ThermoFisher | 53003018 | |
| Fibroblast growth factor | ThermoFisher | 13256029 | |
| Filter papers | Whatman | 1001-055 | |
| Fine Scissors - Sharp | FST | 14060-09 | |
| Gillete Platinum 5 blades | Gillette | ||
| HBSS, no calcium, no magnesium | ThermoFisher | 14175053 | |
| Hoechst 33342 | Invitrogen | 1399 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 (1L) | |
| Labculture Class II Biological Safety Cabinet | ESCO | 2012-65727 | |
| Laminin | Sigma-Aldrich | L2020 | |
| McILWAIN Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 450 μm |
| Micro Spatula - 12 cm | FST | 10091-12 | |
| Micro tube 0.5 mL | SARSTEDT | 72.699 | |
| Micro tube 1.5 mL | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL | SARSTEDT | 72.691 | |
| NeuroCult Chemical Dissociation Kit (Mouse) | Stem Cell | 5707 | |
| Olympus microscope SZ51 | Olympus | SZ51 | |
| Paraformaldehyde, powder | VWR | 28794.295 | |
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Petri dishes 60 mm | Corning | 430166 | |
| Phosphate standard solutions, PO43 - in water | BDH ARISTAR | 452232C | |
| Poly-D-Lysine 100mg | Sigma-Aldrich | P7886 | |
| Poly-L-ornithine solution | Sigma-Aldrich | P4957 | |
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide | Sigma-Aldrich | P4170-25MG | |
| Sodium chloride | VWR | 27800.360.5K | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Triton X-100 | BDH | 14630 | |
| VWR INCU-Line IL10 | VWR | 390-0384 |
参考文献
- Reynolds, B., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of Visualized Experiments. (45), e2393 (2010).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11 (5), 951-966 (1993).
- Rietze, R. L., Reynolds, B. A. Neural Stem Cell Isolation and Characterization. Methods in Enzymology. 419, 3-23 (2006).
- Walker, T. L., Kempermann, G. One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Journal of Visualized Experiments. (84), e51225 (2014).
- Jensen, J. B., Parmar, M. Strengths and Limitations of the Neurosphere Culture System. Molecular Neurobiology. 34 (3), 153-162 (2006).
- Xapelli, S., et al. Activation of Type 1 Cannabinoid Receptor (CB1R) Promotes Neurogenesis in Murine Subventricular Zone Cell Cultures. PLoS ONE. 8 (5), e63529 (2013).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Nowakowski, R. S., Lewin, S. B., Miller, M. W. Bromodeoxyuridine immunohistochemical determination of the lengths of the cell cycle and the DNA-synthetic phase for an anatomically defined population. Journal of Neurocytology. 18 (3), 311-318 (1989).
- Weinberg, D., Adams, C. F., Chari, D. M. Deploying clinical grade magnetic nanoparticles with magnetic fields to magnetolabel neural stem cells in adherent versus suspension cultures. RSC Advances. 5 (54), 43353-43360 (2015).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. Journal of Visualized Experiments. (47), e2457 (2011).
- Azari, H., Louis, S. A., Sharififar, S., Vedam-Mai, V., Reynolds, B. A. Neural-Colony Forming Cell Assay: An Assay To Discriminate Bona Fide Neural Stem Cells from Neural Progenitor Cells. Journal of Visualized Experiments. (49), e2639 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres-re-evaluating the relationship. Nature Methods. 2 (5), 333-336 (2005).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proceedings of the National Academy of Sciences. 106 (15), 6387-6392 (2009).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities?. Nature Reviews Neuroscience. 11 (3), 176-187 (2010).
- Ghate, P. S., Sidhar, H., Carlson, G. A., Giri, R. K. Development of a novel cellular model of Alzheimer's disease utilizing neurosphere cultures derived from B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J embryonic mouse brain. SpringerPlus. 3 (1), 161 (2014).
- Pluchino, S., et al. Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis. Nature. 422 (6933), 688-694 (2003).
- Ogawa, Y., Kaizu, K., Yanagi, Y., Takada, S., Sakuraba, H., Oishi, K. Abnormal differentiation of Sandhoff disease model mouse-derived multipotent stem cells toward a neural lineage. PLoS ONE. 12 (6), e0178978 (2017).
- Khacho, M., et al. Mitochondrial Dynamics Impacts Stem Cell Identity and Fate Decisions by Regulating a Nuclear Transcriptional Program. Cell Stem Cell. 19 (2), 232-247 (2016).
- Soares, R., et al. Tauroursodeoxycholic Acid Enhances Mitochondrial Biogenesis, Neural Stem Cell Pool, and Early Neurogenesis in Adult Rats. Molecular Neurobiology. 55 (5), 3725-3738 (2017).
- Rodrigues, R. S., Ribeiro, F. F., Ferreira, F., Vaz, S. H., Sebastião, A. M., Xapelli, S. Interaction between Cannabinoid Type 1 and Type 2 Receptors in the Modulation of Subventricular Zone and Dentate Gyrus Neurogenesis. Frontiers in Pharmacology. 8, 516 (2017).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin?. Frontiers in Cellular Neuroscience. 8, 59 (2014).
- Kim, H. J., et al. Dynamin-related protein 1 controls the migration and neuronal differentiation of subventricular zone-derived neural progenitor cells. Scientific Reports. 5 (1), 15962 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved