Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Protocolo de imágenes y caracterización de Terahertz para tumores de cáncer de mama recién extirpados
En este artículo
Resumen
Los tumores de cáncer de mama humanorecién exhalados se caracterizan por espectroscopia de terahercios e imágenes siguiendo protocolos de manejo de tejidofresco. El posicionamiento del tejido se tiene en cuenta para permitir una caracterización eficaz, al tiempo que se proporciona un análisis de manera oportuna para futuras aplicaciones intraoperatorias.
Resumen
Este manuscrito presenta un protocolo para manejar, caracterizar e imaginar tumores de mama humanos recién extirpados utilizando técnicas de imágenes y espectroscopia de terahercios pulsadas. El protocolo implica el modo de transmisión de terahercios con incidencia normal y el modo de reflexión de terahercios en un ángulo oblicuo de 30o. Los datos experimentales recopilados representan pulsos de dominio de tiempo del campo eléctrico. La señal de campo eléctrico de terahercios transmitida a través de un punto fijo en el tejido extirpado se procesa, a través de un modelo analítico, para extraer el índice de refracción y el coeficiente de absorción del tejido. Utilizando un escáner de motor paso a paso, el pulso emitido por terahercios se refleja desde cada píxel del tumor proporcionando una imagen plana de diferentes regiones de tejido. La imagen se puede presentar en el dominio de tiempo o frecuencia. Además, los datos extraídos del índice de refracción y el coeficiente de absorción en cada píxel se utilizan para proporcionar una imagen terahercio tocográfica del tumor. El protocolo demuestra una clara diferenciación entre tejidos cancerosos y sanos. Por otro lado, no adherirse al protocolo puede dar lugar a imágenes ruidosos o inexactos debido a la presencia de burbujas de aire y restos de líquido en la superficie del tumor. El protocolo proporciona un método para la evaluación de márgenes quirúrgicos de tumores mamarios.
Introducción
La imagen y la espectroscopia de Terahertz (THz) ha sido un área de investigación en rápido crecimiento en la última década. El continuo desarrollo de emisores de THz más eficientes y consistentes en el rango de 0,1-4 THz ha hecho que sus aplicaciones crezcan significativamente1. Un área donde THz ha demostrado ser prometedor y un crecimiento significativo es el campo biomédico2. Se ha demostrado que la radiación THz es no ionizante y biológicamente segura a los niveles de potencia generalmente utilizados para analizar los tejidos fijos3. Como resultado, la imagen tHz y la espectroscopia se ha utilizado para clasificar y diferenciar diversas características del tejido, como el contenido de agua para indicar daño a quemaduras y curación4, cirrosis hepática5,y cáncer en los tejidos extirpado66,7. La evaluación del cáncer en particular abarca una amplia gama de posibles aplicaciones clínicas y quirúrgicas, y se ha investigado para los cánceres del cerebro8, hígado9, ovarios10, tracto gastrointestinal11, y mama7,12,13,14,,15,16,17,18,19.
Las aplicaciones de THz para el cáncer de mama se centran principalmente en apoyar la cirugía de conservación de mamas, o lumpectomía, a través de la evaluación del margen. El objetivo de una tumorectomía es extirpar el tumor y una pequeña capa de tejido sano circundante, en contraste con la mastectomía completa, que extirpa toda la mama. El margen quirúrgico del tejido extirpado se evalúa a través de la patología una vez que la muestra se ha fijado en formalina, seccionada, incrustada en parafina y montada en rodajas de 4 m a 5 m en portaobjetos de microscopio. Este proceso puede llevar mucho tiempo y requiere un procedimiento quirúrgico secundario en un momento posterior si se observa un margen positivo20. Las directrices actuales de la Sociedad Americana de Oncología Radioterápica definen este margen positivo como que las células cancerosas se encontacto con la tinta de margen a nivel superficial21. Las imágenes de THz para tejido hidratado de alta absorción se limitan principalmente a imágenes superficiales con alguna penetración variable en función del tipo de tejido, que es suficiente para satisfacer las necesidades quirúrgicas de evaluación rápida del margen. Un análisis rápido de las condiciones del margen durante el ajuste quirúrgico reduciría en gran medida los costos quirúrgicos y la tasa de procedimiento de seguimiento. Hasta la fecha, THz ha demostrado ser eficaz para diferenciar entre el cáncer y el tejido sano en los tejidos fijos en formalina, incrustados en parafina (FFPE), pero se necesita una investigación adicional para proporcionar una detección fiable del cáncer en los tejidos recién extirpados7.
Este protocolo detalla los pasos para realizar imágenes y espectroscopia de THz en muestras de tejido humano recién extirpadas obtenidas de un biobanco. Las aplicaciones de THz basadas en tejidos de cáncer de mama humano recién extirpado rara vez se han utilizado en la investigación publicada7,18,22,23, especialmente por grupos de investigación no integrados con un hospital. El uso de tejidos recién extirpado es igualmente raro para otras aplicaciones de cáncer, con la mayoría de los ejemplos de cáncer humano no mamario que se reportan para el cáncer de colon24,25. Una razón para esto es que los bloques de tejido FFPE son mucho más fáciles de acceder y manejar que el tejido recién extirpado a menos que el sistema de THz que se utiliza para el estudio es parte del flujo de trabajo quirúrgico. Del mismo modo, la mayoría de los sistemas de THz de laboratorio comercial no están preparados para manejar tejido fresco, y los que lo hacen todavía están en las etapas de uso del crecimiento de la línea celular o sólo han comenzado a mirar el tejido extirpado de los modelos animales. Para aplicar THz a un entorno intraoperatorio se requiere que se desarrollen pasos de imagen y caracterización para el tejido fresco de antemano para que el análisis no interfiera con la capacidad de realizar patologías estándar. Para las aplicaciones que no están intrínsecamente destinadas a ser intraoperatorias, la caracterización de tejido fresco sigue siendo un paso difícil que debe abordarse para trabajar hacia aplicaciones in vivo y diferenciación.
El objetivo de este trabajo es proporcionar una directriz para la aplicación de THz para el tejido recién extirpado utilizando un sistema comercial de THz. El protocolo fue desarrollado en un sistema de imágenes y espectroscopia THz26 para tumores de cáncer de mama murino13,17,19 y se extendió al tejido quirúrgico humano obtenido de biobancos7,18. Mientras que el protocolo se generó para el cáncer de mama, los mismos conceptos se pueden aplicar a sistemas de imágenes de THz similares y otros tipos de cánceres de tumor sólido que se tratan con cirugía donde el éxito depende de la evaluación de márgenes27. Debido a una cantidad bastante pequeña de resultados de THz publicados en tejidos recién extirpado, este es el primer trabajo a los conocimientos de los autores para centrarse en el protocolo de manejo de tejido fresco para la toma de imágenes y caracterización de THz.
Protocolo
Este protocolo sigue todos los requisitos establecidos por el departamento de Salud y Seguridad Ambiental de la Universidad de Arkansas.
1. Configurar el área de manipulación de tejidos
- Tome una bandeja de metal de acero inoxidable y cúbrala con la bolsa de riesgo biológico como se muestra en la Figura 1. Cualquier manipulación de los tejidos biológicos se realizará dentro del área de la bandeja (es decir, el área de manipulación de tejidos).
- Prepare pinzas de laboratorio, toallitas de tejido, toallas de papel, paquete de papel de filtro, botellas de tinte de tejido, botella de lejía y botella de etanol alrededor de la bandeja para facilitar el acceso cuando sea necesario. Mantenga los tejidos, toallitas y guantes usados en la superficie del material de riesgo biológico para desecharlos al final del protocolo.
- Llene un tubo centrífugo de 50 ml con hasta 45 ml de formalina tamponada neutra al 10% y colóquelo en la bandeja de almacenamiento de centrífugas cerca de la bandeja de manipulación de tejidos.
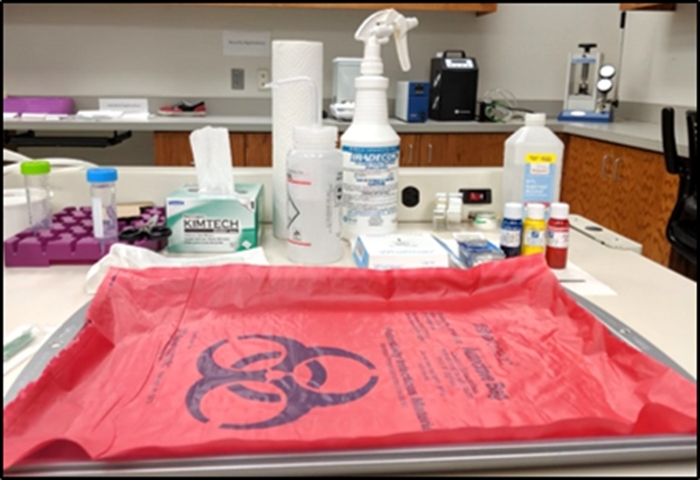
Figura 1: Configuración del área de manipulación de tejidos. Haga clic aquí para ver una versión más grande de esta figura.
2. Manejo del tumor de cáncer de mama fresco para la espectroscopia de transmisión de THz
PRECAUCION: Antes de manipular cualquier tejido vivo, ponte guantes de mano de nitrilo, gafas de protección para los ojos, una máscara facial y una capa de laboratorio. Utilice siempre pinzas de laboratorio para manipular los tejidos y evitar tocarlos directamente con las manos. Todo el trabajo con tejido fresco fuera de un recipiente sellado o de la etapa de exploración debe llevarse a cabo en el área de manipulación de tejidos establecida en el paso 1.1.
NOTA: Todos los tejidos tratados en este trabajo fueron enviados en el medio modificado de Dulbecco (DMEM) y la solución antibiótica del biobanco.
- Retire el tumor a granel de la solución DMEM y colóquelo en una placa de Petri en el área de manipulación de tejidos (ver Figura 2A).
- A partir de la inspección bruta, identifique regiones tumorales distintas desde las que cortar piezas pequeñas para la caracterización de la transmisión. Corte un segmento de tumor de 0,5 mm de espesor de los puntos identificados utilizando una hoja de perfil bajo de acero inoxidable, como se muestra en la Figura 2B. Coloque esta sección en rodajas entre dos ventanas de cuarzo con un espaciador de 0,1 mm de espesor en un soporte de muestra líquida, como se muestra en la Figura 2C.

Figura 2: Seccionamiento del tumor para las mediciones de espectroscopia de transmisión de THz. (A) Fotografía del tumor a granel. (B) Fotografía de las pequeñas secciones (0,5 mm) del tumor cortado del tumor a granel. (C) La sección tumoral en rodajas colocada en el soporte de muestra líquida entre las dos ventanas de cuarzo con un espaciador de politetrafluoroetileno de 0,1 mm para la medición de espectroscopia. Figura reeditada de T. Bowman et al.18 con permiso de SPIE. Haga clic aquí para ver una versión más grande de esta figura.
3. Mediciones de Espectroscopia de Transmisión THz
- Ajuste el módulo de espectroscopia de transmisión dentro de la cámara del núcleo de THz alineando las manijas del módulo sobre los postes de montaje en el sistema central y deslizando la etapa hacia abajo en el sistema. Apriete los dos tornillos de montaje en las esquinas superior derecha e inferior izquierda del módulo como se muestra en la Figura 3A.
- Purgue el sistema con gas nitrógeno seco a 5 L/min (LPM) durante todo el procedimiento de espectroscopia para eliminar el vapor de agua del espacio de la muestra.
- Abra el software de medición de espectroscopia de transmisión THz desde el escritorio conectado al sistema THz. Se abrirá la ventana principal.
- Haga clic en la pestaña Escanear en la parte superior de la ventana. Aparecerá una ventana de Configuración de Spectra Scan. En el menú desplegable de la pestaña Modo de medición en la parte superior derecha de la ventana, seleccione Transmisión para configurar la espectroscopia de transmisión. Si el pico no está visible automáticamente, marque la opción Habilitar en la pestaña Búsqueda manual de picos y repaso manualmente el retardo óptico para que el pico se vea.
-
Después de 30 minutos de purga, registre una señal de referencia de aire siguiendo los pasos a continuación.
- En la pestaña Configuración de escaneado de la ventana de configuración de análisis de espectros, introduzca un nombre adecuado para el archivo de referencia, establezca Num Scans en 1.800 y establezca el retardo de inicio (s) en 0. Deje los demás valores como valores predeterminados.
- Haga clic en Referencia de medida en la ventana de configuración del escaneo para tomar la medida de referencia de aire. A continuación, haga clic en Medir muestra para medir la señal de transmisión a través del aire como un promedio de muestra de 1.800 señales de más de 1 min.

Figura 3: Configuración del módulo de espectroscopia de transmisión THz. (A) Cámara de núcleo THz con el módulo de transmisión montado en ella. (B) Una fotografía del soporte de la muestra líquida. (C) El soporte de muestra colocado dentro de la cámara central para las mediciones. Haga clic aquí para ver una versión más grande de esta figura.
-
Mida las dos ventanas de cuarzo en el soporte de la muestra líquida como se muestra en la Figura 3B.
- Coloque las dos ventanas de cuarzo en el soporte de la muestra líquida sin un espaciador en el medio.
- Abra la cámara del núcleo de THz. Monte el soporte de muestra líquida en el módulo de espectroscopia de transmisión, como se muestra en la Figura 3C. Cierre la cámara.
- Haga clic en la pestaña Escanear en la ventana principal. Repita los pasos 3.5.1–3.5.2 para la muestra de cuarzo, pero actualice Retardo de inicio (s) a 900. Esto permite tiempo para purgar cualquier vapor de agua antes de la medición.
- Si el cuarzo se desea como referencia para muestras adicionales, haga clic en la pestaña Borrar referencia en Configuración de escaneado. Esto borra la referencia aérea. A continuación, haga clic en la pestaña Referencia de medida para registrar las mediciones de cuarzo como una nueva referencia.
- Coloque la sección tumoral en rodajas entre las dos ventanas de cuarzo dentro del soporte de la muestra líquida y coloque el soporte dentro de la cámara para una medición de transmisión de un solo punto del tejido. Para registrar la medición, repita el paso 3.6.3.
- Saque el soporte de muestra líquida de la cámara cuando se completen las mediciones y llévelo al área designada para el manejo de tejidos. Desmontar el soporte de muestra líquida, limpiar la sección tumoral de las ventanas de cuarzo con las toallitas de tejido y colocar las toallitas de tejido usadas en la misma bandeja para desechar en la bolsa de riesgo biológico junto con los otros residuos de riesgo biológico.
- Repita los pasos 2.2, 3.7 y 3.8 según sea necesario para caracterizar las rodajas de tumor adicionales. Cuando se completen las mediciones, vaya a la ventana principal y haga clic en la pestaña Archivo para guardar los datos de medición. Cierre la ventana del software.
4. Manejo del tumor de cáncer de mama fresco para imágenes del modo de reflexión THz
- Retire la muestra de tumor fresco de la solución de DMEM y antibióticos y colóquela en un plato de Petri. Usando la inspección bruta, seleccione un lado del tumor que se va a tomar una imagen que sea lo suficientemente plano y tenga poca sangre y pocos vasos sanguíneos. Evite tomar imágenes del tejido con sangre o vasos sanguíneos si es posible.
- Coloque el tumor con el lado que se va a tomar una imagen en papel de filtro de grado 1 para secar el exceso de DMEM y eliminar el tejido de líquido o secreciones del tumor, como se muestra en la Figura 4A. Vuelva a colocar el tumor en el papel filtrante en una mancha seca a medida que se satura el papel. Seque el tumor durante 5 min.

Figura 4: Preparación de muestras de tumores frescos para imágenes de THz. (A) Tumor colocado en papel filtrante para secar. (B) Tumor colocado en la placa de poliestireno sobre la ventana de imágenes con almohadillas de toallita de tejido para absorber el exceso de líquidos. (C) Tumor visto desde abajo para rastrear la orientación y comprobar si hay burbujas de aire. Haga clic aquí para ver una versión más grande de esta figura.
- Desmonte el módulo de espectroscopia de transmisión y ajuste la base de espejo del módulo de imágenes de reflexión (RIM) en el sistema de núcleo de THz como se muestra en la Figura 5A. Al fijar los espejos, monte la etapa de escaneo RIM por encima de la base del espejo y enrosquela en el sistema central (consulte la figura 5B).
- Purgue el sistema con gas nitrógeno seco a 5 LPM durante 30 minutos antes del procedimiento de toma de imágenes para eliminar el vapor de agua del compartimiento de muestra. Después de 30 minutos, reduzca la cantidad de gas nitrógeno seco a 3 LPM durante el resto del tiempo que el sistema esté en uso.
- Coloque una placa de poliestireno de espesor de 1,2 mm en la ventana de escaneado de diámetro de 37 mm. Centre la ventana de escaneado junto con la placa de poliestireno en el escenario de la muestra.

Figura 5: Configuración del sistema para la creación de imágenes de reflexión. (A) Base de espejo del módulo de imágenes de reflexión. (B) Etapa de escaneado. Haga clic aquí para ver una versión más grande de esta figura.
NOTA: Otros espesores y materiales de placa son adecuados para el paso 4.5, pero deben tener un espesor uniforme y ser de absorción lo suficientemente baja como para no impedir la señal de THz.
- Abra el software de medición de imágenes de reflexión de THz desde el escritorio conectado al sistema THz. Aparecerá una ventana que muestra varios iconos de cuadro de diálogo para funciones específicas y dos subventanas para gráficos de campo de THz, (unidades arbitrarias a.u.) contra el tiempo y la frecuencia, respectivamente.
- Para establecer los parámetros para la configuración de RIM, haga clic en el icono de diálogo Parámetro de imagen en la parte superior de la ventana. Aparecerá una ventana Parámetros de adquisición de imagen. Seleccione RIM en el menú desplegable de la pestaña Plantilla para configurar las imágenes de reflexión. Pulse OK y vuelva a la ventana principal del software.
- En la ventana principal, haga clic en el icono Análisis de punto fijo. Esto activará las antenas THz para comenzar a enviar la señal de THz incidente y recibir la señal de THz reflejada desde un solo punto en la placa de poliestireno.
- Haga clic en el icono Diálogo del escenario del motor en la parte superior de la ventana principal. Se abrirá la ventana de control del motor. Ajuste el eje de retardo óptico haciendo clic en las flechas de dirección hacia adelante/hacia atrás para centrar el pulso reflejado desde el poliestireno en la ventana principal.
NOTA: Después de ajustar el eje de retardo óptico, deben aparecer dos pulsos en la ventana, como se muestra en la Figura 6:uno de la interfaz inferior de la placa de poliestireno (reflexión primaria), y otro desde la interfaz superior de la placa de poliestireno (reflexión secundaria). -
Ventana el reflejo primario de la placa de poliestireno y mantener el reflejo secundario en la ventana, lo que contribuirá a los reflejos del tejido durante el procedimiento de diagnóstico por imágenes. Esto se hace en dos pasos.
- En primer lugar, haga clic en el botón Configuración de DAQ en la parte superior de la ventana principal para abrir la ventana de diálogo Configuración de DAQ. Cambie el valor de retardo óptico de 5 V (predeterminado) a 4 V.
- En segundo lugar, ajuste la posición vertical de la etapa de escaneo con la escala del micrómetro en la etapa de escaneo hasta que el mínimo del pulso secundario sea el más fuerte. Ajuste el retardo óptico del eje en la ventana de control del motor para colocar la reflexión primaria fuera del rango de la señal reflejada que se está midiendo.
NOTA: Para una placa de poliestireno de 1,2 mm de espesor, la reflexión primaria se anota cuando el pico mínimo de reflexión secundaria es de aproximadamente -0,3 mm en el eje de retardo óptico de la ventana de dominio de tiempo.
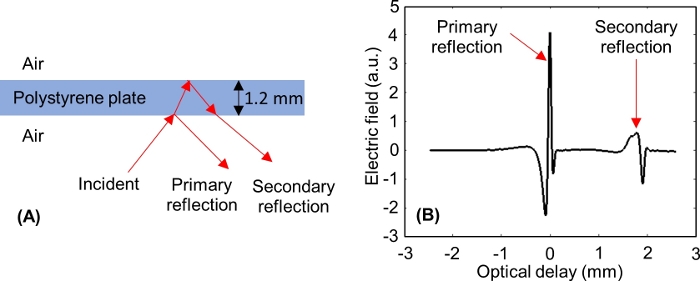
Figura 6: Reflejos de THz de las interfaces inferior y superior de la placa de poliestireno. (A) Incidente de señal de THz y se refleja a partir de una placa de poliestireno de 1,2 mm de espesor. (B) Señales de dominio de tiempo THz primarias y secundarias medidas del poliestireno. Haga clic aquí para ver una versión más grande de esta figura.
- Nivele la etapa de muestra y registre la señal de referencia.
- Seleccione dos puntos en cada eje (eje A y eje B) que denoten ubicaciones en la placa de poliestireno cerca del borde de la ventana de muestra. Por ejemplo, para el eje A que oscila entre -15 mm-15 mm, los dos puntos de posición pueden ser -10 mm y 10 mm; y para el eje B que van desde -15 mm-15 mm, los dos puntos de posición pueden ser -10 mm y 10 mm.
- Haga clic en el botón Diálogo de control del motor para abrir la ventana de control del motor. Vuelva a colocar la ventana de control del motor y la ventana principal del software para que la señal de dominio de tiempo sea visible mientras se ajustan las posiciones del motor. Establezca el eje A y el eje B en 0 mm.
- Nivele el eje A siguiendo los pasos siguientes. Como ejemplo se utiliza un rango de -10 mm–10 mm.
- En la ventana controldel motor , cambie el valor del eje A de 0 a -10 y pulse Intro. El escenario se mueve a la posición de -10 mm en el eje A y se observa un cambio en la posición de la señal en la ventana principal.
- Utilice la escala de micrómetro ajustable en la etapa de escaneo que se muestra en la Figura 5B para mover el pico mínimo de la señal a la posición establecida en el paso 4.10.2.
- Cambie el valor del eje A a +10 y pulse Intro. La etapa ahora se moverá de la posición de -10 mm a la posición de +10 mm en el eje A y se observará de nuevo un cambio en la señal. Observe la dirección y la distancia que la señal desplazó de su posición anterior y cambie el valor del eje A de nuevo a -10. La señal volverá a la posición establecida en el paso 4.11.5.
- Gire el tornillo de nivelación en el eje A de la etapa de escaneo, como se muestra en la Figura 5B y cambie la señal para duplicar la distancia en la misma dirección en la que se movió desde la posición original. Utilice el micrómetro en la etapa de escaneo para desplazar la señal a la posición original (-0,3 mm para 1,2 mm de poliestireno).
- Repita los pasos 4.11.6–4.11.7 hasta que la señal en +10 y -10 sea igual y el pico para ambas posiciones se enfoque en la posición original (-0,3 mm en el eje óptico).
- Una vez alcanzada la nivelación del eje A, cambie el valor del eje A a 0 y repita el mismo procedimiento para el eje B. Comience cambiando el valor del eje B en la ventana de control del motor de 0 al valor más positivo (por ejemplo, +10 mm). Además, durante la nivelación, utilice el tornillo de nivelación en el eje B de la etapa de escaneo, que se muestra en la Figura 5B.
- Una vez que ambos ejes estén nivelados, devuelva el eje A y el eje B a 0 mm. Cierre la ventana de control del motor y verifique que la señal esté en su posición original en caso de que se desplace un poco.
- Registre esta señal como referencia.
- Vaya a la ventana Establecer propiedades DAQ. Cambie el valor de promedio a 5 y mantenga todos los demás parámetros como predeterminados.
- Haga clic en Nueva referencia. El contador de promediación en la parte superior derecha de la ventana contará de 0 a 20. Una vez que el contador alcanza 20, cambie el valor de promediación a 1 y haga clic en Aceptar. La señal reflejada del poliestireno se guardará como referencia para cualquier escaneo realizado más tarde.
NOTA: Si solo se tiene que realizar el procedimiento de diagnóstico por imágenes de THz, es mejor realizar los pasos 4.3–4.14 antes de sacar el tejido tumoral de la solución DMEM.
- Monte el tumor en la placa de poliestireno que cubre la ventana del escenario de exploración.
- Retire la ventana de imágenes de la etapa de exploración y llévela al área de manejo de tejidos. Coloque el tumor en una placa de poliestireno, como se muestra en la Figura 4B.
- Asegúrese de que no haya burbujas de aire significativas entre la placa y el tumor. Si se observan burbujas de aire, presione el tumor con pinzas o levante el tumor y rodéelo suavemente sobre el poliestireno hasta que se minimicen las brechas de aire.
- Coloque los espaciadores de absorción a intervalos regulares alrededor de la muestra de prueba como se muestra en la Figura 4B. Coloque otra placa de poliestireno por encima del tumor y presione suavemente para que la superficie del tumor sea lo más plana posible. Pegue esta disposición de poliestireno-tumor-poliestireno en la ventana de la muestra.
- Voltear la ventana de muestra como se muestra en la Figura 4C, y tomar fotos del tumor para mantener un registro de su orientación. Vuelva a colocar la ventana de muestra con el tumor en la etapa de exploración.
- Haga clic en el botón Diálogo de parámetros de imagen para abrir la ventana Parámetros de adquisición de imagen. Establezca los valores de Axis1min, Axis1max, Axis2miny Axis2max para encerrar completamente la posición del tumor en la ventana de imágenes
NOTA: De forma predeterminada, Axis1 es el eje A y Axis2 es el eje B. - Establezca Axis1step y Axis2step en 0,2 mm para el escaneo de imágenes.
NOTA: Al ajustar Axis1step y Axis2step, el tamaño de paso de los motores paso a paso se establecerá en incrementos de 200 m durante el proceso de escaneado. El tiempo total de escaneado se puede estimar en la ventana Parámetros de adquisición de imagen. - Haga clic en la pestaña Medir en la ventana principal y seleccione la opción Flyback 2D Scan. En la ventana que aparece, indique el directorio y el nombre de archivo bajo los cuales guardar los datos de análisis.
5. Postprocesamiento del Tejido Fresco en Preparación para el Procedimiento de Histopatología
- Una vez completado el proceso de escaneo, retire la ventana de muestra, las placas de poliestireno y la muestra del sistema de THz central y muévalas al área designada para residuos peligrosos. Retire el tumor de la placa de poliestireno y colóquelo en un pedazo plano de cartón de un tamaño comparable al del tumor. Asegúrese de que la orientación del tumor es la misma que en el poliestireno, con la cara de la imagen tocando el cartón.
- Sumerja un hisopo de algodón en un tinte de tejido rojo y manse el lado izquierdo del tumor hasta donde el borde del tumor entra en contacto con el cartón. Del mismo modo, mancha el lado derecho del tumor con tinte de tejido azul. Manchar la superficie expuesta del tumor con una línea de tinte de tejido amarillo que conecta la mancha roja a la mancha azul para denotar la parte posterior de la muestra, como se muestra en la Figura 7A.
NOTA: Para evitar que la tinta tiñe la solución de formalina, aplique sólo una capa delgada sobre el tejido. Esto se puede lograr clavando el hisopo de algodón en una superficie diferente antes de manchar el tejido o usar un hisopo de algodón limpio para limpiar cualquier exceso de tinte. Evite dejar que el tinte entre en contacto con la piel o la ropa. Este proceso de tinción tumoral se lleva a cabo como una referencia para proporcionar información sobre el lado de la imagen del tumor y su orientación al patólogo.

Figura 7: Post procesamiento del tumor después de la toma de imágenes de THz. (A) Tumor colocado boca abajo sobre el soporte de cartón y teñido con tinte de marcado tisular. (B) Filtrar el papel colocado sobre el tumor y pegado para mantener el contacto. (C) Tumor manchado fijado en el cartón sumergido en una solución de formalina tamponada 10% neutra y sellado con parafilm. Haga clic aquí para ver una versión más grande de esta figura.
- Deje secar la tinta durante unos 3-4 min. Cortar un pedazo de papel de filtro con las mismas dimensiones aproximadas que el cartón. Colóquelo en el tumor y envuelva un trozo de cinta completamente alrededor del papel del filtro y el cartón como se muestra en la Figura 7B. La cinta y el papel filtrante deben fijar el tumor contra el cartón sin aplicar ninguna presión significativa.
- Sumerja el tejido manchado fijado al cartón en una solución de formalina tamponada 10% neutral y selle el tubo centrífugo usando una película de parafina, como se muestra en la Figura 7C. Designe el número de muestra, la fecha, el tipo de tejido y el número de tumor para la muestra en la etiqueta del tubo. Envíe el tumor al patólogo para que lo procese más.
6. Eliminación de Residuos Peligrosos
- Recoger todos los residuos de la bandeja de manipulación de tejidos junto con la bolsa de riesgo biológico utilizada para cubrir la bandeja y colocarlos en una nueva bolsa de riesgo biológico, como se muestra en la Figura 8. Lleve la bolsa a la zona de residuos biopeligrosos designada en el edificio y fije una cita con el departamento de Salud y Seguridad Ambiental (EH&S) para la recogida de residuos. Limpie la bandeja de manipulación de tejidos y el área circundante sobre la mesa con un 10% de solución de lejía y etanol.

Figura 8: Fotografía de la bolsa de residuos biopeligrosas. Haga clic aquí para ver una versión más grande de esta figura.
- Lleve el soporte de muestra líquida con los espaciadores y las ventanas de cuarzo, la ventana de muestreo en la que se montó el tumor, las placas de poliestireno y las pinzas de laboratorio a la zona de lavado. Enjuague todos los materiales con agua y luego 10% solución de lejía, limpiando con toallas de papel según sea necesario para eliminar los restos de tejido. Enjuagar de nuevo con agua, fregar con solución de alconox y enjuagar bien. Para vidrio y plástico, enjuague en alcohol isopropílico al 70% y reserve para secar.
NOTA: Una vez que el tumor está en formalina y el espacio de la muestra está limpio, el procesamiento de datos se puede manejar al mismo tiempo que la toma de imágenes o un momento posterior.
7. Procesamiento de datos para construir imágenes THz
- Exporte los archivos de datos .tvl guardados desde el sistema THz. Los archivos de datos sin procesar obtenidos del sistema se escriben en Python y se leen mejor en Python antes de guardarlos como archivos de datos MATLAB.
- Para construir la imagen de THz del tejido fresco escaneado, convierta los datos de imágenes de reflexión de dominio de tiempo sin procesar en el dominio de frecuencia utilizando la transformación de Fourier en la tercera dimensión de la matriz de datos sin procesar (es decir, la dimensión de tiempo). También tome la transformación Fourier de los datos de referencia.
NOTA: Un espectro de dominio de frecuencia típico debe proporcionar datos que van desde 0,1 THz a 4 THz. - Normalizar los datos de la muestra con los datos de referencia y realizar los espectros de potencia basados en la integración de los datos normalizados en el rango de frecuencias de f1 a 0,5 THz a f2 a 1,0 THz utilizando la siguiente ecuación19:

NOTA: Aquí Emuestra es el dominio de frecuencia reflejo de los datos de imagen de la muestra de tejido y Ereferencia es el dominio de frecuencia de un solo punto de datos de reflexión de la señal de referencia. - Construya la imagen bidimensional trazando los datos de espectros de potencia calculados en cada punto de la matriz definida por el eje A y el eje B. Esto se conoce como la imagen de espectro de potencia THz.
NOTA: El método para obtener una imagen tomográfica de THz en su lugar se detalla en los pasos 7.5–7.7. - Para la caracterización, calcule la reflexión teórica dependiente de la frecuencia para un rango de propiedades de tejido potencialutilizando la siguiente ecuación18:
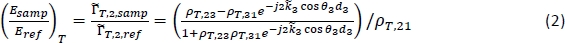
NOTA: Aquí T,ij es el coeficiente de reflexión de Fresnel complejo entre la región i y la región j;dj es el espesor de la región j; y el ángulo de propagación en la región j está relacionado con el ángulo de incidencia de la Ley de Snell. j es el coeficiente de propagación complejo en la región j, donde es la frecuencia angular, c es la velocidad de la luz en vacío, nj es la parte real del índice de refracción, y elabs,j es el coeficiente de absorción18. La región 1 es aire, la Región 2 es la placa de poliestireno, y la Región 3 es el tejido.
es el coeficiente de propagación complejo en la región j, donde es la frecuencia angular, c es la velocidad de la luz en vacío, nj es la parte real del índice de refracción, y elabs,j es el coeficiente de absorción18. La región 1 es aire, la Región 2 es la placa de poliestireno, y la Región 3 es el tejido. - Calcule la reflexión en la ecuación (2) para un rango de índices de refracción definidos por el usuario y coeficientes de absorción para la Región 3 (n3 y áabs,3) y compare con la señal medida en cada punto para calcular el error cuadrado medio combinado para la magnitud y la fase.
NOTA: La solución para el índice de refracción y el coeficiente de absorción es el par de valores que dan el error más bajo. - Construya la imagen tomográfica de THz a partir de los datos de índice de refracción extraídos y los datos del coeficiente de absorción (n3 yabs,3) en cada píxel. α Analizar las regiones tumorales comparando con la imagen de diapositiva sapatopadea obtenida del patólogo. Los resultados representativos se muestran en la Figura 9,con ejemplos de adherencia insuficiente al protocolo en la Figura 10 y la Figura 11.
8. Extracción de propiedades eléctricas del tejido utilizando datos de espectroscopia de transmisión
- En la ventana principal del software de medición de espectroscopia de transmisión THz, vaya a la pestaña Archivo y haga clic en la opción Exportar. Aparecerá una ventana para seleccionar el Tipo de datos y El ejemplo que se va a exportar. Elija los tipos de datos De transmisión y fase de transmisión para las mediciones de cuarzo y muestras de tejido.
- Calcular la transmisión teórica dependiente de la frecuencia para una gama de propiedades de tejido potencial utilizando la siguiente ecuación15:
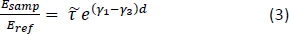
NOTA: Aquí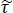 está la relación entre los coeficientes de transmisión de Fresnel para las configuraciones de muestra y de referencia; Los1 números 1 y 3 son las complejas constantes de propagación del aire y el tejido, respectivamente; y d es el grosor del tejido. La constante de propagación
está la relación entre los coeficientes de transmisión de Fresnel para las configuraciones de muestra y de referencia; Los1 números 1 y 3 son las complejas constantes de propagación del aire y el tejido, respectivamente; y d es el grosor del tejido. La constante de propagación  en general se define como . ñ es el índice de
en general se define como . ñ es el índice de  refracción complejo definido como , donde n es la parte real del índice de refracción; c es la velocidad de la luz; es la frecuencia angular; y abs es el coeficiente de absorción15.
refracción complejo definido como , donde n es la parte real del índice de refracción; c es la velocidad de la luz; es la frecuencia angular; y abs es el coeficiente de absorción15. - Calcule el error cuadrado medio combinado entre la magnitud y la fase de la transmisión en la ecuación (3) y los datos de medición del sistema para un rango de valores de n y absabs definidos por el usuario.
NOTA: La solución para el índice de refracción y el coeficiente de absorción es el par de valores que dan el error más bajo. - Trazar los datos extraídos del índice de refracción y del coeficiente de absorción con respecto al rango de frecuencia sin 0,15–3,5 THz. Los resultados representativos se muestran en la Figura 12.
Resultados
Los resultados de las imágenes de THz18 obtenidos siguiendo el protocolo antes mencionado de la muestra de tumor de cáncer de mama humano #ND14139 recibidos del biobanco se presentan en la Figura 9. Según el informe patológico, el tumor #ND14139 era un carcinoma ductal infiltrante de grado I/II obtenido de una mujer de 49 años a través de un procedimiento de cirugía de lumpectomía mamaria izquierda. La fotografía del tumor se muestra en la
Discusión
La imagen eficaz de reflexión tHz del tejido fresco depende principalmente de dos aspectos críticos: 1) la consideración adecuada del manejo de los tejidos (secciones 2 y 4.15); y 2) la configuración de la etapa (principalmente la sección 4.11). El secado insuficiente del tejido puede resultar en una mayor reflexión e incapacidad para visualizar las regiones debido a los altos reflejos de DMEM y otros fluidos. Mientras tanto, el contacto deficiente del tejido con la ventana de imágenes crea anillos o manchas de ba...
Divulgaciones
Los autores declaran que no tienen conflicto de intereses.
Agradecimientos
Este trabajo fue financiado por el Premio de los Institutos Nacionales de Salud (NIH) R15CA208798 y en parte por el Premio de la Fundación Nacional de Ciencias (NSF) n.o 1408007. La financiación del sistema de THz pulsado se obtuvo a través del Premio NSF/MRI n.o 1228958. Reconocemos el uso de tejidos adquiridos por el National Disease Research Interchange (NDRI) con el apoyo de la subvención DE NIH U42OD11158. También reconocemos la colaboración con el Laboratorio de Diagnóstico de Enfermedades Animales de Oklahoma en la Universidad Estatal de Oklahoma para llevar a cabo el procedimiento de histopatología en todos los tejidos manejados en este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| 70% isopropyl alcohol | VWR | 89108-162 | Contains 70% USP grade isopropanol and 30% USP grade deionized water |
| Alconox powder detergent | VWR | 21835-032 | Concentrated detergent to remove organic contaminants from glass, metal, stainless steel, porcelain, ceramic, plastic, rubber, and fiberglass |
| Bio Hazard Bags | Fisher Scientific | 19-033-712 | Justrite FM-Approved Biohazard Waste Container Replacement Bags |
| Cardboard holder | N/A | N/A | Scrap cardboard to keep tissue imaging face intact when immersed in formalin |
| Centrifuge Tubes | VWR | 10026-078 | Centrifuge Tubes with Flat Caps, Conical-Bottom, Polypropylene, Sterile, Standard Line |
| Cotton Swabs | Walmart | 551398298 | Q-tips Original Cotton Swabs used to dye the tissue |
| Ethyl Alcohol | VWR | 71002-426 | KOPTECH Pure (undenatured) anhydrous (200 proof/100%) ethyl alcohol |
| Eye protection goggles | VWR | 89130-918 | Kimberly-clark professional safety glasses |
| Face Mask | VWR | 95041-774 | DUKAL Corporation surgical masks |
| Filter paper | Sigma Aldrich | Z240087 | Whatman grade 1 cellulose filters |
| Formalin solution | Sigma Aldrich | HT501128-4L | 10% neutral buffered formalin |
| Human freshly excised tumors (Infilterating Ductal Carcinoma (IDC)) | National Disease Research Interchange (NDRI biobank | N/A | A protocol is signed with the NDRI for the type of tumors required |
| IRADECON Bleach solution | VWR | 89234-816 | Pre-diluted Sodium Hypochlorite Bleach solution |
| KIMTECH SCIENCE wipes | VWR | 21905-026 | Kimberly-clark professional Kim wipes |
| Laboratory Coat | VWR | 10141-342 | This catalog number is for medium size coat |
| Laboratory tweezers/Forceps | VWR | 82027-388 | Any laboratory tweezers can be used as long as it does not damage the tissue |
| Liquid sample holder (two quartz windows with a 0.1 mm teflon spacer) | TeraView, Ltd | N/A | 1" diameter, and 0.1452" thick quartz windows |
| Nitrile hand gloves | VWR | 82026-426 | This catalog number is for medium size gloves |
| Nitrogen cylinder | Airgas | NI UHP300 | NITROGEN UHP GR 5.0 SIZE 300 |
| Paper towel | VWR | 14222-321 | 11" x 8.78" Sheets, 1 Ply |
| Parafilm | VWR | 52858-076 | Flexible thermoplastic. Rolled, waterproof sheet interwound with paper to prevent self-adhesion. |
| Petri Dish | VWR | 470210-568 | VWR Petri Dish, Slippable, Mono Plate (undivided bottom) |
| Polystyrene Plate | Home Depot | 1S11143A | ~ 10 cm x 10 cm square piece cut from a 11" x 14" x 0.05" Non-glare styrene sheet |
| ScanAcquire Software | TeraView, Ltd | N/A | System Software for THz reflection imaging measurements |
| Stainless steel low-profile blade (#4689) | VWR | 25608-964 | Tissue-Tek Accu-Edge Disposable Microtome Blades |
| Stainless steel metal tray | Quick Medical | 10F | Polar Ware Stainless Steel Medical Instrument Trays |
| Tissue Marking Dyes | Ted Pella, Inc | Yellow Dye #27213-1 Red Dye #27213-2 Blue Dye #27213-4 | Used to orient excised tissue samples sent to the histopathology laboratory |
| TPS Spectra 3000 | TeraView, Ltd | N/A | THz imaging and spectroscopy system |
| TPS Spectra Software | TeraView, Ltd | N/A | System Software for THz transmission spectroscopy measurements |
Referencias
- Burford, N. M., El-Shenawee, M. O. Review of terahertz photoconductive antenna technology. Optical Engineering. 56 (1), 010901 (2017).
- Sun, Q., et al. Recent advances in terahertz technology for biomedical applications. Quantitative Imaging in Medicine and Surgery. 7 (3), 345-355 (2017).
- Wilmink, G. J., et al. In vitro investigation of the biological effects associated with human dermal fibroblasts exposed to 2.52 THz radiation. Lasers in Surgery and Medicine. 43 (2), 152-163 (2011).
- Arbab, M. H., et al. Terahertz spectroscopy for the assessment of burn injuries in vivo. Journal of Biomedical Optics. 18 (7), 077004 (2013).
- Sy, S., et al. Terahertz spectroscopy of liver cirrhosis: investigating the origin of contrast. Physics in Medicine and Biology. 55 (24), 7587-7596 (2010).
- Yu, C., Fan, S., Sun, Y., Pickwell-Macpherson, E. The potential of terahertz imaging for cancer diagnosis: A review of investigations to date. Quantitative Imaging in Medicine and Surgery. 2 (1), 33-45 (2012).
- El-Shenawee, M., Vohra, N., Bowman, T., Bailey, K. Cancer detection in excised breast tumors using terahertz imaging and spectroscopy. Biomedical Spectroscopy and Imaging. 8 (1-2), 1-9 (2019).
- Yamaguchi, S., et al. Brain tumor imaging of rat fresh tissue using terahertz spectroscopy. Scientific Reports. 6 (30124), 1-6 (2016).
- Rong, L., et al. Terahertz in-line digital holography of human hepatocellular carcinoma tissue. Scientific Reports. 5 (8445), 1-6 (2015).
- Park, J. Y., Choi, H. J., Nam, G., Cho, K., Son, J. In Vivo Dual-Modality Terahertz / Magnetic Resonance Imaging Using Superparamagnetic Iron Oxide Nanoparticles as a Dual Contrast Agent. IEEE Transactions on Terahertz Science and Technology. 2 (1), 93-98 (2012).
- Ji, Y. B., et al. Feasibility of terahertz reflectometry for discrimination of human early gastric cancers. Biomedical Optics Express. 6 (4), 1413-1421 (2015).
- Bowman, T., et al. A Phantom Study of Terahertz Spectroscopy and Imaging of Micro- and Nano-diamonds and Nano-onions as Contrast Agents for Breast Cancer. Biomedical Physics and Engineering Express. 3 (5), 055001 (2017).
- Chavez, T., Bowman, T., Wu, J., Bailey, K., El-Shenawee, M. Assessment of Terahertz Imaging for Excised Breast Cancer Tumors with Image Morphing. Journal of Infrared, Millimeter, and Terahertz Waves. 39 (12), 1283-1302 (2018).
- Bowman, T. C., El-Shenawee, M., Campbell, L. K. Terahertz Imaging of Excised Breast Tumor Tissue on Paraffin Sections. IEEE Transactions on Antennas and Propagation. 63 (5), 2088-2097 (2015).
- Bowman, T., El-Shenawee, M., Campbell, L. K. Terahertz transmission vs reflection imaging and model-based characterization for excised breast carcinomas. Biomedical Optics Express. 7 (9), 3756-3783 (2016).
- Bowman, T., Wu, Y., Gauch, J., Campbell, L. K., El-Shenawee, M. Terahertz Imaging of Three-Dimensional Dehydrated Breast Cancer Tumors. Journal of Infrared, Millimeter, and Terahertz Waves. 38 (6), 766-786 (2017).
- Bowman, T., et al. Pulsed terahertz imaging of breast cancer in freshly excised murine tumors. Journal of Biomedical Optics. 23 (2), 026004 (2018).
- Bowman, T., Vohra, N., Bailey, K., El-Shenawee, M. Terahertz tomographic imaging of freshly excised human breast tissues. Journal of Medical Imaging. 6 (2), 023501 (2019).
- Vohra, N., et al. Pulsed Terahertz Reflection Imaging of Tumors in a Spontaneous Model of Breast Cancer. Biomedical Physics and Engineering Express. 4 (6), 065025 (2018).
- Jacobs, L. Positive margins: the challenge continues for breast surgeons. Annals of Surgical Oncology. 15 (5), 1271-1272 (2008).
- Moran, M. S., et al. Society of Surgical Oncology--American Society for Radiation Oncology Consensus Guideline on Margins for Breast-Conserving Surgery With Whole-Breast Irradiation in Stages I and II Invasive Breast Cancer. International Journal of Radiation Oncology. 88 (3), 553-564 (2014).
- Fitzgerald, A. J., et al. Terahertz Pulsed Imaging of human breast tumors. Radiology. 239 (2), 533-540 (2006).
- Ashworth, P. C., et al. Terahertz pulsed spectroscopy of freshly excised human breast cancer. Optics Express. 17 (15), 12444-12454 (2009).
- Doradla, P., Alavi, K., Joseph, C., Giles, R. Detection of colon cancer by continuous-wave terahertz polarization imaging technique. Journal of Biomedical Optics. 18 (9), 090504 (2013).
- Reid, C. B., et al. Terahertz pulsed imaging of freshly excised human colonic tissues. Physics in Medicine and Biology. 56 (1), 4333-4353 (2011).
- . Teraview.com Available from: https://teraview.com (2019)
- Orosco, R. K., et al. Positive Surgical Margins in the 10 Most Common Solid Cancers. Scientific Reports. 8 (1), 1-9 (2018).
- Bowman, T., et al. Statistical signal processing for quantitative assessment of pulsed terahertz imaging of human breast tumors. 2017 42nd International Conference on Infrared, Millimeter, and Terahertz Waves (IRMMW-THz). , 1-2 (2017).
- Gavdush, A. A., et al. Terahertz spectroscopy of gelatin-embedded human brain gliomas of different grades: a road toward intraoperative THz diagnosis. Journal of Biomedical Optics. 24 (2), 027001 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados