É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Protocolo de imagem e caracterização de terahertz para tumores de câncer de mama recém-excisados
Neste Artigo
Resumo
Os tumores de câncer de mama humanos recém-excisados são caracterizados com espectroscopia terahertz e imagens seguindo protocolos de manuseio de tecidos frescos. O posicionamento tecidual é levado em consideração para permitir uma caracterização eficaz, proporcionando a análise em tempo hábil para futuras aplicações intraoperatórias.
Resumo
Este manuscrito apresenta um protocolo para lidar, caracterizar e imagem recém-excisado tumores de mama humana usando técnicas de imagem terahertz pulsada e técnicas de espectroscopia. O protocolo envolve o modo de transmissão terahertz em incidência normal e o modo de reflexão terahertz em um ângulo oblíquo de 30°. Os dados experimentais coletados representam pulsos de domínio de tempo do campo elétrico. O sinal de campo elétrico terahertz transmitido através de um ponto fixo no tecido excisado é processado, através de um modelo analítico, para extrair o índice de refração e coeficiente de absorção do tecido. Utilizando um scanner motor de passo, o pulso emitido por terahertz é refletido a partir de cada pixel no tumor, fornecendo uma imagem planar de diferentes regiões teciduais. A imagem pode ser apresentada no domínio de tempo ou frequência. Além disso, os dados extraídos do índice de refração e do coeficiente de absorção em cada pixel são utilizados para fornecer uma imagem terahertz tomográfica do tumor. O protocolo demonstra clara diferenciação entre tecidos cancerígenos e saudáveis. Por outro lado, não aderir ao protocolo pode resultar em imagens barulhentos ou imprecisas devido à presença de bolhas de ar e restos de fluidos na superfície do tumor. O protocolo fornece um método para avaliação das margens cirúrgicas dos tumores mamários.
Introdução
A imagem e a espectroscopia de Terahertz (THz) têm sido uma área de pesquisa em rápido crescimento na última década. O desenvolvimento contínuo de emissores thz mais eficientes e consistentes na faixa de 0,1-4 THz fez com que suas aplicações crescessem significativamente1. Uma área onde o THz mostrou-se promissor e crescimento significativo é o campo biomédico2. A radiação THz mostrou-se nonionizadora e biologicamente segura nos níveis de potência geralmente utilizados para analisar tecidos fixos3. Como resultado, a imagem e a espectroscopia de THz têm sido utilizadas para classificar e diferenciar várias características teciduais, como o teor de água para indicar danos e cicatrização de queimaduras4, cirrose hepática5, e câncer em tecidos excisados6,7. A avaliação do câncer, em particular, abrange uma ampla gama de aplicações clínicas e cirúrgicas potenciais, e tem sido investigada para cânceres do cérebro8,fígado9, ovários10, trato gastrointestinal11, e mama7,12,13,14,,15,16,17,18,19.
As aplicações de THz para câncer de mama são focadas principalmente no apoio à cirurgia de conservação da mama, ou lumpectomia, via avaliação de margem. O objetivo de uma lumpectomia é remover o tumor e uma pequena camada de tecido saudável circundante, em contraste com a mastectomia completa, que remove toda a mama. A margem cirúrgica do tecido excisado é então avaliada via patologia uma vez que a amostra tenha sido fixada em formalina, seccionada, incorporada em parafina e montada em fatias de 4 μm-5 μm em lâminas de microscópio. Esse processo pode ser demorado e requer um procedimento cirúrgico secundário posteriormente se for observada uma margem positiva20. As diretrizes atuais da Sociedade Americana de Oncologia de Radiação definem essa margem positiva como tendo células cancerígenas entrando em contato com a tinta de margem de nível superficial21. A imagem de THz para tecido hidratado de alta absorção é limitada principalmente à imagem superficial com alguma penetração variável com base no tipo de tecido, o que é suficiente para atender às necessidades cirúrgicas de avaliação rápida da margem. Uma análise rápida das condições de margem durante o ajuste cirúrgico diminuiria consideravelmente os custos cirúrgicos e a taxa de procedimento de acompanhamento. Até o momento, o THz tem se mostrado eficaz na diferenciação entre câncer e tecido saudável em tecidos formalizados, embutidos em parafina (FFPE), mas uma investigação adicional é necessária para fornecer uma detecção confiável de câncer em tecidos recém-excisados7.
Este protocolo detalha as etapas para a realização de imagens e espectroscopia de THz em amostras de tecido humano recém-excisadas obtidas de um biobanco. Aplicações de THz construídas em tecidos recém-excisados do câncer de mama humano raramente têm sido utilizadas em pesquisas publicadas7,,18,22,23, especialmente por grupos de pesquisa não integrados a um hospital. O uso de tecidos recém-excisados também é raro para outras aplicações de câncer, com a maioria dos exemplos de câncer humano não-mamário sendo relatados para câncer de cólon24,25. Uma das razões para isso é que os blocos de tecido ffpe são muito mais fáceis de acessar e manusear do que o tecido recém-excisado, a menos que o sistema THz que está sendo usado para o estudo seja parte do fluxo de trabalho cirúrgico. Da mesma forma, a maioria dos sistemas de THz de laboratório comercial não estão preparados para lidar com tecidos frescos, e aqueles que o fazem ainda estão em fase de uso do crescimento da linha celular ou só começaram a olhar para tecidos excisados de modelos animais. Aplicar THz a um cenário intraoperatório requer que as etapas de imagem e caracterização sejam desenvolvidas para o tecido fresco com antecedência para que a análise não interfira na capacidade de realizar a patologia padrão. Para aplicações que não são inerentemente destinadas a serem intraoperatórias, a caracterização de tecido fresco ainda é um passo desafiador que deve ser abordado para trabalhar em direção às aplicações in vivo e diferenciação.
O objetivo deste trabalho é fornecer uma diretriz para a aplicação de THz para tecido recém-excisado utilizando um sistema comercial de THz. O protocolo foi desenvolvido em um sistema de imagem e espectroscopia thz26 para tumores de câncer de mama murina13,17,19 e foi estendido ao tecido cirúrgico humano obtido a partir de biobancos7,18. Enquanto o protocolo foi gerado para o câncer de mama, os mesmos conceitos podem ser aplicados a sistemas de imagem thz semelhantes e outros tipos de cânceres de tumor sólido que são tratados com cirurgia onde o sucesso depende da avaliação da margem27. Devido a uma quantidade bastante pequena de resultados de THz publicados em tecidos recém-excisados, este é o primeiro trabalho ao conhecimento dos autores a focar no protocolo de manuseio de tecidos frescos para imagem e caracterização de THz.
Protocolo
Este protocolo segue todos os requisitos estabelecidos pelo departamento de Saúde e Segurança Ambiental da Universidade do Arkansas.
1. Configurar a área de manuseio de tecidos
- Pegue uma bandeja de metal de aço inoxidável e cubra-a com o saco de risco biológico, conforme mostrado na Figura 1. Qualquer manuseio dos tecidos biológicos será realizado dentro da área da bandeja (ou seja, a área de manuseio de tecidos).
- Prepare pinças de laboratório, lenços umedecidos, toalhas de papel, pacote de papel filtro, garrafas de tinta de tecido, garrafa de alvejante e garrafa de etanol ao redor da bandeja para fácil acesso quando necessário. Mantenha quaisquer tecidos, lenços e luvas usados na superfície do material de risco biológico para descartar no final do protocolo.
- Encha um tubo de centrífuga de 50 mL com até 45 mL de formalina tamponada neutra de 10% e coloque-a na bandeja de armazenamento de centrífugas perto da bandeja de manuseio de tecidos.
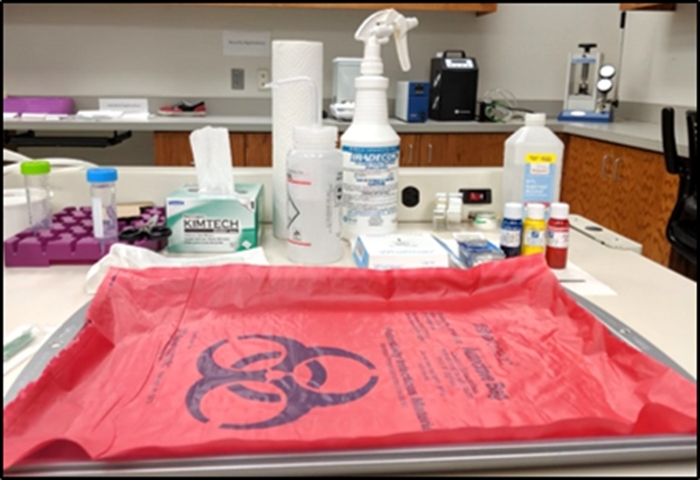
Figura 1: Configuração da área de manuseio de tecidos. Clique aqui para ver uma versão maior desta figura.
2. Manuseio de tumor de câncer de mama fresco para espectroscopia de transmissão de THz
ATENÇÃO: Antes de manusear qualquer tecido vivo, coloque luvas de mão nitrilos, óculos de proteção ocular, uma máscara facial e um jaleco. Use sempre pinças de laboratório para manusear tecidos e evite tocá-los diretamente com as mãos. Todo o trabalho com tecido fresco fora de um recipiente selado ou o estágio de varredura deve ser realizado na área de manuseio de tecidos estabelecida na etapa 1.1.
NOTA: Todos os tecidos manuseados neste trabalho foram enviados no meio de Águia Modificada (DMEM) de Dulbecco e solução de antibióticos do biobanco.
- Remova o tumor a granel da solução DMEM e coloque-o em uma placa de Petri na área de manuseio de tecidos (ver Figura 2A).
- A partir da inspeção bruta, identifique diferentes regiões tumorais das quais cortar pequenos pedaços para caracterização de transmissão. Corte um segmento de 0,5 mm de espessura do tumor dos pontos identificados usando uma lâmina de baixo perfil de aço inoxidável, conforme mostrado na Figura 2B. Coloque esta seção fatiada entre duas janelas de quartzo com um espaçador de 0,1 mm de espessura em um suporte de amostra líquida, conforme mostrado na Figura 2C.

Figura 2: Secção de tumor para as medidas de espectroscopia de transmissão de THz. (A)Fotografia do tumor a granel. (B) Fotografia das pequenas seções (0,5 mm) do tumor cortado do tumor a granel. (C) A seção de tumor fatiado colocada no suporte da amostra líquida entre as duas janelas de quartzo com um espaçador de politetrafluoetileno de 0,1 mm para medição de espectroscopia. Figura republicada de T. Bowman et al.18 com permissão da SPIE. Clique aqui para ver uma versão maior desta figura.
3. Medições de espectroscopia de transmissão de THz
- Defina o módulo de espectroscopia de transmissão dentro da câmara central de THz alinhando as alças do módulo sobre os postes de montagem no sistema central e deslizando o estágio para baixo no sistema. Aperte os dois parafusos de montagem nos cantos superior direito e inferior esquerdo do módulo, conforme mostrado na Figura 3A.
- Expurgue o sistema com gás nitrogênio seco a 5 L/min (LPM) durante todo o procedimento de espectroscopia para remover vapor de água do espaço amostral.
- Abra o software de medição de espectroscopia de transmissão THz da área de trabalho conectada ao sistema THz. Vai abrir a janela principal.
- Clique na guia Scan na parte superior da janela. Uma janela de configuração do Spectra Scan aparecerá. No menu suspenso da guia Modo de Medição no canto superior direito da janela, selecione Transmissão para configurar espectroscopia de transmissão. Se o pico não estiver automaticamente visível, verifique a opção Ativar na guia Manual Peak Search e avance manualmente o atraso óptico para trazer o pico à vista.
-
Após 30 min de purga, registre um sinal de referência de ar seguindo os passos abaixo.
- Na guia Configurações de varredura na janela de configuração spectra scan, insira um nome apropriado para o arquivo de referência, defina Num Scans como 1.800 e defina o Atraso inicial (s)como 0. Deixe as outras configurações como seus valores padrão.
- Clique em Medir referência na janela de configuração de varredura para fazer a medição de referência de ar. Em seguida, clique em Medir amostra para medir o sinal de transmissão através do ar como uma média amostral de 1.800 sinais acima de ~1 min.

Figura 3: Configuração do módulo de espectroscopia de transmissão THz. (A) Câmara central de THz com o módulo de transmissão montado sobre ele. (B) Uma fotografia do portador da amostra líquida. (C) O suporte da amostra colocado dentro da câmara central para as medidas. Clique aqui para ver uma versão maior desta figura.
-
Meça as duas janelas de quartzo no suporte da amostra líquida, conforme mostrado na Figura 3B.
- Coloque as duas janelas de quartzo no suporte da amostra líquida sem um espaçador no meio.
- Abra a câmara central thz. Monte o suporte da amostra líquida no módulo de espectroscopia de transmissão, conforme mostrado na Figura 3C. Feche a câmara.
- Clique na guia Scan na janela principal. Repita as etapas 3.5.1-3.5.2 para a amostra de quartzo, mas atualize Start Delay (s)para 900. Isso permite que o tempo expurgue qualquer vapor de água antes da medição.
- Se o quartzo for desejado como referência para amostras adicionais, clique na guia Limpar referência nas Configurações de varredura. Isso limpa a referência aérea. Em seguida, clique na guia Medir referência para registrar as medidas de quartzo como uma nova referência.
- Coloque a seção de tumor fatiado entre as duas janelas de quartzo dentro do suporte da amostra líquida e posicione o suporte dentro da câmara para uma medição de transmissão de um único ponto do tecido. Para registrar a medição, repita a etapa 3.6.3.
- Tire o suporte da amostra líquida da câmara quando as medidas estiverem concluídas e leve-a para a área designada para o manuseio de tecidos. Desmonte o suporte da amostra líquida, limpe a seção do tumor das janelas de quartzo com os lenços umedecidos e coloque os lenços usados na mesma bandeja para descartar no saco de risco biológico junto com os outros resíduos de risco biológico.
- Repita as etapas 2.2, 3.7 e 3.8 conforme necessário para caracterizar fatias adicionais de tumor. Quando as medidas estiverem concluídas, vá até a janela principal e clique na guia Arquivo para salvar os dados de medição. Feche a janela do software.
4. Manipulação de tumor de câncer de mama fresco para imagem do modo de reflexão de THz
- Remova a amostra de tumor fresco da solução DeMEM e antibióticos e coloque-a em uma placa de Petri. Usando inspeção grosseira, selecione um lado do tumor a ser imagem do que é suficientemente plano e tem pouco sangue e poucos vasos sanguíneos. Evite o tecido de imagem com sangue ou vasos sanguíneos, se possível.
- Coloque o tumor com o lado a ser imagem do papel filtro grau 1 para secar o excesso de DMEM e limpar o tecido de fluidoou secreções do tumor, conforme mostrado na Figura 4A. Reposicione o tumor no papel filtro para um ponto seco à medida que o papel satura. Seque o tumor por ~5 min.

Figura 4: Preparação de amostra de tumor fresco para imagem thz. (A)Tumor colocado no papel filtro para secar. (B) Tumor colocado na placa de poliestireno sobre a janela de imagem com almofadas de limpeza de tecido para absorver fluidos em excesso. (C) Tumor visto de baixo para acompanhar a orientação e verificar se há bolhas de ar. Clique aqui para ver uma versão maior desta figura.
- Desmontar o módulo de espectroscopia de transmissão e definir a base de espelho do módulo de imagem de reflexão (RIM) no sistema central de THz, conforme mostrado na Figura 5A. Ao definir os espelhos, monte o estágio de digitalização RIM acima da base do espelho e aparafusar-o no sistema central (ver Figura 5B).
- Expurgue o sistema com gás nitrogênio seco a 5 LPM por 30 min antes do procedimento de imagem para remover vapor de água do compartimento da amostra. Após 30 min, reduza a quantidade de gás nitrogênio seco para 3 LPM pelo resto do tempo que o sistema estiver em uso.
- Coloque uma placa de poliestireno de espessura ~1,2 mm na janela de varredura de diâmetro ~37 mm. Centrale a janela de varredura juntamente com a placa de poliestireno no estágio da amostra.

Figura 5: Configuração do sistema para imagens de reflexão. (A)Base espelhada do módulo de imagem de reflexão. (B)Estágio de varredura. Clique aqui para ver uma versão maior desta figura.
NOTA: Outras espessuras e materiais de placa são adequados para a etapa 4.5, mas devem ter uma espessura uniforme e ser de baixa absorção suficiente para não impedir o sinal de THz.
- Abra o software de medição de imagem de reflexão THz da área de trabalho conectada ao sistema THz. Uma janela aparecerá mostrando vários ícones de diálogo para funções específicas e duas subjanelas para plotagens de campo De Hz (unidades arbitrárias a.u.) em relação à hora e frequência, respectivamente.
- Para definir os parâmetros da configuração RIM, clique no ícone Diálogo parâmetro de imagem na parte superior da janela. Uma janela Desemestarção de Imagens aparecerá. Selecione RIM no menu suspenso da guia Modelo para configuração de imagens de reflexão. Aperte OK e volte para a janela principal do software.
- Na janela principal, clique no ícone De varredura de ponto fixo. Isso ativará as antenas THz para começar a enviar o sinal thz incidente e receber o sinal thz refletido de um único ponto na placa de poliestireno.
- Clique no ícone Diálogo do Estágio motor na parte superior da janela principal. A janela de controle do motor se abrirá. Ajuste o eixo de atraso óptico clicando nas setas de direção para frente/inversa para centralizar o pulso refletido do poliestireno na janela principal.
NOTA: Após o ajuste do eixo de atraso óptico, dois pulsos devem aparecer na janela, como mostrado na Figura 6: um da interface inferior da placa de poliestireno (reflexo primário) e um da interface superior da placa de poliestireno (reflexo secundário). -
Janela o reflexo primário da placa de poliestireno e mantenha o reflexo secundário na janela, o que contribuirá para os reflexos do tecido durante o procedimento de imagem. Isso é feito em duas etapas.
- Primeiro, clique no botão Configurações daq na parte superior da janela principal para abrir a janela de diálogo de configurações do DAQ. Alterar o valor de atraso óptico de 5 V (padrão) para 4 V.
- Em segundo lugar, ajuste a posição vertical do estágio de varredura com a escala do micrômetro no estágio de varredura até que a minima do pulso secundário seja a mais forte. Ajuste o atraso óptico do eixo na janela de controle do motor para colocar o reflexo primário fora do alcance do sinal refletido que está sendo medido.
NOTA: Para uma placa de poliestireno de 1,2 mm de espessura, o reflexo primário é janelado quando o pico mínimo de reflexo secundário é de aproximadamente -0,3 mm no eixo de atraso óptico da janela de domínio de tempo.
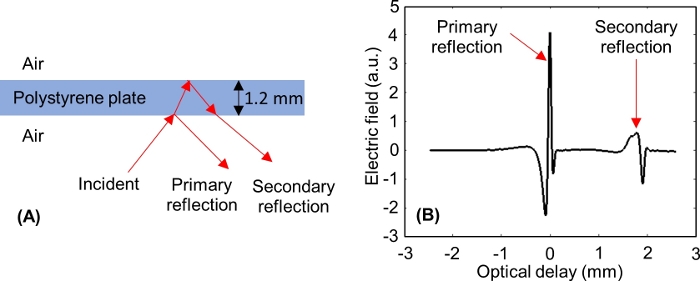
Figura 6: Reflexos de THz das interfaces inferior e superior da placa de poliestireno. (A) Incidente de sinal de THz para e refletido a partir de uma placa de poliestireno de 1,2 mm de espessura. (B) Os sinais de domínio de tempo primário e secundário de THz medidos a partir do poliestireno. Clique aqui para ver uma versão maior desta figura.
- Nivele o estágio amostral e grave o sinal de referência.
- Selecione dois pontos em cada eixo (eixo A e eixo B) que denotam locais na placa de poliestireno perto da borda da janela de amostra. Por exemplo, para o eixo A que varia de -15 mm a 15 mm, os dois pontos de posição podem ser -10 mm e 10 mm; e para o eixo B variando de -15 mm a 15 mm, os dois pontos de posição podem ser -10 mm e 10 mm.
- Clique no botão Diálogo do Controle do Motor para abrir a janela de controle do motor. Reposicione a janela de controle do motor e a janela principal do software para que o sinal de domínio de tempo seja visível enquanto ajusta as posições do motor. Coloque o eixo A e o eixo B em 0 mm.
- Nivele o eixo A usando as etapas seguintes. Um intervalo de -10 mm-10 mm é usado como exemplo.
- Na janela de controle do motor,altere o valor do eixo A de 0 para -10 e aperte Enter. O estágio move-se para a posição de -10 mm no eixo A e observa-se uma mudança na posição do sinal na janela principal.
- Use a escala de micrômetro ajustável no estágio de digitalização mostrado na Figura 5B para mover o pico mínimo do sinal de volta para a posição definida na etapa 4.10.2.
- Altere o valor do eixo A para +10 e aperte enter. O estágio passará da posição -10 mm para a posição +10 mm no eixo A e uma mudança no sinal é observada novamente. Observe a direção e a distância que o sinal mudou da posição anterior e altere novamente o valor do eixo A para -10. O sinal voltará para a posição definida na etapa 4.11.5.
- Gire o parafuso de nivelamento no eixo A do estágio de digitalização, como mostrado na Figura 5B e mude o sinal para dobrar a distância na mesma direção que ele se moveu da posição original. Use o micrômetro no estágio de varredura para deslocar o sinal de volta para a posição original (-0,3 mm para 1,2 mm de poliestireno).
- Repita as etapas 4.11.6-4.11.7 até que o sinal em +10 e -10 sejam iguais e o pico para ambas as posições esteja focado na posição original (-0,3 mm no eixo óptico).
- Uma vez alcançado o nivelamento do eixo A, altere o valor do eixo A para 0 e repita o mesmo procedimento para o eixo B. Comece mudando o valor do eixo B na janela de controle do motor de 0 para o valor mais positivo (por exemplo +10 mm). Além disso, durante o nivelamento, use o parafuso de nivelamento no eixo B do estágio de digitalização, que é mostrado na Figura 5B.
- Uma vez nivelados ambos os eixos, retorne o eixo A e o eixo B para 0 mm. Feche a janela de controle do motor e verifique se o sinal está na posição original caso seja deslocado um pouco.
- Grave este sinal como referência.
- Vá para a janela SET DAQ Properties. Altere o valor médio para 5 e mantenha todos os outros parâmetros como padrão.
- Clique em Nova Referência. O contador médio no canto superior direito da janela contará de 0 a 20. Uma vez que o contador atinja 20, altere o valor médio para 1 e clique em OK. O sinal refletido do poliestireno será salvo como referência para quaisquer exames feitos posteriormente.
NOTA: Se apenas o procedimento de imagem tHz tiver que ser realizado, então é melhor realizar as etapas 4.3-4.14 antes de tirar o tecido tumoral da solução DMEM.
- Monte o tumor na placa de poliestireno que cobre a janela do palco de varredura.
- Remova a janela de imagem do estágio de varredura e leve-a para a área de manuseio de tecidos. Coloque o tumor sobre uma placa de poliestireno, conforme mostrado na Figura 4B.
- Certifique-se de que não há bolhas de ar significativas entre a placa e o tumor. Se forem observadas bolhas de ar, pressione o tumor com pinças ou levante o tumor e role-o suavemente sobre o poliestireno até que as lacunas de ar sejam minimizadas.
- Coloque espaçadores absortivos em intervalos regulares ao redor da amostra de ensaio, conforme mostrado na Figura 4B. Coloque outra placa de poliestireno acima do tumor e pressione suavemente para tornar a superfície do tumor o mais plana possível. Fita este arranjo de poliestireno-tumor-poliestireno na janela da amostra.
- Vire a janela de amostra como mostrado na Figura 4C, e tire fotos do tumor para manter um registro de sua orientação. Devolva a janela da amostra com o tumor para o estágio de varredura.
- Clique no botão Diálogo parâmetro de imagem para abrir a janela Parâmetros de Aquisição de Imagens. Defina os valores de Axis1min, Axis1max, Axis2mine Axis2max para fechar totalmente a posição do tumor na janela de imagem
NOTA: Por padrão, axis1 é o eixo A e Axis2 é o eixo B. - Coloque Axis1step e Axis2step para 0,2 mm para a varredura de imagens.
NOTA: A configuração da etapa Axis1step e Axis2step definirá o tamanho da etapa dos motores do passo para incrementos de 200 μm durante o processo de digitalização. O tempo total de varredura pode ser estimado na janela Parâmetros de Aquisição de Imagens. - Clique na guia Medida na janela principal e selecione a opção 'Varredura 2D' do Flyback. Na janela que aparece, indique o diretório e o nome do arquivo sob o qual salvar os dados de varredura.
5. Pós-processamento do tecido fresco em preparação para o procedimento histopatológico
- Após a conclusão do processo de digitalização, remova a janela de amostra, as placas de poliestireno e a amostra do sistema de THz do núcleo e mova-as para a área designada para resíduos perigosos. Remova o tumor da placa de poliestireno e coloque-o em um pedaço plano de papelão de tamanho comparável ao do tumor. Certifique-se de que a orientação do tumor seja a mesma que foi no poliestireno, com o rosto de imagem tocando o papelão.
- Mergulhe um cotonete em tinta de tecido vermelho e manche o lado esquerdo do tumor até onde a borda do tumor entra em contato com o papelão. Da mesma forma, manche o lado direito do tumor com tintura de tecido azul. Manche a superfície exposta do tumor com uma linha de corante de tecido amarelo ligando a mancha vermelha à mancha azul para denotar a parte de trás da amostra, conforme mostrado na Figura 7A.
NOTA: Para evitar que a tinta manche a solução de formalina, aplique apenas uma camada fina no tecido. Isso pode ser feito esfregando o cotonete em uma superfície diferente antes de manchar o tecido ou usando um cotonete limpo para limpar qualquer corante em excesso. Evite deixar o corantes entrar em contato com a pele ou a roupa. Esse processo de coloração do tumor é realizado como referência para fornecer informações sobre o lado de imagem do tumor e sua orientação ao patologista.

Figura 7: Pós-processamento do tumor após a imagem de THz. (A)Tumor colocado de frente para baixo no suporte de papelão e teucom corantes de marcação tecidual. (B) Papel filtrante colocado sobre o tumor e colado para manter contato. (C) Tumor manchado fixado no papelão imerso em solução de formalina tamponada 10% neutra e selado com parafilme. Clique aqui para ver uma versão maior desta figura.
- Deixe a tinta secar por cerca de 3-4 min. Corte um pedaço de papel filtro com as mesmas dimensões aproximadas do papelão. Coloque-o sobre o tumor e enrole um pedaço de fita completamente ao redor do papel filtro e papelão, conforme mostrado na Figura 7B. A fita e o papel do filtro devem fixar o tumor contra o papelão sem aplicar qualquer pressão significativa.
- Mergulhe o tecido manchado afixado ao papelão em uma solução de formalina tamponada 10% neutra e sele o tubo de centrífuga usando uma película de parafina, como mostrado na Figura 7C. Designe o número da amostra, data, tipo de tecido e número do tumor para a amostra na etiqueta do tubo. Envie o tumor ao patologista para mais processamento histopatológico.
6. Descarte de resíduos perigosos
- Recolher todos os resíduos da bandeja de manuseio de tecidos juntamente com o saco de risco biológico usado para cobrir a bandeja e colocá-lo em um novo saco de risco biológico, como mostrado na Figura 8. Leve a sacola para a área designada de resíduos bioperigosos no prédio e estabeleça uma consulta com o departamento de Saúde e Segurança Ambiental (EH&S) para a coleta de resíduos. Limpe a bandeja de manuseio de tecidos e a área circundante sobre a mesa com 10% de solução alvejante e etanol.

Figura 8: Fotografia do saco de resíduos bioperigosos. Clique aqui para ver uma versão maior desta figura.
- Leve o suporte da amostra líquida com os espaçadores e janelas de quartzo, janela de amostragem em que o tumor foi montado, placas de poliestireno e pinças de laboratório para a área de lavagem. Enxágüe todos os materiais com água e, em seguida, 10% solução de alvejante, limpando com toalhas de papel conforme necessário para remover detritos de tecido. Enxágüe novamente com água, esfregue com solução alconox e enxágue bem. Para vidro e plástico, enxágue em 70% de álcool isopropílico e reserve para secar.
NOTA: Uma vez que o tumor está em formalina e o espaço amostral é limpo, o processamento de dados pode ser tratado ao mesmo tempo que a imagem ou um tempo posterior.
7. Processamento de dados para construir imagens THz
- Exportar os arquivos de dados .tvl salvos do sistema THz. Os arquivos de dados brutos obtidos do sistema são gravados em Python e são melhor lidos em Python antes de salvar como arquivos de dados MATLAB.
- Para construir a imagem THz do tecido fresco digitalizado, converta os dados de imagem de reflexão de domínio de tempo bruto no domínio de freqüência usando a transformada de Fourier na terceira dimensão da matriz de dados brutos (ou seja, a dimensão do tempo). Também pegue a transformada fourier dos dados de referência.
NOTA: Um espectro típico de domínio de freqüência deve fornecer dados que variam de 0,1 THz a 4 THz. - Normalizar os dados da amostra com os dados de referência e realizar os espectros de potência com base na integração dos dados normalizados sobre a faixa de frequência de f1 = 0,5 THz a f2 = 1,0 THz utilizando a seguinte equação19:

NOTA: Aqui e amostra é o domínio de freqüência de dados de imagem de imagem da amostra de tecido e referência E é o domínio de freqüência de um único ponto de reflexão dados do sinal de referência. - Construa a imagem bidimensional plotando os dados do espectro de energia calculado em cada ponto da matriz definida pelo eixo A e eixo B. Isso é conhecido como a imagem do espectro de energia THz.
NOTA: O método para obter uma imagem tomográfica de THz é detalhado nas etapas 7.5-7.7. - Para caracterização, calcule a reflexão teórica dependente da freqüência para uma gama de propriedades potenciais do tecido utilizando a seguinte equação18:
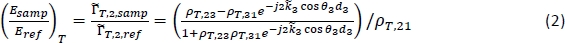
NOTA: Aqui ρT,ij é o complexo coeficiente de reflexão de Fresnel entre a região i e a região j;dj é a espessura da região j; e φj é o ângulo de propagação na região j relacionada ao ângulo de incidência pela Lei de Snell. é o complexo coeficiente de propagação na região j,onde ω é a frequência angular, c é a velocidade da luz no vácuo, nj é a parte real do índice de refração, e αabs,j é o coeficiente de absorção18. Região 1 é ar, Região 2 é a placa de poliestireno, e Região 3 é o tecido.
é o complexo coeficiente de propagação na região j,onde ω é a frequência angular, c é a velocidade da luz no vácuo, nj é a parte real do índice de refração, e αabs,j é o coeficiente de absorção18. Região 1 é ar, Região 2 é a placa de poliestireno, e Região 3 é o tecido. - Calcule a reflexão na equação (2) para uma gama de índices refrativos definidos pelo usuário e coeficientes de absorção para a Região 3 (n3 e αabs,3) e compare com o sinal medido em cada ponto para calcular o erro médio combinado para a magnitude e fase.
NOTA: A solução para o índice de refração e coeficiente de absorção é o par de valores que dão o menor erro. - Construa a imagem tomográfica tHz a partir do índice de refração extraído e dados de coeficiente de absorção (n3 e αabs,3) em cada pixel. Analisar as regiões tumorais comparando-se com a imagem de deslizamento patológico obtida do patologista. Os resultados representativos são apresentados na Figura 9,com exemplos de adesão insuficiente ao protocolo na Figura 10 e Figura 11.
8. Extração de Propriedades Elétricas do Tecido Utilizando Dados de Espectroscopia de Transmissão
- Na janela principal do software de medição de espectroscopia de transmissão THz, vá para a guia Arquivo e clique na opção Exportar. Uma janela aparecerá para selecionar o Tipo de dados e a amostra para exportar. Escolha os tipos de dados da fase de transmissão e transmissão para as medidas da amostra de quartzo e tecido.
- Calcular a transmissão teórica dependente da freqüência para uma gama de propriedades potenciais de tecido usando a seguinte equação15:
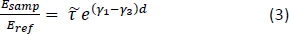
NOTA: Aqui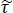 está a razão entre os coeficientes de transmissão de Fresnel para as configurações de amostra e referência; γ1 e γ3 são as complexas constantes de propagação de ar e tecido, respectivamente; e d é a espessura do tecido. A constante de propagação
está a razão entre os coeficientes de transmissão de Fresnel para as configurações de amostra e referência; γ1 e γ3 são as complexas constantes de propagação de ar e tecido, respectivamente; e d é a espessura do tecido. A constante de propagação  em geral é definida como . ñ é o complexo índice
em geral é definida como . ñ é o complexo índice  de refração definido como , onde n é a parte real do índice de refração; c é a velocidade da luz; ω é a frequência angular; e αabs é o coeficiente de absorção15.
de refração definido como , onde n é a parte real do índice de refração; c é a velocidade da luz; ω é a frequência angular; e αabs é o coeficiente de absorção15. - Calcular o erro médio combinado entre a magnitude e a fase da transmissão na equação (3) e os dados de medição do sistema para uma gama de valores n e αabs definidos pelo usuário.
NOTA: A solução para o índice de refração e coeficiente de absorção é o par de valores que dão o menor erro. - Traçar os dados de índice de refração extraído e coeficiente de absorção contra a faixa de frequência de 0,15 a 3,5 THz. Os resultados representativos são mostrados na Figura 12.
Resultados
Os resultados de imagem de THz18 obtidos seguindo o protocolo acima mencionado de amostra de tumor de câncer de mama humano #ND14139 recebidos do biobanco são apresentados na Figura 9. De acordo com o relatório patológico, o tumor #ND14139 foi um carcinoma ductal infiltrado de grau I/II (IDC) obtido de uma mulher de 49 anos através de um procedimento cirúrgico de lumpectomia de mama esquerda. A fotografia do tumor é mostrada na Figura 9A
Discussão
A imagem efetiva de reflexão thz de tecido fresco depende principalmente de dois aspectos críticos: 1) a adequada consideração do manuseio de tecidos (seções 2 e 4.15); e 2) a configuração do palco (principalmente a seção 4.11). A secagem insuficiente do tecido pode resultar em maior reflexão e incapacidade de visualizar regiões devido a altos reflexos de DMEM e outros fluidos. Enquanto isso, o baixo contato do tecido com a janela de imagem cria anéis ou pontos de baixa reflexão na imagem de reflexão thz q...
Divulgações
Os autores declaram que não têm conflito de interesses.
Agradecimentos
Este trabalho foi financiado pelo Prêmio Institutos Nacionais de Saúde (NIH) # R15CA208798 e em parte pelo Prêmio NSF (National Science Foundation) nº 1408007. O financiamento para o sistema de THz pulsado foi obtido através do Prêmio NSF/MRI nº 1228958. Reconhecemos o uso de tecidos adquiridos pelo National Disease Research Interchange (NDRI) com apoio da bolsa NIH U42OD11158. Também reconhecemos a colaboração com o Oklahoma Animal Disease Diagnosticy Laboratory da Oklahoma State University para a realização do procedimento histopatológico em todos os tecidos manuseados neste trabalho.
Materiais
| Name | Company | Catalog Number | Comments |
| 70% isopropyl alcohol | VWR | 89108-162 | Contains 70% USP grade isopropanol and 30% USP grade deionized water |
| Alconox powder detergent | VWR | 21835-032 | Concentrated detergent to remove organic contaminants from glass, metal, stainless steel, porcelain, ceramic, plastic, rubber, and fiberglass |
| Bio Hazard Bags | Fisher Scientific | 19-033-712 | Justrite FM-Approved Biohazard Waste Container Replacement Bags |
| Cardboard holder | N/A | N/A | Scrap cardboard to keep tissue imaging face intact when immersed in formalin |
| Centrifuge Tubes | VWR | 10026-078 | Centrifuge Tubes with Flat Caps, Conical-Bottom, Polypropylene, Sterile, Standard Line |
| Cotton Swabs | Walmart | 551398298 | Q-tips Original Cotton Swabs used to dye the tissue |
| Ethyl Alcohol | VWR | 71002-426 | KOPTECH Pure (undenatured) anhydrous (200 proof/100%) ethyl alcohol |
| Eye protection goggles | VWR | 89130-918 | Kimberly-clark professional safety glasses |
| Face Mask | VWR | 95041-774 | DUKAL Corporation surgical masks |
| Filter paper | Sigma Aldrich | Z240087 | Whatman grade 1 cellulose filters |
| Formalin solution | Sigma Aldrich | HT501128-4L | 10% neutral buffered formalin |
| Human freshly excised tumors (Infilterating Ductal Carcinoma (IDC)) | National Disease Research Interchange (NDRI biobank | N/A | A protocol is signed with the NDRI for the type of tumors required |
| IRADECON Bleach solution | VWR | 89234-816 | Pre-diluted Sodium Hypochlorite Bleach solution |
| KIMTECH SCIENCE wipes | VWR | 21905-026 | Kimberly-clark professional Kim wipes |
| Laboratory Coat | VWR | 10141-342 | This catalog number is for medium size coat |
| Laboratory tweezers/Forceps | VWR | 82027-388 | Any laboratory tweezers can be used as long as it does not damage the tissue |
| Liquid sample holder (two quartz windows with a 0.1 mm teflon spacer) | TeraView, Ltd | N/A | 1" diameter, and 0.1452" thick quartz windows |
| Nitrile hand gloves | VWR | 82026-426 | This catalog number is for medium size gloves |
| Nitrogen cylinder | Airgas | NI UHP300 | NITROGEN UHP GR 5.0 SIZE 300 |
| Paper towel | VWR | 14222-321 | 11" x 8.78" Sheets, 1 Ply |
| Parafilm | VWR | 52858-076 | Flexible thermoplastic. Rolled, waterproof sheet interwound with paper to prevent self-adhesion. |
| Petri Dish | VWR | 470210-568 | VWR Petri Dish, Slippable, Mono Plate (undivided bottom) |
| Polystyrene Plate | Home Depot | 1S11143A | ~ 10 cm x 10 cm square piece cut from a 11" x 14" x 0.05" Non-glare styrene sheet |
| ScanAcquire Software | TeraView, Ltd | N/A | System Software for THz reflection imaging measurements |
| Stainless steel low-profile blade (#4689) | VWR | 25608-964 | Tissue-Tek Accu-Edge Disposable Microtome Blades |
| Stainless steel metal tray | Quick Medical | 10F | Polar Ware Stainless Steel Medical Instrument Trays |
| Tissue Marking Dyes | Ted Pella, Inc | Yellow Dye #27213-1 Red Dye #27213-2 Blue Dye #27213-4 | Used to orient excised tissue samples sent to the histopathology laboratory |
| TPS Spectra 3000 | TeraView, Ltd | N/A | THz imaging and spectroscopy system |
| TPS Spectra Software | TeraView, Ltd | N/A | System Software for THz transmission spectroscopy measurements |
Referências
- Burford, N. M., El-Shenawee, M. O. Review of terahertz photoconductive antenna technology. Optical Engineering. 56 (1), 010901 (2017).
- Sun, Q., et al. Recent advances in terahertz technology for biomedical applications. Quantitative Imaging in Medicine and Surgery. 7 (3), 345-355 (2017).
- Wilmink, G. J., et al. In vitro investigation of the biological effects associated with human dermal fibroblasts exposed to 2.52 THz radiation. Lasers in Surgery and Medicine. 43 (2), 152-163 (2011).
- Arbab, M. H., et al. Terahertz spectroscopy for the assessment of burn injuries in vivo. Journal of Biomedical Optics. 18 (7), 077004 (2013).
- Sy, S., et al. Terahertz spectroscopy of liver cirrhosis: investigating the origin of contrast. Physics in Medicine and Biology. 55 (24), 7587-7596 (2010).
- Yu, C., Fan, S., Sun, Y., Pickwell-Macpherson, E. The potential of terahertz imaging for cancer diagnosis: A review of investigations to date. Quantitative Imaging in Medicine and Surgery. 2 (1), 33-45 (2012).
- El-Shenawee, M., Vohra, N., Bowman, T., Bailey, K. Cancer detection in excised breast tumors using terahertz imaging and spectroscopy. Biomedical Spectroscopy and Imaging. 8 (1-2), 1-9 (2019).
- Yamaguchi, S., et al. Brain tumor imaging of rat fresh tissue using terahertz spectroscopy. Scientific Reports. 6 (30124), 1-6 (2016).
- Rong, L., et al. Terahertz in-line digital holography of human hepatocellular carcinoma tissue. Scientific Reports. 5 (8445), 1-6 (2015).
- Park, J. Y., Choi, H. J., Nam, G., Cho, K., Son, J. In Vivo Dual-Modality Terahertz / Magnetic Resonance Imaging Using Superparamagnetic Iron Oxide Nanoparticles as a Dual Contrast Agent. IEEE Transactions on Terahertz Science and Technology. 2 (1), 93-98 (2012).
- Ji, Y. B., et al. Feasibility of terahertz reflectometry for discrimination of human early gastric cancers. Biomedical Optics Express. 6 (4), 1413-1421 (2015).
- Bowman, T., et al. A Phantom Study of Terahertz Spectroscopy and Imaging of Micro- and Nano-diamonds and Nano-onions as Contrast Agents for Breast Cancer. Biomedical Physics and Engineering Express. 3 (5), 055001 (2017).
- Chavez, T., Bowman, T., Wu, J., Bailey, K., El-Shenawee, M. Assessment of Terahertz Imaging for Excised Breast Cancer Tumors with Image Morphing. Journal of Infrared, Millimeter, and Terahertz Waves. 39 (12), 1283-1302 (2018).
- Bowman, T. C., El-Shenawee, M., Campbell, L. K. Terahertz Imaging of Excised Breast Tumor Tissue on Paraffin Sections. IEEE Transactions on Antennas and Propagation. 63 (5), 2088-2097 (2015).
- Bowman, T., El-Shenawee, M., Campbell, L. K. Terahertz transmission vs reflection imaging and model-based characterization for excised breast carcinomas. Biomedical Optics Express. 7 (9), 3756-3783 (2016).
- Bowman, T., Wu, Y., Gauch, J., Campbell, L. K., El-Shenawee, M. Terahertz Imaging of Three-Dimensional Dehydrated Breast Cancer Tumors. Journal of Infrared, Millimeter, and Terahertz Waves. 38 (6), 766-786 (2017).
- Bowman, T., et al. Pulsed terahertz imaging of breast cancer in freshly excised murine tumors. Journal of Biomedical Optics. 23 (2), 026004 (2018).
- Bowman, T., Vohra, N., Bailey, K., El-Shenawee, M. Terahertz tomographic imaging of freshly excised human breast tissues. Journal of Medical Imaging. 6 (2), 023501 (2019).
- Vohra, N., et al. Pulsed Terahertz Reflection Imaging of Tumors in a Spontaneous Model of Breast Cancer. Biomedical Physics and Engineering Express. 4 (6), 065025 (2018).
- Jacobs, L. Positive margins: the challenge continues for breast surgeons. Annals of Surgical Oncology. 15 (5), 1271-1272 (2008).
- Moran, M. S., et al. Society of Surgical Oncology--American Society for Radiation Oncology Consensus Guideline on Margins for Breast-Conserving Surgery With Whole-Breast Irradiation in Stages I and II Invasive Breast Cancer. International Journal of Radiation Oncology. 88 (3), 553-564 (2014).
- Fitzgerald, A. J., et al. Terahertz Pulsed Imaging of human breast tumors. Radiology. 239 (2), 533-540 (2006).
- Ashworth, P. C., et al. Terahertz pulsed spectroscopy of freshly excised human breast cancer. Optics Express. 17 (15), 12444-12454 (2009).
- Doradla, P., Alavi, K., Joseph, C., Giles, R. Detection of colon cancer by continuous-wave terahertz polarization imaging technique. Journal of Biomedical Optics. 18 (9), 090504 (2013).
- Reid, C. B., et al. Terahertz pulsed imaging of freshly excised human colonic tissues. Physics in Medicine and Biology. 56 (1), 4333-4353 (2011).
- . Teraview.com Available from: https://teraview.com (2019)
- Orosco, R. K., et al. Positive Surgical Margins in the 10 Most Common Solid Cancers. Scientific Reports. 8 (1), 1-9 (2018).
- Bowman, T., et al. Statistical signal processing for quantitative assessment of pulsed terahertz imaging of human breast tumors. 2017 42nd International Conference on Infrared, Millimeter, and Terahertz Waves (IRMMW-THz). , 1-2 (2017).
- Gavdush, A. A., et al. Terahertz spectroscopy of gelatin-embedded human brain gliomas of different grades: a road toward intraoperative THz diagnosis. Journal of Biomedical Optics. 24 (2), 027001 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados