Method Article
Fabricación fantasma de alcohol polivinílico específica del paciente con ultrasonido y contraste de rayos X para la planificación de la cirugía de tumor cerebral
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe la fabricación de un cráneo específico del paciente, cerebro y fantasma tumoral. Utiliza la impresión 3D para crear moldes, y el alcohol polivinílico (PVA-c) se utiliza como material de imitación de tejido.
Resumen
Los fantasmas son herramientas esenciales para la formación clínica, la planificación quirúrgica y el desarrollo de nuevos dispositivos médicos. Sin embargo, es difícil crear fantasmas de cabeza anatómicamente precisos con propiedades de imagen cerebral realistas porque los métodos de fabricación estándar no están optimizados para replicar ningún detalle anatómico específico del paciente y los materiales de impresión 3D no están optimizados para propiedades de imagen. Con el fin de probar y validar un novedoso sistema de navegación para su uso durante la cirugía de tumor cerebral, se requería un fantasma anatómicamente preciso con imágenes realistas y propiedades mecánicas. Por lo tanto, un fantasma fue desarrollado utilizando datos reales del paciente como entrada e impresión 3D de moldes para fabricar un fantasma de cabeza específico del paciente que comprende el cráneo, el cerebro y el tumor con ultrasonido y contraste de rayos X. El fantasma también tenía propiedades mecánicas que permitían manipular el tejido fantasma de manera similar a cómo se maneja el tejido cerebral humano durante la cirugía. El fantasma fue probado con éxito durante una simulación quirúrgica en un quirófano virtual.
El método de fabricación fantasma utiliza materiales disponibles comercialmente y es fácil de reproducir. Los archivos de impresión 3D se pueden compartir fácilmente, y la técnica se puede adaptar para abarcar muchos tipos diferentes de tumor.
Introducción
Los fantasmas que imitan las propiedades específicas de los tejidos biológicos son un recurso útil para diversas aplicaciones experimentales y didácticas. Los fantasmas de imitación de tejidos son esenciales para caracterizar los dispositivos médicos antes de su uso clínico1,2 y los fantasmas anatómicos se utilizan con frecuencia en la formación del personal médico en todas las disciplinas3,4,5,6,7. Los fantasmas anatómicos específicos del paciente fabricados con propiedades apropiadas de imitación de tejidos son a menudo una parte crítica del entorno de pruebas y pueden aumentar la confianza de los médicos que están aprendiendo a usar un nuevo dispositivo8. Sin embargo, los altos costos de fabricación y los complejos procesos de fabricación a menudo impiden el uso rutinario de fantasmas específicos del paciente. Aquí, se describe un método para la fabricación de un modelo de tumor cerebral duradero y específico del paciente utilizando materiales comerciales fácilmente disponibles, que se pueden utilizar para el entrenamiento y validación de ultrasonido intraoperatorio (EE.UU.) mediante imágenes por tomografía computarizada (TC). El fantasma descrito en este estudio fue creado utilizando datos de un paciente con un schwannoma vestibular (un tumor cerebral benigno que surge de uno de los nervios de equilibrio que conectan el cerebro y el oído interno) que posteriormente se sometió a una cirugía y resección tumoral a través de una craneoccipital suboccipital retrosigmoide10. El fantasma fue desarrollado con el fin de probar y validar un sistema de navegación intraoperatorio integrado para su uso durante este tipo de cirugía de tumor cerebral.
Con el fin de ser adecuado para esta aplicación, el fantasma tumor cerebral necesita poseer varias propiedades clave. En primer lugar, debe estar hecho de materiales no tóxicos, por lo que se puede utilizar con seguridad en un entorno de entrenamiento clínico. En segundo lugar, debe tener propiedades de imagen realistas; para la aplicación prevista, estos incluyen específicamente la atenuación por ultrasonido y el contraste de TC. En tercer lugar, debe tener propiedades mecánicas similares al tejido humano para que pueda ser manejado de la misma manera. En cuarto lugar, el fantasma debe basarse en datos reales del paciente, de modo que sea anatómicamente preciso y pueda utilizarse para la planificación quirúrgica y el entrenamiento. Por último, los materiales utilizados deben ser duraderos, de modo que el fantasma se pueda utilizar repetidamente.
En general, el material de imitación de tejido y el método de fabricación elegido para un fantasma dependen de la aplicación prevista. Para estructuras rígidas como el cráneo, la propiedad elegida no debe deformarse o ser soluble en agua y debe ser capaz de mantener un nivel preciso de detalle anatómico con el uso repetido; esto es especialmente importante cuando se utiliza el fantasma para experimentos donde se utiliza el registro de imágenes y para fines de simulación quirúrgica. Los materiales a base de aceite mineral como la cera de gel han sido prometedores para aplicaciones de ultrasonido9,11,12 y fotoacústica13, sin embargo, cuando se someten a deformación mecánica repetida se vuelven friables, por lo que no pueden soportar un uso prolongado, especialmente con instrumentos de neurocirugía microquirúrgica estándar. El agar y la gelatina son materiales acuosos que también se utilizan comúnmente como materiales de imitación de tejidos. Los aditivos necesarios para ajustar las propiedades acústicas de estos materiales son bien conocidos14,pero tienen una resistencia mecánica limitada y no son particularmente duraderos por lo que no son adecuados para esta aplicación, donde el fantasma necesita ser manejado repetidamente.
El criogel de alcohol polivinílico (PVA-c) es una opción popular de material de imitación de tejidos, ya que sus propiedades acústicas y mecánicas se pueden ajustar fácilmente variando sus ciclos de congelación y deshielo. Se ha demostrado que las propiedades de PVA-c son similares a las de los tejidos blandos15,16,17,18. Los fantasmas cerebrales basados en PVA-c se han utilizado con éxito para ultrasonidos e imágenes por TC19. El material es lo suficientemente fuerte como para ser utilizado repetidamente, y tiene un alto grado de elasticidad, por lo que el tejido fantasma hecho de PVA-c puede ser manipulado sin ser deformado permanentemente. El ácido poliláctico (PLA) es un material rígido fácilmente disponible y se utilizó para fabricar el cráneo, sin embargo, se puede utilizar un material de impresión diferente en lugar de PLA, si tiene propiedades mecánicas similares y no es soluble en agua.
Los fantasmas cerebrales en particular han sido fabricados utilizando diferentes métodos, dependiendo del nivel de complejidad requerido y los tejidos que necesitan ser replicados20,21,22,23. Por lo general, se utiliza un molde, y el material de imitación de tejido líquido se vierte en él. Algunos estudios han utilizado moldes comerciales24 mientras que otros utilizan moldes personalizados impresos en 3D de un cerebro sano, y simulan lesiones cerebrales mediante la implantación de esferas de marcadores y catéteres inflables19,25. Hasta el mejor conocimiento del autor, este es el primer informe de un modelo fantasma de tumor cerebral específico del paciente impreso en 3D creado con ultrasonido de imitación de tejidos y propiedades de rayos X. La fabricación total es visualizada por el diagrama de flujo en la Figura 1; todo el proceso tarda alrededor de una semana en completarse.
Protocolo
Este estudio se llevó a cabo de acuerdo con los principios expresados en la Declaración de Helsinki y fue aprobado por la Autoridad de Investigación Sanitaria del NHS y el Comité de ética de la investigación (18/LO/0266). Se obtuvo el consentimiento informado, y todos los datos de imágenes se anonimizaron completamente antes del análisis.
1. Datos
- Obtenga datos de imágenes de resonancia magnética (RM) con peso T1 con contraste preoperatorio y datos de tomografía computarizada volumétrica (TC).
- Si se adquiere en formato Digital Imaging and Communications in Medicine (DICOM), conviértase al formato Neuroimaging Informatics Technology Initiative26 (NiFTI) para su procesamiento y análisis.
- Obtenga datos de ultrasonido intraoperatorios.
2. Segmentación
- Instale software para segmentar los datos del paciente.
- Segmentación del cráneo
NOTA: Los pasos involucrados en la segmentación del cráneo siguen ampliamente los descritos por Cramer y Quigley27 En https://radmodules.com/, pero están adaptados para crear una craneotomía de tamaño adecuado.- Cargue la tomografía computarizada volumétrica del paciente en el software de segmentación, abra el módulo Editor de segmentos y cree una nueva segmentación denominada 'Cráneo'.
- Utilice la función 'Umbral' para resaltar el cráneo.
- Elimine cualquier segmentación no deseada (por ejemplo, calcificaciones de la piel, mandíbula, C1/2, proceso estiloides, el marco del paciente con TC y cualquier anotación incrustada en la imagen). Utilice la función ' Tijeras ' para eliminarpiezasal ver el modelo en 3D y hacer uso de la función 'Islas' después de desconectar manualmente cualquier estructura no deseada utilizando la función 'Borrar'.
- Corrija manualmente los huecos en la segmentación que se omitieron durante el umbral utilizando las funciones 'Pintura' y 'Dibujar' (por ejemplo, lamina papyracea, borde cortical del hueso mastoideo y hueso etmoides).
- Utilice las funciones 'Paint' y 'Draw'para rellenar el foramen magnum y crear un pico sobresaliente de 5 mm sobre el que se puede asegurar la parte inferior del modelo fantasma.
NOTA: La ubicación del pico se determina mejor en los planos de imagen coronal y sagital. - Aplique la función'Suavizado'. Utilice un ajuste de suavizado de mediana de 1,0 mm (3 × 3 × 1 píxeles) para minimizar la cantidad de detalle perdido.
NOTA: Si el modelo fantasma debe incluir un cráneo intacto completo (por ejemplo, para facilitar la simulación quirúrgica de la creación de una craneotomía apropiadamente ubicada), pase al paso 2.2.15; sin embargo, si se requiere una craneotomía en el modelo, complete los pasos 2.2.7 a 2.2.14. - Haga clic en 'Añadir' para agregar una nueva segmentación y asígnele el nombre 'Craniotomía del Cráneo'.
- En el módulo 'Segmentaciones', copie la segmentación 'Cráneo' en 'Craniotomía de cráneo' usando la pestaña 'Copiar/Mover segmentos'.
NOTA: Tanto las segmentaciones 'Skull' como 'Skull Craniotomy' son necesarias para poder realizar las funciones descritas en los pasos 2.2.9 a 2.2.13 - Utilice la función'Tijeras'para eliminar una craneotomía del tamaño adecuado en 'Craniotomía del cráneo'.
NOTA: La creación de la craneotomía de esta manera, también, eliminará una porción adicional del cráneo en el lado opuesto, de ahí la necesidad de los pasos 2.2.11 a 2.2.14. - Haga clic en 'Añadir' y agregue una nueva segmentación; lo que sea 'Solo craneotomía'.
- En 'Solo craneotomía' seleccione la segmentación 'Craniotomía del cráneo' y utilice la función'Operador lógico'para restar 'Craniotomía del cráneo' de 'Cráneo'.
- Utilice la función'Tijeras'para borrar todo excepto la craneotomía deseada en el lado correcto del tumor, salvando 'Solo craneotomía'.
- En 'Skull Craniotomy' utilice la función'Logical Operator'para restar 'Craniotomía solamente' de 'Skull' y guardar.
- Abra el módulo'Segmentaciones' y exporte el archivo 'Skull Craniotomy' como un archivo de estereolitografía (STL).
- Abra el software de modelado 3D e importe el archivo STL 'Skull Craniotomy'.
NOTA: Si el modelo aparece en rosa rayado, complete la función 'Voltear normales' seleccionando el modelo completo (Seleccionar | Haga doble clic )y, a continuación, en 'Editar | Voltear normales'. El modelo ahora se volverá gris y se puede editar. Asegúrese de que'Ver navegador de objetos'está activado. - Reduzca el número de triángulos para mejorar el tiempo de cálculo.
- Seleccione el modelo completo(Seleccione | Haga doble clic en el modelo naranja) y luego en 'Editar | Reducir'. La función predeterminada 'Reducir' se establece en 50% por lo que repetir hasta que se logra la reducción deseada. Apunta a un número total de triángulos < 500.000.
- Aplique la función'Smoothing'asegurando que la casilla 'Shape Conservando'permanezca marcada. Seleccione el modelo completo y, a continuación, 'Deformar | Suave'.
- Haga clic en 'Análisis' y luego en 'Inspector'y utilice esta función para detectar pequeños defectos en el modelo y haga clic en auto-reparación (sugerir 'Relleno plano' selección).
- Corte 'Cráneo' para crear una parte superior e inferior usando la función de corte'Editar/Plano'. Seleccione 'Mantener ambos sectores' y 'Remeshed' tipo de relleno. Cambie el cráneo a transparente con la función 'Shaders' para proporcionar una mejor vista interna del cráneo y ajustar el plano de modo que sea paralelo a la base del cráneo.
- Separe los vaciados seleccionando 'Editar | Separe los shells' y cambie el nombre de 'Skull_Top' y 'Skull_Bottom' en el navegador de objetos.
NOTA: No mueva sus posiciones. Haga clic en el icono del ojo para eliminar uno u otro de la vista. - Haga clic en'Meshmix' y luego seleccione 'Cylinder'para crear una espiga y editar el tamaño a 4 mm × 10 mm × 4 mm ('Editar | Transformar'). Ocultar 'Skull_Bottom' haciendo clic en el icono del ojo para eliminar de la vista.
- Seleccione 'Editar | Alineelos planos. Aparecerá un cilindro transparente adicional. En la ventana'Alinear', elija 'Punto de superficie' (cilindro transparente del extremo izquierdo del clic izquierdo) para el 'Origen' y 'Punto de superficie' (Mayús + clic izquierdo bajo la superficie de 'Skull_Top') para el 'Destino.'
- Usando el'Editar | Transformar' función mover la espiga en el cráneo utilizando la flecha verde y ajustar la posición con flechas azules y rojas. Cambie el nombre de 'Dowel_Anterior'.
- En el navegador de objetos, haga 3 copias y cambie el nombre de 'Dowel_Posterior', 'Dowel_Left' y 'Dowel_Right'.
- Mueva cada espiga a la ubicación deseada utilizando el'Editar | Transformar' función.
NOTA: No mueva ni cambie la posición de la espiga en el plano verde. - Cree copias de cada una, pero guarde todas las copias en la misma ubicación y cree una espiga adicional y cambie el tamaño a 3 mm × 10 mm × 3 mm. Cambiar el nombre de 'Dowel'.
- Cree agujeros para Dowels en el cráneo usando la función 'Diferencia booleana'. Seleccione primero 'Skull_Top' y, a continuación, seleccione una espiga en el explorador de objetos. En la pestaña 'Diferencia booleana' asegúrese de que 'Auto-reducir' está desactivado. Repita el procedimiento para cada espiga a su vez.
- Ocultar 'Skull_Top' y ver 'Skull_Bottom' repitiendo la función anterior 'Diferencia booleana' para cada espiga a su vez.
- Exporte 'Skull_Top', 'Skull_Bottom' y 'Dowel' como archivos binarios STL independientes.
- Segmentación del tejido cerebral
- Sube el contraste mejorado T1 MRI del cerebro para http://niftyweb.cs.ucl.ac.uk/program.php?p=GIF y descargar su salida. Esta es una herramienta de parcellación de código abierto para imágenes ponderadas en T1 que utiliza un algoritmo28 de flujo de información geodésica (GIF) para realizar la extracción cerebral y la segmentación de tejidos.
- Abra el software de segmentación y cargue el archivo de salida de comtería T1 MRI y GIF mejorado en contraste.
- Abra el módulo 'Editor de segmentos'y cree una nueva segmentación.
- Seleccione las etiquetas adecuadas y combínelas para formar una sola segmentación. Por ejemplo, los mapas de etiquetas cerebrales y de diencéfalo se pueden combinar para crear un modelo, denominados estructuras de cerebro, tronco de cerebro, cerebelo y vermón para crear un segundo modelo denominado 'Cerebellum'.
- Utilice la función'Suavizado'(mediana sugerida 2.00 mm, 5 × 5 × 3 píxeles).
- Utilice la función 'Tijeras' para eliminar cualquier segmentación no deseada o errónea.
- Guarde las segmentaciones 'Brain' y 'Cerebellum'.
- Abra el módulo'Segmentaciones'y exporte 'Cerebro' y 'Cerebellum' como archivos STL.
- Segmentación tumoral
- Abra el software de segmentación y cargue la RESONANCIA magnética T1 mejorada por contraste.
- Abra el módulo 'Editor de segmentos'y cree una nueva segmentación denominada 'Tumor'.
- Utilice la función 'Umbral' para resaltar el tumor.
- Corrija la segmentación con las funciones'Pintura','Dibujar'y'Borrar'.
- Aplique la función'Suavizado'(media sugerida 2,00 mm 5 x 5 x 3 píxeles).
- Cree una nueva segmentación denominada 'Cerebellum_Tumor'.
- Combine el modelo 'Cerebellum' y 'Tumor' usando el'Operadores Lógicos | Añadirfunción '.
- Guarde las segmentaciones 'Tumor' y 'Cerebellum_Tumor'.
- Abra el módulo'Segmentaciones'y exporte 'Tumor' y 'Cerebellum_Tumor' como archivos STL.
NOTA: Al final del proceso de segmentación, están disponibles los siguientes archivos: 'Skull_Top', 'Skull_Bottom', 'Dowel', 'Brain', 'Cerebellum', 'Tumor', 'Cerebellum_Tumor'.
3.3D Impresión de moldes cerebrales/tumorales y cráneos
- Crear el cerebro y los moldes tumorales
- Divida la segmentación 'Brain' en dos hemisferios, utilizando la herramienta'Corte plano'en software de modelado 3D.
- Guarde cada hemisferio como un archivo STL separado 'Brain Right' y 'Brain left'.
- Importe el archivo STL 'Tumor' al software de diseño asistido por ordenador (CAD).
- Haga clic en la pestaña 'malla' y luego utilice la función 'Reducir' para reducir el tamaño del modelo para que pueda ser manejado por el programa - el objetivo es reducir el tamaño tanto como sea posible, sin dejar de conservar todos los detalles necesarios.
- Haga clic en la pestaña 'sólido' y utilice la herramienta 'Malla a BRep' para convertir la malla importada en un sólido que se puede manipular. Si esta acción no se puede completar, la malla no se redujo lo suficiente en el paso 3.1.3.
- Haga clic en 'Crear' entonces 'Caja' y dibujar una caja alrededor del tumor. Seleccione para crear esto como un 'Nuevo Cuerpo' y gire la vista para asegurarse de que la caja encierra completamente el tumor en todos los lados.
- En la pestaña Modificar, utilice la herramienta 'Combinar' para cortar el tumor (el 'Cuerpo dela herramienta ') de la caja (el 'Cuerpo objetivo'). Esto dejará una caja con una forma hueca del tumor dentro de ella.
- Compruebe que la caja ahueada esté presente. Corte esta caja en un número adecuado de piezas para que una vez que el molde se llena, se puede valorar sin dañar el fantasma en el interior. Para el tumor aquí, es suficiente dividir la caja en dos, pero para las otras partes del fantasma, se necesitan más piezas.
- Cree planos a través de la caja en los lugares en los que se debe cortar el molde. Haga clic en 'Construir' luego 'Midplane' para crear un plano a través del centro del cuadro. Haga clic con el botón derecho en el plano creado y elija 'Plano de desfase' para colocar el plano con mayor precisión.
- Utilice la función 'Dividir cuerpo' en la pestaña 'Modificar' para dividir el molde a lo largo de los planos creados.
- Mueva las piezas individuales del molde, haciendo clic con el botón derecho y seleccionando'Mover/Copiar',para que todas las piezas estén orientadas hacia afuera.
- Añadir remaches a las caras de cada pieza del molde (para que pueda encajar de forma segura), haciendo clic en 'Crear boceto' a continuación , ' Círculo dediámetro central' y en cada cara, dibujando pequeños círculos. Haga clic con el botón derecho en'Extruir'estos círculos hacia afuera unos pocos milímetros en una cara y extruirlos hacia adentro en la cara correspondiente.
NOTA: Los círculos que se extruyen hacia adentro deben ser ligeramente más grandes - aproximadamente 1,5 mm - que los que se extruyen hacia afuera, de modo que encajen perfectamente. - Guarde cada pieza del molde como un archivo STL independiente.
- Repita los pasos 3.1.4 – 3.1.14 para 'Cerebro a la izquierda', 'Cerebro a la derecha' y 'Tumor de Cerebelo'.
NOTA: El uso del archivo 'tumor de Cerebellum' en lugar de simplemente 'Cerebellum' para crear el molde significa que el molde tendrá un espacio en él para que el tumor se inserte durante la construcción.
- Imprima los moldes 3D
- Instale o abra el software de impresión 3D.
- Abra el archivo STL para cada pieza del molde en el software de impresión y gírelo para que quede plano contra la placa de construcción. Es posible añadir varias piezas de molde a la placa de construcción e imprimirlas simultáneamente.
- Elija una altura de capa grande (alrededor de 0,2 mm) y un valor de relleno bajo (alrededor del 20%) para una impresión más rápida. Imprima los moldes utilizando un material rígido como el ácido poliláctico (PLA). Si los moldes se colocan adecuadamente, el material de soporte no es necesario.
- Imprimir el cráneo
- Abra el archivo 'Skull Top' en el software de impresión y elija una altura de capa grande (alrededor de 0,2 mm) y un valor de relleno bajo (alrededor del 20%).
- Imprima el modelo de cráneo en PLA pero en contraste con el paso 3.2.3, se requerirá material de soporte, así que seleccione'Añadir soporte'en el software. PVA se utiliza como material de soporte, ya que más tarde se puede disolver con agua.
- Repita los pasos 3.3.1 y 3.3.2 para 'SkullBottom'.
- Una vez que la parte superior e inferior del cráneo se han impreso, sumergirlos en agua durante la noche para disolver el material de soporte de PVA.
NOTA: El material de soporte se disolverá mucho más rápido si se utiliza agua tibia, pero si el agua está demasiado caliente, deformará el PLA impreso. Por lo tanto, es preferible utilizar agua fría y dejar la impresión sumergida durante la noche.
4. Preparación de PVA-c
- Mida 200 g de polvo de PVA y ajuste a un lado.
- Calentar 1800 g de agua desionizada a 90oC y añadir a un matraz cónico de 2L.
NOTA: El agua necesita ser casi hirviendo para que el polvo de PVA se disuelva fácilmente, pero si el agua alcanza los 100 oC, algunos se perderán por evaporación, que debe evitarse. - Suspenda el matraz cónico en un baño de agua con temperatura controlada a 90 oC.
- Coloque un agitador electrónico en el matraz, asegurándose de que no toque la parte inferior o los lados, y ajuste la velocidad a 1500 rpm.
NOTA: Compruebe que el agua se agita uniformemente y que no haya puntos estancados en los lados o en la parte inferior. - Añadir gradualmente el polvo de PVA al matraz cónico, alrededor de 30 min, luego dejar que se revuelva durante unos 90 minutos más. El gel resultante es el material de imitación de tejidos PVA-c.
- Retire el matraz cónico del baño de agua y vierta el contenido en un vaso de precipitados. Cubra la parte superior con película de adherencia para evitar la formación de una piel en la parte superior del PVA-c. Deje que el PVA-c se enfríe a temperatura ambiente (alrededor de 20 oC). Una vez enfriado, el PVA-c será transparente. Los cristales blancos diminutos se pueden ver en el PVA-c, pero cualquier burbuja que aparezca en la superficie debe rasparse suavemente.
- Añadir 0,5 w/w% de sorbato de potasio al PVA-c como conservante, y agitar manualmente bien.
- El PVA-c se puede dejar a temperatura ambiente si se cubre con película aferrada durante unos días antes de que se vierta en moldes.
5. Asamblea Fantasma
- Mida lo suficiente PVA-c para llenar el molde tumoral en un vaso de precipitados.
- A la PVA-c para el tumor, agregue microesferas de vidrio de 1 w/w% para el contraste de ultrasonido y 5 w/w% sulfato de bario para contraste de rayos X, y revuelva a mano.
NOTA: Puede ser necesario medir el exceso de PVA-c para el tumor para que estos porcentajes sean una cantidad mensurable. - Sonicar el vaso de precipitados para asegurar una mezcla homogénea de los aditivos.
- Dejar enfriar y permitir que cualquier burbuja formada escape, alrededor de 10 min, luego raspar cualquier burbuja de la superficie.
NOTA: No deje durante un período prolongado una vez que se hayan añadido las esferas de vidrio, no más de 10 minutos, antes de verter el PVA-c en un molde, ya que las esferas de vidrio se asentarán en la parte inferior del vaso de precipitados. Una vez que el fantasma ha sido congelado, esto ya no será una preocupación, y el fantasma final se puede utilizar a temperatura ambiente. - Asegure el molde tumoral (cinta se puede utilizar para cubrir las uniones en el molde) y vierta el PVA-c a través del agujero en la parte superior del molde. Dejar actuar durante unos minutos para permitir que las burbujas formadas en el proceso de vertido escapen a través del agujero y, a continuación, colóquelas directamente en el congelador.
- Realizar dos ciclos de congelación y descongelación en el tumor; cada ciclo aquí consiste en 6 h de congelación a -20 oC y 6 h de descongelación a temperatura ambiente. A continuación, retire cuidadosamente del molde.
- Coloque el tumor en el espacio correspondiente para él en el molde de cerebelo, luego construya el resto del molde del cerebelo y fíjelo.
- A los PVA-c restantes agregue microesferas de vidrio de 0,05 w/w%, luego repita los pasos 5.1.3 y 5.1.4.
- Vierta el PVA-c en el molde del cerebelo, lo que le permite rodear el tumor que se ha colocado en el interior. Además, verter la mezcla en los moldes para cada hemisferio cerebral.
- Realizar dos ciclos de congelación y descongelación en cada hemisferio cerebral y el cerebelo; cada ciclo aquí consiste en 24 h de congelación a -20 oC y 24 h de descongelación a temperatura ambiente.
NOTA: Ciclos con 12 h de congelación seguido de 12 h descongelación también eficaz, para permitir que el fantasma se cree en menos tiempo. 24 h fue elegido para facilitar su aplicación, para evitar volver al laboratorio cada 12 h. - Una vez que los fantasmas se hayan descongelado por segunda vez, retírelos cuidadosamente de los moldes y colóquelos en el cráneo impreso.
NOTA: Cuando no esté en uso, los fantasmas PVA-c completados deben almacenarse en un recipiente hermético en la nevera, y se pueden conservar durante unas semanas de esta manera - Para completarlo, coloque el fantasma 'Tumor de Cerebellum' en el pico en la base del modelo 'Skull Bottom'. Los modelos de dos hemisferios cerebrales ('Cerebro a la izquierda' y 'Cerebro a la derecha') se colocan en la parte superior y ranura en la parte superior del 'tumor de Cerebellum'.
- Coloque los cuatro tacos en cada espacio en el modelo 'Skull Bottom' y coloque el modelo 'Skull Top' en la parte superior. Si es necesario, el modelo puede ser maniobrado en la posición deseada para simular el uso intraoperatorio en la cirugía.
6. Imágenes fantasma
- Imágenes por ultrasonido
- Aplique gel de ultrasonido en la sonda de imágenes.
NOTA: Gel no se utiliza intraoperatoriamente, pero se puede utilizar en la simulación y no cambia significativamente el flujo de trabajo clínico o la calidad de las imágenes adquiridas. - Imagen del cerebro y el tumor a través de la craneotomía, con un escáner clínico y una sonda de agujero de rebaba.
- Aplique gel de ultrasonido en la sonda de imágenes.
- Imágenes por TC
- Imagen de todo el fantasma en un escáner de TC.
Resultados
Siguiendo el protocolo descrito, se fabricó un fantasma anatómicamente realista, que consiste en un cráneo, cerebro y tumor específicos del paciente. Las estructuras anatómicas relevantes para el fantasma (cráneo, cerebro, tumor) se segmentan utilizando datos de RMN y TC del paciente (Figura 2a,b). Los datos de ultrasonido intraoperatorio del paciente(Figura 2c; La Figura 2d muestra la misma imagen que la Figura 2c,pero con el tumor esbozado) se utilizó para comparar las imágenes fantasma con las imágenes reales del paciente.
Se crearon mallas para cada pieza del modelo(Figura 3),y luego se utilizaron para fabricar los moldes 3D. Los moldes se imprimían fácilmente en una impresora comercial y se ensamblaban al juntar las piezas. El molde de cerebelo fue el más complejo de diseñar y ensamblar(Figura 4). El cráneo (Figura 5a) era la parte más difícil de imprimir, ya que requería material de soporte, por lo que era un proceso lento; la impresión completa tardó un total de tres días en completarse, lo que es un factor limitante en el protocolo.
El fantasma completado (Figura 5) era un modelo realista de un cráneo paciente, cerebro y tumor. Los dos hemisferios cerebrales (Figura 5b) se produjeron por separado, y tienen un aspecto realista, con el gyri y sulci del cerebro. Todo el fantasma es de color blanco, ya que este es el color natural de PVA-c; esto se puede cambiar fácilmente añadiendo tinte, pero no era necesario para la aplicación. El cerebelo (Figura 5c) encaja cómodamente en la base del cráneo impreso y los hemisferios cerebrales se sientan encima de esto. El tumor es fácilmente visible en el cerebelo, ya que el contraste adicional añadido al tumor resulta en que sea un color blanquecino que lo separa del material circundante, que está firmemente unido.
El fantasma fue imán con TC y ultrasonido(Figura 6a,b). El sulfato de bario se utilizó para dar al tumor un contraste de TC adecuado, y la imagen fantasma (Figura 6a) muestra que esto se logró, ya que el tumor se visualiza claramente. El cráneo no se imprimió con 100% de relleno, con el fin de reducir el tiempo necesario para la impresión. Por lo tanto, el cráneo no se ve completamente realista en las imágenes de TC, porque se puede ver la estructura de celosía de la impresión. Esto no es un problema para la aplicación, ya que sólo se necesita el contorno del cráneo para el sistema de neuronavigación. El cráneo podría imprimirse con un relleno 100% para evitar esta precisión reducida de la imagen CT, pero añadiría tiempo al proceso de impresión. Se añadieron microesferas de vidrio al cerebelo, hemisferios cerebrales y tumor para el contraste de ultrasonidos. Los resultados muestran que el tumor también es visible con imágenes por ultrasonido (Figura 6b) y se puede distinguir del tejido circundante. En la inspección visual, las imágenes de ultrasonido obtenidas del fantasma(Figura 6b), y las obtenidas del paciente (Figura 2c) muestran que los agentes de contraste utilizados en el fantasma fueron eficaces para crear propiedades de imagen realistas.
El fantasma fue probado durante la simulación quirúrgica en un quirófano virtual (Figura 7). El modelo fantasma se posicionó en la mesa de operaciones quirúrgica utilizando una abrazadera de cráneo estándar y la tomografía computarizada del fantasma se registró utilizando un sistema de neuronavigación clínica. Se simuló un enfoque retrosigmoide del tumor y el tumor se hizo con una imagen utilizando un sistema de ultrasonido clínico con un transductor de ultrasonido de agujero de rebaba. Durante la simulación quirúrgica, el modelo fantasma demostró ser estable y no se observó ningún daño por manipular el fantasma de la misma manera que el cerebro humano sería durante este procedimiento, por lo que podría ser utilizado repetidamente en las mismas condiciones.
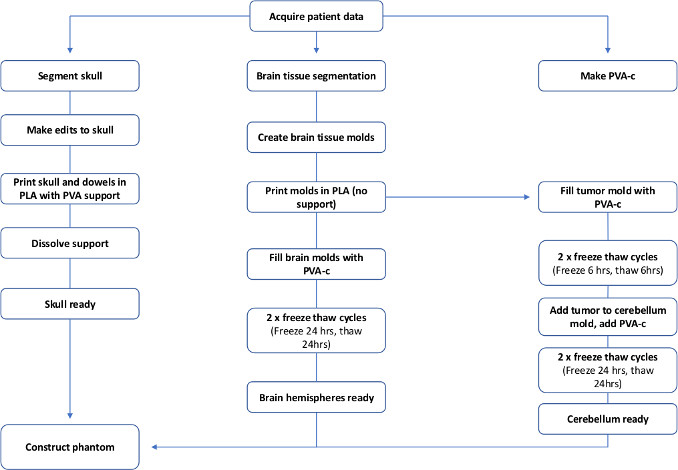
Figura 1: Diagrama de flujo para mostrar los pasos necesarios para hacer que un paciente específico PVA-c cerebro fantasma. Haga clic aquí para ver una versión más grande de esta figura.
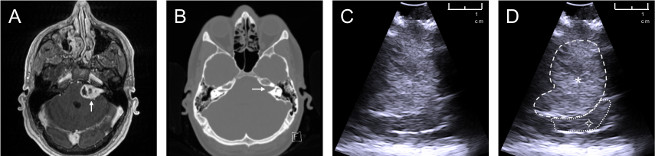
Figura 2: Datos del paciente utilizados para crear un modelo fantasma. Fuentes de datos de un paciente con un schwannoma vestibular del lado izquierdo: (a) RMN ponderada por T1 con contraste axial, flecha blanca que apunta hacia el tumor; (b) tomografía computarizada axial sin contraste con ventanas para resaltar el hueso, flecha blanca que apunta hacia una carnosa auditiva interna expandida causada por el tumor; (c) imagen de ultrasonido intraoperatorio obtenida durante la cirugía de schwannoma vestibular; (d) imagen de ultrasonido intraoperatorio anotado ![]() : tumor (hiperecoico en ultrasonido),
: tumor (hiperecoico en ultrasonido), ![]() : cerebro (cerebelo). Haga clic aquí para ver una versión más grande de esta figura.
: cerebro (cerebelo). Haga clic aquí para ver una versión más grande de esta figura.
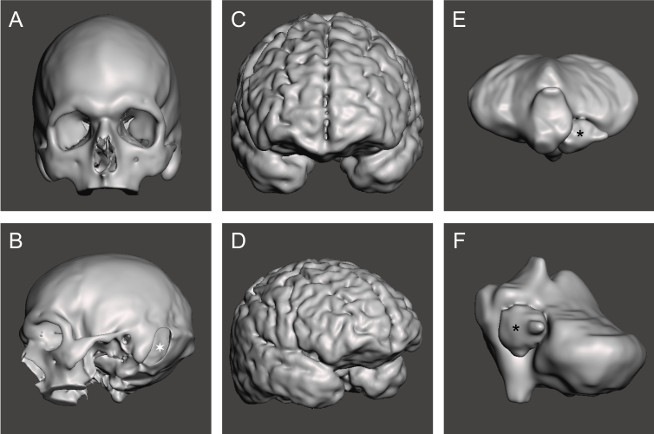
Figura 3: Mallas completadas para cada sección del fantasma. Malla STL para cráneo (a,b), ![]() : craneotomía retrosigmoide del lado izquierdo; (c,d) hemisferios cerebrales; (e,f) tumor y cerebelo,
: craneotomía retrosigmoide del lado izquierdo; (c,d) hemisferios cerebrales; (e,f) tumor y cerebelo, ![]() : tumor. Haga clic aquí para ver una versión más grande de esta figura.
: tumor. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: molde de cerebelo impreso en 3D. Molde de cerebelo impreso en 3D completamente construido (arriba a la izquierda) y las piezas separadas, que están numeradas del 1 al 4. El orificio de la pieza 2 (denotado por 'H') permite que el PVA-c se vierta en el molde. Haga clic aquí para ver una versión más grande de esta figura.
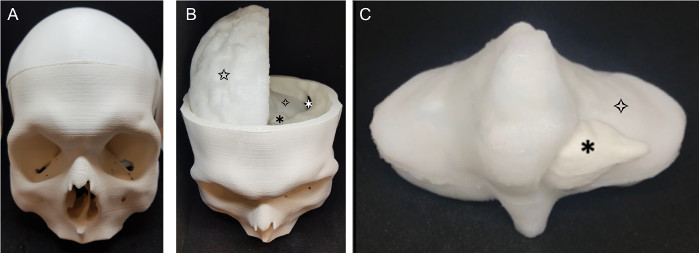
Figura 5: Fantasma completado. El fantasma terminado (a) cráneo (b) fantasma con la parte superior del cráneo eliminado: ![]() : craneotomía retrosigmoide,
: craneotomía retrosigmoide, ![]() : tumor, cerebro
: tumor, cerebro ![]() (cerebelo),
(cerebelo), ![]() cerebro (hemisferio cerebral derecho); (c) cerebelo y tumor:
cerebro (hemisferio cerebral derecho); (c) cerebelo y tumor: ![]() : tumor, cerebro
: tumor, cerebro ![]() (cerebelo). Haga clic aquí para ver una versión más grande de esta figura.
(cerebelo). Haga clic aquí para ver una versión más grande de esta figura.
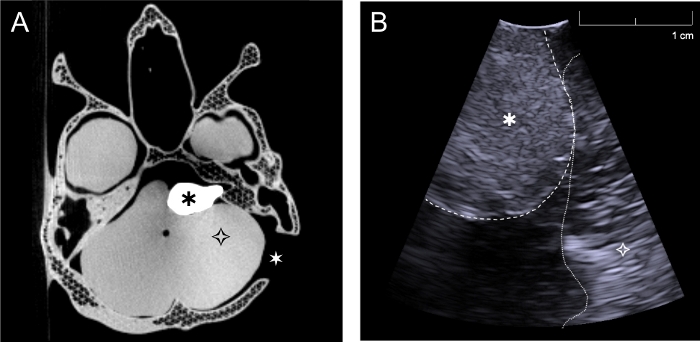
Figura 6: Imágenes de TC y ultrasonido adquiridas con el fantasma. (a) Imagen de TC axial del fantasma completo a través del nivel de la base del cráneo y el tumor, (b) Imagen de ultrasonido intraoperatorio del fantasma adquirida con sonda de ultrasonido de agujero de rebaba a través de la craneotomía retrosigmoide en un plano aproximadamente perpendicular al cráneo (Simulación de cirugía, el cerebelo se retrajo ligeramente con el fin de imagen directamente sobre el tumor). ![]() : tumor,
: tumor, ![]() cerebro (cerebelo),
cerebro (cerebelo), ![]() : craneotomía retrosigmoide del lado izquierdo. Haga clic aquí para ver una versión más grande de esta figura.
: craneotomía retrosigmoide del lado izquierdo. Haga clic aquí para ver una versión más grande de esta figura.
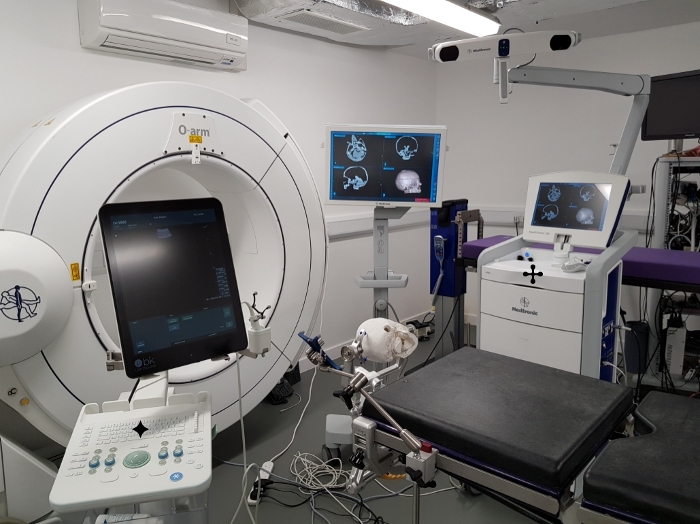
Figura 7: Prueba del fantasma durante la simulación quirúrgica. Prueba del modelo fantasma a través de la simulación quirúrgica en un quirófano virtual. ![]() : sistema de neuronavigación que muestra la exploración registrada del modelo fantasma CT,
: sistema de neuronavigación que muestra la exploración registrada del modelo fantasma CT, ![]() : sistema de ultrasonido utilizado para la imagen del fantasma con un transductor de ultrasonido de agujero de rebaba (visto situado junto al monitor de ultrasonido). Tenga en cuenta que el modelo que se muestra aquí se basa en datos adquiridos de diferentes pacientes con un tumor del lado derecho. Haga clic aquí para ver una versión más grande de esta figura.
: sistema de ultrasonido utilizado para la imagen del fantasma con un transductor de ultrasonido de agujero de rebaba (visto situado junto al monitor de ultrasonido). Tenga en cuenta que el modelo que se muestra aquí se basa en datos adquiridos de diferentes pacientes con un tumor del lado derecho. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo detalla el proceso de fabricación de un fantasma cerebral específico del paciente, que incluye el cráneo, el cerebro y el tumor de schwannoma vestibular. Los métodos de impresión 3D permitieron alcanzar detalles anatómicamente precisos. El fantasma descrito aquí fue fabricado con éxito con el nivel deseado de detalle anatómico; Se utilizaron imágenes por tomografía computarizada y ultrasonido para demostrar que el tumor se visualizaba fácilmente con ambas modalidades. El material de imitación de tejido, PVA-c, está bien establecido como un material de imitación de tejido para fantasmas ultrasónicos; sus propiedades acústicas y mecánicas se pueden ajustar con aditivos y el número de ciclos de congelación y descongelación. El material es fácilmente disponible, fácil de usar y no tóxico. Con el uso repetido, el fantasma tenía suficiente durabilidad para soportar la manipulación y el contacto con una sonda de ultrasonido durante simulaciones físicas de la cirugía de schwannoma vestibular.
Se identificaron varios pasos clave como críticos para el proceso de fabricación. En primer lugar, la segmentación de las estructuras para su inclusión en el fantasma debe incluir el nivel deseado de detalle anatómico. La creación de archivos STL precisos y moldes 3D sigue naturalmente. En segundo lugar, el posicionamiento de los planos dentro del molde del cerebelo en el paso 3.1.9 debe considerarse cuidadosamente, de modo que el fantasma pueda ser fácilmente eliminado, sin daños; debe cortarse en piezas suficientes para permitir que se conserven los detalles anatómicos, al tiempo que se permite que el fantasma se retire sin quedarse atascado en el molde. En este caso, se probaron varias iteraciones y finalmente el molde se cortó en cuatro piezas separadas. La tercera consideración clave es que durante el proceso de fabricación de PVA-c (sección 4), el PVA-c debe dejarse enfriar a temperatura ambiente (paso 4.1.6). Si se pierde este paso y se añade PVA-c caliente a los moldes, puede hacer que los moldes se derritan o distorsionen. También es crucial que una vez que se añaden las esferas de vidrio (pasos 5.1.2 – 5.1.4), el PVA-c no se deja reposar durante más de 10 minutos; si se deja durante un período prolongado de tiempo, las esferas de vidrio se asentarán en el fondo, y el fantasma resultante tendrá un contraste de ultrasonido inhomogéneo29. Una vez que se añaden las esferas de vidrio, el PVA-c debe añadirse directamente a los moldes y colocarse en el congelador. Después del primer ciclo de congelación, las esferas de vidrio se asegurarán en el lugar, y el fantasma se puede utilizar a temperatura ambiente. Por último, es importante que los moldes estén cuidadosamente sellados (por ejemplo, con cinta adhesiva) antes de añadir el PVA-c, para minimizar la fuga de la mezcla a través de huecos donde la pieza separada del molde se une.
El protocolo tiene varias limitaciones. Por ejemplo, se requiere algún equipo especializado, incluyendo un baño de agua y un agitador electrónico. Un sonicador también se utiliza como parte de este protocolo, pero el paso de sonicación (5.1.3) podría ser reemplazado por agitación electrónica adicional; sin embargo, con esta alternativa, tomaría más tiempo lograr una mezcla homogénea de lo que es posible con el uso de sonicación. Una limitación de PVA-c es que se degrada con el tiempo y se vuelve mohoso. La adición de sorbato de potasio, como se describe aquí, aumenta la vida útil del fantasma, aunque todavía debe mantenerse en un recipiente hermético. Una segunda limitación de PVA-c es que se requieren ciclos de congelación-descongelación, lo que aumenta la cantidad de tiempo necesario para hacer un fantasma. Para minimizar el tiempo de fabricación fantasma, una consideración clave es la velocidad de congelación y descongelación; una vez que el fantasma está completamente congelado o totalmente descongelado, el tiempo que permanece en ese estado no afecta significativamente al fantasma final16,30. Por lo tanto, las longitudes de ciclo utilizadas pueden variar, siempre que el fantasma esté completamente congelado y descongelado en cada etapa del ciclo. Por ejemplo, el tumor en el fantasma de este estudio es muy pequeño, por lo que se podrían utilizar ciclos más cortos para el tumor que para el cerebro. Finalmente, la impresión 3D de los moldes y el cráneo es un proceso que consume mucho tiempo y que consume una porción significativa (3 días) del tiempo total (1 semana) necesario para fabricar un fantasma con este protocolo. La impresora utilizada fue un modelo comercial de 2018; el proceso de impresión podría completarse en plazos de tiempo más cortos con el uso de impresoras más nuevas y rápidas.
El fantasma cerebral presentado aquí podría ser utilizado directamente para el entrenamiento clínico y la validación de los sistemas de neuronavigación. Como material de imitación de tejido, PVA-c permite que el fantasma resultante se utilice repetidamente, por ejemplo como una herramienta de entrenamiento o para la validación de ultrasonido intraoperatorio en cirugía de schwannoma vestibular, ya que es un material duradero y no tóxico. Como tal, el método de fabricación es complementario a aquellos descritos anteriormente en los que se utilizó la impresión 3D para crear fantasmas cerebrales específicos del paciente20,21,22,23,24,25. El uso de PVA-c como el TMM hace que el fantasma sea adecuado para su uso en simulación de neurocirugía, ya que el material puede soportar la manipulación manual repetida y el contacto de una sonda de ultrasonido. Este trabajo establece las bases para más estudios cuantitativos de validación. El método fantasma descrito aquí es muy versátil y podría utilizarse para fabricar muchos tipos de fantasmas tumorales específicos del paciente, que se extienden desde el cerebro a otros órganos, con compatibilidad a través de varias modalidades de diagnóstico por imágenes.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Los autores agradecen a Daniil Nikitichev y Steffi Mendes por sus consejos sobre el uso de Meshmixer y Fernando Pérez-García por sus consejos sobre el uso de 3D Slicer y por proporcionarnos código para automatizar algunos de los pasos de procesamiento.
Esta obra fue apoyada por Wellcome Trust [203145Z/16/Z; 203148/Z/16/Z; WT106882], EPSRC [NS/A000050/1; NS/A000049/1], MRC [MC_PC_17180] y National Brain Appeal [NBA/NSG/SBS]. La TV es apoyada por una Cátedra de Investigación de medtronic Inc / Royal Academy of Engineering [RCSRF1819-7-34].
Materiales
| Name | Company | Catalog Number | Comments |
| AutodeskFusion 360 | Autodesk Inc., San Rafael, California, United States | https://www.autodesk.co.uk/products/fusion-360/overview | CAD software |
| Barium sulphate | Source Chemicals | - | |
| CT scanner | Medtronic Inc, Minneapolis, USA | - | O-arm 3D mobile X-ray imaging system |
| Glass microspheres | Boud Minerals | ||
| Mechanical stirrer | IKA | 4442002 | Eurostar Digital 20, IKA |
| Meshmixer | Autodesk Inc., San Rafael, California, United States | http://www.meshmixer.com | 3D modelling software. Version 3.5.484 used |
| Neuronavigation system | Medtronic Inc, Minneapolis, USA | - | S7 Stealth Station |
| PLA | Ultimaker (Ultimaker BV, Utrecht, Netherlands) | UM9016 | |
| Potassium sorbate | Meridianstar | - | |
| PVA | Ultimaker | - | |
| PVA powder | Sigma-Aldrich | 363146 | 99%+ hydrolysed, average molecular weight 85,000-140,000 |
| Sonicator | Fisher Scientific | 12893543 | |
| Ultimaker Cura | Ultimaker BV, Utrecht, Netherlands | https://ultimaker.com/software/ultimaker-cura | 3D printing software. Version 4.0.0 used |
| Ultimaker S5 Printer | Ultimaker BV, Utrecht, Netherlands | - | |
| Ultrasound scanner | BK Medical, Luton, UK | - | BK 5000 scanner |
| Water bath | IKA | 20009381 | HBR4 control, IKA |
| 3D Slicer | http://slicer.org | - | Software used to segment patient data. Version 4.10.2 used |
Referencias
- Culjat, M. O., Goldenberg, D., Tewari, P., Singh, R. S. A review of tissue substitutes for ultrasound imaging. Ultrasound in Medicine and Biology. 36 (6), 861-873 (2010).
- Hwang, J., Ramella-Roman, J. C., Nordstrom, R. Introduction: Feature Issue on Phantoms for the Performance Evaluation and Validation of Optical Medical Imaging Devices. Biomedical Optics Express. 3 (6), 1399 (2012).
- Maul, H., et al. Ultrasound simulators: Experience with the SonoTrainer and comparative review of other training systems. Ultrasound in Obstetrics and Gynecology. 24 (5), 581-585 (2004).
- Craven, C., et al. Development of a modelled anatomical replica for training young neurosurgeons. British Journal of Neurosurgery. 28 (6), 707-712 (2014).
- Zhang, L., Kamaly, I., Luthra, P., Whitfield, P. Simulation in neurosurgical training: a blueprint and national approach to implementation for initial years trainees. British Journal of Neurosurgery. 30 (5), 577-581 (2016).
- Leff, D. R., et al. Validation of an oncoplastic breast simulator for assessment of technical skills in wide local excision. British Journal of Surgery. 103 (3), 207-217 (2016).
- Hunt, A., et al. Low cost anatomically realistic renal biopsy phantoms for interventional radiology trainees. European Journal of Radiology. 82 (4), 594-600 (2013).
- Pacioni, A., et al. Patient-specific ultrasound liver phantom: materials and fabrication method. International Journal of Computer Assisted Radiology and Surgery. 10 (7), 1065-1075 (2015).
- Maneas, E., et al. Anatomically realistic ultrasound phantoms using gel wax with 3D printed moulds. Physics in Medicine and Biology. 63 (1), (2018).
- Samii, M., Matthies, C. Management of 1000 vestibular schwannomas (acoustic neuromas): hearing function in 1000 tumor resections. Neurosurgery. 40 (2), 242-248 (1997).
- Cabrelli, L. C., Pelissari, P. I. B. G. B., Deana, A. M., Carneiro, A. A. O., Pavan, T. Z. Stable phantom materials for ultrasound and optical imaging. Physics in Medicine and Biology. 62 (2), 432-447 (2017).
- Vieira, S. L., Pavan, T. Z., Junior, J. E., Carneiro, A. A. O. Paraffin-Gel Tissue-Mimicking Material for Ultrasound-Guided Needle Biopsy Phantom. Ultrasound in Medicine & Biology. 39 (12), 2477-2484 (2013).
- Maneas, E., et al. Gel wax-based tissue-mimicking phantoms for multispectral photoacoustic imaging. Biomedical Optics Express. 9 (3), 1151 (2018).
- Madsen, E. L., Hobson, M. A., Shi, H., Varghese, T., Frank, G. R. Tissue-mimicking agar/gelatin materials for use in heterogeneous elastography phantoms. Physics in Medicine and Biology. 50 (23), 5597-5618 (2005).
- Duboeuf, F., et al. Investigation of PVA cryogel Young’s modulus stability with time, controlled by a simple reliable technique. Medical Physics. 36 (2), 656-661 (2009).
- Fromageau, J., Brusseau, E., Vray, D., Gimenez, G., Delachartre, P. Characterization of PVA cryogel for intravascular ultrasound elasticity imaging. IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 50 (10), 1318-1324 (2003).
- Fromageau, J., et al. Estimation of polyvinyl alcohol cryogel mechanical properties with four ultrasound elastography methods and comparison with gold standard testings. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 54 (3), 498-508 (2007).
- Khaled, W., et al. Evaluation of Material Parameters of PVA Phantoms for Reconstructive Ultrasound Elastography. 2007 IEEE Ultrasonics Symposium Proceedings. , 1329-1332 (2007).
- Chen, S. J. S., et al. An anthropomorphic polyvinyl alcohol brain phantom based on Colin27 for use in multimodal imaging. Medical Physics. 39 (1), 554-561 (2012).
- Ploch, C. C., Mansi, C. S. S. A., Jayamohan, J., Kuhl, E. Using 3D Printing to Create Personalized Brain Models for Neurosurgical Training and Preoperative Planning. World Neurosurgery. 90, 668-674 (2016).
- Weinstock, P., et al. Creation of a novel simulator for minimally invasive neurosurgery: Fusion of 3D printing and special effects. Journal of Neurosurgery: Pediatrics. 20 (1), 1-9 (2017).
- Grillo, F. W., et al. Patient-specific neurosurgical phantom: assessment of visual quality, accuracy, and scaling effects. 3D Printing in Medicine. 4 (1), (2018).
- Tsai, A., et al. Creation and Validation of a Simulator for Neonatal Brain Ultrasonography: A Pilot Study. Academic Radiology. 24 (1), 76-83 (2017).
- Reinertsen, I., Collins, D. L. A realistic phantom for brain-shift simulations. Medical Physics. 33 (9), 3234-3240 (2006).
- Mobashsher, A. T., Abbosh, A. M., Wang, Y. Microwave system to detect traumatic brain injuries using compact unidirectional antenna and wideband transceiver with verification on realistic head phantom. IEEE Transactions on Microwave Theory and Techniques. 62 (9), 1826-1836 (2014).
- Cox, R. W., et al. A (sort of) new image data format standard: NiFTI-1. 10th Annual Meeting of the Organization for Human Brain Mapping. 22, (2004).
- Cramer, J., Quigley, E. Advanced Visualization and 3D Printing. Learning Lab at the Society for Imaging Informatics in Medicine annual meeting. , (2019).
- Cardoso, M. J., et al. Geodesic Information Flows: Spatially-Variant Graphs and Their Application to Segmentation and Fusion. IEEE Transactions on Medical Imaging. 34 (9), 1976-1988 (2015).
- Dong, J., Zhang, Y., Wei-Ning, L. Walled vessel-mimicking phantom for ultrasound imaging using 3D printing with a water-soluble filament: design principle, fluid-structure interaction (FSI) simulation, and experimental validation. Physics in Medicine & Biology. , 0 (2020).
- Jiang, S., Liu, S., Feng, W. PVA hydrogel properties for biomedical application. Journal of the Mechanical Behavior of Biomedical Materials. 4 (7), 1228-1233 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados