Method Article
Fabrication fantôme d’alcool de polyvinyle patient-spécifique avec l’ultrason et le contraste de rayon X pour la planification de chirurgie de tumeur de cerveau
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit la fabrication d’un crâne spécifique patient, cerveau et fantôme de tumeur. Il utilise l’impression 3D pour créer des moules, et l’alcool polyvinyle (PVA-c) est utilisé comme matériau imitant les tissus.
Résumé
Les fantômes sont des outils essentiels pour la formation clinique, la planification chirurgicale et le développement de nouveaux dispositifs médicaux. Cependant, il est difficile de créer des fantômes de tête anatomiquement précis avec des propriétés réalistes d’imagerie cérébrale parce que les méthodes de fabrication standard ne sont pas optimisées pour reproduire n’importe quel détail anatomique spécifique au patient et les matériaux d’impression 3D ne sont pas optimisés pour les propriétés d’imagerie. Afin de tester et de valider un nouveau système de navigation pour une utilisation pendant la chirurgie de tumeur cérébrale, un fantôme anatomiquement précis avec l’imagerie réaliste et les propriétés mécaniques a été exigé. Par conséquent, un fantôme a été développé en utilisant des données réelles du patient comme entrée et impression 3D des moules pour fabriquer un fantôme de tête spécifique au patient comprenant le crâne, le cerveau et la tumeur avec l’ultrason et le contraste de rayon X. Le fantôme avait également des propriétés mécaniques qui ont permis au tissu fantôme d’être manipulé d’une manière similaire à la façon dont le tissu cérébral humain est manipulé pendant la chirurgie. Le fantôme a été testé avec succès lors d’une simulation chirurgicale dans une salle d’opération virtuelle.
La méthode de fabrication fantôme utilise des matériaux disponibles dans le commerce et est facile à reproduire. Les fichiers d’impression 3D peuvent être facilement partagés, et la technique peut être adaptée pour englober de nombreux types différents de tumeurs.
Introduction
Les fantômes imitant les propriétés spécifiques des tissus biologiques sont une ressource utile pour diverses applications expérimentales et pédagogiques. Les fantômes imitant les tissus sont essentiels pour caractériser les dispositifs médicaux avantleur utilisation clinique 1,2 et les fantômes anatomiques sont fréquemment utilisés dans la formation du personnel médical dans toutes les disciplines3,4,5,6,7. Les fantômes anatomiques spécifiques au patient, qui ont des propriétés imitant les tissus appropriés, sont souvent une partie essentielle de l’environnement d’essai et peuvent accroître la confiance des cliniciens qui apprennent à utiliser un nouvelappareil 8. Cependant, des coûts de fabrication élevés et des processus de fabrication complexes empêchent souvent l’utilisation systématique de fantômes spécifiques aux patients. Ici, une méthode est décrite pour la fabrication d’un modèle durable, spécifique au patient tumeur cérébrale en utilisant facilement disponible, des matériaux commerciaux, qui peuvent être utilisés pour la formation et la validation de l’échographie peropératoire (US) en utilisant la tomographie informatisée (CT) imagerie. Le fantôme décrit dans cette étude a été créé utilisant des données d’un patient présentant un schwannoma vestibulaire (une tumeur bénigne de cerveau résultant d’un des nerfs d’équilibre reliant le cerveau et l’oreille interne) qui plus tard a subi la chirurgie et la résection de tumeur par l’intermédiaire d’une craniotomy suboccipital rétrosigmoid10. Le fantôme a été développé afin de tester et de valider un système intégré de navigation peropératoire pour une utilisation au cours de ce type de chirurgie tumorale du cerveau.
Afin d’être adapté à cette application, le fantôme tumeur au cerveau doit posséder plusieurs propriétés clés. Tout d’abord, il doit être fait de matériaux non toxiques, de sorte qu’il peut être utilisé en toute sécurité dans un environnement de formation clinique. Deuxièmement, il devrait avoir des propriétés d’imagerie réalistes; pour l’application prévue, ceux-ci incluent spécifiquement l’atténuation d’ultrason et le contraste de CT. Troisièmement, il devrait avoir des propriétés mécaniques similaires aux tissus humains afin qu’il puisse être manipulé de la même manière. Quatrièmement, le fantôme doit être basé sur des données réelles sur les patients, de sorte qu’il est anatomiquement précis et peut être utilisé pour la planification chirurgicale et la formation. Enfin, les matériaux utilisés doivent être durables, de sorte que le fantôme peut être utilisé à plusieurs reprises.
En général, le matériau imitant les tissus et la méthode de fabrication choisie pour un fantôme dépend de l’application prévue. Pour les structures rigides comme le crâne, la propriété choisie ne doit pas se déformer ou être soluble dans l’eau et il devrait être en mesure de maintenir un niveau précis de détail anatomique avec une utilisation répétée; ceci est particulièrement important lors de l’utilisation du fantôme pour les expériences où l’enregistrement d’image est utilisé et à des fins de simulation chirurgicale. Les matériaux à base d’huile minérale tels que la cire de gel ont été prometteurspour les ultrasons 9,11,12 et photoacoustiques13 applications d’imagerie, cependant, lorsqu’ils sont soumis à des déformations mécaniques répétées, ils deviennent friables, ne peut donc pas résister à une utilisation prolongée, en particulier avec les instruments de neurochirurgie microchirurgical standard. L’agar et la gélatine sont des matériaux aqueux qui sont également couramment utilisés comme matériaux imitant les tissus. Les additifs nécessaires pour ajuster les propriétés acoustiques de ces matériaux sontbien connus 14, mais ils ont une résistance mécanique limitée et ne sont pas particulièrement durables, donc ne sont pas adaptés à cette application, où le fantôme doit être manipulé à plusieurs reprises.
Le cryogel d’alcool polyvinyle (PVA-c) est un choix populaire de matériau imitant les tissus, parce que ses propriétés acoustiques et mécaniques peuvent facilement être réglées en variant ses cycles gel-dégel. Il a été démontré que les propriétés de PVA-c sont similaires à celles des tissus mous15,16,17,18. Les fantômes cérébraux à base de PVA-c ont été utilisés avec succès pour l’échographie et l’imagerie CT19. Le matériau est assez fort pour être utilisé à plusieurs reprises, et il a un haut degré d’élasticité, de sorte que le tissu fantôme fait de PVA-c peut être manipulé sans être déformé en permanence. L’acide polylactique (PLA) est un matériau rigide facilement disponible et a été utilisé pour fabriquer le crâne, cependant, un matériau d’impression différent peut être utilisé à la place de pla, si elle a des propriétés mécaniques similaires et n’est pas soluble dans l’eau.
Les fantômes cérébraux en particulier ont été fabriqués en utilisant différentes méthodes, selon le niveau de complexité requis et les tissus qui doivent être répliqués20,21,22,23. Habituellement, un moule est employé, et le matériel liquide de tissu-imitant versé dedans. Certaines études ont utilisé des moules commerciaux24 tandis que d’autres utilisent des moules personnalisés imprimés en 3D d’un cerveau sain, et simulent des lésions cérébrales en implantant des sphères marqueurs et des cathétersgonflables 19,25. Au meilleur de la connaissance de l’auteur, c’est le premier rapport d’un modèle fantôme 3D-imprimé patient-spécifique de tumeur de cerveau créé avec l’ultrason de tissu-imitant et les propriétés de rayon X. La fabrication totale est visualisée par le débit de la figure 1; l’ensemble du processus prend environ une semaine.
Protocole
Cette étude a été menée selon les principes exprimés dans la Déclaration d’Helsinki et a été approuvée par l’Autorité de recherche en santé du NHS et le Comité d’éthique de la recherche (18/LO/0266). Le consentement éclairé a été obtenu, et toutes les données d’imagerie ont été complètement anonymisées avant analyse.
1. Données
- Obtenez des données préopératoires d’imagerie par résonance magnétique pondérée par T1 (IRM) et de tomographie calculée volumétrique (Tomodensitométrie).
- S’il est acquis sous forme d’imagerie numérique et de communications en médecine (DICOM), convertissez-vous au format Neuroimaging Informatics Technology Initiative26 (NiFTI) pour le traitement et l’analyse.
- Obtenez des données d’échographie peropératoire.
2. Segmentation
- Installez un logiciel pour segmenter les données des patients avec.
- Segmentation du crâne
NOTE: Les étapes impliquées dans le segmentage du crâne suivent largement celles décrites par Cramer et Quigley27 Sur https://radmodules.com/, mais sont adaptés pour créer une craniotomie de taille appropriée.- Chargez la tomodensitométrie volumétrique du patient dans un logiciel de segmentation, ouvrez le module d’éditeur de segment et créez une nouvelle segmentation nommée « Skull ».
- Utilisez la fonction« Seuil» pour mettre en évidence le crâne.
- Éliminez les segmentations indésirables (p. ex., calcifications cutanées, mandibule, C1/2, processus styloid, cadre patient CT et annotations intégrées à l’image). Utilisez la fonction« Ciseaux» pour supprimer les pièces lors de la visualisation du modèle en 3D et utiliser la fonction «Îles» après avoir débranché manuellement les structures indésirables à l’aide de la fonction« Effacer».
- Corriger manuellement toutes les lacunes dans la segmentation qui ont été manquées pendant le seuil à l’aide des fonctions« Peinture» et« Dessiner» (p. ex., papyracea lamina, bord cortical de l’os mastoïde et de l’os éthhoïde).
- Utilisez les fonctions« Peinture» et« Dessiner» pour remplir le magnum foramen et créer une pointe saillante de 5 mm sur laquelle la partie inférieure du modèle fantôme peut être fixée.
REMARQUE : L’emplacement de la pointe est mieux déterminé sur les plans d’image coronale et sagittal. - Appliquez lafonction « Lissage». Utilisez un réglage de lissage médian de 1,0 mm (3 × 3 × 1 pixels) pour minimiser la quantité de détails perdus.
REMARQUE : Si le modèle fantôme doit inclure un crâne intact complet (p. ex., pour faciliter la simulation chirurgicale de la création d’une craniotomie bien située), passez à l’étape 2.2.15; toutefois, si une craniotomie est nécessaire dans le modèle, remplissez les étapes 2.2.7 à 2.2.14. - Cliquez sur' Ajouter' pour ajouter une nouvelle segmentation et l’nommer 'Skull Craniotomy'.
- Dans le module « Segmentations », copiez la segmentation « Skull » en face de 'Skull Craniotomy' à l’aide de l’onglet 'Copy/Move Segments'.
REMARQUE : Les segmentations « Crâne » et Crâne Craniotomy sont nécessaires pour pouvoir exécuter les fonctions décrites dans les étapes 2.2.9 à 2.2.13 - Utilisez la fonction« Ciseaux» pour supprimer une craniotomie de taille appropriée dans « Skull Craniotomy ».
REMARQUE : La création de la craniotomie de cette façon enlèvera également une partie addition de crâne sur le côté opposé d’où la nécessité des étapes 2.2.11 à 2.2.14. - Cliquez sur « Ajouter » et ajouter une nouvelle segmentation; l’appelle « Craniotomy Only ».
- Dans 'Craniotomy Only' sélectionnez la segmentation 'Skull Craniotomy' et utilisez lafonction 'Logical Operator'pour soustraire 'Skull Craniotomy' de 'Skull'.
- Utilisez la fonction« Ciseaux» pour effacer tout sauf la craniotomie désirée du bon côté de la tumeur, en sauvant la « craniotomie seulement ».
- Dans 'Skull Craniotomy', utilisez la fonction'Logical Operator'pour soustraire 'Craniotomy only' à 'Skull' et enregistrer.
- Ouvrez le module« Segmentations » et exportez le fichier « Skull Craniotomy » sous forme de fichier stéréolithographie (STL).
- Ouvrez le logiciel de modélisation 3D et importez le fichier STL 'Skull Craniotomy'.
REMARQUE : Si le modèle apparaît en rose rayé, remplissez lafonction « Flip Normals» en sélectionnant le modèle complet(Sélectionnez | Double clic) et puis 'Modifier | Flip Normals'. Le modèle va maintenant devenir gris et peut être modifié. Assurez-vousque « View Objects Browser» est activé. - Réduisez le nombre de triangles pour améliorer le temps de calcul.
- Sélectionnez le modèle complet(Sélectionnez | Double clic tourne le modèle orange) puis 'Edit | Réduire'. La fonction «Réduire » pardéfaut est définie à 50 % alors répétez jusqu’à ce que la réduction souhaitée soit atteinte. Visez un nombre total de triangles et 500 000.
- Appliquezla fonction « Lissage» en veillant à ce que la case « Préservationdela forme » reste cochée. Sélectionnez le modèle complet puis 'Deform | Lisse'.
- Cliquez sur« Analyse » puis « Inspecteur» et utilisez cette fonction pour détecter tout petit défaut dans le modèle et cliquez sur la réparation automatique (suggérez la sélection« Remplissageplat »).
- Coupez 'Skull' pour créer un haut et un bas à l’aide de la fonction decoupe 'Edit/Plane'. Sélectionnez« Conserver les deux tranches» et le type de remplissage «Remeshed». Changer le crâne en transparent avec lafonction ' Shaders'pour fournir une meilleure vue interne du crâne et ajuster le plan de sorte qu’il soit parallèle à la base du crâne.
- Séparez les coquilles en sélectionnant' Modifier | Séparez les coquilleset renommez « Skull_Top » et « Skull_Bottom » dans le navigateur d’objets.
REMARQUE : Ne déplacez pas leurs positions. Cliquez sur l’icône de l’œil pour supprimer l’un ou l’autre de la vue. - Cliquez sur' Meshmix' puis sélectionnez 'Cylinder'pour créer une cheville et modifier la taille à 4 mm × 10 mm × 4 mm ('Edit | Transformer'). Cachez 'Skull_Bottom' en cliquant sur l’icône de l’œil pour supprimer de la vue.
- Sélectionnez 'Modifier | Alignezles avions. Un cylindre transparent supplémentaire apparaîtra. Dans la fenêtre« Aligner », choisissez « Point Surface » (cylindre transparent à extrémité gauche) pour le « Source » et le « Point Surface »(Shift + left click undersurface de « Skull_Top ») pour la « Destination ».
- En utilisant le 'Edit | Transformer' fonction déplacer dowel en crâne en utilisant la flèche verte et ajuster la position avec des flèches bleues et rouges. Renommer 'Dowel_Anterior'.
- Dans le navigateur objet faire 3 copies et renommer « Dowel_Posterior », « Dowel_Left » et « Dowel_Right ».
- Déplacez chaque cheville à l’emplacement désiré à l’aide dela « Edit | Transformer' fonction.
REMARQUE : Ne bougez pas ou ne changez pas la position de la cheville dans le plan vert. - Créez des copies de chacune mais conservez toutes les copies au même endroit et créez une cheville supplémentaire et resize à 3 mm × 10 mm × 3 mm. Renommer « Dowel ».
- Créez des trous pour les chevilles dans le crâne à l’aide de la fonction «Boolean Difference». Sélectionnez « Skull_Top » d’abord, puis sélectionnez une cheville dans le navigateur objet. Dans l’onglet« Boolean Difference»,assurez-vous que « Auto-reduce» est éteint. Répétez pour chaque cheville à tour de rôle.
- Cachez 'Skull_Top' et visualisez 'Skull_Bottom' répétant la fonctionci-dessus 'Boolean Difference'pour chaque cheville à son tour.
- Exportez « Skull_Top », « Skull_Bottom » et « Dowel » comme fichiers STL binaires distincts.
- Segmentation des tissus cérébraux
- Téléchargez le contraste amélioré T1 IRM du cerveau pour http://niftyweb.cs.ucl.ac.uk/program.php?p=GIF et télécharger sa sortie. Il s’agit d’un outil de colislation open-source pour les images pondérées en T1 qui utilise un algorithme geodesic information flow (GIF)28 pour effectuer l’extraction du cerveau et la segmentation des tissus.
- Ouvrez le logiciel de segmentation et chargez le fichier de sortie de colis T1 MRI et GIF amélioré.
- Ouvrez le module« Segment Editor» et créez une nouvelle segmentation.
- Sélectionnez les étiquettes appropriées et combinez-les pour former une segmentation unique. Par exemple, les cartes d’étiquettes cérébrales et diencéphales peuvent être combinées pour créer un modèle, appelé « cerveau » et midbrain, tronc cérébral, cervelet et structures vermiennes peuvent être combinés pour créer un deuxième modèle appelé « Cervelet ».
- Utilisez la fonction« Lissage» (médiane suggérée de 2,00 mm, 5 × 5 × 3 pixels).
- Utilisez la fonction« Ciseaux» pour supprimer les segmentations indésirables ou erronées.
- Enregistrez les segmentations « Cerveau » et « Cervelet ».
- Ouvrez le module« Segmentations» et exportez « Brain » et « Cerebellum » sous forme de fichiers STL.
- Segmentation tumorale
- Ouvrez le logiciel de segmentation et chargez l’IRM T1 améliorée par contraste.
- Ouvrez lemodule « Éditeurde segment » et créez une nouvelle segmentation nommée « Tumeur ».
- Utilisez la fonction« Seuil» pour mettre en évidence la tumeur.
- Corrigez la segmentation àl’aide desfonctions «Peinture »,« Dessiner» et« Effacer ».
- Appliquer la fonction« Lissage» (médiane suggérée de 2,00 mm 5 x 5 x 3 pixels).
- Créez une nouvelle segmentation nommée « Cerebellum_Tumor ».
- Combinez le modèle « Cervelet » et « Tumeur » en utilisant le« Opérateurs logiques | Ajouter' fonction.
- Enregistrez les segmentations « Tumeur » et « Cerebellum_Tumor »
- Ouvrez le module« Segmentations» et exportez « Tumor » et « Cerebellum_Tumor » sous forme de fichiers STL.
REMARQUE : À la fin du processus de segmentation, les fichiers suivants sont disponibles : « Skull_Top », « Skull_Bottom », « Dowel », « Brain », « Cerebellum », « Tumor », « Cerebellum_Tumor ».
Impression 3.3D de moules et de crâne de cerveau/tumeur
- Créer le cerveau et les moules tumoraux
- Divisez la segmentation « Cerveau » en deux hémisphères, en utilisantl’outil « Plane cut» dans un logiciel de modélisation 3D.
- Enregistrez chaque hémisphère sous la forme d’un fichier STL distinct « Cerveau droit » et « Cerveau gauche ».
- Importer le fichier STL 'Tumor' dans un logiciel de conception assistée par ordinateur (CAO).
- Cliquez surl’onglet« maille » puis utilisez la fonction «Réduire» pour réduire la taille du modèle afin qu’il puisse être manipulé par le programme – l’objectif est de réduire la taille autant que possible, tout en conservant tous les détails nécessaires.
- Cliquez surl’onglet « solide » et utilisezl’outil « Mesh to BRep» pour convertir le maillage importé en un corps qui peut être manipulé. Si cette action ne peut pas être terminée, le maillage n’a pas été suffisamment réduit à l’étape 3.1.3.
- Cliquez sur« Créer» puis «Boîte» et dessiner une boîte autour de la tumeur. Sélectionnez pour créer ceci comme un «nouveau corps »et faites pivoter la vue pour s’assurer que la boîte enferme complètement la tumeur de tous les côtés.
- Dans l’onglet modifier, utilisezl’outil « Combiner» pour couper la tumeur (le « corpsoutil») de la boîte (le «corps cible»). Cela laissera alors une boîte avec une forme creuse de la tumeur à l’intérieur.
- Vérifiez que la boîte creusée est présente. Coupez cette boîte en un nombre approprié de pièces de sorte qu’une fois que le moule est rempli, il peut être prisé à part sans endommager le fantôme à l’intérieur. Pour la tumeur ici, il suffit de diviser la boîte en deux, mais pour les autres parties du fantôme, plus de pièces sont nécessaires.
- Créer des plans à travers la boîte dans les endroits où le moule doit être coupé. Cliquez sur« Construire» puis« Midplane» pour créer un plan à travers le centre de la boîte. Cliquez à droite sur le plan créé et choisissez «Offset Plane» pour positionner l’avion plus précisément.
- Utilisez la fonction« Split Body» dans l’onglet «Modifier» pour diviser le moule le long des plans créés.
- Déplacez les morceaux individuels du moule, en cliquant à droite et en sélectionnant 'Move/Copy',de sorte que toutes les pièces sont orientées vers l’extérieur.
- Ajouter des rivets sur les faces de chaque morceau du moule (afin qu’il puisse s’adapter solidement), en cliquant sur «Créer croquis» puis « Cercle dediamètre central» et sur chaque visage, en dessinant de petits cercles. Cliquez à droite puis« Extrudez» ces cercles vers l’extérieur quelques millimètres sur un visage etextrudez-les vers l’intérieur sur le visage correspondant.
REMARQUE : Les cercles qui sont extrudés vers l’intérieur doivent être légèrement plus grands - environ 1,5 mm - que ceux qui sont extrudés vers l’extérieur, de sorte qu’ils s’adaptent parfaitement. - Enregistrer chaque morceau du moule comme un fichier STL séparé.
- Répétez les étapes 3.1.4 – 3.1.14 pour 'Brain left', 'Brain right' et 'Cerebellum tumor'.
NOTE: En utilisant le fichier 'Tumeur de Cervelet' plutôt que juste 'Cervelet' pour créer le moule signifie que le moule aura un espace dedans pour que la tumeur soit insérée pendant la construction.
- Imprimer les moules 3D
- Installez ou ouvrez un logiciel d’impression 3D.
- Ouvrez le fichier STL pour chaque morceau du moule dans le logiciel d’impression et tournez-le de sorte qu’il se trouve à plat contre la plaque de construction. Il est possible d’ajouter plusieurs pièces de moule à la plaque de construction et de les imprimer simultanément.
- Choisissez une grande hauteur de couche (environ 0,2 mm) et une faible valeur de remplissage (environ 20 %) pour une impression plus rapide. Imprimez les moules à l’aide d’un matériau rigide tel que l’acide polylactique (PLA). Si les moules sont positionnés de manière appropriée, le matériau de soutien n’est pas nécessaire.
- Imprimer le crâne
- Ouvrez le fichier « Skull Top » dans le logiciel d’impression et choisissez une grande hauteur de couche (environ 0,2 mm) et une faible valeur de remplissage (environ 20%).
- Imprimez le modèle de crâne dans PLA mais contrairement à l’étape 3.2.3, le matériel de support sera nécessaire, alors sélectionnez pour 'Ajouter le support' dans le logiciel. PVA est utilisé comme matériau de soutien car il peut plus tard être dissous avec de l’eau.
- Répétez les étapes 3.3.1 et 3.3.2 pour 'SkullBottom'.
- Une fois que le haut et le bas du crâne ont été imprimés, submergez-les dans l’eau pendant la nuit pour dissoudre le matériau de soutien PVA.
REMARQUE : Le matériau de soutien se dissoudra beaucoup plus rapidement si de l’eau chaude est utilisée, mais si l’eau est trop chaude, elle déformera l’APL imprimé. Par conséquent, il est préférable d’utiliser de l’eau fraîche et de laisser l’impression immergée pendant la nuit.
4. Préparation de PVA-c
- Mesurer 200 g de poudre de PVA et mettre sur le côté.
- Chauffer 1800 g d’eau déionisée à 90 °C et ajouter à un flacon conique de 2 L.
REMARQUE : L’eau doit être presque bouillante de sorte que la poudre de PVA se dissolve facilement, mais si l’eau atteint 100 °C, certaines seront perdues à cause de l’évaporation, ce qui doit être évité. - Suspendre le flacon conique dans un bain d’eau à température contrôlée fixé à 90 °C.
- Placez un agitateur électronique dans le flacon, en vous assurant qu’il ne touche pas le fond ou les côtés, et réglez la vitesse à 1500 rpm.
REMARQUE : Vérifiez que l’eau agite uniformément et qu’il n’y a pas de points stagnants sur les côtés ou au fond. - Ajouter graduellement la poudre de PVA à la fiole conique, sur environ 30 min, puis laisser remuer pendant environ 90 min. Le gel qui en résulte est le matériau imitant les tissus PVA-c.
- Retirer le flacon conique du bain d’eau et verser le contenu dans un bécher. Couvrir le dessus d’un film accrocheur pour empêcher la formation d’une peau au-dessus de la PVA-c. Laisser refroidir le PVA-c à température ambiante (autour de 20 °C). Une fois refroidi, le PVA-c sera transparent. De minuscules cristaux blancs peuvent être vus dans le PVA-c, mais toutes les bulles apparaissant à la surface doivent être doucement grattées.
- Ajouter 0,5 w/w% de sorbate de potassium au PVA-c comme agent de conservation, et bien mélanger manuellement.
- Le PVA-c peut être laissé à température ambiante s’il est recouvert d’un film d’accroissement pendant quelques jours avant d’être versé dans des moules.
5. Assemblée fantôme
- Mesurez suffisamment de PVA-c pour remplir le moule tumoral dans un bécher.
- Au PVA-c pour la tumeur, ajouter 1 w/w% de microsphères en verre pour le contraste ultrasonique et 5 w/w% de sulfate de baryum pour le contraste des rayons X, et remuer à la main.
NOTE : Il peut être nécessaire de mesurer l’excès de PVA-c pour la tumeur de sorte que ces pourcentages soient une quantité mesurable. - Sonifier le bécher pour assurer un mélange homogène des additifs.
- Laisser refroidir et laisser s’échapper les bulles formées, environ 10 min, puis gratter les bulles de la surface.
REMARQUE : Ne partez pas pendant une période prolongée une fois que les sphères de verre ont été ajoutées, pas plus de 10 minutes environ, avant de verser le PVA-c dans un moule, car les sphères de verre s’installeront au fond du bécher. Une fois que le fantôme a été gelé, ce ne sera plus un problème, et le fantôme final peut être utilisé à température ambiante. - Fixer le moule tumoral ensemble (ruban adhésif peut être utilisé pour couvrir les jointures dans le moule) et verser dans le PVA-c à travers le trou dans le haut du moule. Laisser quelques minutes pour permettre aux bulles formées dans le processus de coulée de s’échapper par le trou, puis placer directement dans le congélateur.
- Effectuer deux cycles gel-dégel sur la tumeur; chaque cycle se compose ici de 6 h de congélation à -20 °C et de 6 h de décongélation à température ambiante. Ensuite, retirez soigneusement de la moisissure.
- Placez la tumeur dans l’espace correspondant pour elle dans le moule de cervelet, puis construisez le reste du moule de cervelet et fixez-la ensemble.
- Pour les autres PVA-c ajouter 0,05 w / w% microsphères en verre, puis répéter les étapes 5.1.3 et 5.1.4.
- Versez le PVA-c dans le moule de cervelet, lui permettant d’entourer la tumeur qui a été placée à l’intérieur. En outre, versez le mélange dans les moules pour chaque hémisphère cérébral.
- Effectuer deux cycles gel-dégel sur chaque hémisphère cérébral et le cervelet; chaque cycle se compose ici de 24 h de congélation à -20 °C et de 24 h de dégel à température ambiante.
REMARQUE : Cycles avec congélation de 12 h suivis d’un dégel de 12 h également efficaces, pour permettre au fantôme d’être créé en moins de temps. 24 h a été choisi pour faciliter l’application, pour éviter de retourner au laboratoire toutes les 12 h. - Une fois que les fantômes ont décongelé pour la deuxième fois, retirez-les soigneusement des moules et placez-les dans le crâne imprimé.
REMARQUE : Lorsqu’ils ne sont pas utilisés, les fantômes PVA-c complétés doivent être conservés dans un contenant hermétique au réfrigérateur et peuvent être conservés pendant quelques semaines de cette façon. - Pour l’achèvement, placez le fantôme de la tumeur du Cervelet sur la pointe à la base du modèle « Skull Bottom ». Les modèles de deux hémisphères cérébraux (« Cerveau gauche » et « Cerveau droit ») sont placés sur le dessus et la fente dans la partie supérieure de la « tumeur au cervelet ».
- Placez les quatre chevilles dans chaque espace sur le modèle « Skull Bottom » et placez le modèle « Skull Top » sur le dessus. Si nécessaire, le modèle peut alors être manœuvré dans la position désirée pour simuler l’utilisation peropératoire en chirurgie.
6. Imagerie fantôme
- Imagerie par ultrasons
- Appliquer le gel à ultrasons sur la sonde d’imagerie.
REMARQUE : Le gel n’est pas utilisé peropératoirement, mais peut être utilisé dans la simulation et ne modifie pas de façon significative le flux de travail clinique ou la qualité des images acquises. - Image du cerveau et de la tumeur par la craniotomie, avec un scanner clinique et une sonde de trou de bavure.
- Appliquer le gel à ultrasons sur la sonde d’imagerie.
- Imagerie CT
- Image de tout le fantôme dans un scanner.
Résultats
Suivant le protocole décrit, un fantôme anatomiquement réaliste a été fabriqué, qui se compose d’un crâne, d’un cerveau et d’une tumeur patients-spécifiques. Les structures anatomiques pertinentes pour le fantôme (crâne, cerveau, tumeur) sont segmentées à l’aide de données d’IRM et de Tomodens humains(figure 2a,b). Les données d’échographie intraopératoire du patient( figure 2c; La figure 2d montre la même image que la figure 2c,mais avec la tumeur décrite) a été utilisée pour comparer les images fantômes aux images réelles des patients.
Des mailles ont été créées pour chaque pièce du modèle (figure 3), et celles-ci ont ensuite été utilisées pour fabriquer les moules 3D. Les moules ont été facilement imprimés sur une imprimante commerciale et assemblés en fendant les pièces ensemble. Le moule cervelet était le plus complexe à concevoir et à assembler (Figure 4). Le crâne (Figure 5a) était la partie la plus difficile à imprimer car il avait besoin de matériel de soutien, il en était de même d’un processus lent; l’impression entière a pris un total de trois jours pour terminer, qui est un facteur limitant dans le protocole.
Le fantôme achevé (Figure 5) était un modèle réaliste d’un crâne patient, le cerveau et la tumeur. Les deux hémisphères cérébraux (figure 5b) ont été produits séparément, et ont une apparence réaliste, mettant en vedette le gyri et les sulci du cerveau. Tout le fantôme est de couleur blanche, car c’est la couleur naturelle de PVA-c; cela peut facilement être changé en ajoutant du colorant, mais n’était pas nécessaire pour l’application. Le cervelet (Figure 5c) s’intègre confortablement dans la base du crâne imprimé et les hémisphères cérébraux sont assis sur le dessus de cela. La tumeur est facilement visible dans le cervelet, car le contraste supplémentaire ajouté à la tumeur en résulte qu’il s’agit d’une couleur blanc éteint qui la sépare du matériau environnant, auquel elle est solidement attachée.
Le fantôme a été photographié à la fois avec ct et ultrasons( Figure 6a,b). Le sulfate de baryum a été employé pour donner à la tumeur le contraste approprié de CT, et l’image fantôme (figure 6a) montre que ceci a été réalisé, car la tumeur est clairement visualisée. Le crâne n’a pas été imprimé avec 100% de remplissage, afin de réduire le temps pris pour l’impression. Par conséquent, le crâne ne semble pas tout à fait réaliste dans les images CT, parce que la structure en treillis de l’impression peut être vu. Ce n’est pas un problème pour l’application, comme seul le contour du crâne est nécessaire pour le système de neuronavigation. Le crâne pourrait être imprimé avec 100% de remplissage pour éviter cette précision réduite de l’image CT, mais ajouterait du temps sur le processus d’impression. Des microsphères en verre ont été ajoutés au cervelet, aux hémisphères cérébraux et à la tumeur pour le contraste d’ultrason. Les résultats montrent que la tumeur est également visible avec l’imagerie par ultrasons (Figure 6b) et peut être distinguée du tissu environnant. Lors de l’inspection visuelle, les images échographiques obtenues à partir du fantôme (figure 6b) et celles obtenues auprès du patient (figure 2c) montrent que les agents de contraste utilisés dans le fantôme étaient efficaces pour créer des propriétés d’imagerie réalistes.
Le fantôme a été testé lors d’une simulation chirurgicale dans une salle d’opération virtuelle( Figure 7). Le modèle fantôme a été placé sur la table chirurgicale d’opération utilisant une pince standard de crâne et le balayage de CT du fantôme a été enregistré utilisant un système clinique de neuronavigation. Une approche rétrosigmoid à la tumeur a été simulée et la tumeur a été imaged utilisant un système clinique d’ultrason avec un transducteur d’ultrason de trou de bavure. Au cours de la simulation chirurgicale, le modèle fantôme s’est avéré stable et aucun dommage n’a été observé de manipuler le fantôme de la même manière que le cerveau humain serait au cours de cette procédure, de sorte qu’il pourrait être utilisé à plusieurs reprises dans les mêmes conditions.
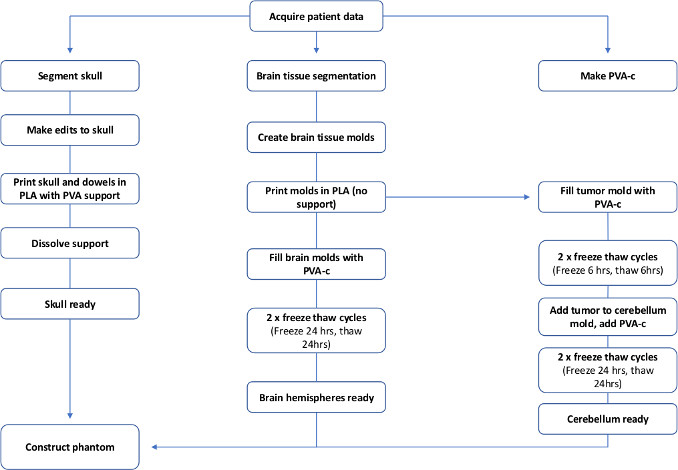
Figure 1 : Flowchart pour montrer les étapes requises pour rendre fantôme un cerveau PVA-c spécifique au patient. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
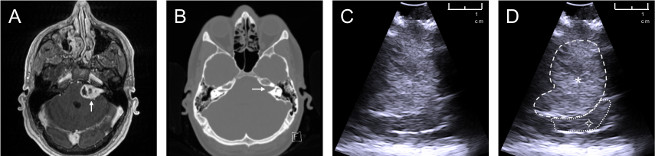
Figure 2 : Données des patients utilisées pour créer un modèle fantôme. Sources de données d’un patient présentant un schwannoma vestibulaire gauche: (a) axial contrast-enhanced T1-weighted MRI, flèche blanche pointant vers la tumeur ; b) balayage axial de CT non-contraste windowed pour mettre en évidence l’os, flèche blanche pointant vers un meatus auditif interne étendu provoqué par la tumeur ; c)image intraopératoire d’ultrason obtenue pendant la chirurgie vestibulaire de schwannoma ; d) image annotée par ultrasons peropératoires ![]() : tumeur (hyperéchoïque à l’échographie),
: tumeur (hyperéchoïque à l’échographie), ![]() : cerveau (cervelet). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
: cerveau (cervelet). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
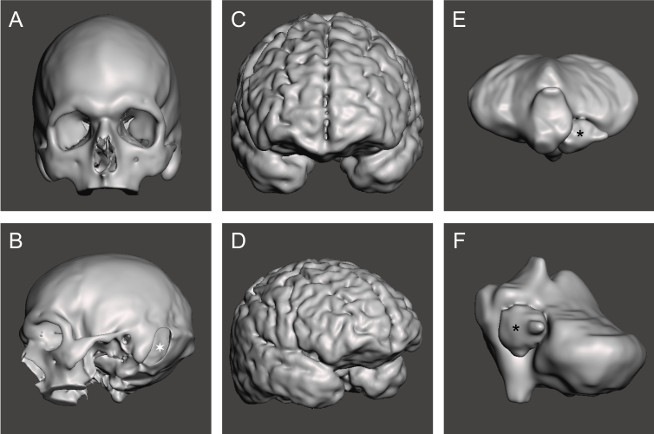
Figure 3 : Mailles complétées pour chaque section du fantôme. Maille STL pour (a,b) crâne, ![]() : craniotomie rétrosigmoïde gauche; (c,d) hémisphères cérébraux; (e,f) tumeur et cervelet,
: craniotomie rétrosigmoïde gauche; (c,d) hémisphères cérébraux; (e,f) tumeur et cervelet, ![]() : tumeur. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
: tumeur. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 4 : Moule imprimé 3D de cervelet. Moule à cervelet imprimé 3D entièrement construit (en haut à gauche) et les pièces séparées, qui sont numérotées de 1 à 4. Le trou dans la pièce 2 (indiqué par « H ») permet à la PVA-c d’être versée dans le moule. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
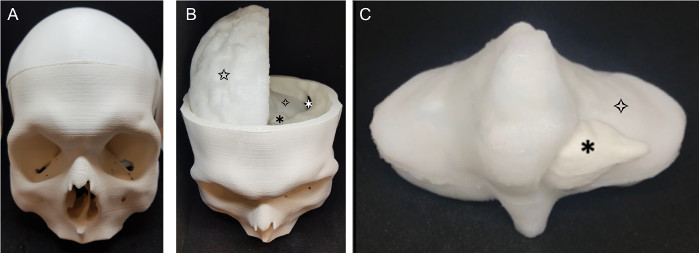
Figure 5 : Fantôme terminé. Le fantôme fini (un) crâne ( b )fantômeavec le sommet du crâne enlevé: ![]() : craniotomie rétrosigmoid,
: craniotomie rétrosigmoid, ![]() : tumeur, cerveau
: tumeur, cerveau ![]() (cervelet),
(cervelet), ![]() cerveau (hémisphère cérébral droit); c) cervelet et tumeur :
cerveau (hémisphère cérébral droit); c) cervelet et tumeur : ![]() tumeur, cerveau
tumeur, cerveau ![]() (cervelet). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
(cervelet). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
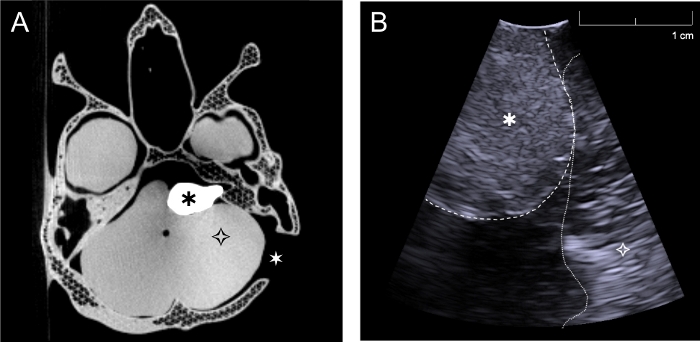
Figure 6 : Images ct et ultrasons acquises avec le fantôme. (a) Image Axiale de CT du fantôme complet par le niveau de la base de crâne et de la tumeur, (b) image intraopératoire d’ultrason du fantôme acquise avec la sonde d’ultrason de trou de bavure par la craniotomie rétrosigmoid dans un plan approximativement perpendiculaire au crâne (Simulant la chirurgie, le cervelet a été rétracté légèrement afin d’image directement sur la tumeur). ![]() : tumeur,
: tumeur, ![]() cerveau (cervelet),
cerveau (cervelet), ![]() : craniotomie rétrosigmoïde gauche. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
: craniotomie rétrosigmoïde gauche. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
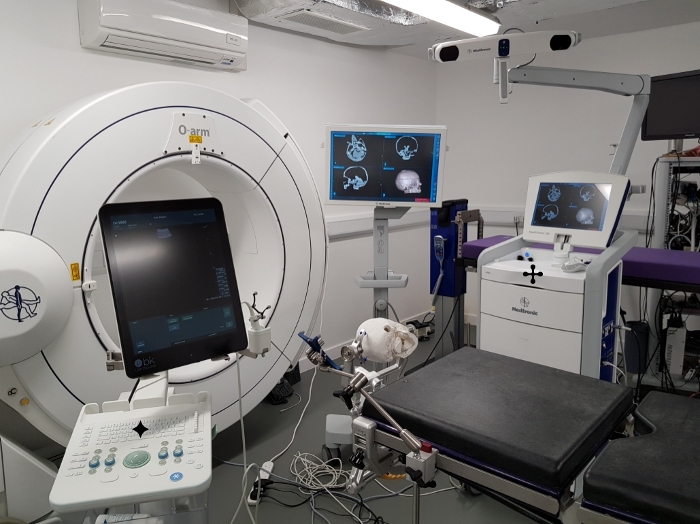
Figure 7 : Tester le fantôme pendant la simulation chirurgicale. Tester le modèle fantôme par simulation chirurgicale dans une salle d’opération virtuelle. ![]() : système de neuronavigation affichant le balayage enregistré du modèle fantôme de CT, : système
: système de neuronavigation affichant le balayage enregistré du modèle fantôme de CT, : système ![]() d’ultrason utilisé pour l’image du fantôme avec un transducteur d’ultrason de trou de bavure (vu placé à côté du moniteur d’ultrason). Notez que le modèle représenté ici est basé sur des données acquises auprès de différents patients avec une tumeur du côté droit. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
d’ultrason utilisé pour l’image du fantôme avec un transducteur d’ultrason de trou de bavure (vu placé à côté du moniteur d’ultrason). Notez que le modèle représenté ici est basé sur des données acquises auprès de différents patients avec une tumeur du côté droit. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Ce protocole détaille le processus de fabrication d’un fantôme spécifique de cerveau de patient, qui inclut le crâne, le cerveau, et la tumeur vestibulaire de schwannoma. Les méthodes d’impression 3D ont permis d’obtenir des détails anatomiquement précis. Le fantôme décrit ici a été fabriqué avec succès avec le niveau désiré de détail anatomique ; La formation image de CT et d’ultrason ont été employées pour démontrer que la tumeur a été facilement visualisée avec les deux modalités. Le matériau imitant le tissu, PVA-c, est bien établi comme matériau imitant les tissus pour les fantômes ultrasoniques; ses propriétés acoustiques et mécaniques peuvent être réglées avec des additifs et le nombre de cycles gel-dégel. Le matériau est facilement disponible, simple à utiliser et non toxique. Avec l’utilisation répétée, le fantôme a eu la durabilité suffisante pour résister à la manipulation et au contact avec une sonde d’ultrason pendant des simulations physiques de chirurgie vestibulaire de schwannoma.
Plusieurs étapes clés ont été identifiées comme étant essentielles au processus de fabrication. Tout d’abord, la segmentation des structures pour l’inclusion dans le fantôme doit inclure le niveau désiré de détail anatomique. La création de fichiers STL précis et de moules 3D suit alors naturellement. Deuxièmement, le positionnement des plans dans le moule du cervelet à l’étape 3.1.9 doit être examiné avec soin, de sorte que le fantôme puisse être facilement enlevé, sans dommage; il doit être coupé en suffisamment de morceaux pour permettre aux détails anatomiques d’être conservés, tout en permettant au fantôme d’être enlevé sans rester coincé dans le moule. Dans ce cas, plusieurs itérations ont été testées et finalement le moule a été coupé en quatre morceaux distincts. La troisième considération clé est que pendant le processus de fabrication pva-c (section 4), le PVA-c doit être laissé refroidir à température ambiante (étape 4.1.6). Si cette étape est manquée et chaud PVA-c est ajouté aux moules, il peut causer les moules à fondre ou à déformer. Il est également crucial qu’une fois les sphères de verre ajoutées (étapes 5.1.2 – 5.1.4), le PVA-c ne soit pas laissé reposer pendant plus de 10 minutes; s’il est laissé pendant une période prolongée, les sphères de verre s’installeront vers le bas, et le fantôme résultant aura le contraste inhomogèned’ultrason 29. Une fois que les sphères de verre sont ajoutées, le PVA-c doit être ajouté directement dans les moules et placé dans le congélateur. Après le premier cycle de gel, les sphères de verre seront fixées sur place, et le fantôme peut être utilisé à température ambiante. Enfin, il est important que les moules soient soigneusement scellés (p. ex., avec du ruban adhésif) avant l’ajout du PVA-c, afin de minimiser les fuites du mélange à travers les lacunes où le moule séparé s’est uni.
Le protocole a plusieurs limites. Par exemple, certains équipements spécialisés sont nécessaires, y compris un bain d’eau et un agitateur électronique. Un sonicateur est également utilisé dans le cadre de ce protocole, mais l’étape de sonication (5.1.3) pourrait être remplacée par une agitation électronique supplémentaire; toutefois, avec cette alternative, il faudrait plus de temps pour parvenir à un mélange homogène que ce qui est possible avec l’utilisation de la sonication. Une limitation de PVA-c est qu’il se dégrade au fil du temps et devient moisi. L’ajout de sorbate de potassium, tel que décrit ici, augmente la durée de conservation du fantôme, bien qu’il doit encore être conservé dans un contenant étanche à l’air. Une deuxième limitation de PVA-c est que des cycles gel-dégel sont nécessaires, ce qui augmente le temps nécessaire pour faire un fantôme. Pour réduire au minimum le temps de fabrication fantôme, une considération clé est la vitesse de congélation et de dégel; une fois que le fantôme est complètement gelé ou entièrement décongelé, le temps qu’il reste dans cet état n’affecte pas significativement le fantôme final16,30. Par conséquent, les longueurs de cycle utilisées peuvent être variées, à condition que le fantôme soit complètement gelé et décongelé à chaque étape du cycle. Par exemple, la tumeur dans le fantôme de cette étude est très petite, de sorte que des cycles plus courts pourraient être utilisés pour la tumeur que pour le cerveau. Enfin, l’impression 3D des moules et du crâne est un processus long qui consomme une partie importante (3 jours) du temps total (1 semaine) nécessaire pour fabriquer un fantôme avec ce protocole. L’imprimante utilisée était un modèle commercial à partir de 2018; le processus d’impression pourrait être complété dans des délais plus courts avec l’utilisation d’imprimantes plus nouvelles et plus rapides.
Le fantôme cérébral présenté ici pourrait être utilisé directement pour la formation clinique et la validation des systèmes de neuronavigation. Comme matériau imitant les tissus, PVA-c permet d’utiliser le fantôme résultant à plusieurs reprises, par exemple comme un outil de formation ou pour la validation de l’échographie peropératoire dans la chirurgie vestibulaire schwannoma, car il s’agit d’un matériau durable et non toxique. En tant que tel, la méthode de fabrication est complémentaire à celles décrites précédemment dans lesquelles l’impression 3D a été utilisée pour créer des fantômes spécifiques au cerveau du patient20,21,22,23,24,25. L’utilisation de PVA-c comme TMM rend le fantôme approprié pour une utilisation dans la simulation de la neurochirurgie, car le matériau peut résister à la manipulation manuelle répétée et le contact à partir d’une sonde à ultrasons. Ces travaux prépare le terrain pour d’autres études quantitatives de validation. La méthode fantôme décrite ici est très polyvalente et pourrait être utilisée pour fabriquer de nombreux types de fantômes tumoraux spécifiques au patient, s’étendant du cerveau à d’autres organes, avec compatibilité entre plusieurs modalités d’imagerie.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Les auteurs remercient Daniil Nikitichev et Steffi Mendes pour leurs conseils sur l’utilisation de Meshmixer et Fernando Perez-Garcia pour ses conseils sur l’utilisation de Slicer 3D et pour nous fournir du code pour automatiser certaines des étapes de traitement.
Ce travail a été soutenu par Wellcome Trust [203145Z/16/Z; 203148/Z/16/Z; WT106882], EPSRC [NS/A000050/1; NS/A000049/1], MRC [MC_PC_17180] et National Brain Appeal [NBA/NSG/SBS] financement. Tv est soutenu par un Medtronic Inc / Royal Academy of Engineering Research Chair [RCSRF1819\7\34].
matériels
| Name | Company | Catalog Number | Comments |
| AutodeskFusion 360 | Autodesk Inc., San Rafael, California, United States | https://www.autodesk.co.uk/products/fusion-360/overview | CAD software |
| Barium sulphate | Source Chemicals | - | |
| CT scanner | Medtronic Inc, Minneapolis, USA | - | O-arm 3D mobile X-ray imaging system |
| Glass microspheres | Boud Minerals | ||
| Mechanical stirrer | IKA | 4442002 | Eurostar Digital 20, IKA |
| Meshmixer | Autodesk Inc., San Rafael, California, United States | http://www.meshmixer.com | 3D modelling software. Version 3.5.484 used |
| Neuronavigation system | Medtronic Inc, Minneapolis, USA | - | S7 Stealth Station |
| PLA | Ultimaker (Ultimaker BV, Utrecht, Netherlands) | UM9016 | |
| Potassium sorbate | Meridianstar | - | |
| PVA | Ultimaker | - | |
| PVA powder | Sigma-Aldrich | 363146 | 99%+ hydrolysed, average molecular weight 85,000-140,000 |
| Sonicator | Fisher Scientific | 12893543 | |
| Ultimaker Cura | Ultimaker BV, Utrecht, Netherlands | https://ultimaker.com/software/ultimaker-cura | 3D printing software. Version 4.0.0 used |
| Ultimaker S5 Printer | Ultimaker BV, Utrecht, Netherlands | - | |
| Ultrasound scanner | BK Medical, Luton, UK | - | BK 5000 scanner |
| Water bath | IKA | 20009381 | HBR4 control, IKA |
| 3D Slicer | http://slicer.org | - | Software used to segment patient data. Version 4.10.2 used |
Références
- Culjat, M. O., Goldenberg, D., Tewari, P., Singh, R. S. A review of tissue substitutes for ultrasound imaging. Ultrasound in Medicine and Biology. 36 (6), 861-873 (2010).
- Hwang, J., Ramella-Roman, J. C., Nordstrom, R. Introduction: Feature Issue on Phantoms for the Performance Evaluation and Validation of Optical Medical Imaging Devices. Biomedical Optics Express. 3 (6), 1399 (2012).
- Maul, H., et al. Ultrasound simulators: Experience with the SonoTrainer and comparative review of other training systems. Ultrasound in Obstetrics and Gynecology. 24 (5), 581-585 (2004).
- Craven, C., et al. Development of a modelled anatomical replica for training young neurosurgeons. British Journal of Neurosurgery. 28 (6), 707-712 (2014).
- Zhang, L., Kamaly, I., Luthra, P., Whitfield, P. Simulation in neurosurgical training: a blueprint and national approach to implementation for initial years trainees. British Journal of Neurosurgery. 30 (5), 577-581 (2016).
- Leff, D. R., et al. Validation of an oncoplastic breast simulator for assessment of technical skills in wide local excision. British Journal of Surgery. 103 (3), 207-217 (2016).
- Hunt, A., et al. Low cost anatomically realistic renal biopsy phantoms for interventional radiology trainees. European Journal of Radiology. 82 (4), 594-600 (2013).
- Pacioni, A., et al. Patient-specific ultrasound liver phantom: materials and fabrication method. International Journal of Computer Assisted Radiology and Surgery. 10 (7), 1065-1075 (2015).
- Maneas, E., et al. Anatomically realistic ultrasound phantoms using gel wax with 3D printed moulds. Physics in Medicine and Biology. 63 (1), (2018).
- Samii, M., Matthies, C. Management of 1000 vestibular schwannomas (acoustic neuromas): hearing function in 1000 tumor resections. Neurosurgery. 40 (2), 242-248 (1997).
- Cabrelli, L. C., Pelissari, P. I. B. G. B., Deana, A. M., Carneiro, A. A. O., Pavan, T. Z. Stable phantom materials for ultrasound and optical imaging. Physics in Medicine and Biology. 62 (2), 432-447 (2017).
- Vieira, S. L., Pavan, T. Z., Junior, J. E., Carneiro, A. A. O. Paraffin-Gel Tissue-Mimicking Material for Ultrasound-Guided Needle Biopsy Phantom. Ultrasound in Medicine & Biology. 39 (12), 2477-2484 (2013).
- Maneas, E., et al. Gel wax-based tissue-mimicking phantoms for multispectral photoacoustic imaging. Biomedical Optics Express. 9 (3), 1151 (2018).
- Madsen, E. L., Hobson, M. A., Shi, H., Varghese, T., Frank, G. R. Tissue-mimicking agar/gelatin materials for use in heterogeneous elastography phantoms. Physics in Medicine and Biology. 50 (23), 5597-5618 (2005).
- Duboeuf, F., et al. Investigation of PVA cryogel Young’s modulus stability with time, controlled by a simple reliable technique. Medical Physics. 36 (2), 656-661 (2009).
- Fromageau, J., Brusseau, E., Vray, D., Gimenez, G., Delachartre, P. Characterization of PVA cryogel for intravascular ultrasound elasticity imaging. IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 50 (10), 1318-1324 (2003).
- Fromageau, J., et al. Estimation of polyvinyl alcohol cryogel mechanical properties with four ultrasound elastography methods and comparison with gold standard testings. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 54 (3), 498-508 (2007).
- Khaled, W., et al. Evaluation of Material Parameters of PVA Phantoms for Reconstructive Ultrasound Elastography. 2007 IEEE Ultrasonics Symposium Proceedings. , 1329-1332 (2007).
- Chen, S. J. S., et al. An anthropomorphic polyvinyl alcohol brain phantom based on Colin27 for use in multimodal imaging. Medical Physics. 39 (1), 554-561 (2012).
- Ploch, C. C., Mansi, C. S. S. A., Jayamohan, J., Kuhl, E. Using 3D Printing to Create Personalized Brain Models for Neurosurgical Training and Preoperative Planning. World Neurosurgery. 90, 668-674 (2016).
- Weinstock, P., et al. Creation of a novel simulator for minimally invasive neurosurgery: Fusion of 3D printing and special effects. Journal of Neurosurgery: Pediatrics. 20 (1), 1-9 (2017).
- Grillo, F. W., et al. Patient-specific neurosurgical phantom: assessment of visual quality, accuracy, and scaling effects. 3D Printing in Medicine. 4 (1), (2018).
- Tsai, A., et al. Creation and Validation of a Simulator for Neonatal Brain Ultrasonography: A Pilot Study. Academic Radiology. 24 (1), 76-83 (2017).
- Reinertsen, I., Collins, D. L. A realistic phantom for brain-shift simulations. Medical Physics. 33 (9), 3234-3240 (2006).
- Mobashsher, A. T., Abbosh, A. M., Wang, Y. Microwave system to detect traumatic brain injuries using compact unidirectional antenna and wideband transceiver with verification on realistic head phantom. IEEE Transactions on Microwave Theory and Techniques. 62 (9), 1826-1836 (2014).
- Cox, R. W., et al. A (sort of) new image data format standard: NiFTI-1. 10th Annual Meeting of the Organization for Human Brain Mapping. 22, (2004).
- Cramer, J., Quigley, E. Advanced Visualization and 3D Printing. Learning Lab at the Society for Imaging Informatics in Medicine annual meeting. , (2019).
- Cardoso, M. J., et al. Geodesic Information Flows: Spatially-Variant Graphs and Their Application to Segmentation and Fusion. IEEE Transactions on Medical Imaging. 34 (9), 1976-1988 (2015).
- Dong, J., Zhang, Y., Wei-Ning, L. Walled vessel-mimicking phantom for ultrasound imaging using 3D printing with a water-soluble filament: design principle, fluid-structure interaction (FSI) simulation, and experimental validation. Physics in Medicine & Biology. , 0 (2020).
- Jiang, S., Liu, S., Feng, W. PVA hydrogel properties for biomedical application. Journal of the Mechanical Behavior of Biomedical Materials. 4 (7), 1228-1233 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon