Method Article
Evaluación in vivo del aclaramiento mucociliario en ratones
En este artículo
Resumen
En esta publicación, describimos protocolos para evaluar el aclaramiento mucociliario de las vías respiratorias (MCC) en ratones in vivo utilizando imágenes de radionúclidos de doble modalidad. Este protocolo está diseñado para un único protocolo de adquisición de tomografía computarizada por emisión de fotones (SPECT) y tomografía computarizada (TC) utilizando colimadores de cuerpo entero del ratón (MWB) en un sistema SPECT/CT dual.
Resumen
Los cilios de motil respiratorio, orgánulos especializados de la célula, recubren la superficie apical de las células epiteliales que recubren las vías respiratorias. Al batir de manera metachronal y sincronal, estos orgánulos múltiples, motiles y basados en actinas generan un flujo de líquido cefalorraya que despeja las vías respiratorias de contaminantes y patógenos inhalados. Con el aumento de la contaminación ambiental, los nuevos patógenos virales y las bacterias multirresistente emergentes, el aclaramiento mucociliario generado por cilios (MCC) es esencial para mantener la salud pulmonar. Mcc también está deprimido en múltiples trastornos congénitas como disquinesia ciciliaria primaria, fibrosis quística, así como trastornos adquiridos como enfermedad pulmonar obstructiva crónica. Todos estos trastornos han establecido, en algún caso múltiples, modelos de ratón. En esta publicación, detallamos un método utilizando una pequeña cantidad de radiactividad e imágenes SPECT/CT de doble modalidad para medir con precisión y reproducibilidad mcc en ratones in vivo. El método permite la recuperación de ratones después de la toma de imágenes, hacer posibles mediciones en serie y probar posibles terapias longitudinalmente a lo largo del tiempo. Los datos en ratones de tipo salvaje demuestran la reproducibilidad de la medición de MCC siempre y cuando se preste una atención adecuada al detalle, y el protocolo se cumpla estrictamente.
Introducción
Los cilia son orgánulos celulares a base de microtúbulos conservados a través de la historia evolutiva, desde algas hasta humanos. Emanan de las superficies celulares y tienen una serie de funciones1,que van desde el reconocimiento de señales sensoriales ambientales locales hasta la motilidad, funciones que se pueden rastrear desde los seres humanos hasta los primeros organismos eucariotas unicelulares2,3. Cilia puede ser no motil y servir como antena especializada de una célula para procesar señales ambientales; o motil y múltiple, batiendo en ondas metachronales sincronizadas para generar flujo fluido, como en el revestimiento de las trompas de Falopio y las vías respiratorias superior e inferior, a excepción de los bronquioles terminales que conducen al alvéolo1,2.
La extensa superficie epitelial de las vías respiratorias está expuesta a un aluvión constante de contaminación en forma de una variedad de contaminantes y patógenos inhalados potencialmente peligrosos, lo que requiere una defensa. Un mecanismo de defensa clave es el aparato mucociliario del árbol traqueobronquial, donde un flujo continuo de moco secreto es transportado mecánicamente fuera de las vías respiratorias por el latido de múltiples cilios motiles que recubren las superficies apicales de las células epiteliales traqueo-bronquiales. Estos funcionan para atrapar contaminantes inhalados, y a través de su latido continuo y sincronal, transportarlos cefalad4,5.
Se ha demostrado que Cilia tiene papeles clave como en el desarrollo de patrones izquierda-derecha en el desarrollo de embriones, donde los cilios móviles en el nodo embrionario rompen la simetría6. Las mutaciones en genes relacionados con cilio se han relacionado con enfermedades como las cardiopatías congénitas (CHD) debido a la estructura asimétrica del corazón6. Estudios recientes han reportado una alta incidencia de disfunción ciciliaria en las vías respiratorias de pacientes con CHD, así como una mayor prevalencia de complicaciones respiratorias postoperatorias y síntomas crónicos de las vías respiratorias en las vías respiratorias superior e inferior7,8,9,10. Se ha demostrado que los pacientes con CHD y disfunción ciciliaria, con o sin heterotaxi, tienen un mayor riesgo de complicaciones respiratorias y resultados respiratorios negativos después de la operación5,8,10. Más allá de sus funciones en la señalización y el desarrollo, la importancia de los ciliopatías de las vías respiratorias ha demostrado la ciliopatías, de las cuales un ejemplo principal es la discinesia ciciliaria primaria (PCD). La PCD es un trastorno congénito resultante de una serie de mutaciones que afectan a los cilios respiratorios móviles, lo que conduce a infecciones pulmonares recurrentes, bronquiectasis y potencialmente la necesidad de trasplante de pulmón11. Además, a pesar de que los cilios son normales en fibrosis quística (CF), trastorno congénito más común en la población caucásica, mcc se deteriora debido a moco grueso y viscoso resultante de mutaciones en el gen CFTR12. Hay múltiples modelos de ratón de PCD y CF, así como un número cada vez mayor de modelos de CHD. En última instancia, los cilios son estructuras versátiles con muchas funciones clave, y un método para evaluar la función de los cilios respiratorios móviles in vivo puede ser valioso para el estudio preclínicos, y la evaluación de los efectos de mutaciones, así como los fármacos sobre el aclaramiento mucociliario (MCC)13. El método también sería valioso para evaluar los efectos de nuevos fármacos, terapia génica o intervenciones en MCC en estos modelos de ratón.
Hay muchos modelos diferentes que se han utilizado para evaluar MCC. Un método notable consiste en el uso de tinte azul de metileno que ha sido inculcado en el bronco, con aclaramiento medido por la medición fibrapóptica del movimiento del tinte14. Este método está limitado por la capacidad de observar el movimiento del tinte, que es más rutinario en los seres humanos que en los modelos de ratón preclínicos. Otro método notable es la imagen de rayos X de contraste de fase sincrotrón (PCXI), que se puede utilizar para rastrear partículas individuales en una vía respiratoria. Este método es relativamente nuevo y no es ampliamente accesible15. Existen numerosos métodos ex vivo para evaluar las vías respiratorias mediante la extirpación de una tráquea para la video-microscopía, sin embargo estos modelos proporcionan poca utilidad en pacientes humanos16. Las técnicas de alta resolución para imágenes ciliadas, como la tomografía por coherencia óptica, están limitadas de la misma manera17.
En este artículo, presentamos un método reproducible para medir mcc in vivo que se ha utilizado para medir los aclaramientos pulmonares en innumerables modelos animales, así como estudiar MCC en la enfermedad pulmonar obstructiva crónica y evaluar los efectos de los fármacos inmunosupresores18,19. Este método rastrea el aclaramiento del coloide radiofármaco de 99mtecnecio-azufre(99mTc-Sc), un radiopaso particulado insoluble, después de la instilación en los pulmones. A continuación, se puede realizar un seguimiento del radionúclido utilizando una sola tomografía computarizada por emisión de fotón (SPECT)18,20. Hemos perfeccionado aún más esta técnica para medir MCC mediante el uso de la doble modalidad SPECT y tomografía computarizada (TC) con la co-localización de los recuentos de radioisótopos a los pulmones y midiendo la disminución en estos recuentos durante 6 horas. Las imágenes de doble modalidad, con el coregistro de imágenes CT y SPECT, permiten una localización precisa de los recuentos de radiación a nuestra región de interés, los pulmones. Aunque describimos en detalle el método para la medición de MCC en ratones, el protocolo se puede ajustar para estudiar MCC en ratas. Los colimadores tendrían que ajustarse, así como la dosis de radiación. En nuestra opinión, los escáneres MCC del ratón son más difíciles técnicamente debido al pequeño tamaño animal, pero más útil que las ratas debido al gran número de modelos de ratón establecidos de una serie de trastornos humanos. Además, debido a su menor costo y costo de mantenimiento en colonias de animales, un tamaño de muestra más grande es más factible en ratones.
Protocolo
El Comité Institucional de Cuidado y Uso de Animales de la Universidad de Pittsburgh aprobó todos los protocolos de animales especificados en esta publicación antes de llevar a cabo cualquiera de estos experimentos con animales.
NOTA: Este protocolo detalla cómo realizar estudios in vivo de aclaramiento mucociliario utilizando imágenes de radionúclidos con un escáner SPECT/CT de doble modalidad. Las técnicas demostradas son la realización de calibraciones del sistema, ratones anestesiantes, intubación traqueal de ratones, inculcar el isótopo en los pulmones, imágenes de doble modalidad, coregistro de estas imágenes y análisis.
1. Configuración del sistema SPECT/CT
- Diseñe un flujo de trabajo adecuado y configure antes de ejecutar experimentos con animales vivos.
- Utilice una adquisición spect que consta de 60 proyecciones con un tamaño de paso de 6o entre proyecciones con un radio de rotación de 40 cm. La adquisición de TC consta de 220 proyecciones con un ángulo de 1,6o entre proyecciones.
- Asegúrese de que el sistema tenga los colimadores MWB correctos para ratones e imágenes SPECT en su lugar. Si los colimadores inapropiados están instalados, utilice el asistente de colimador para instalar los correctos.
- Ejecute las calibraciones del sistema necesarias para preparar el sistema para su uso.
NOTA: Los componentes SPECT y CT del escáner necesitan calibración. Calibrar los componentes ct utilizando un acondicionamiento de origen y una calibración de luz/oscura (D/L) una vez al día, una calibración de desplazamiento central (COS) cada 2 semanas y evaluar el hardware de rayos X cada mes. Los componentes SPECT deben calibrarse una vez al año.- Para evaluar el hardware de rayos X, active la casilla Evaluar hardware de rayos X durante las calibraciones de TC(Menú suplementario de calibración CT).
- Para realizar el acondicionamiento de origen, marque la casilla Realizar acondicionamiento de origen durante las calibraciones ct(Menú suplementario de calibración CT).
- Para realizar una calibración D/L, marque la casilla D/L junto al protocolo de adquisición de TC utilizado durante los experimentos durante las calibraciones por TC. Desmarque todos los demás protocolos(menú de calibración CT suplementaria).
- Para realizar una calibración cos, reemplace la cama por la herramienta de anillo de calibración, ajuste la configuración del tipo de cama para que coincida con la configuración del control de movimiento y marque la casilla COS junto al protocolo de adquisición de TC utilizado durante los experimentos durante las calibraciones por TC. Desmarque todos los demás protocolos(menú suplementario de calibración CT, anillo de calibración suplementario).
2. Intubación e instilación del ratón
- Pesar los ratones para ser escaneados. Si escanea varios ratones, tener cuidado de marcar a los ratones con fines de identificación utilizando métodos como punzonado en los oídos o marcado de la cola.
- Anestesiar un ratón usando 1.5% isoflurano con un flujo de gas de 2 L/min O2 en una cámara de gas durante ~5 minutos para producir anestesia de profundidad suficiente, hasta que la respiración se ralentiza a ~55-65 respiraciones por minuto 16 (Figura 1A).
- Retire el ratón de la cámara y suspenda por los incisivos delanteros en un soporte de intubación en una inclinación de 45o. Equipe el soporte de intubación con un cono nasal para asegurarse de que el ratón se anestesia durante la intubación (Figura 1B).
- Conecte un extremo de un cable de fibra óptica de 50 μm a una fuente de luz e enhebrar una cánula de calibre 20 sobre él utilizando el cable para actuar como guía (Figura 1C).
- Abra la boca del ratón y tire de la lengua hacia adelante usando fórceps contundentes. Ilumine el cable guía y utilícenlo para visualizar las cuerdas vocales (Figura 1D).
- Pase el cable guía a través de las cuerdas vocales para que el cable esté justo más allá de las cuerdas vocales y descansando en la tráquea superior. Deslice la cánula de 1 pulgada hacia adelante a lo largo del alambre para intubar el ratón, pasando la cánula lo suficientemente profundo como para que el cubo de la misma esté contra los incisivos del animal (Figura 1E). Retire el cable dejando la cánula en su lugar.
- Pruebe la intubación conectando brevemente la cánula con un dedo y comprobando si hay cambios en la respiración. La respiración interrumpida o la respiración tensa mientras se conecta y se acelera la respiración al liberarse son signos de intubación traqueal adecuada. Si no hay ningún cambio en los patrones respiratorios al conectar la cánula, es probable que este último esté en el esófago.
- Preparar 0,2 mCi de coloide de 99mde tecnecio-azufre(99mTc-Sc) en un volumen de 10 μL, y pipeta en la cánula. Permita que el ratón lo inhale espontáneamente en los pulmones durante 1-2 min(Figura 1F). Retire la cánula antes de transferir el ratón a la palet del escáner.
NOTA: El radionúclido fue preparado y filtrado por cardinal Health.
3. Imágenes SPECT/CT
- Transfiera el ratón a un palé de 25 mm con un cono nasal y asegure con cinta adhesiva, teniendo cuidado de no pegar el pecho y el abdomen demasiado fuerte para evitar afectar la respiración. Se encargue de quitar las etiquetas de los oídos metálicos conectadas al ratón.
- Prepare un fantasma radiactivo que consista en 0,05 mCi en 200 μL y coloque esta cantidad en un tubo PCR de 0,2 ml. Coloque el tubo pegando al palet debajo del abdomen inferior del ratón, evitando la superposición con los pulmones.
NOTA: El fantasma se utiliza con el fin de co-registrar imágenes CT y SPECT, así como un control negativo para el espacio libre. - Inserte el ratón en el sistema SPECT/CT, seleccione el flujo de trabajo de imágenes y ejecute Configuración.
- Configure el posicionamiento de los detectores en el ratón y ejecute el flujo de trabajo de imágenes.
- Prepare una jaula para ratones que hayan recibido radiactividad después del procedimiento, con acceso sin restricciones a alimentos y agua, y etiquetado claro usando una pegatina de seguridad contra la radiación.
- Una vez completado el flujo de trabajo, retire el ratón del palet de imágenes y déjelo recuperar en la jaula preparada durante una duración de 6 horas entre escaneos (fin de la exploración 1 al comienzo del escaneo 2) con acceso ad libitum a alimentos y agua. 6 h fue elegido ya que corresponde al período de tiempo en el que se está produciendo un despeje lineal dependiendo de la función cilio con muy poca distancia alveolar.
- Después de 6 horas, vuelva a anestesiar el ratón y escanear, junto con el fantasma, utilizando el mismo flujo de trabajo para medir la cantidad de isótopo borrado de las vías respiratorias.
NOTA: Es fundamental permitir que el ratón se recupere como anestesia ininterrumpida con isoflurano durante 6 horas dará lugar a un efecto cilia-depresivo significativo, lo que resulta en aclaramientos mucociliarios cercanos a cero.
4. Análisis
- Después de la creación de imágenes, realice el postprocesamiento para reconstruir imágenes completas de pila 3D.
- Histograma de las imágenes SPECT utilizando los ajustes estándar de fábrica para 99mTc, y luego reconstruir utilizando un algoritmo MAP3D y una reconstrucción de la función de dispersión de puntos (PSF).
NOTA: La reconstrucción se realizó utilizando 8 iteraciones y 6 subconjuntos. Una reconstrucción efectiva necesita una relación de subconjuntos a proyecciones a la 1:10 o dividirse uniformemente en el número de proyecciones, por lo que se utilizaron 6 subconjuntos debido a la adquisición utilizando 60 proyecciones. - Reconstruye las imágenes de TC usando el algoritmo Feldkamp y un filtro Shepp-Logan.
NOTA: La reconstrucción se realizó utilizando 4 iteraciones.
- Histograma de las imágenes SPECT utilizando los ajustes estándar de fábrica para 99mTc, y luego reconstruir utilizando un algoritmo MAP3D y una reconstrucción de la función de dispersión de puntos (PSF).
- Procese las imágenes CT y SPECT en FIJI ImageJ21 utilizando la herramienta de reslice para generar imágenes de vista coronal a partir de las imágenes axiales predeterminadas. A continuación, realice una proyección de suma de pila z en la imagen SPECT para agregar los datos de recuento de cada sector y generar una sola imagen para facilitar el análisis.
- Redimensione y co-registre las imágenes CT y SPECT utilizando el tubo fantasma Eppendorf como referencia (Figura 2A,B). Realice un seguimiento y utilice mediciones consistentes de cambio de tamaño en todas las muestras.
- Binarize la imagen CT utilizando el umbral automático, seguido de invertir la pila y realizar una proyección de suma de pila z para generar un contorno de los pulmones para su análisis (Figura 2C).
- Gire las imágenes CT y SPECT y combine la imagen utilizando las herramientas de canal. Calcule MCC dibujando un ROI alrededor del pulmón derecho y midiendo (Figura 2D).
NOTA: Esta medición será de los recuentos totales en el pulmón derecho para los puntos de tiempo de 0 y 6 horas, con las imágenes de 6 horas corregidas para la descomposición radiactiva utilizando la fórmula: N(t) = N0e−t. 99m Tc-Sc tiene una constante de decaimiento de 3.21e−5 por segundo con una vida media de ~6 horas. Estos valores se pueden utilizar para calcular un porcentaje de espacio libre.
NOTA: Pulmón derecho se elige para el dibujo de ROI y la medición cuenta como el aclaramiento mucociliario transportará el radioisótopo fuera de los pulmones a la faringe desde donde se tragará y terminará en el estómago. Con bastante frecuencia, los recuentos se pueden ver en el estómago que pueden superponerse con el pulmón izquierdo y por lo tanto producir recuentos erróneos. Esta confusión sólo se puede evitar midiendo los recuentos en el pulmón derecho.
Resultados
Usando este protocolo, anestesiamos ratones en una cámara isoflurano(Figura 1A). Después de alcanzar un nivel adecuado de anestesia, los ratones fueron colocados en soportes verticales(Figura 1B)y las cuerdas vocales fueron visualizadas usando un alambre guía iluminado (Figura 1C-1D). Los ratones fueron intubados e inculcados con 0,2 mCi 99mTc-Sc en volúmenes de 10 μL a través de una cánula y ratones autorizados a inhalar espontáneamente en los pulmones (Figura 1E-1F). Después de la adquisición y el procesamiento de imágenes, las imágenes CT y SPECT se colocaron(Figura 2A)utilizando el tubo fantasma como punto de referencia (Figura 2B). Las máscaras de los pulmones se generaron a partir de la imagen de TC(Figura 2C)y se utilizaron para dibujar ROIs alrededor del pulmón derecho para su análisis en 0 (Figura 2D) y 6 horas (Figura 2E-2F). Para probar la reproducibilidad del protocolo, un total de 8 ratones fueron escaneados dos veces en diferentes días con condiciones experimentales idénticas, con análisis utilizando una prueba t emparejada que no muestra ninguna diferencia significativa entre los escaneos repetidos (p-value=0.9904) (Figura 3A). Otros 2 ratones fueron escaneados tres veces en diferentes días con condiciones experimentales idénticas, con análisis utilizando ANOVA unidireccional que muestra coincidencia significativa entre los escaneos repetidos (valor p de 0,0041) (Figura 3B). Se escanearon un total de 8 ratones y se mostraron dos imágenes representativas(Figura 4).
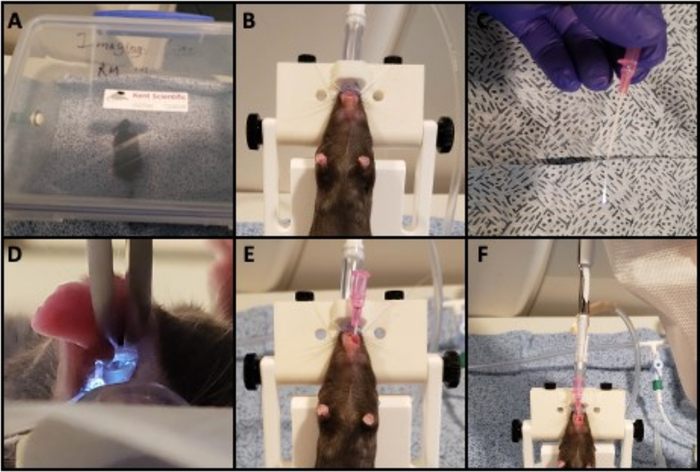
Figura 1: Intubación del ratón e instilación de isótopos. Imágenes de los pasos necesarios para intubar e inculcar isótopos en las vías respiratorias. A) El ratón está anestesiado en una cámara. B) El ratón anestesiado se coloca en un soporte vertical, suspendido por los incisivos delanteros. C) Se prepara un cable de fibra óptica iluminado de 0,5 mm que sirve como cable guía ejecutándolo a través de una cánula de 20 G. D) La boca del ratón se abre con fórceps e iluminada utilizando el cable guía iluminado para visualizar las cuerdas vocales. E) La cánula se empuja a través de las cuerdas vocales y se elimina el cable guía. F) Isótopo soluble se inculca en la cánula utilizando una pipeta y el ratón permite inhalar espontáneamente el isótopo en los pulmones. Haga clic aquí para ver una versión más grande de esta figura.
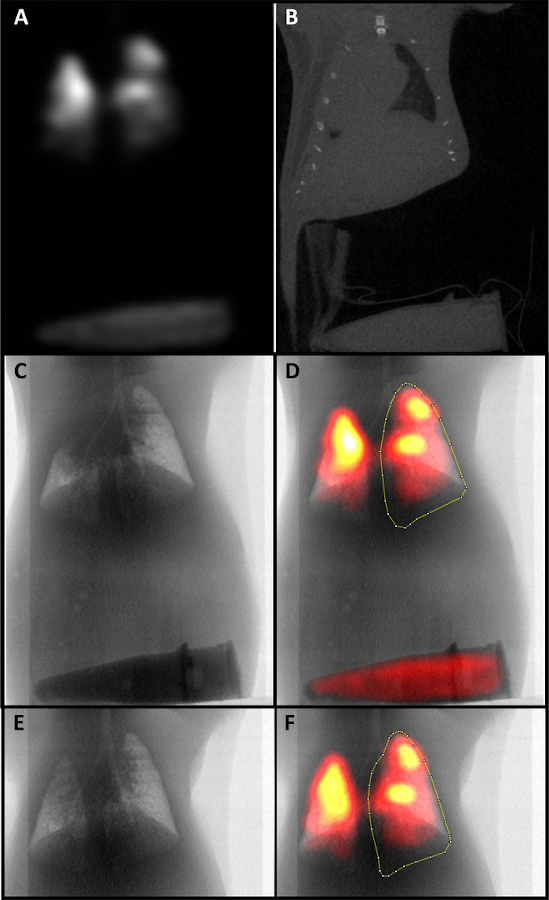
Figura 2: Imágenes SPECT/CT de una exploración MCC. A) Una imagen SPECT que ha sido co-localizada con una imagen de TC. B) Una imagen de TC con un tubo fantasma visible que se utilizó para la coincolo localización. C) Una máscara de las vías respiratorias derivada de binarizar la imagen ct y realizar una proyección de suma de pila z. D) La máscara ct co-localizada con la imagen SPECT. Se ha dibujado un ROI para su análisis alrededor del pulmón derecho. E) Una máscara de las vías respiratorias a las 6 horas. F) Una imagen co-localizada ct y SPECT de las vías respiratorias a las 6 horas con un ROI para su análisis. Haga clic aquí para ver una versión más grande de esta figura.
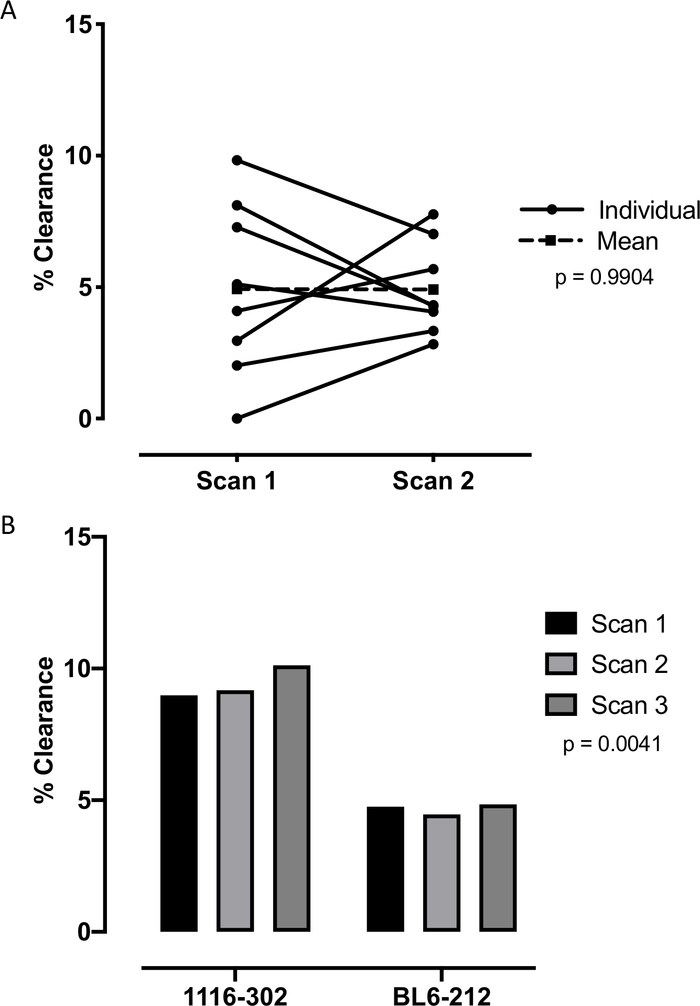
Figura 3: Mediciones de espacio libre de los mismos ratones a través de múltiples escaneos. A) Se midieron dos aclaramientos de repetición individuales para 8 ratones sin cambios en las condiciones experimentales. Una prueba de t emparejada mostró que no había ninguna diferencia significativa entre los escaneos repetidos con un valor p de 0,9904. B) Se midieron tres aclaramientos de repetición individuales para dos ratones sin cambios en las condiciones experimentales. Un ANOVA unidireccional mostró que había coincidencia significativa entre los escaneos repetidos con un valor p de 0,0041. Haga clic aquí para ver una versión más grande de esta figura.
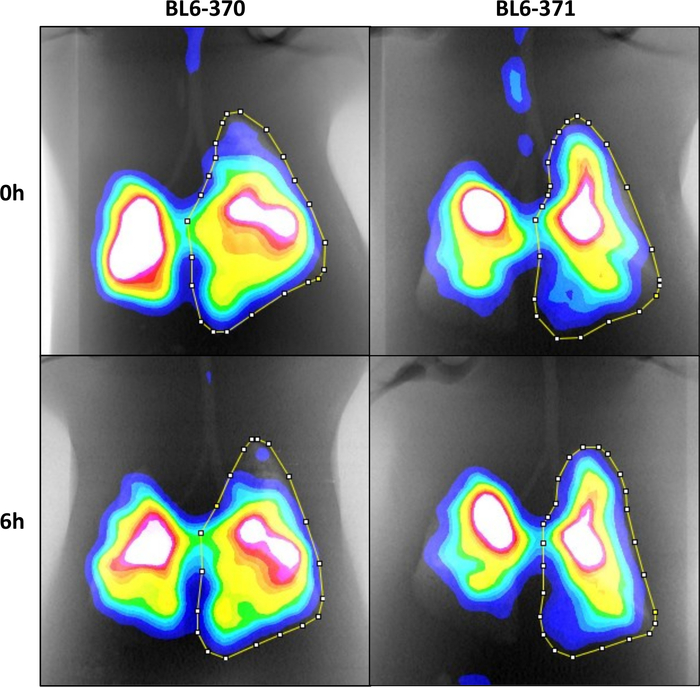
Figura 4: Imágenes espect/CT co-localizadas de las vías respiratorias de 0 y 6 horas en 2 ratones con ROIs dibujadas a las 0 y 6 horas esbozando el pulmón derecho. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Un vídeo de las cuerdas vocales iluminadas por un cable de fibra óptica con el efecto de la respiración visualizada. Haga clic aquí para descargar esta figura.
Archivos suplementarios. Haga clic aquí para descargar estos archivos.
Discusión
El papel de los cilios respiratorios móviles tanto en la enfermedad como en el desarrollo sigue evolucionando y siendo mejor apreciado. El latido sincrónico y meaclronal de múltiples cilios motiles en la superficie apical de las células que recubren el árbol traqueobronquial genera flujo de cefalad produciendo aclaramiento mucociliario o MCC. MCC se ve comprometida en ciliopatías como pcd22,enfermedades adquiridas como la EPOC18,y su importancia está siendo reconocida en los CHD, no tradicionalmente considerados ciliopatías. Datos recientes han mostrado disfunción ciciliaria respiratoria tanto en CHD con heterotaxi23 y sin heterotaxi7. Se demostró que dicha disfunción motil cilia se tradujo en mayores síntomas respiratorios9, así como una mayor morbilidad postoperatoria8. La mayoría, si no todas, de estas enfermedades, tienen modelos de ratón disponibles y nuestro protocolo para medir MCC en ratones es una herramienta valiosa que se puede utilizar para probar terapias potenciales.
Los modelos animales proporcionan utilidad para entender las enfermedades y el desarrollo de terapias. Las imágenes animales in vivo proporcionan más utilidad con la capacidad de adquirir múltiples puntos de datos de los mismos animales, sin necesidad de sacrificar a los animales, permitiendo a los investigadores seguir el curso longitudinal de la enfermedad, así como la duración del estudio de los efectos del tratamiento. El modelo de ratón de MCC ha sido desarrollado a lo largo de décadas por múltiples investigadores, inicialmente se está realizando en perros beagle utilizando centtigrafía plana, una técnica de imágenes nucleares bidimensionales24. La técnica fue adaptada para su uso en ratones una década más tarde, seguida de la adaptación a la imagen SPECT una década después de que25,26. El desarrollo de esta técnica en modelos de ratón fue un desarrollo importante en la relevancia de esta técnica, debido a la disponibilidad de múltiples modelos de ratón de enfermedades humanas como la PCD en la que la función ciliaria se altera significativamente. MCC ha sido evaluado en modelos de ratón de denervación pulmonar e inmunosupresión, y tiene el potencial de ser utilizado en conjunto con otros modelos19,26. Se han realizado estudios de medición de MCC en pacientes humanos con enfermedades de las vías respiratorias como CF, asma, PCD y ciliopatías asociadas con la CHD, y han dado resultados de que la técnica puede ayudar tanto a estudios de fisiología pulmonar como a eficacia terapéutica13.
Una parte importante de este protocolo es la configuración de adquisiciones con los parámetros de imagen correctos para adquirir imágenes precisas para la cuantificación. Una serie de factores son clave al diseñar la configuración de adquisición de SPECT, incluidos los que se utilizan colimadores, el número de proyecciones que se van a adquirir por revolución y el tamaño del paso de rotación. La selección del colimador es un factor importante en la sensibilidad y resolución de la adquisición, y es posible que los ajustes de adquisición deban adaptarse al colimador que se utiliza27. Alternativamente, cuando se utilizan animales más grandes como ratas, los colimadores tendrían que ser ajustados. Varios colimadores de agujeros, por ejemplo, son más sensibles, pero se debe tener cuidado al seleccionar un tamaño de paso para evitar la superposición de proyecciones y causar multiplexación no deseada, lo que puede aumentar aún más la sensibilidad de la adquisición a expensas de alguna ambigüedad de imagen que puede causar artefactos de reconstrucción25. La configuración de reconstrucción también es clave para generar imágenes cuantificables. MAP3D es un algoritmo de reconstrucción iterativa comúnmente utilizado, y PSF es un modelo de reconstrucción común. Ambos son confiables para reconstruir imágenes, pero se debe tener cuidado al establecer el número de iteraciones y subconjuntos. Un mayor número de iteraciones aumentará el tiempo computacional requerido para la reconstrucción, y aumentará la calidad de la reconstrucción con rendimientos cada vez menores al aumentar aún más.
Con el fin de cuantificar imágenes en ImageJ, la herramienta de medición ideal para utilizar es RawIntDen, que genera el valor de suma de píxeles en una selección. Al cuantificar los datos SPECT en ROIs pulmonares de diferentes tamaños, el uso de RawIntDen proporciona una medida absoluta de los recuentos y evita ajustar la medición al área del ROI, como lo haría la medición media21.
Esta técnica tiene una serie de fuentes de error asociadas de las que el investigador debe ser consciente al aplicar esta técnica. Un confundador notable es el uso de agentes anestésicos. Isoflurane es un anestésico inhalado de acción rápida del que los ratones se recuperan rápidamente después de completar una adquisición. Sin embargo, se debe tener cuidado de proporcionar a los ratones tiempo suficiente para recuperarse en sus jaulas, y no mantenerse anestesiados más tiempo del necesario. En nuestra experiencia personal (datos inéditos) los ratones que se mantuvieron anestesiados continuamente usando isofluranos inhalados entre el punto de tiempo de 0 y 6 horas mostraron un aclaramiento insignificante. Del mismo modo, también es necesaria una dosis controlada de anestésico para garantizar una rápida recuperación. Al asegurar al animal al palet para obtener imágenes, el tubo fantasma utilizado para el coregistro debe mantenerse bajo en el estómago para evitar que los artefactos se superpongan con los pulmones. Del mismo modo, para garantizar una imagen CT de calidad, tener cuidado de eliminar cualquier etiqueta de metal del ratón para evitar artefactos de dispersión de rayos X.
El protocolo MCC actual se puede aplicar a innumerables modelos animales. Esta técnica tiene un efecto insignificante en la salud del animal escaneado, es bien tolerada por ratones, y debido a esto se puede utilizar con modelos de enfermedad sin poner en riesgo la salud de ratones ya delicados. La fuerza de esta metodología proviene de que se trata de una técnica in vivo, que permite la adquisición de mediciones consistentes y repetibles de la función de las vías respiratorias sin el sacrificio de animales para excitar las tráqueas para la video-microscopía, que los modelos ex vivo requieren26. La consistencia de esta técnica en la producción de mediciones repetibles a través de múltiples escaneos de los mismos animales, permite que el mismo animal sea tratado con diferentes agentes o terapias potenciales, y comparaciones estadísticas realizadas entre el mismo animal para reducir la variabilidad biológica inherente a cualquier modelo animal, reduciendo así el tamaño de la muestra necesaria para mostrar diferencias estadísticamente significativas.
La evaluación de la función de las vías respiratorias utilizando la técnica MCC se puede ajustar a una variedad de modelos animales y aplicarse a muchos modelos diferentes de salud de las vías respiratorias, así como probar nuevas terapias. Las vías respiratorias de los modelos de ratón de PCD se pueden evaluar utilizando esta técnica, así como modelos de EPOC. Nuestro método también se puede utilizar para estudiar efectos diferenciales de varios anestésicos en MCC que están en uso clínico común. Por último, los efectos de los agentes terapéuticos en las vías respiratorias también se pueden evaluar utilizando este modelo. Como se indicó anteriormente pero lleva a la repetición, ya que es una medición in vivo que permite repetir las evaluaciones de MCC en el transcurso de una enfermedad, así como los beneficios de prueba de intervenciones terapéuticas a lo largo del tiempo. Además, los ratones son los animales de laboratorio más comunes utilizados para imitar/estudiar enfermedades humanas, con, en algunos casos, múltiples modelos transgénicos de ratón de enfermedades humanas disponibles para elegir.
Divulgaciones
Ninguno relacionado con este trabajo.
Agradecimientos
M.Z. y K.S.F. y este trabajo fue apoyado por una subvención otorgada bajo el Pitt Innovation Challenge (PInCh), a través del Instituto de Ciencias Clínicas y Traslacionales de la Universidad de Pittsburgh, y la subvención NHLBI R01 HL153407, otorgada a M.Z.
Materiales
| Name | Company | Catalog Number | Comments |
| 500 µm Unjacketed Fiber Optic Wire | Edmund Optics | 02-532 | |
| 99mTechnecium-Sulfur Colloid | Cardinal Health | ||
| Anesthesia Vaporizer | Vetland Medical | A13480 | |
| Durmont #5 Forceps | Fine Science Tools | 99150-20 | |
| FIJI ImageJ 2.0.0-rc-65/1.52p Software | |||
| Introcan Safety Catheters 20G 1inch | Fisher Scientific | NC1534477 | |
| Isoflurane | Henry Schein | 118-2097 | |
| Mouse Intubation Stand | Kent Scientific | ETI-MSE-01 | |
| Siemens Inveon dual-modality SPECT/CT | Siemens | ||
| Single Channel Anesthesia Stand | Summit Anesthesia Solutions | 22860 |
Referencias
- Afzelius, B. A. Cilia-related diseases. Journal of Pathology. 204 (4), 470-477 (2004).
- Mitchell, D. R. The evolution of eukaryotic cilia and flagella as motile and sensory organelles. Advances in Experimental Medicine and Biology. 607, 130-140 (2007).
- Carvalho-Santos, Z., Azimzadeh, J., Pereira-Leal, J. B., Bettencourt-Dias, M. Evolution: Tracing the origins of centrioles, cilia, and flagella. Journal of Cell Biology. 194 (2), 165-175 (2011).
- Randell, S. H., Boucher, R. C. University of North Carolina Virtual Lung, G. Effective mucus clearance is essential for respiratory health. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 20-28 (2006).
- Wanner, A., Salathe, M., O'Riordan, T. G. Mucociliary clearance in the airways. American Journal of Respiratory and Critical Care Medicine. 154, 1868-1902 (1996).
- Li, Y., et al. Global genetic analysis in mice unveils central role for cilia in congenital heart disease. Nature. 521 (7553), 520-524 (2015).
- Zahid, M., et al. Airway ciliary dysfunction and respiratory symptoms in patients with transposition of the great arteries. PLoS One. 13 (2), 0191605 (2018).
- Stewart, E., et al. Airway ciliary dysfunction: Association with adverse postoperative outcomes in nonheterotaxy congenital heart disease patients. Journal of Thoracic and Cardiovascular Surgery. 155 (2), 755-763 (2018).
- Garrod, A. S., et al. Airway ciliary dysfunction and sinopulmonary symptoms in patients with congenital heart disease. Annals of the American Thoracic Society. 11 (9), 1426-1432 (2014).
- Harden, B., et al. Increased postoperative respiratory complications in heterotaxy congenital heart disease patients with respiratory ciliary dysfunction. Journal of Thoracic and Cardiovascular Surgery. 147 (4), 1291-1298 (2014).
- Leigh, M. W., et al. Clinical and genetic aspects of primary ciliary dyskinesia/Kartagener syndrome. Genetics in Medicine. 11 (7), 473-487 (2009).
- Donaldson, S. H., et al. Effect of ivacaftor on mucociliary clearance and clinical outcomes in cystic fibrosis patients with G551D-CFTR. JCI Insight. 3 (24), (2018).
- Donaldson, S. H., Corcoran, T. E., Laube, B. L., Bennett, W. D. Mucociliary clearance as an outcome measure for cystic fibrosis clinical research. Proceedings of the American Thoracic Society. 4 (4), 399-405 (2007).
- Ledowski, T., Hilmi, S., Paech, M. J. Bronchial mucus transport velocity in patients receiving anaesthesia with propofol and morphine or propofol and remifentanil. Anaesthesia. 61 (8), 747-751 (2006).
- Donnelley, M., Morgan, K. S., Siu, K. K., Parsons, D. W. Dry deposition of pollutant and marker particles onto live mouse airway surfaces enhances monitoring of individual particle mucociliary transit behaviour. Journal of Synchrotron Radiation. 19, 551-558 (2012).
- Christopher, A. B., et al. The effects of temperature and anesthetic agents on ciliary function in murine respiratory epithelia. Frontiers in Pediatrics. 2, 111 (2014).
- Liu, L., et al. Method for quantitative study of airway functional microanatomy using micro-optical coherence tomography. PLoS One. 8 (1), 54473 (2013).
- Lam, H. C., et al. Histone deacetylase 6-mediated selective autophagy regulates COPD-associated cilia dysfunction. Journal of Clinical Investigation. 123 (12), 5212-5230 (2013).
- Bhashyam, A. R., et al. A pilot study to examine the effect of chronic treatment with immunosuppressive drugs on mucociliary clearance in a vagotomized murine model. PLoS One. 7 (9), 45312 (2012).
- Ortiz, J. L., et al. Evaluation of Mucociliary Clearance by Three Dimension Micro-CT-SPECT in Guinea Pig: Role of Bitter Taste Agonists. PLoS One. 11 (10), 0164399 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Solomon, G. M., et al. Assessment of ciliary phenotype in primary ciliary dyskinesia by micro-optical coherence tomography. JCI Insight. 2 (5), 91702 (2017).
- Nakhleh, N., et al. High prevalence of respiratory ciliary dysfunction in congenital heart disease patients with heterotaxy. Circulation. 125 (18), 2232-2242 (2012).
- Whaley, S. L., Renken, S., Muggenburg, B. A., Wolff, R. K. Technique for aerosol deposition restricted to the nose in beagle dogs. Journal of Toxicology and Environmental Health. 23 (4), 519-525 (1988).
- Foster, W. M., Walters, D. M., Longphre, M., Macri, K., Miller, L. M. Methodology for the measurement of mucociliary function in the mouse by scintigraphy. Journal of Applied Physiology. 90 (3), 1111-1117 (2001).
- Bhashyam, A. R., et al. Vagal control of mucociliary clearance in murine lungs: a study in a chronic preparation. Autonomic Neuroscience. 154 (1-2), 74-78 (2010).
- Van Audenhaege, K., et al. Review of SPECT collimator selection, optimization, and fabrication for clinical and preclinical imaging. Medical Physics. 42 (8), 4796-4813 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados