Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cuantificación del flujo sanguíneo fetal humano con imágenes por resonancia magnética y compensación de movimiento
En este artículo
Resumen
Aquí presentamos un protocolo para medir el flujo sanguíneo fetal rápidamente con resonancia magnética y realizar retrospectivamente la corrección del movimiento y la activación cardíaca.
Resumen
La resonancia magnética (RM) es una herramienta importante para la evaluación clínica de la morfología cardiovascular y la función cardíaca. También es el estándar de atención reconocido para la cuantificación del flujo sanguíneo basado en la resonancia magnética de contraste de fase. Si bien tal medición del flujo sanguíneo ha sido posible en adultos durante décadas, los métodos para extender esta capacidad al flujo sanguíneo fetal solo se han desarrollado recientemente.
La cuantificación del flujo sanguíneo fetal en los vasos principales es importante para controlar patologías fetales como la cardiopatía congénita (CHD) y la restricción del crecimiento fetal (FGR). La cardiopatía coronaria provoca alteraciones en la estructura cardíaca y la vasculatura que cambian el curso de la sangre en el feto. En FGR, la ruta del flujo sanguíneo se altera a través de la dilatación de las derivaciones de tal manera que aumenta el suministro de sangre oxigenada al cerebro. La cuantificación del flujo sanguíneo permite evaluar la gravedad de la patología fetal, lo que a su vez permite un manejo adecuado del paciente en el útero y la planificación de la atención postnatal.
Los principales desafíos de aplicar la resonancia magnética de contraste de fase al feto humano incluyen el tamaño pequeño de los vasos sanguíneos, la alta frecuencia cardíaca fetal, la posible corrupción de los datos de resonancia magnética debido a la respiración materna, los movimientos fetales impredecibles y la falta de métodos convencionales de activación cardíaca para sincronizar la adquisición de datos. Aquí, describimos los desarrollos técnicos recientes de nuestro laboratorio que han permitido la cuantificación del flujo sanguíneo fetal utilizando resonancia magnética de contraste de fase, incluidos los avances en imágenes aceleradas, compensación de movimiento y activación cardíaca.
Introducción
La evaluación integral de la circulación fetal es necesaria para el seguimiento de patologías fetales como la restricción del crecimiento fetal (FGR) y la cardiopatía congénita (CHD)1,2,3. En el útero, el manejo del paciente y la planificación de la atención postnatal dependen de la gravedad de la patología fetal 4,5,6,7. La viabilidad de la cuantificación del flujo sanguíneo fetal con RM y sus aplicaciones en la evaluación de patologías fetales han sido demostradas recientemente 3,8,9. Sin embargo, el método de imagen enfrenta desafíos, como el aumento de los tiempos de imagen para lograr una alta resolución espaciotemporal, la falta de métodos de sincronización cardíaca y el movimiento fetal impredecible10.
La vasculatura fetal comprende estructuras pequeñas (~5 mm de diámetro para los vasos sanguíneos principales que comprenden la aorta descendente, el conducto arterial, la aorta ascendente, la arteria pulmonar principal y la vena cava superior11,12,13). Para resolver estas estructuras y cuantificar el flujo, se requieren imágenes a alta resolución espacial. Además, la frecuencia cardíaca fetal es aproximadamente el doble que la de un adulto. Por lo tanto, también se requiere una alta resolución temporal para resolver el movimiento cardíaco dinámico y el flujo sanguíneo a lo largo del ciclo cardíaco fetal. Las imágenes convencionales a esta alta resolución espaciotemporal requieren tiempos de adquisición relativamente largos. Para abordar este problema, se ha introducido la resonancia magnética fetal acelerada14,15,16. Brevemente, estas técnicas de aceleración implican submuestreo en el dominio de la frecuencia durante la adquisición de datos y la reconstrucción retrospectiva de alta fidelidad utilizando técnicas iterativas. Uno de estos enfoques es la reconstrucción de detección comprimida (CS), que permite la reconstrucción de imágenes a partir de datos muy submuestreados cuando la imagen reconstruida es escasa en un dominio conocido y los artefactos de submuestreo son incoherentes17.
El movimiento en las imágenes fetales presenta un gran desafío. La corrupción del movimiento puede surgir del movimiento respiratorio materno, el movimiento masivo materno o el movimiento fetal grueso. La respiración materna conduce a traducciones periódicas del feto, mientras que los movimientos fetales son más complejos. Los movimientos fetales pueden clasificarse como localizados o macroscópicos10,18. Los movimientos localizados implican el movimiento de sólo segmentos del cuerpo. Por lo general, duran alrededor de 10-14 s y su frecuencia aumenta con la gestación (~ 90 por hora a término)10. Estos movimientos generalmente causan pequeñas corrupciones y no afectan el área de interés de la imagen. Sin embargo, los movimientos fetales gruesos pueden conducir a una corrupción grave de la imagen con componentes de movimiento a través del plano. Estos movimientos son movimientos de todo el cuerpo mediados por la columna vertebral y duran entre 60 y 90 s.
Para evitar los artefactos del movimiento fetal, primero se toman medidas para minimizar los movimientos maternos. Las mujeres embarazadas se relajan más utilizando almohadas de apoyo en la cama del escáner y vestidas con batas cómodas y pueden tener a sus parejas presentes al lado del escáner para reducir la claustrofobia19,20. Para mitigar los efectos del movimiento respiratorio materno, los estudios han realizado exámenes de RM fetal bajo retención de la respiración materna21,22,23. Sin embargo, tales adquisiciones deben ser cortas (~ 15 s) dada la tolerancia reducida a la retención de la respiración de las sujetos embarazadas. Recientemente, se han introducido métodos retrospectivos de corrección de movimiento para la RM fetal14,15,16. Estos métodos rastrean el movimiento fetal utilizando kits de herramientas de registro y corrigen el movimiento o descartan partes no corregibles de los datos adquiridos.
Finalmente, las imágenes de RM cardíaca postnatal se adquieren convencionalmente mediante la activación del electrocardiograma (ECG) para sincronizar la adquisición de datos con el ciclo cardíaco. Sin gating, el movimiento cardíaco y el flujo pulsátil de todo el ciclo cardíaco se combinan, produciendo artefactos. Desafortunadamente, la señal del ECG fetal sufre de interferencia de la señal de ECG materna24 y distorsiones del campo magnético25. Por lo tanto, se han propuesto enfoques alternativos no invasivos para la activación cardíaca fetal, incluida la autoactivación, la activación optimizada métrica (MOG) y la activación por ultrasonido doppler21,26,27,28.
Como se describe en las siguientes secciones, nuestro enfoque de resonancia magnética para cuantificar el flujo sanguíneo fetal aprovecha un nuevo método de compuerta, MOG, desarrollado en nuestro laboratorio y combinado con la corrección de movimiento y la reconstrucción iterativa de adquisiciones aceleradas de resonancia magnética. El enfoque se basa en una tubería en un estudio publicado anteriormente14 y se compone de las siguientes cinco etapas: (1) adquisición del flujo sanguíneo fetal, (2) reconstrucciones en tiempo real, (3) corrección de movimiento, (4) activación cardíaca y (5) reconstrucciones cerradas.
Protocolo
Todas las imágenes por resonancia magnética se realizaron con el consentimiento informado de voluntarios como parte de un estudio aprobado por nuestra junta de ética de investigación institucional.
NOTA: Los métodos descritos a continuación se han utilizado en un sistema de resonancia magnética 3T. La adquisición se realiza utilizando una secuencia de resonancia magnética de contraste de fase radial. Esta secuencia se preparó modificando la trayectoria de lectura (para lograr un patrón estrellado) de la resonancia magnética de contraste de fase cartesiana del fabricante. Los protocolos de secuencia y muestra están disponibles bajo petición a través de nuestra plataforma de intercambio C2P. Todas las reconstrucciones de este trabajo se realizaron en una computadora de escritorio estándar con las siguientes especificaciones: memoria de 32 GB, procesador de 3.40 GHz con 8 núcleos y tarjeta gráfica de 2GB con 1024 núcleos de arquitectura de dispositivo unificado de cómputo (CUDA). La reconstrucción de imágenes se realizó en MATLAB. La transformada rápida de Fourier no uniforme (NUFFT)29 se realizó en la unidad de procesamiento de gráficos (GPU). Los parámetros de corrección de movimiento fueron calculados utilizando elastix30. La Figura 1 muestra el protocolo en orden cronológico, rastreando cómo se procesan las codificaciones de velocidad adquirida (codificadas por colores en la Figura 1) con imágenes representativas en cada etapa de la reconstrucción. El código de reconstrucción está disponible en https://github.com/datta-g/Fetal_PC_MRI. Si bien proporcionamos los pasos del protocolo aquí, la mayoría de estos pasos del algoritmo están automatizados en nuestra canalización.
1. Posicionamiento de asignaturas y exámenes de localización
- Ayude a la madre a posicionarse en la mesa de resonancia magnética en su posición cómoda preferida, generalmente en posición supina o decúbito lateral, para el examen de resonancia magnética.
- Coloque la bobina cardíaca sobre la región abdominal de la madre.
- Cargue la tabla de resonancia magnética en el orificio del imán y notifique a la madre que la exploración está a punto de comenzar.
- Realice un examen localizador para localizar el cuerpo fetal (resolución: 0.9 x 0.9 x 10 mm3, TE/TR: 5.0/15.0 ms, FOV: 450 x 450 mm2, cortes: 6).
- Realice un examen de localización refinado para localizar la vasculatura fetal con el grupo de cortes centrado en el corazón fetal (resolución 1.1 x 1.1 x 6.0 mm3, TE/TR: 2.69/1335.4 ms, FOV: 350 x 350 mm2, cortes: 10, orientación: axial al feto).
- Repita los localizadores refinados con orientaciones sagital y coronal para una visión más clara de los vasos fetales.
- Repita los localizadores refinados en casos de movimiento fetal grueso.
2. Adquisición de datos de flujo sanguíneo fetal
- Localice los vasos fetales mediante los exámenes del localizador. Por ejemplo, la aorta descendente es un vaso largo y recto cerca de la columna vertebral en los planos sagitales. La aorta ascendente y las arterias pulmonares principales se pueden identificar como vasos que salen de los ventrículos izquierdo y derecho, respectivamente. El conducto arterioso se puede rastrear como un segmento aguas abajo de la arteria pulmonar principal proximal a la aorta descendente. La vena cava superior se puede identificar a partir de planos axiales cerca de la base del corazón fetal como el vaso adyacente a la aorta ascendente.
- Prescriba una rebanada perpendicular al eje del vaso fetal de interés. Gire y mueva la guía de corte en la computadora de la consola de resonancia magnética de modo que se cruce perpendicularmente con el vaso objetivo.
- Ajuste los parámetros de escaneo (tipo de adquisición: resonancia magnética de contraste de fase radial, resolución: 1,3 x 1,3 x 5,0 mm 3, tiempo de eco (TE)/tiempo de repetición (TR):3,25/5,75 ms, campo de visión (FOV): 240 x 240 mm2, corte: 1, codificación de velocidad: 100-150 cm/s dependiendo del recipiente de interés, dirección de codificación de velocidad: plano pasante, vistas radiales: 1500 por codificación, respiración libre).
- Ejecute el escaneo y verifique la prescripción en función de la reconstrucción inicial con promedio de tiempo realizada y mostrada en la computadora de consola de MRI. Repita el localizador y las exploraciones de contraste de fase si el vaso objetivo está ausente o no es identificable en la reconstrucción inicial. Los datos brutos adquiridos se representan en el esquema de la Figura 1A con la velocidad compensada y a través de adquisiciones de planos codificadas por colores como rojo y azul, respectivamente.
- Repita la adquisición de datos del flujo sanguíneo fetal para cada vaso sanguíneo objetivo.
NOTA: Los datos sin procesar adquiridos (formato: archivos DAT) deben transferirse para la reconstrucción sin conexión. Por ejemplo, en los escáneres Siemens, esto se puede realizar ejecutando 'twix'. Se hace clic con el botón derecho en los datos sin procesar adquiridos de la lista de adquisiciones y se elige "copiar archivo RAID total".
3. Corrección de movimiento de las mediciones fetales
- Reconstruir series en tiempo real (resolución temporal: 370 ms, vistas radiales: 64) a partir de los datos adquiridos utilizando CS con 15 iteraciones de una optimización de descenso de gradiente conjugado que explota la variación total espacial (STV, peso: 0.008) y la variación total temporal (TTV, peso: 0.08) regularización como se representa en el esquema de la Figura 1B.
- Seleccione una región de interés (ROI) que abarque el buque de interés de esta primera reconstrucción en tiempo real utilizando una interfaz gráfica de usuario desarrollada en MATLAB. En este paso, el usuario debe dibujar un contorno que encierre la anatomía fetal, como los grandes vasos objetivo o el corazón fetal.
- Realice un seguimiento del movimiento del cuerpo rígido con elastix 30 (basado en información mutua normalizada con parámetros optimizados empíricamente: 4 niveles piramidales,300 iteraciones y transformaciones traslacionales).
- Rechazar fotogramas en tiempo real rastreados que comparten información mutua baja (MI) con todas las demás tramas (donde MI es menos de 1.5x el rango intercuartil del IM medio). Se considera que estos marcos se representan a través del movimiento plano o el movimiento fetal grueso.
- Utilice los datos de resonancia magnética correspondientes a la serie más larga de fotogramas continuos en tiempo real (sin espacios) de los fotogramas restantes como el período de reposo utilizado para la reconstrucción posterior.
- Interpolar los parámetros de corrección de movimiento traslacional desde la resolución temporal de la serie en tiempo real (370 ms) hasta el TR de la adquisición en reposo (5,75 ms).
- Aplique parámetros interpolados al período de reposo definido de los datos de MRI modulando la fase como en:
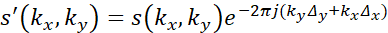
donde s' son los datos corregidos por movimiento, k x y k y son las coordenadas en el espacio k, s son los datos no corregidos adquiridos, Δ x y Δ y son los desplazamientos rastreados en el espacio, y j representa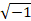 .
.
NOTA: Todos los valores numéricos de los coeficientes de regularización en este trabajo se optimizaron en experimentos anteriores. Esto se logró utilizando una búsqueda en cuadrícula de fuerza bruta para encontrar los coeficientes de regularización que minimizaron el error entre las reconstrucciones de un conjunto de datos de referencia fetal altamente muestreado y los casos retrospectivamente submuestreados del mismo conjunto de datos.
4. Resolver la frecuencia cardíaca fetal
- Reconstruya una segunda serie de imágenes en tiempo real a una resolución temporal más alta (resolución temporal: 46 ms, vistas radiales: 8) utilizando los datos adquiridos usando CS, nuevamente con 15 iteraciones de una optimización de descenso de gradiente conjugado con regularización STV (peso: 0.008) y TTV (peso: 0.08) como se representa en el esquema de la Figura 1C.
- Vuelva a seleccionar un ROI que abarque el vaso fetal de interés.
- Ejecute MOG multiparamétrico en la serie en tiempo real para derivar la frecuencia cardíaca fetal dependiente del tiempo.
- Bin motion corrigió los datos de resonancia magnética en 15 fases cardíacas utilizando la forma de onda de frecuencia cardíaca derivada. En este paso, los límites temporales de las fases cardíacas se calculan utilizando la frecuencia cardíaca del paso anterior. Por ejemplo, los límites para la i-ésima fase en el k-ésimo latido del corazón están dados por:
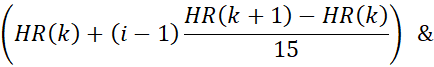
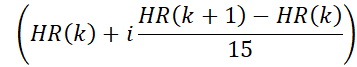
donde HR(K) es el momento en el que se produce el k-ésimo latido del corazón. La marca de tiempo de la n ésima adquisición radial viene dada por (n x TR). Los datos con marcas de tiempo que caen dentro de los límites de una fase cardíaca se asignan a esa fase.
NOTA: MOG es una técnica de compuerta26 que comprende la agrupación iterativa de los datos adquiridos basada en un modelo de frecuencia cardíaca fetal multiparamétrica para crear imágenes CINE que optimicen una métrica de imagen en una región de interés.
5. Reconstrucción de los CINEs fetales
- Reconstruir los CINEs de flujo fetal utilizando los datos de RM corregidos por movimiento binned y CS con 10 iteraciones de una optimización de descenso de gradiente conjugado con regularización de STV (peso: 0.025) y TTV (peso: 0.01). En este paso se producen dos CINE: uno para la adquisición compensada por flujo, CFC, y otro con los datos codificados por flujo, CFE, como se representa en el esquema de la Figura 1D.
- Calcule la imagen de velocidad dada por la fase del producto elemental de CFE y el conjugado complejo de CFC.
- Aplique la corrección de fase de fondo31 para corregir los efectos de corrientes de Foucault. Brevemente, en este paso automático, se ajusta un plano a la fase de tejidos fetales y maternos estáticos. La corrección se realiza restando el plano de la fase sensible a la velocidad calculada en 4.2.
- Escribir datos reconstruidos en archivos DICOM.
- Cargue DICOM en software de análisis de flujo, como Segment v2.232.
- Dibuje un ROI que abarque la luz del vaso sanguíneo de interés utilizando las imágenes anatómicas y sensibles a la velocidad.
- Propague el ROI a todas las fases cardíacas y corrija los cambios en el diámetro del vaso.
- Registre las mediciones de flujo.
Resultados
En general, los exámenes de RM de fase del flujo se dirigen a seis vasos fetales principales: la aorta descendente, la aorta ascendente, la arteria pulmonar principal, el conducto arterial, la vena cava superior y la vena umbilical. Esos vasos son de interés para el clínico, ya que a menudo están implicados en CHD y FGR, influyendo en la distribución de la sangre en todo el feto9. Una duración típica de la exploración con la resonancia magnética de contraste de fase radial es de 17 s por ...
Discusión
Este método permite la medición no invasiva del flujo sanguíneo en grandes vasos fetales humanos y permite la corrección retrospectiva del movimiento y la activación cardíaca mediante el uso de técnicas de reconstrucción iterativa. La cuantificación del flujo sanguíneo fetal se ha realizado con resonancia magnética en los últimos 1,3,8,9. Estos estud...
Divulgaciones
Ninguno.
Agradecimientos
Ninguno.
Materiales
| Name | Company | Catalog Number | Comments |
| elastix | Image Sciences Institute, University Medical Center Utrecht | Image registration software | |
| Geforce GTX 960 | Nvidia | 04G-P4-3967-KR | |
| gpuNUFFT | CAI²R | Non-uniform fast Fourier transform | |
| MAGNETOM Prisma | Siemens | 10849583 | |
| MATLAB | MathWorks | ||
| Radial Phase Contrast MRI sequence | Trajectory modification of manufacturer's Cartesian Phase Contrast sequence | ||
| Segment | Medvisio | Data analysis | |
| VENGEANCE | Corsair | LPX DDR4-2666 |
Referencias
- Zhu, M. Y., et al. The hemodynamics of late-onset intrauterine growth restriction by MRI. American Journal of Obstetrics and Gynecology. 214 (3), 1-17 (2016).
- Zhu, M. Y., Jaeggi, E., Roy, C. W., Macgowan, C. K., Seed, M. Reduced combined ventricular output and increased oxygen extraction fraction in a fetus with complete heart block demonstrated by MRI. HeartRhythm Case Reports. 2 (2), 164-168 (2016).
- Sun, L., et al. Reduced Fetal Cerebral Oxygen Consumption is Associated With Smaller Brain Size in Fetuses With Congenital Heart Disease. Circulation. 131 (15), 1313-1323 (2015).
- Freud, L. R., et al. Fetal aortic valvuloplasty for evolving hypoplastic left heart syndrome: postnatal outcomes of the first 100 patients. Circulation. 130 (8), 638-645 (2014).
- Peleg, D., Kennedy, C. M., Hunter, S. K. Intrauterine growth restriction: identification and management. American Family Physician. 58 (2), 453-467 (1998).
- Krishna, U., Bhalerao, S. Placental Insufficiency and Fetal Growth Restriction. Journal of Obstetrics and Gynaecology of India. 61 (5), 505-511 (2011).
- Seravalli, V., Miller, J. L., Block-Abraham, D., Baschat, A. A. Ductus venosus Doppler in the assessment of fetal cardiovascular health: an updated practical approach. Acta Obstetricia et Gynecologica Scandinavica. 95 (6), 635-644 (2016).
- Seed, M., et al. Feasibility of quantification of the distribution of blood flow in the normal human fetal circulation using CMR: a cross-sectional study. Journal of Cardiovascular Magnetic Resonance. 14 (1), 79 (2012).
- Prsa, M., et al. Reference ranges of blood flow in the major vessels of the normal human fetal circulation at term by phase-contrast magnetic resonance imaging. Circulation. Cardiovascular Imaging. 7 (4), 663-670 (2014).
- Piontelli, A. . Development of Normal Fetal Movements: The Last 15 Weeks of Gestation. , (2015).
- Cartier, M., et al. The normal diameter of the fetal aorta and pulmonary artery: echocardiographic evaluation in utero. American Journal of Roentgenology. 149 (5), 1003-1007 (1987).
- Ruano, R., de Fátima Yukie Maeda, M., Niigaki, J. I., Zugaib, M. Pulmonary artery diameters in healthy fetuses from 19 to 40 weeks' gestation. Journal of Ultrasound in Medicine. 26 (3), 309-316 (2007).
- Nowak, D., Kozłowska, H., Żurada, A., Gielecki, J. Diameter of the ductus arteriosus as a predictor of patent ductus arteriosus (PDA). Central European Journal of Medicine. 6 (4), 418-424 (2011).
- Goolaub, D. S., et al. Multidimensional fetal flow imaging with cardiovascular magnetic resonance: a feasibility study. Journal of Cardiovascular Magnetic Resonance. 20 (1), 77 (2018).
- Roy, C. W., Seed, M., Kingdom, J. C., Macgowan, C. K. Motion compensated cine CMR of the fetal heart using radial undersampling and compressed sensing. Journal of Cardiovascular Magnetic Resonance. 19 (1), 29 (2017).
- van Amerom, J. F. P., et al. Fetal cardiac cine imaging using highly accelerated dynamic MRI with retrospective motion correction and outlier rejection. Magnetic Resonance in Medicine. 79 (1), 327-338 (2018).
- Lustig, M., Donoho, D., Pauly, J. M. Sparse MRI: The application of compressed sensing for rapid MR imaging. Magnetic Resonance in Medicine. 58 (6), 1182-1195 (2007).
- Edwards, D. D., Edwards, J. S. Fetal movement: development and time course. Science. 169 (3940), 95-97 (1970).
- Malamateniou, C., et al. Motion-Compensation Techniques in Neonatal and Fetal MR Imaging. American Journal of Neuroradiology. 34 (6), 1124-1136 (2013).
- Rutherford, M., et al. MR imaging methods for assessing fetal brain development. Developmental Neurobiology. 68 (6), 700-711 (2008).
- Haris, K., et al. Self-gated fetal cardiac MRI with tiny golden angle iGRASP: A feasibility study: Self-Gated Fetal Cardiac MRI with iGRASP. Journal of Magnetic Resonance Imaging. 46 (1), 207-217 (2017).
- Glenn, O. A. MR imaging of the fetal brain. Pediatric Radiology. 40 (1), 68-81 (2010).
- Rodríguez-Soto, A. E., et al. MRI Quantification of Human Fetal O2 Delivery Rate in the Second and Third Trimesters of Pregnancy. Magnetic Resonance in Medicine. 80 (3), 1148-1157 (2018).
- Sameni, R., Clifford, G. D. A Review of Fetal ECG Signal Processing; Issues and Promising Directions. The Open Pacing, Electrophysiology & Therapy Journal. 3, 4-20 (2010).
- Millis, R. Advances in Electrocardiograms: Methods and Analysis. BoD - Books on Demand. , (2012).
- Jansz, M. S., et al. Metric optimized gating for fetal cardiac MRI. Magnetic Resonance in Medicine. 64 (5), 1304-1314 (2010).
- Yamamura, J., et al. Cardiac MRI of the fetal heart using a novel triggering method: initial results in an animal model. Journal of Magnetic Resonance Imaging: JMRI. 35 (5), 1071-1076 (2012).
- Larson, A. C., et al. Self-gated cardiac cine MRI. Magnetic Resonance in Medicine. 51 (1), 93-102 (2004).
- Knoll, F., Schwarzl, A., Diwoky, C., Sodickson, D. K. gpuNUFFT-An open source GPU library for 3D regridding with direct Matlab interface. Proceedings of the 22nd Annual Meeting of ISMRM. , (2014).
- Klein, S., Staring, M., Murphy, K., Viergever, M. A., Pluim, J. P. W. elastix: a toolbox for intensity-based medical image registration. IEEE Transactions on Medical Imaging. 29 (1), 196-205 (2010).
- Walker, P. G., et al. Semiautomated method for noise reduction and background phase error correction in MR phase velocity data. Journal of Magnetic Resonance Imaging. 3 (3), 521-530 (1993).
- Heiberg, E., et al. Design and validation of Segment - freely available software for cardiovascular image analysis. BMC Medical Imaging. 10 (1), 1 (2010).
- Inder, T. E., Volpe, J. J. Chapter 17 - Intrauterine, Intrapartum Assessments in the Term Infant. Volpe's Neurology of the Newborn (Sixth Edition). , 458-483 (2018).
- Pelc, N. J., Herfkens, R. J., Shimakawa, A., Enzmann, D. R. Phase contrast cine magnetic resonance imaging. Magnetic Resonance Quarterly. 7 (4), 229-254 (1991).
- Steeden, J. A., Atkinson, D., Hansen, M. S., Taylor, A. M., Muthurangu, V. Rapid flow assessment of congenital heart disease with high-spatiotemporal-resolution gated spiral phase-contrast MR imaging. Radiology. 260 (1), 79-87 (2011).
- Kowalik, G. T., Knight, D., Steeden, J. A., Muthurangu, V. Perturbed spiral real-time phase-contrast MR with compressive sensing reconstruction for assessment of flow in children. Magnetic Resonance in Medicine. 83 (6), 2077-2091 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados