È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Quantificazione del flusso sanguigno fetale umano con risonanza magnetica e compensazione del movimento
In questo articolo
Riepilogo
Qui presentiamo un protocollo per misurare rapidamente il flusso sanguigno fetale con la risonanza magnetica ed eseguire retrospettivamente la correzione del movimento e il gating cardiaco.
Abstract
La risonanza magnetica (MRI) è uno strumento importante per la valutazione clinica della morfologia cardiovascolare e della funzione cardiaca. È anche lo standard di cura riconosciuto per la quantificazione del flusso sanguigno basato sulla risonanza magnetica a contrasto di fase. Mentre tale misurazione del flusso sanguigno è stata possibile negli adulti per decenni, i metodi per estendere questa capacità al flusso sanguigno fetale sono stati sviluppati solo di recente.
La quantificazione del flusso sanguigno fetale nei vasi principali è importante per il monitoraggio delle patologie fetali come la cardiopatia congenita (CHD) e la restrizione della crescita fetale (FGR). CHD provoca alterazioni nella struttura cardiaca e vascolare che cambiano il corso del sangue nel feto. In FGR, il percorso del flusso sanguigno viene alterato attraverso la dilatazione degli shunt in modo tale che l'apporto di sangue ossigenato al cervello sia aumentato. La quantificazione del flusso sanguigno consente di valutare la gravità della patologia fetale, che a sua volta consente un'adeguata gestione del paziente in utero e la pianificazione per l'assistenza postnatale.
Le sfide principali dell'applicazione della risonanza magnetica a contrasto di fase al feto umano includono piccole dimensioni dei vasi sanguigni, alta frequenza cardiaca fetale, potenziale corruzione dei dati MRI dovuta alla respirazione materna, movimenti fetali imprevedibili e mancanza di metodi di gating cardiaco convenzionali per sincronizzare l'acquisizione dei dati. Qui, descriviamo i recenti sviluppi tecnici del nostro laboratorio che hanno permesso la quantificazione del flusso sanguigno fetale utilizzando la risonanza magnetica a contrasto di fase, compresi i progressi nell'imaging accelerato, nella compensazione del movimento e nel gating cardiaco.
Introduzione
Una valutazione completa della circolazione fetale è necessaria per monitorare patologie fetali come la restrizione della crescita fetale (FGR) e la cardiopatia congenita (CHD)1,2,3. In utero, la gestione del paziente e la pianificazione per l'assistenza postnatale dipendono dalla gravità della patologia fetale 4,5,6,7. La fattibilità della quantificazione del flusso sanguigno fetale con la risonanza magnetica e le sue applicazioni nella valutazione delle patologie fetali sono state recentemente dimostrate 3,8,9. Il metodo di imaging, tuttavia, deve affrontare sfide, come l'aumento dei tempi di imaging per ottenere un'elevata risoluzione spaziotemporale, la mancanza di metodi di sincronizzazione cardiaca e il movimento fetale imprevedibile10.
La vascolarizzazione fetale comprende piccole strutture (~ 5 mm di diametro per i principali vasi sanguigni che comprendono l'aorta discendente, il dotto arterioso, l'aorta ascendente, l'arteria polmonare principale e la vena cava superiore11,12,13). Per risolvere queste strutture e quantificare il flusso, è necessaria l'imaging ad alta risoluzione spaziale. Inoltre, la frequenza cardiaca fetale è circa il doppio di quella di un adulto. È quindi necessaria anche un'elevata risoluzione temporale per risolvere il movimento cardiaco dinamico e il flusso sanguigno attraverso il ciclo cardiaco fetale. L'imaging convenzionale a questa elevata risoluzione spaziotemporale richiede tempi di acquisizione relativamente lunghi. Per risolvere questo problema, è stata introdotta la risonanza magnetica fetale accelerata14,15,16. In breve, queste tecniche di accelerazione comportano il sottocampionamento nel dominio della frequenza durante l'acquisizione dei dati e la ricostruzione retrospettiva ad alta fedeltà utilizzando tecniche iterative. Uno di questi approcci è la ricostruzione del rilevamento compresso (CS), che consente la ricostruzione di immagini da dati fortemente sottocampionati quando l'immagine ricostruita è sparsa in un dominio noto e gli artefatti di sottocampionamento sono incoerenti17.
Il movimento nell'imaging fetale rappresenta una grande sfida. La corruzione del movimento può derivare dal movimento respiratorio materno, dal movimento di massa materno o dal movimento fetale grossolano. La respirazione materna porta a traduzioni periodiche del feto, mentre i movimenti fetali sono più complessi. I movimenti fetali possono essere classificati come localizzati o lordi10,18. I movimenti localizzati comportano il movimento di soli segmenti del corpo. In genere durano circa 10-14 s e la loro frequenza aumenta con la gestazione (~90 all'ora a termine)10. Questi movimenti generalmente causano piccole corruzioni e non influiscono sull'area di interesse dell'imaging. Tuttavia, i movimenti fetali grossolani possono portare a gravi danni dell'immagine con componenti di movimento del piano passante. Questi movimenti sono movimenti di tutto il corpo mediati dalla colonna vertebrale e durano per 60-90 s.
Per evitare artefatti dal movimento fetale, vengono prima prese misure per ridurre al minimo i movimenti materni. Le donne incinte sono rese più rilassate usando cuscini di supporto sul letto dello scanner e vestite con abiti comodi e possono avere i loro partner presenti accanto allo scanner per ridurre la claustrofobia19,20. Per mitigare gli effetti del movimento respiratorio materno, gli studi hanno eseguito esami MR fetali in apnealematerna 21,22,23. Tuttavia, tali acquisizioni devono essere brevi (~15 s) data la ridotta tolleranza al respiro delle soggetti gravide. Recentemente, sono stati introdotti metodi di correzione retrospettiva del movimento per la risonanza magnetica fetale14,15,16. Questi metodi tracciano il movimento fetale utilizzando toolkit di registrazione e correggono il movimento o scartano porzioni non correggibili dei dati acquisiti.
Infine, le immagini di RM cardiaca postnatale vengono acquisite convenzionalmente utilizzando il gating dell'elettrocardiogramma (ECG) per sincronizzare l'acquisizione dei dati con il ciclo cardiaco. Senza gating, il movimento cardiaco e il flusso pulsatile da tutto il ciclo cardiaco sono combinati, producendo artefatti. Sfortunatamente, il segnale ECG fetale soffre di interferenze dal segnale ECG materno24 e distorsioni dal campo magnetico25. Pertanto, sono stati proposti approcci alternativi non invasivi al gating cardiaco fetale, tra cui self-gating, gating metrico ottimizzato (MOG) e gating ecografico doppler21,26,27,28.
Come descritto nelle sezioni seguenti, il nostro approccio MRI per quantificare il flusso sanguigno fetale sfrutta un nuovo metodo di gating, MOG, sviluppato nel nostro laboratorio e combinato con la correzione del movimento e la ricostruzione iterativa delle acquisizioni MRI accelerate. L'approccio si basa su una pipeline in uno studio precedentemente pubblicato14 ed è composto dalle seguenti cinque fasi: (1) acquisizione del flusso sanguigno fetale, (2) ricostruzioni in tempo reale, (3) correzione del movimento, (4) gating cardiaco e (5) ricostruzioni gated.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le scansioni MRI sono state eseguite con il consenso informato dei volontari come parte di uno studio approvato dal nostro comitato etico di ricerca istituzionale.
NOTA: I metodi descritti di seguito sono stati utilizzati su un sistema di risonanza magnetica 3T. L'acquisizione viene eseguita utilizzando una sequenza MRI a contrasto di fase radiale. Questa sequenza è stata preparata modificando la traiettoria di lettura (per ottenere un modello stellato) della risonanza magnetica a contrasto di fase cartesiana del produttore. I protocolli di sequenza e campione sono disponibili su richiesta attraverso la nostra piattaforma di scambio C2P. Tutte le ricostruzioni in questo lavoro sono state eseguite su un computer desktop standard con le seguenti specifiche: 32 GB di memoria, processore da 3,40 GHz con 8 core e scheda grafica da 2 GB con 1024 core CUDA (Compute Unified Device Architecture). La ricostruzione dell'immagine è stata eseguita su MATLAB. La trasformata di Fourier veloce non uniforme (NUFFT)29 è stata eseguita sull'unità di elaborazione grafica (GPU). I parametri di correzione del movimento sono stati calcolati utilizzando elastix30. La Figura 1 illustra il protocollo in ordine cronologico, tracciando il modo in cui le codifiche di velocità acquisite (codificate a colori nella Figura 1) vengono elaborate con immagini rappresentative in ogni fase della ricostruzione. Il codice di ricostruzione è disponibile all'indirizzo https://github.com/datta-g/Fetal_PC_MRI. Mentre forniamo i passaggi nel protocollo qui, la maggior parte di questi passaggi dell'algoritmo sono automatizzati nella nostra pipeline.
1. Posizionamento del soggetto ed esami di localizzazione
- Aiutare la madre a posizionarsi sul tavolo della risonanza magnetica nella sua posizione comoda preferita, di solito posizioni di decubito supino o laterale, per l'esame MRI.
- Posizionare la bobina cardiaca sulla regione addominale della madre.
- Caricare il tavolo MRI nel foro del magnete e informare la madre che la scansione sta per iniziare.
- Eseguire un esame localizzatore per localizzare il corpo fetale (risoluzione: 0,9 x 0,9 x 10 mm3, TE/TR: 5,0/15,0 ms, FOV: 450 x 450 mm2, fette: 6).
- Eseguire un esame localizzatore raffinato per localizzare la vascolarizzazione fetale con il gruppo fetta centrato sul cuore fetale (risoluzione 1,1 x 1,1 x 6,0 mm3, TE / TR: 2,69 / 1335,4 ms, FOV: 350 x 350 mm2, fette: 10, orientamento: assiale al feto).
- Ripetere i localizzatori raffinati con orientamenti sagittali e coronali per una visione più chiara dei vasi fetali.
- Ripetere i localizzatori raffinati in caso di movimento fetale grossolano.
2. Acquisizione dei dati sul flusso sanguigno fetale
- Localizzare i vasi fetali utilizzando gli esami localizzatori. Ad esempio, l'aorta discendente è un lungo vaso dritto vicino alla colonna vertebrale nei piani sagittali. L'aorta ascendente e le principali arterie polmonari possono essere identificate come vasi che lasciano rispettivamente i ventricoli sinistro e destro. Il dotto arterioso può essere tracciato come un segmento a valle dell'arteria polmonare principale prossimale all'aorta discendente. La vena cava superiore può essere identificata dai piani assiali vicino alla base del cuore fetale come il vaso adiacente all'aorta ascendente.
- Prescrivere una fetta perpendicolare all'asse del vaso fetale di interesse. Ruotare e spostare la linea guida della sezione sul computer della console MRI in modo che intersechi perpendicolarmente il recipiente bersaglio.
- Impostare i parametri di scansione (tipo di acquisizione: risonanza magnetica a contrasto di fase radiale, risoluzione: 1,3 x 1,3 x 5,0 mm 3, tempo di eco (TE)/ tempo di ripetizione (TR):3,25/5,75 ms, campo visivo (FOV): 240 x 240 mm2, fetta: 1, codifica della velocità: 100-150 cm/s a seconda del recipiente di interesse, direzione di codifica della velocità: piano passante, viste radiali: 1500 per codifica, respirazione libera).
- Eseguire la scansione e verificare la prescrizione in base alla ricostruzione mediata nel tempo iniziale eseguita e visualizzata sul computer della console MRI. Ripetere le scansioni del localizzatore e del contrasto di fase se la nave bersaglio è assente o non identificabile dalla ricostruzione iniziale. I dati grezzi acquisiti sono rappresentati nello schema nella Figura 1A con la velocità compensata e attraverso acquisizioni piane codificate a colori come rosso e blu, rispettivamente.
- Ripetere l'acquisizione dei dati del flusso sanguigno fetale per ciascun vaso sanguigno target.
NOTA: i dati grezzi acquisiti (formato: file DAT) devono essere trasferiti per la ricostruzione offline. Ad esempio, sugli scanner Siemens, questo può essere eseguito eseguendo 'twix'. I dati grezzi acquisiti vengono cliccati con il pulsante destro del mouse dall'elenco delle acquisizioni e viene scelto "copia file raid totale".
3. Correzione del movimento delle misurazioni fetali
- Ricostruire serie real-time (risoluzione temporale: 370 ms, viste radiali: 64) dai dati acquisiti utilizzando CS con 15 iterazioni di un'ottimizzazione della discesa del gradiente coniugato sfruttando la variazione totale spaziale (STV, peso: 0,008) e la variazione totale temporale (TTV, peso: 0,08) regolarizzazione come rappresentato dallo schema in Figura 1B.
- Seleziona una regione di interesse (ROI) che comprenda il vaso di interesse da questa prima ricostruzione in tempo reale utilizzando un'interfaccia utente grafica sviluppata in MATLAB. In questo passaggio, l'utente deve disegnare un contorno che racchiude l'anatomia fetale, come i grandi vasi bersaglio o il cuore fetale.
- Esegui il tracciamento del movimento del corpo rigido con elastix 30 (basato su informazioni reciproche normalizzate con parametri ottimizzati empiricamente: 4 livelli piramidali,300 iterazioni e trasformazioni traslazionali).
- Rifiuta i fotogrammi in tempo reale tracciati che condividono informazioni reciproche (MI) basse con tutti gli altri frame (in cui MI è inferiore a 1,5 volte l'intervallo interquartile dall'MI medio). Si ritiene che questi fotogrammi siano rappresentati attraverso il movimento piano o il movimento fetale grossolano.
- Utilizzare i dati MRI corrispondenti alla serie più lunga di fotogrammi continui in tempo reale (senza spazi vuoti) dai fotogrammi rimanenti come periodo di quiescenza utilizzato per ulteriori ricostruizioni.
- Interpolare i parametri di correzione del moto traslazionale dalla risoluzione temporale della serie in tempo reale (370 ms) al TR dell'acquisizione quiescente (5,75 ms).
- Applicare parametri interpolati al periodo di quiescenza definito dei dati MRI modulando la fase come in:
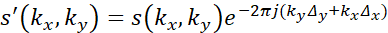
dove s' sono i dati corretti dal moto, k x e k y sono le coordinate nel k-spazio, s sono i dati acquisiti non corretti, Δ x e Δy sono gli spostamenti tracciati nello spazio e j rappresenta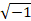 .
.
NOTA: Tutti i valori numerici dei coefficienti di regolarizzazione in questo lavoro sono stati ottimizzati in esperimenti precedenti. Ciò è stato realizzato utilizzando una ricerca a griglia a forza bruta per trovare i coefficienti di regolarizzazione che hanno ridotto al minimo l'errore tra le ricostruzioni di un set di dati di riferimento fetale altamente campionato e i casi retrospettivamente sottocampionati dallo stesso set di dati.
4. Risolvere la frequenza cardiaca fetale
- Ricostruire una seconda serie di immagini in tempo reale ad una risoluzione temporale più elevata (risoluzione temporale: 46 ms, viste radiali: 8) utilizzando i dati acquisiti utilizzando CS, sempre con 15 iterazioni di un'ottimizzazione della discesa del gradiente coniugato con regolarizzazione STV (peso: 0,008) e TTV (peso: 0,08) come rappresentato dallo schema in Figura 1C.
- Riseleziona un ROI che comprenda il vaso fetale di interesse.
- Eseguire MOG multiparametrici sulla serie in tempo reale per ricavare la frequenza cardiaca fetale dipendente dal tempo.
- Il movimento del contenitore ha corretto i dati della risonanza magnetica in 15 fasi cardiache utilizzando la forma d'onda della frequenza cardiaca derivata. In questa fase, i limiti temporali delle fasi cardiache vengono calcolati utilizzando la frequenza cardiaca del passaggio precedente. Ad esempio, i limiti per l'i-esima fase nel kesimo battito cardiaco sono dati da:
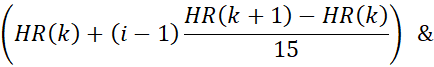
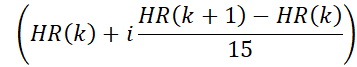
dove HR(K) è il momento in cui si verifica il kesimo battito cardiaco. Il timestamp dell'n-esima acquisizione radiale è dato da (n x TR). I dati con timestamp che rientrano nei limiti di una fase cardiaca vengono assegnati a quella fase.
NOTA: MOG è una tecnica di gating26 che comprende il binning iterativo dei dati acquisiti sulla base di un modello di frequenza cardiaca fetale multiparametrico per creare immagini CINE che ottimizzano una metrica dell'immagine su una regione di interesse.
5. Ricostruzione di CINE fetali
- Ricostruire le CCINE del flusso fetale utilizzando i dati MRI e CS corretti dal movimento binned con 10 iterazioni di un'ottimizzazione della discesa del gradiente coniugato con regolarizzazione STV (peso: 0,025) e TTV (peso: 0,01). In questa fase vengono prodotti due CINE: uno per l'acquisizione con compensazione del flusso, CFC, e uno con i dati codificati del flusso, CFE, come rappresentato nello schema nella Figura 1D.
- Calcolare l'immagine della velocità data dalla fase del prodotto elementare di CFE e dal complesso coniugato di CFC.
- Applicare la correzione di fase di fondo31 per correggere gli effetti delle correnti parassite. In breve, in questo passaggio automatico, un piano viene adattato alla fase dei tessuti fetali e materni statici. La correzione viene eseguita sottraendo il piano dalla fase sensibile alla velocità calcolata in 4.2.
- Scrivere dati ricostruiti in file DICOM.
- Caricare DICOM in software di analisi di flusso, come Segment v2.232.
- Disegna un ROI che comprenda il lume del vaso sanguigno di interesse utilizzando le immagini anatomiche e sensibili alla velocità.
- Propagare il ROI a tutte le fasi cardiache e correggere i cambiamenti nel diametro del vaso.
- Registrare le misurazioni del flusso.
Access restricted. Please log in or start a trial to view this content.
Risultati
In generale, gli esami di fase MRI del flusso mirano a sei vasi fetali principali: l'aorta discendente, l'aorta ascendente, l'arteria polmonare principale, il dotto arterioso, la vena cava superiore e la vena ombelicale. Questi vasi sono di interesse per il clinico in quanto sono spesso implicati in CHD e FGR, influenzando la distribuzione del sangue in tutto il feto9. Una durata tipica della scansione con la risonanza magnetica a contrasto di fase radiale è di 17 s per vaso, in modo tale che le ...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo metodo consente la misurazione non invasiva del flusso sanguigno nei grandi vasi fetali umani e consente la correzione retrospettiva del movimento e il gating cardiaco facendo uso di tecniche di ricostruzione iterativa. La quantificazione del flusso sanguigno fetale è stata eseguita con la risonanza magnetica negli ultimi 1,3,8,9. Questi studi avevano un...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Nessuno.
Riconoscimenti
Nessuno.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| elastix | Image Sciences Institute, University Medical Center Utrecht | Image registration software | |
| Geforce GTX 960 | Nvidia | 04G-P4-3967-KR | |
| gpuNUFFT | CAI²R | Non-uniform fast Fourier transform | |
| MAGNETOM Prisma | Siemens | 10849583 | |
| MATLAB | MathWorks | ||
| Radial Phase Contrast MRI sequence | Trajectory modification of manufacturer's Cartesian Phase Contrast sequence | ||
| Segment | Medvisio | Data analysis | |
| VENGEANCE | Corsair | LPX DDR4-2666 |
Riferimenti
- Zhu, M. Y., et al. The hemodynamics of late-onset intrauterine growth restriction by MRI. American Journal of Obstetrics and Gynecology. 214 (3), 1-17 (2016).
- Zhu, M. Y., Jaeggi, E., Roy, C. W., Macgowan, C. K., Seed, M. Reduced combined ventricular output and increased oxygen extraction fraction in a fetus with complete heart block demonstrated by MRI. HeartRhythm Case Reports. 2 (2), 164-168 (2016).
- Sun, L., et al. Reduced Fetal Cerebral Oxygen Consumption is Associated With Smaller Brain Size in Fetuses With Congenital Heart Disease. Circulation. 131 (15), 1313-1323 (2015).
- Freud, L. R., et al. Fetal aortic valvuloplasty for evolving hypoplastic left heart syndrome: postnatal outcomes of the first 100 patients. Circulation. 130 (8), 638-645 (2014).
- Peleg, D., Kennedy, C. M., Hunter, S. K. Intrauterine growth restriction: identification and management. American Family Physician. 58 (2), 453-467 (1998).
- Krishna, U., Bhalerao, S. Placental Insufficiency and Fetal Growth Restriction. Journal of Obstetrics and Gynaecology of India. 61 (5), 505-511 (2011).
- Seravalli, V., Miller, J. L., Block-Abraham, D., Baschat, A. A. Ductus venosus Doppler in the assessment of fetal cardiovascular health: an updated practical approach. Acta Obstetricia et Gynecologica Scandinavica. 95 (6), 635-644 (2016).
- Seed, M., et al. Feasibility of quantification of the distribution of blood flow in the normal human fetal circulation using CMR: a cross-sectional study. Journal of Cardiovascular Magnetic Resonance. 14 (1), 79(2012).
- Prsa, M., et al. Reference ranges of blood flow in the major vessels of the normal human fetal circulation at term by phase-contrast magnetic resonance imaging. Circulation. Cardiovascular Imaging. 7 (4), 663-670 (2014).
- Piontelli, A. Development of Normal Fetal Movements: The Last 15 Weeks of Gestation. , Springer-Verlag. Mailand. (2015).
- Cartier, M., et al. The normal diameter of the fetal aorta and pulmonary artery: echocardiographic evaluation in utero. American Journal of Roentgenology. 149 (5), 1003-1007 (1987).
- Ruano, R., de Fátima Yukie Maeda, M., Niigaki, J. I., Zugaib, M. Pulmonary artery diameters in healthy fetuses from 19 to 40 weeks' gestation. Journal of Ultrasound in Medicine. 26 (3), 309-316 (2007).
- Nowak, D., Kozłowska, H., Żurada, A., Gielecki, J. Diameter of the ductus arteriosus as a predictor of patent ductus arteriosus (PDA). Central European Journal of Medicine. 6 (4), 418-424 (2011).
- Goolaub, D. S., et al. Multidimensional fetal flow imaging with cardiovascular magnetic resonance: a feasibility study. Journal of Cardiovascular Magnetic Resonance. 20 (1), 77(2018).
- Roy, C. W., Seed, M., Kingdom, J. C., Macgowan, C. K. Motion compensated cine CMR of the fetal heart using radial undersampling and compressed sensing. Journal of Cardiovascular Magnetic Resonance. 19 (1), 29(2017).
- van Amerom, J. F. P., et al. Fetal cardiac cine imaging using highly accelerated dynamic MRI with retrospective motion correction and outlier rejection. Magnetic Resonance in Medicine. 79 (1), 327-338 (2018).
- Lustig, M., Donoho, D., Pauly, J. M. Sparse MRI: The application of compressed sensing for rapid MR imaging. Magnetic Resonance in Medicine. 58 (6), 1182-1195 (2007).
- Edwards, D. D., Edwards, J. S. Fetal movement: development and time course. Science. 169 (3940), New York, N.Y. 95-97 (1970).
- Malamateniou, C., et al. Motion-Compensation Techniques in Neonatal and Fetal MR Imaging. American Journal of Neuroradiology. 34 (6), 1124-1136 (2013).
- Rutherford, M., et al. MR imaging methods for assessing fetal brain development. Developmental Neurobiology. 68 (6), 700-711 (2008).
- Haris, K., et al. Self-gated fetal cardiac MRI with tiny golden angle iGRASP: A feasibility study: Self-Gated Fetal Cardiac MRI with iGRASP. Journal of Magnetic Resonance Imaging. 46 (1), 207-217 (2017).
- Glenn, O. A. MR imaging of the fetal brain. Pediatric Radiology. 40 (1), 68-81 (2010).
- Rodríguez-Soto, A. E., et al. MRI Quantification of Human Fetal O2 Delivery Rate in the Second and Third Trimesters of Pregnancy. Magnetic Resonance in Medicine. 80 (3), 1148-1157 (2018).
- Sameni, R., Clifford, G. D. A Review of Fetal ECG Signal Processing; Issues and Promising Directions. The Open Pacing, Electrophysiology & Therapy Journal. 3, 4-20 (2010).
- Millis, R. Advances in Electrocardiograms: Methods and Analysis. BoD - Books on Demand. , (2012).
- Jansz, M. S., et al. Metric optimized gating for fetal cardiac MRI. Magnetic Resonance in Medicine. 64 (5), 1304-1314 (2010).
- Yamamura, J., et al. Cardiac MRI of the fetal heart using a novel triggering method: initial results in an animal model. Journal of Magnetic Resonance Imaging: JMRI. 35 (5), 1071-1076 (2012).
- Larson, A. C., et al. Self-gated cardiac cine MRI. Magnetic Resonance in Medicine. 51 (1), 93-102 (2004).
- Knoll, F., Schwarzl, A., Diwoky, C., Sodickson, D. K. gpuNUFFT-An open source GPU library for 3D regridding with direct Matlab interface. Proceedings of the 22nd Annual Meeting of ISMRM. , (2014).
- Klein, S., Staring, M., Murphy, K., Viergever, M. A., Pluim, J. P. W. elastix: a toolbox for intensity-based medical image registration. IEEE Transactions on Medical Imaging. 29 (1), 196-205 (2010).
- Walker, P. G., et al. Semiautomated method for noise reduction and background phase error correction in MR phase velocity data. Journal of Magnetic Resonance Imaging. 3 (3), 521-530 (1993).
- Heiberg, E., et al. Design and validation of Segment - freely available software for cardiovascular image analysis. BMC Medical Imaging. 10 (1), 1(2010).
- Inder, T. E., Volpe, J. J. Chapter 17 - Intrauterine, Intrapartum Assessments in the Term Infant. Volpe's Neurology of the Newborn (Sixth Edition). , 458-483 (2018).
- Pelc, N. J., Herfkens, R. J., Shimakawa, A., Enzmann, D. R. Phase contrast cine magnetic resonance imaging. Magnetic Resonance Quarterly. 7 (4), 229-254 (1991).
- Steeden, J. A., Atkinson, D., Hansen, M. S., Taylor, A. M., Muthurangu, V. Rapid flow assessment of congenital heart disease with high-spatiotemporal-resolution gated spiral phase-contrast MR imaging. Radiology. 260 (1), 79-87 (2011).
- Kowalik, G. T., Knight, D., Steeden, J. A., Muthurangu, V. Perturbed spiral real-time phase-contrast MR with compressive sensing reconstruction for assessment of flow in children. Magnetic Resonance in Medicine. 83 (6), 2077-2091 (2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon