Method Article
Uso de ultrasonido robótico 3D para el análisis in vivo de riñones de ratón
* Estos autores han contribuido por igual
En este artículo
Erratum Notice
Resumen
Este protocolo demuestra que el ultrasonido robótico (US) es una alternativa práctica, rentable y rápida a las modalidades tradicionales de imágenes no invasivas.
Resumen
Las modalidades comunes para la obtención de imágenes in vivo de roedores incluyen tomografía por emisión de positrones (PET), tomografía computarizada (TC), resonancia magnética (IRM) y ultrasonido (EE. UU.). Cada método tiene limitaciones y ventajas, incluida la disponibilidad, la facilidad de uso, el costo, el tamaño y el uso de radiación ionizante o campos magnéticos. Este protocolo describe el uso de US robótico 3D para imágenes in vivo de riñones y corazón de roedores, análisis de datos posteriores y posibles aplicaciones de investigación. Las aplicaciones prácticas de la US robótica son la cuantificación del volumen renal total (TKV), así como la medición de quistes, tumores y vasculatura. Aunque la resolución no es tan alta como otras modalidades, la robótica US permite una recopilación de datos de alto rendimiento más práctica. Además, utilizando imágenes en modo M de EE. UU., Se puede cuantificar la función cardíaca. Dado que los riñones reciben entre el 20% y el 25% del gasto cardíaco, la evaluación de la función cardíaca es fundamental para la comprensión de la fisiología renal y la fisiopatología.
Introducción
Las modalidades más comunes para las imágenes in vivo de roedores incluyen la tomografía por emisión de positrones (PET), la imagen óptica (OI), la tomografía computarizada (TC), la resonancia magnética (MRI) y el ultrasonido (US). Estas técnicas proporcionan imágenes in vivo de alta resolución, lo que permite a los investigadores evaluar cuantitativamente y seguir longitudinalmente modelos de enfermedad de forma no invasiva1. Si bien cada modalidad de imagen tiene limitaciones, también proporcionan herramientas invaluables para la investigación preclínica.
Aquí, el estudio detalla un sistema estadounidense y presenta el protocolo para imágenes robóticas y 3D de roedores. Las ondas estadounidenses son producidas por una sonda llamada transductor, que generalmente es de mano. Las ondas sonoras se reflejan de nuevo a medida que interactúan con los tejidos, y los ecos se reconstruyen en imágenes2. El protocolo descrito aquí se centrará en imágenes renales y cardíacas utilizando un transductor controlado robóticamente y utilizando un software que permite una reconstrucción 3D rápida para una evaluación cuantitativa.
Robotic US es una modalidad de imagen rápida, confiable y no invasiva que permite a los investigadores realizar estudios longitudinales y de alto rendimiento. En comparación con los métodos portátiles de ee.UU., el método robótico de EE.UU. es eficiente en el tiempo, ya que se pueden escanear hasta tres animales en cuestión de minutos. El alto rendimiento para las mediciones renales sugiere que se pueden tomar imágenes de hasta 20 ratones por hora. Los transductores robóticos se encuentran debajo de las membranas acústicas y se mueven independientemente del animal con dos grados de libertad (Figura 1A). Esto permite a los usuarios novatos obtener imágenes de alta calidad, mientras que los métodos portátiles de EE. UU. son más susceptibles al error del usuario. El software acoplado permite una reconstrucción renal 3D eficiente y en tiempo real. Anteriormente, la resonancia magnética (MRI) ha sido un método frecuente para imágenes no invasivas debido al excelente contraste de tejidos blandos, la falta de radiactividad y la profundidad de penetración. Sin embargo, la resonancia magnética a menudo requiere largos tiempos de adquisición y es costosa de realizar. La US ha sido evaluada como una alternativa fiable y más rápida a la RM en la evaluación del volumen renal total (TKV)3.
Protocolo
Todos los pasos de este protocolo cumplen con las pautas de uso de animales de Mayo Clinic (Rochester, MN) y han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales de Mayo Clinic.
1. Modelo animal
- Obtener ratones de fuentes comerciales.
NOTA: C57BL/6J (edad = 18 meses; n = 22 (7 hombres, 15 mujeres)) (Tabla de materiales) y Pkd1(RC/RC) (edad = 18 meses; n = 9 (3 hombres, 6 mujeres))4 se utilizaron para el estudio.
2. Depilación
- Anestesiar al animal utilizando isoflurano vaporizado (2%-3%) en una cámara de anestesia. Asegúrese de que el animal esté suficientemente anestesiado mediante la realización de un pellizco en el dedo del pie. Asegúrese de que el ratón está respirando a una velocidad de aproximadamente 60-90 respiraciones / min sin tragar aire obvio.
NOTA: Se eligió el isoflurano vaporizado debido a la capacidad de controlar y ajustar el nivel de anestesia del animal. Se utilizó isoflurano mezclado con oxígeno al 100%. - Use una maquinilla de afeitar eléctrica para afeitar el área de la piel deseada para las mediciones de LOS ESTADOS UNIDOS.
NOTA: En este estudio, la atención se centra en las mediciones renales y cardíacas, por lo que el pecho y la espalda del animal fueron afeitados. - Aplique la crema depilatoria sobre la piel afeitada del animal con un aplicador con punta de algodón. Limpie la crema después de 30-60 s con una toalla de papel seco. Luego, continúe limpiando los residuos de crema depilatoria con almohadillas de gasa húmedas. Asegúrese de que la depilación esté completa antes de comenzar los escaneos.
NOTA: Cualquier cabello restante interferirá con la calidad de la imagen; la depilación completa es crucial. Sin embargo, es necesario limpiar la crema depilatoria en un minuto para evitar dañar la piel del animal. La crema depilatoria sobrante en el animal puede manchar la membrana de imagen de la máquina estadounidense. Asegúrese de una limpieza adecuada del animal con gasas húmedas.
3. Posicionamiento de los animales
- Encienda la máquina de EE. UU. y el interruptor del elemento calefactor interno para las bahías de EE. UU. Encienda las válvulas de anestesia apropiadas para las bahías estadounidenses correspondientes que se utilizarán.
NOTA: La máquina de EE. UU. debe estar encendida antes de iniciar el software de imágenes de EE. UU. - Llene las bahías con suficiente agua para cubrir la membrana. Coloque el animal anestesiado en el cono de la nariz.
- Para mediciones cardíacas, coloque al animal en posición prona y anímelo aproximadamente 30° hacia la derecha.
- Para las mediciones renales, coloque al animal en posición recta y supina. Aplanar suavemente el cuerpo del animal para minimizar las bolsas de aire entre el animal y la membrana (Figura 1B).
NOTA: Pasar un dedo junto al cuerpo del animal puede eliminar cualquier burbuja de aire que se adhiera a la piel, lo que interferirá con las imágenes. Use agua o gel salino estadounidense como medio estadounidense; pero el agua facilita las imágenes rápidas discutidas aquí.
4. Mediciones de ultrasonido
- En el software de imágenes de EE. UU., seleccione Adquisición de EE. UU. y permita que el instrumento se inicialice.
- Imágenes renales en modo B.
- Escriba un nombre para el estudio en el cuadro de diálogo correspondiente.
- Introduzca el ID de animal en el cuadro de diálogo correspondiente.
NOTA: Se pueden visualizar secuencialmente hasta tres animales. - Haga clic en la pestaña etiquetada 3D para inicializar el escaneo 3D.
- Usando la transmisión de la cámara en vivo, mueva la caja de región de interés (ROI) para contener los riñones.
NOTA: El tamaño del ROI puede ajustarse en función del tamaño del objetivo de la imagen. Aumentar el tamaño del ROI aumentará ligeramente el tiempo de escaneo (Figura 1C). Dependiendo del tamaño del ROI, el escáner ajustará automáticamente el número de pasadas necesarias para que el transductor escanee todo el ROI. - Dependiendo del tipo de imagen deseada, seleccione Linear Array o Wobbler, para elegir el transductor. Seleccione entre Escaneo rápido u Optimizado para cualquiera de los transductores.
NOTA: La matriz lineal es más rápida y generalmente proporciona imágenes adecuadas. El transductor wobbler se puede utilizar si no puede adquirir la calidad de imagen deseada con la matriz lineal. El transductor wobbler utiliza una longitud de onda de frecuencia más alta y, por lo tanto, proporciona más definición en las imágenes. La opción de escaneo rápido adquiere imágenes de calidad media sin corrección respiratoria a una velocidad más alta. Si bien la opción optimizada requiere un poco más de tiempo, proporciona una mejor calidad de imagen y permite la corrección de la respiración. Este manuscrito se centrará en el uso del ajuste preestablecido de matriz lineal optimizada. - Haga clic en la vista en vivo para ver una imagen en vivo del área de visualización deseada.
- Para mover el transductor, haga clic en el botón circular Ir a y luego haga clic en el área del mouse que se va a obtener la imagen. Utilice las flechas direccionales con tamaños de paso predeterminados para ajustar finamente la posición del transductor.
- Haga clic en la flecha en el lateral de la ventana del Panel de control para abrir la bandeja de configuración. Haga clic en Protocolo de escaneo para abrir la configuración de escaneo.
- Determine la profundidad focal ideal y ajuste los controles deslizantes para el TGC (compensación de ganancia de tiempo) para cambiar el contraste de la imagen para ver mejor los riñones. Después de lograr la configuración deseada, haga clic en la flecha nuevamente para cerrar la bandeja de configuración.
- Presione el botón Adquirir estática para comenzar el escaneo 3D.
NOTA: El progreso del escaneo se indica a través de una barra de progreso en la parte inferior izquierda del software. - Una vez que se complete el escaneo, verifique la calidad de la imagen haciendo clic en la flecha azul de descarga para abrir el escaneo en modo de vista previa. Desplácese por los fotogramas 3D del escaneo arrastrando la flecha roja en la parte superior de la ventana. Para acercar o alejar, mantenga presionada la tecla Ctrl y use el botón de desplazamiento del mouse.
- Para analizar animales adicionales, actualice los cuadros de diálogo de identificación de animal, introduzca los nuevos identificadores y, a continuación, repita los pasos anteriores.
NOTA: Cuando se completen las exploraciones, seque a los animales y devuélvalos a sus jaulas domésticas.
- Imágenes cardíacas en modo M.
NOTA: El modo M es la visualización de una onda de ultrasonido a lo largo de una línea de ultrasonido específica elegida.- Haga clic en la pestaña Modo M para activar las imágenes cardíacas.
NOTA: Solo se puede tomar una imagen de un animal a la vez. - Asegúrese de que el animal esté en la posición adecuada para las exploraciones cardíacas (paso 2.2). Mueva el ROI a la ubicación aproximada del corazón.
- Presione el botón Heart Finder para localizar el corazón. Utilice el mapa de calor para optimizar la ubicación del transductor. Utilice el botón circular Ir a para mover el transductor al ventrículo izquierdo (Figura 2A).
- Vaya a la vista en vivo y use los botones de flecha para colocar el transductor entre los músculos papilares (Figura 2B). Para verificar la colocación correcta del transductor, vea el seguimiento del modo M activo (Figura 2D).
- Una vez que el transductor esté en la posición adecuada, haga clic en Adquirir secuencia. Haga clic en la flecha azul de descarga para ver el escaneo completado.
- Haga clic en la pestaña Modo M para activar las imágenes cardíacas.
5. Análisis renal (mecánica del análisis)
- Abra la pestaña Análisis de imágenes y seleccione el botón Cargar volúmenes para ingresar los archivos / carpetas de imagen.
- Segmentación
- Mueva las líneas de colores que representan varios planos para encontrar el riñón en todos los planos.
- Haga clic en Agregar para agregar una nueva segmentación. Proporcione un nombre de marcado para el archivo.
- Use el botón Corte de superficie para agregar puntos alrededor del borde externo del riñón en varios planos. Haga clic en Aplicar para generar segmentación a través de todo el riñón (Figura 3A).
- Desplácese por los diferentes marcos de cada plano y edite las regiones inexactas haciendo clic en Editar y arrastrando los puntos a la ubicación correcta.
- Alternativamente, si el riñón tiene forma irregular, use la función Dibujar para crear un rastro de forma irregular alrededor del riñón. Haga clic en los puntos alrededor del borde o mantenga presionado el clic izquierdo para dibujar el rastro a mano alzada.
- Para completar el seguimiento con el botón Dibujar , haga clic con el botón derecho del ratón. Desplácese hacia adelante varios fotogramas y repita el proceso de seguimiento.
- Repita el proceso hasta que se rastreen las tramas en toda la región de interés.
- Si se utiliza la función Dibujar , seleccione Rellenar entre sectores para comprobar y ajustar el trazado. Haga clic en Inicializar para ver una vista previa. Si la vista previa es aceptable, haga clic en Aplicar. De lo contrario, haga clic en Cancelar y modifique los seguimientos.
NOTA: El botón Borrar permitirá la eliminación de una región dentro de un seguimiento. El botón Suavizar suaviza los bordes irregulares de un trazado. - Cuando el análisis de imagen sea satisfactorio, seleccione Guardar para guardar el análisis en el archivo de imagen original.
- Medición
- Utilice la función Pinzas para medir las características dentro de la imagen. Haga clic en el botón Pinzas y haga clic con el botón izquierdo en los dos puntos de la distancia a medir (Figura 3B).
- Guarde la medición haciendo clic en el botón de disco en la parte superior de la pantalla.
- Segmentación
6. Análisis cardíaco
- Seleccione Cargar volúmenes para introducir los archivos que se van a analizar.
- Seleccione la opción Agregar .
- Utilice la herramienta Colocación de puntos para rastrear la sístole y la diástole de cada capa de tejido cardíaco. Continúe con las otras capas de tejido cardíaco. Utilice la función Editar para modificar los seguimientos (Figura 2C,D).
NOTA: Si el seguimiento en modo M es muy claro, utilice el botón Agregar (automático) para generar automáticamente los seguimientos de cada capa. - Seleccione Aplicar para calcular los parámetros cardíacos. Vea la ficha Cuantificar y seleccione Exportar estadísticas para exportar todos los datos como un archivo *.csv (Figura 2E).
Resultados
Resultados del análisis renal
Los datos de área de superficie y volumen se adquieren a partir de la segmentación de los riñones. Esta información se puede utilizar para comparar modelos experimentales y de control o realizar un seguimiento de los cambios a lo largo del tiempo. La herramienta de pinzas es útil para medir rápidamente las anomalías (es decir, quistes, tumores) y cómo cambian de longitud con el tiempo. La Figura 3 sugiere que tanto los métodos de segmentación como los de calibración se pueden utilizar para medir los volúmenes de quistes con precisión. La Figura 4 demuestra una clara diferencia en el volumen renal total (TKV) entre los ratones de control de la misma edad y los experimentales (Pkd1RC / RC). La visualización 3D de estas representaciones de volumen se puede realizar dentro del sistema, incluidas las rotaciones dentro del espacio 3D (Figura 5). Estas reconstrucciones en 3D se utilizan para calcular TKV (mm3; Figura 4) así como un gran volumen de quiste individual.
Resultados del análisis cardíaco
Muchos parámetros útiles se adquieren a partir del análisis de imágenes en modo M. Estos datos proporcionan una buena instantánea de la función cardíaca del ventrículo izquierdo (VI) en ese momento. La salida de datos incluye el diámetro interno del VI, la pared posterior del VI, el diámetro de la pared anterior del VI, la fracción de eyección, el acortamiento fraccional, el volumen sistólico, la frecuencia cardíaca, el gasto cardíaco, el volumen del VI y la masa del VI. El éxito del análisis cardíaco depende de la segmentación precisa de las capas en la imagen del modo M. La mayoría de los resultados cardiovasculares se calculan por las fases sistólicas y diastólicas máximas de las capas endocárdicas posterior y anterior. La capa epicárdica posterior aparece de color blanco brillante y sigue un patrón similar a la capa endocárdica posterior. El trazado de la capa endocárdica posterior debe colocarse en el contorno más bajo. La capa endocárdica anterior debe trazarse a lo largo del contorno más alto de esa capa. La capa epicárdica anterior aparece lineal en la parte inferior de la imagen debido al posicionamiento prono del animal (Figura 2D). La Figura 6 muestra un ejemplo de un estudio sin diferencias significativas en el gasto cardíaco entre ratones experimentales y control. Al igual que con las imágenes renales, la visualización cardíaca en 3D es posible. Sin embargo, una visualización 4D del ciclo cardíaco (Figura suplementaria 1) permite al investigador visualizar e identificar anomalías morfológicas y dinámicas del ciclo en el animal evaluado.
Evaluación de la morfología
Para una evaluación rápida y económica, US puede monitorear eficazmente los parámetros fisiológicos longitudinalmente. Sin embargo, muchos estudios desean determinar adicionalmente las características morfológicas más finas, por ejemplo, el número y el tamaño de los quistes, las calcificaciones (cálculos renales), la vascularización o el grado de fibrosis. La Figura 7 compara un riñón de ratón normal con un riñón de ratón quístico con un riñón de ratón moderadamente calcificado. Al aumentar la frecuencia central de EE.UU. (10 MHz con la matriz lineal) a 35 MHz (amplificador wobbler), se pueden obtener imágenes de detalle creciente.

Figura 1: Sistema de ultrasonido y colocación del ratón. (A) Diagrama del sistema de ultrasonido y ubicación de los transductores. (B) Vista de ratones en posición supina en la plataforma de ultrasonido. (C) Ejemplo de región de interés (ROI) establecida para el área de interés (riñones) con identificaciones de animales. Haga clic aquí para ver una versión más grande de esta figura.
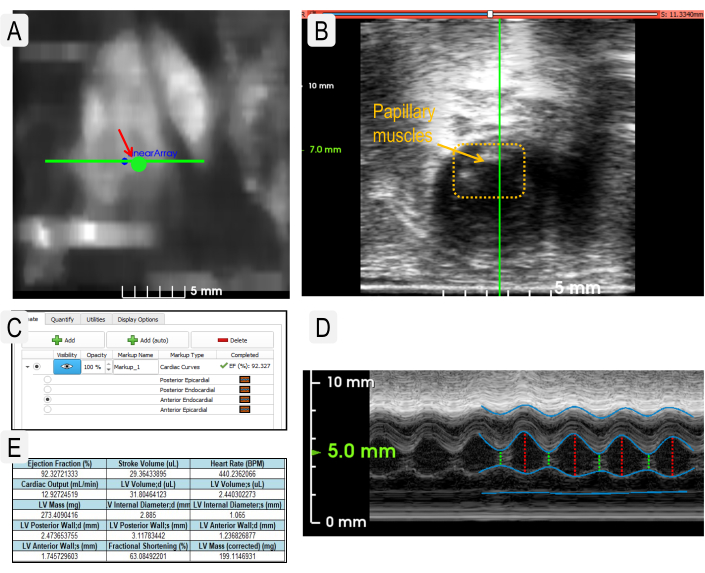
Figura 2: Imágenes de ultrasonido cardíaco para obtener parámetros fisiológicos. (A) Uso de la imagen de mapa de calor de Heart Finder para colocar el transductor en el ventrículo izquierdo para imágenes en modo M. La ubicación del transductor en el ventrículo izquierdo está indicada por el gran punto verde. (B) Vista del transductor cuando se coloca correctamente sobre los músculos papilares (caja punteada). (C) Vista de ejemplo de las capas necesarias para medir los parámetros cardíacos. (D) Vista de la imagen M-Mode en vivo con capas designadas como en el panel C. (Capas de arriba a abajo: epicárdico posterior, endocárdico posterior, endocárdico anterior y epicárdico anterior). (E) Ejemplo de resultado de estadísticas generadas a partir de mediciones cardíacas. Haga clic aquí para ver una versión más grande de esta figura.
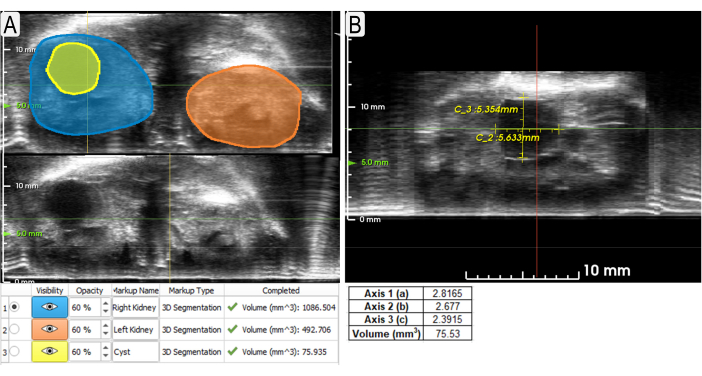
Figura 3: Uso de herramientas de segmentación y calibradores para medir riñones y quistes. (A) Ejemplos de segmentaciones (vista axial) de ambos riñones (sombreado azul y naranja) y un quiste grande (amarillo) con volúmenes enumerados a continuación. Las vistas no segmentadas se muestran debajo para que se puedan ver los EE. UU. no oscurecidos. (B) Ejemplo de uso de pinzas para medir el mismo quiste (vista sagital) de la Figura 3A con mediciones a continuación. El volumen se calculó utilizando la fórmula para una elipse (volumen = (4/3)π x a x b x c, donde a, b, c son relativos x, y, z, respectivamente). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Distribuciones TKV de WT y riñones quísticos de ratón. Representación de TKV para ratones de tipo salvaje (WT) (C57BL/6J) y enfermos (Pkd1RC/RC). n = 22 (WT) n = 9 (Pkd1RC/RC); Resultados de la prueba t de dos colas: p < 0,0001. La caja muestra los valores del percentil 25-75 y los bigotes muestran 1,5 veces el rango intercuartílico. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Reconstrucción animada en 3D de riñones y quistes segmentados. Usando el software, las proyecciones 3D de los riñones y el quiste pueden girarse o balancearse en el espacio 3D (azul = riñón izquierdo; amarillo = quiste grande; naranja = riñón derecho). Haga clic aquí para descargar esta figura.
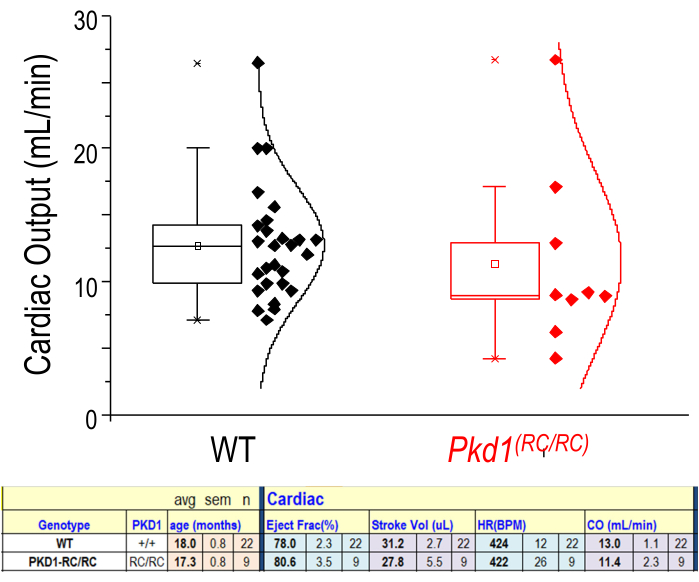
Figura 6: Parámetros fisiológicos cardíacos de mediciones estadounidenses. Representación del gasto cardíaco (ml/min) para ratones WT y enfermos (Pkd1RC/RC). n = 22 (WT) n = 9 (Pkd1RC/RC). Los datos tabulados más bajos muestran que no hay diferencias significativas para estos dos grupos en la fracción de eyección, el volumen sistólico, la frecuencia cardíaca (FC) o el gasto cardíaco (CO). Resultados de la prueba t de dos colas: p > 0,05. El cuadro muestra los valores del percentil 25-75. Haga clic aquí para ver una versión más grande de esta figura.
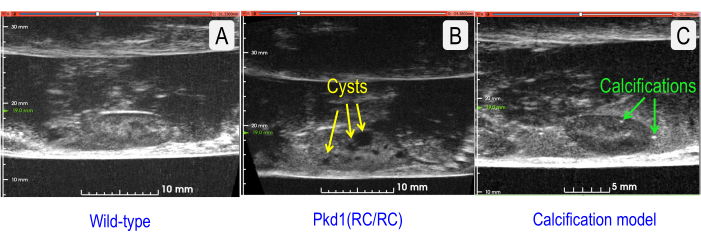
Figura 7: Comparación de secciones sagitales US de patologías normales y dos. (A) Riñón de tipo salvaje (cepa C57BL/6J) (TKV = 143,202 mm3). (B) Riñón quístico con aumento de TKV (ratón Pkd1RC/RC ) (TKV = 333,158 mm3). Los quistes se indican con flechas amarillas. (C) Riñón con calcificaciones vasculares (Modelo = Deficiente en receptor de lipoproteínas de baja densidad, ratón solo con apolipoproteína B100 alimentado con una dieta occidental durante 12 meses5) (TKV = 127,376 mm3). Los cálculos renales están indicados por flechas verdes. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Película del ciclo cardíaco 4D de mediciones de EE. UU. Usando el software, una representación del corazón que late se captura en 3D US y se proyecta a través del ciclo cardíaco. La flecha verde indica la válvula aórtica. (Modelo = Deficiente en receptores de lipoproteínas de baja densidad, ratón solo con apolipoproteína B100, alimentado con una dieta occidental durante 12 meses5). Este modelo genera calcificaciones vasculares que permiten una visualización más fácil del corazón y las válvulas debido a la mayor reflectividad acústica de las calcificaciones en Estados Unidos. Reconstrucciones 4D similares son posibles con ratones WT; sin embargo, el contraste acústico capturado no será tan alto. Haga clic aquí para descargar este archivo.
Discusión
El ultrasonido utiliza ondas sonoras, y cualquier barrera para la propagación de ondas sonoras interferirá con la calidad de la imagen. Por lo tanto, la depilación completa del área a fotografiar es crítica. También es importante garantizar la eliminación completa de la crema depilatoria, ya que puede causar quemaduras / irritación de la piel del animal y decolorar la membrana transparente del escáner. Los niveles adecuados de agua en las bahías son necesarios para una propagación óptima de las ondas sonoras, por lo que se requiere para obtener la mayor resolución de imagen. Sin embargo, cuando el animal está en una posición prona, asegúrese de que el hocico del animal esté por encima del nivel del agua o que el animal esté en riesgo de inhalación de agua. La optimización de los parámetros de imagen, especialmente la profundidad focal, es fundamental para obtener imágenes de alta calidad. Las modificaciones de los parámetros pueden ser necesarias para animales individuales.
Robotic US ofrece muchas ventajas sobre las modalidades tradicionales de mano de LOS Estados Unidos. En primer lugar, el sistema utiliza una interfaz simple basada en cámara de apuntar y hacer clic. Esta característica aborda la complejidad de los Estados Unidos convencionales y produce datos consistentes incluso cuando son operados por un usuario novato6. En segundo lugar, el sistema permite el uso de agua en lugar del gel tradicional de los Estados Unidos como medio acústico. Anteriormente, el uso de gel estadounidense permitía la formación de burbujas que interferían con la adquisición de imágenes de calidad. Además, el gel estadounidense es desordenado y proporciona desafíos para la limpieza. Además, el agua se calienta con la lámpara de calor y ayuda a mantener la temperatura corporal del animal. En tercer lugar, el US robótico es más rápido, por lo que los artefactos del movimiento respiratorio no son problemáticos. El aumento de la velocidad de imagen permite la finalización práctica de la recopilación de datos de alto rendimiento. En cuarto lugar, el robot estadounidense obtiene imágenes en 3D y, por lo tanto, simplifica la reconstrucción 3D de objetos (Figura 4). La resonancia magnética y otras modalidades son costosas, requieren mucho tiempo y no siempre están disponibles. Es importante destacar que el sistema robótico de EE. UU. cabe en una mesa o banco y es más rentable. Finalmente, trabajos anteriores demostraron que la robótica US podría proporcionar datos de medición comparables a modalidades más costosas, como MRI3.
Si bien la calidad de imagen y la resolución del sistema robótico estadounidense descrito en este trabajo fueron adecuadas para la aplicación propuesta (Figura 7), hay varias formas en que la calidad de la imagen se puede mejorar en el futuro. Por ejemplo, la utilización de transductores de mayor frecuencia (por ejemplo, 50-70 MHz) daría como resultado imágenes de mayor resolución con una mejor definición de características. Si bien la utilización de frecuencias más altas resultaría en una profundidad de penetración más pobre, las imágenes deberían ser suficientes para obtener imágenes in vivo de órganos superficiales, como el riñón del ratón. Al igual que con otras modalidades de imágenes, se pueden usar agentes de contraste para mejorar características específicas. Para los Estados Unidos, esto generalmente significa usar algo altamente reflectante de las ondas de sonido. Las microburbujas intravasculares en las que los lípidos rodean burbujas de gas muy pequeñas son uno de esos agentes. Las burbujas de gas del tamaño de micras son altamente reflectantes y, por lo tanto, proporcionan una segunda señal distinta que se traduce en una alta resolución de vasculatura7. Si bien esta técnica de contraste acústico puede ser bastante útil, puede tener varias desventajas. Primero, las microburbujas deben hacerse frescas y solo persistir in vivo durante 5-10 min. En segundo lugar, la inyección intravascular in vivo generalmente requiere un cateterismo con velo de cola para la inyección, y esto puede ser técnicamente desafiante. Bajo ciertas circunstancias y regímenes pulsantes, las imágenes de microburbujas pueden conducir a daños en la vasculatura renal8.
También hay algunas limitaciones más generales del sistema estadounidense particular utilizado. En primer lugar, solo se incluye una matriz lineal (centrada en 18 MHz) en el chasis robótico, por lo que actualmente no es posible cambiar a sondas de frecuencia más alta o más baja. Esto puede afectar la amplitud de los modelos (ya sean más grandes o más pequeños) que se pueden evaluar con el sistema. Las iteraciones futuras del instrumento deben incluir múltiples matrices lineales para cubrir toda la gama de modelos animales preclínicos. En segundo lugar, el ángulo del transductor en relación con el sujeto animal no se puede controlar. Por lo tanto, realizar técnicas de imagen dependientes del ángulo, como Doppler, o lograr vistas alternativas en el plano de ciertos órganos (por ejemplo, vista de eje largo del riñón) requiere el reposicionamiento del animal y puede ser difícil de lograr. Se podrían agregar grados adicionales de libertad al movimiento robótico para mejorar este desafío. En tercer lugar, en ocasiones, hemos observado artefactos de reverberación que surgen de la membrana acústica que separa al animal del transductor que puede oscurecer la visualización de características superficiales y límites. En estos casos, el uso de un gel de separación para elevar al animal lejos de la membrana puede remediar la situación. Finalmente, el control de la temperatura a través de una lámpara de calor es impreciso y, por lo tanto, se debe prestar mucha atención a la temperatura corporal central del animal durante la toma de imágenes. Los mecanismos de calentamiento más controlados, como una almohadilla térmica integrada, probablemente mejorarán la gestión de la homeostasis y el rendimiento de las imágenes.
El uso de la robótica US puede ser aplicable a varios campos de investigación. Esta tecnología permite la visualización de las estructuras del tejido grueso, por lo que puede utilizarse para rastrear la progresión tumoral y las posibles terapias6,9, así como la morfología renal como se presenta aquí. La capacidad de segmentar las características específicas de las imágenes la convierte en una herramienta atractiva para el estudio de modelos de enfermedad renal poliquística (PKD)3. Las imágenes en modo M permiten una cuantificación simple de muchos parámetros cardíacos importantes que permiten la evaluación in vivo de la fisiología cardíaca. Como los riñones reciben entre el 20% y el 25% del gasto cardíaco10, es importante comprender la función cardíaca durante la evaluación longitudinal de la patología renal. A través de estos protocolos estadounidenses, hemos tratado de ilustrar que las imágenes estadounidenses no solo son prácticas para estudios renales in vivo y longitudinales, sino también que cada vez más las herramientas estadounidenses permiten tanto la evaluación morfológica como fisiológica de ratones en estudios preclínicos.
Divulgaciones
Varios autores son empleados, tienen un interés financiero significativo en, o son coinventores de patentes licenciadas por SonoVol, Inc. (CJM, RCG, TJC).
Agradecimientos
Este trabajo fue apoyado por el NIH (R43-DK126607, TJC, TLK, MFR) y la Fundación Mayo.
Materiales
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
Referencias
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107(2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021. Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados