Method Article
Использование 3D роботизированного ультразвука для анализа почек мыши in vivo
* Эти авторы внесли равный вклад
В этой статье
Erratum Notice
Резюме
Этот протокол демонстрирует роботизированный ультразвук (US) как практичную, экономически эффективную и быструю альтернативу традиционным неинвазивным методам изображения.
Аннотация
Общие методы визуализации грызунов in vivo включают позитронно-эмиссионную томографию (ПЭТ), компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ) и ультразвук (УЗИ). Каждый метод имеет ограничения и преимущества, включая доступность, простоту использования, стоимость, размер и использование ионизирующего излучения или магнитных полей. Этот протокол описывает использование 3D-роботизированной УЗИ для визуализации in vivo почек и сердца грызунов, последующего анализа данных и возможных исследовательских приложений. Практическими приложениями роботизированной УЗИ являются количественная оценка общего объема почек (TKV), а также измерение кист, опухолей и сосудистой системы. Хотя разрешение не так высоко, как в других модальностях, роботизированные США позволяют более практичный сбор данных с высокой пропускной способностью. Кроме того, используя визуализацию УЗИ в М-режиме, сердечная функция может быть количественно определена. Поскольку почки получают 20%-25% сердечного выброса, оценка сердечной функции имеет решающее значение для понимания физиологии почек и патофизиологии.
Введение
Наиболее распространенные методы визуализации грызунов in vivo включают позитронно-эмиссионную томографию (ПЭТ), оптическую визуализацию (ОИ), компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ) и ультразвук (УЗИ). Эти методы обеспечивают изображения с высоким разрешением in vivo, что позволяет исследователям количественно оценивать и продольно следовать моделям заболеваний неинвазивно1. Хотя каждый метод визуализации имеет ограничения, они также предоставляют бесценные инструменты для доклинических исследований.
Здесь исследование детализирует американскую систему и представляет протокол для роботизированной и 3D-визуализации грызунов. Американские волны производятся зондом, называемым преобразователем, который обычно удерживается вручную. Звуковые волны отражаются обратно, когда они взаимодействуют с тканями, а эхо реконструируется в изображения2. Протокол, описанный здесь, будет сосредоточен на визуализации почек и сердца с использованием роботизированного датчика и использования программного обеспечения, которое позволяет быструю 3D-реконструкцию для количественной оценки.
Robotic US - это быстрый, надежный и неинвазивный метод визуализации, который позволяет исследователям проводить высокопроизводительные и продольные исследования. По сравнению с ручными методами США, роботизированный метод США экономит время, так как до трех животных могут быть отсканированы за считанные минуты. Высокая пропускная способность для измерений почек предполагает, что может быть изображено до 20 мышей в час. Роботизированные преобразователи расположены под акустическими мембранами и движутся независимо от животного с двумя степенями свободы (рисунок 1А). Это позволяет начинающим пользователям получать высококачественные изображения, в то время как портативные методы США более подвержены ошибкам пользователя. Связанное программное обеспечение обеспечивает эффективную 3D-реконструкцию почек в режиме реального времени. Ранее магнитно-резонансная томография (МРТ) была распространенным методом неинвазивной визуализации из-за отличного контраста мягких тканей, отсутствия радиоактивности и глубины проникновения. Тем не менее, МРТ часто требует длительного времени приобретения и является дорогостоящим для выполнения. УЗИ был оценен как надежная и более быстрая альтернатива МРТ при оценке общего объема почек (TKV)3.
протокол
Все шаги в этом протоколе соответствуют рекомендациям по использованию животных клиники Майо (Рочестер, штат Миннесота) и были одобрены Комитетом по уходу и использованию животных клиники Майо.
1. Животная модель
- Добывайте мышей из коммерческих источников.
ПРИМЕЧАНИЕ: Для исследования использовались C57BL/6J (возраст = 18 месяцев; n = 22 (7 мужчин, 15 женщин)) (Таблица материалов) и Pkd1(RC/RC) (возраст = 18 месяцев; n = 9 (3 мужчины, 6 женщин))4 .
2. Эпиляция
- Обезболить животное с помощью испаренного изофлурана (2%-3%) в анестезиологической камере. Убедитесь, что животное достаточно обезболено, выполнив ущемление пальца ноги. Убедитесь, что мышь дышит со скоростью примерно 60-90 вдохов в минуту без явного глотания воздуха.
ПРИМЕЧАНИЕ: Испаренный изофлуран был выбран из-за способности контролировать и точно настраивать уровень анестезии животного. Изофлуран, смешанный со 100% кислородом, был использован. - Используйте электрическую бритву, чтобы сбрить желаемый участок кожи для измерений в США.
ПРИМЕЧАНИЕ: В этом исследовании основное внимание уделяется измерениям почек и сердца, поэтому грудь и спина животного были выбриты. - Нанесите крем для депиляции на бритую кожу животного с помощью аппликатора с ватным наконечником. Протрите крем через 30-60 секунд сухим бумажным полотенцем. Затем продолжайте вытирать остатки крема для депиляции с помощью влажных марлевых подушечек. Убедитесь, что эпиляция завершена до начала сканирования.
ПРИМЕЧАНИЕ: Любые оставшиеся волосы будут мешать качеству изображения; полная эпиляция имеет решающее значение. Тем не менее, необходимо вытереть крем для депиляции в течение минуты, чтобы предотвратить травмирование кожи животного. Оставшийся крем для депиляции на животном может окрашивать визуализационную мембрану американской машины. Обеспечьте правильную очистку животного с помощью влажных марлевых подушечек.
3. Позиционирование животных
- Включите американскую машину и переключатель для внутреннего нагревательного элемента для отсеков США. Включите соответствующие анестезиологические клапаны для соответствующих отсеков США, которые будут использоваться.
ПРИМЕЧАНИЕ: Устройство в США должно быть включено перед запуском программного обеспечения для создания образов в США. - Заполните отсеки достаточным количеством воды, чтобы покрыть мембрану. Поместите обезболенное животное в носовой конус.
- Для сердечных измерений поместите животное в положение лежа и наклоните его примерно на 30° вправо.
- Для измерения почек поместите животное в прямое и лежачее положение. Осторожно сплющивайте тело животного, чтобы свести к минимуму воздушные карманы между животным и мембраной (рисунок 1B).
ПРИМЕЧАНИЕ: Проведение пальцем рядом с телом животного может удалить любые пузырьки воздуха, прилипшие к коже, которые будут мешать визуализации. Используйте воду или американский физиологический гель в качестве среды США; но вода облегчает быструю визуализацию, обсуждаемую здесь.
4. Ультразвуковые измерения
- В программном обеспечении для создания образов США выберите US Acquisition и разрешите инициализацию инструмента.
- Визуализация почек с использованием B-режима.
- Введите имя исследования в соответствующем диалоговом окне.
- Введите идентификатор животного в соответствующем диалоговом окне.
ПРИМЕЧАНИЕ: До трех животных могут быть изображены последовательно. - Нажмите на вкладку с надписью 3D , чтобы инициализировать 3D-сканирование.
- Используя прямую трансляцию с камеры, переместите область интереса (ROI), чтобы вместить почки.
ПРИМЕЧАНИЕ: Размер ROI может быть скорректирован в зависимости от размера целевого изображения. Увеличение размера ROI немного увеличит время сканирования (рисунок 1C). В зависимости от размера окупаемости инвестиций сканер автоматически регулирует количество проходов, необходимое преобразователю для сканирования всей окупаемости инвестиций. - В зависимости от желаемого типа изображения выберите Линейный массив или Воблер, чтобы выбрать преобразователь. Выберите Быстрое сканирование или Оптимизировано для любого датчика.
ПРИМЕЧАНИЕ: Линейный массив быстрее и обычно обеспечивает адекватную визуализацию. Преобразователь воблера может быть использован, если не может получить желаемое качество изображения с помощью линейной матрицы. Преобразователь воблера использует более высокую частоту волны и, следовательно, обеспечивает большую четкость на изображениях. Функция быстрого сканирования позволяет получать изображения среднего качества без коррекции дыхания на более высокой скорости. Хотя опция Optimized требует немного больше времени, она обеспечивает лучшее качество изображения и позволяет коррекцию дыхания. Эта рукопись будет посвящена использованию предустановки оптимизированного линейного массива. - Нажмите на Live View , чтобы увидеть живое изображение нужной области просмотра.
- Чтобы переместить преобразователь, нажмите на круглую кнопку «Перейти к », а затем нажмите на область мыши, которую нужно изобразить. Используйте стрелки направления с заданными размерами шагов для точной регулировки положения преобразователя.
- Нажмите на стрелку сбоку окна панели управления, чтобы открыть панель настроек. Нажмите « Протокол сканирования», чтобы открыть настройки сканирования.
- Определите идеальную глубину фокуса и отрегулируйте ползунки для TGC (компенсация временного усиления), чтобы изменить контрастность изображения для лучшего обзора почек. После достижения нужных настроек нажмите на стрелку еще раз, чтобы закрыть панель настроек.
- Нажмите кнопку «Получить статический », чтобы начать 3D-сканирование.
ПРИМЕЧАНИЕ: Ход сканирования отображается с помощью индикатора выполнения в левом нижнем углу программного обеспечения. - После завершения сканирования проверьте качество изображения, щелкнув синюю стрелку загрузки, чтобы открыть сканирование в режиме предварительного просмотра. Перемещайтесь по 3D-кадрам сканирования, перетаскивая красную стрелку в верхней части окна. Чтобы увеличить или уменьшить масштаб, удерживайте клавишу Ctrl и используйте кнопку прокрутки мыши.
- Чтобы проверить дополнительных животных, обновите диалоговые окна идентификаторов животных, введите новые идентификаторы и повторите описанные выше действия.
ПРИМЕЧАНИЕ: Когда сканирование будет завершено, высушите животных и верните их в домашние клетки.
- Визуализация сердца с использованием режима M.
ПРИМЕЧАНИЕ: M-режим - это отображение ультразвуковой волны вдоль определенной, выбранной ультразвуковой линии.- Нажмите на вкладку M Mode , чтобы активировать визуализацию сердца.
ПРИМЕЧАНИЕ: Одновременно может быть изображено только одно животное. - Убедитесь, что животное находится в соответствующем положении для сканирования сердца (шаг 2.2). Переместите ROI в приблизительное местоположение сердца.
- Нажмите кнопку Heart Finder , чтобы найти сердце. Используйте тепловую карту для оптимизации расположения датчика. Используйте круглую кнопку Go To для перемещения датчика в левый желудочек (рисунок 2A).
- Перейдите в Live View и используйте кнопки со стрелками, чтобы поместить преобразователь между сосочковыми мышцами (рисунок 2B). Чтобы убедиться в правильности размещения преобразователя, просмотрите трассировку режима M в реальном времени (рисунок 2D).
- Как только преобразователь окажется в соответствующем положении, нажмите « Получить последовательность». Нажмите на синюю стрелку загрузки, чтобы просмотреть завершенное сканирование.
- Нажмите на вкладку M Mode , чтобы активировать визуализацию сердца.
5. Анализ почек (механика анализа)
- Откройте вкладку Анализ изображений и нажмите кнопку Загрузить тома, чтобы ввести файлы/папки изображений.
- Сегментация
- Переместите цветные линии, представляющие различные плоскости, чтобы найти почку во всех плоскостях.
- Нажмите кнопку Добавить , чтобы добавить новую сегментацию. Укажите имя разметки для файла.
- Используйте кнопку Surface Cut , чтобы добавить точки вокруг внешнего края почки в нескольких плоскостях. Нажмите кнопку Применить , чтобы создать сегментацию по всей почке (рисунок 3А).
- Прокрутите различные кадры в каждой плоскости и отредактируйте любые неточные области, нажав « Редактировать» и перетащив точки в нужное место.
- В качестве альтернативы, если почка имеет неправильную форму, используйте функцию Draw , чтобы создать след неправильной формы вокруг почки. Щелкните точки по краю или удерживайте левый щелчок, чтобы нарисовать трассировку от руки.
- Чтобы завершить трассировку с помощью кнопки Нарисовать , щелкните правой кнопкой мыши. Прокрутите несколько кадров вперед и повторите процесс трассировки.
- Повторяйте до тех пор, пока кадры не будут прослежены по всей интересующей области.
- Если используется функция Рисование , выберите «Заливка между фрагментами», чтобы проверить и настроить трассировку. Нажмите «Инициализировать», чтобы увидеть предварительный просмотр. Если предварительный просмотр приемлем, нажмите кнопку Применить. Если нет, нажмите кнопку Отмена и измените трассировки.
ПРИМЕЧАНИЕ: Кнопка «Стереть» позволит удалить область в трассировке. Кнопка Smooth сглаживает зубчатые края трассировки. - Если анализ изображения будет удовлетворительным, нажмите кнопку Сохранить , чтобы сохранить анализ в исходном файле изображения.
- Измерение
- Используйте функцию Суппорты для измерения объектов на изображении. Нажмите на кнопку Суппорты и щелкните левой кнопкой мыши две точки измеряемого расстояния (рисунок 3B).
- Сохраните измерение, нажав кнопку диска в верхней части экрана.
- Сегментация
6. Анализ сердца
- Выберите Загрузить тома, чтобы ввести файлы для анализа.
- Выберите параметр Добавить .
- Используйте инструмент Point Placement для отслеживания систолы и диастолы для каждого слоя сердечной ткани. Продолжайте с другими слоями сердечной ткани. Используйте функцию Edit для изменения трассировок (рисунок 2C,D).
ПРИМЕЧАНИЕ: Если трассировка M-режима очень четкая, используйте кнопку Добавить (авто) для автоматического создания трассировок каждого слоя. - Выберите Применить , чтобы рассчитать параметры сердца. Откройте вкладку Quantify и выберите Export Statistics (Экспорт статистики), чтобы экспортировать все данные в виде файла *.csv (рисунок 2E).
Результаты
Результаты анализа почек
Данные о площади поверхности и объеме получаются из сегментации почек. Эта информация может быть использована для сравнения экспериментальных и контрольных моделей или отслеживания изменений с течением времени. Инструмент суппортов полезен для быстрого измерения аномалий (например, кист, опухолей) и того, как они изменяются в длине с течением времени. Рисунок 3 предполагает, что как метод сегментации, так и метод суппорта могут быть использованы для точного измерения объемов кисты. Рисунок 4 демонстрирует четкую разницу в общем объеме почек (TKV) между контрольными и экспериментальными (Pkd1RC/RC) мышами. 3D-визуализация этих объемных рендеров может быть выполнена внутри системы, включая вращения в 3D-пространстве (рисунок 5). Эти 3D-реконструкции затем используются для расчета TKV (мм3; Рисунок 4) а также индивидуальный большой объем кисты.
Результаты сердечного анализа
Многие полезные параметры получаются при анализе изображений M Mode. Эти данные обеспечивают хороший снимок сердечной функции левого желудочка (LV) в этот момент времени. Выходные данные включают внутренний диаметр РН, заднюю стенку РН, диаметр передней стенки РН, фракционную фракцию, дробное укорочение, ударный объем, частоту сердечных сокращений, сердечный выброс, объем РН и массу РН. Успех сердечного анализа зависит от точной сегментации слоев на изображении M Mode. Большинство сердечно-сосудистых результатов рассчитываются по пиковым систолическим и диастолическим фазам заднего и переднего эндокардиального слоев. Задний эпикардиальный слой выглядит ярко-белым и следует рисунку, аналогичному заднему эндокардиальному слою. Трассировка заднего слоя эндокарда должна быть размещена на самом нижнем контуре. Передний эндокардиальный слой должен быть прорисован по самому высокому контуру этого слоя. Передний эпикардиальный слой выглядит линейным в нижней части изображения из-за наклонного положения животного (рисунок 2D). На рисунке 6 показан пример одного исследования без существенной разницы в сердечном выбросе между экспериментальными и контрольными мышами. Как и в случае с почечной визуализацией, возможна 3D-визуализация сердца. Тем не менее, 4D-визуализация сердечного цикла (дополнительный рисунок 1) позволяет исследователю визуализировать и точно определять как морфологические, так и циклодинамические аномалии у оцениваемого животного.
Оценка морфологии
Для быстрой и недорогой оценки УЗИ может эффективно контролировать физиологические параметры продольно. Тем не менее, многие исследования хотят дополнительно определить более тонкие морфологические характеристики, например, количество и размеры кист, кальцинатов (камней в почках), васкуляризации или степени фиброза. На рисунке 7 сравнивается нормальная почка мыши с кистозной почкой мыши с умеренно кальцинированной почкой мыши. При увеличении центральной частоты США (10 МГц с линейным массивом) до 35 МГц (усилитель воблера) можно получить изображения с возрастающей детализацией.

Рисунок 1: Размещение ультразвуковой системы и мыши. (А) Схема ультразвуковой системы и расположение датчиков. (B) Вид мышей в положении лежа на спине на ультразвуковой платформе. (C) Пример интересующего региона (ROI) для интересующей области (почки) с идентификаторами животных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
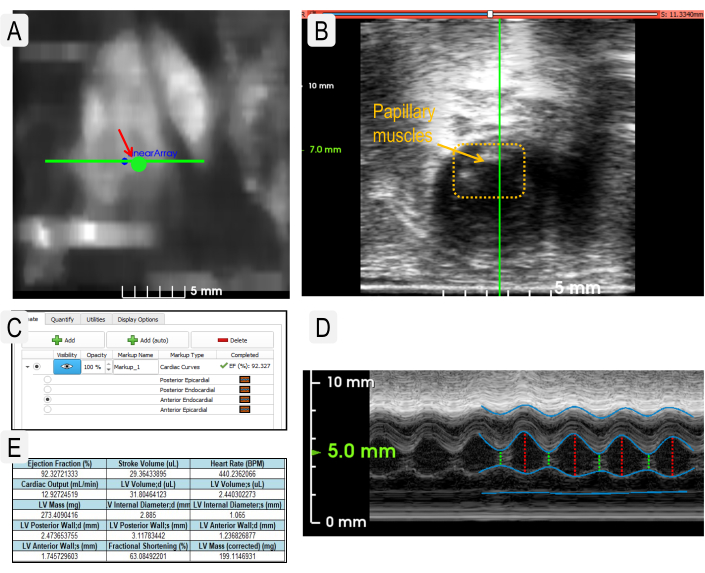
Рисунок 2: Ультразвуковая визуализация сердца для получения физиологических параметров. (A) Использование изображения тепловой карты Heart Finder для позиционирования датчика в левом желудочке для визуализации m-mode. Расположение преобразователя в левом желудочке обозначено большой зеленой точкой. (B) Вид датчика при правильном размещении над сосочковыми мышцами (пунктирная коробка). (C) Пример представления слоев, необходимых для измерения параметров сердца. (D) Вид живого изображения M-Mode со слоями, обозначенными как на панели C. (Слои сверху вниз: задние эпикардиальные, задние эндокардиальные, передние эндокардиальные и передние эпикардиальные.) Е) Пример статистических данных, полученных на основе кардиологических измерений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
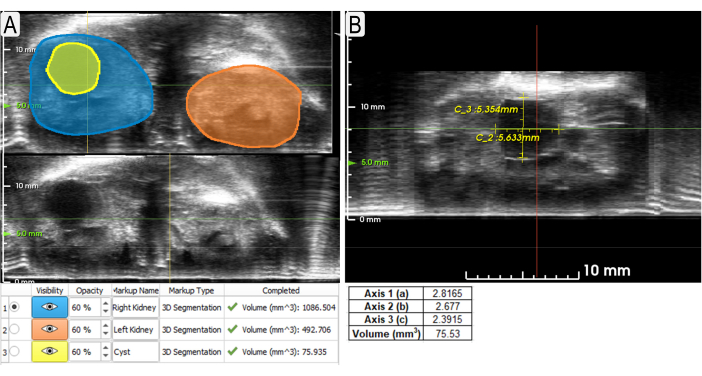
Рисунок 3: Использование инструментов сегментации и суппортов для измерения почек и кисты. (А) Пример сегментации (осевой вид) обеих почек (синее и оранжевое затенение) и большой кисты (желтый) с объемами, перечисленными ниже. Несегментированные представления отображаются внизу, чтобы можно было просматривать незатененные США. (B) Пример использования суппортов для измерения одной и той же кисты (сагиттальный вид) из рисунка 3А с измерениями ниже. Объем вычислялся по формуле для эллипса (объем = (4/3)π x a x b x c, где a, b, c — относительные x, y, z соответственно). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Распределение TKV WT и кистозных почек мыши. Представление TKV для мышей дикого типа (WT) (C57BL/6J) и больных (Pkd1RC/RC). n = 22 (WT) n = 9 (Pkd1RC/RC); Результаты двуххвостого t-теста: p < 0,0001. Коробка показывает значения 25-75-го процентиля, а усы показывают в 1,5 раза больше межквартильного диапазона. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Анимированная 3D-реконструкция сегментированных почек и кисты. Используя программное обеспечение, 3D-проекции почек и кисты могут поворачиваться или раскачиваться в 3D-пространстве (синий = левая почка; желтый = большая киста; оранжевый = правая почка). Пожалуйста, нажмите здесь, чтобы загрузить этот рисунок.
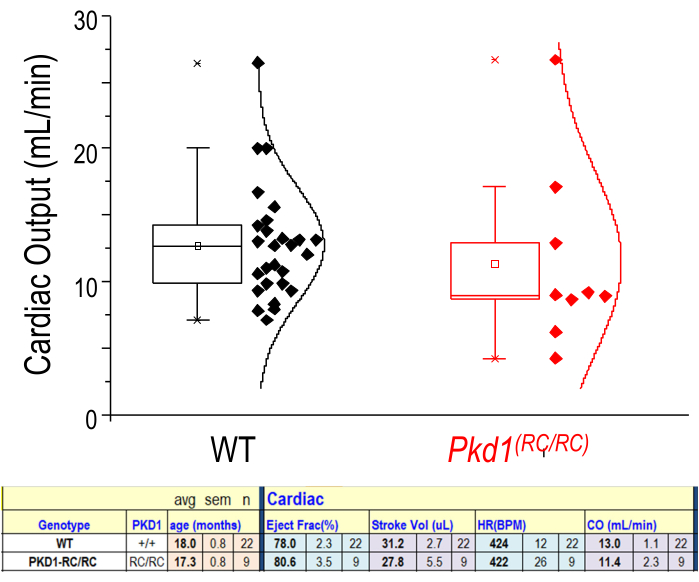
Рисунок 6: Физиологические параметры сердца из измерений УЗИ. Представление сердечного выброса (мл/мин) для WT и больных (Pkd1RC/RC) мышей. n = 22 (WT) n = 9 (Pkd1RC/RC). Более низкие табличные данные показывают, что для этих двух групп нет существенной разницы в фракции выброса, объеме удара, частоте сердечных сокращений (HR) или сердечном выбросе (CO). Результаты двуххвостого т-теста: p > 0,05. В поле показаны значения 25-75-го процентиля. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
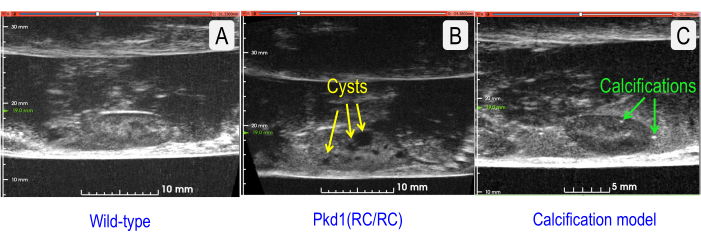
Рисунок 7: Сравнение сагиттальных участков УЗИ нормальной и двух патологий. (А) Почка дикого типа (штамм C57BL/6J) (TKV = 143,202 мм3). (B) Кистозная почка с повышенным TKV (мышь Pkd1RC/RC ) (TKV = 333,158 мм3). Кисты обозначены желтыми стрелками. (C) Почки с сосудистыми кальцификациями (Модель = Дефицит липопротеинов низкой плотности, мышь только с аполипопротеином B100, получавшая западную диету в течение 12 месяцев5) (TKV = 127,376 мм3). Почечные камни обозначены зелеными стрелками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: 4D фильм сердечного цикла из измерений США. Используя программное обеспечение, представление бьющегося сердца захватывается в 3D US и проецируется через сердечный цикл. Зеленая стрелка указывает на аортальный клапан. (Модель = Дефицит липопротеиновых рецепторов низкой плотности, мышь только с аполипопротеином B100, получавшая западную диету в течение 12 месяцев5). Эта модель генерирует сосудистые кальцинаты, что позволяет легче визуализировать сердце и клапаны благодаря большей акустической отражательной способности кальцинатов в США. Подобные 4D-реконструкции возможны с мышами WT; однако захваченный акустический контраст будет не таким высоким. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Ультразвук использует звуковые волны, и любые барьеры для распространения звуковых волн будут мешать качеству изображения. Таким образом, полная эпиляция области, подлежащей изображению, имеет решающее значение. Также важно обеспечить полное удаление крема для депиляции, так как он может вызвать ожоги/раздражение кожи животного и обесцвечивать прозрачную мембрану сканера. Адекватные уровни воды в заливах необходимы для оптимального распространения звуковой волны, что необходимо для получения самого высокого разрешения изображения. Однако, когда животное находится в положении лежа, убедитесь, что морда животного находится выше уровня воды, иначе животное подвергается риску вдыхания воды. Оптимизация параметров изображения, особенно глубины фокусировки, имеет решающее значение для получения высококачественных изображений. Изменения параметров могут потребоваться для отдельных животных.
Роботизированные США предоставляют много преимуществ по сравнению с традиционными ручными американскими модальностями. Во-первых, система использует простой интерфейс на основе камеры «укажи и щелкни». Эта функция решает сложность обычных США и создает согласованные данные даже при работе с начинающим пользователем6. Во-вторых, система позволяет использовать воду, а не традиционный американский гель в качестве акустической среды. Ранее использование американского геля позволяло образовывать пузырьки, которые мешали качественному получению изображения. Кроме того, американский гель грязный и создает проблемы для очистки. Далее вода нагревается тепловой лампой и помогает поддерживать температуру тела животного. В-третьих, роботизированные США быстрее, поэтому артефакты от дыхательного движения не проблематичны. Увеличенная скорость обработки изображений позволяет практически завершить сбор данных с высокой пропускной способностью. В-четвертых, роботизированные США получают 3D-изображения, и поэтому делают 3D-реконструкцию объектов простой (рисунок 4). МРТ и другие методы являются дорогостоящими, трудоемкими и не всегда доступными. Важно отметить, что роботизированная американская система помещается на столе или скамейке и является более экономичной. Наконец, предыдущая работа показала, что роботизированные США могут предоставлять сопоставимые данные измерений для более дорогих методов, таких как MRI3.
Хотя качество изображения и разрешение роботизированной системы США, описанные в этой работе, были адекватны для предлагаемого приложения (рисунок 7), существует несколько способов улучшения качества изображения в будущем. Например, использование высокочастотных преобразователей (например, 50-70 МГц) приведет к получению изображений с более высоким разрешением и лучшей четкостью функций. Хотя использование более высоких частот приведет к снижению глубины проникновения, изображений должно быть достаточно для визуализации in vivo поверхностных органов, таких как почки мыши. Как и в случае с другими методами визуализации, контрастные вещества могут использоваться для улучшения конкретных функций. Для США это обычно означает использование чего-то, что сильно отражает звуковые волны. Внутрисосудистые микропузырьки, в которых липиды окружают очень маленькие пузырьки газа, являются одним из таких агентов. Пузырьки газа микронного размера обладают высокой отражающей способностью и, таким образом, обеспечивают второй отчетливый сигнал, который переводится в сосудистую систему с высоким разрешением7. Хотя этот метод акустического контраста может быть весьма полезным, он может иметь несколько недостатков. Во-первых, микропузырьки должны быть свежими и сохраняться in vivo только в течение 5-10 минут. Во-вторых, внутрисосудистая инъекция in vivo обычно требует катетеризации хвостовой вуали для инъекции, и это может быть технически сложной задачей. При определенных обстоятельствах и пульсирующих режимах микропузырьковая визуализация сама по себе может привести к повреждению почечных сосудов8.
Существуют также некоторые более общие ограничения конкретной используемой системы США. Во-первых, в роботизированное шасси включен только один линейный массив (центрированный на частоте 18 МГц), поэтому переход на зонды с более высокой или низкой частотой в настоящее время невозможен. Это может повлиять на широту моделей (больших или меньших), которые могут быть оценены с помощью системы. Будущие итерации прибора должны включать в себя несколько линейных массивов, охватывающих весь спектр доклинических моделей животных. Во-вторых, угол преобразователя относительно животного субъекта не может контролироваться. Поэтому выполнение методов визуализации, зависящих от угла, таких как допплерография, или достижение альтернативных плоских видов определенных органов (например, вид почек с длинной осью) требует перепозиционирования животного и может быть трудно достижимым. Дополнительные степени свободы могут быть добавлены к роботизированному движению, чтобы улучшить эту проблему. В-третьих, иногда мы наблюдали артефакты реверберации, возникающие из акустической мембраны, которая отделяет животное от преобразователя, что может скрывать визуализацию поверхностных особенностей и границ. В этих случаях использование гелевого противостояния для поднятия животного от мембраны может исправить ситуацию. Наконец, контроль температуры с помощью тепловой лампы неточен, и поэтому при визуализации необходимо уделять пристальное внимание температуре тела животного. Более контролируемые механизмы нагрева, такие как интегрированная грелка, вероятно, улучшат управление гомеостазом и пропускную способность визуализации.
Использование роботизированных США может быть применимо к различным областям исследований. Эта технология позволяет визуализировать грубые тканевые структуры, таким образом, может быть использована для отслеживания прогрессирования опухоли и потенциальных методов лечения6,9, а также почечной морфологии, представленной здесь. Возможность сегментации специфических особенностей изображений делает его привлекательным инструментом для изучения моделей поликистоза почек (ПОКД)3. Изображения в М-режиме позволяют просто количественно оценить многие важные параметры сердца, что позволяет in vivo оценивать физиологию сердца. Поскольку почки получают 20%-25% сердечного выброса10, важно понимать сердечную функцию во время продольной оценки почечной патологии. С помощью этих протоколов США мы попытались проиллюстрировать, что визуализация США не только практична для исследований in vivo и продольных почек, но и что все более американские инструменты позволяют как морфологические, так и физиологические оценки мышей в доклинических исследованиях.
Раскрытие информации
Несколько авторов либо работают, либо имеют значительный финансовый интерес, либо являются соавторами патентов, лицензированных SonoVol, Inc. (CJM, RCG, TJC).
Благодарности
Эта работа была поддержана NIH (R43-DK126607, TJC, TLK, MFR) и Фондом Майо.
Материалы
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
Ссылки
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107(2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021. Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены