Method Article
Pletismografía de cuerpo entero simplificada para caracterizar la función pulmonar durante la melioidosis respiratoria
En este artículo
Resumen
Este protocolo presenta la construcción y el uso de un aparato de pletismografía simplificada de cuerpo entero para monitorear la progresión de la enfermedad respiratoria bacteriana de forma no invasiva.
Resumen
Los modelos animales sustitutos de la enfermedad están sujetos a las 3R de la Investigación Responsable. Hay una revisión frecuente de los refinamientos de los modelos animales para garantizar que tanto el bienestar animal como los conocimientos científicos avancen con la disponibilidad de nuevas tecnologías. Este artículo demuestra el uso de la pletismografía simplificada de cuerpo entero (parm s) para estudiar de forma no invasiva la insuficiencia respiratoria en un modelo de melioidosis respiratoria letal. sWBP tiene la sensibilidad para detectar la respiración en ratones a lo largo de todo el curso de la enfermedad, lo que permite medir los síntomas asociados a la muerte (bradipnea e hipopnea) y potencialmente usarlos para desarrollar criterios de valoración humanos.
Algunos de los beneficios del sWBP en el contexto de la enfermedad respiratoria son que la monitorización de la respiración del huésped es lo más cercano de cualquier medición fisiológica para evaluar la disfunción del tejido infectado primario, a saber, el pulmón. Además de la importancia biológica, el uso de sWBP es rápido y no invasivo, minimizando el estrés en animales de investigación. Este trabajo demuestra el uso del aparato interno de sWBP para monitorear la enfermedad a lo largo del curso de la insuficiencia respiratoria en el modelo murino de melioidosis respiratoria.
Introducción
Los patógenos bacterianos respiratorios a menudo se asocian con una respuesta inflamatoria en el pulmón que conduce a la patología pulmonar 1,2. En el entorno clínico, el diagnóstico de neumonía generalmente incluye técnicas de cultivo de esputo, análisis de saturación de oxígeno en sangre y radiografía de tórax. Estas técnicas se pueden traducir para modelos de infección de animales pequeños, pero solo el análisis de saturación de oxígeno representa un análisis rápido y en tiempo real en ratones para determinar la gravedad de la enfermedad. La saturación de oxígeno en sangre (SpO2) se investigó previamente como un método para rastrear la progresión de la enfermedad en estudios de enfermedades respiratorias; sin embargo, los ratones moribundos tienen lecturas inesperadamente altas de SpO2 tanto enun modelo 3 de Pseudomonas aeruginosa, que no son la enfermedad predictiva o moribunda, probablemente porque los ratones pueden modular su actividad fisiológica. Con este fin, hasta el momento no se encontraron niveles diagnósticos de SpO2 para la enfermedad respiratoria bacteriana en ratones.
Por lo tanto, este trabajo investigó el uso de otros métodos clínicamente relevantes para detectar los efectos de la enfermedad pulmonar en la función pulmonar como una medición fisiológica rápida. La pletismografía simplificada de cuerpo entero (sWBP) ofrece la oportunidad de investigar la frecuencia respiratoria y la profundidad como un análisis biométrico rápido y no invasivo. Estudios previos han demostrado cómo ensamblar aparatos WBP en un laboratorio4; sin embargo, varios de los componentes mostrados en tales estudios no están actualmente disponibles comercialmente. Además, el WBP tradicional requiere una recopilación y procesamiento de datos complejos basados en la humedad y la temperatura 5,6. Por lo tanto, se decidió desarrollar un aparato WBP simplificado que se calibra diariamente a temperatura / humedad ambiente y evaluar si la contribución de temperatura / humedad del sujeto en sí tiene algún efecto sobre el volumen de respiración medido. Por lo tanto, se ha creado un aparato sWBP modificado que obtiene los materiales disponibles actualmente. Además, se ha investigado si este aparato de laboratorio puede detectar cambios en la respiración asociados con la progresión de la enfermedad durante el modelo de melioidosis respiratoria letal en ratones.
El aparato sWBP construido para este trabajo utilizó equipos y software disponibles comercialmente para procesar datos de sensores de presión analógicos en una lectura digital. El sensor de presión se instaló en un frasco de vidrio hermético con conectores de mamparo. El beneficio de un frasco de vidrio es la rigidez estructural del material, que resistirá los cambios en la presión interna del frasco, afectando las mediciones de los cambios de volumen durante el monitoreo de la respiración. La cámara de muestreo ha sido diseñada para tener dos puertos en las dos superficies planas del frasco cuadrado, uno para acceder a la cámara mediante un conector Luer para la calibración y el otro para albergar el sensor de presión. El sensor de presión seleccionado tiene un transductor de presión manométrica altamente sensible con un rango para pequeños cambios de presión (rango de 25 mbar).
Este protocolo se demuestra utilizando un modelo murino de melioidosis respiratoria. Burkholderia pseudomallei (Bp) es el agente bacteriano de la melioidosis - una enfermedad asociada a las regiones tropicales del mundo7. La Bp se encuentra en el medio ambiente, específicamente en ambientes húmedos de agua estancada y suelo húmedo, de los cuales generalmente causa infecciones subcutáneas de cortes / arañazos de huéspedes susceptibles. Sin embargo, la Bp también es infecciosa cuando se inhala y es una amenaza potencial para su uso en bioterrorismo por dispersión de aerosoles. Mientras que la Bp totalmente virulenta requiere manipulación en un laboratorio BSL-3, previamente se diseñó una cepa mutante acapsular, que puede manejarse con seguridad en BSL-2 y excluirse de los criterios de agente selecto8. Además, se ha desarrollado un modelo de infección intratraqueal mediada por intubación (IMIT) de melioidosis respiratoria para estudiar la progresión de la enfermedad respiratoria de Bp 5,9. Hemos utilizado este modelo de infección para caracterizar el cambio en la respiración que ocurre durante la progresión de la enfermedad a través del punto final moribundo.
Protocolo
Los procedimientos descritos aquí fueron revisados y aprobados por el Comité Institucional de Bioseguridad de la Universidad de Louisville (protocolo # 14-038) y el Comité Institucional de Cuidado y Uso de Animales (protocolo # 19567).
1. Montaje de la cámara de muestreo
- Cree dos orificios usando una broca de diamante de 3/4" en una prensa de perforación en las superficies planas de un frasco de conservas Mason de boca ancha de vidrio cuadrado de 600 ml con junta de 95 mm y tapas herméticas, con tapas de abrazadera de fianza y gatillo (Figura 1).
NOTA: Una cámara de muestreo no está disponible comercialmente y debe ser construida. - Ensamble un mamparo de latón (rosca interna NPT de 1/4", rosca externa UNF 3/4-16) a través de ambos orificios en el frasco Mason usando arandelas de goma (diámetro interior de 3/4", diámetro exterior de 1") en ambas caras de contacto entre el mamparo y el vidrio para garantizar un sello hermético.
- Utilice un conjunto de mamparo para un sensor de presión mientras fija el otro mamparo mediante una jeringa conectada a Luer para fines de calibración.
- Para el sensor de presión, envuelva las roscas NPT de 1/4" de un transductor de presión manométrica de alto rendimiento con cinta de teflón y enhebralas en el mamparo. Utilice un soldador para conectar el cableado del sensor de presión a un conector DIN macho de 8 pines, utilizando las instrucciones de cableado del fabricante para interactuar con un dispositivo de adquisición de datos de alta calidad disponible comercialmente (consulte la Tabla de materiales).
NOTA: Esto requiere el uso de una resistencia de película metálica de 150 K ohmios 1/8 vatios 1% dentro del cableado del conector DIN. - Para el puerto de calibración, utilice un adaptador NPT macho de 1/4" a NPT hembra de 1/8" para conectar un NPT macho de 1/8" a un conector niquelado Luer lock hembra al mamparo de latón que envuelve las conexiones roscadas con cinta de teflón. Use una tapa Luer macho roscada de polipropileno para sellar el conector Luer cuando no esté en uso.
NOTA: No apriete demasiado los conectores del mamparo en el frasco de vidrio, ya que esto desarrollará grietas. Si se desea, se puede agregar silicona a las juntas de goma para garantizar un sello hermético de los mamparos al frasco de vidrio.
- Para el sensor de presión, envuelva las roscas NPT de 1/4" de un transductor de presión manométrica de alto rendimiento con cinta de teflón y enhebralas en el mamparo. Utilice un soldador para conectar el cableado del sensor de presión a un conector DIN macho de 8 pines, utilizando las instrucciones de cableado del fabricante para interactuar con un dispositivo de adquisición de datos de alta calidad disponible comercialmente (consulte la Tabla de materiales).
2. Configuración del sistema
- Conecte la cámara de muestreo a un amplificador puente mediante un conector DIN de 8 pines y el amplificador puente al dispositivo de adquisición de datos, siguiendo las instrucciones del fabricante.
- Conecte el dispositivo de adquisición de datos a una fuente de alimentación y a una computadora que ejecute software de análisis de datos fisiológicos utilizando los cables del fabricante.
NOTA: Asegúrese de que el dispositivo de adquisición de datos esté encendido y calentado durante al menos 5 minutos antes de usarlo para asegurarse de que el sensor estabilice sus mediciones. - Inicie el software para interactuar con el sistema de adquisición de datos.
- Descargue el módulo de espirometría opcional dentro del software y modifique la configuración predeterminada de la unidad de L / s a μL / s en la ventana Configuración de > de espirometría .
3. Calibración del sistema
- Dentro del software, cree una ventana de 4 canales con las siguientes ventanas de datos: Canal 1: Datos de origen a una frecuencia de muestreo de 4 k/s y un rango de 1 mV; Canal 2: Filtro digital del canal 1 con un filtro de ajuste automático de paso alto de 1 Hz; Canal 3: Suavizado de los datos del canal 2 mediante un promedio de 100 muestras; Canal 4: Flujo de espirometría de datos del canal 3 (cabezal de flujo personalizado, calibrado a fórmula (μL/s) = 120.000 x voltaje).
NOTA: 120.000 es un coeficiente de correlación de marcador de posición que se modificará durante la calibración. - Configure el análisis DataPad de Channel 4 con las siguientes columnas: Columna 1: Datos de Channel 4, comentarios > texto completo del comentario; Columna 2: Datos del canal 4, mediciones cíclicas > frecuencia cíclica media; Columna 3: Datos del canal 4, mediciones cíclicas > altura cíclica media.
- Establezca la velocidad de fotogramas en 100:1 en la esquina inferior derecha de la pantalla del gráfico. Guarde esta configuración de ventana como plantilla para todos los estudios futuros.
- Cierre la tapa de la cámara de muestras y conecte una jeringa hermética al gas de 25 μL al conector del mamparo Luer. Ajuste la jeringa con un adaptador Chaney configurado para entregar repetidamente un volumen de 20 μL.
NOTA: Se puede usar una pieza corta opcional de tubo de 1/16" y conectores Luer/púa para conectar la jeringa a la cámara de muestra. Sin embargo, se deben evitar los tubos largos para evitar cambios significativos en el volumen total de aire de la cámara de muestras. - Introduzca 20 μL de aire en la jeringa utilizando el tope de profundidad del adaptador Chaney.
- Ponga a cero la pleth en el software (Configuración > cero todas las entradas (Alt-Z)) e inicie una grabación.
- Durante la grabación, y con una línea de base estable, presione / retire rápidamente el émbolo de la jeringa durante aproximadamente 10 repeticiones para replicar la respiración del sujeto con una respiración medida de 20 μL. Detenga la grabación.
NOTA: La frecuencia de las respiraciones artificiales debe exceder los 2 Hz para maximizar la reproducibilidad de la calibración. - Etiquete la identidad de la muestra medida haciendo clic con el botón derecho en el comienzo de la grabación de pleth numerada y haga clic en Agregar comentario.
- Restablezca la jeringa, ponga a cero la entrada y repita las mediciones de grabación de pulsos de 20 μL dos veces adicionales (tres sesiones de grabación en total).
- Después de completar todas las mediciones, use el mouse de la computadora para seleccionar una porción de pleth respiratorio que represente con precisión las respiraciones artificiales de 20 μL.
NOTA: Dentro del módulo DataPad, los datos aparecerán en el encabezado de vista previa proporcionando una lectura temporal de la frecuencia respiratoria (frecuencia cíclica promedio, Hz) y la profundidad de respiración (altura cíclica promedio, μL). La vista previa de datos se puede grabar en DataPad utilizando el icono Agregar a DataPad . - Revise los datos de la columna 3 (Altura cíclica promedio) y calcule el volumen de respiración promedio medido a partir de las tres grabaciones. Realice el siguiente cálculo del volumen de respiración medido promedio: Coeficiente de calibración = volumen entregado / volumen medido x 120,000.
NOTA: 120.000 fue el coeficiente de calibración del cabezal de flujo utilizado en el paso 3.1 ahora modificado a partir de los datos medidos. El sistema ahora está calibrado para la respiración típica del ratón utilizando la temperatura y humedad ambiental actuales. El sistema ahora puede monitorear la respiración del sujeto, y la calibración se puede volver a realizar diariamente para tener en cuenta cualquier fluctuación en la temperatura / humedad.
4. Seguimiento de la asignatura
- Abra una plantilla maestra como se describe en el paso 3.4 o complete los pasos 4.2 a 4.3.
- Dentro del software, cree una ventana de 4 canales con el siguiente procesamiento de datos: Canal 1: Datos de origen a una frecuencia de muestreo de 4 k/s y un rango de 1 mV; Canal 2: Filtro digital del canal 1 mediante un filtro High Pass 1 Hz Auto Adjust; Canal 3: suavizado de los datos del canal 2 mediante un promedio de 100 muestras; Canal 4: Flujo de espirometría de datos del canal 3 (cabezal de flujo personalizado, calibrado a fórmula (μL/s) = 120.000 x voltaje).
NOTA: 120.000 es el coeficiente de correlación calculado para el sensor de presión de corriente; Sin embargo, el usuario debe realizar la calibración del sistema descrita en el paso 3 y utilizar este coeficiente de correlación definido por el usuario en su lugar. - Configure el análisis DataPad de Channel 4 con las siguientes columnas: Columna 1: Datos de Channel 4, comentarios > texto completo del comentario; Columna 2: Datos del canal 4, mediciones cíclicas > frecuencia cíclica media; Columna 3: Datos del canal 4, mediciones cíclicas > altura cíclica media.
- Coloque el sujeto en la cámara de muestreo y cierre la tapa. Para este experimento se utilizó un ratón albino C57BL / 6J hembra consciente de 4-12 semanas (B6 (Cg)-Tyrc-2J / J).
- Iguale la presión atmosférica en la cámara (al sellar la tapa) aflojando brevemente la tapa del mamparo Luer y vuelva a apretar.
- Observe que el sujeto no se está moviendo activamente dentro de la cámara de muestreo antes de poner a cero todas las entradas (acceso directo Alt-Z) y comenzar una grabación.
NOTA: Si el sujeto comienza a moverse en la cámara de muestreo, la línea de base puede moverse fuera de la escala, lo que puede abordarse volviendo a poner a cero todas las entradas en medio de una grabación, lo que creará una nueva grabación en la escala. Supongamos que el sujeto se dedica a la exploración o aseo durante la grabación; Observe qué parte de la grabación de la pletismografía refleja con mayor precisión la respiración normal. - Etiquete la identidad del sujeto haciendo clic derecho en el comienzo de la grabación de pleth numerada y haga clic en Agregar comentario.
- Devuelva el sujeto a su jaula. Limite el tiempo de permanencia en la cámara de muestreo sellada a 5 minutos para evitar asfixia y estrés.
NOTA: El riesgo de asfixia es bajo dado que el volumen de aire de 600 ml de la cámara de muestras no será gastado rápidamente por un ratón sano que respira a <15 ml / min. - Use el mouse de la computadora para seleccionar una porción de pleth de respiración que represente con precisión la respiración del sujeto.
NOTA: Dentro del módulo DataPad, los datos aparecerán en el encabezado de vista previa proporcionando una lectura temporal de la frecuencia respiratoria (frecuencia cíclica promedio, Hz) y el volumen de respiración (altura cíclica promedio, μL). La vista previa de datos se puede grabar en DataPad utilizando el icono Agregar a DataPad . - Continúe midiendo los ratones sujetos uno a la vez y registrando secciones representativas de la pleth respiratoria en DataPad.
- Después de grabar los datos, exporte los datos de DataPad a Excel. Calcule el volumen minuto de la siguiente manera: Volumen minuto (ml/min) = frecuencia respiratoria (Hz) x volumen respiratorio (μl) x 0,06.
Resultados
Calibración del sistema
El software de análisis de datos permite la calibración directa de un cabezal de flujo personalizado, como el que se describe en este documento. Esto se realiza al configurar el flujo de espirometría Como se describe en el paso 3.1, existe una opción para ingresar el volumen de aire de calibración conocido, que calcula el coeficiente de correlación voltaje-volumen dentro del sistema. Esto, sin embargo, genera un coeficiente de correlación basado en una sola lectura, y se ha observado que la variación inherente de la calibración de un estándar n = 1 tiene poca utilidad. El enfoque actual puede abordar esta deficiencia y permite al usuario realizar una calibración diaria utilizando múltiples lecturas promediadas para calcular un coeficiente de calibración. La calibración con 20 μL de aire inyectado se demostró aquí, lo que representa un volumen de respiración típico de alta gama en un ratón típico. El software asume una intercepción de origen (0,0) y, por lo tanto, se calibra de 0 a 20 μL utilizando este enfoque.
La metodología propuesta aquí para sWBP se calibra diariamente, teniendo en cuenta así cualquier fluctuación en la humedad / temperatura ambiental. Los métodos originales utilizados para el WBP específico, se remontan a la metodología de Drorbaugh y Fenn de 1955, quienes desarrollaron WBP para medir la ventilación en bebés humanos5. Los cálculos de Drorbaugh y Fenn tienen en cuenta las variaciones de temperatura y humedad del ambiente y del sujeto. El enfoque actual corrige las fluctuaciones ambientales calibrando cada sesión de sWBP. Aún así, se decidió abordar si el calentamiento y la humidificación de la respiración a través de la cavidad nasal / pulmón de un ratón afectan la medición de un volumen conocido de aire. Por lo tanto, se creó un aparato artificial para imitar el efecto del sujeto en las mediciones de aire calibrado de calentamiento y humidificación. Los conectores Luer se unieron a un tubo cónico de 15 ml y colocaron este cónico sellado en línea entre la cámara de muestra y la jeringa de calibración hermética al gas. Se realizó una calibración de 20 μL utilizando un tubo cónico vacío mantenido a temperatura ambiente (23 °C). El tubo cónico se llenó parcialmente con agua destilada justo debajo de los conectores Luer, lo que permitió que el tiempo equilibrara el espacio de cabeza del cónico; El volumen de calibración se volvió a medir para investigar el efecto de la humedad. El tubo cónico se colocó en un bloque de calentamiento y se equilibró a 37 °C en un ambiente húmedo, y finalmente se equilibró a 37 °C sin agua para evaluar el efecto del calentamiento del sujeto y sin aporte adicional de humedad. La Figura 2 demuestra que todas las condiciones probadas no afectaron significativamente la medición calibrada de 20 μL proporcionada por la jeringa estanca al gas. A partir de este hallazgo, se concluyó que sWBP ofrece un enfoque accesible para monitorear la respiración en animales de investigación sin la necesidad de cálculos complejos basados en la temperatura y la humedad del sujeto animal, ya que estos no tienen un impacto significativo en el volumen de respiración medido.
Seguimiento de asignaturas
El pbm se utilizó para controlar la respiración durante la enfermedad de infecciones respiratorias letales con el patógeno bacteriano B. pseudomallei. Un desafío de monitorear la respiración en animales conscientes es la curiosidad de los animales sanos normales que se mueven dentro de la cámara de muestra. El movimiento del ratón crea una línea de base en constante movimiento que puede mitigarse en parte mediante el preacondicionamiento de los sujetos a la cámara durante un período de varios días antes de la medición. Este problema afecta principalmente a la medición de referencia en ratones sanos, ya que los sujetos se vuelven letárgicos durante la infección, lo que hace que el sWBP sea mucho más manejable con una actividad reducida del sujeto. Puede ser tentador intentar usar algún tipo de restricción, ya sea física o de anestesia. El uso de la restricción física puede afectar la respiración natural al causar estrés. Además, se sabe que el uso de anestésicos tiene efectos pronunciados sobre la frecuencia respiratoria y la profundidad10; por lo tanto, se decidió investigar el impacto de la anestesia con el aparato interno de sWBP. El isoflurano se usa comúnmente para realizar imágenes de diagnóstico in vivo durante los modelos de infección y, por lo tanto, un ratón C57BL / 6 fue anestesiado y monitoreado la progresión hasta la recuperación de la anestesia usando sWBP. Este ensayo se realizó con un ratón albino C57BL / 6J juvenil de 4 semanas de edad para prolongar la ventana de recuperación de la anestesia. La Figura 3 demuestra que el anestésico preferido hace que los ratones exhiban una frecuencia respiratoria lenta con un gran volumen corriente de aire. A medida que los ratones comienzan a recuperarse de la sedación, su frecuencia respiratoria aumenta y el volumen de la respiración disminuye, con el efecto neto de que el aire inspirado total aumenta lentamente. En este ensayo, se encontró que el volumen de la respiración se restaura a los niveles previos a la anestesia dentro de los primeros 30 s de recuperación. La frecuencia respiratoria aumenta constantemente hasta que la respiración basal se restablece a 2-2.5 minutos después de la retirada de la anestesia. El volumen minuto siguió de cerca los efectos de la frecuencia respiratoria, alcanzando el volumen minuto basal a los 2,5 minutos después de la retirada de la anestesia. Este hallazgo apoya que la anestesia no debe emplearse en el enfoque de pbs. No es sorprendente que afecte dramáticamente la respiración basal, ya que la anestesia ralentizará el metabolismo del huésped, creando una demanda reducida de oxígeno inspirado. El saneamiento de la cámara de muestra también debe considerarse entre sujetos para abordar el control de infecciones específicas del estudio, así como el impacto de las feromonas de la orina o las heces que podrían afectar el estrés entre los sujetos.
El WBP es una estrategia atractiva para monitorear la función pulmonar en modelos de enfermedades respiratorias de manera no invasiva. Se utilizó sWBP para estudiar cómo cambia la respiración durante las infecciones letales por melioidosis respiratoria (Figura 4), con puntos de tiempo que reflejan la monitorización de la bioluminiscencia en el pulmón. Se observó que este modelo se asocia con un inicio temprano de letargo, que persiste de manera lentamente progresiva hasta el desarrollo de la enfermedad moribunda aproximadamente 3 días después de la infección. También se observó que la frecuencia respiratoria y el aire inspirado total (volumen minuto) de los ratones disminuyen rápidamente durante el primer día de infección y permanecen bajos durante el resto del curso de la infección (Figura 4A, C). Este patrón es consistente con el letargo de inicio temprano, que persiste durante los próximos 2 días de la infección. Por el contrario, el volumen de la respiración no disminuye bruscamente durante las primeras 24 h y, en cambio, tiene una disminución leve y constante, que se acerca a una disminución lineal durante el curso de 3 días de la enfermedad (Figura 4B).

Figura 1: aparato sWBP. Se construyó una cámara de muestras personalizada a partir de un frasco de vidrio cuadrado sellable con conectores de mampara en dos caras planas. Se utilizó un mamparo para montar un sensor de presión manométrica conectado a un amplificador de puente y un digitalizador de dispositivos de adquisición de datos a través de una conexión DIN de 8 pines. El segundo mamparo estaba equipado con un conector Luer para la calibración mediante una jeringa estanca al gas. El dispositivo estaba conectado a una PC que ejecutaba el software. Haga clic aquí para ver una versión más grande de esta figura.
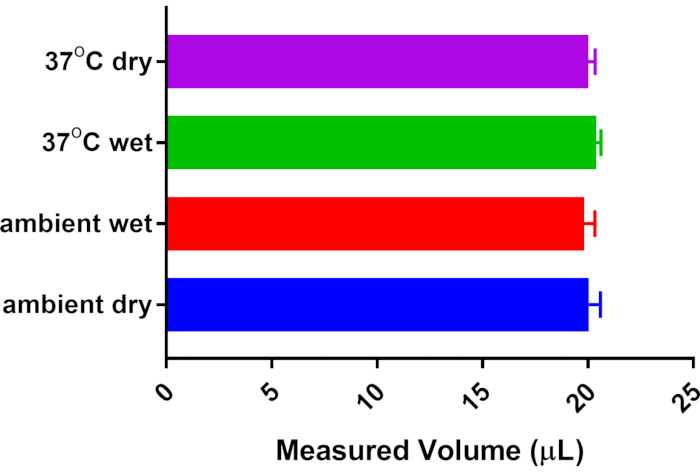
Figura 2: Efecto de la temperatura y humedad del sujeto en el volumen de aliento. Se instaló un tubo cónico de 15 ml con conectores Luer en línea entre la jeringa de calibración de 20 μL y la cámara de muestras. El sistema se calibró a 20 μL sin contribución adicional de temperatura/humedad del tubo cónico. Otras mediciones se recogieron después del equilibrio con la humedad saturada del agua destilada y / o el calentamiento del tubo cónico de la temperatura ambiente (23 ° C) a la temperatura corporal (37 ° C). No se detectaron diferencias significativas a partir de n = 5 mediciones de cada condición mediante ANOVA unidireccional con la prueba posterior de comparación múltiple de Tukey. Haga clic aquí para ver una versión más grande de esta figura.
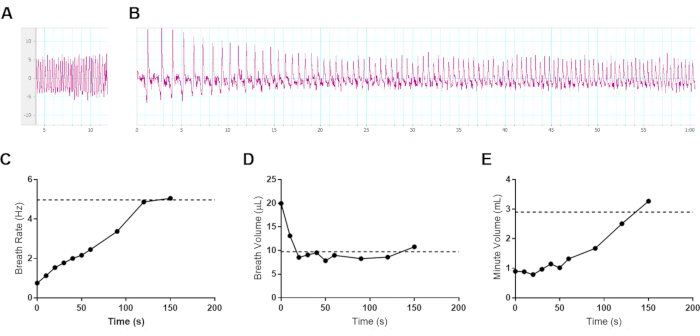
Figura 3: Efecto de la anestesia gaseosa en la respiración en ratones. Los datos representativos de una hembra de ratón albino C57BL / 6J de 4 semanas de edad (8,6 g) se sedaron durante 5 min con isoflurano al 3% en oxígeno y se transfirieron a una cámara de muestras sWBP. Los datos pleth se recogieron durante 150 s después de la retirada de la anestesia. El sujeto comenzó la deambulación inicial a los 100 s después de la retirada de la anestesia. (A) Respiración basal antes de la anestesia, midiendo una frecuencia respiratoria de 4.97 Hz, un volumen de respiración de 9.74 μL y un volumen minuto de 2.91 ml. (B) Los primeros 60 s de cambios en la respiración durante la recuperación de la anestesia. (A-B) Eje vertical que mide μL por respiración y eje horizontal en segundos. (C-E) Los datos de ventilación se recolectaron durante los 150 s de recuperación de la anestesia, promediados de ≥3 ciclos de respiración por punto de tiempo para (C) Frecuencia respiratoria, (D) Volumen de respiración y (E) Volumen minuto calculado. Los valores basales previos a la anestesia se indican con una línea punteada horizontal en cada gráfico respectivo. Haga clic aquí para ver una versión más grande de esta figura.
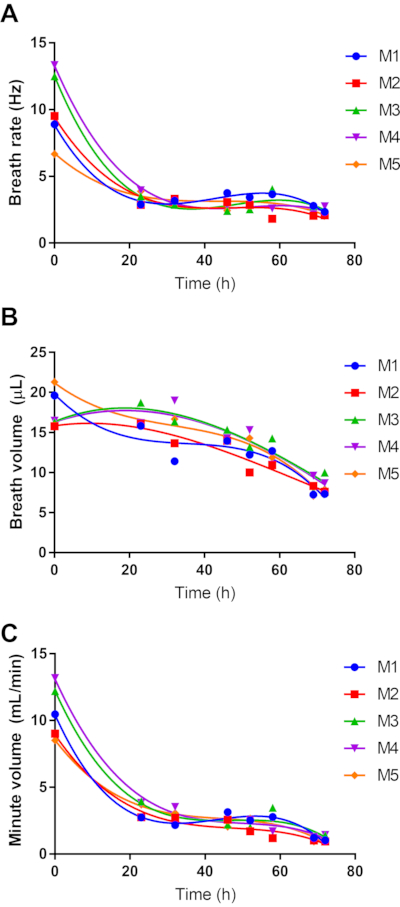
Figura 4: Efecto de la melioidosis respiratoria en la respiración del huésped. Cinco ratones hembra C57BL/6 de 8 semanas fueron infectados con 4.9 log CFU de la cepa bioluminiscente de B. pseudomallei JW270. El pbp se realizó durante el curso de 3 días de la infección, midiendo la frecuencia respiratoria (A) y el volumen de la respiración (B). El aire inspirado total se calculó como el volumen minuto (C). Los datos para cada uno de los cinco sujetos se representan de forma independiente con regresión polinómica de tercer orden. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
sWBP es un enfoque atractivo para mejorar la comprensión de la infección respiratoria en modelos de animales pequeños. Es importante destacar que es un enfoque no invasivo y, como tal, no representa un riesgo significativo de causar estrés indebido a los animales de investigación durante un desafío de infección. De hecho, el procedimiento de monitoreo de la respiración del sujeto es una prueba rápida que requiere varios minutos y un manejo mínimo del sujeto. El beneficio científico es la comprensión de alta resolución de cómo los patógenos microbianos influyen en la función pulmonar durante la enfermedad. Este enfoque proporcionará beneficios a la investigación básica, facilitando la comprensión de cómo un patógeno causa la enfermedad, así como proporcionando una utilidad traslacional para comprender cómo una nueva terapéutica restaura un sujeto de investigación a un estado de salud respiratoria.
En este manuscrito, se proporcionan resultados representativos para el patógeno B. pseudomallei, que causa una respuesta letárgica temprana. No todas las infecciones pulmonares bacterianas se presentan de la misma manera en los modelos de infección de ratón. La experiencia previa con otros modelos de infección ha demostrado que el patógeno bacteriano Klebsiella pneumoniae se presenta como una infección asintomática hasta el punto en que los ratones sucumben a la infección, también aproximadamente en el día 3 después de la infección11. Se plantea la hipótesis de que la demanda del huésped de aire inspirado (es decir, volumen diminuto) puede relacionarse estrechamente con el grado de letargo con el que se presenta una enfermedad determinada. Se requerirán estudios futuros para examinar cómo los diferentes patógenos bacterianos afectan la función pulmonar durante la enfermedad respiratoria. Se entiende que los diferentes patógenos tienen enfoques únicos para evadir la defensa del huésped, incluidas las diferencias en, (1) la propensión a ser patógenos intracelulares o extracelulares, (2) la capacidad de causar una respuesta hipotérmica temprana / tardía, y (3) el uso de diferentes repertorios de determinantes de virulencia 3,12,13. Por lo tanto, es probable que diferentes estrategias de enfermedad den lugar a efectos únicos sobre la función pulmonar y la respiración durante la infección.
La configuración recomendada descrita en este protocolo se puede modificar para adaptarse a los desafíos únicos presentes durante sWBP. Uno de los problemas comunes experimentados durante una sesión de grabación de sWBP es el movimiento del sujeto dentro de la Cámara de Muestras. Como se mencionó, este movimiento modifica la línea de base y puede afectar la precisión de las mediciones de respiración. Se utilizó un filtro digital para normalizar la línea de base cambiante, lo que permite mediciones de respiración viables a pesar de pequeños movimientos. El movimiento excesivo puede empujar una medición de línea base fuera del rango de una entrada a cero. Las grabaciones se recomiendan en un rango de 1 mV (ajuste del canal 1), lo que proporciona un compromiso de seguir observando los picos de la pletismografía y evitar la pérdida de datos fuera del rango. Para sujetos excepcionalmente activos, puede ser necesario ampliar el rango de grabación >1 mV para evitar señales persistentes fuera de rango.
El procedimiento recomendado requiere una calibración diaria (o en cada sesión) para adaptarse a las fluctuaciones de humedad / temperatura ambiental. El WBP tradicional utiliza cálculos complejos que tienen en cuenta la temperatura/humedad tanto del ambiente como del sujeto 5,6. Se ha demostrado que en el actual aparato sWBP, los efectos de la temperatura/humedad del huésped no alteran significativamente el volumen de aliento medido de una fuente de calibración. Por lo tanto, este enfoque en sWBP difiere fundamentalmente del enfoque de >50 años de Drorbaugh y Fenn. Aquí, sWBP relaciona directamente los cambios de presión con un volumen de respiración medido sin corrección adicional por parte del huésped.
Es esencial contrastar el WBP animal de investigación con el WBP clínico. Los tipos de datos biométricos que se intentaron recopilar mediante sWBP son el volumen y la frecuencia de la respiración. Dichas mediciones se recopilan clínicamente utilizando un equipo de espirometría simple en el que un paciente sostiene un monitor de aliento en su boca y respira normalmente en un dispositivo que monitorea el flujo de aire. Una espirometría similar en animales de investigación requiere moderación, lo que contribuye al estrés y a una interrupción inherente de la respiración. Por lo tanto, la espirometría simple es funcional clínicamente pero no para animales de investigación. WBP tiene un propósito esencial en la clínica para recopilar datos avanzados, incluidas mediciones como el volumen pulmonar residual. Dichos datos solo pueden estar contenidos en el contexto de que un sujeto pueda seguir instrucciones sobre cómo respira, incluida la espiración forzada (vaciado de su pulmón por una exhalación profunda). No se puede confiar en que los animales de investigación sigan las instrucciones de respiración de un investigador. Muchas de las mediciones avanzadas recogidas clínicamente durante el dolor corporal no se pueden reproducir en animales de investigación. El WBP en animales de investigación es fundamentalmente diferente del WBP clínico. Animal WBP busca recopilar datos de ventilación simples (frecuencia respiratoria y volumen) de una manera no restringida para evitar el estrés animal y la perturbación de la respiración. Hasta ahora, el uso de WBP en animales de investigación parece replicar las técnicas utilizadas en WBP clínico, incluidos cálculos complejos basados en la temperatura y humedad ambiental y del sujeto, pero sin la capacidad de recopilar los datos avanzados de un sujeto que puede seguir instrucciones sobre cómo realizar una expiración forzada. Con esto en mente, se buscó demostrar si una versión simplificada de WBP sería suficiente para recopilar la frecuencia respiratoria pertinente y el volumen relevante para los estudios de enfermedades respiratorias. Se empleó una sesión de calibración, que compensó cualquier variación en la temperatura y humedad ambiental. Además, se demostró con un ratón artificial que someter la temperatura y la humedad a un volumen de respiración medido no tienen un efecto significativo en la medición precisa del volumen de respiración. Se concluyó que sWBP tiene una excelente aplicación para la investigación de estudios en animales, sin el requisito del usuario de emplear un tratamiento matemático engorroso de los datos.
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Estos estudios fueron apoyados por la subvención COBRE P20GM125504-01 del Subproyecto 8246 de los Institutos Nacionales de Salud.
Materiales
| Name | Company | Catalog Number | Comments |
| 1/8" NPT Luer adaptor | Amazon | B07DH9MY8W | Calibration port |
| 1/8" NPT to 1/4" NPT adaptor | Amazon | B07T6CR6FS | Bulkhead to luer adaptor |
| 150 kohm resistor | Amazon | B07GPRYL81 | Pressure transducer excitation voltage selection |
| 3/4" diamond drill bit | Drilax | DRILAX100425 | To drill bulkhead mounts in glass jar |
| Bridge Amp | AD Instruments | FE221 | One channel option |
| Bulkhead fitting | Legines | 3000L-B | 1/4" NPT, 3/4-16 UNF brass bulkhead coupling |
| Chaney adaptor | Hamilton | 14725 | Gas tight syringe adaptor for set volume |
| DIN connector | AD Instruments | SP0104 | To connect pressure sensor to Bridge Amp |
| Gastight syringe, 25 uL | Hamilton | 80201 | Calibration syringe |
| LabChart | AD Instruments | Life Science Data Acquisition Software | |
| Luer plug | Cole Parmer | 45513-56 | Calibration port closure |
| PowerLab 4/26 | AD Instruments | PL2604 | Digital interface to computer |
| Pressure transducer | Omega Engineering | PX409-10WGV | High accuracy oil filed gage pressure sensor |
| Rubber gasket | Amazon | B07LH4C8LS | To mount bulkheads (4 required per chamber) |
| Square glass jar | Amazon | B07VNSPR8P | 600 ml with 95 mm silicone gasket |
Referencias
- Warawa, J. M., Long, D., Rosenke, R., Gardner, D., Gherardini, F. C. Role for the Burkholderia pseudomallei capsular polysaccharide encoded by the wcb operon in acute disseminated melioidosis. Infection and Immunity. 77 (12), 5252-5261 (2009).
- West, T. E., Myers, N. D., Liggitt, H. D., Skerrett, S. J. Murine pulmonary infection and inflammation induced by inhalation of Burkholderia pseudomallei. International Journal of Experimental Pathology. 93 (6), 421-428 (2012).
- Lawrenz, M. B., et al. Development and evaluation of murine lung-specific disease models for Pseudomonas aeruginosa applicable to therapeutic testing. Pathogens and Disease. 73 (5), (2015).
- Lim, R., et al. Measuring respiratory function in mice using unrestrained whole-body plethysmography. Journal of Visualized Experiments: JoVE. (90), e51755(2014).
- Drorbaugh, J. E., Fenn, W. O. A barometric method for measuring ventilation in newborn infants. Pediatrics. 16 (1), 81-87 (1955).
- Simon, G., Pride, N. B., Jones, N. L., Raimondi, A. C. Relation between abnormalities in the chest radiograph and changes in pulmonary function in chronic bronchitis and emphysema. Thorax. 28 (1), 15-23 (1973).
- Gassiep, I., Armstrong, M., Norton, R. Human melioidosis. Clinical Microbiology Reviews. 33 (2), 06-19 (2020).
- Gutierrez, M. G., Warawa, J. M. Attenuation of a select agent-excluded Burkholderia pseudomallei capsule mutant in hamsters. Acta Tropica. 157, 68-72 (2016).
- Gutierrez, M. G., Pfeffer, T. L., Warawa, J. M. Type 3 secretion system cluster 3 is a critical virulence determinant for lung-specific melioidosis. PLoS Neglected Tropical Diseases. 9 (1), 3441(2015).
- Rocco, P. R. M., Zin, W. A. Anaesthesia, Pain, Intensive Care and Emergency Medicine. Gullo, A. , Springer. (2002).
- Fodah, R. A., et al. Correlation of Klebsiella pneumoniae comparative genetic analyses with virulence profiles in a murine respiratory disease model. PLoS One. 9 (9), 107394(2014).
- Gotts, J. E., et al. Clinically relevant model of pneumococcal pneumonia, ARDS, and nonpulmonary organ dysfunction in mice. American Journal of Physiology-Lung Cellular and Molecular Physiology. 317 (5), 717-736 (2019).
- Galan, J. E. Common themes in the design and function of bacterial effectors. Cell Host & Microbe. 5 (6), 571-579 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados