Method Article
Упрощенная плетизмография всего тела для характеристики функции легких во время респираторного мелиоидоза
В этой статье
Резюме
Этот протокол представляет собой конструкцию и использование упрощенного аппарата плетизмографии всего тела для неинвазивного мониторинга прогрессирования бактериальных респираторных заболеваний.
Аннотация
Суррогатные животные модели заболеваний подпадают под действие 3R ответственного исследования. Существует частый пересмотр уточнений в моделях животных, чтобы гарантировать, что как благополучие животных, так и научные идеи продвигаются вперед с доступностью новых технологий. В данной статье демонстрируется использование упрощенной плетизмографии всего тела (sWBP) для неинвазивного изучения дыхательной недостаточности в модели летального респираторного мелиоидоза. sWBP обладает чувствительностью для обнаружения дыхания у мышей на протяжении всего течения заболевания, что позволяет измерять и потенциально использовать симптомы, связанные с умиранием (брадипноэ и гипопноэ), и потенциально использовать их для разработки гуманных критериев конечной точки.
Некоторые из преимуществ sWBP в контексте респираторных заболеваний заключаются в том, что мониторинг дыхания хозяина ближе всего подходит к любому физиологическому измерению при оценке дисфункции первичной инфицированной ткани, а именно легких. В дополнение к биологическому значению, использование sWBP является быстрым и неинвазивным, сводя к минимуму стресс у исследовательских животных. Данная работа демонстрирует использование собственного аппарата sWBP для мониторинга заболевания на протяжении всего течения дыхательной недостаточности в мышиной модели респираторного мелиоидоза.
Введение
Респираторные бактериальные возбудители часто связаны с воспалительной реакцией в легких, приводящей к патологии легких 1,2. В клинических условиях диагностика пневмонии обычно включает методы культивирования мокроты, анализ насыщения крови кислородом и рентген грудной клетки. Эти методы могут быть переведены для моделей инфекций мелких животных, но только анализ насыщения кислородом представляет собой быстрый анализ в режиме реального времени у мышей на тяжесть заболевания. Насыщение крови кислородом (SpO2) ранее исследовалось как метод отслеживания прогрессирования заболевания в исследованиях респираторных заболеваний; однако умирающие мыши имеют неожиданно высокие показания SpO2 как в модели Pseudomonas aeruginosa 3, которые не являются прогностическим или умирающим заболеванием, вероятно, потому, что мыши могут модулировать свою физиологическую активность. С этой целью диагностические уровни SpO2 до сих пор не были обнаружены для бактериальных респираторных заболеваний у мышей.
Поэтому в данной работе исследовалось использование других клинически значимых методов выявления влияния заболеваний легких на функцию легких в качестве быстрого физиологического измерения. Упрощенная плетизмография всего тела (sWBP) дает возможность исследовать частоту и глубину дыхания в качестве быстрого, неинвазивного биометрического анализа. Предыдущие исследования показали, как собрать аппарат WBP в лаборатории4; однако некоторые из компонентов, показанных в таких исследованиях, в настоящее время не являются коммерчески доступными. Кроме того, традиционная WBP требует сложного сбора и обработки данных на основе влажности и температуры 5,6. Следовательно, было решено разработать упрощенный аппарат WBP, который ежедневно калибруется в соответствии с комнатной температурой / влажностью и оценивает, влияет ли вклад температуры / влажности самого субъекта на измеряемый объем дыхания. Таким образом, был создан модифицированный аппарат sWBP, который использует имеющиеся в настоящее время материалы. Кроме того, было исследовано, может ли этот лабораторный аппарат обнаруживать изменения в дыхании, связанные с прогрессированием заболевания, во время модели летального респираторного мелиоидоза у мышей.
Аппарат sWBP, построенный для этой работы, использовал коммерчески доступное оборудование и программное обеспечение для обработки данных аналогового датчика давления в цифровое считывание. Датчик давления был установлен на герметичной стеклянной банке с разъемами переборки. Преимуществом стеклянной банки является структурная жесткость материала, которая будет противостоять изменениям внутреннего давления банки, влияя на измерения изменений объема во время мониторинга дыхания. Камера для отбора проб была спроектирована так, чтобы иметь два порта на двух плоских поверхностях квадратной банки, один для доступа к камере через разъем Luer для калибровки, а другой для размещения датчика давления. Выбранный датчик давления имеет высокочувствительный манометрический преобразователь давления с диапазоном для небольших изменений давления (диапазон 25 мбар).
Этот протокол демонстрируется с использованием мышиной модели респираторного мелиоидоза. Burkholderia pseudomallei (Bp) является бактериальным агентом мелиоидоза - заболевания, связанного с тропическими регионами мира7. Bp обнаруживается в окружающей среде, особенно во влажной среде стоячей воды и влажной почвы, из которой он обычно вызывает подкожные инфекции порезов / царапин восприимчивых хозяев. Тем не менее, АД также заразен при вдыхании и представляет собой потенциальную угрозу для использования в биотерроризме путем рассеивания аэрозолей. В то время как полностью вирулентный Bp требует обработки в лаборатории BSL-3, ранее был разработан акапсулярный мутантный штамм, который можно безопасно обрабатывать в BSL-2 и исключать из критерия выбора агента8. Кроме того, для изучения прогрессирования респираторных заболеваний адв. Мы использовали эту модель инфекции для характеристики изменения дыхания, которое происходит во время прогрессирования заболевания через умирающую конечную точку.
протокол
Процедуры, описанные здесь, были рассмотрены и одобрены Институциональным комитетом по биобезопасности Университета Луисвилля (протокол No 14-038) и Институциональным комитетом по уходу за животными и их использованию (протокол No 19567).
1. Монтаж камеры для отбора проб
- Создайте два отверстия с помощью алмазного сверла 3/4" на сверлильном прессе на плоских поверхностях 600 мл квадратного стекла с широким горловиной консервной банки Mason с прокладкой 95 мм и герметичными крышками, с крышками зажимов и спускового крючка (рисунок 1).
ПРИМЕЧАНИЕ: Камера для отбора проб не является коммерчески доступной и должна быть сконструирована. - Соберите латунную переборку (внутренняя резьба 1/4" NPT, внешняя резьба 3/4-16 UNF) через оба отверстия в банке Mason с помощью резиновых шайб (внутренний диаметр 3/4 дюйма, наружный диаметр 1 дюйм) на обеих сторонах контакта между переборкой и стеклом для обеспечения герметичного уплотнения.
- Используйте одну переборку в сборе для датчика давления, а другую переборку крепит шприц, подключенный к Luer, для целей калибровки.
- Для датчика давления обмотайте резьбу 1/4" NPT высокопроизводительного манометрического преобразователя давления тефлоновой лентой и вдавите их в переборку. Используйте паяльник для подключения проводки датчика давления к 8-контактному разъему DIN, используя инструкции производителя по проводке для сопряжения с коммерчески доступным высококачественным устройством сбора данных (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Для этого требуется использование металлического пленочного резистора мощностью 150 КОм 1/8 Вт в проводке разъема DIN. - Для калибровочного порта используйте 1/4" мужской адаптер NPT к 1/8" гнездовому адаптеру NPT для подключения 1/8" мужского NPT к никелированному разъему Luer lock к латунной переборке, оборачивающей резьбовые соединения тефлоновой лентой. Используйте полипропиленовый резьбовой колпачок Luer для герметизации разъема Luer, когда он не используется.
ПРИМЕЧАНИЕ: Не затягивайте соединители переборки на стеклянную банку, так как это приведет к появлению трещин. При желании силикон можно добавить в резиновые прокладки для обеспечения герметичного уплотнения переборок к стеклянной банке.
- Для датчика давления обмотайте резьбу 1/4" NPT высокопроизводительного манометрического преобразователя давления тефлоновой лентой и вдавите их в переборку. Используйте паяльник для подключения проводки датчика давления к 8-контактному разъему DIN, используя инструкции производителя по проводке для сопряжения с коммерчески доступным высококачественным устройством сбора данных (см. Таблицу материалов).
2. Настройка системы
- Подключите камеру дискретизации к мостовому усилителю с помощью 8-контактного разъема DIN, а мостовой усилитель — к устройству сбора данных в соответствии с инструкциями производителя.
- Подключите устройство сбора данных к источнику питания и компьютеру, на котором запущено программное обеспечение для анализа физиологических данных, используя кабели производителя.
ПРИМЕЧАНИЕ: Убедитесь, что устройство сбора данных включено и прогрето в течение не менее 5 минут перед использованием, чтобы убедиться, что датчик стабилизирует свои измерения. - Инициируйте программное обеспечение для взаимодействия с системой сбора данных.
- Загрузите дополнительный модуль спирометрии в программном обеспечении и измените настройки устройства по умолчанию с L/s на μL/s в окне Spirometry > Settings .
3. Калибровка системы
- В программном обеспечении создайте 4-канальное окно со следующими окнами данных: Канал 1: Исходные данные со скоростью дискретизации 4 к/с и диапазоном 1 мВ ; Канал 2: Цифровой фильтр канала 1 с использованием фильтра автоматической регулировки высоких частот 1 Гц ; Канал 3: Сглаживание данных канала 2 путем усреднения 100 выборок; Канал 4: Спирометрический поток данных канала 3 (пользовательская проточная головка, откалиброванная по формуле (мкл/с) = 120 000 x Напряжение).
ПРИМЕЧАНИЕ: 120 000 - это коэффициент корреляции заполнителя, который будет изменен во время калибровки. - Настройте анализ DataPad канала 4 со следующими столбцами: Столбец 1: Данные канала 4, Комментарии > Полный текст комментария; Колонка 2: Данные канала 4, циклические измерения > средней циклической частоты; Колонка 3: Данные канала 4, циклические измерения > средняя циклическая высота.
- Установите частоту кадров 100:1 в правом нижнем углу графика. Сохраните эту конфигурацию окна в качестве шаблона для всех будущих исследований.
- Закройте крышку камеры отбора проб и прикрепите газонепроницаемый шприц объемом 25 мкл к разъему переборки Luer. Установите шприц с адаптером Chaney, чтобы многократно доставлять объем 20 мкл.
ПРИМЕЧАНИЕ: Для подключения шприца к камере отбора проб может использоваться опциональный короткий кусок трубки 1/16" и разъемов Luer/barb. Однако следует избегать длинных трубок, чтобы избежать значительных изменений общего объема воздуха в камере отбора проб. - Втяните 20 мкл воздуха в шприц с помощью глубинного упора адаптера Чейни.
- Обнулите pleth в программном обеспечении (Setup > Zero All Inputs (Alt-Z)) и начните запись.
- Во время записи и со стабильным исходным уровнем быстро нажмите / выньте поршень шприца примерно на 10 повторений, чтобы воспроизвести дыхание субъекта с измеренным дыханием 20 мкл. Остановите запись.
ПРИМЕЧАНИЕ: Частота искусственного дыхания должна превышать 2 Гц, чтобы максимизировать воспроизводимость калибровки. - Пометьте идентификатор измеряемого образца, щелкнув правой кнопкой мыши начало пронумерованной записи pleth и нажмите «Добавить комментарий».
- Сбросьте шприц, обнулите вход и повторите запись измерений импульсов 20 мкл еще два раза (три сеанса записи).
- После завершения всех измерений используйте компьютерную мышь, чтобы выбрать часть дыхательного плета, которая точно представляет собой искусственные вдохи 20 мкл.
ПРИМЕЧАНИЕ: В модуле DataPad в заголовке предварительного просмотра появятся данные, обеспечивающие временное считывание частоты дыхания (средняя циклическая частота, Гц) и глубины дыхания (средняя циклическая высота, мкл). Предварительный просмотр данных можно записать в DataPad с помощью значка Добавить в DataPad . - Просмотрите данные столбца 3 (Средняя циклическая высота) и рассчитайте средний измеренный объем дыхания из трех записей. Выполните следующий расчет среднего измеренного объема дыхания: Калибровочный коэффициент = поставляемый объем / измеренный объем x 120 000.
ПРИМЕЧАНИЕ: 120 000 был замещающим коэффициентом калибровки flow head, используемым на шаге 3.1, который теперь изменен на основе измеренных данных. Теперь система откалибрована в соответствии с типичным дыханием мыши с использованием текущей температуры и влажности окружающей среды. Теперь система может контролировать дыхание субъекта, а калибровка может выполняться ежедневно для учета любых колебаний температуры / влажности.
4. Предметный мониторинг
- Откройте главный шаблон, как описано в шаге 3.4, или выполните шаги 4.2–4.3.
- В программном обеспечении создайте 4-канальное окно со следующей обработкой данных: Канал 1: Исходные данные со скоростью дискретизации 4 к/с и диапазоном 1 мВ ; Канал 2: Цифровой фильтр канала 1 с использованием фильтра High Pass 1 Hz Auto Adjust; Канал 3: Сглаживание данных канала 2 путем усреднения 100 образцов; Канал 4: Спирометрический поток данных канала 3 (пользовательская проточная головка, откалиброванная по формуле (мкл/с) = 120 000 x Напряжение).
ПРИМЕЧАНИЕ: 120 000 - коэффициент корреляции, рассчитанный для датчика текущего давления; однако пользователь должен выполнить калибровку системы, описанную в шаге 3, и вместо этого использовать этот определяемый пользователем коэффициент корреляции. - Настройте анализ DataPad канала 4 со следующими столбцами: Столбец 1: Данные канала 4, Комментарии > Полный текст комментария; Колонка 2: Данные канала 4, циклические измерения > средней циклической частоты; Колонка 3: Данные канала 4, циклические измерения > средняя циклическая высота.
- Поместите субъект в камеру для отбора проб и закройте крышкой. Для этого эксперимента использовалась сознательная 4-12-недельная самка мыши-альбиноса C57BL/6J (B6(Cg)-Tyrc-2J/J).
- Выровнять атмосферное давление в камере (за счет герметизации крышки) путем кратковременного ослабления крышки переборки Luer и перенапряжения.
- Обратите внимание, что субъект не активно перемещается в камере выборки до обнуления всех входов (сочетание клавиш Alt-Z) и начала записи.
ПРИМЕЧАНИЕ: Если субъект начинает перемещаться в камере отбора проб, исходный уровень может сместиться со шкалы, что может быть решено путем повторного обнуления всех входных данных в середине записи, что создаст новую запись на шкале. Предположим, что субъект занимается исследованием или грумингом во время записи; Обратите внимание, какая часть записи плетизмографии наиболее точно отражает нормальное дыхание. - Пометьте личность субъекта, щелкнув правой кнопкой мыши начало пронумерованной записи pleth и нажмите «Добавить комментарий».
- Верните предмет в клетку. Ограничьте время, проведенное в герметичной камере для отбора проб, до 5 минут, чтобы избежать удушья и стресса.
ПРИМЕЧАНИЕ: Риск асфиксии низок, учитывая, что объем воздуха в 600 мл камеры для отбора проб не будет быстро расходоваться здоровой мышью, дышащей со скоростью <15 мл / мин. - Используйте компьютерную мышь, чтобы выбрать часть дыхательного плета, которая точно представляет дыхание субъекта.
ПРИМЕЧАНИЕ: В модуле DataPad в заголовке предварительного просмотра появятся данные, обеспечивающие временное считывание частоты дыхания (средняя циклическая частота, Гц) и объема дыхания (средняя циклическая высота, мкл). Предварительный просмотр данных можно записать в DataPad с помощью значка Добавить в DataPad . - Продолжайте измерять мышей по одному и записывать репрезентативные участки дыхания на DataPad.
- После записи данных экспортируйте данные DataPad в Excel. Рассчитайте минутный объем следующим образом: Минутный объем (мл/мин) = Частота дыхания (Гц) x Объем дыхания (мкл) x 0,06.
Результаты
Калибровка системы
Программное обеспечение для анализа данных позволяет проводить прямую калибровку пользовательской проточной головки, такой как описанная в настоящем документе. Это выполняется при настройке потока спирометрии. Как описано в шаге 3.1, существует опция для ввода известного калибровочного объема воздуха, который вычисляет коэффициент корреляции напряжения к объему в системе. Это, однако, генерирует коэффициент корреляции, основанный на одном считывании, и было замечено, что присущее отклонение калибровки от стандарта n = 1 имеет плохую полезность. Текущий подход может устранить этот недостаток и позволяет пользователю выполнять ежедневную калибровку с использованием нескольких показаний, усредненных для расчета калибровочного коэффициента. Калибровка с 20 мкл впрыскиваемого воздуха была продемонстрирована в настоящем описании, представляя собой типичный объем дыхания высокого класса у типичной мыши. Программное обеспечение предполагает исходный перехват (0,0) и, таким образом, калибруется от 0-20 мкл с использованием этого подхода.
Методология, предлагаемая здесь для sWBP, калибруется ежедневно, таким образом, учитывая любые колебания влажности / температуры окружающей среды. Оригинальные методы, используемые для конкретной WBP, восходят к методологии Дрорбо и Фенна с 1955 года, которые разработали WBP для измерения вентиляции у младенцев5. Расчеты Дрорбо и Фенна учитывают изменения температуры и влажности окружающей среды и субъекта. Текущий подход корректирует колебания окружающей среды путем калибровки каждого сеанса sWBP. Тем не менее, было решено рассмотреть вопрос о том, влияет ли нагрев и увлажнение дыхания через носовую полость / легкое мыши на измерение известного объема воздуха. Таким образом, был создан искусственный аппарат для имитации влияния субъекта на нагрев и увлажнение калиброванного воздуха. Соединители Luer были прикреплены к конической трубке объемом 15 мл и помещены в эту герметичную коническую линию между камерой для отбора проб и газонепроницаемым калибровочным шприцем. Калибровку 20 мкл проводили с использованием пустой конической трубки, удерживаемой при комнатной температуре (23 °C). Затем коническая трубка была частично заполнена дистиллированной водой чуть ниже соединителей Luer, что позволило вовремя уравновесить пространство над головой конического; затем калибровочный объем был повторно измерен для исследования влияния влажности. Коническую трубку помещали в нагревательный блок и уравновешивали при 37 °C во влажной среде и, наконец, уравновешивали до 37 °C без воды для оценки влияния нагрева субъекта и без дополнительного вклада влажности. На рисунке 2 показано, что все испытанные условия не оказывали существенного влияния на калиброванное измерение 20 мкл, проводимое газонепроницаемым шприцем. Из этого вывода был сделан вывод, что sWBP предлагает доступный подход к мониторингу дыхания у исследуемых животных без необходимости сложных расчетов, основанных на температуре и влажности животного субъекта, поскольку они не оказывают существенного влияния на измеренный объем дыхания.
Тематический мониторинг
sWBP применялся для контроля дыхания во время заболевания летальными респираторными инфекциями бактериальным возбудителем B. pseudomallei. Одной из проблем мониторинга дыхания у сознательных животных является любопытство нормальных здоровых животных, движущихся в камере образца. Движение мыши создает постоянно движущуюся базовую линию, которая может быть частично смягчена путем предварительного кондиционирования субъектов в камере в течение нескольких дней до измерения. Эта проблема в первую очередь влияет на исходное измерение у здоровых мышей, поскольку испытуемые становятся вялыми во время инфекции, что делает sWBP гораздо более управляемым при снижении активности субъекта. Может возникнуть соблазн попытаться использовать какую-либо форму сдерживания, будь то физическая или анестезия. Использование физического сдерживания может повлиять на естественное дыхание, вызывая стресс. Кроме того, известно, что применение анестетиков оказывает выраженное влияние на частоту дыхания и глубину10; таким образом, было решено исследовать влияние анестезии с помощью собственного аппарата sWBP. Изофлуран обычно используется для выполнения диагностической визуализации in vivo во время моделей инфекции, и поэтому мышь C57BL/6 анестезировалась и контролировалась прогрессирование до восстановления после анестезии с использованием sWBP. Это испытание проводилось с ювенильной 4-недельной мышью-альбиносом C57BL/6J, чтобы продлить окно восстановления после анестезии. Рисунок 3 показывает, что предпочтительный анестетик заставляет мышей демонстрировать медленную частоту дыхания с большим приливным объемом воздуха. Когда мыши начинают восстанавливаться после седации, их частота дыхания увеличивается, а объем дыхания уменьшается, с чистым эффектом, что общее количество вдыхаемого воздуха медленно увеличивается. В этом исследовании было обнаружено, что объем дыхания восстанавливается до уровня до анестезии в течение первых 30 секунд после выздоровления. Частота дыхания неуклонно увеличивается до тех пор, пока исходное дыхание не восстановится до 2-2,5 мин после снятия с анестезии. Минутный объем внимательно следил за эффектами частоты дыхания, достигая исходного минутного объема через 2,5 мин после снятия с анестезии. Этот вывод подтверждает, что анестезия не должна использоваться в подходе sWBP. Это резко влияет на исходное дыхание, что неудивительно, так как анестезия замедляет метаболизм хозяина, создавая снижение потребности во вдыхаемом кислороде. Санитария камеры образца также должна рассматриваться между субъектами для решения проблемы инфекционного контроля, специфичного для исследования, а также воздействия феромонов с мочой или фекалиями, которые могут повлиять на стресс между субъектами.
WBP является привлекательной стратегией для мониторинга функции легких в моделях респираторных заболеваний неинвазивным способом. sWBP был использован для изучения того, как дыхание изменяется во время смертельных респираторных мелиоидозных инфекций (рисунок 4), с временными точками, отражающими мониторинг биолюминесценции в легких. Было замечено, что эта модель связана с ранним началом летаргии, которая сохраняется медленно прогрессирующим образом до развития умирающего заболевания примерно через 3 дня после заражения. Было также отмечено, что частота дыхания и общий объем вдыхаемого воздуха (минутный объем) мышей быстро уменьшаются в течение первого дня заражения и остаются низкими в течение оставшейся части течения инфекции (рисунок 4A, C). Эта картина согласуется с ранней летаргией, которая сохраняется в течение следующих 2 дней инфекции. Напротив, объем дыхания не резко падает в течение первых 24 ч, а вместо этого имеет небольшое и устойчивое снижение, которое приближается к линейному снижению в течение 3-дневного течения заболевания (рисунок 4B).

Рисунок 1: аппарат sWBP. Специальная пробная камера была построена из герметичной квадратной стеклянной банки с соединителями переборки на двух плоских гранях. Одна переборка использовалась для установки датчика манометрического давления, подключенного к мостовому усилителю и дигитайзеру устройства сбора данных через 8-контактное соединение DIN. Вторая переборка была оснащена разъемом Luer для калибровки газонепроницаемым шприцем. Устройство было подключено к ПК, на котором запущено программное обеспечение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
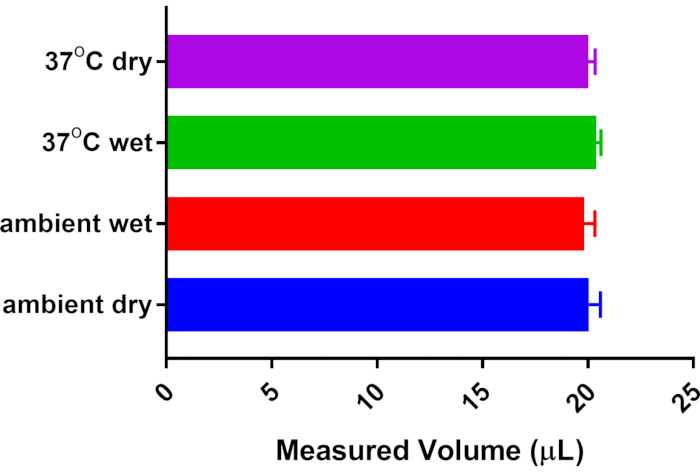
Рисунок 2: Влияние температуры и влажности объекта на объем дыхания. Коническая трубка объемом 15 мл с разъемами Luer была установлена в линию между калибровочным шприцем объемом 20 мкл и камерой для отбора проб. Система была откалибрована до 20 мкл без дополнительного вклада температуры / влажности из конической трубки. Другие измерения были собраны после уравновешивания с насыщенной влажностью от дистиллированной воды и/или потеплением конической трубки от комнатной температуры (23 °C) до температуры тела (37 °C). Не было обнаружено существенной разницы из n = 5 измерений каждого состояния с помощью одностороннего ANOVA с пост-тестом Туки с множественным сравнением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
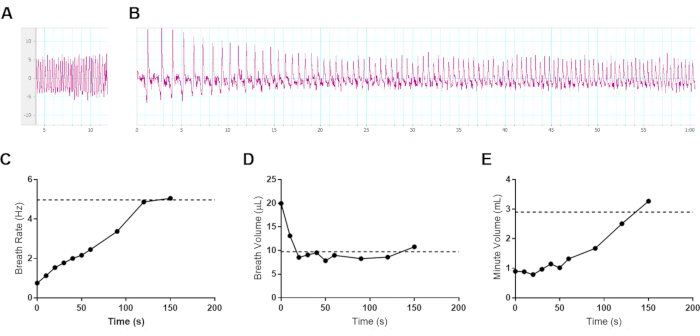
Рисунок 3: Влияние газовой анестезии на дыхание у мышей. Репрезентативные данные 4-недельной самки мыши-альбиноса C57BL/6J (8,6 г) усыпляли в течение 5 мин с 3% изофлурана в кислороде и переносили в камеру отбора проб sWBP. Данные Pleth собирались в течение 150 с после снятия с анестезии. Испытуемый начал начальную амбулацию через 100 с после удаления из анестезии. (A) Исходное дыхание перед анестезией, измерение частоты дыхания 4,97 Гц, объема дыхания 9,74 мкл и минутного объема 2,91 мл. (B) Первые 60 с изменений дыхания во время восстановления после анестезии. (А-Б) Вертикальная ось, измеряющая мкл на вдох, и горизонтальная ось за считанные секунды. (С-Е) Данные о вентиляции были собраны в течение 150 секунд восстановления после анестезии, усредненные из ≥3 циклов дыхания за точку времени для (C) частоты дыхания, (D) объема дыхания и (E) расчетного минутного объема. Исходные значения до анестезии обозначены горизонтальной пунктирной линией на каждом соответствующем графике. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 4: Влияние респираторного мелиоидоза на дыхание хозяина. Пять 8-недельных самок мышей C57BL/6 были инфицированы 4,9 log КОЕ биолюминесцентного штамма B. pseudomallei JW270. sWBP проводили на протяжении всего 3-дневного курса инфекции, измеряя частоту дыхания (A) и объем дыхания (B). Общий объем вдохновенного воздуха был рассчитан как минутный объем (C). Данные для каждого из пяти субъектов независимо строятся с полиномиальной регрессией третьего порядка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
sWBP является привлекательным подходом для улучшения понимания респираторной инфекции на моделях мелких животных. Важно отметить, что это неинвазивный подход, и как таковой он не представляет значительного риска возникновения чрезмерного стресса у исследуемых животных во время инфекции. Действительно, процедура контроля дыхания субъекта представляет собой экспресс-тест, требующий нескольких минут и минимального обращения с субъектом. Научным преимуществом является понимание с высоким разрешением того, как микробные патогены влияют на функцию легких во время болезни. Этот подход принесет пользу фундаментальным исследованиям, облегчая понимание того, как патоген вызывает заболевание, а также обеспечивая трансляционную полезность для понимания того, как новое терапевтическое средство восстанавливает состояние респираторного здоровья субъекта исследования.
В этой рукописи представлены репрезентативные результаты для патогена B. pseudomallei, который вызывает раннюю летаргическую реакцию. Не все бактериальные инфекции легких присутствуют одинаково в моделях мышиной инфекции. Предыдущий опыт работы с другими моделями инфекции показал, что бактериальный патоген Klebsiella pneumoniae представляет собой бессимптомную инфекцию до того момента, когда мыши поддаются инфекции, также примерно на 3-й день после заражения11. Предполагается, что потребность хозяина во вдохновенном воздухе (т. е. минутный объем) может тесно связана со степенью летаргии, с которой проявляется данное заболевание. Будущие исследования потребуются для изучения того, как различные бактериальные патогены влияют на функцию легких во время респираторных заболеваний. Понятно, что различные патогены имеют уникальные подходы к уклонению от защиты хозяина, включая различия в ( 1) склонности к внутриклеточным или внеклеточным патогенам, (2) способности вызывать ранний / поздний гипотермический ответ и (3) использование различных репертуаров детерминант вирулентности 3,12,13. Поэтому вполне вероятно, что различные стратегии заболевания приведут к уникальному воздействию на функцию легких и дыхание во время инфекции.
Рекомендуемые настройки, описанные в этом протоколе, могут быть изменены для учета уникальных проблем, возникающих во время sWBP. Одной из распространенных проблем, возникающих во время сеанса записи sWBP, является движение субъекта в камере выборки. Как уже упоминалось, это движение изменяет базовую линию и может повлиять на точность измерений дыхания. Цифровой фильтр использовался для нормализации смещающейся базовой линии, что позволяло измерять жизнеспособное дыхание, несмотря на небольшие движения. Чрезмерное движение может вытолкнуть базовое измерение из диапазона обнуленного входа. Записи рекомендуются в диапазоне 1 мВ (настройка канала 1), что обеспечивает компромисс в наблюдении пиков плетизмографии, избегая потери данных за пределами диапазона. Для исключительно активных субъектов может потребоваться расширить диапазон записи >1 мВ, чтобы избежать постоянных сигналов вне диапазона.
Рекомендуемая процедура требует ежедневной калибровки (или на каждом сеансе) для учета колебаний влажности окружающей среды / температуры. Традиционная WBP использует сложные расчеты, которые учитывают температуру / влажность как окружающей среды, так ипредмета 5,6. Было продемонстрировано, что в настоящем аппарате sWBP воздействие температуры/влажности хозяина существенно не изменяет измеренный объем дыхания калибровочного источника. Поэтому такой подход в sWBP принципиально отличается от >50-летнего подхода Дрорбо и Фенна. Здесь sWBP напрямую связывает изменения давления с измеренным объемом дыхания без дальнейшей коррекции со стороны хозяина.
Важно противопоставить WBP на животных с клинической WBP. Типы биометрических данных, которые пытались собрать sWBP, - это объем и частота дыхания. Такие измерения собираются клинически с использованием простого спирометрического оборудования, в котором пациент прижимает монитор дыхания ко рту и нормально вдыхает в устройство, контролирующее воздушный поток. Подобная спирометрия у исследуемых животных требует сдержанности, тем самым способствуя стрессу и присущему нарушению дыхания. Поэтому простая спирометрия функциональна клинически, но не для исследовательских животных. WBP служит важной цели в клинике для сбора передовых данных, включая такие измерения, как остаточный объем легких. Такие данные могут содержаться только в контексте того, что субъект может следовать инструкциям о том, как он дышит, включая принудительное выдох (опорожнение легкого глубоким выдохом). На исследуемых животных нельзя полагаться, чтобы они следовали инструкциям исследователя по дыханию. Многие из передовых измерений, собранных клинически во время WBP, не могут быть воспроизведены на исследуемых животных. WBP у исследовательских животных принципиально отличается от клинической WBP. WBP животных стремится собирать простые данные вентиляции (частота дыхания и объем) несдержанным образом, чтобы избежать стресса животных и дыхательных возмущений. До сих пор использование WBP на исследовательских животных, по-видимому, повторяет методы, используемые в клинической WBP, включая сложные расчеты, основанные на температуре и влажности окружающей среды и субъекта, но без возможности сбора передовых данных от субъекта, который может следовать инструкциям о том, как выполнить принудительный экспирацию. Имея это в виду, было предпринято стремление продемонстрировать, будет ли упрощенной версии WBP достаточно для сбора соответствующей частоты и объема дыхания, относящихся к исследованиям респираторных заболеваний. Был использован сеанс калибровки, который компенсировал любые изменения температуры и влажности окружающей среды. Кроме того, с помощью искусственной мыши было продемонстрировано, что температура и влажность до измеренного объема дыхания не оказывают существенного влияния на точное измерение объема дыхания. Был сделан вывод о том, что sWBP имеет отличное применение для исследований на животных, без требования пользователя использовать громоздкую математическую обработку данных.
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Эти исследования были поддержаны грантом Национального института здравоохранения COBRE P20GM125504-01 Sub-Project 8246.
Материалы
| Name | Company | Catalog Number | Comments |
| 1/8" NPT Luer adaptor | Amazon | B07DH9MY8W | Calibration port |
| 1/8" NPT to 1/4" NPT adaptor | Amazon | B07T6CR6FS | Bulkhead to luer adaptor |
| 150 kohm resistor | Amazon | B07GPRYL81 | Pressure transducer excitation voltage selection |
| 3/4" diamond drill bit | Drilax | DRILAX100425 | To drill bulkhead mounts in glass jar |
| Bridge Amp | AD Instruments | FE221 | One channel option |
| Bulkhead fitting | Legines | 3000L-B | 1/4" NPT, 3/4-16 UNF brass bulkhead coupling |
| Chaney adaptor | Hamilton | 14725 | Gas tight syringe adaptor for set volume |
| DIN connector | AD Instruments | SP0104 | To connect pressure sensor to Bridge Amp |
| Gastight syringe, 25 uL | Hamilton | 80201 | Calibration syringe |
| LabChart | AD Instruments | Life Science Data Acquisition Software | |
| Luer plug | Cole Parmer | 45513-56 | Calibration port closure |
| PowerLab 4/26 | AD Instruments | PL2604 | Digital interface to computer |
| Pressure transducer | Omega Engineering | PX409-10WGV | High accuracy oil filed gage pressure sensor |
| Rubber gasket | Amazon | B07LH4C8LS | To mount bulkheads (4 required per chamber) |
| Square glass jar | Amazon | B07VNSPR8P | 600 ml with 95 mm silicone gasket |
Ссылки
- Warawa, J. M., Long, D., Rosenke, R., Gardner, D., Gherardini, F. C. Role for the Burkholderia pseudomallei capsular polysaccharide encoded by the wcb operon in acute disseminated melioidosis. Infection and Immunity. 77 (12), 5252-5261 (2009).
- West, T. E., Myers, N. D., Liggitt, H. D., Skerrett, S. J. Murine pulmonary infection and inflammation induced by inhalation of Burkholderia pseudomallei. International Journal of Experimental Pathology. 93 (6), 421-428 (2012).
- Lawrenz, M. B., et al. Development and evaluation of murine lung-specific disease models for Pseudomonas aeruginosa applicable to therapeutic testing. Pathogens and Disease. 73 (5), (2015).
- Lim, R., et al. Measuring respiratory function in mice using unrestrained whole-body plethysmography. Journal of Visualized Experiments: JoVE. (90), e51755(2014).
- Drorbaugh, J. E., Fenn, W. O. A barometric method for measuring ventilation in newborn infants. Pediatrics. 16 (1), 81-87 (1955).
- Simon, G., Pride, N. B., Jones, N. L., Raimondi, A. C. Relation between abnormalities in the chest radiograph and changes in pulmonary function in chronic bronchitis and emphysema. Thorax. 28 (1), 15-23 (1973).
- Gassiep, I., Armstrong, M., Norton, R. Human melioidosis. Clinical Microbiology Reviews. 33 (2), 06-19 (2020).
- Gutierrez, M. G., Warawa, J. M. Attenuation of a select agent-excluded Burkholderia pseudomallei capsule mutant in hamsters. Acta Tropica. 157, 68-72 (2016).
- Gutierrez, M. G., Pfeffer, T. L., Warawa, J. M. Type 3 secretion system cluster 3 is a critical virulence determinant for lung-specific melioidosis. PLoS Neglected Tropical Diseases. 9 (1), 3441(2015).
- Rocco, P. R. M., Zin, W. A. Anaesthesia, Pain, Intensive Care and Emergency Medicine. Gullo, A. , Springer. (2002).
- Fodah, R. A., et al. Correlation of Klebsiella pneumoniae comparative genetic analyses with virulence profiles in a murine respiratory disease model. PLoS One. 9 (9), 107394(2014).
- Gotts, J. E., et al. Clinically relevant model of pneumococcal pneumonia, ARDS, and nonpulmonary organ dysfunction in mice. American Journal of Physiology-Lung Cellular and Molecular Physiology. 317 (5), 717-736 (2019).
- Galan, J. E. Common themes in the design and function of bacterial effectors. Cell Host & Microbe. 5 (6), 571-579 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены