Method Article
Preparación de muestras para la visualización tridimensional basada en tomografía computarizada de vasos murinos de las extremidades posteriores
En este artículo
Resumen
Aquí, describimos un método de visualización y cuantificación para los vasos murinos de las extremidades posteriores utilizando tomografía computarizada de micro-rayos X.
Resumen
Los vasos sanguíneos son redes complejas con estructuras similares a árboles, y las redes vasculares son esenciales para mantener tanto la circulación como la función de los órganos. Por lo tanto, aclarar el mecanismo de formación de vasos sanguíneos es extremadamente útil para dilucidar los procesos de desarrollo y los mecanismos patológicos. Los vasos murinos de las extremidades posteriores se utilizan a menudo como modelo para la angiogénesis fisiológica y patológica. La evaluación se realiza principalmente a través de un método bidimensional utilizando secciones de tejido. Sin embargo, los métodos para evaluar la morfología vascular tridimensional (3D) son particularmente limitados. Este artículo presenta un método para visualizar las extremidades posteriores murinas mediante tomografía computarizada (TC). La resina opaca a la radiación se inyecta a través de la aorta descendente, y los vasos enteros se llenan con tinte. Al ajustar el tiempo de inyección de tinte, también es posible el llenado específico de la arteria, y se pueden obtener muestras con cualquier dispositivo de TC de micro-rayos X. Este método de contraste proporciona una técnica básica para la evaluación 3D de los vasos sanguíneos murinos en las extremidades inferiores. Además, este método se puede utilizar para visualizar todos los vasos sanguíneos debajo del diafragma y evaluar los vasos sanguíneos en los órganos abdominales.
Introducción
Los vasos sanguíneos son redes complejas con estructuras similares a árboles. La angiogénesis y la nueva formación vascular juegan un papel esencial en el mantenimiento de la homeostasis de los órganos1. La angiogénesis está regulada para el tratamiento de enfermedades isquémicas y malignas2. Por lo tanto, es esencial comprender los mecanismos subyacentes de la angiogénesis. Los vasos murinos de las extremidades posteriores se utilizan a menudo como un modelo útil para la investigación vascular3; La ligadura ipsilateral de la arteria ilíaca o femoral es un modelo conocido de isquemia de las extremidades posteriores utilizado para evaluar la angiogénesis y la remodelación vascular en la angiogénesis fisiológica y patológica4. Sin embargo, la evaluación de la angiogénesis se realiza principalmente mediante tinción de sección, y los métodos para evaluar la morfología vascular 3D son particularmente limitados.
En comparación con la tinción de sección, la TC permite la visualización 3D. Recientemente, Weyers et al. reportaron un sofisticado protocolo adecuado para la tomografía computarizada, permitiendo la visualización del sistema circulatorio coronario adulto murino5. Modificamos su método para crear un método de preparación de muestras adecuado para la obtención de imágenes por TC de los vasos sanguíneos de las extremidades inferiores6. Aquí, se inyecta una resina opaca a la radiación a través de la aorta descendente, y los vasos en las extremidades inferiores se llenan de tinte. Al ajustar el tiempo de inyección de tinte, también es posible el llenado específico de la arteria, y se pueden obtener muestras con cualquier dispositivo de tomografía computarizada de micro-rayos X. Este método de contraste proporciona una técnica básica para la evaluación 3D de los vasos sanguíneos murinos debajo del diafragma y en los órganos abdominales y las extremidades inferiores.
Protocolo
Todos los procedimientos se realizaron de acuerdo con las directrices de cuidado de animales de la Universidad de Kumamoto (referencia de aprobación no. M30-040/A2020-105), que se ajustan a la Guía de los Institutos Nacionales de Salud de los Estados Unidos para el Cuidado y Uso de Animales de Laboratorio (publicación n.º 85-23, revisada en 2011).
1. Preparación
- Preparar el aparato de perfusión y el tampón vasodilatador (4 mg/L de clorhidrato de papaverina, 4 g/L; adenosina, 1 g/L; heparina, 1 U/ml en solución salina tamponada con fosfato (PBS)).
NOTA: El dispositivo de reflujo y los reactivos vasodilatadores son los mismos que los reportados por Weyers et al.5. - Conecte el catéter de 22 G, el tubo de extensión de 2 ml y la llave de paso de tres vías (Figura 1A).
NOTA: Ajuste el calibre de acuerdo con el tamaño del animal. Para ratones adultos C57BL/6, 22 G es óptimo. - Llene el aparato de perfusión a presión con el tampón vasodilatador (Figura 1A).
NOTA: Evite la formación de burbujas para evitar interrupciones en el llenado del medio de contraste.
2. Perfusión
- Inyecte 1 U/g de heparina en PBS en la cavidad intraperitoneal 30 min antes de la operación.
- Anestesiar completamente al ratón con isoflurano y sacrificarlo por luxación cervical.
- Después de la decapitación, haga una incisión en la línea media en el esternón y fije el tórax abierto con alfileres.
NOTA: Para evitar fugas del contraste, evite lesionar el diafragma. - Cortar la aorta ascendente y retirar el corazón.
- Retire el pulmón y exponga la aorta descendente.
NOTA: No lesione la aorta descendente. - Corte la aorta descendente en diagonal para exponer la sección transversal (Figura 1B).
NOTA: No despegue la aorta; una sección diagonal es mejor para la inserción del catéter. - Inserte el catéter de 22 G en la aorta descendente mientras ejecuta el tampón de vasodilatación.
NOTA: La inserción del catéter mientras se ejecuta el tampón de vasodilatación evita la contaminación del aire. - Fije la raíz del catéter (Figura 1C).
- Haga un nudo para evitar fugas debido al reflujo.
- Perfundir una solución vasodilatadora calentada (clorhidrato de papaverina, 4 g/L; adenosina, 1 g/L; heparina, 1 U/mL) durante 3 min a una presión fija entre 13 y 15 kPa.
- Perfundir una solución de paraformaldehído al 4% en (PBS) durante 3 min.
NOTA: El éxito de la fijación puede ser confirmado por el movimiento del pie (Figura 1D). - Prepare el medio de contraste justo antes de la perfusión.
NOTA: Ajuste la tasa de dilución de acuerdo con la muestra; para ratones adultos, mezcle la mancha y el diluyente en una proporción de 1: 1. - Detenga la perfusión y llene el tubo de extensión con 2 ml de medio de contraste diluido (Figura 1E).
NOTA: El medio de contraste debe inyectarse lentamente para evitar lesiones en los vasos sanguíneos. - Perfundir el medio de contraste a una presión fija entre 13 y 15 kPa.
- Para visualizar las arterias, revise la uña del pie para confirmar que el medio de contraste ha llegado a la arteria (Figura 1F).
- Para visualizar todos los vasos, verifique la vena cava inferior del diafragma para confirmar la circulación completa del medio de contraste.
NOTA: Al principio, el contraste contiene la solución vasodilatadora; por lo tanto, su correcta circulación es esencial.
- Cierre la llave de paso de tres vías y retire el tubo (Figura 1G).
NOTA: Si la llave de paso de tres vías no está cerrada, el contraste fluirá hacia atrás. - Incubar la muestra durante la noche a 4 °C.
- Retire la piel y fíjela en una solución de formaldehído al 10%.
3. Visualización
NOTA: Los protocolos de visualización difieren según el escáner ct. En este protocolo se utilizó un escáner de TC de rayos X de microfoco. Es necesario optimizar el método de imagen de acuerdo con cada escáner de TC.
- Fije la muestra en un tubo de 50 ml que contenga PBS.
- Coloque el tubo de muestra sobre la mesa.
- Escanee la muestra con una tensión de 50 kV y una corriente de 600 μA, asegurando una distancia de enfoque al centro de 75,2 mm.
NOTA: Una dimensión de 1 vóxel fue de 28,7 μm x 28,7 μm x 28,7 μm en este entorno. - Cargue los datos de imagen adquiridos con Fiji, una plataforma de código abierto para el análisis de imágenes biológicas.
- Determinar el valor del vóxel muscular utilizando el músculo gastrocnemio.
- Elija el músculo gastrocnemio utilizando la herramienta de rectángulo .
- Comprobar la media y la desviación estándar (DE) del histograma (Analizar | Histograma).
- Definir la densidad del vóxel muscular como media + 2SD del músculo gastrocnemio.
- Establezca la densidad del vóxel muscular como el nivel de umbral inferior (imagen | ajustar | Umbral | Establecer | nivel de umbral inferior).
NOTA: El área vascular y el área ósea permanecen en los datos binarizados después de establecer el umbral.
Resultados
Todos los vasos de las extremidades inferiores se pueden visualizar si este protocolo se realiza correctamente (Figura 2A). En un modelo de isquemia de las extremidades posteriores, la arteria femoral no ligada corre paralela a la vena femoral (Figura 2B), y una arteria femoral ligada puede confirmarse mediante la interrupción de los medios de contraste (Figura 2C). Los resultados revelaron el desarrollo de buques colaterales (Figura 2D). La circulación colateral se forma entre las arterias proximales a la arteria ligada y la arteria en la región inferior de la pierna y en los lados ventral y dorsal de la arteria femoral. La arteria glútea inferior, que comienza en el lado dorsal de la pelvis y corre en el lado lateral del muslo, se expande robustamente en el lado isquémico.
Los recipientes llenos de contraste se llenan con el medio de contraste (Figura 2E); la interrupción en el contraste indica mezcla de medios no contraste (por ejemplo, sangre, tampón vasodilatador o burbujas) o perfusión insuficiente del contraste (Figura 2F). La vasodilatación y la fijación no funcionarían bien si los vasos sanguíneos se han encogido. Aunque las imágenes por TC solo pueden visualizar el medio de contraste, es posible ver las arterias en la superficie del cuerpo mediante observación macroscópica o estereomicroscópica (Figura 2G). Por lo tanto, es más fácil evaluar los defectos utilizando el medio de contraste (Figura 2H).
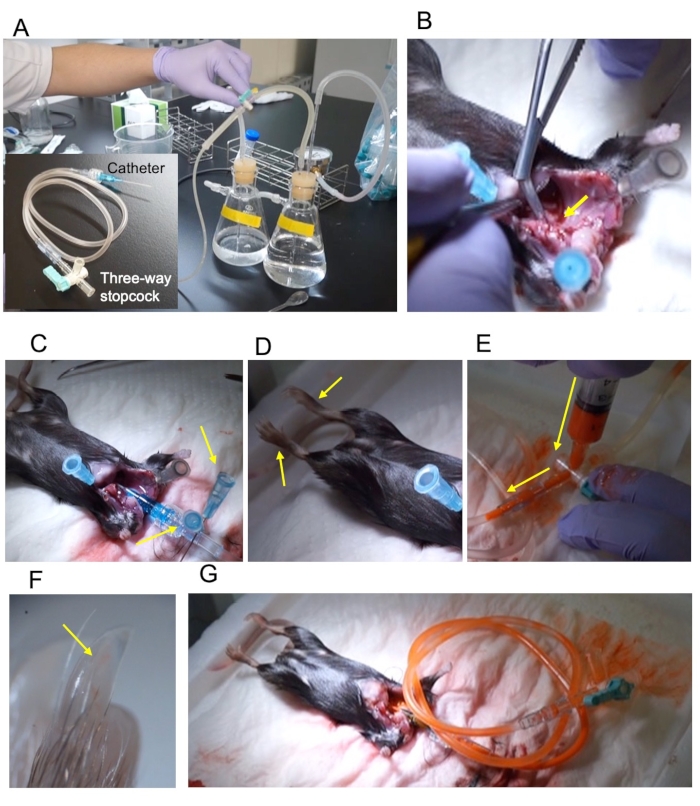
Figura 1: Esquema del procedimiento. (A) Aparato de perfusión a presión y el catéter de 22 G conectados a través de un tubo de extensión de 2 ml y una llave de paso de tres vías. (B) La aorta ascendente se corta diagonalmente para exponer la sección transversal (flecha amarilla). (C) El catéter se fijó con dos pines (flechas amarillas). (D) Las extremidades inferiores fijas se extienden tras la fijación (flechas amarillas). (E) Inyección de contraste a través de la llave de paso de tres vías. La dirección de la inyección se indica mediante una flecha amarilla. (F) La uña de la extremidad posterior se llena con el contraste (flecha amarilla). (G) La llave de paso se cierra y se retira del aparato de perfusión. Haga clic aquí para ver una versión más grande de esta figura.
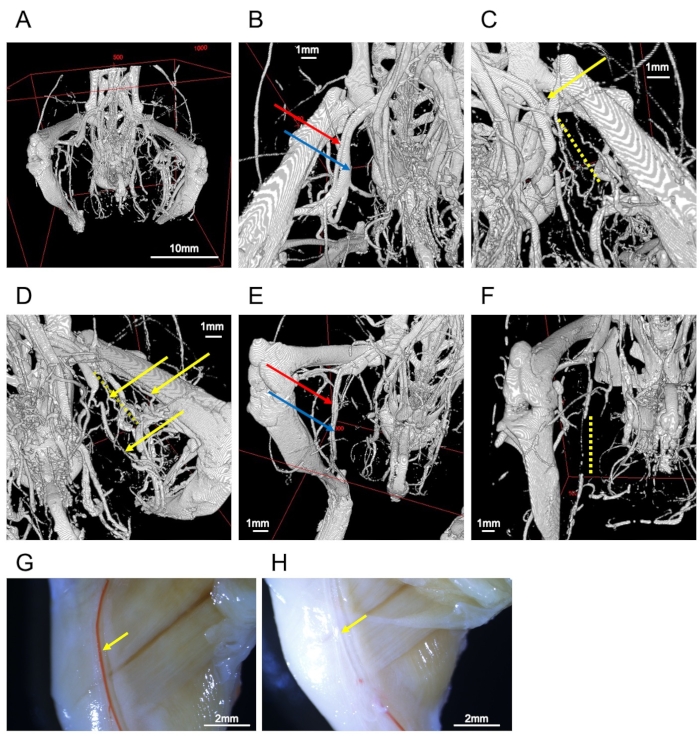
Figura 2: Imágenes de buques. (A) Imagen completa de los huesos y vasos de las extremidades posteriores. (B) Arteria femoral (flecha roja) y vena (flecha azul). (C) Arteria femoral ligada (flecha amarilla). La periferia es interrumpida por la obstrucción (línea punteada amarilla). (D) Vasos colaterales en el lado ligado (flechas amarillas). La línea punteada amarilla representa la arteria femoral interrumpida. (E) Una muestra bien llena de la arteria safena (flecha roja) y la vena (flecha azul). (F) La perfusión inadecuada conduce a la interrupción de los vasos safenos (línea punteada amarilla). (G) Observación estereomicroscópica de una muestra representativa. La arteria femoral derecha (flecha amarilla) está llena de medio de contraste. (H) Observación estereomicroscopio de una muestra fallida. La arteria femoral derecha (flecha amarilla) carece de medio de contraste. Barras de escala = 1 mm (B-F), 2 mm (G, H), 10 mm (A). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este informe presenta un método sofisticado para visualizar los vasos sanguíneos en la parte inferior del cuerpo. Hay varios pasos críticos en este proceso: el primero es la preperfusión antes de la inyección del medio de contraste. Si no se extrae suficiente sangre, el contraste no llenará el sistema. Además, la inclusión de burbujas de aire perturba el llenado del contraste; por lo tanto, el aire en el circuito debe eliminarse por completo. Además, debido a que el medio de contraste no se solidifica inmediatamente después de la inyección, la muestra no debe moverse excesivamente.
Este método es útil para evaluar el aumento de la formación de vasos sanguíneos y la circulación, como la circulación colateral. Por el contrario, como limitación, es difícil evaluar los vasos sanguíneos estrechados, ya que es difícil distinguir entre estenosis y una reducción artificial en el medio de contraste. Además, es difícil evaluar los vasos sanguíneos en los huesos, ya que la separación de la sangre y el hueso es difícil.
Un método alternativo para la visualización 3D es la inmunotinción. Utilizando la técnica de limpieza de tejidos, hay varios métodos disponibles para imágenes 3D7. La inmunotinción es ventajosa ya que permite la tinción de proteínas específicas utilizando anticuerpos. Un informe reciente desafía las imágenes de todo el cuerpo basadas en la inmunotinción8; sin embargo, las imágenes basadas en TC no requieren ningún tratamiento previo de limpieza de tejidos.
Este método permite la visualización de todos los vasos debajo del diafragma, incluidos los órganos abdominales. La angiogénesis en los órganos abdominales tiene un fuerte impacto en el mantenimiento de la homeostasis y el desarrollo de enfermedades9,10. Como este protocolo se optimizó para la evaluación de los vasos de las extremidades inferiores, el cebado específico de órganos permitiría la visualización de la angiogénesis asociada con cualquier factor, como inflamación o tumores.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Agradecemos a Yasuyo Kimura, Megumi Nagahiro y Saeko Tokunaga por el excelente apoyo técnico en experimentos con animales.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | TERUMO | SS-01T | |
| 10% Formalin Solution | Fujifilm-Wako | 068-03841 | |
| 10x phosphate-buffered saline (-) (PBS) | Fujifilm-Wako | 163-25265 | Prepare 1x PBS |
| 22 G catheter (22 G S5 x 1" V(F)) | MEDIKIT | HP2140 | Only catheter is used. |
| 23 G needle | TERUMO | NN-2325R | Use as a pin |
| 4% paraformaldehyde in PBS | Fujifilm-Wako | 163-20145 | |
| 5 mL syringe | |||
| 5-0 Suture with needle | Alfresa Pharma Corporation | ER1205SB45 | |
| Adenosine | Sigma-aldrich | A9251-5G | For vasodilating solution |
| Dumont #55 Forceps | FST | No.11255-20 | |
| Extension tube | TOP | X2-FL50 | |
| Falcon 50 mL tube | CORNING | 352098 | |
| Graefe Forceps | FST | No.11051-10 | |
| Heparin Sodium 5,000 units/5 mL | Mochida Co. Ltd. | 224122458 | |
| Isoflurane | Fujifilm-Wako | 099-06571 | |
| Microfil Injection Compounds | Flow Tech Inc. | MV-117 | Mix liquid MV-Compound (stain) and MV-Diluent 1: 1 |
| Papaverine hydrochloride | Fujifilm | 164-18002 | For vasodilating solution |
| Small Animal Anesthetizer | Muromachi Kikai Co. Ltd. | MK-A100ecoW-ST | |
| Spring Scissors - Angled to Side | FST | No.15006-09 | |
| Surgical Scissors - Sharp-Blunt | FST | No.14001-12 | |
| three-way cock | TERUMO | TS-TR1K | |
| Transfer pipette | SAMCO SCIENTIFIC | SM262-1S | Use for mixing contrast medium |
| X-ray CT scanner | Toshiba IT & Control Systems Corporation | TOSHIBA TOSCANNER 32300 FPD |
Referencias
- Folkman, J. Angiogenesis. Annual Review of Medicine. 57, 1-18 (2006).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nature Medicine. 1 (1), 27-31 (1995).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PLoS One. 8 (12), 84047 (2013).
- Limbourg, A., et al. Evaluation of postnatal arteriogenesis and angiogenesis in a mouse model of hind-limb ischemia. Nature Protocols. 4 (12), 1737-1746 (2009).
- Weyers, J. J., Carlson, D. D., Murry, C. E., Schwartz, S. M., Mahoney, W. M. Retrograde perfusion and filling of mouse coronary vasculature as preparation for micro computed tomography imaging. Journal of Visualized Experiments: JoVE. (60), e3740 (2012).
- Arima, Y., et al. Evaluation of collateral source characteristics with 3-dimensional analysis using micro-X-ray computed tomography. Journal of the American Heart Association. 7 (6), 007800 (2018).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Susaki, E. A., et al. Advanced CUBIC protocols for whole-brain and whole-body clearing and imaging. Nature Protocols. 10 (11), 1709-1727 (2015).
- Fernandez, M., et al. Angiogenesis in liver disease. Journal of Hepatology. 50 (3), 604-620 (2009).
- Li, S., et al. Angiogenesis in pancreatic cancer: current research status and clinical implications. Angiogenesis. 22 (1), 15-36 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados