Method Article
Préparation d’échantillons pour la visualisation tridimensionnelle basée sur la tomodensitométrie des vaisseaux murins des membres postérieurs
Dans cet article
Résumé
Nous décrivons ici une méthode de visualisation et de quantification des vaisseaux murins des membres postérieurs à l’aide de la tomodensitométrie par micro-rayons X.
Résumé
Les vaisseaux sanguins sont des réseaux complexes avec des structures arborescentes, et les réseaux vasculaires sont essentiels pour maintenir à la fois la circulation et le maintien de la fonction des organes. Clarifier le mécanisme de formation des vaisseaux sanguins est donc extrêmement utile pour élucider les processus de développement et les mécanismes pathologiques. Les vaisseaux murins des membres postérieurs sont souvent utilisés comme modèle pour l’angiogenèse physiologique et pathologique. L’évaluation est principalement effectuée par une méthode bidimensionnelle utilisant des coupes de tissus. Cependant, les méthodes d’évaluation de la morphologie vasculaire tridimensionnelle (3D) sont particulièrement limitées. Cet article présente une méthode de visualisation des membres postérieurs murins à l’aide de la tomodensitométrie (TDM). La résine opaque par rayonnement est injectée à travers l’aorte descendante et des vaisseaux entiers sont remplis de colorant. En ajustant le temps d’injection du colorant, un remplissage spécifique à l’artère est également possible et des échantillons peuvent être obtenus avec n’importe quel appareil de tomodensitométrie à micro-rayons X. Cette méthode de contraste fournit une technique de base pour l’évaluation 3D des vaisseaux sanguins murins dans les membres inférieurs. En outre, cette méthode peut être utilisée pour visualiser tous les vaisseaux sanguins sous le diaphragme et évaluer les vaisseaux sanguins dans les organes abdominaux.
Introduction
Les vaisseaux sanguins sont des réseaux complexes avec des structures arborescentes. L’angiogenèse et la nouvelle formation vasculaire jouent un rôle essentiel dans le maintien de l’homéostasie des organes1. L’angiogenèse est régulée pour le traitement des maladies ischémiques et malignes2. Il est donc essentiel de comprendre les mécanismes sous-jacents de l’angiogenèse. Les vaisseaux murins des membres postérieurs sont souvent utilisés comme modèle utile pour la recherche vasculaire3; La ligature ipsilatérale de l’artère iliaque ou fémorale est un modèle connu d’ischémie des membres postérieurs utilisé pour évaluer l’angiogenèse et le remodelage vasculaire dans l’angiogenèse physiologique et pathologique4. Cependant, l’évaluation de l’angiogenèse est principalement réalisée par coloration par section, et les méthodes d’évaluation de la morphologie vasculaire 3D sont particulièrement limitées.
Par rapport à la coloration de section, la tomodensitométrie permet une visualisation 3D. Récemment, Weyers et al. ont rapporté un protocole sophistiqué adapté à l’imagerie CT, permettant la visualisation du système circulatoire coronaire adulte murin5. Nous avons modifié leur méthode pour créer une méthode de préparation d’échantillons adaptée à l’imagerie par tomodensitométrie des vaisseaux sanguins des membres inférieurs6. Ici, une résine opaque par rayonnement est injectée à travers l’aorte descendante et les vaisseaux des membres inférieurs sont remplis de colorant. En ajustant le temps d’injection du colorant, un remplissage spécifique à l’artère est également possible et des échantillons peuvent être obtenus avec n’importe quel appareil de tomodensitométrie à micro-rayons X. Cette méthode de contraste fournit une technique de base pour l’évaluation 3D des vaisseaux sanguins murins sous le diaphragme et dans les organes abdominaux et les membres inférieurs.
Protocole
Toutes les procédures ont été effectuées conformément aux directives de soins aux animaux de l’Université de Kumamoto (référence d’approbation no. M30-040/A2020-105), qui sont conformes au Guide des états-Unis des National Institutes of Health pour les soins et l’utilisation des animaux de laboratoire (publication n° 85-23, révisée en 2011).
1. Préparation
- Préparer l’appareil de perfusion et le tampon vasodilatateur (4 mg/L de chlorhydrate de papavérine, 4 g/L; adénosine, 1 g/L; héparine, 1 U/mL dans une solution saline tamponnée au phosphate (PBS)).
REMARQUE: Le dispositif de reflux et les réactifs vasodilatateurs sont les mêmes que ceux rapportés par Weyers et al.5. - Connectez le cathéter de 22 G, le tube d’extension de 2 mL et le robinet d’arrêt à trois voies (Figure 1A).
REMARQUE: Ajustez la jauge en fonction de la taille de l’animal. Pour les souris adultes C57BL/6, 22 G est optimal. - Remplissez l’appareil de perfusion sous pression avec le tampon vasodilatateur (Figure 1A).
REMARQUE: Évitez la formation de bulles pour éviter toute perturbation dans le remplissage du produit de contraste.
2. Perfusion
- Injecter 1 U/g d’héparine dans le PBS dans la cavité intrapéritonéale 30 min avant l’opération.
- Anesthésiez complètement la souris avec de l’isoflurane et euthanasiez-la par luxation cervicale.
- Après la décapitation, faites une incision médiane dans le sternum et fixez le thorax ouvert avec des épingles.
REMARQUE: Pour éviter les fuites de contraste, évitez de blesser le diaphragme. - Coupez l’aorte ascendante et retirez le cœur.
- Retirez le poumon et exposez l’aorte descendante.
REMARQUE: Ne pas blesser l’aorte descendante. - Coupez l’aorte descendante en diagonale pour exposer la section transversale (Figure 1B).
REMARQUE: Ne pas décoller l’aorte; une section diagonale est préférable pour l’insertion du cathéter. - Insérez le cathéter de 22 G dans l’aorte descendante tout en exécutant le tampon de vasodilatation.
REMARQUE: L’insertion du cathéter pendant l’exécution du tampon de vasodilatation évite la contamination de l’air. - Épinglez la racine du cathéter (Figure 1C).
- Faites un nœud pour éviter les fuites dues au refoulement.
- Perfuser une solution vasodilatatrice chauffée (chlorhydrate de papavérine, 4 g/L ; adénosine, 1 g/L ; héparine, 1 U/mL) pendant 3 min à une pression fixe comprise entre 13 et 15 kPa.
- Perfuser une solution de paraformaldéhyde à 4% dans (PBS) pendant 3 min.
REMARQUE: Le succès de la fixation peut être confirmé par le mouvement du pied (Figure 1D). - Préparez le produit de contraste juste avant la perfusion.
REMARQUE: Ajuster le taux de dilution en fonction de l’échantillon; pour les souris adultes, mélanger la tache et le diluant dans un rapport de 1: 1. - Arrêtez la perfusion et remplissez le tube d’extension avec 2 mL de produit de contraste dilué (Figure 1E).
REMARQUE: Le produit de contraste doit être injecté lentement pour éviter de blesser les vaisseaux sanguins. - Perfuser le produit de contraste à une pression fixe comprise entre 13 et 15 kPa.
- Pour visualiser les artères, vérifiez l’ongle de l’orteil pour confirmer que le produit de contraste a atteint l’artère (Figure 1F).
- Pour visualiser tous les vaisseaux, vérifiez la veine cave inférieure du diaphragme pour confirmer la circulation complète du produit de contraste.
REMARQUE: Au début, le contraste contient la solution vasodilatatrice; par conséquent, sa bonne circulation est essentielle.
- Fermez le robinet d’arrêt à trois voies et retirez le tube (Figure 1G).
REMARQUE: Si le robinet d’arrêt à trois voies n’est pas fermé, le contraste s’écoulera vers l’arrière. - Incuber l’échantillon pendant la nuit à 4 °C.
- Retirez la peau et fixez-la dans une solution de formaldéhyde à 10%.
3. Visualisation
REMARQUE : Les protocoles de visualisation diffèrent selon le tomodensitomètre. Un tomodensitomètre à rayons X microfocus a été utilisé dans ce protocole. Il est nécessaire d’optimiser la méthode d’imagerie en fonction de chaque tomodensitomètre.
- Fixez l’échantillon dans un tube de 50 mL contenant du PBS.
- Placez le tube d’échantillonnage sur la table.
- Scannez l’échantillon avec une tension de 50 kV et un courant de 600 μA, en assurant une distance focale-centre de 75,2 mm.
REMARQUE: Une dimension de 1 voxel était de 28,7 μm x 28,7 μm x 28,7 μm dans ce contexte. - Chargez les données d’image acquises avec Fiji, une plate-forme open source pour l’analyse d’images biologiques.
- Déterminez la valeur du voxel musculaire à l’aide du muscle gastrocnémien.
- Choisissez le muscle gastrocnémien à l’aide de l’outil rectangle .
- Vérifiez la moyenne et l’écart-type (ET) de l’histogramme (Analyser | Histogramme).
- Définissez la densité du voxel musculaire comme moyenne + 2SD du muscle gastrocnémien.
- Définissez la densité du voxel musculaire comme niveau de seuil inférieur (Image | ajustez | Seuil | Définir | niveau de seuil inférieur).
REMARQUE: La zone vasculaire et la zone osseuse restent dans les données binarisées après la définition du seuil.
Résultats
Tous les vaisseaux des membres inférieurs peuvent être visualisés si ce protocole est correctement exécuté (Figure 2A). Dans un modèle d’ischémie des membres postérieurs, l’artère fémorale non ligaturée est parallèle à la veine fémorale (figure 2B), et une artère fémorale ligaturée peut être confirmée par l’interruption des produits de contraste (figure 2C). Les résultats ont révélé le développement de navires collatéraux (figure 2D). La circulation collatérale se forme entre les artères proximales de l’artère ligaturée et l’artère dans la région de la jambe inférieure et sur les côtés ventral et dorsal de l’artère fémorale. L’artère fessière inférieure - commençant sur la face dorsale du bassin et courant sur le côté latéral de la cuisse - se dilate solidement sur le côté ischémique.
Les récipients remplis de contraste sont remplis avec le produit de contraste (figure 2E); la perturbation du contraste indique un mélange de milieux non contretrastes (p. ex., sang, tampon vasodilatateur ou bulles) ou une perfusion insuffisante du contraste (figure 2F). La vasodilatation et la fixation ne fonctionneraient pas bien si les vaisseaux sanguins avaient rétréci. Bien que l’imagerie CT ne puisse visualiser que le produit de contraste, il est possible de visualiser les artères à la surface du corps par observation macroscopique ou stéréoscopique (Figure 2G). Ainsi, il est plus facile d’évaluer les défauts à l’aide du produit de contraste (Figure 2H).
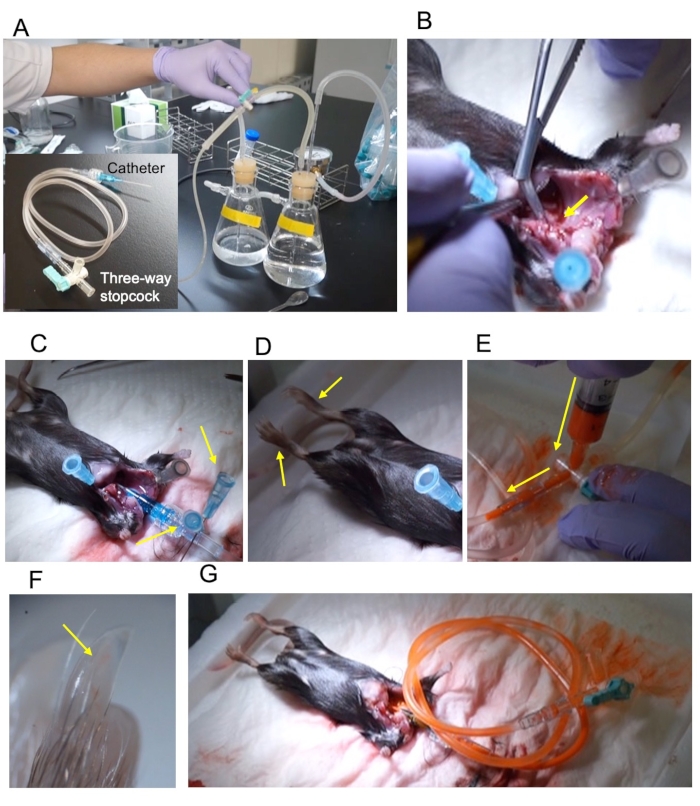
Figure 1: Aperçu de la procédure. (A) Appareil de perfusion sous pression et cathéter 22 G reliés par un tube d’extension de 2 mL et un robinet d’arrêt à trois voies. (B) L’aorte ascendante est coupée en diagonale pour exposer la section transversale (flèche jaune). (C) Le cathéter a été fixé à l’aide de deux broches (flèches jaunes). (D) Les membres inférieurs fixes s’étendent lors de la fixation (flèches jaunes). (E) Injection de contraste à travers le robinet d’arrêt à trois voies. La direction d’injection est indiquée par une flèche jaune. (F) L’ongle du membre postérieur est rempli du contraste (flèche jaune). (G) Le robinet d’arrêt est fermé et retiré de l’appareil de perfusion. Veuillez cliquer ici pour voir une version agrandie de cette figure.
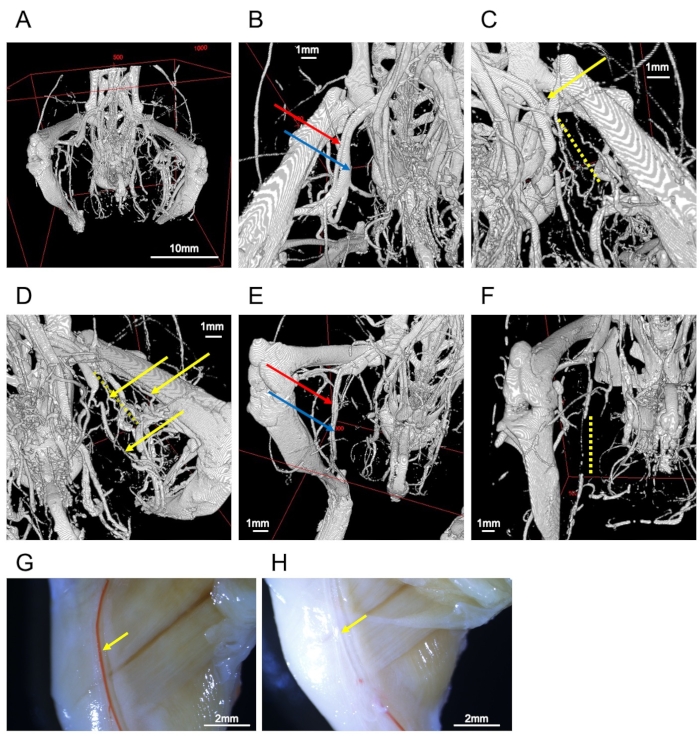
Figure 2 : Images de navires. (A) Image entière des os et des vaisseaux des membres postérieurs. (B) Artère fémorale (flèche rouge) et veine (flèche bleue). (C) Artère fémorale ligaturée (flèche jaune). La périphérie est interrompue par l’obstruction (ligne pointillée jaune). D) Récipients collatéraux du côté ligaturé (flèches jaunes). La ligne pointillée jaune représente l’artère fémorale interrompue. (E) Un échantillon bien rempli de l’artère saphène (flèche rouge) et de la veine (flèche bleue). (F) Une perfusion inadéquate entraîne l’interruption des vaisseaux saphènes (ligne pointillée jaune). G) Observation stérémicroscopique d’un échantillon représentatif. L’artère fémorale droite (flèche jaune) est remplie de produit de contraste. (H) Observation par stéréomicroscope d’un échantillon défaillant. L’artère fémorale droite (flèche jaune) manque de produit de contraste. Barres d’échelle = 1 mm (B-F), 2 mm (G, H), 10 mm (A). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce rapport présente une méthode sophistiquée pour visualiser les vaisseaux sanguins dans le bas du corps. Il y a plusieurs étapes critiques dans ce processus: la première est la préfusion avant l’injection de produit de contraste. Si suffisamment de sang n’est pas retiré, le contraste ne remplira pas le système. De plus, l’inclusion de bulles d’air perturbe le remplissage du contraste; ainsi, l’air dans le circuit doit être complètement éliminé. De plus, comme le produit de contraste ne se solidifie pas immédiatement après l’injection, l’échantillon ne doit pas être déplacé de manière excessive.
Cette méthode est utile pour évaluer la formation accrue de vaisseaux sanguins et de circulation, comme la circulation collatérale. Inversement, comme limite, il est difficile d’évaluer les vaisseaux sanguins rétrécis, car il est difficile de faire la distinction entre la sténose et une réduction artificielle du produit de contraste. De plus, il est difficile d’évaluer les vaisseaux sanguins dans les os, car la séparation du sang et des os est difficile.
Une méthode alternative pour la visualisation 3D est l’immunocoloration. En utilisant la technique de nettoyage des tissus, plusieurs méthodes sont disponibles pour l’imagerie 3D7. L’immunocoloration est avantageuse car elle permet la coloration de protéines spécifiques à l’aide d’anticorps. Un rapport récent remet en question l’imagerie du corps entier basée sur l’immunocoloration8; cependant, l’imagerie par tomodensitométrie ne nécessite aucun prétraitement de nettoyage tissulaire.
Cette méthode permet la visualisation de tous les vaisseaux sous le diaphragme, y compris les organes abdominaux. L’angiogenèse dans les organes abdominaux a un fort impact sur le maintien de l’homéostasie et le développement de maladies9,10. Comme ce protocole a été optimisé pour l’évaluation des vaisseaux des membres inférieurs, l’amorçage spécifique à l’organe permettrait la visualisation de l’angiogenèse associée à n’importe quel facteur, tel que l’inflammation ou les tumeurs.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Nous remercions Yasuyo Kimura, Megumi Nagahiro et Saeko Tokunaga pour l’excellent soutien technique dans l’expérimentation animale.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | TERUMO | SS-01T | |
| 10% Formalin Solution | Fujifilm-Wako | 068-03841 | |
| 10x phosphate-buffered saline (-) (PBS) | Fujifilm-Wako | 163-25265 | Prepare 1x PBS |
| 22 G catheter (22 G S5 x 1" V(F)) | MEDIKIT | HP2140 | Only catheter is used. |
| 23 G needle | TERUMO | NN-2325R | Use as a pin |
| 4% paraformaldehyde in PBS | Fujifilm-Wako | 163-20145 | |
| 5 mL syringe | |||
| 5-0 Suture with needle | Alfresa Pharma Corporation | ER1205SB45 | |
| Adenosine | Sigma-aldrich | A9251-5G | For vasodilating solution |
| Dumont #55 Forceps | FST | No.11255-20 | |
| Extension tube | TOP | X2-FL50 | |
| Falcon 50 mL tube | CORNING | 352098 | |
| Graefe Forceps | FST | No.11051-10 | |
| Heparin Sodium 5,000 units/5 mL | Mochida Co. Ltd. | 224122458 | |
| Isoflurane | Fujifilm-Wako | 099-06571 | |
| Microfil Injection Compounds | Flow Tech Inc. | MV-117 | Mix liquid MV-Compound (stain) and MV-Diluent 1: 1 |
| Papaverine hydrochloride | Fujifilm | 164-18002 | For vasodilating solution |
| Small Animal Anesthetizer | Muromachi Kikai Co. Ltd. | MK-A100ecoW-ST | |
| Spring Scissors - Angled to Side | FST | No.15006-09 | |
| Surgical Scissors - Sharp-Blunt | FST | No.14001-12 | |
| three-way cock | TERUMO | TS-TR1K | |
| Transfer pipette | SAMCO SCIENTIFIC | SM262-1S | Use for mixing contrast medium |
| X-ray CT scanner | Toshiba IT & Control Systems Corporation | TOSHIBA TOSCANNER 32300 FPD |
Références
- Folkman, J. Angiogenesis. Annual Review of Medicine. 57, 1-18 (2006).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nature Medicine. 1 (1), 27-31 (1995).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PLoS One. 8 (12), 84047(2013).
- Limbourg, A., et al. Evaluation of postnatal arteriogenesis and angiogenesis in a mouse model of hind-limb ischemia. Nature Protocols. 4 (12), 1737-1746 (2009).
- Weyers, J. J., Carlson, D. D., Murry, C. E., Schwartz, S. M., Mahoney, W. M. Retrograde perfusion and filling of mouse coronary vasculature as preparation for micro computed tomography imaging. Journal of Visualized Experiments: JoVE. (60), e3740(2012).
- Arima, Y., et al. Evaluation of collateral source characteristics with 3-dimensional analysis using micro-X-ray computed tomography. Journal of the American Heart Association. 7 (6), 007800(2018).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Susaki, E. A., et al. Advanced CUBIC protocols for whole-brain and whole-body clearing and imaging. Nature Protocols. 10 (11), 1709-1727 (2015).
- Fernandez, M., et al. Angiogenesis in liver disease. Journal of Hepatology. 50 (3), 604-620 (2009).
- Li, S., et al. Angiogenesis in pancreatic cancer: current research status and clinical implications. Angiogenesis. 22 (1), 15-36 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon