Method Article
Murine Hind-limb Damarlarının Bilgisayarlı Tomografi Tabanlı Üç Boyutlu Görselleştirilmesi için Örnek Hazırlık
Bu Makalede
Özet
Burada, mikro-X-ışını bilgisayarlı tomografi kullanarak murine arka eks uzuv damarları için bir görselleştirme ve niceleme yöntemini açıklıyoruz.
Özet
Kan damarları ağaç benzeri yapılara sahip karmaşık ağlardır ve damar ağları hem dolaşımı korumak hem de organ fonksiyonunu korumak için gereklidir. Bu nedenle kan damarı oluşum mekanizmasının netleştirilmesi, gelişimsel süreçleri ve patolojik mekanizmaları aydınlatmak için son derece yararlıdır. Murine arka ekstremite damarları genellikle fizyolojik ve patolojik anjiogenez için bir model olarak kullanılır. Değerlendirme esas olarak doku bölümleri kullanılarak iki boyutlu bir yöntemle gerçekleştirilir. Bununla birlikte, üç boyutlu (3D) vasküler morfolojiyi değerlendirme yöntemleri özellikle sınırlıdır. Bu makalede, bilgisayarlı tomografi (BT) kullanılarak murine arka uzuvların görselleştirilmesi için bir yöntem tanıtılmıştır. Radyasyon-opak reçine, alçalan aorttan enjekte edilir ve tüm damarlar boya ile doldurulur. Boya enjeksiyonunun süresinin ayarlanmasıyla arteriyel spesifik dolgu da mümkündür ve herhangi bir mikro-X-ışını CT cihazı ile numuneler alınabilir. Bu kontrast yöntemi, alt ekstremitelerdeki murin kan damarlarının 3D değerlendirilmesi için temel bir teknik sağlar. Ayrıca, bu yöntem diyaframın altındaki tüm kan damarlarını görselleştirmek ve karın organlarındaki kan damarlarını değerlendirmek için kullanılabilir.
Giriş
Kan damarları ağaç benzeri yapılara sahip karmaşık ağlardır. Anjiogenez ve yeni vasküler oluşum organ homeostazının sürdürülmesinde önemli roller oynar1. Anjiogenez iskemik ve kötü huylu hastalıkların tedavisi için düzenlenir2. Bu nedenle anjiogenezin altında kalan mekanizmaları anlamak esastır. Murine arka eks uzuv damarları genellikle damar araştırmaları için yararlı bir model olarak kullanılır3; iliak veya femoral arterin ipsilateral ligasyonu, fizyolojik ve patolojik anjiogenezde anjiogenez ve vasküler remodelasyonu değerlendirmek için kullanılan bilinen bir arka ekstremite iskemi modelidir4. Bununla birlikte, anjiogenezin değerlendirilmesi esas olarak kesit boyama ile gerçekleştirilir ve 3D vasküler morfolojiyi değerlendirme yöntemleri özellikle sınırlıdır.
Kesit boyama ile karşılaştırıldığında, CT 3D görselleştirme sağlar. Son zamanlarda, Weyers ve arkadaşları, murine yetişkin koroner dolaşım sisteminin görselleştirilmesini sağlayan BT görüntüleme için uygun sofistike bir protokol bildirmektedir5. Alt ekstremite kan damarlarının BT görüntülemesine uygun bir örnek hazırlama yöntemi oluşturmak için yöntemlerini değiştirdik6. Burada, alçalan aorttan radyasyon-opak bir reçine enjekte edilir ve alt ekstremitelerdeki damarlar boya ile doldurulur. Boya enjeksiyonunun zamanı ayarlanarak arteriyel spesifik dolgu da mümkündür ve herhangi bir mikro-X-ışını bilgisayarlı tomografi cihazı ile numuneler alınabilir. Bu kontrast yöntemi diyaframın altındaki ve karın organlarında ve alt ekstremitelerde murin kan damarlarının 3D değerlendirilmesi için temel bir teknik sağlar.
Protokol
Tüm prosedürler Kumamoto Üniversitesi hayvan bakım yönergelerine uygun olarak gerçeklenmiştir (onay referans no. M30-040/A2020-105), ABD Ulusal Laboratuvar Hayvanlarının Bakımı ve Kullanımı Için Sağlık Enstitüleri Kılavuzu'na uygundur (yayın no. 85-23, revize 2011).
1. Hazırlık
- Perfüzyon aparatı ve vazodilatör tamponunu hazırlayın (fosfat tamponlu salinde (PBS) 4 mg/L papaverin hidroklorür, 4 g/L; adenozin, 1 g/L; heparin, 1 U/mL).
NOT: Reflü cihazı ve vazodilatör reaktifleri Weyers ve ark.5 tarafından bildirilenlerle aynıdır. - 22 G kateter, 2 mL uzatma tüpü ve üç yönlü stopcock'u bağlayın (Şekil 1A).
NOT: Ölçeri hayvanın büyüklüğüne göre ayarlayın. Yetişkin C57BL/ 6 fareler için 22 G en uygun olanıdır. - Basınç perfüzyon cihazını vazodilatör tamponu ile doldurun (Şekil 1A).
NOT: Kontrast ortamının doldurulmasında aksamayı önlemek için kabarcıkların oluşmasından kaçının.
2. Perfüzyon
- Operasyondan 30 dakika önce PBS'deki 1 U/g heparini intraperitoneal boşluğa enjekte edin.
- Fareyi izofluran ile tamamen uyuşturun ve servikal çıkık ile ötenazi.
- Kafa kesmeden sonra sternumda bir orta çizgi kesisi yapın ve açık toraksı pimlerle sabitleyin.
NOT: Kontrastın sızmasını önlemek için diyaframın yaralanmasını önler. - Yükselen aortu kesin ve kalbi çıkarın.
- Akciğeri çıkarın ve alçalanı aort ortaya çıkarın.
NOT: Azalan aortu yaralamayın. - Kesiti ortaya çıkarmak için azalan aortu çapraz olarak kesin (Şekil 1B).
NOT: Aortu soymayın; köşegen bir bölüm kateter takmak için daha iyidir. - Vazodilasyon tamponunu çalıştırırken 22 G kateteri azalan aort içine yerleştirin.
NOT: Vazodilasyon tamponu çalıştırılırken kateterin yerleştirilmesi hava kirlenmesini önler. - Kateterin kökünü sabitleyin (Şekil 1C).
- Geri akış nedeniyle sızıntıyı önlemek için bir düğüm yapın.
- Isıtılmış bir vazodilasyon çözeltisi (papaverin hidroklorür, 4 g/L; adenozin, 1 g/L; heparin, 1 U/mL) 13 ila 15 kPa arasında sabit bir basınçta 3 dakika boyunca kullanın.
- 3 dakika boyunca (PBS) %4 paraformaldehit çözeltisi kullanın.
NOT: Fiksasyonun başarısı ayağın hareketi ile doğrulanabilir (Şekil 1D). - Perfüzyondan hemen önce kontrast ortamını hazırlayın.
NOT: Seyreltme oranını örneğe göre ayarlayın; yetişkin fareler için lekeyi ve seyrelticiyi 1:1 oranında karıştırın. - Perfüzyonu durdurun ve uzatma tüpünü 2 mL seyreltilmiş kontrast ortamı ile doldurun (Şekil 1E).
NOT: Kan damarlarının yaralanmasını önlemek için kontrast ortamı yavaşça enjekte edilmelidir. - Kontrast ortamını 13 ila 15 kPa arasında sabit bir basınçta etkisiz haline geçirin.
- Arterleri görselleştirmek için, kontrast ortamının artere ulaştığını doğrulamak için tırnağı kontrol edin (Şekil 1F).
- Tüm damarları görselleştirmek için, kontrast ortamının tam dolaşımını onaylamak için diyaframın alt vena kavasını kontrol edin.
NOT: Başlangıçta, kontrast vazodilasyon çözeltisini içerir; bu nedenle, uygun sirkülasyonu esastır.
- Üç yönlü stopcock kapatın ve tüpü çıkarın (Şekil 1G).
NOT: Üç yönlü stopcock kapatılmazsa, kontrast geriye doğru akar. - Numuneyi 4 °C'de gece boyunca kuluçkaya yatırın.
- Cildi çıkarın ve% 10 formaldehit çözeltisinde sabitlenin.
3. Görselleştirme
NOT: Görselleştirme protokolleri CT tarayıcısına bağlı olarak farklılık gösterir. Bu protokolde mikro odak X-ışını CT tarayıcısı kullanıldı. Görüntüleme yöntemini her CT tarayıcısına göre optimize etmek gerekir.
- Numuneyi PBS içeren 50 mL'lik bir tüpe sabitle.
- Örnek tüpü masaya yerleştirin.
- Numuneyi 50 kV voltaj ve 600 μA akımla tarayarak 75,2 mm odak-merkez mesafesi sağlayın.
NOT: Bu ayarda 1 voksel boyutu 28,7 μm x 28,7 μm x 28,7 μm idi. - Elde edilen görüntü verilerini biyolojik görüntü analizi için açık kaynaklı bir platform olan Fiji ile yükleyin.
- Gastroknemius kasını kullanarak kas voksel değerini belirleyin.
- Dikdörtgen aracını kullanarak gastrocnemius kasını seçin.
- Histogramdan ortalama ve standart sapmayı (SD) kontrol edin (Analiz | Histogram).
- Kas voksel yoğunluğunu gastroknemius kasının ortalama + 2SD'si olarak tanımlayın.
- Kas voksel yoğunluğunu alt eşik seviyesi olarak ayarlayın (Görüntü | | Eşik | | ayarla daha düşük eşik düzeyi).
NOT: Vasküler alan ve kemik bölgesi eşik belirlendikten sonra binarized verisinde kalır.
Sonuçlar
Bu protokol doğru yapılırsa alt ekstremitelerdeki tüm damarlar görselleştirilebilir (Şekil 2A). Arka eksper iskemi modelinde, lige edilmemiş femoral arter femoral damara paralel çalışır (Şekil 2B) ve ligatlı bir femoral arter kontrast ortamın kesilmesiyle doğrulanabilir (Şekil 2C). Sonuçlar kollateral damarların gelişimini ortaya koydu (Şekil 2D). Bağrında dolaşım, liglenmiş artere proksimal olan arterler ile alt bacak bölgesindeki arterler arasında ve femoral arterin ventral ve dorsal taraflarında oluşur. Pelvisin dorsal tarafında başlayan ve uyluğun yan tarafında çalışan alt gluteal arter iskemik tarafta sağlam bir şekilde genişler.
Kontrast dolu kaplar kontrast ortamı ile doldurulur (Şekil 2E); kontrasttaki bozulma, noncontrast ortamlarının (örneğin, kan, vazodilatör tamponu veya kabarcıklar) karıştırıldığını veya kontrastın yetersiz perfüzyonunu gösterir (Şekil 2F). Kan damarları küçülmüşse vazodilatasyon ve fiksasyon iyi çalışmaz. BT görüntüleme sadece kontrast ortamını görselleştirebilse de makroskopik veya stereoskopik gözlem ile vücut yüzeyindeki arterleri görüntülemek mümkündür (Şekil 2G). Bu nedenle, kontrast ortamını kullanarak kusurları değerlendirmek daha kolaydır (Şekil 2H).
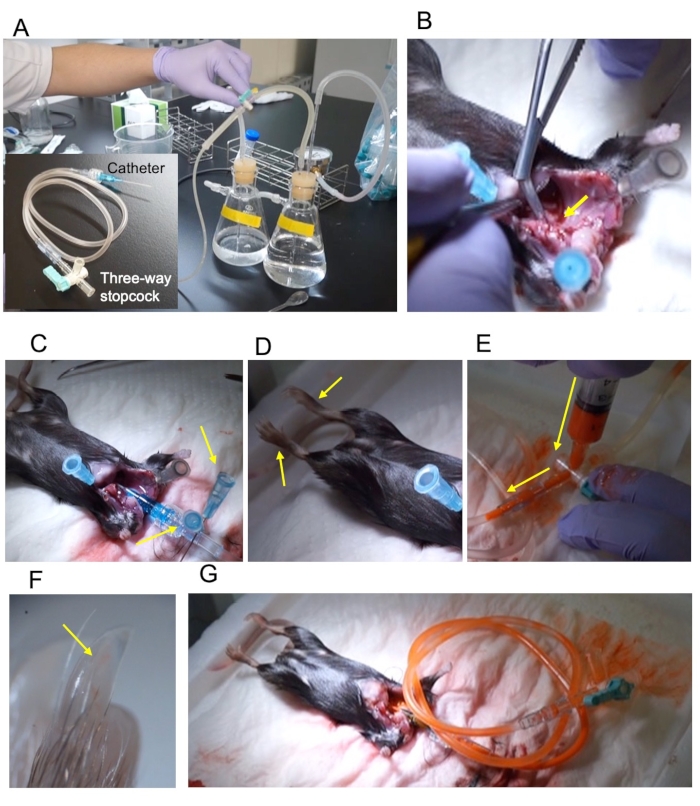
Şekil 1: Prosedürün ana hatları. (A) Basınç perfüzyon aparatı ve 22 G kateter 2 mL uzatma tüpü ve üç yönlü stopcock ile bağlanır. (B) Artan aort, kesiti (sarı ok) açığa çıkarmak için çapraz olarak kesilir. (C) Kateter iki pim (sarı ok) kullanılarak sabitlendi. (D) Sabit alt uzuvlar sabitleme üzerine uzanır (sarı oklar). (E) Üç yönlü stopcock yoluyla kontrast enjeksiyonu. Enjeksiyon yönü sarı bir okla gösterilir. (F) Arka eksfol uzuv çivisi kontrast (sarı ok) ile doldurulur. (G) Stopcock kapatılarak perfüzyon cihazından çıkarılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
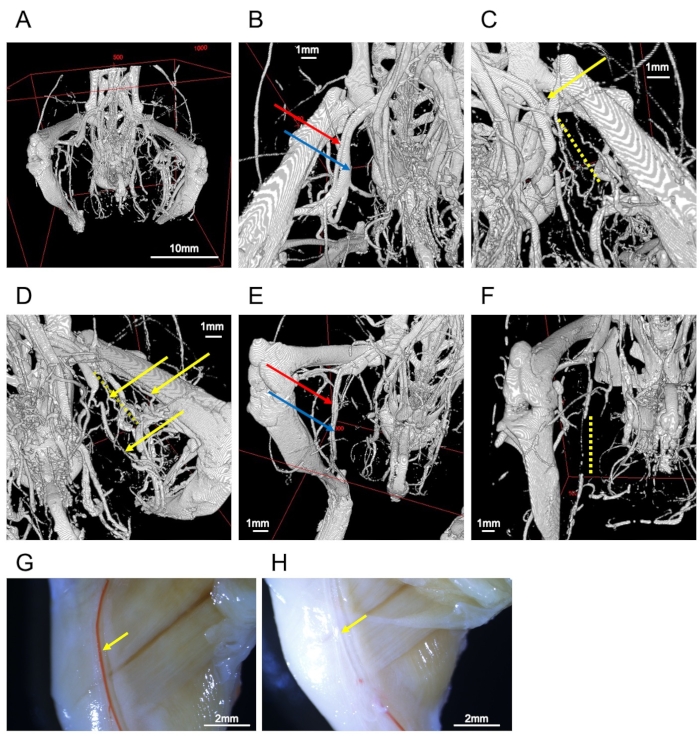
Şekil 2: Gemilerin görüntüleri. (A) Arka uzvun kemiklerinin ve damarlarının tüm görüntüsü. (B) Femoral arter (kırmızı ok) ve damar (mavi ok). (C) Ligated femoral arter (sarı ok). Çevre tıkanıklık (sarı noktalı çizgi) ile kesilir. (D) Liglenmiş taraftaki kollateral damarlar (sarı oklar). Sarı noktalı çizgi, kesilen femoral arteri temsil eder. (E) Saphenöz arter (kırmızı ok) ve damarın (mavi ok) iyi doldurulmuş bir örneği. (F) Yetersiz perfüzyon saphenöz damarların (sarı noktalı çizgi) kesilmesine yol açar. (G) Temsili bir numunenin stereomikroskopik gözlemi. Sağ uyluk atardamarı (sarı ok) kontrast ortamı ile doldurulur. (H) Başarısız bir numunenin stereomikroskop gözlemi. Sağ uyluk atardamarı (sarı ok) kontrast ortamından yoksundur. Ölçek çubukları = 1 mm (B-F), 2 mm (G, H), 10 mm (A). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu rapor, alt vücuttaki kan damarlarını görselleştirmek için sofistike bir yöntem sunar. Bu süreçte birkaç kritik adım vardır: birincisi kontrast ortamının enjeksiyonundan önce preperfüzyondur. Yeterli kan çıkarılmazsa, kontrast sistemi doldurmaz. Ek olarak, hava kabarcıklarının dahil edilmesi kontrastın doldurulması rahatsız eder; böylece devredeki hava tamamen çıkarılmalıdır. Ayrıca, kontrast ortamı enjeksiyondan hemen sonra katılaşmadığı için, numune aşırı hareket ettirilmemelidir.
Bu yöntem, kollateral dolaşım gibi kan damarlarının ve dolaşımın artan oluşumunu değerlendirmek için yararlıdır. Tersine, bir sınırlama olarak, dar kan damarlarını değerlendirmek zordur, çünkü darlık ve kontrast ortamda yapay bir azalma arasında ayrım yapmak zordur. Ek olarak, kan ve kemik ayrımı zor olduğu için kemiklerdeki kan damarlarını değerlendirmek zordur.
3D görselleştirme için alternatif bir yöntem immünostainingdir. Doku temizleme tekniği kullanılarak, 3D görüntüleme için çeşitli yöntemler mevcuttur7. İmmünostaining, antikorlar kullanılarak belirli proteinlerin lekelenerek boyanmalarına izin verdiği için avantajlıdır. Yeni bir rapor immünostaininge dayalı tüm vücut görüntülemeye meydan okuyor8; ancak BT tabanlı görüntüleme herhangi bir doku temizleme ön işlem gerektirmez.
Bu yöntem, karın organları da dahil olmak üzere diyaframın altındaki tüm damarların görselleştirilmesini sağlar. Karın organlarında anjiogenez homeostazın korunması ve hastalıkların gelişmesi üzerinde güçlü bir etkiye sahiptir9,10. Bu protokol alt ekstremite damarlarının değerlendirilmesi için optimize edildiği için organa özgü astarlama, iltihaplanma veya tümörler gibi herhangi bir faktörle ilişkili anjiogenezin görselleştirilmesini sağlayacaktır.
Açıklamalar
Yazarların beyan edecekleri bir çıkar çatışması yoktur.
Teşekkürler
Hayvan deneylerindeki mükemmel teknik destek için Yasuyo Kimura, Megumi Nagahiro ve Saeko Tokunaga'ya teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | TERUMO | SS-01T | |
| 10% Formalin Solution | Fujifilm-Wako | 068-03841 | |
| 10x phosphate-buffered saline (-) (PBS) | Fujifilm-Wako | 163-25265 | Prepare 1x PBS |
| 22 G catheter (22 G S5 x 1" V(F)) | MEDIKIT | HP2140 | Only catheter is used. |
| 23 G needle | TERUMO | NN-2325R | Use as a pin |
| 4% paraformaldehyde in PBS | Fujifilm-Wako | 163-20145 | |
| 5 mL syringe | |||
| 5-0 Suture with needle | Alfresa Pharma Corporation | ER1205SB45 | |
| Adenosine | Sigma-aldrich | A9251-5G | For vasodilating solution |
| Dumont #55 Forceps | FST | No.11255-20 | |
| Extension tube | TOP | X2-FL50 | |
| Falcon 50 mL tube | CORNING | 352098 | |
| Graefe Forceps | FST | No.11051-10 | |
| Heparin Sodium 5,000 units/5 mL | Mochida Co. Ltd. | 224122458 | |
| Isoflurane | Fujifilm-Wako | 099-06571 | |
| Microfil Injection Compounds | Flow Tech Inc. | MV-117 | Mix liquid MV-Compound (stain) and MV-Diluent 1: 1 |
| Papaverine hydrochloride | Fujifilm | 164-18002 | For vasodilating solution |
| Small Animal Anesthetizer | Muromachi Kikai Co. Ltd. | MK-A100ecoW-ST | |
| Spring Scissors - Angled to Side | FST | No.15006-09 | |
| Surgical Scissors - Sharp-Blunt | FST | No.14001-12 | |
| three-way cock | TERUMO | TS-TR1K | |
| Transfer pipette | SAMCO SCIENTIFIC | SM262-1S | Use for mixing contrast medium |
| X-ray CT scanner | Toshiba IT & Control Systems Corporation | TOSHIBA TOSCANNER 32300 FPD |
Referanslar
- Folkman, J. Angiogenesis. Annual Review of Medicine. 57, 1-18 (2006).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nature Medicine. 1 (1), 27-31 (1995).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PLoS One. 8 (12), 84047(2013).
- Limbourg, A., et al. Evaluation of postnatal arteriogenesis and angiogenesis in a mouse model of hind-limb ischemia. Nature Protocols. 4 (12), 1737-1746 (2009).
- Weyers, J. J., Carlson, D. D., Murry, C. E., Schwartz, S. M., Mahoney, W. M. Retrograde perfusion and filling of mouse coronary vasculature as preparation for micro computed tomography imaging. Journal of Visualized Experiments: JoVE. (60), e3740(2012).
- Arima, Y., et al. Evaluation of collateral source characteristics with 3-dimensional analysis using micro-X-ray computed tomography. Journal of the American Heart Association. 7 (6), 007800(2018).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Susaki, E. A., et al. Advanced CUBIC protocols for whole-brain and whole-body clearing and imaging. Nature Protocols. 10 (11), 1709-1727 (2015).
- Fernandez, M., et al. Angiogenesis in liver disease. Journal of Hepatology. 50 (3), 604-620 (2009).
- Li, S., et al. Angiogenesis in pancreatic cancer: current research status and clinical implications. Angiogenesis. 22 (1), 15-36 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır