Method Article
Análisis simplificado y de alto rendimiento de la contractilidad de una sola célula utilizando elastómeros con micropatrones
En este artículo
Resumen
Este trabajo presenta un protocolo flexible para utilizar la tecnología de superficies contráctiles elastoméricas marcadas fluorescentemente (FLECS) en formato de micropozos para una cuantificación simplificada y sin intervención de las fuerzas contráctiles de una sola célula basada en desplazamientos visualizados de micropatrones de proteínas fluorescentes.
Resumen
La generación de fuerza contráctil celular es un rasgo fundamental compartido por prácticamente todas las células. Estas fuerzas contráctiles son cruciales para el desarrollo adecuado, funcionan tanto a nivel celular como tisular, y regulan los sistemas mecánicos en el cuerpo. Numerosos procesos biológicos dependen de la fuerza, incluida la motilidad, la adhesión y la división de células individuales, así como la contracción y relajación de órganos como el corazón, la vejiga, los pulmones, los intestinos y el útero. Dada su importancia en el mantenimiento de la función fisiológica adecuada, la contractilidad celular también puede conducir a los procesos de enfermedad cuando se exagera o interrumpe. El asma, la hipertensión, el trabajo de parto prematuro, la cicatrización fibrótica y la vejiga poco activa son ejemplos de procesos de enfermedad impulsados mecánicamente que podrían aliviarse con el control adecuado de la fuerza contráctil celular. Aquí, presentamos un protocolo integral para utilizar una nueva tecnología de ensayo de contractilidad basada en microplacas conocida como superficies con contracción elastoméricas marcadas fluorescentemente (FLECS), que proporciona un análisis simplificado e intuitivo de la contractilidad de una sola célula de manera masiva. Aquí, proporcionamos un protocolo paso a paso para obtener dos curvas dosis-respuesta de seis puntos que describen los efectos de dos inhibidores contráctiles en la contracción de las células primarias del músculo liso de la vejiga humana en un procedimiento simple que utiliza una sola microplaca de ensayo FLECS, para demostrar la técnica adecuada a los usuarios del método. Utilizando la tecnología FLECS, todos los investigadores con laboratorios biológicos básicos y sistemas de microscopía fluorescente obtienen acceso al estudio de este fenotipo celular funcional fundamental pero difícil de cuantificar, reduciendo efectivamente la barrera de entrada en el campo de la biología de la fuerza y la detección fenotípica de la fuerza celular contráctil.
Introducción
Las fuerzas mecánicas generadas por las células son esenciales para el funcionamiento adecuado en varios órganos de todo el cuerpo, como los intestinos, la vejiga, el corazón y otros. Estos órganos deben generar patrones estables de contracción y relajación celular para mantener el estado homeostático interno. La contracción anormal de las células del músculo liso (SMC) puede conducir a la aparición de diversos trastornos, incluyendo, por ejemplo, la dismotilidad intestinal, caracterizada por patrones anormales de contracción del músculo liso intestinal1, así como las condiciones urológicas de vejiga hiperactiva2 o hipoactiva3. Dentro de las vías respiratorias, las SMC que exhiben patrones de contracción irregulares pueden desencadenar hiperreactividad asmática4, lo que podría tensar las vías respiratorias y disminuir el flujo de aire de oxígeno hacia los pulmones. Otra condición física generalizada, la hipertensión, es causada por fluctuaciones en la contracción del músculo liso dentro de los vasos sanguíneos5. Claramente, los mecanismos contráctiles dentro de las células y los tejidos pueden conducir a enfermedades que requieren opciones de tratamiento. Como estas condiciones se derivan inequívocamente de los comportamientos contráctiles disfuncionales de las células, se vuelve lógico y necesario medir la función contráctil celular en sí, al detectar posibles candidatos a fármacos.
Reconociendo la necesidad de herramientas para estudiar la fuerza contráctil celular, investigadores académicos han desarrollado varios métodos cuantitativos de ensayo de contracción, incluyendo microscopía de fuerza de tracción (TFM)6, TFM7 micromodelado, ensayos de gel flotante8 y ensayos de micropost elastoméricos9. Estas tecnologías se han utilizado en formato de plato único, así como en formato de placa de múltiples pozos en numerosos estudios e incluso se han propuesto para mediciones de fuerza tridimensional10,11,12,13,14. Si bien estas tecnologías han permitido una investigación pionera dentro del campo expansivo de la biología de la fuerza celular, todas se han limitado en gran medida a laboratorios que poseen capacidades y recursos específicos, en particular: capacidad para fabricar sustratos de TFM, capacidad para aplicar adecuadamente algoritmos complejos y no intuitivos para resolver mapas de desplazamiento de TFM, y sistemas de microscopía relativamente precisos que pueden registrar imágenes tomadas antes y después de la eliminación de muestras de la etapa (para la disociación celular). Por lo tanto, para un investigador no capacitado, la barrera de entrada para usar estos métodos puede ser bastante alta dado el amplio conjunto de requisitos para aplicar estas tecnologías. Además, la resolución de imágenes requerida para muchas tecnologías existentes (objetivos 40x o más) puede limitar significativamente el rendimiento experimental, mientras que las tecnologías de medición a granel podrían enmascarar las contribuciones de células atípicas y evitar el descubrimiento de diferencias contráctiles más leves. Cabe destacar que, hasta donde los autores saben, solo el enfoque de ensayo de gel flotante semicuantitativo y de bajo rendimiento ha madurado lo suficiente como para estar disponible para los investigadores (ver Figura 1).

Figura 1: Esquema general del método de la tecnología FLECS. (A) Las células se adhieren a micropatrones de proteínas adhesivas que se incrustan covalentemente en una capa elastomérica delgada soportada por vidrio. (B) Vista superior de varias formas posibles de micropatrones y una explosión de una célula que contrae un micropatrón en forma de 'X'. (C) Superposición de micropatrones fluorescentes e imágenes de contraste de fase de una célula en contracción. (D) Imágenes de curso de tiempo de una sola célula contratante. Barras de escala = 25 μm. Esta figura fue adaptada con permiso de Pushkarsky et al15. Haga clic aquí para ver una versión más grande de esta figura.
Siguiendo los recientes avances en microtecnología, los autores desarrollaron una tecnología basada en microplacas que permite mediciones cuantitativas de la contracción de una sola célula en cientos de miles de células llamadas FLECS (superficies contraíbles elastoméricas marcadas fluorescentemente)15,16,17,18,19,20 , como alternativa al TFM. En este enfoque, los micropatrones de proteínas fluorescentes se incrustan en películas blandas que se deforman y se encogen cuando las células les aplican fuerzas de tracción, de una manera intuitiva y medible. Es importante destacar que los micropatrones de proteínas restringen la posición, la forma y el área de propagación de la célula, lo que lleva a condiciones de prueba uniformes. Estos permiten mediciones simples basadas solo en sus cambios dimensionales, que están altamente resueltos espacialmente incluso en imágenes de aumento 4x. El método incluye un módulo de análisis de imágenes basado en navegador y permite un análisis sencillo de la fuerza celular contráctil sin requerir procedimientos de manejo delicados o el registro de marcadores fiduciarios, de modo que cualquier investigador debería ser operable con una instalación básica de cultivo celular y un microscopio fluorescente simple con bajo aumento (Figura 2 ). Esta tecnología, que está lista para el estante y disponible comercialmente, fue diseñada pensando en el usuario final y tiene como objetivo reducir la barrera de entrada para que cualquier científico de laboratorio estudie la biología de la fuerza celular.

Figura 2: Esquema del formato de placa de 24 pocillos para el ensayo de contractilidad de una sola célula. Este formato se utilizó en los experimentos descritos en este documento y se muestra en la parte de video del artículo. Barras de escala = 25 μm. Haga clic aquí para ver una versión más grande de esta figura.
En este trabajo, presentamos un protocolo para aplicar el formato de placa de 24 pocillos de la plataforma de tecnología FLECS para cuantificar los efectos de los fármacos moduladores de fuerza sobre la contractilidad celular en células primarias del músculo liso de la vejiga. Este protocolo de propósito general se puede adaptar y modificar según sea necesario para tener en cuenta otras escalas de tiempo, tipos de células y condiciones de tratamiento de interés, y escalarse para responder a otras preguntas en la biología de la fuerza.
Protocolo
1. Día 1: Preparación de la placa de 24 pocillos
- Comience el procedimiento agregando 20 ml del medio de cultivo celular en un tubo cónico de 50 ml. En este experimento, se utiliza el medio a base de F12 Ham suplementado con suero bovino fetal (FBS) al 10%.
- Obtener una placa de 24 pocillos diseñada para evaluar la contractilidad celular. Ajuste la pipeta a 500 μL y obtenga un colador celular para el paso celular.
NOTA: La placa está disponible de los autores a pedido. - Levante y sostenga la placa en una mano y proceda a pelar suavemente la película de plástico de la parte superior de la placa. Luego, vuelva a colocar cuidadosamente el plato hacia abajo.
- Encienda un aspirador de vacío y aspire la capa superior de solución salina tamponada con fosfato (PBS) de los pozos para evitar derrames. Quite el PBS una fila a la vez. Una vez que los pozos ya no estén completamente llenos, sostenga la placa en una mano y retire cuidadosamente el resto del PBS de los pozos. Llene rápidamente con 500 μL de medio de cultivo celular. Tenga cuidado de evitar el contacto entre el aspirador y el fondo del pozo.
- Agite la placa suavemente y toque en el costado para asegurarse de que todo el fondo del pozo esté cubierto con solución. Una vez que todos los pocillos estén llenos de medio, coloque el plato a un lado.
2. Día 1: Siembra celular
- Recupere el matraz de cultivo con el paso 7 o menos de las células primarias del músculo liso de la vejiga humana (BSM) de la incubadora de 37 °C. Bajo un microscopio, verifique la morfología celular y asegúrese de que las células hayan crecido al menos al 90% de confluencia pero menos del 100% de confluencia.
- Realizar el protocolo de disociación celular. Dentro de un gabinete de bioseguridad estéril, tripsinizar las células durante 2,5 minutos hasta que las células se separen antes de apagarlas con un medio suplementado con suero (10% FBS).
- Una vez que las células se disocian, use un hemocitómetro para contar las células y diluya la suspensión celular a aproximadamente 50,000 células / ml en medio suplementado con suero. Es importante destacar que las células requieren al menos un 2% de suero para adherirse a los micropatrones.
- Antes de la siembra, cuele rápidamente la suspensión celular a través de un colador celular de 40 o 100 μm en un tubo cónico de 50 ml con una pipeta serológica para romper grupos de células en células individuales.
- Agregue cuidadosamente 500 μL de la suspensión de células de 50,000 células / ml en cada uno de los 24 pocillos en la placa usando una pipeta P1000 dispensando la solución gota a gota en diferentes posiciones en los pozos.
- Después de la siembra celular, deje que la placa se asiente a temperatura ambiente durante 1 h para que las células se asienten directamente sobre los micropatrones sin verse influenciadas por las microcorrientes generadas por la evaporación. Después de 1 h, coloque la placa en una incubadora de 37 °C durante la noche. Las células se autoensamblarán y se extenderán sobre los micropatrones adhesivos durante este tiempo y comenzarán a ejercer niveles de contracción basal.
3. Día 2: Adición de la droga de prueba
NOTA: La concentración final de dimetilsulfóxido (DMSO) en los pocillos que contienen células adheridas no puede exceder el 1% y el fármaco / DMSO no se puede agregar directamente a las células, sino que primero debe diluirse y mezclarse en una solución intermedia de medio celular.
- Cree una serie de dilución de fármacos de seis pasos y ocho veces transfiriendo 30 μL del fármaco de stock a volúmenes consecutivos de 210 μL de DMSO y mezclándolos completamente entre cada paso de transferencia. En este trabajo, se prepara una serie de dilución de seis pasos y ocho veces de blebbistatina en dosis que van desde 40 μM a 1 nM, en DMSO.
- Para cada solución farmacológica madre (a partir de la etapa 3.1), mezcle 30 μL de fármaco en 470 μL de medio de cultivo celular. La solución intermedia produce una dilución de DMSO de 16,7 veces.
- Transfiera 200 μL de cada solución intermedia al pozo apropiado en la placa de 24 pocillos (que ya contiene 100 μL de medio en cada pozo). Esto produce una dilución adicional de seis veces de DMSO.
- Los pasos 3.2 y 3.3 producen colectivamente una concentración final del 1% de DMSO en los pozos.
- Coloque la placa tratada en una incubadora de 37 °C durante la duración adecuada. Para este experimento, se utiliza una incubación de 30 minutos.
- Inmediatamente antes de la obtención de imágenes, agregue la solución de tinción nuclear viva Hoechst 33342 a cada pozo (dilución final 1:10,000). Deje que se incube durante 15 minutos adicionales para etiquetar los núcleos celulares.
4. Día 2: Obtención de imágenes de la placa del pozo
- Acceda a un microscopio que esté equipado para obtener imágenes de los canales tanto para los núcleos celulares (DAPI) como para los micropatrones (TRITC).
- Primera imagen de las células con DMSO solamente.
- A continuación, concéntrese e imagine tanto los micropatrones como los núcleos celulares marcados para identificar células individuales y garantizar que ambos canales estén perfectamente alineados para permitir el análisis automatizado de imágenes.
- Repita en múltiples posiciones en cada uno de los 24 pocillos de la placa. Las imágenes se pueden tomar con un objetivo 4x (u opcionalmente más alto para acelerar la obtención de imágenes y adquirir puntos de datos máximos por imagen).
- Exporte las imágenes como archivos TIF y ábralas en una computadora conectada a la web con ImageJ para analizar los datos.
5. Post-experimento: Análisis de imágenes
NOTA: El análisis de imágenes se realizó utilizando Biodock.ai portal y software de imágenes.
- Sube las imágenes adquiridas a un ordenador.
- Asegúrese de que los pares correspondientes de imágenes nucleares y de micromodelo se nombren correctamente.
- Asegúrese de que todos los nombres de imagen de micropatrones tomen la forma "sharedCoreName_pt.tif".
- Asegúrese de que todos los nombres de imagen de los núcleos tomen la forma "sharedCoreName_dapi.tif".
- Convierta imágenes de TIF a PNG usando ImageJ.
- Una vez que se abre ImageJ, cargue en un canal a la vez. Para este experimento, primero cargue imágenes de micropatrones como una pila en ImageJ.
- Usando image > Ajustar > brillo/contraste, ajustar el brillo de la imagen para enfatizar los micropatrones y reducir el fondo a negro. Además de esto, suaviza las imágenes.
- Usando Image > Type > 8 bits, convierta las imágenes a 8 bits.
- A continuación, exporte la imagen al tipo PNG y marque el nivel de división de la casilla como nombre de archivo. Ahora cree una nueva carpeta PNG y guarde los archivos PNG allí con el mismo nombre.
- Repita este proceso para las imágenes de núcleos.
- Cargue pares de imágenes PNG en el software de procesamiento de imágenes para el análisis.
- Cree y valide la cuenta. Los autores tienen una cuenta para permitir el acceso abierto a los usuarios académicos.
- Valide la cuenta poniéndose en contacto con los autores.
- Inicie sesión en el software.
- En la pestaña Datos de la izquierda, haga clic en Cargar lote.
- Importe las imágenes arrastrando y soltando pares de imágenes en la ventana que aparece y asigne un nombre al lote. Haga clic en Aceptar.
- Marque la casilla situada junto al nombre del lote y haga clic en Analizar.
- En la siguiente pantalla, desplácese hacia abajo y marque la casilla junto a Análisis de contractilidad y haga clic en Seleccionar. Más abajo en la página, seleccione 10x como la ampliación que se utilizó para obtener imágenes en un menú desplegable.
- Haga clic en Enviar. Una vez que el análisis de datos lea Completado, haga clic en el nombre del lote. En la siguiente pantalla, haga clic en Descargar datos en el lado derecho de la página.
NOTA: Los archivos descargados contendrán imágenes que se analizaron, resultados resumidos que informan la contracción promedio en cada imagen y un análisis detallado de cada micropatrón que se detectó en cualquier imagen, informando sus tamaños, posiciones, número de celdas adheridas y contracción. - Trazar los valores de contracción frente a las concentraciones de fármacos para generar una curva concentración-respuesta y determinar las potencias relativas de los diferentes tratamientos.
- Haga clic en Enviar. Una vez que el análisis de datos lea Completado, haga clic en el nombre del lote. En la siguiente pantalla, haga clic en Descargar datos en el lado derecho de la página.
Resultados
Las regiones de las imágenes adquiridas de pozos que fueron tratados con DMSO solamente y aquellos que fueron tratados con 40 μM de blebbistatina se muestran lado a lado en la Figura 3. Se puede observar claramente que las células tratadas solo con DMSO exhiben un nivel significativo de contracción basado en las deformaciones muy prominentes de los micropatrones adheridos por las células del músculo liso de la vejiga (BSMC) en ese pozo. Por el contrario, en la imagen del bien tratado con 40 μM de blebbistatina, se observa una relajación celular significativa7 ya que los micropatrones adheridos por los BSMC son casi indistinguibles en tamaño de los micropatrones que no son adheridos por las células, lo que indica una contracción mínima. Estas imágenes demuestran la representación visual intuitiva y clara de la contractilidad unicelular ofrecida por el método de micropatronaje fluorescente. A diferencia de los métodos basados en TFM, donde el movimiento omnidireccional de numerosas partículas fluorescentes distribuidas aleatoriamente debajo de una monocapa de célula densa está destinado a transmitir una fuerza contráctil relativa, aquí, las geometrías contraídas uniformes y marcadas de los micropatrones proporcionan información cualitativa inmediata y fácilmente interpretable sobre la contracción de células individuales. Estos se pueden cuantificar directamente aplicando operaciones de objeto binario estándar en las imágenes.
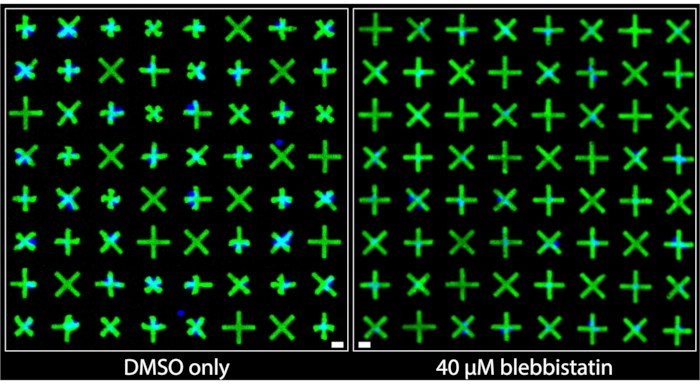
Figura 3: Comparaciones lado a lado de imágenes tomadas de pocillos que contienen solo un 1% de tratamiento con DMSO (izquierda) o que contienen 40 μM de blebbistatina (derecha). Se puede observar claramente que el tratamiento con blebbistatina reduce significativamente la contractilidad de las células individuales, como lo indican los micromodelos más grandes y no contraídos. Los núcleos azules indican qué micropatrones están unidos por las células. Barra de escala = 25 μm. Haga clic aquí para ver una versión más grande de esta figura.
Mediante la aplicación del módulo de análisis basado en navegador para analizar los pares de imágenes adquiridas de micropatrones y núcleos celulares, se obtienen distribuciones de contractilidad unicelular para cada población como se muestra en la Figura 4. Descrito en detalle en un informe previo sobre la metodología FLECS15, el análisis funciona localizando las posiciones y orientaciones de cada micropatron en forma de "X", contando el número de núcleos adheridos directamente sobre el centro de cada micropatron, calculando la longitud media de cada micropatron, y calculando la distancia de píxeles de la contracción de cada micropato con respecto a la longitud media de los micropatrones vacíos (referencia de contracción cero). Por lo tanto, los micropatrones vacíos tienen un propósito importante para normalizar los datos de contracción. Es importante destacar que las células que no se unen a los micropatrones se acumularán en los límites del pozo debido a las microcorrientes donde no afectarán el análisis de imágenes. Como se ve en estas gráficas, la contractilidad imperturbable de la población celular tratada solo con controles DMSO abarca un amplio rango de hasta 20 píxeles, con un centro que se encuentra en alrededor de 10 píxeles. Mientras tanto, las células tratadas con blebbistatina se contraen significativamente menos y su distribución se empuja hacia abajo a un centro de poco más de 6 píxeles. Es importante destacar que cada micropatrones que se encuentra en la imagen que se une exactamente a la célula está representado en estas distribuciones. Esto demuestra la capacidad del método para transmitir respuestas celulares diferenciales a los tratamientos farmacológicos.
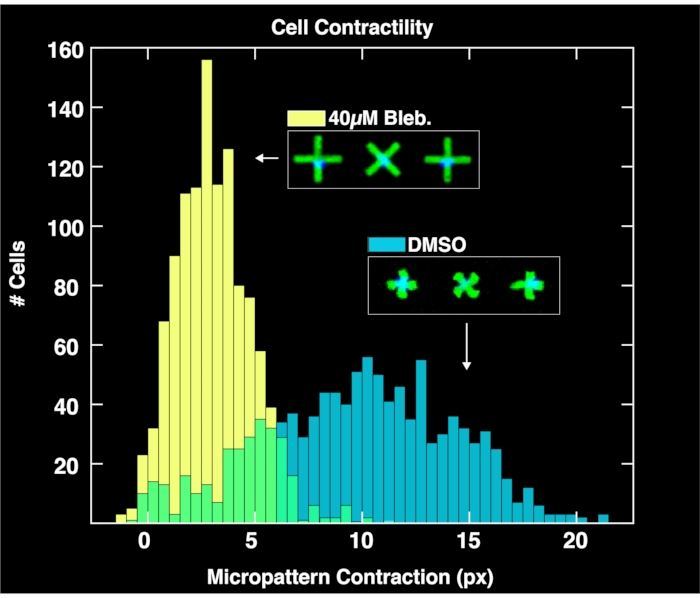
Figura 4: Histogramas que representan datos de contractilidad unicelular obtenidos del análisis de imágenes tomadas de pozos que contienen 1% de DMSO solo (azul) o 40μM de blebbistatina. La distribución de las células tratadas con DMSO es amplia y se centra en un valor de contracción mucho mayor (~ 10 píxeles) que la distribución tratada con blebbistatina, lo que demuestra los efectos cuantitativos del tratamiento de las células con blebbistatina. Haga clic aquí para ver una versión más grande de esta figura.
Al utilizar todos los pozos en una sola placa de 24 pocillos y obtener imágenes de al menos 3 sitios por pozo, se generan simultáneamente curvas dosis-respuesta de seis puntos para dos compuestos farmacológicos. La Figura 5 muestra los datos de concentración-respuesta para los BSMC tratados con el mismo rango de dosis de blebbistatina o citochalasina D (ambos inhibidores conocidos de la contractilidad). Como se desprende de los perfiles de concentración-respuesta, la citocalasina D es el inhibidor más potente de la contracción tónica en estas células. Al ajustar una curva sigmoidal a los puntos de datos, se pueden calcular los valores de IC50 para cada fármaco. Nuestros experimentos indican que los IC50 son de 7,9 μM y 100 nM para blebbistatina y citocalasina D, respectivamente, después de ~ 30 min de exposición a los medicamentos. Es importante destacar que, en general, estos valores son consistentes con informes previos, validando la precisión cuantitativa del método para determinar la potencia de los inhibidores de la contracción7,21.
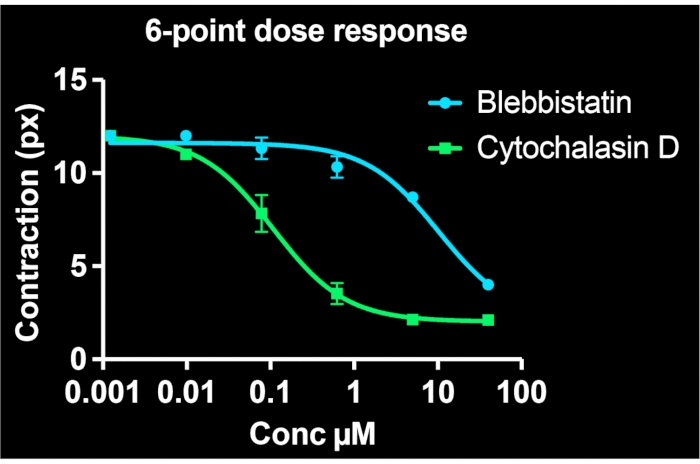
Figura 5: Curvas de concentración-respuesta que representan los efectos de la blebbistatina y la citocalasina D sobre la contractilidad celular en células individuales. Cada punto de datos comprende tres imágenes para esa condición. Una curva sigmoidal se ajustó a cada conjunto de datos. Los resultados indican que la citocalasina D es más potente, teniendo un valor de IC50 más bajo. Estos datos se pueden recopilar a partir de una sola placa FLECS de 24 pocillos. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este método simplificado para medir cuantitativamente la contracción en cientos de miles de células a la vez bajo diferentes condiciones de tratamiento y utilizando solo instrumentos de microscopía estándar proporciona una alternativa accesible al TFM tradicional para que los investigadores estudien la biología de la fuerza celular. Debido a que la tecnología presentada proporciona una visualización de la contracción celular mediante el análisis de los cambios en los micropatrones fluorescentes de forma regular, la magnitud de la contracción producida por cualquier célula dada se entiende intuitivamente: cuanto más pequeño es el micromodelo, mayor es la fuerza contráctil ejercida por la célula.
En particular, al ofrecer control sobre factores como la forma, el área de propagación y la molécula de adhesión que comprende los micropatrones (todos los factores conocidos por regular la contractilidad celular22,23,24), la tecnología presentada elimina sistemáticamente variables adicionales que pueden confundir las interpretaciones de los estudios de contracción celular.
En este experimento, se utilizó una rigidez de 10 kPa en el gel y se utilizó un micropatrón de 70 μm (longitud diagonal) compuesto de colágeno tipo IV. Además de estos parámetros, la molécula adhesiva se puede reemplazar con varios colágenos, fibronectina, gelatina y otra matriz extracelular (ECM). La rigidez del gel se puede ajustar a 0,1 kPa y hasta el rango de MPa. La geometría del micropatrones se puede diseñar de novo para que sea de cualquier forma con un tamaño de función mínimo de ~ 5 μm. Estos parámetros están desacoplados y pueden optimizarse de forma independiente para un contexto biológico particular.
Esta tecnología ha sido ampliamente validada para ser compatible con tipos de células altamente adhesivas y contráctiles de un fenotipo mesenquimal que incluye varios tipos de células del músculo liso (vejiga humana primaria, intestinal, traqueal, bronquial, uterina, aórtica y arterial), células madre mesenquimales y su progenie diferenciada, varios fibroblastos (pulmonares, dérmicos y cardíacos), miofibroblastos y células endoteliales. Además, los macrófagos derivados de monocitos también producirán una gran fuerza fagocítica medible en los micropatrones, particularmente si el micropatrón consiste en una opsonina conocida. También se pueden analizar varias líneas de cáncer utilizando el método.
El método puede plantear algunos desafíos para el uso con células que son relativamente pequeñas, como las células T y los neutrófilos, o tipos de células con un fenotipo predominantemente epitelial. La razón principal de esto es que el método se basa en una fuerte adhesión y una propagación completa de las células sobre el micropatrón para generar la señal contráctil medible. Las células que se unen débilmente, se unen entre sí o no se propagan por completo no producirán señales contráctiles medibles. Estos comportamientos, que son relativamente raros, se pueden mitigar ajustando el tamaño del micropatrones para que sea más pequeño, o mediante el uso de moléculas adhesivas alternativas dentro de los micropatrones que promoverán mejor la adhesión y la propagación en esas células.
Los usuarios de la tecnología deben evaluar cuidadosamente diferentes formulaciones de medios de cultivo celular posibles para su tipo particular de interés celular, ya que los diferentes componentes, factores de crecimiento, niveles séricos y sensibilidades al pH pueden impulsar comportamientos variables en diferentes células. La optimización del protocolo debe preceder al escalado de cualquier flujo de trabajo experimental, y los componentes de los medios siempre deben ser frescos, estériles y consistentes con lotes anteriores.
En última instancia, si la resolución de una sola célula no es necesaria para los objetivos de un usuario, o si el tipo de célula objetivo tiene una capacidad de propagación mínima, entonces el TFM tradicional puede ser igual o más adecuado para tales experimentos. El objetivo y la esperanza de los autores es que esta herramienta proporcione una vía adicional para que los biólogos celulares estudien la contracción celular, particularmente en el contexto de las pruebas de detección automatizadas de fármacos fenotípicos de alto rendimiento.
Específico para usos futuros en pantallas de drogas, se pueden usar placas de mayor rendimiento, como una placa FLECS de 384 pocillos. En tales placas, los objetivos 4x en muchos microscopios pueden capturar un solo pozo completo en su campo de visión, asegurando que se capturen todas las respuestas contráctiles celulares. Mediante el uso de un sistema de imágenes de alto rendimiento, se puede obtener una imagen de una placa completa de 384 pocillos en aproximadamente 5 minutos, lo que hace que este sistema sea dramáticamente más rápido que otras opciones y, por lo tanto, adecuado para el descubrimiento de fármacos fenotípicos de alto rendimiento. De hecho, los autores realizan rutinariamente pruebas semanales de detección de drogas en ~ 50 placas de 384 pocillos (que totalizan más de 19,000 pozos) utilizando la automatización.
Divulgaciones
I.P. es un inventor de una familia de patentes emitida que protege los métodos y sistemas de la tecnología FLECS. I.P., Y.W., J.Z., E.C. y R.H. son empleados de Forcyte Biotechnologies, Inc. R.D. es profesor de UCLA y cofundador de Forcyte Biotechnologies, Inc. I.P., Y.W., J.Z. y R.D. tienen intereses financieros en Forcyte Biotechnologies, Inc., que es el licenciatario exclusivo de las patentes anteriores y está comercializando FLECS Technology.
Agradecimientos
El trabajo de laboratorio se llevó a cabo con el apoyo del UCLA Molecular Shared Screening Resource (MSSR), donde Forcyte patrocina actividades de investigación, y la Incubadora Magnify en el California NanoSystems Institute (CNSI), donde Forcyte Biotechnologies, Inc. es una empresa residente. Los autores otorgarán acceso al módulo de análisis flecs Biodock.ai a todos los investigadores académicos que lo soliciten. L.H. e I.P. contribuyeron igualmente a este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| Bladder smooth muscle cell culture | Sciencell | #4310 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Cell culture media | Thermofisher | 11765054 | Ham's F12 medium supplemented with 10% FBS and 1% p/s |
| Cell strainer | Fisher Scientific | 7201432 | |
| Conical Tube | Fisher Scientific | 05-539-13 | |
| Culture flask | Fisher Scientific | FB012941 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| DMSO (Dimethyl sulfoxide) | Fisher Scientific | D1284 | |
| Eppendorf tubes | Fisher Scientific | 05-402-31 | |
| Fluorescent microscope | Molecular Devices | ImageXpress Confocal | |
| Forcyte-manufactured 24-well plate | Forcyte Biotechnologies | 24-HC4R-X1-QB12 | |
| Hoescht 3342 Live Nuclear Stain | Thermofisher | 62249 | |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP39920 |
Referencias
- Ohama, T., Hori, M., Ozaki, H. Mechanism of abnormal intestinal motility in inflammatory bowel disease: How smooth muscle contraction is reduced. Journal of Smooth Muscle Research. 43 (2), 43-54 (2007).
- Peyronnet, B., et al. A comprehensive review of overactive bladder pathophysiology: On the way to tailored treatment. European Urology. 75 (6), 988-1000 (2019).
- Aldamanhori, R., Osman, N. I., Chapple, C. R. Underactive bladder: Pathophysiology and clinical significance. Asian Journal of Urology. 5 (1), 17-21 (2018).
- Sanderson, M. J., Delmotte, P., Bai, Y., Perez-Zogbhi, J. F. Regulation of airway smooth muscle cell contractility by Ca2+ signaling and sensitivity. Proceedings of the American Thoracic Society. 5 (1), 23-31 (2008).
- Brozovich, F. V., et al. Mechanisms of vascular smooth muscle contraction and the basis for pharmacologic treatment of smooth muscle disorders. Pharmacological Reviews. 68 (2), 476-532 (2016).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophysical Journal. 80 (4), 1744-1757 (2001).
- Tseng, Q., et al. A new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab on a Chip. 11 (13), 2231-2240 (2011).
- Bell, E., Ivarsson, B., Merrill, C. Production of a tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potential in vitro. Proceedings of the National Academy of Sciences. 76 (3), 1274-1278 (1979).
- Tan, J. L., et al. Cells lying on a bed of microneedles: an approach to isolate mechanical force. Proceedings of the National Academy of Sciences. 100 (4), 1484-1489 (2003).
- Rokhzan, R., et al. high-throughput measurements of cell contraction and endothelial barrier function. Laboratory Investigation. 99 (1), 138-145 (2019).
- Park, C. Y., et al. High-throughput screening for modulators of cellular contractile force. Integrative Biology. 7 (10), 1318-1324 (2015).
- Kaylan, K. B., Kourouklis, A. P., Underhill, G. H. A high-throughput cell microarray platform for correlative analysis of cell differentiation and traction forces. Journal of Visualized Experiments. (121), e55362(2017).
- Huang, Y., et al. Traction force microscopy with optimized regularization and automated Bayesian parameter selection for comparing cells. Scientific Reports. 9, 539(2019).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLOS ONE. 6, 17833(2011).
- Pushkarsky, I., et al. Elastomeric sensor surfaces for high-throughput single-cell force cytometry. Nature Biomedical Engineering. 2 (2), 124-137 (2018).
- Pushkarsky, I. FLECS technology for high-throughput single-cell force biology and screening. ASSAY and Drug Development Technologies. 16 (1), 7-11 (2017).
- Koziol-White, C. J., et al. Inhibition of PI3K promotes dilation of human small airways in a rho kinase-dependent manner. British Journal of Pharmacology. 173 (18), 2726-2738 (2016).
- Orfanos, S., et al. Obesity increases airway smooth muscle responses to contractile agonists. American Journal of Physiology-Lung Cellular and Molecular Physiology. 315 (5), 673-681 (2018).
- Tseng, P., Pushkarsky, I., Carlo, D. D. Metallization and biopatterning on ultra-flexible substrates via dextran sacrificial layers. PLOS ONE. 9, 106091(2014).
- Yoo, E. J., et al. Gα12 facilitates shortening in human airway smooth muscle by modulating phosphoinositide 3-kinase-mediated activation in a RhoA-dependent manner. British Journal of Pharmacology. 174 (4), 4383-4395 (2017).
- MacGlashan, D., Vilariño, N. Polymerization of actin does not regulate desensitization in human basophils. Journal of Leukocyte Biology. 85 (4), 627-637 (2009).
- Hocking, D. C., Sottile, J., Langenbach, K. J. Stimulation of integrin-mediated cell contractility by fibronectin polymerization. Journal of Biological Chemistry. 275 (14), 10673-10682 (2000).
- Tolić-Nørrelykke, I. M., Wang, N. Traction in smooth muscle cells varies with cell spreading. Journal of Biomechanics. 38 (7), 1405-1412 (2005).
- Ye, G. J. C., et al. The contractile strength of vascular smooth muscle myocytes is shape dependent. Integrative Biology. 6 (2), 152-163 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados