Method Article
Análise simplificada e de alto rendimento da contractilidade unicelular usando Elastômeros Micropatterned
Neste Artigo
Resumo
Este trabalho apresenta um protocolo flexível para utilizar a tecnologia de superfícies contraíveis elastoméricas rotuladas fluorescentes (FLECS) em formato de microwell para quantificação simplificada e prática de forças contraídas unicelulares com base em deslocamentos visualizados de micropatterns de proteína fluorescente.
Resumo
A geração de força contratil celular é um traço fundamental compartilhado por praticamente todas as células. Essas forças contratuais são cruciais para o desenvolvimento adequado, funcionam nos níveis celular e tecidual, e regulam os sistemas mecânicos no corpo. Numerosos processos biológicos são dependentes da força, incluindo motilidade, adesão e divisão de células únicas, bem como contração e relaxamento de órgãos como coração, bexiga, pulmões, intestinos e útero. Dada a sua importância na manutenção da função fisiológica adequada, a contratude celular também pode impulsionar processos de doença quando exagerada ou interrompida. Asma, hipertensão, parto prematuro, cicatrizes fibrosas e bexiga subativa são todos exemplos de processos de doenças mecanicamente impulsionados que poderiam ser potencialmente aliviadas com o controle adequado da força contratil celular. Aqui, apresentamos um protocolo abrangente para a utilização de uma nova tecnologia de ensaio de contractilidade baseada em microplaca conhecida como superfícies contragívels elastoméricas fluorescentes (FLECS), que fornece análise simplificada e intuitiva da contratilidade unicelular de forma massivamente dimensionada. Aqui, fornecemos um protocolo passo-sábio para a obtenção de duas curvas de dose-resposta de seis pontos descrevendo os efeitos de dois inibidores contratuais na contração de células musculares lisas da bexiga humana primária em um procedimento simples utilizando apenas uma única microplaca de ensaio FLECS, para demonstrar técnica adequada aos usuários do método. Usando a Tecnologia FLECS, todos os pesquisadores com laboratórios biológicos básicos e sistemas de microscopia fluorescente ganham acesso ao estudo desse fenótipo celular funcional fundamental, mas difícil de quantificar, reduzindo efetivamente a barreira de entrada no campo da biologia da força e a triagem fenotípica da força celular contraílica.
Introdução
Forças mecânicas geradas por células são essenciais para o bom funcionamento em vários órgãos em todo o corpo, como intestinos, bexiga, coração e outros. Esses órgãos devem gerar padrões estáveis de contração celular e relaxamento para manter o estado homeostático interno. A contração anormal de células musculares lisas (SMC) pode levar ao aparecimento de vários distúrbios, incluindo, por exemplo, a dismotilidade intestinal, caracterizada por padrões anormais de contração muscular lisa intestinal1, bem como as condições urológicas de bexiga hiperativa2 ou subativa3. Dentro das vias aéreas, os SMCs que apresentam padrões irregulares de contração podem desencadear hiperresponsividade asmática4, potencialmente apertando as vias aéreas e diminuindo o fluxo de ar de oxigênio para os pulmões. Outra condição física generalizada, a hipertensão, é causada por flutuações na contração muscular lisa dentro dos vasos sanguíneos5. Claramente, mecanismos contratuais dentro de células e tecidos podem levar a doenças que requerem opções de tratamento. Como essas condições inequivocamente decorrem dos comportamentos contratuais disfuncionais das células, torna-se lógico e necessário medir a própria função contratil celular, ao selecionar potenciais candidatos a medicamentos.
Reconhecendo a necessidade de ferramentas para estudar a força contratil celular, vários métodos de ensaio de contração quantitativa foram desenvolvidos por pesquisadores acadêmicos, incluindo microscopia de força de tração (TFM)6, TFM7 micropagado, ensaios de gel flutuante8 e ensaios de microposto elastomérico9. Essas tecnologias têm sido utilizadas em formato de prato único, bem como em formato multi-bem-prato em inúmeros estudos e até foram propostas para medições de força tridimensional10,11,12,13,14. Embora essas tecnologias tenham habilitado pesquisas pioneiras no campo expansivo da biologia da força celular, todas elas foram em grande parte limitadas a laboratórios que possuem capacidades e recursos específicos, em particular: capacidade de fabricar substratos TFM, capacidade de aplicar adequadamente algoritmos complexos e não intuitivos para resolver mapas de deslocamento TFM e sistemas de microscopia relativamente precisos que podem registrar imagens tiradas antes e depois da remoção da amostra do estágio (para dissociação celular). Assim, para um pesquisador destreinado, a barreira de entrada para o uso desses métodos pode ser bastante alta, dado o extenso conjunto de requisitos para aplicar essas tecnologias. Além disso, a resolução de imagens necessária para muitas tecnologias existentes (objetivos de 40x ou maior) pode limitar significativamente o throughput experimental, enquanto as tecnologias de medição em massa poderiam mascarar contribuições de células outlier e impedir a descoberta de diferenças contratuais mais brandas. Note-se que, até onde os autores sabem, apenas a abordagem de ensaio de gel flutuante de baixo rendimento e semi-quantitativo amadureceu o suficiente para se tornar disponível aos pesquisadores (ver Figura 1).

Figura 1: Esquema global do método de tecnologia FLECS. (A) As células são aderidas a micropatters de proteína adesiva que são incorporadas covalentemente em uma fina camada elastomérica suportada por vidro. (B) Visão superior de várias formas possíveis de micropattern e uma explosão de uma célula contraindo uma micropattern em forma de 'X'. (C) Sobreposição de micropatters fluorescentes e imagens de contraste de fase de uma célula contratante. (D) Imagens de curso de tempo de uma única célula de contração. Barras de escala = 25 μm. Este número foi adaptado com permissão de Pushkarsky et al15. Clique aqui para ver uma versão maior desta figura.
Após os recentes avanços na microtecnologia, os autores desenvolveram uma tecnologia baseada em microplaca que permite medições quantitativas de contração unicelular em centenas de milhares de células chamadas FLECS (superfícies contraíveis elastoméricas fluorescentes)15,16,17,18,19,20 , como alternativa à TFM. Nesta abordagem, micropatterns de proteína fluorescente são incorporados em filmes macios que se deformam e encolhem quando as células aplicam forças de tração a eles, de forma intuitiva e mensurável. É importante ressaltar que os micropatterns proteicos restringem a posição celular, forma e área de propagação, levando a condições uniformes de teste. Estes permitem medidas simples baseadas apenas em suas mudanças dimensionais, que são altamente resolvidas espacialmente mesmo em imagens de ampliação 4x. O método inclui um módulo de análise de imagem baseado em navegador e permite a análise direta da força celular contratil sem exigir procedimentos delicados de manuseio ou registro de marcadores fiduciários, de modo que ele deve ser operável por qualquer pesquisador com uma instalação básica de cultura celular e microscópio fluorescente simples com baixa ampliação (Figura 2 ). Esta tecnologia, que está pronta para prateleiras e comercialmente disponível, foi projetada com o usuário final em mente e tem como objetivo reduzir a barreira de entrada para qualquer cientista de laboratório estudar biologia da força celular.

Figura 2: Esquema do formato de placa de 24 poços para o ensaio de contração unicelular. Este formato foi usado nos experimentos aqui descritos e retratados na parte de vídeo do artigo. Barras de escala = 25 μm. Clique aqui para ver uma versão maior desta figura.
Neste trabalho, apresentamos um protocolo para a aplicação do formato de placa de 24 poços da plataforma de tecnologia FLECS para quantificar os efeitos de drogas moduladoras à força na contratude celular em células musculares lisas da bexiga primária. Este protocolo de uso geral pode ser adaptado e modificado conforme necessário para explicar várias outras escalas de tempo, tipos de células e condições de tratamento de interesse, e dimensionado para responder a outras questões em biologia em vigor.
Protocolo
1. Dia 1: Preparação da placa de 24 poços
- Inicie o procedimento adicionando 20 mL do meio de cultura celular em um tubo cônico de 50 mL. Neste experimento, o meio baseado em F12 Ham é complementado com 10% de soro bovino fetal (FBS).
- Obtenha uma placa de 24 poços projetada para avaliar a contratude celular. Coloque a pipeta em 500 μL e obtenha um coador celular para a passagem celular.
NOTA: A placa está disponível nos autores mediante solicitação. - Levante e segure a placa em uma mão e continue a descascar suavemente o filme plástico do topo da placa. Em seguida, cuidadosamente coloque a placa de volta para baixo.
- Ligue um aspirador de vácuo e aspire a camada superior de soro fisiológico tamponado de fosfato (PBS) dos poços para evitar derramamento. Remova a linha PBS uma de cada vez. Uma vez que os poços não estejam mais completamente cheios, segure a placa em uma mão e remova cuidadosamente o resto do PBS dos poços. Preencha rapidamente com 500 μL de meio de cultura celular. Tome cuidado para evitar contato entre o aspirador e a parte inferior do poço.
- Agite a placa suavemente e toque na lateral para garantir que toda a parte inferior do poço esteja coberta com solução. Uma vez que todos os poços estejam cheios de médio, coloque a placa para o lado.
2. Dia 1: Semeadura celular
- Recupere o frasco de cultura com a passagem 7 ou inferior das células do músculo liso da bexiga humana primária (BSM) da incubadora de 37 °C. Sob um microscópio, verifique a morfologia celular e garanta que as células tenham crescido para pelo menos 90% de confluência, mas menos de 100% de confluência.
- Conduza o protocolo de dissociação celular. Dentro de um gabinete de biossegurança estéril, tentepsinizar as células por 2,5 minutos até que as células sejam separadas antes de saciá-las com meio suplementado por soro (10% FBS).
- Uma vez que as células sejam dissociadas, use um hemótmetro para contar as células e diluir a suspensão celular para aproximadamente 50.000 células/mL em meio suplementado por soro. É importante ressaltar que as células requerem pelo menos 2% de soro para se conectar aos micropatterns.
- Antes da semeadura, escote rapidamente a suspensão celular através de um coador de células de 40 ou 100 μm em um tubo cônico de 50 mL com uma pipeta sorológica para quebrar aglomerados de células em células únicas.
- Adicione cuidadosamente 500 μL da suspensão celular de 50.000 células/mL em cada um dos 24 poços da placa usando uma pipeta P1000, distribuindo a solução em diferentes posições nos poços.
- Após a semeadura celular, deixe a placa sentar-se à temperatura ambiente por 1h para deixar as células se acomodarem diretamente nos micropatterns sem serem influenciadas por microcorrentes geradas pela evaporação. Depois de 1h, coloque a placa em uma incubadora de 37 °C durante a noite. As células se auto-montarão e se espalharão sobre os micropatterns adesivos durante este tempo e começarão a exercer níveis de contração basal.
3. Dia 2: Adição de droga de teste
NOTA: A concentração final de sulfóxido de dimetila (DMSO) nos poços que contêm células aderidas não pode exceder 1% e a droga/DMSO não pode ser adicionada diretamente às células, mas deve primeiro ser diluída e misturada em uma solução intermediária de meio celular.
- Crie uma série de diluição de seis etapas e oito vezes, transferindo 30 μL da droga de estoque para volumes consecutivos de 210 μL de DMSO e misturando completamente entre cada etapa de transferência. Neste trabalho, uma série de diluição de seis etapas e oito vezes de blebbistatina é preparada em doses que variam de 40 μM a 1 nM, em DMSO.
- Para cada solução de droga de estoque (a partir do passo 3.1), misture 30 μL de droga em 470 μL de meio de cultura celular. A solução intermediária produz uma diluição de 16,7 vezes do DMSO.
- Transfira 200 μL de cada solução intermediária para o poço apropriado na placa de 24 poços (que já contém 100 μL de médio em cada poço). Isso produz uma diluição adicional de seis vezes do DMSO.
- As etapas 3.2 e 3.3 coletivamente produzem uma concentração final de 1% de DMSO nos poços.
- Coloque a placa tratada em uma incubadora de 37 °C durante a duração apropriada. Para este experimento, é utilizada uma incubação de 30 minutos.
- Imediatamente antes da imagem, adicione hoechst 33342 solução de mancha nuclear viva para cada poço (diluição final de 1:10.000). Deixe-o incubar por mais 15 minutos para rotular os núcleos celulares.
4. Dia 2: Imagem do bem-prato
- Acesse um microscópio equipado para visualizar os canais tanto para os núcleos celulares (DAPI) quanto para os micropatterns (TRITC).
- Primeira imagem as células apenas com DMSO.
- Em seguida, concentre-se e imagem tanto os micropatterns quanto os núcleos celulares rotulados, a fim de identificar células únicas e garantir que ambos os canais estejam perfeitamente alinhados para permitir a análise automatizada de imagens.
- Repita em várias posições em cada um dos 24 poços da placa. As imagens podem ser tiradas com 4x objetivo (ou opcionalmente maior para agilizar a imagem e adquirir pontos de dados máximos por imagem).
- Exporte as imagens como arquivos TIF e abra-as em um computador conectado à Web com imageJ para analisar os dados.
5. Pós-experimento: Análise de imagem
NOTA: A análise da imagem foi realizada por meio de Biodock.ai portal e software de imagem.
- Carregue as imagens adquiridas para um computador.
- Certifique-se de que os pares correspondentes de micropattern e imagens nucleares sejam nomeados corretamente.
- Certifique-se de que os nomes de imagens de micropattern tomem o formulário "SharedCoreName_pt.tif".
- Certifique-se de que os nomes de imagens dos núcleos tomem a forma "SharedCoreName_dapi.tif".
- Converta imagens do TIF para png usando ImageJ.
- Uma vez que o ImageJ é aberto, carregue em um canal de cada vez. Para este experimento, primeiro carregue imagens de micropattern como uma pilha no ImageJ.
- Usando > de imagem Ajuste > brilho/contraste, ajuste o brilho da imagem para enfatizar os micropatterns e reduza o fundo para preto. Além disso, amenize as imagens.
- Usando > de imagem Tipo > de 8 bits, converta as imagens em 8 bits.
- Em seguida, exporte a imagem para o tipo PNG e marque o nível de fatia da caixa como nome do arquivo. Agora crie uma nova pasta PNGs e salve os arquivos PNG lá com o mesmo nome.
- Repita este processo para imagens de núcleos.
- Carregue pares de imagens PNG no software de processamento de imagens para a análise.
- Crie e valide a conta. Os autores têm uma conta para permitir o acesso aberto aos usuários acadêmicos.
- Valide a conta entrando em contato com os autores.
- Faça login no software.
- Na guia Dados à esquerda, clique em Carregar lote.
- Importe as imagens arrastando e soltando pares de imagens na janela que aparece e nomeie o lote. Clique ok.
- Verifique a caixa ao lado do nome do lote e clique em Analisar.
- Na próxima tela, role para baixo e marque a caixa ao lado da Análise de Contractilidade e clique em Selecionar. Abaixe a página, selecione 10x como a ampliação usada para imagens de um menu suspenso.
- Clique em Enviar. Uma vez que a análise de dados seja concluída, clique no nome do lote. Na próxima tela, clique em Baixar Dados no lado direito da página.
NOTA: Os arquivos baixados conterão imagens que foram analisadas, resultados sumários relatando contração média em cada imagem e uma análise detalhada de cada micropattern que foi detectado em qualquer imagem, relatando seus tamanhos, posições, número de células aderidas e contração. - Valores de contração de enredo contra concentrações de drogas para gerar uma curva de concentração-resposta e determinar as potências relativas de diferentes tratamentos.
- Clique em Enviar. Uma vez que a análise de dados seja concluída, clique no nome do lote. Na próxima tela, clique em Baixar Dados no lado direito da página.
Resultados
As regiões das imagens adquiridas a partir de poços que foram tratados apenas com DMSO e aquelas que foram tratadas com blebbistatina de 40 μM são mostradas lado a lado na Figura 3. Pode-se observar claramente que as células tratadas somente com DMSO apresentam um nível significativo de contração com base nas deformações muito proeminentes dos micropatterns aderidos pelas células musculares lisas da bexiga (BSMCs) nesse poço. Por outro lado, na imagem do bem tratado com blebbistatina de 40 μM, observa-se um relaxamento celular significativo7 , pois os micropatterns aderidos pelos BSMCs são quase indistinguíveis em tamanho dos micropatterns que não são aderidos pelas células, indicando contração mínima. Essas imagens demonstram a representação visual intuitiva e clara da contratude unicelular oferecida pelo método de micropatterning fluorescente. Ao contrário dos métodos baseados em TFM, onde o movimento omnidirecional de numerosas partículas fluorescentes distribuídas aleatoriamente sob uma densa monocamada celular destina-se a transmitir força contraítária relativa, aqui, as geometrias uniformes e marcadas contraídas dos micropatterns fornecem informações qualitativas imediatas e facilmente interpretativas sobre contração de células individuais. Estes podem ser diretamente quantificados aplicando operações padrão de objetos binários nas imagens.
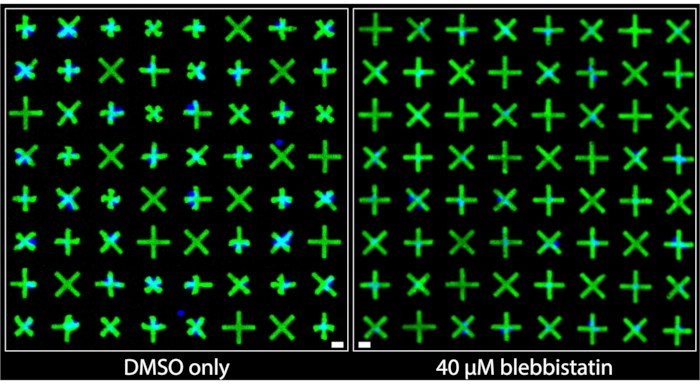
Figura 3: Comparações lado a lado de imagens tiradas de poços contendo apenas 1% de tratamento DMSO (esquerda) ou contendo 40 μM de blebbistatina (direita). Pode-se observar claramente que o tratamento com blebbistatina reduz significativamente a contratibilidade das células únicas, conforme indicado pelos micropatters maiores e não contraídos. Núcleos azuis indicam quais micropatterns estão ligados por células. Barra de escala = 25 μm. Clique aqui para ver uma versão maior desta figura.
Ao aplicar o módulo de análise baseado no navegador para analisar os pares de imagens adquiridos de micropatterns e núcleos celulares, as distribuições de contradição unicelulares são obtidas para cada população, conforme mostrado na Figura 4. Descrita detalhadamente em um relatório prévio sobre a metodologia FLECS15, a análise funciona localizando as posições e orientações de cada micropattern em forma de "X", contando o número de núcleos aderidos diretamente sobre o centro de cada micropattern, calculando o comprimento médio de cada micropattern, e calculando a distância pixel da contração de cada micropattern em relação ao comprimento médio de micropatterns vazios (referência de contração zero). Portanto, os micropatters vazios servem a um importante propósito para normalizar os dados de contração. É importante ressaltar que as células que não se ligam aos micropatterns se acumularão nos limites do poço devido às microcorrentes onde não afetarão a análise da imagem. Como visto nessas parcelas, a contratude não perturbada da população celular tratada apenas com controles DMSO abrange uma grande faixa de até 20 pixels, com um centro encontrado em cerca de 10 pixels. Enquanto isso, as células tratadas com blebbistatina contraem significativamente menos e sua distribuição é empurrada para um centro de pouco mais de 6 pixels. É importante ressaltar que cada micropattern encontrado na imagem que se liga exatamente à célula está representado nessas distribuições. Isso demonstra a capacidade do método de transmitir respostas celulares diferenciadas aos tratamentos medicamentosos.
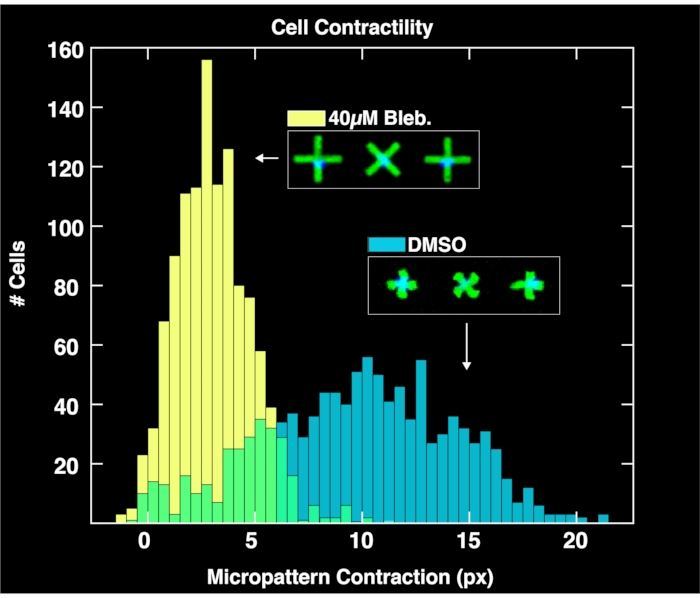
Figura 4: Histogramas que retratam dados de contratilidade unicelular obtidos a partir da análise de imagens tiradas de poços contendo 1% de blebbistatin DMSO (azul) ou 40μM blebbistatin. A distribuição de células tratadas com DMSO é ampla e centrada em um valor de contração muito maior (~10 pixels) do que a distribuição tratada blebbistatina, demonstrando os efeitos quantitativos do tratamento de células com blebbistatina. Clique aqui para ver uma versão maior desta figura.
Utilizando todos os poços em uma única placa de 24 poços e imagens de pelo menos 3 locais por poço, curvas de dose-resposta de seis pontos são geradas simultaneamente para dois compostos medicamentosos. A Figura 5 mostra os dados de concentração-resposta para BSMCs tratados com a mesma gama de doses de blebbistatina ou citochalasina D (ambos inibidores conhecidos de contrailidade). Como evidente nos perfis de concentração-resposta, a citochalasina D é o inibidor mais potente da contração tônica nessas células. Ao encaixar uma curva sigmoidal nos pontos de dados, os valores de IC50 podem ser calculados para cada droga. Nossos experimentos indicam que o IC50 são de 7,9 μM e 100 nM para blebbistatina e citochalasina D, respectivamente, seguindo ~30 minutos de exposição às drogas. É importante ressaltar que, no geral, esses valores são consistentes com relatórios prévios, validando a precisão quantitativa do método para determinar a potência dos inibidores de contração7,21.
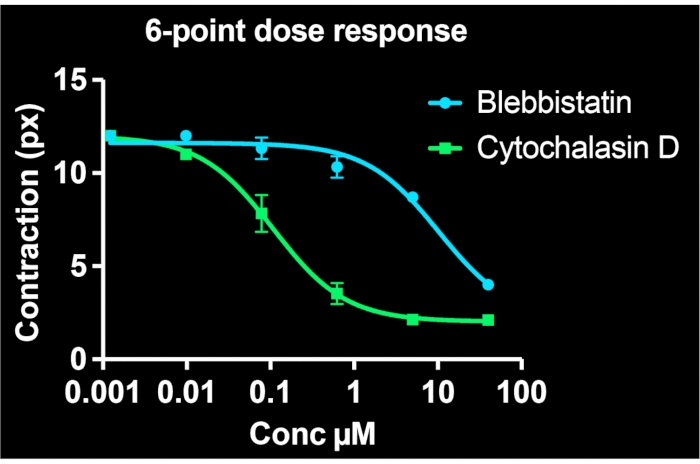
Figura 5: Curvas de concentração-resposta que retratam os efeitos da blebbistatina e citochalasina D na contratude celular em células únicas. Cada ponto de dados compreende três imagens para essa condição. Uma curva sigmoidal era adequada a cada conjunto de dados. Os resultados indicam que a citochalasina D é mais potente, tendo um valor ic50 mais baixo. Esses dados são colecionáveis de uma única placa FLECS de 24 poços. Clique aqui para ver uma versão maior desta figura.
Discussão
Este método simplificado para medir quantitativamente a contração em centenas de milhares de células de cada vez em diferentes condições de tratamento e usando apenas instrumentos de microscopia padrão fornece uma alternativa acessível ao TFM tradicional para os pesquisadores estudarem a biologia da força celular. Como a tecnologia apresentada fornece uma exibição visual da contração celular analisando mudanças em micropatters fluorescentes regularmente moldados, a magnitude da contração produzida por qualquer célula é intuitivamente compreendida - quanto menor a micropatteria, maior a força contratil exercida pela célula.
Notavelmente, ao oferecer controle sobre fatores como forma, área de disseminação e molécula de adesão que compreende os micropatterns (todos os fatores conhecidos por regular a contração celular22,23,24), a tecnologia apresentada elimina sistematicamente variáveis adicionais que podem confundir interpretações de estudos de contração celular.
Neste experimento, foi utilizada rigidez de 10 kPa no gel e um micropattern de 70 μm (comprimento diagonal) composto por colágeno tipo IV. Além desses parâmetros, a molécula adesiva pode ser substituída por várias collagens, fibronectina, gelatina e outras matrizes extracelulares (ECM). A rigidez do gel pode ser ajustada até 0,1 kPa, e até a faixa MPa. A geometria de micropattern pode ser projetada de novo para ser qualquer forma com tamanho mínimo de característica de ~5 μm. Esses parâmetros são dissociados e podem ser otimizados independentemente para um contexto biológico específico.
Esta tecnologia foi extensivamente validada para ser compatível com tipos de células altamente adesivas e contratuais de um fenótipo mesenquimal, incluindo vários tipos de células musculares lisas (bexiga humana primária, células-tronco intestinais, traqueais, brônquias, uterinas, aórticas e arterias), células-tronco mesenquimais e suas prole diferenciadas, vários fibroblastos (pulmonares, dérmicos e cardíacos), miofibroblasts e células endoteliais. Além disso, macrófagos derivados de monócitos também produzirão grande força fagocítica mensurável nos micropatterns, particularmente se o micropattern consiste em uma opsonina conhecida. Várias linhas de câncer também podem ser avaliadas usando o método.
O método pode representar alguns desafios para o uso com células relativamente pequenas, como células T e neutrófilos, ou tipos de células com um fenótipo predominantemente epitelial. A principal razão para isso é que o método conta com forte adesão e completa disseminação de células sobre o micropattern, a fim de gerar o sinal contratil mensurável. Células que se ligam fracamente, se ligam umas às outras ou não se espalham completamente não produzirão sinais contratuais mensuráveis. Esses comportamentos, relativamente raros, podem ser mitigados ajustando o tamanho da micropattern para ser menor, ou usando moléculas adesivas alternativas dentro dos micropatterns que promoverão melhor a adesão e a disseminação nessas células.
Os usuários da tecnologia devem avaliar cuidadosamente diferentes formulações médias de cultura celular possíveis para seu tipo de interesse celular particular, já que diferentes componentes, fatores de crescimento, níveis de soro e sensibilidades ao pH podem conduzir comportamentos variáveis em diferentes células. A otimização do protocolo deve preceder o dimensionamento de quaisquer fluxos de trabalho experimentais, e os componentes de mídia devem ser sempre frescos, estéreis e consistentes com lotes anteriores.
Em última análise, se a resolução unicelular não for necessária para os objetivos de um usuário ou se o tipo de célula alvo tiver capacidade mínima de difusão, então o TFM tradicional pode ser igual ou mais adequado para tais experimentos. O objetivo e a esperança dos autores é que esta ferramenta forneça um caminho adicional para os biólogos celulares estudarem a contração celular, particularmente no contexto de telas de drogas fenotípicas automatizadas de alto rendimento.
Específicas para usos futuros em telas de drogas, podem ser usadas placas de rendimento mais elevado, como uma placa FLECS de 384 poços. Nessas placas, os objetivos 4x em muitos microscópios podem capturar um único poço inteiro em seu campo de visão, garantindo que todas as respostas contratuais celulares sejam capturadas. Usando um sistema de imagem de alto rendimento, uma placa inteira de 384 poços pode ser imageda em aproximadamente 5 minutos, tornando este sistema dramaticamente mais rápido do que outras opções, e, portanto, adequado para a descoberta de drogas fenotípicas de alto rendimento. De fato, os autores rotineiramente executam telas de drogas semanais em ~50 384-wellplates (totalizando mais de 19.000 poços) usando automação.
Divulgações
I.P. é um inventor de uma família de patentes emitida protegendo os métodos e sistemas da tecnologia FLECS. I.P., Y.W., J.Z., E.C., e R.H. são todos funcionários da Forcyte Biotechnologies, Inc. R.D. é professor da UCLA e cofundador da Forcyte Biotechnologies, Inc. I.P., Y.W., J.Z., e R.D. detêm interesses financeiros em Forcyte Biotechnologies, Inc., que é o licenciado exclusivo das patentes acima e está comercializando flecs tecnologia.
Agradecimentos
O trabalho de laboratório foi realizado com o apoio do Recurso de Triagem Molecular Compartilhada (MSSR) da UCLA, onde a Forcyte patrocina atividades de pesquisa, e a Incubadora de Magnify do Instituto Nanosistemas da Califórnia (CNSI), onde a Forcyte Biotechnologies, Inc. é uma empresa residente. Os autores concederão acesso ao módulo de análise Biodock.ai FLECS a todos os pesquisadores acadêmicos mediante solicitação. L.H. e I.P. contribuíram igualmente para este trabalho.
Materiais
| Name | Company | Catalog Number | Comments |
| Bladder smooth muscle cell culture | Sciencell | #4310 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Cell culture media | Thermofisher | 11765054 | Ham's F12 medium supplemented with 10% FBS and 1% p/s |
| Cell strainer | Fisher Scientific | 7201432 | |
| Conical Tube | Fisher Scientific | 05-539-13 | |
| Culture flask | Fisher Scientific | FB012941 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| DMSO (Dimethyl sulfoxide) | Fisher Scientific | D1284 | |
| Eppendorf tubes | Fisher Scientific | 05-402-31 | |
| Fluorescent microscope | Molecular Devices | ImageXpress Confocal | |
| Forcyte-manufactured 24-well plate | Forcyte Biotechnologies | 24-HC4R-X1-QB12 | |
| Hoescht 3342 Live Nuclear Stain | Thermofisher | 62249 | |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP39920 |
Referências
- Ohama, T., Hori, M., Ozaki, H. Mechanism of abnormal intestinal motility in inflammatory bowel disease: How smooth muscle contraction is reduced. Journal of Smooth Muscle Research. 43 (2), 43-54 (2007).
- Peyronnet, B., et al. A comprehensive review of overactive bladder pathophysiology: On the way to tailored treatment. European Urology. 75 (6), 988-1000 (2019).
- Aldamanhori, R., Osman, N. I., Chapple, C. R. Underactive bladder: Pathophysiology and clinical significance. Asian Journal of Urology. 5 (1), 17-21 (2018).
- Sanderson, M. J., Delmotte, P., Bai, Y., Perez-Zogbhi, J. F. Regulation of airway smooth muscle cell contractility by Ca2+ signaling and sensitivity. Proceedings of the American Thoracic Society. 5 (1), 23-31 (2008).
- Brozovich, F. V., et al. Mechanisms of vascular smooth muscle contraction and the basis for pharmacologic treatment of smooth muscle disorders. Pharmacological Reviews. 68 (2), 476-532 (2016).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophysical Journal. 80 (4), 1744-1757 (2001).
- Tseng, Q., et al. A new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab on a Chip. 11 (13), 2231-2240 (2011).
- Bell, E., Ivarsson, B., Merrill, C. Production of a tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potential in vitro. Proceedings of the National Academy of Sciences. 76 (3), 1274-1278 (1979).
- Tan, J. L., et al. Cells lying on a bed of microneedles: an approach to isolate mechanical force. Proceedings of the National Academy of Sciences. 100 (4), 1484-1489 (2003).
- Rokhzan, R., et al. high-throughput measurements of cell contraction and endothelial barrier function. Laboratory Investigation. 99 (1), 138-145 (2019).
- Park, C. Y., et al. High-throughput screening for modulators of cellular contractile force. Integrative Biology. 7 (10), 1318-1324 (2015).
- Kaylan, K. B., Kourouklis, A. P., Underhill, G. H. A high-throughput cell microarray platform for correlative analysis of cell differentiation and traction forces. Journal of Visualized Experiments. (121), e55362(2017).
- Huang, Y., et al. Traction force microscopy with optimized regularization and automated Bayesian parameter selection for comparing cells. Scientific Reports. 9, 539(2019).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLOS ONE. 6, 17833(2011).
- Pushkarsky, I., et al. Elastomeric sensor surfaces for high-throughput single-cell force cytometry. Nature Biomedical Engineering. 2 (2), 124-137 (2018).
- Pushkarsky, I. FLECS technology for high-throughput single-cell force biology and screening. ASSAY and Drug Development Technologies. 16 (1), 7-11 (2017).
- Koziol-White, C. J., et al. Inhibition of PI3K promotes dilation of human small airways in a rho kinase-dependent manner. British Journal of Pharmacology. 173 (18), 2726-2738 (2016).
- Orfanos, S., et al. Obesity increases airway smooth muscle responses to contractile agonists. American Journal of Physiology-Lung Cellular and Molecular Physiology. 315 (5), 673-681 (2018).
- Tseng, P., Pushkarsky, I., Carlo, D. D. Metallization and biopatterning on ultra-flexible substrates via dextran sacrificial layers. PLOS ONE. 9, 106091(2014).
- Yoo, E. J., et al. Gα12 facilitates shortening in human airway smooth muscle by modulating phosphoinositide 3-kinase-mediated activation in a RhoA-dependent manner. British Journal of Pharmacology. 174 (4), 4383-4395 (2017).
- MacGlashan, D., Vilariño, N. Polymerization of actin does not regulate desensitization in human basophils. Journal of Leukocyte Biology. 85 (4), 627-637 (2009).
- Hocking, D. C., Sottile, J., Langenbach, K. J. Stimulation of integrin-mediated cell contractility by fibronectin polymerization. Journal of Biological Chemistry. 275 (14), 10673-10682 (2000).
- Tolić-Nørrelykke, I. M., Wang, N. Traction in smooth muscle cells varies with cell spreading. Journal of Biomechanics. 38 (7), 1405-1412 (2005).
- Ye, G. J. C., et al. The contractile strength of vascular smooth muscle myocytes is shape dependent. Integrative Biology. 6 (2), 152-163 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados