Method Article
Encuesta de métodos de bajo costo para medir la esperanza de vida y la salud en Caenorhabditis elegans
En este artículo
Resumen
Caenorhabditis elegans sirve como un excelente sistema modelo con métodos robustos y de bajo costo para estudiar la duración de la salud, la vida útil y la resistencia al estrés.
Resumen
El descubrimiento y desarrollo de Caenorhabditis elegans como organismo modelo fue influyente en la biología, particularmente en el campo del envejecimiento. Muchos estudios históricos y contemporáneos han identificado miles de paradigmas que alteran la esperanza de vida, incluidas las mutaciones genéticas, la expresión génica transgénica y la hormesis, una exposición beneficiosa y de bajo grado al estrés. Con sus muchas ventajas, incluida una vida útil corta, un mantenimiento fácil y de bajo costo, y un genoma completamente secuenciado con homología de casi dos tercios de todos los genes humanos, C. elegans se ha adoptado rápidamente como un modelo excepcional para la biología del estrés y el envejecimiento. Aquí, se estudian varios métodos estandarizados para medir la vida útil y la duración de la salud que se pueden adaptar fácilmente a casi cualquier entorno de investigación, especialmente aquellos con equipos y fondos limitados. Se destaca la increíble utilidad de C. elegans , destacando la capacidad de realizar potentes análisis genéticos en biología del envejecimiento sin la necesidad de una infraestructura extensa. Finalmente, las limitaciones de cada análisis y enfoques alternativos se discuten para su consideración.
Introducción
Desde el momento de la publicación de 'La genética de Caenorhabditis elegans', uno de los artículos más influyentes de Sydney Brenner en 1974, este gusano microscópico ha sido considerado un sistema modelo sobresaliente para estudiar misterios biológicos1. En 1977, Michael R. Klass publicó el método para medir la vida útil de C. elegans y estableció este sistema modelo para estudiar el envejecimiento2. La investigación para comprender la relación entre el estrés y la longevidad ha comenzado con la identificación de una sola mutación en el gen age-1, lo que resultó en una extensión de la vida útil en C. elegans3. Además, estudios contemporáneos han identificado otras mutaciones que aumentan la esperanza de vida, que revelaron gusanos mutantes de larga vida que exhiben una mayor resistencia al estrés 4,5,6. Con sus muchas ventajas, incluida una vida útil corta, fácil mantenimiento, genoma completamente secuenciado que contiene homología de aproximadamente dos tercios de todos los genes que causan enfermedades humanas, disponibilidad y facilidad de uso de bibliotecas de interferencia de ARN (ARNi) y similitud fisiológica con humanos 7,8,9, C. elegans se ha adoptado rápidamente como un modelo sobresaliente para la biología del estrés y el envejecimiento.
Quizás las mayores utilidades de C. elegans son su costo extremadamente bajo de mantenimiento, la facilidad de experimentación y la variedad de herramientas genéticas disponibles para los estudios. C. elegans se cultiva típicamente en un medio de agar sólido con una fuente de alimento de E. coli. Dos cepas de E. coli de uso común son OP50 estándar, una cepa B que es quizás la10 más utilizada, y HT115, una cepa K-12 que se usa principalmente para experimentos de ARNi11,12. La cepa HT115 K-12 lleva una deleción en RNAIII RNasa, una mutación que es esencial para los métodos de ARNi, donde se utilizan plásmidos que expresan dsRNA correspondiente a genes individuales de C. elegans. Los vectores de alimentación de dsRNA permiten un derribo robusto de genes de C. elegans sin la necesidad de cruces complejos o edición del genoma, ya que las bacterias que transportan estos plásmidos pueden ser alimentadas directamente a los nematodos. Miles de estos vectores de ARNi bacteriano existen en el fondo de HT115, incluida la biblioteca de ARNi de Vidal más popular con >19,000 construcciones de ARNi individuales13 y la biblioteca de ARNi de Ahringer con 16,757 construcciones de ARNi14. Sin embargo, las dietas bacterianas OP50 y HT115 tienen grandes diferencias en el perfil metabólico, incluidas las diferencias en la vitamina B1215,16. Por lo tanto, se recomienda realizar todos los experimentos en una sola fuente de bacterias, si es posible, para evitar interacciones gen-dieta que puedan introducir múltiples factores de confusión como se describió anteriormente 17,18,19. Debido a su facilidad, los animales se mantienen en OP50 para todas las condiciones experimentales descritas aquí, pero todos los experimentos se realizan en HT115 como se describió anteriormente20. Brevemente, los animales se mantienen en OP50 y se transfieren a HT115 después de la sincronización (después del blanqueamiento) para la consistencia entre los experimentos de ARNi vs. no ARNi. Alternativamente, también se puede utilizar una cepa OP50 competente en ARNi que lleve una deleción similar de RNAIII RNasa que se encuentra en la cepa E. coli K12HT115 21.
Quizás una limitación importante de los experimentos de ARNi en C. elegans es la preocupación por la eficiencia de derribo. Si bien la eficiencia de derribo se puede validar a través de qPCR o western blotting, estos requieren equipos y reactivos costosos y se limitan al análisis a granel. Esto es aún más preocupante al observar células específicas, como las neuronas, que son refractarias (menos sensibles) al ARNi. Si bien la eficiencia del ARNi en células específicas se puede mejorar a través de la sobreexpresión de SID-1, la proteína transmembrana esencial para la absorción de dsRNA22, esto todavía se limita a los patrones de expresión específicos del tipo de célula de los promotores utilizados para estas construcciones, y por lo tanto los knockouts y mutaciones de genes son el medio más infalible de agotar las funciones del gen. Más allá del derribo mediado por RNAi, los C. elegans también son altamente susceptibles a la edición del genoma con estrategias basadas en CRISPR 23,24,25 y a la sobreexpresión de constructos transgénicos a través de microinyecciones, con la opción de integrar construcciones transgénicas a través de irradiación o integración basada en transposones 26,27,28,29 . Sin embargo, estos métodos requieren costosos equipos de microinyección, y el alto costo de los ARN guía o la enzima Cas9 puede prohibir estos métodos en instituciones con fondos limitados. En cambio, miles de líneas transgénicas y mutantes están disponibles por unos pocos dólares tanto en el Centro de Genética Caenorhabditis (CGC) como en el Proyecto Nacional de Biorecursos (NBRP). El NBRP ofrece mutantes aislados para un gran número de genes de C. elegans, incluidas cepas mutantes publicadas y, por lo tanto, verificadas, mutantes derivados de proyectos piloto y mutantes que aún no se han caracterizado. En contraste, CGC es un depósito de líneas de C. elegans en su mayoría publicadas y establecidas de la comunidad investigadora. Ambos envían cepas a todo el mundo a precios muy razonables y ofrecen una amplia variedad de opciones para aquellos con capacidad limitada para sintetizar cepas internamente.
Aquí, se ofrece una colección de métodos curados, que probablemente sean los métodos de menor costo para evaluar la vida útil y la salud en C. elegans. Todos los métodos presentados aquí requieren equipos y suministros de bajo costo, y solo utilizan cepas fácilmente disponibles en el CGC. Quizás lo más prohibitivo para los ensayos de longevidad y supervivencia en C. elegans es el costo de las placas de nematodos growth media (NGM). Dado que C. elegans son hermafroditas y autofertilizados, los ensayos de supervivencia estándar requieren que los animales adultos se alejen continuamente de su progenie para evitar la contaminación de la descendencia. Este proceso no solo consume mucho tiempo, sino que puede llegar a ser costoso debido a la necesidad de aproximadamente 100 placas por condición para ejecutar un solo ensayo de vida útil. Aquí, se proporcionan dos alternativas: la utilización del mutante sensible a la temperatura sin germinación, glp-4 (bn2), o la esterilización química con 5-fluoro-2'-desoxiuridina (FUDR). glp-4 codifica una VALIL aminoacil ARNt sintetasa, y la glp-4(bn2) sensible a la temperatura es reproductivamente deficiente a temperaturas restrictivas debido a la disminución de la traducción de proteínas30,31. FUDR es un método robusto para esterilizar químicamente C. elegans previniendo la replicación del ADN, inhibiendo así la reproducción32. Aunque FUDR puede ser prohibitivamente caro para algunos laboratorios, solo se requiere una pequeña cantidad para esterilizar químicamente a los gusanos, y su estabilidad en forma de polvo puede hacerlo factible para la mayoría de los grupos. La utilización del mutante glp-4 (bn2) sensible a la temperatura es sin duda la opción más barata, ya que el único requisito es una incubadora para cambiar a los animales a los restrictivos 25 ° C; sin embargo, cabe señalar que el crecimiento a 25 °C puede causar estrés por calor leve33,34. Independientemente del método, el uso de animales estériles puede disminuir significativamente los costos de los consumibles necesarios para los ensayos relacionados con la edad.
Para estudiar el envejecimiento, los ensayos estándar de vida útil son convencionales, ya que los paradigmas que alteran la longevidad tienen un impacto directo en el envejecimiento. Sin embargo, las mediciones de la duración de la salud y la tolerancia al estrés presentan información adicional sobre la salud del organismo. Aquí, se ofrecen varios métodos para medir la salud: 1) fecundidad como medida de la salud reproductiva; 2) el tamaño de la cría como una medida de la salud del desarrollo y la viabilidad de la descendencia puesta; y 3) el comportamiento locomotor como una medida de la función muscular y la motilidad, los cuales están directamente correlacionados con el envejecimiento. Además, se ofrecen ensayos de tolerancia al estrés: supervivencia al estrés ER, estrés mitocondrial / oxidativo y supervivencia al estrés térmico. De hecho, los animales con mayor resistencia al estrés ER35,36, estrés mitocondrial37 y estrés térmico38 exhiben una mayor vida útil. El estrés ER se aplica exponiendo C. elegans a la tunicamicina, que bloquea la glicosilación ligada a N y causa la acumulación de proteínas mal plegadas39. El estrés mitocondrial/oxidativo es inducido por la exposición al paraquat, que induce la formación de superóxidos específicamente en las mitocondrias40. El estrés por calor se aplica a través de la incubación de animales a 34-37 °C33,41. Todos los ensayos descritos aquí se pueden realizar con equipos y fondos mínimos, y ofrecen una variedad de herramientas para estudiar el envejecimiento en diversos grupos.
Protocolo
1. Crecimiento y mantenimiento de C. elegans
- Verter placas de nematodos para medios de crecimiento (NGM)
- Cultive C. elegans en placas de agar estándar al 2% con nematodos growth media (NGM) que consisten en 1 mM CaCl2, 5 μg/ ml de colesterol, 25 mM KPO4 (pH 6.0), 1 mM MgSO4, 0.25% p/v peptona y 51.3 mM NaCl.
- Para 1 L de placas de agar NGM, mida 2,5 g de peptona, 3,0 g de NaCl y 20 g de agar en un matraz de 1 L con una barra de agitación.
NOTA: Se recomienda estandarizar una fuente de agar específica, ya que hemos visto variabilidad en la rigidez entre marcas, lo que puede afectar la reproducibilidad. Aquí, Bacto-Agar se usa estrictamente. Además, se recomienda agregar agar directamente en el matraz que se está autoclave, ya que el agar no se disolverá por completo sin calentarse, y la transferencia de la solución que contiene agar dará como resultado la pérdida de agar y errores de concentración. - Agregue dH2O hasta 970 ml.
NOTA: 30 ml de aditivos líquidos después de la esterilización llevarán el volumen final a 1 L. En nuestras manos, se requerirán ~ 951 mL de dH2O para alcanzar los 970 mL del volumen final. - Esterilice la solución de agar NGM utilizando un esterilizador de medios o autoclave estándar para una esterilización eficiente.
NOTA: En este punto, el agar NGM estéril se puede almacenar durante varios meses a temperatura ambiente. Si se almacena, el agar NGM se puede licuar en un microondas con pulsos de 15-45 s para evitar que la solución hierva, o en un baño de agua caliente. - Deje que la solución revuelva hasta que se enfríe a 60-75 °C. Agitar durante el enfriamiento es importante para evitar un enfriamiento desigual, lo que puede hacer que un poco de agar se solidifique.
- Mientras la solución se enfría, caliente un baño de agua o un baño de cuentas a 65-70 ° C.
- Una vez que la solución se enfríe a 60-75 °C, agregue aditivos líquidos: 2.0 mL de 0.5 M CaCl2, 1 mL de 5 mg / ml de colesterol, 25 ml de 1 M KPO4 (pH 6.0) y 0.5 M MgSO4 (consulte la Tabla 1 para recetas para todos los reactivos), y deje que la solución se mezcle durante ~ 5 min para garantizar una mezcla completa.
NOTA: Los medicamentos también se pueden incluir en las placas aquí (por ejemplo, agregue 1 ml de 100 mg / ml de carbenicilina y 1 ml de 1 M de IPTG; agregue 10 ml de 2.5 mg / ml de tunicamicina; agregue 10 ml de 400 ml de paraquat). - Sumerja el matraz que contiene agar NGM en un baño de agua de 65-70 °C para evitar que el agar NGM se solidifique mientras se vierte en las placas.
- Pipetear 9-11 ml de solución en cada placa de 60 mm, o 20-30 ml de solución en cada placa de 100 mm.
NOTA: Se recomienda utilizar el volumen de pipeta más pequeño disponible para evitar fugas de NGM causadas por la expansión del aire en la pipeta. Pipetear hasta 1-2 ml más de medios de los que se agregarán a cada placa para evitar vaciar completamente la pipeta ayudará a prevenir la formación de burbujas. Alternativamente, las placas se pueden verter a mano directamente desde la botella en un plato, pero se recomienda encarecidamente el pipeteo para garantizar que las placas tengan el mismo volumen. Las placas de igual volumen son importantes para garantizar concentraciones similares de soluciones cuando se utilizan métodos en los que las soluciones se aplican directamente sobre una placa (véase el paso 1.1.17). Los volúmenes iguales también permiten una microscopía fácil para mantener un plano focal similar a través de las placas. - Vuelva a colocar la pipeta en la solución calentada para mantener la temperatura y evitar que el agar NGM se solidifique.
- Repita los dos pasos anteriores para todas las placas.
- Permita que las placas de agar NGM se solidifiquen durante la noche.
- Después de que las placas se hayan solidificado, almacene las placas hasta por 3 meses a 4 ° C o continúe con el paso 1.1.14 para sembrar placas con bacterias. Almacene las placas en recipientes sellados para ayudar a retener la humedad y mantener la calidad de la placa.
- Cultivar un cultivo de OP50 en caldo de lisogenia (LB) o medio equivalente de elección durante 24-48 h a temperatura ambiente (~22-25 °C) o cultivar un cultivo de HT115 en LB + antibióticos (se recomienda ampicilina/carbo + tetraciclina para HT115) con agitación a 37 °C durante 12-16 h.
NOTA: Se recomienda cultivar OP50 a temperatura ambiente porque se ha encontrado un crecimiento más agresivo de OP50 a 37 °C, lo que afecta la vida útil de C. elegans . En contraste, HT115 tiene una tasa de crecimiento más lenta y hace cultivos menos densos; por lo tanto, se recomienda cultivar HT115 a 37 ° C con agitación. - Sembrar un volumen de 100-200 μL de un cultivo saturado OP50/HT115 en una placa de 60 mm, o 1 mL para una placa de 100 mm.
- Deje que las placas se sequen durante la noche en una mesa de trabajo y deje que se seque un día adicional si las placas aún están húmedas. Guarde las placas en recipientes sellados a 4 °C durante ~2 meses.
- Opcional: Agregue medicamentos directamente sobre las placas de agar NGM con semillas (por ejemplo, 100 μL de solución FUDR de 10 mg / ml) para esterilizar químicamente los gusanos.
- Mantenimiento de las existencias de C. elegans
- Etiquete correctamente el fondo de una placa de agar NGM con semillas. Etiquete los bordes en la parte inferior de la placa para evitar obstruir el paso de la luz en los microscopios de disección estándar.
- Usando un microscopio de disección estándar, cuchara las bacterias de elección en C. elegans pick.
NOTA: En este protocolo, se utilizó una selección compuesta por un cable de platino / iridio al 90% / 10% unido al extremo de una pipeta Pasteur de vidrio. - Usando la bacteria, recolecte 10-20 huevos, animales L1, L2 o L3, y transfiéralos a una placa de agar NGM recién etiquetada.
NOTA: Es mejor recolectar animales más jóvenes; en la experiencia de los autores, para los animales estándar de tipo salvaje, mover 10-20 huevos / animal joven permitirá que el plato crezca a 15 ° C sin inanición. Para los animales transgénicos o mutantes con fecundidad disminuida, se deben mover más animales al plato. - Para animales con fecundidad de tipo salvaje y cultivados a 15 °C, repita los pasos 1.2.1-1.2.3 cada 7 días para mantener un stock semanal. Para los animales cultivados a 20 °C, repita los pasos 1.2.1-1.2.3 cada 4-5 días para evitar la inanición.
- Sincronización de gusanos via blanqueo
NOTA: Una placa de agar NGM completa de 60 mm (por ejemplo, placas de stock de 1 semana de antigüedad cultivadas a 15 °C) proporcionará un número suficiente de animales para la mayoría de los ensayos estándar descritos. En general, un adulto grávido (adulto lleno de huevos) proporcionará 10-15 huevos42, y una placa completa de agar NGM de 60 mm tiene entre 100 y 200 adultos grávidos, proporcionando ~ 1000-2000 huevos.- Para experimentos a mayor escala que requieran más animales, corte un agar NGM completo de 60 mm en cuatro a seis piezas iguales y córtelas en placas sembradas de 100 mm para su expansión.
NOTA: Aquí, la fragmentación se refiere a cortar un trozo de la placa de agar NGM que contiene gusanos y mover todo el trozo de agar + gusanos a una nueva placa, del lado del gusano hacia abajo para permitir que los gusanos se arrastren hacia la nueva placa. Como marco de referencia, los animales con fecundidad de tipo salvaje producirán una placa completa de 100 mm si crecen a 20 ° C durante 2-3 días después de la fragmentación. - Para comenzar a recolectar los nematodos, vierta una pequeña cantidad de solución de M9 (Tabla 1) en placas que contengan gusanos, teniendo cuidado de no llenar en exceso la placa de Petri. Agite la solución M9 suavemente para aflojar los gusanos del césped bacteriano.
- Recolecte gusanos adultos grávidos con una pipeta serológica, teniendo cuidado de no perforar el agar con la punta de la pipeta.
NOTA: Se recomiendan pipetas serológicas de vidrio, ya que C. elegans tiende a adherirse al plástico. Si las pipetas de vidrio no están disponibles, se recomienda comenzar con un mayor número de animales de los necesarios, ya que algunos se perderán debido a la adherencia a las pipetas de plástico. - Pellet de los animales por centrifugación durante 30 s a 1.100 x g. Aspirar el sobrenadante.
NOTA: El pellet de C. elegans está muy suelto, así que tenga cuidado de no agitar o interrumpir el pellet mientras aspira el sobrenadante. - Mientras los animales están centrifugando, prepare 5 ml de solución blanqueadora por cepa (consulte la Tabla 1 para obtener detalles de la receta); para 5 ml de solución, mezclar 1,5 ml de hipoclorito de sodio al 6% (lejía), 0,75 ml de 5 M de NaOH o KOH y 2,75 ml de dH2O.
PRECAUCIÓN: El hipoclorito de sodio y las soluciones de hidróxido de alta concentración son corrosivas, por lo que se recomienda usar guantes y una bata de laboratorio al manipular. - Agregue 5 ml de solución blanqueadora a la mezcla de pellets de gusano/M9.
- Revise los gusanos bajo un microscopio de disección cada pocos minutos hasta que todos los cuerpos de gusanos adultos se hayan disuelto y solo queden huevos en la mezcla. Agite la mezcla de gusano / lejía vigorosamente para acelerar el proceso de blanqueo.
NOTA: Dejar los huevos dentro de una mezcla de lejía durante períodos prolongados dañará los huevos y afectará la viabilidad de los animales. Para los animales de tipo salvaje, el blanqueamiento generalmente toma de 4 a 6 minutos con agitación. Por lo tanto, se recomienda verificar a los animales bajo un microscopio a intervalos de 30 s a partir de la marca de 4 minutos. - Peletizar los huevos haciendo girar la mezcla de huevo / lejía durante 30 s a 1.100 x g.
NOTA: Algunos tubos cónicos de 15 ml tienen líneas de gradiente en el interior del tubo. Para estos tubos, se recomienda hacer girar los huevos a una velocidad más alta (por ejemplo, 30 s a 2,000 x g) para garantizar que los huevos se peguen en la parte inferior del tubo y no permanezcan en las líneas de gradiente. - Aspirar la solución blanqueadora.
NOTA: Un pellet de huevo es más rígido que un pellet de gusano, pero aún puede interrumpirse fácilmente. Por lo tanto, tenga cuidado de no agitar el tubo después de centrifugar. - Lave los huevos agregando la solución M9 hasta 15 ml e invirtiendo el tubo cuatro o cinco veces para asegurarse de que los huevos estén completamente dispersos en la solución M9.
- Huevos de pellet por centrifugado durante 30 s a 1.100 x g y aspirar la solución M9.
- Repita los dos pasos anteriores durante un total de cuatro lavados para eliminar cualquier blanqueador de la mezcla de huevos.
- Resuspender los huevos en 100 μL a 2 ml de solución M9 (es decir, dependiendo del número total de gusanos blanqueados) después del lavado final. Agite bien los huevos para romper los grumos y asegúrese de que el pellet esté completamente resuspendido.
- Alternativamente, los animales pueden ser detenidos L1 para una sincronización temporal más estrecha; para la detención de L1, agregue la solución M9 a la bolita de huevo a ~ 10 ml en un tubo cónico de 15 ml. Deje que los gusanos giren en un rotador durante un máximo de 24 h a 20 °C o a temperatura ambiente. Los animales L1 generalmente tardan medio día menos en llegar a la edad adulta en comparación con el momento de los huevos descrito en el paso 1.3.16.
- Aproximar la concentración de huevo (o concentración de L1; ver paso 1.3.14) pipeteando 4 μL de mezcla de huevo/M9 en una placa NGM sembrada con bacterias. Cuente y calcule cuántos huevos están presentes por μL chapado. Repita el conteo tres o cuatro veces para mejorar la aproximación.
NOTA: Aproximar la concentración de huevos asegurará que se plateen suficientes animales para el tamaño de muestra adecuado para experimentos sin sobreplatación, lo que causará inanición. - Sobre la base de la aproximación, coloque el número apropiado de huevos en placas de agar NGM sembradas con bacterias de elección. Para las placas OP50, coloque un máximo de 200 animales en una placa de 60 mm y 1.000 animales en una placa de 100 mm. Para las placas HT115, coloque un máximo de 150 animales en una placa de 60 mm y 600 animales en una placa de 100 mm.
NOTA: Estos son números aproximados basados en nuestras condiciones de laboratorio, y los números pueden cambiar según el grosor del césped bacteriano. Los huevos cultivados a 15 ° C tardarán ~ 5 días en alcanzar el día 1 en la edad adulta (~ 140 h para alcanzar la etapa adulta grávida máxima de puesta de huevos). Los huevos cultivados a 20 ° C tardarán ~ 4 días en alcanzar el día 1 en la edad adulta (~ 96 h para alcanzar la etapa adulta grávida máxima de puesta de huevos). Los huevos cultivados a 25 ° C tardarán ~ 3.5 días en alcanzar el día 1 en la edad adulta (~ 62 h para alcanzar la etapa adulta grávida máxima de puesta de huevos).
- Para experimentos a mayor escala que requieran más animales, corte un agar NGM completo de 60 mm en cuatro a seis piezas iguales y córtelas en placas sembradas de 100 mm para su expansión.
- Puesta de huevos como método alternativo para sincronizar poblaciones de C. elegans
- Si los protocolos de blanqueamiento no son factibles (por ejemplo, no hay centrífuga disponible), como método alternativo para sincronizar las poblaciones de C. elegans, realice un procedimiento de puesta de huevos. Tenga en cuenta que este protocolo es más intensivo en mano de obra y dará como resultado menores rendimientos de los animales.
- Para la puesta de huevos, coloque de 8 a 12 adultos grávidos en una placa de agar NGM estándar sembrada con bacterias de elección y documente el número exacto de animales colocados en una placa.
NOTA: Los procedimientos de puesta de huevos deben realizarse a la temperatura que se utilizará para la experimentación. - Permita que los animales pongan huevos durante 4-8 h.
NOTA: La duración que los animales quedan en el plato se puede ajustar cuando sea necesario. Por ejemplo, se puede poner un mayor número de animales en un plato por una duración más corta de puesta de huevos cuando hay menos tiempo disponible. C. elegans generalmente pone huevos en ráfagas, que pueden estimarse a una tasa de aproximadamente cinco huevos/h para animales con fecundidad de tipo salvaje43. Siga las recomendaciones del paso 1.3.16 para evitar sobrepasar a los animales. - Retire todos los animales adultos del plato.
NOTA: Cualquier animal adulto que quede en el plato continuará poniendo huevos, lo que resultará en una población no sincronizada. - Coloque los huevos a 15 ° C durante ~ 5 días o 20 ° C durante ~ 4 días para llegar al día 1 de la edad adulta.
2. Medición de la longevidad en C. elegans
- Vida útil estándar
- Prepare placas de agar NGM sembrando placas con 100 μL de bacterias de elección. Para mayor consistencia, asegúrese de que se use la misma bacteria en todas las réplicas. Dado que los gusanos se mueven todos los días durante las etapas de puesta de huevos de la edad adulta, siembra de cinco a siete juegos de placas de agar NGM durante la vida útil, y de dos a cuatro placas por cepa para hacer crecer a los animales hasta la edad adulta (es decir, si se usan ocho placas de 15 animales para la vida útil, se necesitan sembrar 40-56 placas por condición).
- Deje que las placas se sequen durante la noche antes del almacenamiento.
NOTA: Se recomienda que las placas se almacenen a 4 ° C, y que el número requerido de placas se retire del almacenamiento en frío diariamente para evitar que las bacterias produzcan céspedes gruesos que pueden dificultar la vida útil de movimiento / conteo. Asegúrese de que las placas se calienten antes de enchapar los gusanos. - Recolectar una población sincronizada de C. elegans utilizando un ensayo de blanqueamiento estándar como se describe en los pasos 1.3 y 1.4.
- Mueva de 10 a 15 días 1 animales adultos a 8-12 platos cada uno. Para una vida útil estándar, comience con ~ 120 animales para asegurarse de que el tamaño de la muestra no caiga demasiado por debajo de 100 después de los eventos de censura (por ejemplo, ocho placas de 15 animales = 120 animales; 12 placas de 10 animales = 120 animales).
NOTA: En el caso actual, 10-15 animales son un número manejable para la mayoría de los investigadores, aunque seis placas de 20 animales también es factible para disminuir el costo de los consumibles. - Durante los primeros 7-8 días o hasta que la progenie ya no sea visible, aleje a los animales adultos de su progenie cada 1-2 días.
NOTA: Los animales se pueden mover cada dos días para ahorrar materiales, pero se debe tener cuidado para garantizar que los huevos / animales larvales no se transfieran con el adulto para evitar la contaminación de las poblaciones adultas con progenie. En este estudio, el método más simple es mover animales todos los días desde los días 1-3 cuando la puesta de huevos está en su máximo, y luego cambiar a animales en movimiento cada dos días durante los días 5-8 cuando la puesta de huevos es mínima. Con este método, no es imperativo evitar la transferencia de huevos / animales larvales durante los días 1-3, ya que los adultos se moverán todos los días y los huevos / larvas no pueden desarrollarse a la edad adulta en 1 día. - Después de que los animales hayan dejado de producir progenie, califique la esperanza de vida cada dos días hasta que todos los animales hayan sido calificados como muertos o censurados. Retire todos los animales muertos o censurados del plato para evitar confusiones y contar el mismo animal.
NOTA: La muerte se califica como animales que no exhiben movimiento cuando se tocan suavemente con un pico. La censura se califica como animales que son embolsados, exhiben protuberancias vulvares / intestinales o se arrastran hasta los lados de la placa donde se desecan.
- Vida útil con esterilización química con FUDR
- Prepare placas de agar NGM sembrando placas con 100 μL de bacterias de elección. Para mayor consistencia, asegúrese de que se use la misma bacteria en todas las réplicas. Separe de 8 a 12 placas por cepa para experimentos de vida útil, y de dos a cuatro placas por cepa para cultivar animales hasta la edad adulta. Deje que las placas se sequen durante la noche.
- Agregue 100 μL de 10 mg / ml de FUDR en el centro del césped bacteriano para las placas de 8-12 que se utilizarán para el ensayo de vida útil. Recuerde dejar de dos a cuatro placas sin FUDR como placas de inicio para permitir que los animales crezcan hasta la edad adulta. Deje que los platos se sequen durante la noche.
PRECAUCIÓN: FUDR bloquea la síntesis de ADN, por lo que se recomienda usar guantes al manipular. - Recolectar una población sincronizada de C. elegans utilizando un ensayo de blanqueamiento estándar como se describe en los pasos 1.3 y 1.4.
NOTA: Estos animales deben cultivarse en placas sin FUDR, ya que FUDR hará que los animales se detengan / mueran. - Mueva 10-15 días 1 animales adultos en 8-12 placas cada una, que contengan FUDR. Para una vida útil estándar, comience con ~ 120 animales para asegurarse de que el tamaño de la muestra no caiga demasiado por debajo de 100 después de los eventos de censura (por ejemplo, ocho placas de 15 animales = 120 animales; 12 placas de 10 animales = 120 animales).
NOTA: Los animales también pueden ser trasladados a FUDR en la etapa L4 si es imperativo que la formación de progenie se evite por completo, pero los animales no deben moverse demasiado pronto, ya que esto hará que los animales tengan un mayor riesgo de protuberancias vulvares / intestinales y aumentará la censura. - Puntúe la esperanza de vida cada dos días hasta que todos los animales hayan sido calificados como muertos o censurados. Retire todos los animales muertos o censurados del plato para evitar confusiones y contar el mismo animal.
NOTA: Para la vida útil de FUDR, cualquier progenie puede ser ignorada, ya que se detendrán en la etapa L1 y eventualmente morirán.
- Vida útil utilizando mutantes estériles sensibles a la temperatura
- Prepare placas de agar NGM sembrando placas con 100 μL de bacterias de elección. Para mayor consistencia, asegúrese de que se use la misma bacteria en todas las réplicas. Separe 8-12 placas por cepa para experimentos de vida útil, y 2-4 placas por cepa para cultivar animales hasta la edad adulta. Deje que los platos se sequen durante la noche.
- Recolectar una población sincronizada de C. elegans utilizando un ensayo de blanqueamiento estándar como se describe en los pasos 1.3 y 1.4. Recuerde cultivar animales a la temperatura restrictiva de 25 ° C para asegurarse de que los animales sean estériles.
- Mueva de 10 a 15 días 1 animales adultos a 8-12 platos cada uno. Para una vida útil estándar, comience con ~ 120 animales para asegurarse de que el tamaño de la muestra no caiga demasiado por debajo de 100 después de los eventos de censura (por ejemplo, ocho placas de 15 animales = 120 animales; 12 placas de 10 animales = 120 animales).
- Puntúe la esperanza de vida cada dos días hasta que todos los animales hayan sido calificados como muertos o censurados. Retire todos los animales muertos o censurados del plato para evitar confusiones y contar el mismo animal.
NOTA: Cuando se trata de cepas de corta duración, se recomienda puntuar la esperanza de vida todos los días, ya que la vida útil a 25 ° C es mucho más corta y, por lo tanto, el rango dinámico es limitado. En la experiencia de los autores, los animales pueden volver a 20 ° C después del día 2, y los animales permanecerán estériles si es preferible obtener una vida útil de 20 ° C.
3. Medición de la salud en C. elegans
- Mediciones del comportamiento locomotor a través de la golpiza
- Recolectar una población sincronizada de C. elegans utilizando un ensayo de blanqueamiento estándar como se describe en los pasos 1.3 y 1.4.
- Mueva una pequeña colonia de gusanos adultos del día 1 sobre una placa de agar NGM bajo un endoscopio de disección sobre 10-20 μL de solución M9. Se recomiendan 10-15 animales como un número manejable de animales para contar.
- Centrándose en un gusano a la vez, cuente el número de veces que la muestra cambia de una formación cóncava a convexa en 15 s. Use un contador de mano y un temporizador para que se pueda enfocar el gusano durante la duración del ensayo.
NOTA: Se puede grabar un video de la placa para un análisis más exhaustivo / más fácil. Por ejemplo, los accesorios estándar para oculares de microscopio están disponibles para la mayoría de los teléfonos inteligentes y cámaras digitales ($ 15- $ 30), y estos son una excelente opción para grabar videos a un bajo costo. - Repita el paso 3.1.3 para los otros gusanos en el líquido, promediando una tasa de motilidad total para 10-15 gusanos. Para un tamaño de muestra más alto, repita los pasos 3.1.2-3.1.4.
- Envejecer los gusanos a la edad deseada. Se pueden usar métodos similares para los ensayos de vida útil descritos en los pasos 2.1-2.3 para envejecer a los gusanos. Repita los pasos 3.1.2-3.1.4 para evaluar la golpiza a las edades deseadas.
NOTA: Un método alternativo para el paso 3.1.2 es agregar ~ 30 μL o más de solución M9 a un grupo de gusanos en una placa. Esto ahorrará tiempo al tener que transferir gusanos manualmente, aunque debido a la posibilidad aleatoria de dónde están los gusanos en una sola placa, no hay garantía de que un grupo de gusanos permanezca en un solo punto de la placa.
- Mediciones de fecundidad (recuento de óvulos) en C. elegans
- Recolectar una población sincronizada de C. elegans utilizando un ensayo de blanqueamiento estándar como se describe en los pasos 1.3 y 1.4. Los ensayos para el recuento de óvulos comienzan en la etapa L4, que es ~ 1 día antes del día 1 en la edad adulta (~ 3 días a 15 ° C o ~ 2 días a 20 ° C después de la detención de L1).
- Individualice los gusanos L4 en placas separadas de agar NGM sembradas con bacterias de elección. Se recomienda que se utilicen ~ 10-15 animales para un ensayo de fecundidad.
NOTA: Se recomienda diluir las bacterias de elección en un 50% (es decir, no un cultivo saturado) para mejorar la visibilidad del huevo en el césped bacteriano. - Permita que los animales crezcan durante la noche a 20 ° C. Asegúrese de que un lote de placas recién sembrado esté listo para el día siguiente.
- En el día 1 de la edad adulta, transfiera gusanos adultos a placas frescas de agar NGM sembradas con las bacterias diluidas de su elección.
NOTA: Se recomienda usar placas recién sembradas, o almacenar placas a 4 ° C hasta su uso para evitar céspedes bacterianos espesos. - Cuente el número total de huevos puestos en cada plato de agar NGM.
NOTA: Para ayudar a escanear el plato, se puede dibujar una rejilla en la tapa de un plato y colocarla debajo del plato que se está anotando para los huevos. La placa se puede escanear a lo largo de las líneas de la cuadrícula para mantener la orientación a medida que se mueve la placa y evitar el recuento de huevos. - Repita los pasos 3.2.4-3.2.5 durante 7-8 días o hasta que los huevos ya no sean visibles en el plato.
NOTA: Para los días 1-3 cuando las tasas de puesta de huevos son altas, se recomienda mover animales al menos cada 12 h y evaluar los recuentos de huevos dos veces al día. Sin embargo, esto aumenta la cantidad de trabajo y los costos de los consumibles, y por lo tanto el traslado de animales y las mediciones pueden limitarse a una vez al día, pero se debe tener cuidado para garantizar que todos los huevos y animales eclosionados se cuenten correctamente. Los animales eclosionados se cuentan como huevos a los efectos de este ensayo.
- Medición del tamaño de la cría (desarrollo) de la progenie de C. elegans
- Recolectar una población sincronizada de C. elegans utilizando un ensayo de blanqueamiento estándar como se describe en los pasos 1.3 y 1.4. Los ensayos para el tamaño de la cría comienzan en la etapa L4, que es ~ 1 día antes del día 1 en la edad adulta (~ 3 días a 15 ° C o ~ 2 días a 20 ° C después de la detención de L1).
- Individualice los gusanos L4 en placas separadas de agar NGM sembradas con bacterias de elección. Se recomienda que se utilicen ~ 10-15 animales para un ensayo de fecundidad.
- Permita que los animales crezcan durante la noche a 20 ° C. Asegúrese de que un lote de placas recién sembrado esté listo para el día siguiente.
- En el día 1 de la edad adulta, transfiera gusanos adultos a placas frescas de agar NGM sembradas con bacterias de elección.
- Cada 12-24 h (2 veces al día o 1 vez al día), transfiera gusanos adultos a placas frescas de agar NGM sembradas con bacterias de elección durante 7-8 días o hasta que la progenie ya no sea visible. Mantenga todas las placas que contengan huevos a 20 °C.
- Repita el paso 3.3.5 durante 7-8 días o hasta que la progenie ya no sea visible. Mantenga todas las placas que contengan huevos a 20 °C.
NOTA: Las placas de progenie también se pueden almacenar a 15 ° C para extender el tiempo antes de que deban ser marcadas. - Dos días después de transferir gusanos, cuente la progenie desarrollada en las placas. Cuente los gusanos en desarrollo en la etapa L4 (es decir, 2 días después de la eclosión a 20 ° C) o antes para garantizar que la generación F2 (es decir, la progenie de la progenie) no confunda los resultados. Cuenta todos los gusanos que están vivos.
- Retire todos los gusanos de la placa a medida que se cuentan. Mantenga las placas durante 1-2 días adicionales antes de volver a puntuarlas para asegurarse de que no se pierdan los animales con eclosión / desarrollo retrasados.
- Repita el paso 3.3.7 por cada plato de puesta de huevos recogido.
NOTA: Los ensayos de tamaño de cría se pueden realizar junto con el ensayo de recuento de huevos (paso 3.2) para minimizar la mano de obra y los costos de los consumibles mediante la recopilación de dos conjuntos de datos de un experimento. Esto también permitirá la comparación directa del tamaño de la cría y el recuento de huevos dentro de los mismos animales.
4. Medición de la resiliencia al estrés en C. elegans
- Mediciones de la sensibilidad al estrés de ER usando tunicamicina
- Preparar placas de agar NGM mediante placas de siembra que contengan tunicamicina (ver paso 1.1.7, NOTA) con 100 μL de bacterias de elección.
PRECAUCIÓN: Se deben usar guantes cuando se manipule tunicamicina. - Para mayor consistencia, asegúrese de que se use la misma bacteria en todas las réplicas. Sembra 8-12 placas de tunicamicina por cepa para ensayos de supervivencia, y de dos a cuatro placas sin tunicamicina por cepa para cultivar animales hasta la edad adulta. Deje que los platos se sequen durante la noche.
- Recolectar una población sincronizada de C. elegans utilizando un ensayo de blanqueamiento estándar como se describe en los pasos 1.3 y 1.4.
NOTA: Los animales deben cultivarse en placas sin tunicamicina hasta el día 1 de la edad adulta, ya que los animales se detendrán / morirán con tunicamicina. - Mueva de 10 a 15 días 1 animales adultos a 8-12 platos cada uno. Para un ensayo de supervivencia estándar, comience con ~ 120 animales para asegurarse de que el tamaño de la muestra no caiga demasiado por debajo de 100 después de los eventos de censura (por ejemplo, ocho placas de 15 animales = 120 animales; 12 placas de 10 animales = 120 animales).
NOTA: Al igual que los ensayos FUDR, los ensayos de supervivencia de tunicamicina se pueden realizar sin mover animales, ya que la tunicamicina causa la muerte / detención de animales L1. Sin embargo, al realizar un control DMSO, la progenie se desarrollará en placas DMSO, por lo que los animales deben ser movidos diariamente o se requerirá una técnica de esterilización (se pueden usar métodos idénticos utilizados en la sección 2 para la vida útil para los ensayos de supervivencia). - Los ensayos de supervivencia se puntúan de manera similar a la esperanza de vida. Retire todos los animales muertos o censurados del plato para evitar confusiones y contar el mismo animal.
NOTA: Aunque es posible puntuar a los animales cada dos días, ya que la muerte ocurre rápidamente en la tunicamicina, se recomienda puntuar los ensayos de supervivencia diariamente.
- Preparar placas de agar NGM mediante placas de siembra que contengan tunicamicina (ver paso 1.1.7, NOTA) con 100 μL de bacterias de elección.
- Mediciones de la sensibilidad al estrés mitocondrial/oxidativo con paraquat
- Preparar placas de agar NGM mediante placas de siembra que contengan paraquat (ver paso 1.1.7; NOTA) con 100 μL de bacterias de elección.
PRECAUCIÓN: Se deben usar guantes al manipular paraquat, ya que es un peligro para el medio ambiente. Consulte con la salud y seguridad ambiental de la institución los requisitos de descarte, ya que muchas instituciones de investigación requerirán instrucciones específicas de descarte para los peligros ambientales. - Para mayor consistencia, asegúrese de que se use la misma bacteria en todas las réplicas. Siembra de 8 a 12 placas por cepa para ensayos de supervivencia, y de dos a cuatro placas sin paraquat por cepa para cultivar animales hasta la edad adulta. Deje que las placas se sequen durante la noche.
- Recolectar una población sincronizada de C. elegans utilizando un ensayo de blanqueamiento estándar como se describe en los pasos 1.3 y 1.4.
NOTA: Recuerde cultivar animales en placas sin paraquat hasta el día 1 de la edad adulta; sin embargo, es necesario realizar una técnica de esterilización o alejar a los adultos de la progenie, ya que algunos animales pueden desarrollarse hasta la edad adulta en placas de paraquat (ver pasos 2.2-2.3). - Mueva de 10 a 15 días 1 animales adultos a 8-12 platos cada uno. Para un ensayo de supervivencia estándar, comience con ~ 120 animales para asegurarse de que el tamaño de la muestra no caiga demasiado por debajo de 100 después de los eventos de censura (por ejemplo, ocho placas de 15 animales = 120 animales; 12 placas de 10 animales = 120 animales).
- Los ensayos de supervivencia se puntúan de manera similar a la esperanza de vida. Retire todos los animales muertos o censurados del plato para evitar confusiones y contar el mismo animal.
NOTA: Aunque es posible puntuar a los animales cada dos días, ya que la muerte ocurre rápidamente en el paraquat, se recomienda puntuar los ensayos de supervivencia diariamente. Esto es especialmente cierto cuando se usan animales glp-4 (bn2) cultivados a 25 ° C, ya que la muerte ocurrirá muy rápidamente.
- Preparar placas de agar NGM mediante placas de siembra que contengan paraquat (ver paso 1.1.7; NOTA) con 100 μL de bacterias de elección.
- Mediciones de la sensibilidad al estrés térmico (termotolerancia) utilizando temperaturas elevadas
- Recolectar una población sincronizada de C. elegans utilizando un ensayo de blanqueamiento estándar como se describe en los pasos 1.3 y 1.4.
- Precaliente las placas de agar NGM a 37 °C antes de mover los animales a las placas colocando las placas en una incubadora de 37 °C durante al menos 1 h.
- Mueva de 10 a 15 días 1 animales adultos en cuatro a seis platos precalentados cada uno. Para una termotolerancia estándar, comience con ~ 60 animales (por ejemplo, cuatro placas de 15 animales = 60 animales; seis placas de 10 animales = 60 animales)
- Coloque a los animales en una incubadora de 37 ° C y puntúe la muerte cada 2 h. La muerte se define como animales que no exhiben movimiento cuando se tocan suavemente con un pico. Retire todos los animales muertos o censurados del plato para evitar confusiones y contar el mismo animal.
- Asegúrese de que las placas se retiren de la incubadora de 37 ° C durante el mínimo tiempo posible, ya que las placas que se dejan a temperatura ambiente durante largas duraciones mientras se puntúa alterarán los resultados de termotolerancia.
NOTA: Se recomienda extraer solo una cepa a la vez para puntuar, ya que la temperatura del agar no debe cambiar drásticamente en el tiempo que lleva anotar una cepa. - La termotolerancia mediana generalmente se logra en 7-9 h; por lo tanto, asegúrese de un ensayo adecuado a las 7 h, 9 h y 11 h.
NOTA: Si bien se pueden omitir de 1 a 5 h, debido a la variabilidad de las incubadoras, el grosor de las placas y otros factores de confusión en cada laboratorio, es importante que el tiempo se titule cuidadosamente en cada laboratorio si se planea omitir los puntos de tiempo. Consulte la referencia 44 para obtener una guía completa sobre termotolerancia. - Alternativamente, realice el ensayo de termotolerancia a 34 °C en lugar de 37 °C.
NOTA: La termotolerancia media a 34 ° C ocurre mucho más tarde (10-14 h en este estudio), lo que permite que los ensayos de termotolerancia se preparen a altas horas de la noche (colocados en una incubadora de 34 ° C) y que la puntuación comience temprano al día siguiente. Esto permite ~ 8 h de puntuación continua en lugar del período típico de 12 h requerido para un ensayo de termotolerancia de 37 ° C.
Resultados
C. elegans es un excelente organismo modelo para la investigación del envejecimiento debido a que una gran mayoría de los mecanismos de envejecimiento se conservan con los seres humanos. Es importante destacar que tienen un costo muy bajo en mantenimiento y experimentación con requisitos mínimos de equipos y consumibles, lo que los convierte en un sistema modelo codiciado para instituciones con fondos limitados. Además, una gran cantidad de ensayos simples con curvas de aprendizaje poco profundas los convierte en un excelente sistema incluso para el investigador más joven con poca o ninguna experiencia. Todos estos factores combinados con la poderosa genética de C. elegans , incluida la facilidad de edición del genoma, miles de mutantes y animales transgénicos disponibles a costos nominales, y las bibliotecas de ARNi disponibles para la eliminación genética de prácticamente todos los genes los convierten en un sistema ideal para las instituciones de pregrado. Aquí, se estudian algunos de los métodos de menor costo para estudiar el envejecimiento en C. elegans , centrándose principalmente en ensayos con un costo mínimo de equipo y consumible, así como curvas de aprendizaje poco profundas. De hecho, la totalidad de los protocolos y la recopilación de datos fueron escritos / realizados por investigadores junior con <5 meses de experiencia en investigación, en su mayoría estudiantes de pregrado.
Los estudios de longevidad en C. elegans son muy simples debido a la corta vida útil de los animales, que oscila entre 14 y 20 días. Es importante destacar que los ensayos de vida útil están altamente estandarizados y solo requieren una incubadora, un microscopio de disección estándar, una selección de gusanos estándar y consumibles para preparar placas de agar NGM. Quizás el aspecto más prohibitivo de las mediciones de la vida útil en C. elegans son los consumibles requeridos. Esto se debe a que C. elegans son hermafroditas que se autofertilizan; por lo tanto, los adultos que son rastreados para los ensayos de longevidad deben alejarse de la progenie diariamente. Sin embargo, los animales pueden ser esterilizados exponiéndolos a FUDR o usando mutantes, como el mutante glp-4(bn2) sensible a la temperatura sin línea germinal cultivado a los prohibitivos 25 °C para reducir la cantidad de consumibles requeridos 30,31,32. Aquí, los ensayos de vida útil se realizaron con FUDR o con los mutantes sin línea germinal glp-4 (bn2), que muestran resultados similares a la vida útil estándar realizada en animales no estériles. Si bien la vida útil de tipo salvaje no es idéntica debido a los efectos de FUDR45 o el crecimiento a 25 ° C en la vida útil2, el animal de derribo hsf-1 de corta duración muestra de manera confiable una disminución significativa en la vida útil para todas las condiciones (Figura 1). hsf-1 codifica el factor de transcripción del factor de choque térmico-1, que está involucrado en la regulación de la respuesta al estrés térmico, y su derribo resulta en una disminución significativa de la vida útil38,46.
Si bien la longevidad es un factor importante a considerar en la biología del envejecimiento, a menudo, la longevidad no se correlaciona con el aumento de la salud, incluso en C. elegans47. Por lo tanto, como enfoque complementario, ofrecemos varios métodos para medir la salud del organismo, incluida la salud reproductiva, el comportamiento locomotor y la resiliencia al estrés. La salud reproductiva se puede medir de una de dos maneras. Primero, las mediciones del recuento de óvulos darán una medición directa de cuántos huevos pone un solo hermafrodita autofertilizante. Sin embargo, dado que los animales producen más ovocitos que espermatozoides, también se ponen algunos óvulos no fertilizados que nunca producirían progenie viable48. Por lo tanto, para obtener una mejor comprensión de la verdadera capacidad reproductiva de un animal, las mediciones del tamaño de la cría proporcionan una medida de cuántas crías viables se producen. A menudo, el aumento de la resiliencia al estrés puede disminuir la capacidad reproductiva, potencialmente debido al efecto inherente del estrés percibido en la reproducción49. Del mismo modo, se encuentra una disminución significativa tanto en el número de huevos puestos como en el tamaño de la cría en los animales de sobreexpresión de hsf-1 en comparación con los controles de tipo salvaje (Figura 2A, B). De hecho, algunos animales de sobreexpresión de hsf-1 exhiben esterilidad completa, lo que proporciona evidencia de que la salud reproductiva puede estar inversamente correlacionada con la longevidad.
Si bien la salud reproductiva es importante para comprender la salud de la línea germinal, la meiosis funcional y la capacidad reproductiva, en general, no existe una correlación directa entre la longevidad y el tamaño de la cría50. Por lo tanto, como un enfoque complementario, el comportamiento locomotor se ofrece como un método estándar de oro para el ensayo de la salud de C. elegans durante el envejecimiento51. Hay muchos métodos para medir el comportamiento locomotor, pero la mayoría de los métodos requieren cámaras sofisticadas, software de seguimiento o productos químicos costosos. En contraste, los ensayos de golpeo prácticamente no requieren equipo más allá de lo que un laboratorio estándar de C. elegans está equipado: microscopio de disección, pico de gusano, pipeta y consumibles para hacer placas de agar NGM. Las tasas de golpiza proporcionan un método confiable para medir la salud durante el envejecimiento, medida por una disminución significativa en la golpiza en animales viejos en comparación con animales jóvenes (Figura 2C).
Finalmente, la supervivencia a los ensayos de estrés es una medida fisiológica adicional de la resiliencia. La capacidad de activar las respuestas al estrés generalmente disminuye durante el proceso de envejecimiento, lo que hace que los animales sean menos resistentes y más sensibles al estrés. Por lo tanto, la resiliencia al estrés se puede utilizar como un proxy confiable para la salud del organismo. Aquí, se ofrecen métodos para estudiar la sensibilidad a 1) estrés ER en respuesta a la exposición a la tunicamicina, un agente químico que bloquea la glicosilación ligada a N y da como resultado la acumulación de proteínas mal plegadas en el ER; 2) estrés mitocondrial/ oxidativo a través de la exposición al paraquat, un agente químico que induce la formación de superóxido en las mitocondrias; y 3) estrés térmico a través de la exposición a temperaturas elevadas. Para los ensayos de tunicamicina y paraquat, el fármaco se incorpora a la placa de agar NGM durante la producción de la placa. Para altas concentraciones de tunicamicina, la progenie generalmente no se desarrolla y, por lo tanto, no es necesario utilizar técnicas de esterilización. El protocolo presentado aquí recomienda 25 ng/μL como concentración final de tunicamicina, pero para aquellos con fondos limitados, 10 ng/μL también muestra una reducción significativa en la supervivencia (Figura 3A). Ambas concentraciones limitan el desarrollo de la progenie y, por lo tanto, no se necesitan métodos de esterilización, aunque el control DMSO requerirá una técnica de esterilización o el movimiento de animales a nuevas placas. Esto se debe a que la toxicidad de la tunicamicina previene el desarrollo de la progenie, pero el DMSO es prácticamente no tóxico, lo que permite que la progenie se desarrolle completamente cuando se cultiva con tunicamicina.
Para los ensayos de paraquat, se requiere una técnica de esterilización o movimiento de animales, ya que el tratamiento con paraquat no evita que la progenie se desarrolle hasta la edad adulta. Los altos niveles de paraquat (4 mM) acortan significativamente la vida útil, mientras que los bajos niveles de paraquat (0,25 mM) aumentan la vida útil debido a un efecto hormético (Figura 3B), consistente con los resultados publicados anteriormente52. Finalmente, los ensayos de termotolerancia solo requieren una incubadora que pueda alcanzar los 30-37 ° C, y no se requieren reactivos adicionales. La sobreexpresión de hsf-1 aumenta la termotolerancia a 37 °C (Figura 3C) como se publicó anteriormente53. Sin embargo, como otros han demostrado anteriormente y a partir de los datos actuales, el principal problema con los ensayos de termotolerancia es su variabilidad. Muchos factores pueden contribuir a la variabilidad dentro de los ensayos de termotolerancia, incluidas las diferencias entre las incubadoras y el tiempo que los animales pasan fuera de la incubadora mientras califican la termotolerancia cada hora. Para obtener una guía completa de termotolerancia, consulte la referencia 41.
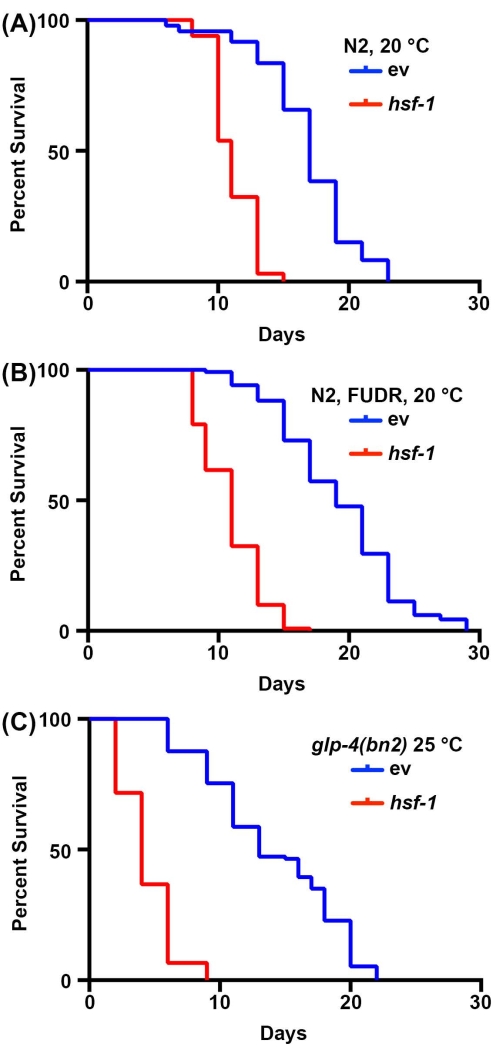
Figura 1: Comparación de las mediciones de la vida útil con y sin esterilización. (A) Vida útil de nematodos N2 de tipo silvestre cultivados en placas de agar NGM sembradas con bacterias RNAi de vector vacío (ev) o hsf-1 a 20 °C. Los animales fueron alejados de la progenie en los días 1, 3, 5 y 7 de la edad adulta. (B) Vida útil de nematodos N2 de tipo silvestre cultivados en placas NGM-agar-FUDR sembradas con bacterias RNAi de vector vacío (ev) o hsf-1 a 20 °C. Los animales crecieron hasta la edad adulta en placas estándar ev o hsf-1 RNAi, y luego se movieron a placas FUDR en el día 1 de la edad adulta. (C) Vida útil de animales mutantes glp-4(bn2) cultivados en placas de agar NGM sembradas con vector vacío (ev) o RNAi hsf-1 a 25 °C. Para todas las condiciones, los animales fueron calificados por muerte cada 2 días hasta que todos los animales fueron registrados como muertos o censurados. Los animales con embolsamiento, protuberancia o explosión de la vulva, o aquellos que se arrastraban por los lados de las placas y se desecaban fueron censurados. Todas las estadísticas se realizaron utilizando las pruebas Log-Rank Mantel-Cox y se pueden encontrar en la Tabla 2. Haga clic aquí para ver una versión más grande de esta figura.
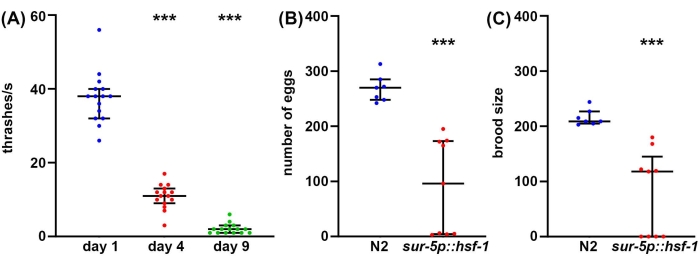
Figura 2: Recuento de huevos, tamaño de cría y golpeo como medidas de salud. (A) Se realizaron ensayos de trillado en animales mutantes glp-4 (bn2) cultivados en placas de agar NGM sembradas con vector vacío a 25 ° C en el día 1 (azul), día 4 (rojo) y día 9 (verde). El thrashing se puntuó en animales colocados en la solución M9 en una placa de agar NGM, el video se grabó con una cámara estándar de teléfono inteligente montada en un ocular de un visor de disección estándar, y el thrashing se puntuó en cámara lenta para mayor precisión. n = 15 animales por condición. (B) Los recuentos de huevos se midieron en animales silvestres de tipo N2 (azul) y sur-5p::hsf-1 (rojo). Los animales se cultivaron a 20 ° C y se trasladaron a platos frescos, y los huevos se contaron cada 12 h. Se sumó el número total de huevos puestos. n = 7 animales para el tipo salvaje y 9 animales para sur-5p::hsf-1. (C) Los ensayos de cría se midieron en los mismos animales que (B) donde los huevos se cultivaron a 20 °C durante 2 días para permitir la eclosión, y se contaron todos los huevos eclosionados. = p < 0,001 calculado mediante pruebas de Mann-Whitney no paramétricas. Cada punto representa un solo animal, y las líneas representan la mediana y el rango intercuartílico. Haga clic aquí para ver una versión más grande de esta figura.
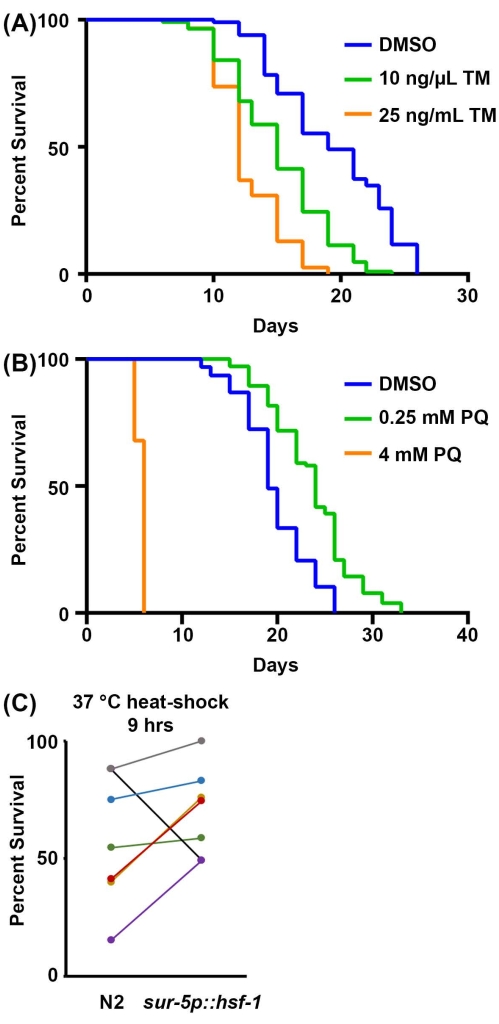
Figura 3: Resiliencia al estrés como sustituto de la salud del organismo. (A) Ensayo de supervivencia de animales N2 cultivados en la bacteria RNAi del vector vacío a 20 °C. Los animales fueron trasladados a placas que contenían 1% de DMSO, 10 ng / μL de tunicamicina (TM) o 25 ng / μL TM en el día 1 de la edad adulta. (B) Ensayo de supervivencia de animales N2 cultivados en el vector vacío de bacterias RNAi a 20 °C. Los animales se cultivaron desde la escotilla en placas que contenían agua, paraquat (PQ) de 0,25 mM o PQ de 4 mM. Para A-B, los animales fueron calificados por muerte cada 2 días hasta que todos los animales fueron registrados como muertos o censurados. Los animales con embolsamiento, protuberancia o explosión de la vulva, o aquellos que se arrastraban por los lados de las placas y se desecaban fueron censurados. Todas las estadísticas se realizaron mediante la prueba Log-Rank Mantel-Cox (Tabla 2). (C) Datos agrupados de todos los ensayos de termotolerancia de 37 °C para animales salvajes de tipo N2 versus sobreexpresión de hsf-1 (sur-5p::hsf-1). Los datos se representan como porcentaje de vida en el tiempo = 9 h de un ensayo de termotolerancia, y cada línea representa un experimento coincidente realizado el mismo día. Los animales se cultivaron en la bacteria RNAi del vector vacío a 20 ° C y se movieron a 37 ° C en el día 1 de la edad adulta para el ensayo. n = 60 animales por cepa por réplica. Haga clic aquí para ver una versión más grande de esta figura.
| Reactivo | Receta | ||
| Solución de lejía | 1,8% (v/v) de hipoclorito de sodio, 0,375 M KOH | ||
| Carbenicilina | Solución madre de 100 mg/ml (1000x) en agua. Conservar a 4 °C durante un máximo de 6 meses o -20 °C para almacenamiento a largo plazo | ||
| FUDR | Solución de 10 mg/ml en agua. Conservar a -20 °C. | ||
| IPTG | 1 M de solución en agua. | ||
| Caldo de lisogenia (LB) | En este protocolo, se utilizó LB comercial (ver Tabla de Materiales), pero todas las recetas caseras estándar de LB que usan Bacto-triptona, extracto de levadura y NaCl son suficientes. | ||
| Solución M9 | 22 mM KH2PO4 monobásico, 42,3 mM Na2HPO4, 85,6 mM NaCl, 1 mM MgSO4 | ||
| Medios de crecimiento de nematodos (NGM) | 1 mM CaCl2, 5 μg/mL de colesterol, 25 mM KPO4 pH 6.0, 1 mM MgSO4, 2% (p/v) de agar, 0.25% (p/v) de Bacto-Peptona, 51.3 mM de NaCl | ||
| Placas de ARNi NGM | 1 mM CaCl2, 5 μg/mL de colesterol, 25 mM KPO4 pH 6.0, 1 mM MgSO4, 2% (p/v) de agar, 0.25% (p/v) de Bacto-Peptona, 51.3 mM de NaCl, 1 mM de IPTG, 100 μg/mL de carbenicilina/ampicilina. Conservar a 4 ° C en la oscuridad durante un máximo de 3 meses | ||
| NGM RNAi DMSO | 1 mM CaCl2, 5 μg/mL de colesterol, 25 mM KPO4 pH 6.0, 1 mM MgSO4, 2% (p/v) de agar, 0.25% (p/v) de Bacto-Peptona, 51.3 mM de NaCl, 1 mM de IPTG, 100 μg/mL de carbenicilina/ampicilina; 1% DMSO | ||
| (control de tunicamicina) | |||
| NGM RNAi TM | 1 mM CaCl2, 5 μg/mL de colesterol, 25 mM KPO4 pH 6.0, 1 mM MgSO4, 2% (p/v) de agar, 0.25% (p/v) de Bacto-Peptona, 51.3 mM de NaCl, 1 mM de IPTG, 100 μg/mL de carbenicilina/ampicilina; 1% DMSO, 25 ng/μL de tunicamicina | ||
| Paraquat | Solución de 400 mM en agua – debe prepararse fresca | ||
| Tetraciclina | Solución madre de 10 mg/ml (500x) en etanol al 100%. Conservar a -20 °C | ||
| Tunicamicina | Solución madre de 2,5 mg/ml en DMSO al 100%. Conservar a -80 °C para su almacenamiento a largo plazo. Esta es una solución 100x (solución de trabajo de 25 ng/μL) | ||
Tabla 1. Recetas para reactivos y medios para protocolos.
| Panel Figura correspondiente | Tensión, Tratamiento | Vida útil media | # Muertes/# Total | p-valor (Log-Rank) | |
| 1A | N2, RNAi vectorial, 20 °C | 17 | 74/120 | -- | |
| N2, hsf-1 RNAi, 20 °C | 11 | 65/120 | <0.001 | ||
| 1B | N2, RNAi vectorial, FUDR, 20 °C | 19 | 120/120 | -- | |
| N2, hsf-1 RNAi, FUDR, 20 °C | 11 | 116/120 | <0.001 | ||
| 1C | N2, glp-4(bn2), vector RNAi, 25 °C | 13 | 115/121 | -- | |
| N2, glp-4(bn2), hsf-1 RNAi, 25 °C | 4 | 120/120 | < 0,001 | ||
| 2A | N2, RNAi vectorial, 20 °C, 1% DMSO | 19 | 85/120 | -- | |
| N2, vector RNAi, 20 °C, 10 ng/μL tunicamicina | 15 | 109/120 | <0.001 | ||
| N2, vector RNAi, 20 °C, 25 ng/μL tunicamicina | 12 | 117/120 | <0.001 | ||
| 2B | N2, RNAi vectorial, 20 °C | 19 | 84/120 | -- | |
| N2, RNAi vectorial, 20 °C, 0,25 mM paraquat | 24 | 91/120 | <0.001 | ||
| N2, RNAi vectorial, 20 °C, paraquat de 4 mM | 6 | 50/120 | <0.001 | ||
Tabla 2. Estadísticas de esperanza de vida y resiliencia al estrés.
Discusión
La esperanza de vida, definida más simplemente como la duración de la vida, es un fenómeno binario claro en la mayoría de los organismos: ya sea que un organismo esté vivo o no lo esté. Sin embargo, la longevidad no siempre se correlaciona con la salud de un organismo. Por ejemplo, los modelos de hormesis mitocondrial donde la exposición al estrés mitocondrial aumenta dramáticamente la vida útil son generalmente algunos de los animales más longevos, sin embargo, exhiben retraso en el crecimiento y disminución de la función metabólica37,54. Del mismo modo, los animales con respuestas de estrés del retículo endoplásmico hiperactivo también exhiben ciertos comportamientos y fenotipos que pueden correlacionarse con una disminución de la salud, a pesar de haber mejorado drásticamente la homeostasis de las proteínas y la vida útil36,49. Finalmente, muchos paradigmas de longevidad en organismos modelo, incluido el aumento de la función HSF-155, el aumento de la función XBP-156 y la señalización alterada de FoxO57, se correlacionan con un mayor riesgo de cáncer, y es indiscutible que la vida útil prolongada no es beneficiosa si un organismo está en una lucha constante contra el cáncer y otras enfermedades de salud. Por lo tanto, la longevidad no puede ser una medida independiente en la biología del envejecimiento.
Por lo tanto, el concepto de healthspan ha sido un campo creciente en la biología del envejecimiento. Healthspan, definido vagamente como el período de la vida en el que uno está sano, es más difícil de determinar que la longevidad. Sin embargo, a diferencia de la longevidad, el concepto de "salud" es complicado, ya que hay muchas lecturas diferentes a la salud del organismo: a nivel del organismo, hay función / fuerza muscular, función neuronal / cognitiva, salud reproductiva, etc.; a nivel celular hay homeostasis proteica, homeostasis lipídica, homeostasis de glucosa, metabolismo, etc. En 2014, los biólogos del envejecimiento han caracterizado definitivamente las características biológicas del envejecimiento con la definición estructurada de que debe ser algo que se descompone naturalmente durante el envejecimiento y puede alterarse experimentalmente de tal manera que la exacerbación experimental debería acelerar el envejecimiento y la intervención experimental debería retrasar el envejecimiento. Estas nueve características del envejecimiento incluyen inestabilidad genómica, desgaste de los telómeros, alteraciones epigenéticas, pérdida de homeostasis de proteínas (proteostasis), agotamiento de células madre, señalización intercelular alterada, disfunción mitocondrial, detección desregulada de nutrientes y senescencia celular58. Desde entonces, numerosos estudios argumentan que se deben incluir otros factores, incluidas las proteínas extracelulares y la fisiología sistémica como la inmunidad y la inflamación59. En última instancia, la compleja definición de healthspan exige que la salud de los organismos se mida utilizando múltiples métodos diferentes.
Por lo tanto, en este manuscrito, se presentan múltiples métodos para medir diversos aspectos de la salud utilizando el modelo de nematodos, C. elegans. Evaluamos el comportamiento locomotor utilizando ensayos de golpeo, la salud reproductiva utilizando el recuento de huevos y el tamaño de la cría, y la sensibilidad al estrés. De hecho, el comportamiento locomotor es un método estándar de oro para medir la salud, ya que los organismos exhiben una pérdida significativa de motilidad y movimiento durante el envejecimiento51. La pérdida del comportamiento locomotor puede atribuirse a múltiples características del envejecimiento, ya que la función muscular en C. elegans depende de la proteostasis adecuada60, la disfunción mitocondrial61 y la señalización neuron-muscular62. Si bien este manuscrito se centra en una medición del comportamiento locomotor, es importante tener en cuenta que existen muchos otros métodos, incluida la motilidad de los animales en una placa de agar sólido, la respuesta al tacto51 y los ensayos de quimiotaxis63. Sin embargo, estos métodos generalmente requieren dispositivos de grabación más sofisticados, el uso de software de seguimiento de gusanos o el uso de productos químicos caros, peligrosos o volátiles, todo lo cual puede ser prohibitivo en algunos entornos de investigación.
Además, los ensayos para el recuento de huevos y el tamaño de la cría se presentan como un método para medir la salud reproductiva y como el método más simple para medir la división celular en gusanos adultos, ya que los gusanos adultos son postmitóticos y solo las células germinales y los embriones se someten a la división celular dentro de un gusano adulto64. Como medida de la división celular, la salud reproductiva puede ser relevante para las características del envejecimiento de la senescencia celular y el agotamiento de las células madre. La salud reproductiva puede verse afectada por muchos factores, incluida la infección patógena65 o la exposición al estrés49, aunque no existe una correlación directa entre la salud reproductiva y la longevidad. De hecho, algunos animales longevos exhiben una disminución significativa en el tamaño de la cría49, e incluso es posible que exista una correlación inversa entre la longevidad y el tamaño de la cría50. Este no es un fenómeno específico de C. elegans, ya que los efectos perjudiciales de la reproducción sobre la longevidad se han observado durante mucho tiempo en humanos66, perros de compañía67 y ratones68. Aún así, proporcionamos el recuento de huevos y el tamaño de la cría como un método confiable y de bajo costo para medir la salud reproductiva con la advertencia de que la salud reproductiva puede no correlacionarse con la longevidad o la duración de la salud.
Finalmente, los ensayos de supervivencia se ofrecen como una medida indirecta de la salud del organismo. Es importante destacar que las respuestas al estrés celular, incluida la respuesta al estrés térmico69 y al estrés ER35, disminuyen rápidamente durante el proceso de envejecimiento y tienen una relevancia directa con el sello de envejecimiento de la proteostasis70,71. Por el contrario, las respuestas de estrés hiperactivantes pueden aumentar significativamente la esperanza de vida al promover la resiliencia al estrés 35,37,38. Si bien este estudio se centra en los métodos más simples y de menor costo, existe un gran número de métodos alternativos para los ensayos de resiliencia al estrés para la termotolerancia41 y el estrés oxidativo66, cada uno de los cuales requiere un conjunto diferente de equipos y consumibles. Más allá de los simples estudios de exposición a factores estresantes, se pueden realizar otros métodos fisiológicos dependiendo del acceso al equipo. Por ejemplo, un analizador de flujo extracelular puede monitorear la función mitocondrial y la respiración celular73; los microscopios de disección fluorescentes permitirán mediciones de reporteros transcripcionales para la activación de la respuesta al estrés20; y se pueden utilizar microscopios compuestos o confocales de alta resolución para medir la morfología de los orgánulos con sondas fluorescentes para las mitocondrias74, el retículo endoplásmico75,76 y el citoesqueleto de actina77.
Como una advertencia final para las mediciones de la longevidad, si bien se ofrecen métodos químicos y genéticos para esterilizar gusanos para disminuir significativamente el costo, es importante tener en cuenta que ambos pueden afectar directamente la vida útil. Por ejemplo, se ha informado previamente que la exposición a FUDR afecta tanto la vida útil como la termotolerancia45. Y mientras que el mutante glp-4 (bn2) en sí mismo no tiene ningún efecto directo sobre la vida útil, el crecimiento a 25 ° C es un estrés por calor leve33,34 y, por lo tanto, puede afectar la vida útil2. Existen otros métodos para esterilizar C. elegans, incluida la esterilidad mediada por auxina78 o mutantes alternativos con deficiencia de espermatozoides sensibles a la temperatura79. Sin embargo, todos los métodos tienen algunas advertencias, y se debe tener cuidado de utilizar el ensayo menos perjudicial para las necesidades científicas de cada laboratorio. Una limitación final de los estudios de longevidad es la variabilidad potencial que puede ocurrir debido a los bajos tamaños de la muestra o simplemente por un error objetivo del investigador. Esto se puede eludir a medida que nacen nuevas tecnologías en tecnologías de vida útilautomatizadas 80, pero nuevamente estos sistemas son costosos y requieren algunos equipos y habilidades de ingeniería y computacionales. En última instancia, la colección de métodos proporcionados aquí es un conjunto confiable de herramientas que se pueden adaptar y aprender rápidamente en casi cualquier institución y proporcionar una base sólida para la biología del envejecimiento.
Divulgaciones
Los autores no declaran intereses financieros contrapuestos.
Agradecimientos
G.G. es compatible con T32AG052374 y R.H.S. es compatible con R00AG065200 del Instituto Nacional sobre el Envejecimiento. Agradecemos al CGC (financiado por la Oficina de Investigación del Programa de Infraestructura de Investigación P40 OD010440 de los NIH) por las cepas.
Materiales
| Name | Company | Catalog Number | Comments |
| APEX IPTG | Genesee | 18-242 | for RNAi |
| Bacto Agar | VWR | 90000-764 | for NGM plates |
| Bacto Peptone | VWR | 97064-330 | for NGM plates |
| Calcium chloride dihydrate | VWR | 97061-904 | for NGM plates |
| Carbenicillin | VWR | 76345-522 | for RNAi |
| Cholesterol | VWR | 80057-932 | for NGM plates |
| DMSO | VWR | BDH1115-1LP | solvent for drugs |
| LB Broth | VWR | 95020-778 | for LB |
| Magnesium sulfate heptahydrate | VWR | 97062-132 | for NGM plates, M9 |
| Paraquat | Sigma-Aldrich | 36541 | for oxidative/mitochondrial stress |
| Potassium Chloride | VWR | 97061-566 | for bleach soluton |
| Potassium phosphate dibasic | VWR | EM-PX1570-2 | for NGM plates |
| Potassium phosphate monobasic | VWR | EM-PX1565-5 | for M9 |
| S7E Dissecting Scope | Leica | 10450840 | Standard dissecting microscope |
| Sodium Chloride | VWR | EM-SX0420-5 | for NGM plates, M9 |
| Sodium hypochlorite | VWR | RC7495.7-32 | for bleach solution |
| Sodium phosphate dibasic | VWR | 71003-472 | for M9 |
| Tetracycline hydrochloride | VWR | 97061-638 | for RNAi |
| Tunicamycin | Sigma-Aldrich | T7765-50MG | for ER stress |
Referencias
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Klass, M. R. Aging in the nematode Caenorhabditis elegans: major biological and environmental factors influencing life span. Mechanisms of Ageing and Development. 6 (6), 413-429 (1977).
- Friedman, D. B., Johnson, T. E. A mutation in the age-1 gene in Caenorhabditis elegans lengthens life and reduces hermaphrodite fertility. Genetics. 118 (1), 75-86 (1988).
- Kenyon, C., Chang, J., Gensch, E., Rudner, A., Tabtiang, R. A C. elegans mutant that lives twice as long as wild type. Nature. 366 (6454), 461-464 (1993).
- Lithgow, G. J., White, T. M., Melov, S., Johnson, T. E. Thermotolerance and extended life-span conferred by single-gene mutations and induced by thermal stress. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7540-7544 (1995).
- Epel, E. S., Lithgow, G. J. Stress biology and aging mechanisms: toward understanding the deep connection between adaptation to stress and longevity. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 69, 10-16 (2014).
- Luo, Y. Long-lived worms and aging. Redox Report: Communications in Free Radical Research. 9 (2), 65-69 (2004).
- Tissenbaum, H. A. Using C. elegans for aging research. Invertebrate Reproduction & Development. 59, 59-63 (2015).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Frontiers in Endocrinology. 11, 554994 (2020).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Rual, J. -. F., et al. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Research. 14 (10), 2162-2168 (2004).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Reboul, J., et al. Open-reading-frame sequence tags (OSTs) support the existence of at least 17,300 genes in C. elegans. Nature Genetics. 27 (3), 332-336 (2001).
- Lee, S. S., et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nature Genetics. 33 (1), 40-48 (2003).
- Reinke, S. N., Hu, X., Sykes, B. D., Lemire, B. D. Caenorhabditis elegans diet significantly affects metabolic profile, mitochondrial DNA levels, lifespan and brood size. Molecular Genetics and Metabolism. 100 (3), 274-282 (2010).
- Revtovich, A. V., Lee, R., Kirienko, N. V. Interplay between mitochondria and diet mediates pathogen and stress resistance in Caenorhabditis elegans. PLOS Genetics. 15 (3), 1008011 (2019).
- Pang, S., Curran, S. P. Adaptive capacity to bacterial diet modulates aging in C. elegans. Cell Metabolism. 19 (2), 221-231 (2014).
- Brooks, K. K., Liang, B., Watts, J. L. The influence of bacterial diet on fat storage in C. elegans. PLOS ONE. 4 (10), 7545 (2009).
- Soukas, A. A., Kane, E. A., Carr, C. E., Melo, J. A., Ruvkun, G. Rictor/TORC2 regulates fat metabolism, feeding, growth, and life span in Caenorhabditis elegans. Genes & Development. 23 (4), 496-511 (2009).
- Bar-Ziv, R., et al. Measurements of physiological stress responses in C. Elegans. Journal of Visualized Experiments: JoVE. (159), e61001 (2020).
- Xiao, R., et al. RNAi interrogation of dietary modulation of development, metabolism, behavior, and aging in C. elegans. Cell Reports. 11 (7), 1123-1133 (2015).
- Calixto, A., Chelur, D., Topalidou, I., Chen, X., Chalfie, M. Enhanced neuronal RNAi in C. elegans using SID-1. Nature Methods. 7 (7), 554-559 (2010).
- Dickinson, D. J., Goldstein, B. CRISPR-based methods for Caenorhabditis elegans genome engineering. Genetics. 202 (3), 885-901 (2016).
- Kim, H. -. M., Colaiácovo, M. P. CRISPR-Cas9-guided genome engineering in C. elegans. Current Protocols in Molecular Biology. 129 (1), 106 (2019).
- Farboud, B., Severson, A. F., Meyer, B. J. Strategies for efficient genome editing using CRISPR-Cas9. Genetics. 211 (2), 431-457 (2019).
- Transformation and Microinjection. WormBook: The Online Review of C. elegans Biology Available from: https://www.ncbi.nlm.nih.gov/books/NBK19648/ (2006)
- Frøkjaer-Jensen, C., et al. Single-copy insertion of transgenes in Caenorhabditis elegans. Nature Genetics. 40 (11), 1375-1383 (2008).
- Kaymak, E., et al. Efficient generation of transgenic reporter strains and analysis of expression patterns in Caenorhabditis elegans using Library MosSCI. Developmental Dynamics: an Official Publication of the American Association of Anatomists. 245 (9), 925-936 (2016).
- Mariol, M. -. C., Walter, L., Bellemin, S., Gieseler, K. A rapid protocol for integrating extrachromosomal arrays with high transmission rate into the C. elegans genome. Journal of Visualized Experiments: JoVE. (82), (2013).
- Rastogi, S., et al. Caenorhabditis elegans glp-4 encodes a valyl aminoacyl tRNA synthetase. G3: Genes|Genomes|Genetics. 5 (12), 2719-2728 (2015).
- Beanan, M. J., Strome, S. Characterization of a germ-line proliferation mutation in C. elegans. Development. 116 (3), 755-766 (1992).
- Santi, D. V., McHenry, C. S. 5-Fluoro-2′-Deoxyuridylate: covalent complex with thymidylate synthetase. Proceedings of the National Academy of Sciences. 69 (7), 1855-1857 (1972).
- Lithgow, G. J., White, T. M., Hinerfeld, D. A., Johnson, T. E. Thermotolerance of a long-lived mutant of Caenorhabditis elegans. Journal of Gerontology. 49 (6), 270-276 (1994).
- Labbadia, J., Morimoto, R. I. The biology of proteostasis in aging and disease. Annual Review of Biochemistry. 84 (1), 435-464 (2015).
- Taylor, R. C., Dillin, A. XBP-1 is a cell-nonautonomous regulator of stress resistance and longevity. Cell. 153 (7), 1435-1447 (2013).
- Higuchi-Sanabria, R., et al. Divergent nodes of non-autonomous UPRER signaling through serotonergic and dopaminergic neurons. Cell Reports. 33 (10), 108489 (2020).
- Durieux, J., Wolff, S., Dillin, A. The cell-non-autonomous nature of electron transport chain-mediated longevity. Cell. 144 (1), 79-91 (2011).
- Morley, J. F., Morimoto, R. I. Regulation of longevity in Caenorhabditis elegans by heat shock factor and molecular chaperones. Molecular Biology of the Cell. 15 (2), 657-664 (2004).
- Heifetz, A., Keenan, R. W., Elbein, A. D. Mechanism of action of tunicamycin on the UDP-GlcNAc:dolichyl-phosphate Glc-NAc-1-phosphate transferase. Biochemistry. 18 (11), 2186-2192 (1979).
- Castello, P. R., Drechsel, D. A., Patel, M. Mitochondria are a major source of paraquat-induced reactive oxygen species production in the brain. The Journal of Biological Chemistry. 282 (19), 14186-14193 (2007).
- Park, H. -. E. H., Jung, Y., Lee, S. -. J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Gardner, M., Rosell, M., Myers, E. M. Measuring the effects of bacteria on C. Elegans behavior using an egg retention assay. Journal of Visualized Experiments: JoVE. (80), e51203 (2013).
- Waggoner, L. E., Hardaker, L. A., Golik, S., Schafer, W. R. Effect of a neuropeptide gene on behavioral states in Caenorhabditis elegans egg-laying. Genetics. 154 (3), 1181-1192 (2000).
- Zevian, S. C., Yanowitz, J. L. Methodological considerations for heat shock of the nematode Caenorhabditis elegans. Methods. 68 (3), 450-457 (2014).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset). PLOS ONE. 9 (1), 85964 (2014).
- Hsu, A. -. L., Murphy, C. T., Kenyon, C. Regulation of aging and age-related disease by DAF-16 and heat-shock factor. Science. 300 (5622), 1142-1145 (2003).
- Bansal, A., Zhu, L. J., Yen, K., Tissenbaum, H. A. Uncoupling lifespan and healthspan in Caenorhabditis elegans longevity mutants. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 277-286 (2015).
- Hodgkin, J., Barnes, T. M. More is not better: brood size and population growth in a self-fertilizing nematode. Proceedings. Biological Sciences. 246 (1315), 19-24 (1991).
- Ozbey, N. P., et al. Tyramine Acts Downstream of Neuronal XBP-1s to coordinate inter-tissue UPRER activation and behavior in C. elegans. Developmental Cell. 55 (6), 754-770 (2020).
- Lee, Y., et al. Inverse correlation between longevity and developmental rate among wild C. elegans strains. Aging. 8 (5), 986-994 (2016).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature Methods. 8 (7), 592-598 (2011).
- Lee, S. -. J., Hwang, A. B., Kenyon, C. Inhibition of respiration extends C. elegans life span via reactive oxygen species that increase HIF-1 activity. Current Biology: CB. 20 (23), 2131-2136 (2010).
- Baird, N. A., et al. HSF-1-mediated cytoskeletal integrity determines thermotolerance and life span. Science. 346 (6207), 360-363 (2014).
- Houtkooper, R. H., et al. Mitonuclear protein imbalance as a conserved longevity mechanism. Nature. 497 (7450), 451-457 (2013).
- Carpenter, R. L., Gökmen-Polar, Y. HSF1 as a cancer biomarker and therapeutic target. Current Cancer Drug Targets. 19 (7), 515-524 (2019).
- Chen, S., et al. The emerging role of XBP1 in cancer. Biomedicine & Pharmacotherapy. 127, 110069 (2020).
- Yadav, R. K., Chauhan, A. S., Zhuang, L., Gan, B. FoxO transcription factors in cancer metabolism. Seminars in Cancer Biology. 50, 65-76 (2018).
- López-Otín, C., Blasco, M. A., Partridge, L., Serrano, M., Kroemer, G. The hallmarks of aging. Cell. 153 (6), 1194-1217 (2013).
- Kennedy, B. K., et al. Geroscience: linking aging to chronic disease. Cell. 159 (4), 709-713 (2014).
- Ben-Zvi, A., Miller, E. A., Morimoto, R. I. Collapse of proteostasis represents an early molecular event in Caenorhabditis elegans aging. Proceedings of the National Academy of Sciences. 106 (35), 14914-14919 (2009).
- Hewitt, J. E., et al. Muscle strength deficiency and mitochondrial dysfunction in a muscular dystrophy model of Caenorhabditis elegans and its functional response to drugs. Disease Models & Mechanisms. 11 (12), (2018).
- Gao, S., Zhen, M. Action potentials drive body wall muscle contractions in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 108 (6), 2557-2562 (2011).
- Margie, O., Palmer, C., Chin-Sang, I. C. elegans chemotaxis assay. Journal of Visualized Experiments: JoVE. (74), e50069 (2013).
- Flemming, A. J., Shen, Z. Z., Cunha, A., Emmons, S. W., Leroi, A. M. Somatic polyploidization and cellular proliferation drive body size evolution in nematodes. Proceedings of the National Academy of Sciences of the United States of America. 97 (10), 5285-5290 (2000).
- Madhu, B. J., Salazar, A. E., Gumienny, T. L. Caenorhabditis elegans egg-laying and brood-size changes upon exposure to Serratia marcescens and Staphylococcus epidermidis are independent of DBL-1 signaling. microPublication Biology. 2019, (2019).
- Westendorp, R. G., Kirkwood, T. B. Human longevity at the cost of reproductive success. Nature. 396 (6713), 743-746 (1998).
- Hoffman, J. M., Creevy, K. E., Promislow, D. E. L. Reproductive capability is associated with lifespan and cause of death in companion dogs. PLOS ONE. 8 (4), 61082 (2013).
- Garratt, M., Try, H., Smiley, K. O., Grattan, D. R., Brooks, R. C. Mating in the absence of fertilization promotes a growth-reproduction versus lifespan trade-off in female mice. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15748-15754 (2020).
- Labbadia, J., Morimoto, R. I. Repression of the heat shock response is a programmed event at the onset of reproduction. Molecular Cell. 59 (4), 639-650 (2015).
- Higuchi-Sanabria, R., Frankino, P. A., Paul, J. W., Tronnes, S. U., Dillin, A. A futile battle? Protein quality control and the stress of aging. Developmental Cell. 44 (2), 139-163 (2018).
- Dutta, N., Garcia, G., Higuchi-Sanabria, R. Hijacking cellular stress responses to promote lifespan. Frontiers in Aging. 3, (2022).
- Senchuk, M. M., Dues, D. J., Van Raamsdonk, J. M. Measuring oxidative stress in Caenorhabditis elegans: paraquat and juglone sensitivity assays. Bio-protocol. 7 (1), 2086 (2017).
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: mitochondrial function using the seahorse system. Methods in molecular biology. 1710, 285-293 (2018).
- Daniele, J. R., et al. High-throughput characterization of region-specific mitochondrial function and morphology. Scientific Reports. 7 (1), 6749 (2017).
- Xu, N., et al. The FATP1-DGAT2 complex facilitates lipid droplet expansion at the ER-lipid droplet interface. The Journal of Cell Biology. 198 (5), 895-911 (2012).
- Daniele, J. R., et al. UPRER promotes lipophagy independent of chaperones to extend life span. Science Advances. 6 (1), 1441 (2020).
- Higuchi-Sanabria, R., et al. Spatial regulation of the actin cytoskeleton by HSF-1 during aging. Molecular Biology of the Cell. 29 (21), 2522-2527 (2018).
- Kasimatis, K. R., Moerdyk-Schauwecker, M. J., Phillips, P. C. Auxin-mediated sterility induction system for longevity and mating studies in Caenorhabditis elegans. G3: Genes|Genomes|Genetics. 8 (8), 2655-2662 (2018).
- Fabian, T. J., Johnson, T. E. Production of age-synchronous mass cultures of Caenorhabditis elegans. Journal of Gerontology. 49 (4), 145-156 (1994).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados