Method Article
Desarrollo de un modelo de rata con suspensión del ligamento uterosacro
En este artículo
Resumen
El prolapso de órganos pélvicos afecta a millones de mujeres en todo el mundo y, sin embargo, algunas intervenciones quirúrgicas comunes tienen tasas de fracaso de hasta el 40%. La falta de modelos animales estándar para investigar esta condición impide el progreso. Proponemos el siguiente protocolo como modelo para la suspensión del ligamento uterosacro y la prueba de tracción in vivo .
Resumen
El prolapso de órganos pélvicos (POP) es un trastorno común del suelo pélvico (PFD) con el potencial de afectar significativamente la calidad de vida de una mujer. Aproximadamente del 10% al 20% de las mujeres se someten a cirugía de reparación del piso pélvico para tratar el prolapso en los Estados Unidos. Los casos de PFD resultan en un costo anual total de $ 26.3 mil millones solo en los Estados Unidos. Esta condición multifactorial tiene un impacto negativo en la calidad de vida y, sin embargo, las opciones de tratamiento solo han disminuido en el pasado reciente. Una opción quirúrgica común es la suspensión del ligamento uterosacro (USLS), que generalmente se realiza fijando la bóveda vaginal al ligamento uterosacro en la pelvis. Esta reparación tiene una menor incidencia de complicaciones en comparación con aquellos con aumento de malla, pero es notable por una tasa de fracaso relativamente alta de hasta el 40%. Teniendo en cuenta la falta de modelos animales estándar para estudiar la disfunción del suelo pélvico, existe una necesidad clínica urgente de innovación en este campo con un enfoque en el desarrollo de modelos animales rentables y accesibles. En este manuscrito, describimos un modelo de rata de USLS que implica una histerectomía completa seguida de la fijación de la bóveda vaginal restante al ligamento uterosacro. El objetivo de este modelo es imitar el procedimiento realizado en mujeres para poder utilizar el modelo para luego investigar estrategias reparadoras que mejoren la integridad mecánica de la fijación del ligamento. Es importante destacar que también describimos el desarrollo de un procedimiento de prueba de tracción in situ para caracterizar la integridad de la interfaz en los puntos de tiempo elegidos después de la intervención quirúrgica. En general, este modelo será una herramienta útil para futuros estudios que investiguen las opciones de tratamiento para la reparación de POP a través de USLS.
Introducción
El prolapso de órganos pélvicos (POP) es un trastorno común del suelo pélvico que afecta a millones de mujeres en todo el mundo con el potencial de afectar significativamente muchos aspectos de la vida de una mujer, particularmente con la edad de1 año. En particular, aproximadamente el 13% de las mujeres en los Estados Unidos se someterán a cirugía por prolapso o incontinencia urinaria2. Una condición más común después del embarazo y el parto, el prolapso se caracteriza por el descenso de los órganos pélvicos, predominantemente los diversos compartimentos de la vagina y / o el útero, más allá de su posición normal en la cavidad peritoneal. Esto conduce a síntomas molestos de protuberancia o presión vaginal, intestino, vejiga y disfunción sexual, y reducción general de la calidad de vida. Otros factores de riesgo para el POP incluyen obesidad, consumo de tabaco, tos crónica y estreñimiento3.
En mujeres sanas, los órganos del suelo pélvico están soportados por los músculos elevadores del ano, los ligamentos uterosacros (USL), los ligamentos cardinales, las uniones del tejido conectivo a la pared lateral pélvica y las estructuras distales del cuerpo perineal 4,5. Las USL se encuentran entre las estructuras de soporte apical más importantes tanto para el útero como para la vagina apical, y por lo tanto, se usan a menudo en la corrección quirúrgica del POP (Figura 1). El soporte estructural de la USL proviene del denso tejido conectivo colágeno en la región sacra que se transforma en músculo liso estrechamente empaquetado. Debido a este gradiente composicional, la USL se entrelaza con la musculatura uterina y vaginal para proporcionar un soporte robusto para los órganos pélvicos 6,7. En la suspensión del ligamento uterosacro (USLS), las USL se aseguran a la bóveda vaginal después de una histerectomía, restaurando la vagina y las estructuras circundantes a su posición anatómica en el compartimiento abdominal. Sin embargo, independientemente de la vía transvaginal o laparoscópica, el procedimiento USLS está plagado de una tasa de fracaso relativamente alta de hasta 40% en algunos estudios 8,9. La tasa de recurrencia de síntomas molestos de protuberancias vaginales a los 5 años después de la reparación para el prolapso del compartimiento apical, como las USL, fue de aproximadamente 40% en un gran ensayo controlado aleatorizado multicéntrico9. En el mismo ensayo, el retratamiento para el prolapso recurrente a los 5 años fue de aproximadamente 10%. El mecanismo de esta alta tasa de fracaso no se ha estudiado, pero restaurar la vagina y las estructuras circundantes a su posición anatómica requiere la colocación de suturas en la región densa de colágeno de la USL10,11 en lugar de la región del músculo liso. Por lo tanto, la alta tasa de fracaso podría deberse al desajuste mecánico y de composición de la interfaz vagina-USL formada quirúrgicamente en comparación con la integración completa observada en el accesorio cervical-USL nativo.
El impacto económico del tratamiento de estos trastornos también es notable, con aproximadamente $ 300 millones gastados anualmente en los Estados Unidos en atención ambulatoria12, y más de $ 1 mil millones gastados anualmente en costos directos para procedimientos quirúrgicos13. A pesar de los vastos recursos económicos dedicados al tratamiento de estas afecciones, las complicaciones derivadas de muchas cirugías de prolapso siguen siendo desalentadoras. Por ejemplo, las reparaciones del prolapso apical basadas en malla de polipropileno, como la sacrocolpopexia, ofrecen mayores tasas de éxito en comparación con las reparaciones de tejidos nativos14, pero a costa de complicaciones potenciales como la exposición a la malla o la erosión. La FDA recibió casi 3,000 quejas relacionadas con complicaciones de malla solo entre 2008 y 2010. Esto culminó en una orden de la FDA para detener la fabricación y venta de todos los productos de malla colocados transvaginalmente para POP en abril de 201915. Por lo tanto, existe una fuerte necesidad clínica de materiales distintos del polipropileno, y modelos con los que probarlos, que puedan aumentar las reparaciones del prolapso del tejido nativo y aumentar las tasas de éxito en comparación con las técnicas tradicionales con sutura sola.
Desde el anuncio de la FDA en 2019, la mayoría de los cirujanos pélvicos han dejado de usar malla colocada transvaginalmente para las reparaciones del prolapso, lo que llevó a los investigadores a buscar nuevos enfoques de ingeniería de tejidos para aumentar las reparaciones de tejidos nativos16,17,18 como con las células del estroma mesenquimal (MSC)9,20 . Con este cambio de enfoque, existe una necesidad urgente de refinar los modelos animales que puedan ayudar con el desarrollo de nuevos materiales; El desafío en este proceso es equilibrar la relevancia clínica con el costo. Con este fin, la ciencia básica y los investigadores clínicos que estudian el prolapso de órganos pélvicos han aprovechado varios modelos animales hasta el momento, incluyendo ratas, ratones, conejos, ovejas, cerdos y primates no humanos19. El proceso de identificación de un modelo animal óptimo es un desafío, ya que los humanos son bípedos, no tienen cola y tienen un proceso de nacimiento traumático en comparación con otras especies de mamíferos20. Los cerdos21 se han utilizado para simular la sacrocolpopexia robótica, mientras que las ovejas se han utilizado para simular reparaciones del prolapso vaginal22. Estos modelos animales, aunque clínicamente relevantes, están limitados en viabilidad por el costo y el mantenimiento. Se han utilizado primates no humanos para estudiar la patogénesis del prolapso; Los monos ardilla en particular son una de las únicas especies, aparte de los humanos, que pueden desarrollar prolapso espontáneo, lo que los convierte en uno de los modelos animales más relevantes20. Los primates no humanos también se han utilizado para estudiar procedimientos quirúrgicos ginecológicos como la sacrocolpopexia23 y el trasplante uterino24. Al igual que sus homólogos ovinos y porcinos, la principal limitación de los primates no humanos como modelo animal de prolapso es el costo de mantenimiento, cuidado y alojamiento19.
Aunque la pelvis de los roedores está orientada horizontalmente con una relación mucho menor entre el tamaño del canal de cabeza a nacimiento en comparación con los humanos19, las ratas son adecuadas para estudios con animales pequeños de la cirugía USLS, ya que tienen anatomía, celularidad, arquitectura histológica y composición de matriz similares en comparación con la USL25 humana. Además, son beneficiosos en términos de mantenimiento y embarque. A pesar de estos atributos beneficiosos, no hay informes publicados de un modelo de rata de reparación de USLS. Por lo tanto, el objetivo es describir un protocolo para histerectomía y USLS en la rata Lewis multípara. Este protocolo será beneficioso para los investigadores que tienen como objetivo estudiar la fisiopatología y los componentes quirúrgicos de POP utilizando este modelo animal accesible.
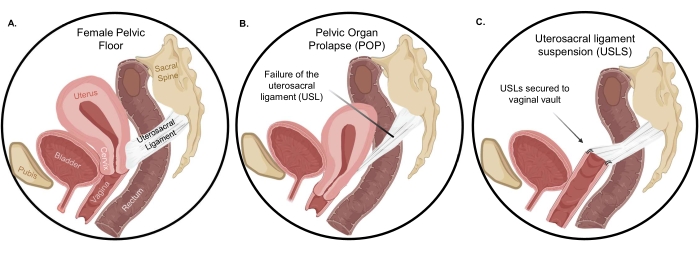
Figura 1: Prolapso de órganos pélvicos . (A) La orientación normal de los órganos en la cavidad peritoneal y (B) la dramática descensión de órganos cuando ocurre el prolapso. Después de la histerectomía, (C) la suspensión del ligamento uterosacro restaura la vagina y las estructuras circundantes a su posición anatómica adecuada. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Siga todas las pautas del Comité Institucional de Cuidado y Uso de Animales (IACUC), obteniendo la aprobación para todos los procedimientos con animales antes de comenzar. Los requisitos para la técnica de cirugía aséptica se pueden encontrar en la Guía26 y el Reglamento de Bienestar Animal27. El estudio fue aprobado por el protocolo número 4332-11-20 del Comité Institucional de Cuidado y Uso de Animales de la Universidad de Virginia. Obtener criadoras multíparas (dos camadas). Las ratas deben ser alojadas en un vivero acreditado por la Asociación Americana para la Acreditación del Cuidado de Animales de Laboratorio y provistas de alimentos y agua ad libitum. Los animales en este estudio eran ratas Lewis obtenidas del río Charles y tenían entre 4 y 6 meses de edad para adaptarse al requisito de dos camadas. Los animales se mantuvieron en un ciclo de luz-oscuridad de 12 h.
1. Reparación del prolapso de órganos pélvicos mediante suspensión del ligamento uterosacro
- Preparación del equipo y del área quirúrgica para la cirugía de animales vivos
- Prepare el área quirúrgica de tal manera que la placa quirúrgica se caliente a 37 ° C utilizando almohadillas térmicas de recirculación de agua caliente junto con una almohadilla impermeable estéril. Asegure la esterilidad de la placa quirúrgica y el área quirúrgica utilizando un desinfectante de superficies sin lejía seguido de una toallita con etanol al 70%.
- Use esterilización por calor en autoclave para esterilizar todos los suministros seguros para autoclaves, incluidos instrumentos quirúrgicos, esponjas quirúrgicas (gasa), hisopos de algodón y una cortina desechable. Obtenga guantes quirúrgicos empaquetados estériles.
- Obtenga cortapelos eléctricos, ungüento oftálmico, toallitas de etanol, hisopos de algodón y solución de yodo, junto con una hoja de bisturí y suturas estéril empaquetadas, y colóquelos en el banco de trabajo.
- Preparación de animales para cirugía de animales vivos
- Coloque cuidadosamente al animal en una cámara de anestesia suministrada con isoflurano al 2% y pese al animal después de alcanzar el plano adecuado de anestesia. La anestesia adecuada se confirma cuando el animal no responde a un pellizco en el dedo del pie.
- Coloque al animal en la tabla de cirugía en posición prona con la nariz firmemente en el cono de anestesia suministrado con isoflurano al 2%. Aplicar ungüento oftálmico en cada uno de los ojos de los animales.
- Administrar analgésico opioide y analgésico AINE por vía subcutánea (Tabla de materiales).
- Coloque al animal en posición supina, como se muestra en la Figura 2, y afeite el pelaje abdominal desde el proceso xifoideo hasta el orificio uretral (8 cm x 4 cm). Esterilice el abdomen con tres cargas de yodo y alcohol para preparar el sitio de la incisión.
NOTA: Si el afeitado resulta en sangrado, logre la hemostasia con presión antes de preparar la piel con yodo y almohadilla de preparación con alcohol. Mantener el yodo en la piel durante 30 s. - Si no hay un asistente quirúrgico disponible, deposite los suministros e instrumentos estériles en una bandeja de instrumentos estéril, incluidos hisopos de algodón estériles, cortinas, esponjas (gasa), cuchilla quirúrgica, suturas y marcador quirúrgico (opcional). Si hay un asistente quirúrgico disponible, entonces este paso puede omitirse, y el asistente puede proporcionar los instrumentos estériles siguiendo el paso 1.3.1.
- Histerectomía y suspensión del ligamento uterosacro (USLS)
- Póngase una bata quirúrgica, cubierta para la cabeza, máscara y guantes estériles. Cubra al animal con un campo estéril, dejando solo el abdomen expuesto.
- Haga una incisión de 7 cm por la línea alba desde justo debajo del proceso xifoide hasta la línea inferior del pezón con una cuchilla de bisturí. La incisión debe terminar ~0.5-1.0 cm rostral desde el orificio uretral. Luego, haga una incisión a través de la capa muscular debajo. Evite el vaso sanguíneo de la pared abdominal para prevenir el sangrado.
- Ensamble el retractor abdominal e inspeccione la cavidad abdominal (Figura 3A). Con pinzas para iris, localice suavemente el cuerno uterino izquierdo. El útero está en lo profundo del intestino, que a menudo es la estructura que se encuentra por primera vez al entrar en la cavidad peritoneal. Es beneficioso identificar primero el ovario (Figura 3B) y la almohadilla de grasa ovárica asociada.
- Eleve suavemente el cuerno uterino izquierdo con un pinza de agarre o pinza de mosquito y comience la histerectomía ligando el cuerno debajo del ovario y el oviducto con una pinza de mosquito. Los ovarios son estructuras delicadas y se dañan o desvascularizan fácilmente con manipulación. Tenga cuidado al elevar los cuernos uterinos; Agarre el cuerno a una distancia segura del ovario para lograr esto.
- Continúe la histerectomía sujetando y recortando la vasculatura adyacente, el tejido conectivo y la grasa del cuerno uterino con microtijeras. Sujete el tejido conectivo antes de retirarlo para reducir el sangrado. Coloque las pinzas lo más cerca posible de la interfaz uterina, hasta la unión uterocervical (también denominada bifurcación del cuerno).
- Sujete a través del cuerno uterino cerca del punto de bifurcación usando pinzas para mosquitos (Figura 4A-C). Extirpe el cuerno ipsilateral justo cefalad a la pinza para evitar sangrado. Esto se encuentra entre la unión utero-cervical (solo rostral al cuello uterino) y el punto de ligadura utero-tubárica. La bóveda vaginal permanecerá después de la histerectomía (Figura 4D).
NOTA: Debido al pequeño calibre de los vasos de rata, la ligadura de los muñones uterinos con una pinza temporal fue suficiente para esta cirugía. Sin embargo, esta técnica se puede modificar según sea necesario con el sellado de los pedículos con electrocauterio o la ligadura de sutura. - Repita los pasos 1.3.3-1.3.6 en el cuerno uterino derecho para realizar una histerectomía total.
- Ajuste el retractor abdominal para exponer la pelvis inferior. Inspeccione la bóveda vaginal expuesta y el suelo pélvico que soporta los tejidos ligamentales y conectivos, que se pueden ver unidos a la vagina y el cuello uterino. Si es posible, identifique el uréter bilateralmente, que es solo medial a los ovarios.
- Identifique los ligamentos uterosacros28,29, que se muestran en la Figura 5A, que se pueden encontrar unidos al cuello uterino justo debajo de los muñones restantes de los cuernos uterinos (bóveda vaginal). El ligamento se traza en una orientación cefalad-medial hacia el sacro.
- Usando una sutura de polidiaxanona 3-0 en una aguja pequeña y cónica, coloque una sutura a través del ligamento uterosacro izquierdo. Coloque la puntada en lo alto del ligamento, cerca del sacro.
- Tire de la puntada para asegurarse de que ha capturado el ligamento uterosacro: la estructura USL se inserta en el cuello uterino con el origen buceando detrás del recto donde se une al sacro. Una vez más, identifique el uréter para asegurarse de que no se haya incorporado o torcido con la puntada uterosacral.
- Luego, pase la puntada de polidiaxanona izquierda a través de la cara izquierda de la bóveda vaginal (Figura 5B), con cuidado de incorporar los aspectos anterior y posterior del manguito vaginal. Repita los pasos para completar el procedimiento USLS en el lado derecho. Se pueden colocar múltiples puntos bilateralmente, si se desea.
- Una vez que los puntos uterosacros se colocan bilateralmente, ate firmemente la sutura usando un nudo cuadrado, como se muestra en la Figura 5C, de modo que la bóveda vaginal se eleve cefalada hacia el sacro; Esto completa la suspensión del ligamento uterosacro.
- Cierre de la herida quirúrgica
- Reemplace el contenido abdominal de nuevo en su posición anatómica dentro de la cavidad peritoneal. Cierre las capas profundas de la pared abdominal (peritoneo, fascia, músculo) con un patrón de sutura continua de 4-0 a 6-0 poliglactina 910 o sutura de polidiaxanona.
- Cierre la piel con una sutura subcutánea (o interrumpida) de 4-0 a 6-0 polidiaxanona o poliglactina 910. Administrar antibióticos por vía subcutánea según sea necesario para la profilaxis de la infección del sitio quirúrgico.
- Realizar un seguimiento postquirúrgico hasta que el animal haya recuperado la conciencia suficiente para mantener la decúbito esternal. No devuelva al animal a una vivienda social hasta que esté completamente recuperado.
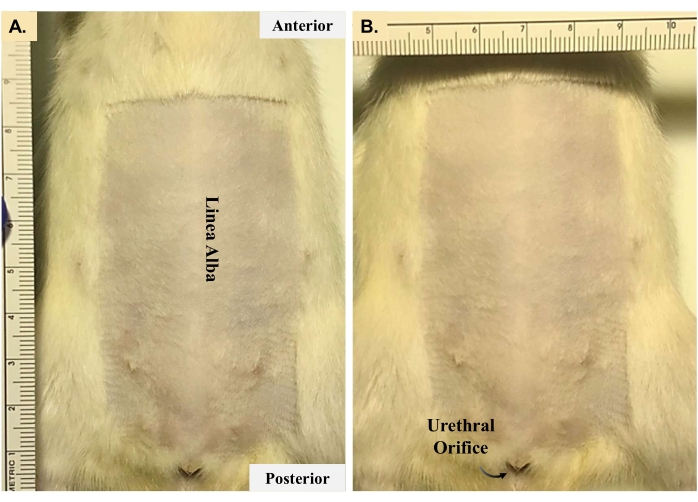
Figura 2: Preparación animal para cirugía viva. La eliminación del pelaje del área que rodea el sitio de la incisión es necesaria para una técnica aséptica adecuada. El área que se muestra en los paneles (A) y (B) son directrices. Los investigadores deben eliminar suficiente vello para que los instrumentos estériles no entren en contacto con el cabello durante la cirugía. Haga clic aquí para ver una versión más grande de esta figura.
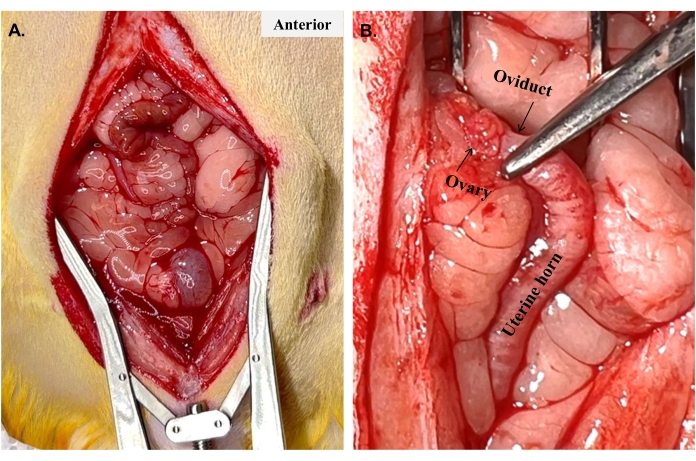
Figura 3: Preservación de los ovarios. Los cuernos uterinos generalmente no son visibles cuando se abre el abdomen por primera vez, como se muestra en (A). Una vez que se localiza y se sigue un cuerno para encontrar (B) el ovario y el oviducto donde se conectan al cuerno, se puede sujetar la parte superior del cuerno y separar el cuerno para comenzar la histerectomía. Haga clic aquí para ver una versión más grande de esta figura.
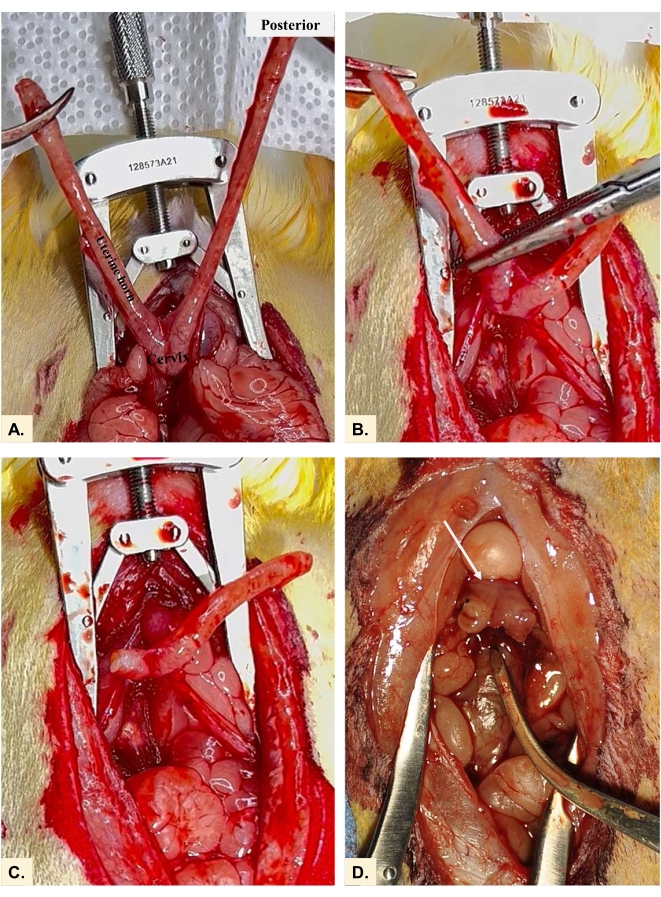
Figura 4: Extracción de los cuernos uterinos. La histerectomía en la rata implica (A) ambos cuernos uterinos (B) sujetados en la unión uterocervical y (C) extirpados. La bóveda vaginal de cada cuerno permanece con el muñón (D) cervical/uterino (flecha) que los conecta. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Suspensión del ligamento uterosaco. (A) Orientación de los ligamentos uterosacros en relación con las estructuras de bóveda vaginal creadas. Al colocar suturas para la reparación de la suspensión del ligamento uterosacro (USLS), (B) las suturas capturan el ligamento uterosacro y luego pasan a través de los aspectos anterior y posterior del manguito vaginal. (C) Asegurada al ligamento uterosacro, la bóveda vaginal ahora está elevada cefalada hacia el sacro. Haga clic aquí para ver una versión más grande de esta figura.
2. Ensayo de tracción uniaxial
NOTA: El sistema de prueba y el software utilizado se operaron siguiendo las pautas del fabricante para la calibración y las pruebas. Todas las pruebas se realizaron a 22 °C.
- Preparación de muestras
- Eutanasia a la rata utilizando un procedimiento farmacológico aprobado por IACUC. Asegurar la muerte a través del método físico secundario. Aquí, se utilizó la inhalación de CO2 seguida de punción cardíaca. Exponga la bóveda vaginal en preparación para las pruebas mecánicas de tracción. En el presente estudio, realizar pruebas de tracción en ligamentos uterosacros nativos (control), así como en animales que se habían sometido a suspensión del ligamento uterosacro como se describió anteriormente (POP).
- Probar los ligamentos in situ 24 semanas después de la cirugía. Se sugiere un punto de tiempo terminal de mínimo 8 semanas para permitir la reabsorción completa de las suturas.
- Después de la eutanasia humana, haga una incisión por la línea alba para exponer el abdomen.
- Comience a diseccionar el tejido adiposo hasta que la bóveda vaginal sea visible. Continúe diseccionando las almohadillas de grasa abdominal hasta que las USL intactas sean claramente visibles (animales de control, Figura 6A) o la unión entre el ligamento uterosacro y la bóveda vaginal sea visible (animales POP, Figura 6C). Tenga cuidado de no tirar de la unión para eliminar el tejido adiposo, sino más bien usar cortes cuidadosos con microtijeras para mantener la consistencia entre las muestras.
- Usando una regla flexible, mida la distancia entre la inserción uterosacro (posterior al recto) y la bóveda vaginal. Este valor es la longitud original del tejido.
NOTA: La longitud original del tejido, la longitud del calibre, para las USL de control medía 13,4 ± 0,5 mm, mientras que la longitud del calibre para la reparación de USL medía 12,8 ± 0,4 mm. - Coloque cinta umbilical detrás del USL intacto (control, Figura 6B) o la unión USLS (POP, Figura 6D) de modo que el tejido esté centrado en la cinta umbilical. Mida la altura y el ancho del tejido donde se cruza con la cinta umbilical utilizando calibradores digitales. Estos valores se utilizarán para calcular el área de la sección transversal.
- Coloque una placa de compresión grande (Tabla de materiales) a través del adaptador de base y coloque al animal encima de modo que la muestra esté centrada debajo del soporte de agarre.
- Pruebas de tracción
- Programe el régimen de prueba de tracción en el software: precarga, precondición, tirar a fallo. Esto sigue los protocolos previos de pruebas mecánicas del suelo pélvico29 y del tejido reproductivo30 .
- Configure el instrumento en preparación para la prueba de tracción. Para el estudio actual, use una célula de carga de 10 N, una empuñadura impresa en 3D y un adaptador de base para colocar una placa de compresión como se muestra en la Figura 7.
NOTA: Cualquier configuración base que pueda soportar el tamaño completo del animal es aceptable. Use cualquier agarre que pueda sujetar de forma segura la cinta umbilical. En esta prueba se utilizó un soporte impreso en 3D personalizado y un agarre de estudios previos31,32. Los archivos STL se incluyeron como archivos complementarios.- Coloque el animal de tal manera que el espécimen esté centrado debajo de la empuñadura (Figura 8A). Inmovilizar la región pélvica que rodea la muestra asegurando el animal a la platina (Figura 8B).
- Baje la célula de carga de tal manera que las colas de la cinta umbilical lleguen fácilmente a la empuñadura. Asegure la cinta umbilical en la empuñadura, dejando la cinta floja para evitar la manipulación de la muestra.
- Abra la prueba de preacondicionamiento en la interfaz del software y etiquete la prueba con el nombre de la muestra. Asegúrese de que el método de preacondicionamiento incluye el paso de precarga.
- Haga clic para iniciar la prueba de preacondicionamiento, que precargará la muestra a 0,015 N. Una vez que la fuerza de precarga es estable, la prueba preacondicionará la muestra a una velocidad de elongación de 0,1 mm/s durante 30 s. Deje que el tejido descanse durante 1 minuto. Mientras espera, cargue el régimen de pruebas pull-to-failure.
NOTA: La fuerza de precarga puede variar dependiendo de las limitaciones del instrumento y las condiciones de prueba. Consulte estudios previos en los que la precarga informada oscila entre 0,015 N y 0,1 N 29,33,34,35,36. - Abra el régimen de prueba que está programado para tirar hacia el fracaso. Etiquete la prueba con el nombre de la muestra y haga clic en Aceptar para acceder a la siguiente ventana. Ingrese la longitud del medidor de la muestra y luego haga clic en Siguiente para pasar a la página de prueba.
- Equilibre todo y haga clic en Inicio. Deje que la prueba se ejecute a una velocidad de elongación de 0,1 mm/s hasta que el tejido haya sido retirado hasta el fallo. La prueba producirá datos de desplazamiento de carga.
- Cálculo de tensión, deformación y módulo para ensayos de tracción
- Utilizando los datos de carga-desplazamiento, el área de la sección transversal y la longitud del medidor de la muestra, calcule la tensión (MPa) y la deformación (%) como se informó anteriormente 37,38,39,40,41. Use la Ecuación 1 y la Ecuación 2 que se muestran a continuación. Tenga en cuenta que el estiramiento de la cinta durante la prueba también debe tenerse en cuenta en estos cálculos.
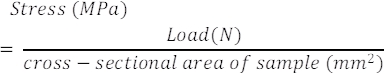 Ecuación 1
Ecuación 1 Ecuación 2
Ecuación 2- A partir de la curva de carga-desplazamiento (Figura 9A,D), calcule la rigidez (pendiente lineal, N/mm) y la carga final. A partir de la curva de deformación de tensiones, calcule el módulo tangente (pendiente lineal, MPa) y la tensión final. La región lineal de la curva de deformación de tensión se observa en la Figura 9B,E con el módulo tangente calculado de esta región que se muestra en la Figura 9C,F para ambos grupos experimentales.
NOTA: Tanto para la rigidez como para el módulo tangente, identifique la porción lineal eligiendo una ventana de puntos que maximice el valor de R2 para una regresión lineal37,41.
- A partir de la curva de carga-desplazamiento (Figura 9A,D), calcule la rigidez (pendiente lineal, N/mm) y la carga final. A partir de la curva de deformación de tensiones, calcule el módulo tangente (pendiente lineal, MPa) y la tensión final. La región lineal de la curva de deformación de tensión se observa en la Figura 9B,E con el módulo tangente calculado de esta región que se muestra en la Figura 9C,F para ambos grupos experimentales.
- Utilizando los datos de carga-desplazamiento, el área de la sección transversal y la longitud del medidor de la muestra, calcule la tensión (MPa) y la deformación (%) como se informó anteriormente 37,38,39,40,41. Use la Ecuación 1 y la Ecuación 2 que se muestran a continuación. Tenga en cuenta que el estiramiento de la cinta durante la prueba también debe tenerse en cuenta en estos cálculos.
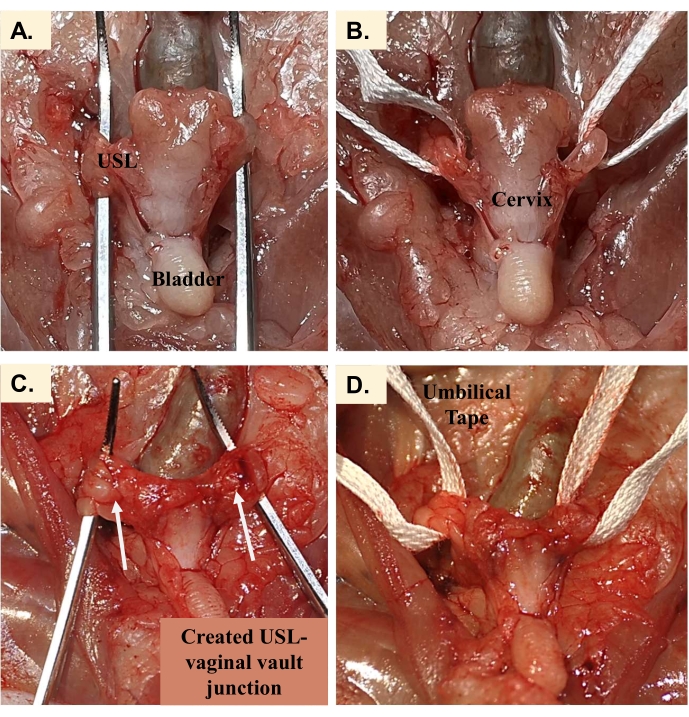
Figura 6: Preparación de la muestra para la prueba de tracción uniaxial. (A) Las USL de control expuestas antes de (B) la cinta umbilical se enrosca detrás del tejido. (C) Unión USL-bóveda vaginal después de la disolución completa de las suturas con (B) la cinta umbilical roscada detrás del tejido en preparación de la prueba de tracción. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: El sistema de pruebas mecánicas. (A) El sistema de prueba en modo de prueba de tracción utilizado con (B) soporte impreso en 3D y (C) agarre de muestra impreso en 3D completo con una tira texturizada para mejorar el agarre. Configuración de las piezas mostradas en el panel (D). Haga clic aquí para ver una versión más grande de esta figura.
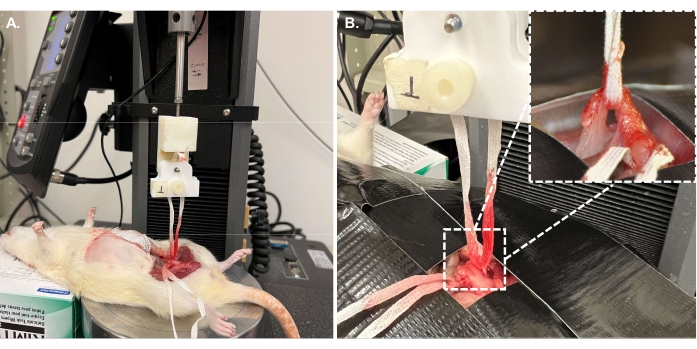
Figura 8: Configuración de la prueba de tracción. (A) La muestra está centrada debajo de la empuñadura y el soporte. (B) El animal y el tejido que rodea la muestra se mantienen estacionarios antes del inicio de la prueba de tracción. Como se muestra en la imagen insertada, asegurar el tejido circundante es esencial para aislar el tejido de interés. Haga clic aquí para ver una versión más grande de esta figura.
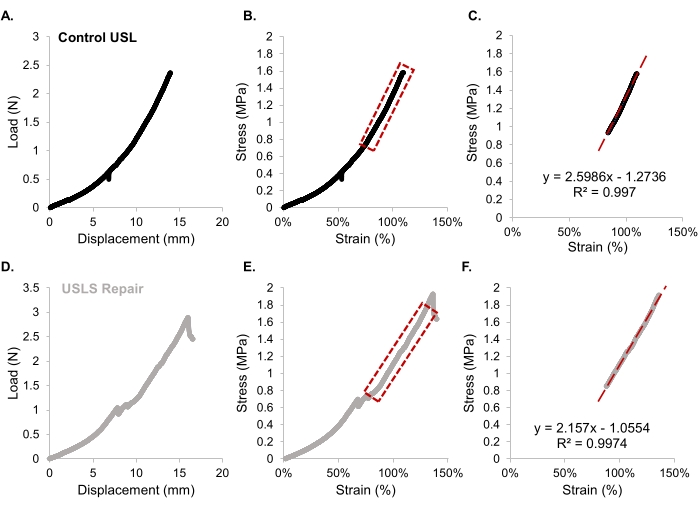
Figura 9: Ejemplo de salida y análisis de datos de prueba de tracción. (A) La curva de carga-desplazamiento para una muestra de control seguida de (B) el análisis de deformación de tensión y (C) la ecuación de ajuste de la pendiente de la curva de línea que muestra el módulo tangente en MPa. (D-F) muestra el mismo proceso para una muestra USLS. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Viabilidad quirúrgica y colocación de sutura uterosacro
No hubo complicaciones intraoperatorias relacionadas con la histerectomía o la suspensión del ligamento uterosacro en ninguno de los animales. Hubo un sangrado mínimo durante la extracción de los cuernos uterinos, siempre que la vasculatura adyacente se sujetara antes de la extracción. El sangrado limitado permitió una buena visualización de los ligamentos uterosacros para la colocación de suturas y evitó la lesión intraoperatoria del intestino, el recto, la ureteral o la vejiga. Después de la colocación de las suturas, la unión recién formada USL-bóveda vaginal impidió el movimiento del muñón cervical/uterino como se muestra en la Figura 5C. Durante los primeros tres días postoperatorios, los animales fueron revisados diariamente, y luego quincenalmente hasta el final del experimento. Con los analgésicos opioides de liberación prolongada y AINE administrados en el momento de la cirugía, se encontró que los analgésicos adicionales eran innecesarios. Según nuestra experiencia con 16 cirugías con animales (n = 8 para los grupos control y USLS), se debe esperar una caída de peso en la primera semana después de la cirugía con una pérdida promedio de 5.7 ± 1.4% del peso del día de la cirugía. Como se esperaba, las ratas ganaron peso lentamente durante las siguientes 23 semanas, con un aumento de peso promedio de 15.1 ± 4.5% en el transcurso del experimento.
Pruebas mecánicas de la reparación del USLS
Para demostrar la funcionalidad de la reparación del USLS, se realizó una prueba de tracción uniaxial. Después de la eutanasia del animal en el punto de tiempo postoperatorio elegido, 24 semanas en este estudio, el área quirúrgica debe diseccionarse cuidadosamente para visualizar la unión USL-bóveda vaginal como se muestra en la Figura 6A. En comparación con otras metodologías para probar las USL de rata junto con otras estructuras de soporte y órganos pélvicos29,42, el método descrito aquí es el primero en probar el USL de rata de manera aislada. La cinta umbilical utilizada en este estudio se eligió estratégicamente por su flexibilidad, ya que el cumplimiento de la cinta permitió una interrupción mínima del tejido durante la preparación de la prueba de tracción. Los datos de desplazamiento de carga, por lo tanto, deben ajustarse para tener en cuenta la pequeña cantidad de estiramiento que aporta la cinta umbilical. La Figura 9 proporciona un ejemplo de los datos obtenidos a través de pruebas de tracción con la Figura 9A proporcionando un ejemplo de un gráfico típico de tensión-deformación. Se recomienda informar los datos sobre la tensión y la deformación, ya que esta información está normalizada e independiente del tamaño de las muestras34 y se puede comparar mejor entre los estudios. Para el ligamento uterosacro intacto, informamos propiedades estructurales como carga final (2.9 ± 0.5 N) y rigidez (0.4 ± 0.1 N / mm), así como propiedades de material normalizadas como tensión final (2.1 ± 0.4 MPa), deformación final (1.6 ± 0.5) y módulo tangente (4.0 ± 1.1 MPa). En las pruebas uniaxiales realizadas en los órganos reproductores de ratas y todas sus conexiones de tejido de soporte por Moalli et al., informaron una carga final en el fracaso (13,2 ± 1,1 N) y rigidez (2,9 ± 0,9 N/mm) mayor que el USL29 aislado. El trabajo realizado por Moalli et al. y otras publicaciones34,35 mencionan la alta variabilidad entre los especímenes probados, como se muestra en los datos presentados aquí. Para la reparación de la suspensión del ligamento uterosacro, encontramos que todas las propiedades estructurales del material (rigidez, 0.33 ± 0.13 N / mm; carga final, 2.6 ± 1.3 N) y propiedades normalizadas del material (tensión final, 1.8 ± 0.7 MPa; deformación final 1.3 ± 0.3; módulo tangente, 3.0 ± 0.9 MPa) son más bajas que las del USL nativo.
Discusión
El protocolo es notable por varias ventajas. Hasta donde sabemos, es la primera descripción publicada de USLS en el modelo de rata y proporcionará a los futuros investigadores pasos reproducibles para realizar este procedimiento en el entorno de investigación. En segundo lugar, incluimos un protocolo novedoso para la prueba de tracción de la interfaz nativa y quirúrgica de la USL. El protocolo de prueba de tracción podría utilizarse en estudios similares que investigan nuevos enfoques de ingeniería de tejidos para aumentar las reparaciones de tejidos nativos, como USLS. Además, el modelo de rata en sí es útil para el estudio de los trastornos del suelo pélvico debido a la facilidad de manejo / embarque, la corta vida útil y la rentabilidad en comparación con los modelos animales más grandes. Las limitaciones del protocolo incluyen la incapacidad de evaluar una de las principales complicaciones del USLS, el torcimiento ureteral. A pesar de esto, no tuvimos casos de presunta lesión ureteral en este estudio. Otra consideración es que la orientación horizontal de la pelvis, la pequeña proporción de canales de cabeza fetal a parto y la falta de prolapso espontáneo en el modelo de rata limitan cierta aplicabilidad de los resultados a los humanos. Sin embargo, el uso de ratas multíparas es una fortaleza de este estudio, ya que esto explica el principal factor de riesgo en el desarrollo de POP3.
El establecimiento de un protocolo exitoso para la histerectomía y el USLS en la rata Lewis será una herramienta útil para futuros investigadores que investiguen los componentes quirúrgicos del POP, al tiempo que minimiza la variabilidad en las pruebas del comportamiento mecánico del USL. Los modelos animales quirúrgicos son beneficiosos porque permiten a los investigadores diseñar experimentos clínicamente relevantes que controlan la paridad, la masa corporal, la enfermedad y la nutrición34 al tiempo que mitigan el riesgo ético del estudio inicial en humanos. Además, los modelos estandarizados para POP permiten a los investigadores eludir las limitaciones de la recolección de tejido humano. En particular, los métodos de ensayo de tracción descritos en este protocolo permitirán la coherencia entre los estudios. Los modelos anteriores de roedores probaron las propiedades mecánicas de toda la región pélvica, que incluye el cuello uterino, la vagina y los múltiples ligamentos de soporte pélvico29,42. Los métodos descritos aquí permiten medir el USL de una manera que mantiene las inserciones espinales y cervicales nativas. Cabe señalar que los métodos de prueba de tracción no evalúan el USL solo, sino el USL en combinación con su inserción en el sacro y el cuello uterino. Esta es una fortaleza del estudio, ya que refleja las fuerzas in situ habituales a las que se somete el ligamento. Reconocemos que el comportamiento mecánico del ligamento aislado sería diferente si se probara ex vivo sin sus uniones nativas. Esto es especialmente cierto ya que las estructuras de rata son pequeñas y limitan la viabilidad de recolectar una muestra adecuada para pruebas ex vivo. Las USL experimentan carga en múltiples direcciones in situ, por lo que la naturaleza uniaxial de la prueba es una limitación, pero el uso de este método permite comparaciones significativas entre estudios previos de mecánica de USL en ratas29,42. Si bien actualmente no existe un protocolo de prueba mecánica estándar ampliamente aceptado, este modelo será una herramienta útil para futuros estudios de ingeniería de tejidos en el campo.
Varios pasos descritos en este protocolo son críticos para la salud y el bienestar de los animales, así como para la reproducibilidad de la cirugía USLS y las posteriores pruebas de tracción. En primer lugar, es esencial obtener tanto el analgésico como los medicamentos antiinflamatorios descritos como el analgésico solo resultó ser inadecuado para el manejo del dolor. El antibiótico profiláctico disminuye el riesgo de infección del sitio quirúrgico y es el estándar de atención en la cirugía humana. Con respecto al procedimiento quirúrgico USLS, evitar el daño a los ovarios y minimizar la pérdida de sangre son esenciales para una cirugía exitosa. Los pasos 1.3.3 y 1.3.4 describen la separación de la parte superior del cuerno uterino del ovario adyacente; Se debe tener cuidado para mantener esta disección en el lado del cuerno uterino para evitar la interrupción de los vasos delicados alrededor del ovario, lo que puede provocar un sangrado excesivo. Cabe destacar que otros investigadores han demostrado que la función ovárica se conserva después de la extirpación de los cuernos uterinos43. Además, si los ovarios son alterados o eliminados, la arquitectura general de las fibrillas de colágeno se verá alterada, alterando las propiedades mecánicas de sus tejidos44,45. Una vez que el cuerno uterino se separa de forma segura del ovario, hay un plano claro de disección que permite el aislamiento del cuerno uterino de las almohadillas de grasa circundantes y la vasculatura. A pesar del plano claro de disección, los pedículos a lo largo del cuerno uterino deben asegurarse con una pinza antes de la transección con microtijeras. Contrariamente a la práctica quirúrgica en humanos, hemos encontrado que la ligadura de sutura de los pedículos de histerectomía es innecesaria, ya que el pinzamiento del pedículo antes de la transección asegura una hemostasia adecuada. El paso 1.3.6 del protocolo describe este proceso cuidadoso para minimizar la pérdida de sangre. A medida que se realiza la histerectomía, se debe tener mucho cuidado para identificar los uréteres como se menciona en los pasos 1.3.6 y 1.3.8. Comprender la proximidad anatómica del uréter es fundamental, ya que una de las complicaciones más comunes asociadas con las USL en humanos es la lesión ureteral46.
En conclusión, presentamos un protocolo novedoso para realizar histerectomía, suspensión del ligamento uterosacro y prueba de tracción de la USL en un modelo de rata. Anticipamos que nuestros hallazgos ayudarán a los futuros investigadores de ciencias básicas al proporcionar una descripción clara y reproducible de estos procedimientos y, por lo tanto, permitirán el avance de la investigación del prolapso de órganos pélvicos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a la Prof. Silvia Blemker por el uso de su Instron y al Prof. George Christ por el uso de su espacio quirúrgico, así como al soporte y agarre impresos en 3D. Este trabajo fue apoyado por la Asociación de Investigación Traslacional UVA-Coulter y el Departamento de Defensa (W81XWH-19-1-0157).
Materiales
| Name | Company | Catalog Number | Comments |
| Alcohol prep pad | BD | 326895 | |
| Artificial Tear Ointment | American Health Service Sales Corp | PH-PARALUBE-O | |
| Bluehill software | Instron | Bluehill 3 | |
| Cavicide 1 disinfectant | Fisher Scientific | 22 998 800 | |
| Compression platean | Instron | 2501-163 | |
| Cotton swabs | Puritan Medical | 806-WC | |
| Gauze Sponge, 8-Ply | VWR | 95038-728 | |
| Mosquito Forceps | Medline Industries | MMDS1222115 | |
| Needle Holder | Medline Industries | DYND04045 | |
| Operating Scissors, 5½", Sharp | American Health Service Sales Corp | 4-222 | |
| Opioid Analgesic (Buprenorphine XR) | Fidelis Animal Health | Ethiqa XR | 0.65 mg/kg SC Q72 |
| NSAID Analgesic (Meloxicam SR) | Wildlife Pharmaceuticals, LLC | Meloxicam SR | 1 mg/kg SC q72 |
| PDS II, 3-0 Polydioxanone Suture, SH-1 | Ethicon | Z316H | |
| PDS II, 5-0 P olydioxanone Suture, RB-1 | Ethicon | Z303H | |
| Retractor | Medline Industries | MDS1862107 | |
| Scalpel Blade Stainless Surgical #10 | Miltex | 4-310 | |
| Scalpel Handle | Medline Industries | MDS15210 | |
| Scissor, Micro, Curved, 4.5" | Westcott | MDS0910311 | |
| Single Column Universal Testing System | Instron | 5943 S3873 | 1 kN force capacity, 10 N load cell |
| Sterile Natural Rubber Latex Gloves | Accutech | 91225075 | |
| Suture,Vicryl,6-0,P-3 | Ethicon | J492G | |
| Tape,Umbilical,Cotton,1/8X18" | Ethicon | U10T | |
| Tension and Compression Load Cell | Instron | 2530-10N | 10N load cell (1 kgf, 2 lbf) |
| Veterinary surgical adhesive (skin glue) | Covetrus | 31477 |
Referencias
- Olsen, A. L., et al. Epidemiology of surgically managed pelvic organ prolapse and urinary incontinence. Obstetrics and Gynecology. 89 (4), 501-506 (1997).
- Wu, J. M., et al. Lifetime risk of stress urinary incontinence or pelvic organ prolapse surgery. Obstetrics and Gynecology. 123 (6), 1201-1206 (2014).
- Kenton, K., Mueller, E. R. The global burden of female pelvic floor disorders. BJU International. 98, 1-7 (2006).
- Herschorn, S. Female pelvic floor anatomy The pelvic floor, supporting structures, and pelvic organs. Reviews in Urology. 6, 2-10 (2004).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 369 (9566), 1027-1038 (2007).
- Campbell, R. M. The anatomy and histology of the sacrouterine ligaments. American Journal of Obstetrics and Gynecology. 59 (1), 1-12 (1950).
- Reisenauer, C., et al. The role of smooth muscle in the pathogenesis of pelvic organ prolapse - An immunohistochemical and morphometric analysis of the cervical third of the uterosacral ligament. International Urogynecology Journal and Pelvic Floor Dysfunction. 19 (3), 383-389 (2008).
- Lavelle, R. S., Christie, A. L., Alhalabi, F., Zimmern, P. E. Risk of prolapse recurrence after native tissue anterior vaginal suspension procedure with intermediate to long-term followup. Journal of Urology. 195 (4), 1014-1020 (2016).
- Jelovsek, J. E., et al. Effect of uterosacral ligament suspension vs sacrospinous ligament fixation with or without perioperative behavioral therapy for pelvic organ vaginal prolapse on surgical outcomes and prolapse symptoms at 5 years in the OPTIMAL randomized clinical trial. JAMA - Journal of the American Medical Association. 319 (15), 1554-1565 (2018).
- Bradley, M. S., et al. Vaginal uterosacral ligament suspension: A retrospective cohort of absorbable and permanent suture groups. Female Pelvic Medicine & Reconstructive Surgery. 24 (3), 207-212 (2018).
- Cola, A., et al. Native-tissue prolapse repair: Efficacy and adverse effects of uterosacral ligaments suspension at 10-year follow up. International Journal of Gynecology and Obstetrics. , (2022).
- Sung, V. W., Washington, B., Raker, C. A. Costs of ambulatory care related to female pelvic floor disorders in the United States. American Journal of Obstetrics and Gynecology. 202 (5), 1-4 (2010).
- Subak, L. L., et al. Cost of pelvic organ prolapse surgery in the United States. Obstetrics and Gynecology. 98 (4), 646-651 (2001).
- Siddiqui, N. Y., et al. Mesh sacrocolpopexy compared with native tissue vaginal repair: A systematic review and meta-analysis. Obstetrics & Gynecology. 125 (1), 44-55 (2015).
- FDA takes action to protect women's health, orders manufacturers of surgical mesh intended for transvaginal repair of pelvic organ prolapse to stop selling all devices. FDA News Release Available from: https://www.fda.gov/news-events/press-announcements/fda-takes-action-protect-womens-health-orders-manufacturers-surgical-mesh-intended-transvaginal (2019)
- Brincat, C. A. Pelvic organ prolapse reconsidering treatment, innovation, and failure. JAMA - Journal of the American Medical Association. 322 (11), 1047-1048 (2019).
- Cundiff, G. W. Surgical innovation and the US Food and Drug Administration. Female Pelvic Medicine & Reconstructive Surgery. 25 (4), 263-264 (2019).
- Luchristt, D., Weidner, A. C., Siddiqui, N. Y. Urinary basement membrane graft-augmented sacrospinous ligament suspension: a description of technique and short-term outcomes. International Urogynecology Journal. 33 (5), 1347-1350 (2022).
- Couri, B. M., et al. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics and Gynecology. 7 (3), 249-260 (2012).
- Mori da Cunha, M. G. M. C., et al. Animal models for pelvic organ prolapse: systematic review. International Urogynecology Journal. 32 (6), 1331-1344 (2021).
- Kasabwala, K., Goueli, R., Culligan, P. J. A live porcine model for robotic sacrocolpopexy training. International Urogynecology Journal. 30 (8), 1371-1375 (2019).
- Mansoor, A., et al. Development of an ovine model for training in vaginal surgery for pelvic organ prolapse. International Urogynecology Journal. 28 (10), 1595-1597 (2017).
- Liang, R., et al. Impact of prolapse meshes on the metabolism of vaginal extracellular matrix in rhesus macaque. American Journal of Obstetrics and Gynecology. 212 (2), 1-7 (2015).
- Johannesson, L., et al. Preclinical report on allogeneic uterus transplantation in non-human primates. Human Reproduction. 28 (1), 189-198 (2013).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- National Research Council. . Guide for the Care and Use of Laboratory Animals: Eighth Edition. , (2011).
- Federal Animal Welfare Regulations. National Archives Available from: https://www.ecfr.gov/current/title-9/chapter-l/subchapter-A/part-2/subpart-C/section-2.31 (2022)
- Ma, Y., et al. Knockdown of Hoxa11 in vivo in the uterosacral ligament and uterus of mice results in altered collagen and matrix metalloproteinase activity. Biology of Reproduction. 86 (4), 100 (2012).
- Moalli, P. A., et al. A rat model to study the structural properties of the vagina and its supportive tissues. American Journal of Obstetrics and Gynecology. 192 (1), 80-88 (2005).
- Yoshida, K., et al. Mechanics of cervical remodelling: Insights from rodent models of pregnancy. Interface Focus. 9 (5), 20190026 (2019).
- Christ, G. J., Sharma, P., Hess, W., Bour, R. . Modular biofabrication platform for diverse tissue engineering applications and related method thereof. , (2020).
- Smith, K., Christ, G. J. . Incorporation of in vitro double seeding for enhanced development of tissue engineered skeletal muscle implants. , (2019).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Baah-Dwomoh, A., McGuire, J., Tan, T., De Vita, R. Mechanical properties of female reproductive organs and supporting connective tissues: A review of the current state of knowledge. Applied Mechanics Reviews. 68 (6), 1-12 (2016).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Kurtaliaj, I., Golman, M., Abraham, A. C., Thomopoulos, S. Biomechanical testing of murine tendons. Journal of Visualized Experiments. (152), e60280 (2019).
- Griffin, M., et al. Biomechanical characterization of human soft tissues using indentation and tensile testing. Journal of Visualized Experiments. (118), e54872 (2016).
- Feola, A., et al. Parity negatively impacts vaginal mechanical properties and collagen structure in rhesus macaques. American Journal of Obstetrics and Gynecology. 203 (6), 1-8 (2010).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics and Gynecology and Reproductive Biology. 144, 146-158 (2009).
- Lowder, J. L., et al. Adaptations of the rat vagina in pregnancy to accommodate delivery. Obstetrics and Gynecology. 109 (1), 128-135 (2007).
- Koebele, S. V., et al. Hysterectomy uniquely impacts spatial memory in a rat model: A role for the nonpregnant uterus in cognitive processes. Endocrinology. 160 (1), 1-19 (2019).
- Kafantari, H., et al. Structural alterations in rat skin and bone collagen fibrils induced by ovariectomy. Bone. 26 (4), 349-353 (2000).
- Daghma, D. E. S., et al. Computational segmentation of collagen fibers in bone matrix indicates bone quality in ovariectomized rat spine. Journal of Bone and Mineral Metabolism. 36 (3), 297-306 (2018).
- Manodoro, S., Frigerio, M., Milani, R., Spelzini, F. Tips and tricks for uterosacral ligament suspension: how to avoid ureteral injury. International Urogynecology Journal. 29 (1), 161-163 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados