Method Article
Entwicklung eines uterosakralen Ligament-Suspensionsrattenmodells
In diesem Artikel
Zusammenfassung
Ein Beckenorganprolaps betrifft Millionen von Frauen weltweit, und dennoch weisen einige gängige chirurgische Eingriffe Ausfallraten von bis zu 40% auf. Das Fehlen von Standard-Tiermodellen zur Untersuchung dieses Zustands behindert den Fortschritt. Wir schlagen das folgende Protokoll als Modell für die uterosakrale Bandsuspension und den In-vivo-Zugversuch vor.
Zusammenfassung
Der Beckenorganprolaps (POP) ist eine häufige Beckenbodenerkrankung (PFD) mit dem Potenzial, die Lebensqualität einer Frau erheblich zu beeinträchtigen. Ungefähr 10%-20% der Frauen unterziehen sich in den Vereinigten Staaten einer Beckenbodenreparaturoperation, um einen Prolaps zu behandeln. PFD-Fälle verursachen allein in den Vereinigten Staaten jährliche Gesamtkosten in Höhe von 26,3 Milliarden US-Dollar. Diese multifaktorielle Erkrankung wirkt sich negativ auf die Lebensqualität aus und dennoch sind die Behandlungsmöglichkeiten erst in der jüngeren Vergangenheit geschrumpft. Eine gängige chirurgische Option ist die uterosakrale Bandsuspension (USLS), die typischerweise durch Anbringen des Vaginalgewölbes am uterosakralen Band im Becken durchgeführt wird. Diese Reparatur hat eine geringere Inzidenz von Komplikationen im Vergleich zu denen mit Netzaugmentation, zeichnet sich jedoch durch eine relativ hohe Ausfallrate von bis zu 40% aus. In Anbetracht des Mangels an Standard-Tiermodellen zur Untersuchung von Beckenbodenfunktionsstörungen besteht ein dringender klinischer Bedarf an Innovationen in diesem Bereich, wobei der Schwerpunkt auf der Entwicklung kostengünstiger und zugänglicher Tiermodelle liegt. In diesem Manuskript beschreiben wir ein Rattenmodell von USLS, das eine vollständige Hysterektomie mit anschließender Fixierung des verbleibenden Vaginalgewölbes am uterosakralen Ligamentum beinhaltet. Das Ziel dieses Modells ist es, das an Frauen durchgeführte Verfahren nachzuahmen, um mit dem Modell dann reparative Strategien untersuchen zu können, die die mechanische Integrität des Bandansatzes verbessern. Wichtig ist, dass wir auch die Entwicklung eines In-situ-Zugversuchsverfahrens beschreiben, um die Grenzflächenintegrität zu ausgewählten Zeitpunkten nach einem chirurgischen Eingriff zu charakterisieren. Insgesamt wird dieses Modell ein nützliches Werkzeug für zukünftige Studien sein, die Behandlungsoptionen für die POP-Reparatur über USLS untersuchen.
Einleitung
Beckenorganprolaps (POP) ist eine häufige Beckenbodenerkrankung, von der Millionen von Frauen weltweit betroffen sind und die das Potenzial hat, viele Aspekte des Lebens einer Frau erheblich zu beeinflussen, insbesondere im Altervon 1 Jahren. Bemerkenswert ist, dass etwa 13% der Frauen in den Vereinigten Staaten wegen Prolaps oder Harninkontinenz operiert werden2. Der Prolaps ist eine Erkrankung, die am häufigsten nach Schwangerschaft und Geburt auftritt und durch das Absinken der Beckenorgane, vor allem der verschiedenen Kompartimente der Vagina und/oder der Gebärmutter, über ihre normale Position in der Bauchhöhle hinaus gekennzeichnet ist. Dies führt zu lästigen Symptomen wie vaginaler Wölbung oder Druck, Darm-, Blasen- und sexueller Dysfunktion und insgesamt zu einer verminderten Lebensqualität. Weitere Risikofaktoren für POP sind Fettleibigkeit, Tabakkonsum, chronischer Husten und Verstopfung3.
Bei gesunden Frauen werden die Beckenbodenorgane von den Musculus levator ani, den uterosakralen Bändern (USLs), den Kardinalbändern, den Bindegewebsansätzen an der Beckenseitenwand und den distalen Strukturen des Dammkörpersunterstützt 4,5. Die USLs gehören zu den wichtigsten apikalen Stützstrukturen sowohl für die Gebärmutter als auch für die apikale Vagina und werden daher häufig bei der chirurgischen Korrektur von POP eingesetzt (Abbildung 1). Die strukturelle Unterstützung durch die USL stammt aus dem dichten kollagenen Bindegewebe im Sakralbereich, das in eine dicht gepackte glatte Muskulatur übergeht. Aufgrund dieses Zusammensetzungsgradienten wird die USL mit der Gebärmutter- und Vaginalmuskulatur verwoben, um die Beckenorgane stabil zu stützen 6,7. Bei der uterosakralen Bandsuspension (USLS) werden die USLs nach einer Hysterektomie am Vaginalgewölbe befestigt, wodurch die Vagina und die umgebenden Strukturen wieder in ihre anatomische Position im Bauchkompartiment gebracht werden. Unabhängig von einem transvaginalen oder laparoskopischen Weg ist das USLS-Verfahren jedoch in einigen Studien von einer relativ hohen Ausfallrate von bis zu 40% geplagt 8,9. Die Rezidivrate von störenden vaginalen Bulge-Symptomen 5 Jahre nach der Reparatur bei apikalem Kompartimentprolaps, wie z. B. USLs, betrug in einer großen multizentrischen randomisierten kontrollierten Studie etwa 40%9. In derselben Studie betrug die erneute Behandlung eines rezidivierenden Prolaps nach 5 Jahren etwa 10%. Der Mechanismus dieser hohen Ausfallrate wurde nicht untersucht, aber die Wiederherstellung der Vagina und der umgebenden Strukturen in ihre anatomische Position erfordert die Nahtplatzierung in der dichten kollagenen Region der USL10,11 und nicht in der glatten Muskelregion. Daher könnte die hohe Ausfallrate auf die mechanische und kompositorische Diskrepanz der chirurgisch geformten Vagina-USL-Schnittstelle im Vergleich zur vollständigen Integration des nativen zervikalen USL-Ansatzes zurückzuführen sein.
Die wirtschaftlichen Auswirkungen der Behandlung dieser Erkrankungen sind ebenfalls bemerkenswert: In den USA werden jährlich etwa 300 Millionen US-Dollar für die ambulante Versorgung ausgegeben12 und jährlich mehr als 1 Milliarde US-Dollar für direkte Kosten für chirurgische Eingriffeausgegeben 13. Trotz der enormen wirtschaftlichen Ressourcen, die für die Behandlung dieser Erkrankungen aufgewendet werden, bleiben die Komplikationen, die sich aus vielen Prolapsoperationen ergeben, entmutigend. Beispielsweise bieten auf Polypropylennetzen basierende apikale Prolapsreparaturen, wie z. B. die Sakrokolpopexie, höhere Erfolgsraten im Vergleich zu nativen Gewebereparaturen14, jedoch auf Kosten potenzieller Komplikationen wie Netzexposition oder Erosion. Allein zwischen 2008 und 2010 erhielt die FDA fast 3.000 Beschwerden im Zusammenhang mit Netzkomplikationen. Dies gipfelte in einer Anordnung der FDA, die Herstellung und den Verkauf aller transvaginal platzierten Netzprodukte für POP im April 2019einzustellen 15. Daher besteht ein starker klinischer Bedarf an anderen Materialien als Polypropylen und Modellen, mit denen sie getestet werden können, die die Reparatur von nativem Gewebeprolaps verbessern und die Erfolgsraten im Vergleich zu herkömmlichen Techniken mit Naht allein erhöhen können.
Seit der Ankündigung der FDA im Jahr 2019 haben die meisten Beckenchirurgen aufgehört, transvaginal platzierte Netze für Prolapsreparaturen zu verwenden, was die Forscher dazu veranlasste, nach neuen Tissue-Engineering-Ansätzen zu suchen, um native Gewebereparaturen zu verstärken16,17,18, z. B. mit mesenchymalen Stromazellen (MSCs)9,20 . Angesichts dieser Schwerpunktverlagerung besteht ein dringender Bedarf an der Verfeinerung von Tiermodellen, die bei der Entwicklung neuer Materialien helfen können. Die Herausforderung in diesem Prozess besteht darin, die klinische Relevanz mit den Kosten in Einklang zu bringen. Zu diesem Zweck haben Grundlagenforscher und klinische Forscher, die den Beckenorganprolaps untersuchen, bisher mehrere Tiermodelle genutzt, darunter Ratten, Mäuse, Kaninchen, Schafe, Schweine und nichtmenschliche Primaten19. Der Prozess der Identifizierung eines optimalen Tiermodells ist eine Herausforderung, da Menschen zweibeinig sind, keinen Schwanz haben und im Vergleich zu anderen Säugetierarten einen traumatischen Geburtsprozess haben20. Schweine21 wurden verwendet, um die robotergestützte Sakrokolpopexie zu simulieren, während Schafe verwendet wurden, um vaginale Prolapsreparaturen zu simulieren22. Diese Tiermodelle sind zwar klinisch relevant, aber durch Kosten und Wartung in ihrer Durchführbarkeit begrenzt. Nicht-menschliche Primaten wurden verwendet, um die Pathogenese des Prolaps zu untersuchen; Insbesondere Totenkopfäffchen sind eine der wenigen Arten außer dem Menschen, die einen spontanen Prolaps entwickeln können, was sie zu einem der relevantesten Tiermodelle macht20. Nichtmenschliche Primaten wurden auch verwendet, um gynäkologische chirurgische Eingriffe wie Sakrokolpopexie23 und Gebärmuttertransplantation24 zu untersuchen. Ähnlich wie bei ihren Artgenossen bei Schafen und Schweinen liegt die primäre Einschränkung bei nichtmenschlichen Primaten als Tiermodell für Prolaps in den Kosten für Wartung, Pflege und Unterbringung19.
Obwohl das Becken von Nagetieren horizontal ausgerichtet ist und im Vergleich zum Menschen ein viel kleineres Verhältnis von Kopf zu Geburtskanal aufweist19, eignen sich Ratten für Kleintierstudien zur USLS-Chirurgie, da sie im Vergleich zum menschlichen USL25 eine ähnliche USL-Anatomie, Zellularität, histologische Architektur und Matrixzusammensetzung aufweisen. Darüber hinaus sind sie in Bezug auf Wartung und Boarding von Vorteil. Trotz dieser vorteilhaften Eigenschaften gibt es keine veröffentlichten Berichte über ein Rattenmodell der USLS-Reparatur. Ziel ist es daher, ein Protokoll für Hysterektomie und USLS bei der multiparen Lewis-Ratte zu beschreiben. Dieses Protokoll ist für Forscher von Vorteil, die die Pathophysiologie und die chirurgischen Komponenten von POP mit diesem zugänglichen Tiermodell untersuchen möchten.
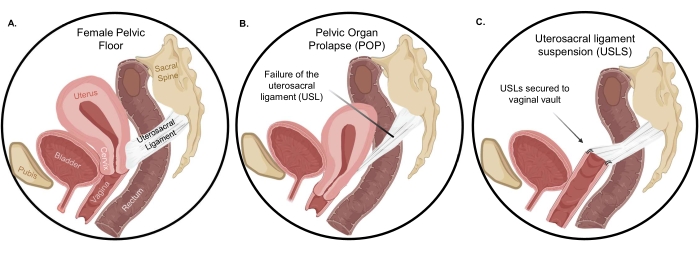
Abbildung 1: Beckenorganprolaps . (A) Die normale Orientierung der Organe in der Bauchhöhle und (B) die dramatische Herablassung der Organe beim Auftreten eines Prolaps. Nach einer Hysterektomie stellt die uterosakrale Bandsuspension (C) die Vagina und die umgebenden Strukturen in ihre richtige anatomische Position wieder her. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
Befolgen Sie alle Richtlinien des Institutional Animal Care and Use Committee (IACUC) und holen Sie die Genehmigung für alle Tierverfahren ein, bevor Sie beginnen. Die Anforderungen an die Technik der aseptischen Chirurgie finden Sie im Leitfaden26 und in den Tierschutzbestimmungen27. Die Studie wurde vom Protokoll 4332-11-20 des Institutional Animal Care and Use Committee der University of Virginia genehmigt. Erhalten Sie multipare (zwei Würfe) weibliche Züchter. Ratten sollten paarweise in einem Vivarium untergebracht werden, das von der American Association for the Accreditation of Laboratory Animal Care akkreditiert ist, und ad libitum mit Futter und Wasser versorgt werden. Bei den Tieren in dieser Studie handelte es sich um Lewis-Ratten, die aus dem Charles River stammten und zwischen 4 und 6 Monate alt waren, um die Zwei-Wurf-Anforderung zu erfüllen. Die Tiere wurden in einem 12-stündigen Hell-Dunkel-Zyklus gehalten.
1. Reparatur von Beckenorganprolaps mit uterosakraler Bandsuspension
- Ausrüstung und Operationsbereichsvorbereitung für die Lebendtierchirurgie
- Bereiten Sie den Operationsbereich so vor, dass das OP-Brett mit umlaufenden Heißwasser-Heizkissen zusammen mit einem sterilen wasserdichten Pad auf 37 °C erhitzt wird. Stellen Sie die Sterilität des Operationsbretts und des Operationsbereichs mit einem bleichmittelfreien Flächendesinfektionsmittel sicher, gefolgt von einem 70%igen Ethanoltuch.
- Verwenden Sie die Autoklav-Hitzesterilisation, um alle autoklavensicheren Verbrauchsmaterialien zu sterilisieren, einschließlich chirurgischer Instrumente, chirurgischer Schwämme (Gaze), Wattestäbchen und eines Einwegtuchs. Besorgen Sie sich steril verpackte OP-Handschuhe.
- Besorgen Sie sich eine elektrische Haarschneidemaschine, Augensalbe, Ethanoltücher, Wattestäbchen und Jodlösung sowie steril verpackte Skalpellklinge und Nähte und legen Sie sie an die Werkbank.
- Tiervorbereitung für die Lebendtierchirurgie
- Legen Sie das Tier vorsichtig in eine Anästhesiekammer, die mit 2% Isofluran versorgt ist, und wiegen Sie das Tier, nachdem die richtige Anästhesieebene erreicht ist. Die richtige Anästhesie wird bestätigt, wenn das Tier nicht auf eine Zehenklemme anspricht.
- Legen Sie das Tier in Bauchlage auf das Operationsbrett, wobei die Nase sicher in den Anästhesiekegel gelegt wird, der mit 2% Isofluran versorgt ist. Tragen Sie Augensalbe auf jedes Auge der Tiere auf.
- Verabreichen Sie Opioid-Analgetikum und NSAID-Analgetikum subkutan (Materialtabelle).
- Legen Sie das Tier in Rückenlage, wie in Abbildung 2 gezeigt, und rasieren Sie das Bauchfell vom Xiphoidfortsatz bis zur Harnröhrenöffnung (8 cm x 4 cm) ab. Sterilisieren Sie den Bauch mit drei Ladungen Jod und Alkohol, um die Inzisionsstelle vorzubereiten.
HINWEIS: Wenn die Rasur zu Blutungen führt, führen Sie eine Blutstillung mit Druck durch, bevor Sie die Haut mit Jod und Alkohol-Vorbereitungspad vorbereiten. Halten Sie Jod für 30 s auf der Haut. - Wenn kein chirurgischer Assistent verfügbar ist, legen Sie sterile Verbrauchsmaterialien und Instrumente auf eine sterile Instrumentenablage, einschließlich steriler Wattestäbchen, Vorhänge, Schwämme (Gaze), chirurgische Klinge, Nähte und chirurgische Marker (optional). Wenn ein chirurgischer Assistent zur Verfügung steht, kann dieser Schritt entfallen, und der Assistent kann die sterilen Instrumente nach Schritt 1.3.1 bereitstellen.
- Hysterektomie und uterosakrale Bandsuspension (USLS)
- Ziehen Sie einen OP-Kittel, eine Kopfbedeckung, eine Maske und sterile Handschuhe an. Drapieren Sie das Tier mit einem sterilen Feld und lassen Sie nur den Bauch frei.
- Machen Sie mit einer Skalpellklinge einen 7 cm langen Einschnitt entlang der Linea alba von knapp unterhalb des Xiphoid-Prozesses bis zur unteren Brustwarzenlinie. Der Schnitt sollte ~0,5-1,0 cm rostral von der Harnröhrenöffnung enden. Machen Sie dann einen Schnitt durch die darunter liegende Muskelschicht. Vermeiden Sie das Blutgefäß der Bauchdecke, um Blutungen zu vermeiden.
- Montieren Sie den Bauchretraktor und untersuchen Sie die Bauchhöhle (Abbildung 3A). Lokalisieren Sie mit einer Iriszange vorsichtig das linke Uterushorn. Die Gebärmutter befindet sich tief im Darm, was oft die Struktur ist, die zuerst beim Eintritt in die Bauchhöhle angetroffen wird. Es ist von Vorteil, zuerst den Eierstock (Abbildung 3B) und das zugehörige Eierstockfettpolster zu identifizieren.
- Heben Sie das linke Uterushorn vorsichtig mit einem Greifer oder einer Mückenklemme an und beginnen Sie mit der Hysterektomie, indem Sie das Horn mit einer Mückenklemme unterhalb des Eierstocks und des Eileiters ligieren. Die Eierstöcke sind empfindliche Strukturen und können durch Manipulation leicht beschädigt oder verwüstet werden. Seien Sie vorsichtig, wenn Sie die Gebärmutterhörner anheben; Fassen Sie das Horn in sicherer Entfernung vom Eierstock, um dies zu erreichen.
- Setzen Sie die Hysterektomie fort, indem Sie benachbarte Gefäße, Bindegewebe und Fett mit einer Mikroschere aus dem Uterushorn klemmen und trimmen. Klemmen Sie das Bindegewebe vor der Entfernung fest, um Blutungen zu reduzieren. Platzieren Sie die Klammern so nah wie möglich an der Uterusgrenzfläche, bis hinunter zum uterozervikalen Übergang (auch als Horngabelung bezeichnet).
- Klemmen Sie das Uterushorn in der Nähe des Gabelungspunktes mit einer Moskito-Pinzette an (Abbildung 4A-C). Entfernen Sie das ipsilaterale Horn nur an der Klemme, um Blutungen zu vermeiden. Diese befindet sich zwischen dem utero-zervikalen Übergang (nur rostral zum Gebärmutterhals) und dem utero-tubalen Ligaturpunkt. Das Vaginalgewölbe bleibt nach der Hysterektomie bestehen (Abbildung 4D).
HINWEIS: Aufgrund des geringen Kalibers der Rattengefäße war die Ligatur der Gebärmutterstümpfe mit einer provisorischen Klemme für diese Operation ausreichend. Diese Technik kann jedoch je nach Bedarf modifiziert werden, indem die Stiele entweder mit Elektrokauter oder Nahtligatur versiegelt werden. - Wiederholen Sie die Schritte 1.3.3-1.3.6 am rechten Gebärmutterhorn, um eine totale Hysterektomie durchzuführen.
- Passen Sie den Bauchretraktor an, um das untere Becken freizulegen. Untersuchen Sie das freiliegende Vaginalgewölbe und das Band- und Bindegewebe des Beckenbodens, das an der Vagina und dem Gebärmutterhals befestigt ist. Wenn möglich, identifizieren Sie den Harnleiter beidseitig, der nur medial zu den Eierstöcken ist.
- Identifizieren Sie die uterosakralen Bänder28,29, die in Abbildung 5A gezeigt sind und am Gebärmutterhals direkt unter den verbleibenden Stümpfen der Gebärmutterhörner (Vaginalgewölbe) befestigt sind. Das Band ist in einer cephalad-medialen Ausrichtung zum Kreuzbein hin verfolgt.
- Legen Sie mit einer 3-0-Polydiaxanon-Naht auf einer kleinen, sich verjüngenden Nadel einen Stich durch das linke uterosakrale Band. Platzieren Sie den Stich hoch auf dem Band, in der Nähe des Kreuzbeins.
- Ziehen Sie am Stich, um sicherzustellen, dass er das uterosakrale Ligamentum erfasst hat - die USL-Struktur wird in den Gebärmutterhals eingeführt, wobei der Ursprung hinter das Rektum taucht, wo er am Kreuzbein befestigt ist. Identifizieren Sie erneut den Harnleiter, um sicherzustellen, dass er nicht in den uterosakralen Stich eingearbeitet oder mit ihm geknickt wurde.
- Führen Sie dann den linken Polydiaxanonstich durch den linken Aspekt des Vaginalgewölbes (Abbildung 5B), wobei darauf zu achten ist, dass sowohl der vordere als auch der hintere Teil der Vaginalmanschette einbezogen werden. Wiederholen Sie die Schritte zum Abschließen des USLS-Verfahrens auf der rechten Seite. Auf Wunsch können mehrere Stiche beidseitig platziert werden.
- Sobald die uterosakralen Stiche beidseitig platziert sind, binden Sie die Naht sicher mit einem quadratischen Knoten, wie in Abbildung 5C gezeigt, so dass das Vaginalgewölbe zum Kreuzbein hin angehoben ist. Damit ist die uterosakrale Bandaufhängung abgeschlossen.
- Schließen der Operationswunde
- Setzen Sie den Bauchinhalt wieder in seine anatomische Position in der Bauchhöhle ein. Schließen Sie die tiefen Schichten der Bauchdecke (Peritoneum, Faszien, Muskeln) mit einem kontinuierlichen Nahtmuster von 4-0 bis 6-0 Polyglactin 910 oder Polydiaxanon-Naht.
- Schließen Sie die Haut mit einem laufenden subkutikulären (oder unterbrochenen) Stich von 4-0 bis 6-0 Polydiaxanon oder Polyglactin 910. Verabreichen Sie das Antibiotikum subkutan nach Bedarf zur Prophylaxe von Infektionen an der Operationsstelle.
- Führen Sie eine postoperative Überwachung durch, bis das Tier wieder genügend Bewusstsein erlangt hat, um das Brustbein aufrechtzuerhalten. Bringen Sie das Tier erst dann in eine Sozialwohnung zurück, wenn es vollständig genesen ist.
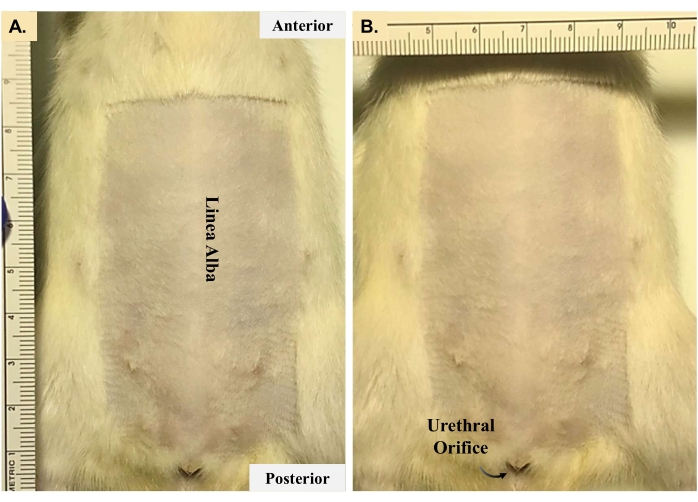
Abbildung 2: Tiervorbereitung für Lebendoperationen. Das Entfernen von Fell aus dem Bereich um die Inzisionsstelle ist für eine ordnungsgemäße aseptische Technik erforderlich. Die in den Tafeln (A) und (B) dargestellten Bereiche sind Richtwerte. Forscher sollten so viele Haare entfernen, dass sterile Instrumente während der Operation keinen Kontakt mit den Haaren haben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
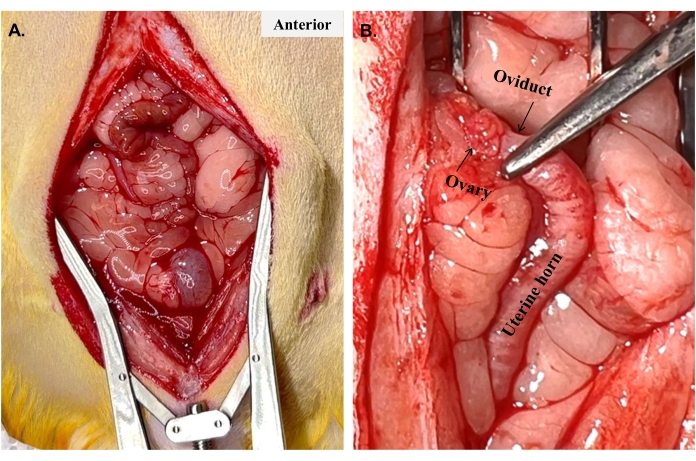
Abbildung 3: Konservierung der Eierstöcke. Die Uterushörner sind in der Regel nicht sichtbar, wenn der Bauch zum ersten Mal geöffnet wird, wie in (A) gezeigt. Sobald ein Horn lokalisiert und verfolgt wird, um (B) den Eierstock und den Eileiter zu finden, wo sie mit dem Horn verbunden sind, kann die Oberseite des Horns geklemmt und das Horn getrennt werden, um mit der Hysterektomie zu beginnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
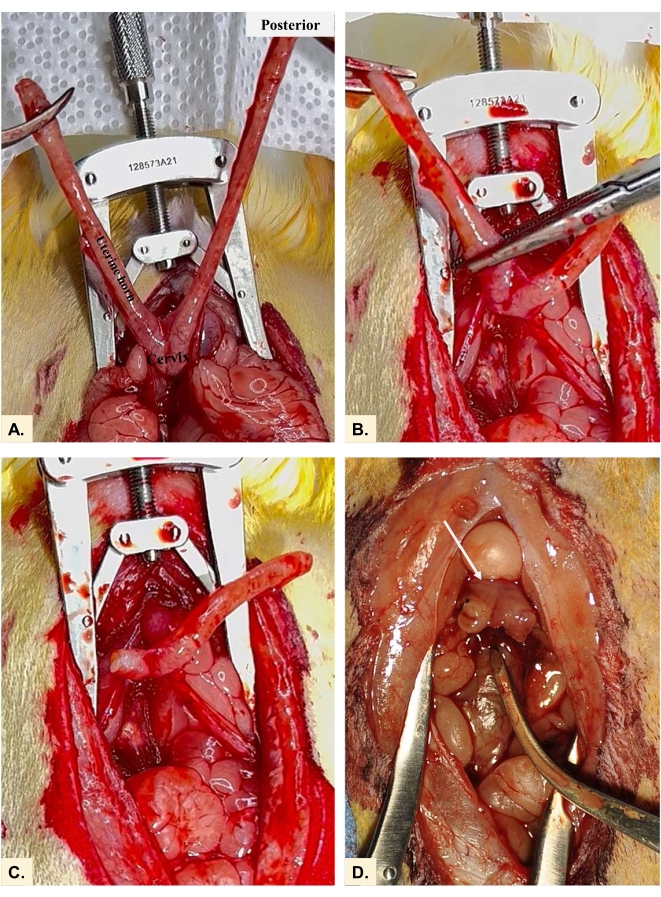
Abbildung 4: Entfernen der Gebärmutterhörner. Bei der Hysterektomie bei der Ratte werden (A) beide Uterushörner (B) am Uterusübergang festgeklemmt und (C) herausgeschnitten. Das Vaginalgewölbe von jedem Horn bleibt mit dem (D) Hals-/Gebärmutterstumpf (Pfeil) erhalten, der sie verbindet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Uterosakrale Bandsuspension. (A) Orientierung der uterosakralen Bänder in Bezug auf die geschaffenen Vaginalgewölbestrukturen. Beim Platzieren von Nähten für die Reparatur der uterosakralen Bandsuspension (USLS) erfassen (B) Nähte das uterosakrale Band und passieren dann sowohl die vorderen als auch die hinteren Aspekte der Vaginalmanschette. (C) Das Vaginalgewölbe, das am Band uterosacralis befestigt ist, ist nun in Richtung Kreuzbein erhöht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Einachsiger Zugversuch
HINWEIS: Das verwendete Prüfsystem und die verwendete Software wurden gemäß den Richtlinien des Herstellers für die Kalibrierung und Prüfung betrieben. Alle Tests fanden bei 22 °C statt.
- Probenvorbereitung
- Euthanasieren Sie die Ratte mit einem von der IACUC zugelassenen pharmakologischen Verfahren. Stellen Sie den Tod durch sekundäre physikalische Methode sicher. Hier wurde die CO2 -Inhalation mit anschließender Herzpunktion verwendet. Legen Sie das Vaginalgewölbe frei, um sich auf die mechanische Zugprüfung vorzubereiten. Führen Sie in der aktuellen Studie Zugversuche an nativen uterosakralen Bändern (Kontrolle) sowie an Tieren durch, die sich wie oben beschrieben einer uterosakralen Bandsuspension unterzogen hatten (POP).
- Testen Sie die Bänder in situ 24 Wochen nach der Operation. Es wird ein Endpunkt von mindestens 8 Wochen empfohlen, um die vollständige Rückresorption der Nähte zu ermöglichen.
- Machen Sie nach der humanen Euthanasie einen Einschnitt in die Linea alba, um den Bauch freizulegen.
- Beginnen Sie mit dem Sezieren des Fettgewebes, bis das Vaginalgewölbe sichtbar ist. Schneiden Sie die Bauchfettpolster weiter ab, bis die intakten USLs deutlich sichtbar sind (Kontrolltiere, Abbildung 6A) oder die Verbindung zwischen dem uterosakralen Band und dem Vaginalgewölbe sichtbar ist (POP-Tiere, Abbildung 6C). Seien Sie vorsichtig, um nicht an der Verbindungsstelle zu ziehen, um Fettgewebe zu entfernen, sondern verwenden Sie vorsichtige Schnitte mit einer Mikroschere, um die Konsistenz zwischen den Proben aufrechtzuerhalten.
- Messen Sie mit einem flexiblen Lineal den Abstand zwischen dem uterosakralen Ansatz (hinter dem Rektum) und dem Vaginalgewölbe. Dieser Wert ist die ursprüngliche Länge des Gewebes.
HINWEIS: Die ursprüngliche Länge des Gewebes, die Messlänge, für Kontroll-USLs betrug 13,4 ± 0,5 mm, während die Messlänge für USL-Reparaturen 12,8 ± 0,4 mm betrug. - Fädeln Sie das Nabelband hinter dem intakten USL (Kontrolle, Abbildung 6B) oder dem USLS-Übergang (POP, Abbildung 6D) so ein, dass das Gewebe auf dem Nabelband zentriert ist. Messen Sie die Höhe und Breite des Gewebes an der Stelle, an der es sich mit dem Nabelband schneidet, mit digitalen Messschiebern. Diese Werte werden zur Berechnung der Querschnittsfläche verwendet.
- Befestigen Sie eine große Druckplatte (Materialtabelle) über den Basisadapter und positionieren Sie das Tier so, dass die Probe unter dem Griffhalter zentriert ist.
- Zugversuch
- Programmieren Sie das Zugprüfregime in die Software: Vorspannung, Vorbedingung, Ziehen bis zum Versagen. Dies folgt früheren mechanischen Testprotokollen für den Beckenboden29 und das Fortpflanzungsgewebe30 .
- Richten Sie das Gerät in Vorbereitung auf den Zugversuch ein. Verwenden Sie für die aktuelle Studie eine 10-N-Wägezelle, einen 3D-gedruckten Griff und einen Basisadapter, um eine Druckplatte anzubringen, wie in Abbildung 7 gezeigt.
HINWEIS: Jede Basiseinrichtung, die die volle Größe des Tieres tragen kann, ist akzeptabel. Verwenden Sie einen Griff, der das Nabelband sicher halten kann. Bei diesem Test wurde ein benutzerdefinierter 3D-gedruckter Halter und Griff aus früheren Studien31,32 verwendet. STL-Dateien wurden als ergänzende Dateien beigefügt.- Positionieren Sie das Tier so, dass die Probe unter dem Griff zentriert ist (Abbildung 8A). Immobilisieren Sie die Beckenregion, die die Probe umgibt, indem Sie das Tier an der Platte befestigen (Abbildung 8B).
- Senken Sie die Wägezelle so ab, dass die Enden des Nabelbandes den Griff leicht erreichen. Befestigen Sie das Nabelband im Griff und lassen Sie das Klebeband locker, um eine Manipulation der Probe zu vermeiden.
- Öffnen Sie den Vorkonditionierungstest in der Softwareoberfläche und beschriften Sie den Test mit dem Probennamen. Stellen Sie sicher, dass die Vorkonditionierungsmethode den Vorladeschritt enthält.
- Klicken Sie hier, um den Vorkonditionierungstest zu starten, bei dem die Probe bei 0,015 N vorbelastet wird. Sobald die Vorspannkraft stabil ist, konditioniert der Test die Probe mit einer Dehnungsrate von 0,1 mm/s für 30 s. Lassen Sie das Gewebe 1 Minute ruhen. Laden Sie während des Wartens das Pull-to-Failure-Testregime.
HINWEIS: Die Vorspannkraft kann je nach Gerätebeschränkungen und Prüfbedingungen variieren. Beziehen Sie sich auf frühere Studien, in denen die berichtete Vorlast von 0,015 N bis 0,1 N 29,33,34,35,36 reicht. - Öffnen Sie das Testregime, das so programmiert ist, dass es zum Scheitern führt. Beschriften Sie den Test mit dem Beispielnamen und klicken Sie auf OK , um zum nächsten Fenster zu gelangen. Geben Sie die Messlänge der Probe ein und klicken Sie dann auf Weiter , um zur Testseite zu gelangen.
- Gleichen Sie alle aus und klicken Sie auf Start. Lassen Sie den Test mit einer Dehnungsrate von 0,1 mm/s laufen, bis das Gewebe zum Versagen gezogen wurde. Der Test liefert Last-Weg-Daten.
- Berechnung von Spannung, Dehnung und Modul für den Zugversuch
- Berechnen Sie anhand der Last-Weg-Daten, der Querschnittsfläche und der Messlänge aus der Probe die Spannung (MPa) und die Dehnung (%) wie zuvor berichtet 37,38,39,40,41. Verwenden Sie die unten gezeigten Gleichungen 1 und 2. Beachten Sie, dass die Dehnung des Bandes während des Tests ebenfalls in diesen Berechnungen berücksichtigt werden sollte.
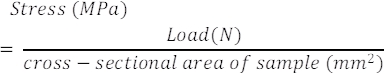 Gleichung 1
Gleichung 1 Gleichung 2
Gleichung 2- Berechnen Sie aus der Last-Weg-Kurve (Abbildung 9A,D) die Steifigkeit (lineare Steigung, N/mm) und die Traglast. Berechnen Sie aus der Spannungs-Dehnungs-Kurve den Tangentialmodul (lineare Steigung, MPa) und die Endspannung. Der lineare Bereich der Spannungsdehnungskurve ist in Abbildung 9B,E mit dem berechneten Tangentialmodul aus diesem Bereich in Abbildung 9C,F für beide Versuchsgruppen dargestellt.
ANMERKUNG: Identifizieren Sie sowohl für die Steifigkeit als auch für den Tangentialmodul den linearen Anteil, indem Sie ein Fenster mit Punkten auswählen, das den R2-Wert für eine lineare Regression37,41 maximiert.
- Berechnen Sie aus der Last-Weg-Kurve (Abbildung 9A,D) die Steifigkeit (lineare Steigung, N/mm) und die Traglast. Berechnen Sie aus der Spannungs-Dehnungs-Kurve den Tangentialmodul (lineare Steigung, MPa) und die Endspannung. Der lineare Bereich der Spannungsdehnungskurve ist in Abbildung 9B,E mit dem berechneten Tangentialmodul aus diesem Bereich in Abbildung 9C,F für beide Versuchsgruppen dargestellt.
- Berechnen Sie anhand der Last-Weg-Daten, der Querschnittsfläche und der Messlänge aus der Probe die Spannung (MPa) und die Dehnung (%) wie zuvor berichtet 37,38,39,40,41. Verwenden Sie die unten gezeigten Gleichungen 1 und 2. Beachten Sie, dass die Dehnung des Bandes während des Tests ebenfalls in diesen Berechnungen berücksichtigt werden sollte.
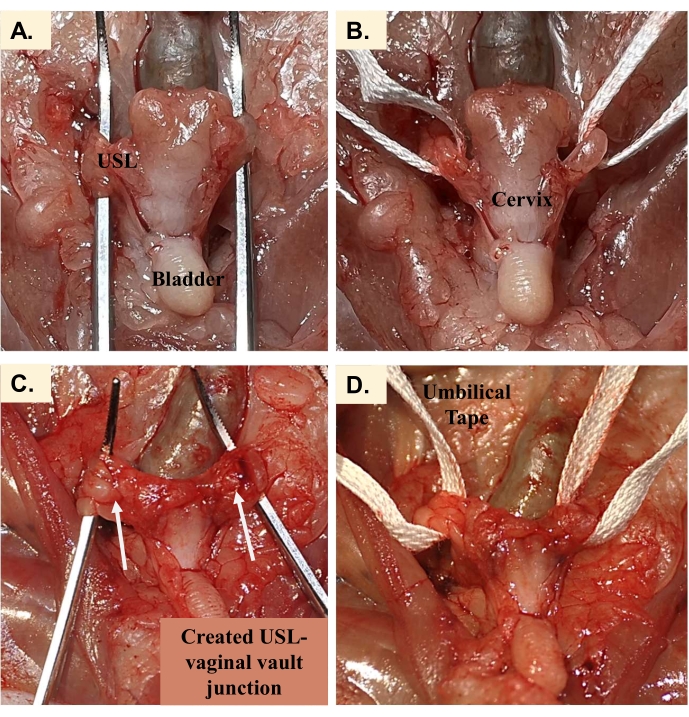
Abbildung 6: Probenvorbereitung für den einachsigen Zugversuch. (A) Die freiliegenden Kontroll-USLs, bevor (B) das Nabelband hinter das Gewebe gefädelt wird. (C) USL-Vaginalgewölbe-Übergang nach der vollständigen Auflösung der Nähte mit (B) dem Nabelband, das zur Vorbereitung des Zugversuchs hinter das Gewebe gefädelt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 7: Das mechanische Prüfsystem . (A) Das Prüfsystem im Zugprüfmodus, das mit (B) 3D-gedrucktem Halter und (C) 3D-gedrucktem Probengriff verwendet wird, komplett mit einem strukturierten Streifen zur Verbesserung der Griffigkeit. Konfiguration der in Tafel (D) gezeigten Teile. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
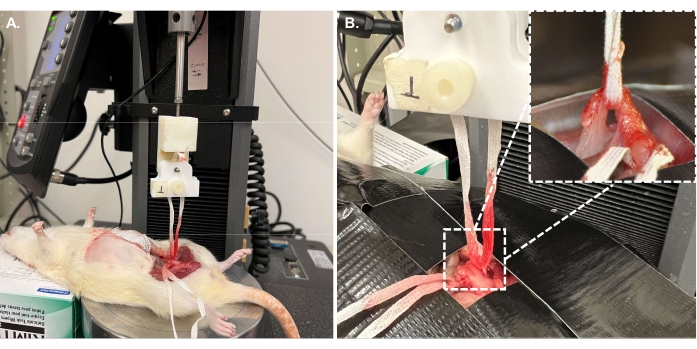
Abbildung 8: Aufbau des Zugversuchs . (A) Die Probe ist unter dem Griff und dem Halter zentriert. (B) Das Tier und das die Probe umgebende Gewebe werden vor Beginn des Zugversuchs stationär gehalten. Wie das Nebenbild zeigt, ist die Sicherung des umgebenden Gewebes unerlässlich, um das interessierende Gewebe zu isolieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
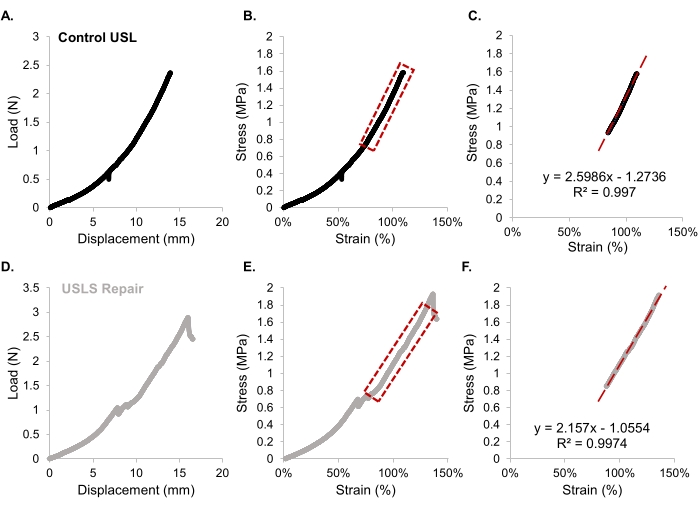
Abbildung 9: Beispiel für die Ausgabe und Analyse von Zugversuchsdaten. (A) Die Last-Weg-Kurve für eine Kontrollprobe, gefolgt von (B) der Spannungsdehnungsanalyse und (C) der Steigungsanpassungsgleichung der Linienkurve, die den Tangentialmodul in MPa zeigt. (D-F) zeigt den gleichen Prozess für eine USLS-Probe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Chirurgische Machbarkeit und uterosakrale Nahtplatzierung
Bei keinem der Tiere traten intraoperative Komplikationen im Zusammenhang mit einer Hysterektomie oder einer uterosakralen Bandsuspension auf. Bei der Entfernung der Gebärmutterhörner kam es zu minimalen Blutungen, sofern das benachbarte Gefäßsystem vor der Entfernung festgeklemmt wurde. Begrenzte Blutungen ermöglichten eine gute Visualisierung der uterosakralen Bänder für die Nahtplatzierung und verhinderten intraoperative Darm-, Rektum-, Harnleiter- oder Blasenverletzungen. Nach dem Einsetzen der Nähte verhinderte der neu gebildete USL-Vaginal-Gewölbeübergang die Bewegung des Gebärmutterhals-/Uterusstumpfes, wie in Abbildung 5C gezeigt. Während der ersten drei postoperativen Tage wurden die Tiere täglich und dann alle zwei Wochen bis zum Ende des Versuchs kontrolliert. Mit den Opioid- und NSAID-Analgetika mit verlängerter Freisetzung, die zum Zeitpunkt der Operation verabreicht wurden, erwiesen sich zusätzliche Analgetika als unnötig. Basierend auf unseren Erfahrungen mit 16 Tieroperationen (n = 8 sowohl für die Kontroll- als auch für die USLS-Gruppe) ist in der ersten Woche nach der Operation mit einer Gewichtsabnahme von durchschnittlich 5,7 ± 1,4% gegenüber dem Operationstag zu rechnen. Wie erwartet, nahmen die Ratten in den folgenden 23 Wochen langsam an Gewicht zu, mit einer durchschnittlichen Gewichtszunahme von 15,1 ± 4,5% im Verlauf des Experiments.
Mechanische Prüfung der USLS-Reparatur
Um die Funktionalität der USLS-Reparatur zu demonstrieren, wurde ein einachsiger Zugversuch durchgeführt. Nach der Euthanasie des Tieres zum gewählten postoperativen Zeitpunkt, 24 Wochen in dieser Studie, sollte der Operationsbereich sorgfältig präpariert werden, um den USL-Vaginal-Gewölbeübergang sichtbar zu machen, wie in Abbildung 6A gezeigt. Im Vergleich zu anderen Methoden zur Untersuchung der Ratten-USLs zusammen mit anderen Stützstrukturen und Beckenorganen29,42 ist die hier beschriebene Methode die erste, die die Ratten-USL isoliert testet. Das in dieser Studie verwendete Nabelband wurde aufgrund seiner Flexibilität strategisch ausgewählt, da die Bandnachgiebigkeit eine minimale Störung des Gewebes während der Zugversuchsvorbereitung ermöglichte. Die Lastverschiebungsdaten müssen daher angepasst werden, um die geringe Dehnung des Nabelbandes zu berücksichtigen. Abbildung 9 zeigt ein Beispiel für Daten, die durch Zugversuche gewonnen wurden, während Abbildung 9A ein Beispiel für ein typisches Spannungs-Dehnungs-Diagramm darstellt. Die Meldung von Spannungs-Dehnungs-Daten wird empfohlen, da diese Informationen normiert und unabhängig von der Größe der Proben34 sind und besser über Studien hinweg verglichen werden können. Für das intakte Band uterosakralis berichten wir strukturelle Eigenschaften wie Traglast (2,9 ± 0,5 N) und Steifigkeit (0,4 ± 0,1 N/mm) sowie normierte Materialeigenschaften wie Endspannung (2,1 ± 0,4 MPa), Enddehnung (1,6 ± 0,5) und Tangentialmodul (4,0 ± 1,1 MPa). In den einachsigen Tests, die von Moalli et al. an den Fortpflanzungsorganen der Ratte und all ihren unterstützenden Gewebeverbindungen durchgeführt wurden, berichteten sie über eine Endbelastung bei Versagen (13,2 ± 1,1 N) und eine Steifigkeit (2,9 ± 0,9 N/mm), die höher war als die isolierte USL29. Die Arbeit von Moalli et al. und andere Literatur34,35 erwähnen die hohe Variabilität zwischen den getesteten Proben, wie sie in den hier vorgestellten Daten gezeigt wird. Für die Reparatur der uterosakralen Bandaufhängung stellten wir fest, dass alle strukturellen Materialeigenschaften (Steifigkeit, 0,33 ± 0,13 N/mm; Traglast, 2,6 ± 1,3 N) und normierte Materialeigenschaften (Endspannung, 1,8 ± 0,7 MPa; Enddehnung 1,3 ± 0,3; Tangentialmodul, 3,0 ± 0,9 MPa) niedriger waren als die der nativen USL.
Diskussion
Das Protokoll zeichnet sich durch mehrere Vorteile aus. Unseres Wissens ist es die erste veröffentlichte Beschreibung von USLS im Rattenmodell und wird zukünftigen Forschern reproduzierbare Schritte zur Durchführung dieses Verfahrens im Forschungsumfeld liefern. Zweitens fügen wir ein neuartiges Protokoll für die Zugprüfung der nativen und chirurgischen Schnittstelle der USL hinzu. Das Zugversuchsprotokoll könnte in ähnlichen Studien verwendet werden, in denen neue Tissue-Engineering-Ansätze zur Verbesserung nativer Gewebereparaturen wie USLS untersucht werden. Darüber hinaus ist das Rattenmodell selbst für die Untersuchung von Beckenbodenerkrankungen aufgrund der einfachen Handhabung/des Einsteigens, der kurzen Lebensdauer und der Kosteneffizienz im Vergleich zu größeren Tiermodellen nützlich. Zu den Einschränkungen des Protokolls gehört die Unfähigkeit, eine der Hauptkomplikationen von USLS, das Abknicken der Harnleiter, zu beurteilen. Trotzdem hatten wir in dieser Studie keine Fälle von vermuteter Harnleiterverletzung. Eine weitere Überlegung ist, dass die horizontale Ausrichtung des Beckens, das kleine Verhältnis des fetalen Kopf-zu-Geburts-Kanals und das Fehlen eines spontanen Prolaps im Rattenmodell die Anwendbarkeit der Ergebnisse auf den Menschen einschränken. Die Verwendung von multiparen Ratten ist jedoch eine Stärke dieser Studie, da dies der führende Risikofaktor bei der Entwicklung von POP3 ist.
Die Etablierung eines erfolgreichen Protokolls für Hysterektomie und USLS bei der Lewis-Ratte wird ein nützliches Werkzeug für zukünftige Forscher sein, die chirurgische Komponenten von POP untersuchen und gleichzeitig die Variabilität beim Testen des mechanischen Verhaltens der USL minimieren. Chirurgische Tiermodelle sind insofern von Vorteil, als sie es Forschern ermöglichen, klinisch relevante Experimente zu entwerfen, die Parität, Körpermasse, Krankheit und Ernährung kontrollieren34 und gleichzeitig das ethische Risiko einer ersten Studie am Menschen mindern. Darüber hinaus ermöglichen standardisierte Modelle für POP den Forschern, die Einschränkungen der Entnahme von menschlichem Gewebe zu umgehen. Insbesondere die in diesem Protokoll beschriebenen Zugprüfverfahren ermöglichen die Kohärenz zwischen den Studien. Frühere Nagetiermodelle testeten die mechanischen Eigenschaften des gesamten Beckenbereichs, der den Gebärmutterhals, die Vagina und die multiplen Beckenstützbänder umfasst29,42. Die hier beschriebenen Methoden ermöglichen es, die USL so zu messen, dass die nativen spinalen und zervikalen Anhaftungen erhalten bleiben. Es ist zu beachten, dass die Zugversuchsmethoden nicht nur die USL bewerten, sondern die USL in Kombination mit ihrer Insertion am Kreuzbein und am Gebärmutterhals. Dies ist eine Stärke der Studie, da sie die üblichen In-situ-Kräfte widerspiegelt, denen das Band ausgesetzt ist. Wir erkennen an, dass das mechanische Verhalten des isolierten Bandes anders wäre, wenn es ex vivo ohne seine nativen Anhänge getestet würde. Dies gilt insbesondere, da die Rattenstrukturen klein sind und die Durchführbarkeit der Entnahme einer für Ex-vivo-Tests geeigneten Probe einschränken. Die USLs erfahren in situ eine Belastung in mehrere Richtungen, so dass die einachsige Natur des Tests eine Einschränkung darstellt, aber die Verwendung dieser Methode ermöglicht aussagekräftige Vergleiche zwischen früheren Studien zur USL-Mechanik von Ratten29,42. Obwohl es derzeit kein allgemein akzeptiertes Standard-Protokoll für mechanische Tests gibt, wird dieses Modell ein nützliches Werkzeug für zukünftige Tissue-Engineering-Studien in diesem Bereich sein.
Mehrere Schritte, die in diesem Protokoll beschrieben werden, sind entscheidend für die Gesundheit und das Wohlbefinden der Tiere sowie für die Reproduzierbarkeit der USLS-Operation und der anschließenden Zugtests. Erstens ist es wichtig, sowohl das Analgetikum als auch die entzündungshemmenden Medikamente zu erhalten, die beschrieben werden, da sich das Analgetikum allein als unzureichend für die Schmerzbehandlung erwiesen hat. Das prophylaktische Antibiotikum verringert das Risiko einer Infektion an der Operationsstelle und ist der Behandlungsstandard in der Humanchirurgie. In Bezug auf den USLS-Operationseingriff sind die Vermeidung von Schäden an den Eierstöcken und die Minimierung des Blutverlusts für eine erfolgreiche Operation unerlässlich. In den Schritten 1.3.3 und 1.3.4 wird beschrieben, wie die Oberseite des Uterushorns vom angrenzenden Eierstock getrennt wird. Es sollte darauf geachtet werden, dass diese Dissektion auf der Seite des Gebärmutterhorns beibehalten wird, um eine Störung empfindlicher Gefäße um den Eierstock herum zu vermeiden, die zu übermäßigen Blutungen führen kann. Bemerkenswert ist, dass andere Forscher gezeigt haben, dass die Eierstockfunktion nach Entfernung der Uterushörner erhalten bleibt43. Wenn die Eierstöcke gestört oder entfernt werden, wird außerdem die gesamte Kollagenfibrillenarchitektur gestört, wodurch sich die mechanischen Eigenschaften ihres Gewebes verändern44,45. Sobald das Uterushorn sicher vom Eierstock getrennt ist, gibt es eine klare Dissektionsebene, die eine Isolierung des Uterushorns von den umgebenden Fettpolstern und Gefäßen ermöglicht. Trotz der klaren Dissektionsebene sollten die Stiele entlang des Uterushorns vor der Durchtrennung mit einer Mikroschere mit einer Klemme gesichert werden. Im Gegensatz zur chirurgischen Praxis beim Menschen haben wir festgestellt, dass eine Nahtligatur der Hysterektomiestiele unnötig ist, da das Einklemmen des Stiels vor der Durchtrennung eine ausreichende Blutstillung gewährleistet. Schritt 1.3.6 des Protokolls beschreibt diesen sorgfältigen Prozess zur Minimierung des Blutverlusts. Bei der Durchführung der Hysterektomie sollte sehr darauf geachtet werden, die Harnleiter wie in den Schritten 1.3.6 und 1.3.8 beschrieben zu identifizieren. Das Verständnis der anatomischen Nähe des Harnleiters ist von entscheidender Bedeutung, da eine der häufigsten Komplikationen im Zusammenhang mit den USLs beim Menschen eine Harnleiterverletzung ist46.
Abschließend stellen wir ein neuartiges Protokoll zur Durchführung einer Hysterektomie, einer uterosakralen Bandsuspension und eines Zugtests der USL in einem Rattenmodell vor. Wir gehen davon aus, dass unsere Ergebnisse zukünftigen Grundlagenforschern helfen werden, indem sie eine klare, reproduzierbare Beschreibung dieser Verfahren liefern und dadurch die Weiterentwicklung der Beckenorganprolapsforschung ermöglichen.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken Prof. Silvia Blemker für die Nutzung ihres Instron und Prof. George Christ für die Nutzung seines Operationsraums sowie der 3D-gedruckten Halterung und des Griffs. Diese Arbeit wurde von der UVA-Coulter Translational Research Partnership und dem DoD (W81XWH-19-1-0157) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Alcohol prep pad | BD | 326895 | |
| Artificial Tear Ointment | American Health Service Sales Corp | PH-PARALUBE-O | |
| Bluehill software | Instron | Bluehill 3 | |
| Cavicide 1 disinfectant | Fisher Scientific | 22 998 800 | |
| Compression platean | Instron | 2501-163 | |
| Cotton swabs | Puritan Medical | 806-WC | |
| Gauze Sponge, 8-Ply | VWR | 95038-728 | |
| Mosquito Forceps | Medline Industries | MMDS1222115 | |
| Needle Holder | Medline Industries | DYND04045 | |
| Operating Scissors, 5½", Sharp | American Health Service Sales Corp | 4-222 | |
| Opioid Analgesic (Buprenorphine XR) | Fidelis Animal Health | Ethiqa XR | 0.65 mg/kg SC Q72 |
| NSAID Analgesic (Meloxicam SR) | Wildlife Pharmaceuticals, LLC | Meloxicam SR | 1 mg/kg SC q72 |
| PDS II, 3-0 Polydioxanone Suture, SH-1 | Ethicon | Z316H | |
| PDS II, 5-0 P olydioxanone Suture, RB-1 | Ethicon | Z303H | |
| Retractor | Medline Industries | MDS1862107 | |
| Scalpel Blade Stainless Surgical #10 | Miltex | 4-310 | |
| Scalpel Handle | Medline Industries | MDS15210 | |
| Scissor, Micro, Curved, 4.5" | Westcott | MDS0910311 | |
| Single Column Universal Testing System | Instron | 5943 S3873 | 1 kN force capacity, 10 N load cell |
| Sterile Natural Rubber Latex Gloves | Accutech | 91225075 | |
| Suture,Vicryl,6-0,P-3 | Ethicon | J492G | |
| Tape,Umbilical,Cotton,1/8X18" | Ethicon | U10T | |
| Tension and Compression Load Cell | Instron | 2530-10N | 10N load cell (1 kgf, 2 lbf) |
| Veterinary surgical adhesive (skin glue) | Covetrus | 31477 |
Referenzen
- Olsen, A. L., et al. Epidemiology of surgically managed pelvic organ prolapse and urinary incontinence. Obstetrics and Gynecology. 89 (4), 501-506 (1997).
- Wu, J. M., et al. Lifetime risk of stress urinary incontinence or pelvic organ prolapse surgery. Obstetrics and Gynecology. 123 (6), 1201-1206 (2014).
- Kenton, K., Mueller, E. R. The global burden of female pelvic floor disorders. BJU International. 98, 1-7 (2006).
- Herschorn, S. Female pelvic floor anatomy The pelvic floor, supporting structures, and pelvic organs. Reviews in Urology. 6, 2-10 (2004).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 369 (9566), 1027-1038 (2007).
- Campbell, R. M. The anatomy and histology of the sacrouterine ligaments. American Journal of Obstetrics and Gynecology. 59 (1), 1-12 (1950).
- Reisenauer, C., et al. The role of smooth muscle in the pathogenesis of pelvic organ prolapse - An immunohistochemical and morphometric analysis of the cervical third of the uterosacral ligament. International Urogynecology Journal and Pelvic Floor Dysfunction. 19 (3), 383-389 (2008).
- Lavelle, R. S., Christie, A. L., Alhalabi, F., Zimmern, P. E. Risk of prolapse recurrence after native tissue anterior vaginal suspension procedure with intermediate to long-term followup. Journal of Urology. 195 (4), 1014-1020 (2016).
- Jelovsek, J. E., et al. Effect of uterosacral ligament suspension vs sacrospinous ligament fixation with or without perioperative behavioral therapy for pelvic organ vaginal prolapse on surgical outcomes and prolapse symptoms at 5 years in the OPTIMAL randomized clinical trial. JAMA - Journal of the American Medical Association. 319 (15), 1554-1565 (2018).
- Bradley, M. S., et al. Vaginal uterosacral ligament suspension: A retrospective cohort of absorbable and permanent suture groups. Female Pelvic Medicine & Reconstructive Surgery. 24 (3), 207-212 (2018).
- Cola, A., et al. Native-tissue prolapse repair: Efficacy and adverse effects of uterosacral ligaments suspension at 10-year follow up. International Journal of Gynecology and Obstetrics. , (2022).
- Sung, V. W., Washington, B., Raker, C. A. Costs of ambulatory care related to female pelvic floor disorders in the United States. American Journal of Obstetrics and Gynecology. 202 (5), 1-4 (2010).
- Subak, L. L., et al. Cost of pelvic organ prolapse surgery in the United States. Obstetrics and Gynecology. 98 (4), 646-651 (2001).
- Siddiqui, N. Y., et al. Mesh sacrocolpopexy compared with native tissue vaginal repair: A systematic review and meta-analysis. Obstetrics & Gynecology. 125 (1), 44-55 (2015).
- FDA takes action to protect women's health, orders manufacturers of surgical mesh intended for transvaginal repair of pelvic organ prolapse to stop selling all devices. FDA News Release. , Available from: https://www.fda.gov/news-events/press-announcements/fda-takes-action-protect-womens-health-orders-manufacturers-surgical-mesh-intended-transvaginal (2019).
- Brincat, C. A. Pelvic organ prolapse reconsidering treatment, innovation, and failure. JAMA - Journal of the American Medical Association. 322 (11), 1047-1048 (2019).
- Cundiff, G. W. Surgical innovation and the US Food and Drug Administration. Female Pelvic Medicine & Reconstructive Surgery. 25 (4), 263-264 (2019).
- Luchristt, D., Weidner, A. C., Siddiqui, N. Y. Urinary basement membrane graft-augmented sacrospinous ligament suspension: a description of technique and short-term outcomes. International Urogynecology Journal. 33 (5), 1347-1350 (2022).
- Couri, B. M., et al. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics and Gynecology. 7 (3), 249-260 (2012).
- Mori da Cunha, M. G. M. C., et al. Animal models for pelvic organ prolapse: systematic review. International Urogynecology Journal. 32 (6), 1331-1344 (2021).
- Kasabwala, K., Goueli, R., Culligan, P. J. A live porcine model for robotic sacrocolpopexy training. International Urogynecology Journal. 30 (8), 1371-1375 (2019).
- Mansoor, A., et al. Development of an ovine model for training in vaginal surgery for pelvic organ prolapse. International Urogynecology Journal. 28 (10), 1595-1597 (2017).
- Liang, R., et al. Impact of prolapse meshes on the metabolism of vaginal extracellular matrix in rhesus macaque. American Journal of Obstetrics and Gynecology. 212 (2), 1-7 (2015).
- Johannesson, L., et al. Preclinical report on allogeneic uterus transplantation in non-human primates. Human Reproduction. 28 (1), 189-198 (2013).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- National Research Council. Guide for the Care and Use of Laboratory Animals: Eighth Edition. , National Academies Press. (2011).
- Federal Animal Welfare Regulations. National Archives. , Available from: https://www.ecfr.gov/current/title-9/chapter-l/subchapter-A/part-2/subpart-C/section-2.31 (2022).
- Ma, Y., et al. Knockdown of Hoxa11 in vivo in the uterosacral ligament and uterus of mice results in altered collagen and matrix metalloproteinase activity. Biology of Reproduction. 86 (4), 100(2012).
- Moalli, P. A., et al. A rat model to study the structural properties of the vagina and its supportive tissues. American Journal of Obstetrics and Gynecology. 192 (1), 80-88 (2005).
- Yoshida, K., et al. Mechanics of cervical remodelling: Insights from rodent models of pregnancy. Interface Focus. 9 (5), 20190026(2019).
- Christ, G. J., Sharma, P., Hess, W., Bour, R. Modular biofabrication platform for diverse tissue engineering applications and related method thereof. , (2020).
- Smith, K., Christ, G. J. Incorporation of in vitro double seeding for enhanced development of tissue engineered skeletal muscle implants. , University of Virginia. (2019).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Baah-Dwomoh, A., McGuire, J., Tan, T., De Vita, R. Mechanical properties of female reproductive organs and supporting connective tissues: A review of the current state of knowledge. Applied Mechanics Reviews. 68 (6), 1-12 (2016).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Kurtaliaj, I., Golman, M., Abraham, A. C., Thomopoulos, S. Biomechanical testing of murine tendons. Journal of Visualized Experiments. (152), e60280(2019).
- Griffin, M., et al. Biomechanical characterization of human soft tissues using indentation and tensile testing. Journal of Visualized Experiments. (118), e54872(2016).
- Feola, A., et al. Parity negatively impacts vaginal mechanical properties and collagen structure in rhesus macaques. American Journal of Obstetrics and Gynecology. 203 (6), 1-8 (2010).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics and Gynecology and Reproductive Biology. 144, Suppl 1 146-158 (2009).
- Lowder, J. L., et al. Adaptations of the rat vagina in pregnancy to accommodate delivery. Obstetrics and Gynecology. 109 (1), 128-135 (2007).
- Koebele, S. V., et al. Hysterectomy uniquely impacts spatial memory in a rat model: A role for the nonpregnant uterus in cognitive processes. Endocrinology. 160 (1), 1-19 (2019).
- Kafantari, H., et al. Structural alterations in rat skin and bone collagen fibrils induced by ovariectomy. Bone. 26 (4), 349-353 (2000).
- Daghma, D. E. S., et al. Computational segmentation of collagen fibers in bone matrix indicates bone quality in ovariectomized rat spine. Journal of Bone and Mineral Metabolism. 36 (3), 297-306 (2018).
- Manodoro, S., Frigerio, M., Milani, R., Spelzini, F. Tips and tricks for uterosacral ligament suspension: how to avoid ureteral injury. International Urogynecology Journal. 29 (1), 161-163 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten