Method Article
Análisis en tiempo real de la comunicación neuronal intestino-cerebro: dinámica del calcio en toda la corteza en respuesta a la estimulación intestinal de la glucosa
En este artículo
Resumen
La comunicación intestino-cerebro, facilitada por el nervio vago, es crucial para la comunicación entre el sistema endocrino gastrointestinal y el cerebro. Sin embargo, aún no se comprende si la inyección intragástrica de glucosa puede cambiar la actividad cortical. Aquí, ofrecemos un protocolo integral para observar los cambios en la actividad cortical después de la inyección de glucosa en el duodeno.
Resumen
La comunicación entre el tracto gastrointestinal y el cerebro después de la absorción de nutrientes juega un papel esencial en la preferencia de alimentos, el metabolismo y los comportamientos alimentarios. En particular en lo que respecta a los nutrientes específicos, muchos estudios han dilucidado que la asimilación de la glucosa dentro de las células epiteliales intestinales instiga la activación de muchas moléculas de señalización. Las hormonas como el péptido similar al glucagón-1 son conocidas como mediadores de señalización por excelencia. Dado que las hormonas influyen predominantemente en el cerebro a través de las vías circulatorias, modulan lentamente la actividad cerebral.
Sin embargo, estudios recientes han demostrado dos vías intestinales y cerebrales expeditas facilitadas por el sistema nervioso autónomo. Uno opera a través de la vía neural aferente espinal, mientras que el nervio vago media el otro. En consecuencia, las respuestas cerebrales tras la asimilación de la glucosa en el tracto gastrointestinal son complicadas. Además, dado que la estimulación intestinal finalmente induce diversas actividades corticales, incluidas las respuestas sensoriales, nociceptivas, de recompensa y motoras, es necesario emplear metodologías que faciliten la visualización de circuitos cerebrales localizados y actividades pancorticales para comprender completamente la transmisión neuronal intestino-cerebro. Algunos estudios han indicado alteraciones precipitadas en las concentraciones de iones de calcio (Ca2+) dentro del hipotálamo y el área tegmental ventral de forma independiente a través de diferentes vías después de la estimulación intestinal. Sin embargo, no se sabe si hay cambios en la actividad de la corteza cerebral.
Para observar la actividad de la corteza cerebral después de la inyección intragástrica de glucosa, desarrollamos una técnica de imagen para la visualización en tiempo real de la dinámica de Ca2+ en toda la corteza a través de un cráneo completamente intacto, utilizando ratones transgénicos que expresan indicadores de Ca2+ codificados genéticamente. Este estudio presenta un protocolo completo para una técnica diseñada para monitorizar la imagen de Ca2+ ancho de la corteza transcraneal inducida por estimulación intestinal después de la inyección de glucosa intragástrica a través de un catéter implantado. Los datos preliminares sugieren que la administración de una solución de glucosa en el intestino activa la corteza frontal, que no responde a la administración de agua.
Introducción
Principalmente, la detección intestinal de la glucosa se produce a través de los receptores del sabor dulce (Tas1r2, Tas1r3) y el cotransportador de sodio-glucosa 1 (SGLT-1) ubicado en las células enteroendocrinas dentro de la luz intestinal 1,2,3,4,5,6. La sensación de glucosa en el cerebro es un proceso que generalmente se extiende de minutos a horas después de su absorción en el intestino, una ocurrencia basada principalmente en el aumento de los niveles de azúcar en la sangre plasmática y la liberación de hormonas 7,8,9,10,11 (por ejemplo, péptido similar al glucagón-1 [GLP-1], péptido YY (PYY) y polipéptido insulinotrópico dependiente de glucosa [GIP]). Alcanzan el núcleo arqueado del hipotálamo (ARC), donde se unen a las neuronas pro-opiomelanocortina (POMC) y a las neuronas de la proteína relacionada con agutí (AgRP) mediante el flujo sanguíneo y el nervio vago (nervio parasimpático)12,13,14. El cambio en la actividad de estas neuronas conduce al control del metabolismo y del comportamiento alimentario15,16.
La literatura reciente destaca cada vez más la importancia de la señalización neuronal intestino-cerebro después de la absorción de glucosa. Esta compleja vía se puede clasificar en dos mecanismos principales. La primera implica la activación de las aferencias espinales, que en última instancia influyen en la actividad neuronal de AgRP en el ARC. El segundo mecanismo implica la estimulación del nervio vago a través de conexiones con células epiteliales. Dadas las múltiples formas en que las células epiteliales intestinales pueden activar el nervio vago13, su papel se considera versátil.
Una proporción significativa de las actividades del nervio vago intestinal y del nervio aferente espinal se asocian con comportamientos alimentarios 17,18,19. Sin embargo, la evidencia emergente sugiere que ciertas fibras del nervio vago, que se proyectan a las "células de neurópodos", están implicadas en la preferencia por la glucosa. Las células neurópodas, un subconjunto de las células enteroendocrinas, expresan SGLT-1 en su lado luminal y transmiten estímulos sensoriales a un nervio vago a través de las sinapsis glutamatérgicas 2,20,21,22. La activación del nervio vago desencadena neuronas dopaminérgicas en el área tegmental ventral (VTA) en cuestión de segundos19. En particular, la inhibición de la activación vagal, particularmente en el duodeno, el uso de un antagonista del glutamato reduce la preferencia por la sacarosa en ratones1. Esto subraya el papel crítico de la activación de las células de neurópodos en la modulación del comportamiento de elección de alimentos después de la ingesta de glucosa2.
A pesar de estos avances, una comprensión profunda de los mecanismos de detección rápida de la glucosa intestinal y su efecto sobre las actividades corticales sigue siendo un enigma complejo. Aunque la activación cerebral controlada por las neuronas AgRP no incluye la corteza cerebral23, se sabe que las neuronas dopaminérgicas en el VTA se proyectan a la corteza cerebral. Sin embargo, se desconoce si la rápida activación neuronal dopaminérgica de VTA después de la detección de glucosa realmente activa la corteza cerebral. Para dilucidar este mecanismo, investigamos el potencial de la administración intragástrica de glucosa para influir rápidamente en la dinámica cortical de Ca2+ en ratones transgénicos que expresan un indicador de calcio codificado genéticamente.
Este artículo presenta un método de bajo costo y menos invasivo para comprender de manera integral los cambios en la actividad cortical después de la administración de glucosa intragástrica utilizando imágenes de Ca2+ de la corteza ancha en ratones Recientemente, la técnica de imagen de Ca2+ de la corteza transcraneal ancha a través de un cráneo intacto, utilizando ratones transgénicos que expresan indicadores de calcio codificados genéticamente, ha ganado popularidad24. En particular, la línea de ratones transgénicos BAC GLT-1-G-CaMP7 #817 (también conocida como ratón G7NG817) empleada en este estudio expresa el sensor Ca2+ , G-CaMP7, en neuronas y astrocitos25. Debido a su alta densidad de expresión en la corteza cerebral, esta línea de ratones transgénicos es especialmente adecuada para la obtención de imágenes de Ca2+ de la corteza transcraneal utilizando un microscopio de epifluorescencia estándar.
Protocolo
Todos los protocolos experimentales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Ochanomizu, Japón (protocolos de estudio en animales 2017). Todos los experimentos con animales se realizaron de acuerdo con las directrices para la experimentación con animales de la Universidad de Ochanomizu que se ajustan a las Directrices Fundamentales para la Realización Adecuada de Experimentos con Animales y Actividades Relacionadas en Instituciones Académicas de Investigación (Ministerio de Educación, Cultura, Deportes, Ciencia y Tecnología, Japón). Se tomaron medidas para minimizar el número de animales utilizados. Este estudio se llevó a cabo de acuerdo con las directrices ARRIVE.
1. Preparación de ratones transgénicos
- Para seguir este experimento, utilice la línea de ratones transgénicos BAC GLT-1-G-CaMP7 #817 machos y hembras adultos, es decir, G7NG817 ratones24,25 (mayores de 8 semanas). La cepa de fondo de G7NG817 ratones25 es C57BL/6J.
- Aloje a los ratones en un ciclo de luz/oscuridad de 12 h / 12 h y críalos en grupos de hasta cinco ratones.
2. Creación de catéteres
- Utilice unas tijeras para ajustar el tubo de silicona (diámetro interior de 0,5 mm, diámetro exterior de 1,0 mm) a una longitud precisa de 7 cm (Figura 1A-a).
NOTA: Antes de los procedimientos, se esterilizaron las tijeras y el tubo de silicona. - Adherir diminutas perlas de plástico (diámetro interior 3 mm, diámetro exterior 5 mm) al tubo a medida, asegurándose de que estén situadas a 3 mm de su extremo (Figura 1A-b). Fije las cuentas de forma segura con pegamento de cianoacrilato (se aceptan variantes médicas o estándar).
- Extraer el ápice de una aguja de 23 G y posteriormente cortar a 1,5 cm de la punta de la aguja (Figura 1A-c).
- Introduzca la aguja seccionada de 23 G del paso 2.3 en la extremidad del tubo de silicona, opuesta a donde se fijaron las cuentas (Figura 1A-d).
3. Creación de inyectores
- Utilice alicates estériles para extirpar a 1 cm de la punta de la aguja (Figura 1B-a).
NOTA: Asegúrese de que el orificio en el extremo cortado conserve su integridad y no se deforme, ya que cualquier distorsión podría obstruir el flujo de la solución de inyección. - Acople la aguja de inyección de 23 g adaptada del paso 3.1.1 a una jeringa de 2,5 ml (figura 1B-b).
- Segmente un tubo de silicona a la longitud requerida (un tubo de silicona de 15 cm en este experimento) y colóquelo sobre la aguja de inyección de 23 G (Figura 1B-c).
NOTA: El volumen de solución dispensada fluctuará según la longitud del tubo. Por ejemplo, con un tubo de 15 cm, aproximadamente 50 μL de solución permanecerán después del experimento. - Corte la aguja de inyección de 23 g a 1,5 cm de la punta de la aguja.
- Unir la porción seccionada del paso 3.4 con el catéter de silicona diseñado en el paso 3.3 (Figura 1B-d).
NOTA: Asegúrese de que los orificios creados en los pasos 3.1 y 3.4 permanezcan sin distorsiones después de la incisión. Si es necesaria una rectificación, emplee alicates para restaurar su configuración circular.
4. Localización gástrica
- Administrar anestesia al ratón mediante inhalación de isoflurano al 3,0% en una cámara específica. Aplique ungüento oftálmico para prevenir la sequedad ocular.
- Transfiera delicadamente el ratón anestesiado de la cámara de inhalación a la mesa quirúrgica después de verificar el estado anestesiado del ratón. Proporcionar soporte térmico durante todo el procedimiento.
- Coloque al ratón en decúbito supino, alineando su boca cerca del aparato de inhalación, y module la concentración de isoflurano de 3,0% a 2,0%.
NOTA: Desenganche el segmento inferior de la mascarilla de isoflurano de su contraparte superior y ancle la mascarilla separada (segmento superior) a la mesa quirúrgica con cinta adhesiva. - Complemente la cavidad oral, las extremidades anteriores y las extremidades traseras del ratón con cinta adhesiva.
NOTA: Al fijar el ratón a la mesa, se pueden prevenir los errores quirúrgicos debidos al movimiento incluso si el ratón está anestesiado. - Retire el pelo del ratón de la parte superior izquierda del abdomen (150% del área alrededor del sitio quirúrgico) usando crema depilatoria. Aplique un analgésico local por vía tópica en el sitio de la cirugía y espere 5 minutos antes de continuar.
- Aplique un gel anestésico local en la piel abdominal y espere de 5 a 10 minutos. Luego, desinfecte el área quirúrgica 3 veces con rondas alternas de yodoforo y etanol al 70%. Confirme la profundidad de la anestesia mediante un pellizco en el dedo del pie y cubra al animal con paños quirúrgicos estériles. Realice una incisión en la piel de aproximadamente 1,5 cm de longitud (Figura 1C-b), situada 1 cm a la derecha de la mediana abdominal y 5 mm por debajo de la apófisis xifoides (Figura 1C-c). A continuación, realiza una incisión de 1,5 cm en la pared abdominal en el mismo lugar que la incisión cutánea inicial.
NOTA: Tenga cuidado para evitar infligir daño al hígado subyacente. - Reposicione delicadamente el lóbulo hepático izquierdo lateralmente con pinzas de punta roma, revelando el estómago que se encuentra debajo.
5. Inserción del catéter
- Eleve el estómago y sáquelo con cuidado a través de la incisión.
NOTA: Ejerza el máximo cuidado para preservar la integridad de los órganos adyacentes, especialmente el hígado, y absténgase de ejercer una fuerza indebida sobre el estómago. - Utiliza unas tijeras para crear una perforación diminuta (de aproximadamente 1,5 mm de diámetro) en el antro pilórico.
- Introduzca el extremo del catéter en la perforación, asegurándose de que la perla esté en contacto directo con el antro pilórico.
NOTA: El catéter se desinfecta con una solución de gluconato de clorhexidina al 0,1 a 0,5% antes de la inserción. - Adhiera la perla del catéter al estómago empleando pegamento de cianoacrilato de grado médico.
NOTA: Asegúrese de que el estómago permanezca libre de los órganos circundantes. - Verifique la fijación firme del catéter al estómago, luego vuelva a colocar delicadamente el estómago en su ubicación innata debajo del lóbulo hepático izquierdo.
- Suturar la pared abdominal, permitiendo que el catéter se extienda externamente, utilizando una sutura de polidioxanona (PDS). Después de eso, cierre la incisión cutánea de manera análoga al cierre abdominal.
- Vuelva a colocar suavemente el ratón en una jaula desinfectada.
NOTA: Los ratones postoperatorios deben estar alojados individualmente. Aplique un analgésico local por vía tópica sobre el cierre de la herida y siga los planes analgésicos recomendados por las directrices institucionales locales. - Permita un período mínimo de recuperación de 48 h en un entorno estándar.
NOTA: Un extremo del catéter insertado en el estómago del ratón se cierra con una aguja de 23G con una punta sellada para evitar la entrada de sustancias extrañas y evitar mordeduras. Dado que el catéter que sobresale del abdomen es corto, evita que el ratón lo arrastre a través de la ropa de cama, lo que podría hacer que se abra o se enrede.
6. Preparación para la obtención de imágenes transcraneales in vivo de Ca2+
- Administrar anestesia al ratón con isoflurano (inducción al 2%; mantenimiento entre 0,8% y 1,0%).
- Asegure el mouse a una plataforma estereotáxica usando barras auxiliares para los oídos para mitigar los efectos de la pulsación y la respiración. A continuación, coloque el ratón bajo un microscopio estereoscópico de fluorescencia.
- Emplee un conjunto de filtros de fluorescencia azul de banda ancha (con excitación a 460-490 nm y emisión a 520 nm) junto con una fuente de luz de mercurio.
- Capture las imágenes con una cámara y procéselas con el software de imágenes designado.
- Retire con cuidado el vello del cuero cabelludo con una afeitadora eléctrica o una crema depilatoria.
NOTA: Si usa una maquinilla de afeitar, asegúrese de que esté completamente desinfectada y tenga cuidado de no cortar la piel. - Desinfecte la superficie del cuero cabelludo con un bastoncillo de algodón o una herramienta similar con una solución de gluconato de clorhexidina diluida al 0,1-0,5%. A continuación, desinfecte con alcohol y repita esto alternando rondas 3 veces.
- Aplique un gel anestésico local y espere de 5 a 10 minutos.
- Prepárese para aplicar el cemento acrílico dental.
- Use una hoja de bisturí estéril para cortar el cuero cabelludo. Retira completamente el cuero cabelludo o haz un corte recto desde la parte posterior de la cabeza hasta la frente.
- Use clips para exponer el cráneo extendiendo el exceso de piel.
- Use un hisopo de algodón para extraer el tejido conectivo del periostio.
- Aplique inmediatamente el cemento acrílico después de eliminar el periostio. Actúe rápidamente para evitar que la superficie del cráneo se vuelva opaca debido a la evaporación del hueso expuesto.
- Espere unos 5 minutos para que el cemento se seque.
7. Imagen transcraneal de Ca2+ con administración de glucosa intraduodenal
- Equilibrar tanto la solución experimental como la solución salina a temperatura ambiente. Someta a los ratones a una restricción dietética durante un período específico (por ejemplo, 2 h).
- Purgue cualquier contenido residual dentro del catéter del lado del ratón usando ~ 0.03 mL de solución salina antes de iniciar la inyección.
- Aspire la solución experimental (por ejemplo, una solución de glucosa al 10% preparada en 300 μL de agua, complementada con 300 μL adicionales de agua) en la jeringa, luego conéctela al catéter. Determinar la dosis óptima de la solución adaptada al objetivo experimental específico.
NOTA: Durante esta fase, tenga cuidado para evitar una tensión excesiva en el catéter, lo que podría poner en peligro la anatomía interna del ratón. Esfuérzate por manipular el tubo del lado del ratón con la máxima delicadeza. Además, asegúrese de que la jeringa permanezca desprovista de aspiración de aire después de la solución, ya que el aire atrapado y las burbujas podrían inducir distensión gastrointestinal. - Evalúe el estado fisiológico del ratón y active la función de grabación del software de imagen haciendo clic en el botón de proceso de grabación de la aplicación de software.
- Captura imágenes con una resolución de 512 x 512 píxeles, una profundidad de 16 bits y una velocidad de fotogramas de 10 Hz.
NOTA: Los parámetros de registro se pueden ajustar para alinearlos con los requisitos experimentales específicos. - Adquisición de datos espontáneos (por ejemplo, que abarquen 50 s), seguidos de la infusión gradual de la solución experimental a una velocidad adaptada al experimento (en este caso, 0,035 mL/s).
NOTA: Al final del experimento, el ratón será sacrificado de inmediato por dislocación cervical bajo anestesia con isoflurano.
8. Procesamiento y análisis de datos de imágenes
- Agrupe los datos de la imagen en 64 x 64 píxeles.
- Determine las regiones de interés (ROI) dibujadas a mano con ImageJ. Consulte el atlas del cerebro del ratón para designar las ROI como el área frontal (M2), el área somatosensorial que incluye el barril (Somato), el área occipital (visual) y la región retroesplenial (RSC).
- Utilice la función ReadImageJROI de MATLAB para extraer las coordenadas correspondientes a los ROI. Acceda a la función de MATLAB a través del enlace proporcionado: https://jp.mathworks.com/matlabcentral/fileexchange/32479-readimagejroi
- Calcule la tasa media de cambio en la intensidad de la fluorescencia dentro del ROI mediante MATLAB.
- Defina la tasa de cambio de intensidad de fluorescencia (ΔF/F) con la ecuación (1):
 (1)
(1)
Donde Ft representa el valor de intensidad de fluorescencia en un momento específico y el valor medio de la intensidad desde el inicio del registro hasta 50 s después de la inyección se denota como F0.
- Defina la tasa de cambio de intensidad de fluorescencia (ΔF/F) con la ecuación (1):
- Tenga en cuenta la demora en que la solución inyectable llegue al órgano. Utilice el valor de intensidad promedio que abarca los tres segundos posteriores a la inyección como referencia. Formas de onda objetivo que superan el valor de intensidad de referencia + 1 SD para el análisis si se producen 3 s o más después de la inyección.
Resultados
Obtención de imágenes de Ca2+ ancho de la corteza transcraneal con un ratón G7NG817 anestesiado con isoflurano
Creamos el catéter siguiendo el procedimiento que se ilustra en la Figura 1. Después de identificar cuidadosamente la posición del estómago, conectamos el catéter a esa ubicación (Figura 1). Después de permitir un tiempo de recuperación suficiente después de la inserción del catéter (aproximadamente 48 h), medimos la actividad neuronal espontánea bajo anestesia leve con isoflurano (0,8-1,0%) para establecer los cambios basales en la intensidad de la fluorescencia para las observaciones posteriores de estimulación intestinal. Como resultado, confirmamos los patrones aleatorios de oscilación de Ca2+ que abarcaban toda la corteza (Figura 2A). En la figura 2 se presentan ejemplos representativos de actividad cerebral espontánea, con los catéteres insertados previamente. Definimos el tiempo del primer pico transitorio observable de Ca2+ en la región M2 después de la inyección como 0,0 s. La representación de pseudo color mostraba el pico de este transitorio Ca2+ como el valor máximo, con el valor medio más una desviación estándar (1 SD) como valor mínimo. Estaba claro que los hemisferios izquierdo y derecho mostraban actividad sincrónica en todas las regiones.
A continuación, establecimos ROIs para caracterizar las ondas dentro de cada área funcional. Como se muestra en la Figura 2B, presentamos los cambios temporales en la tasa de intensidad de fluorescencia para cada ROI (Figura 2B). Estas oscilaciones superficiales observadas de Ca2+ en la superficie siguieron un patrón de supresión de ráfagas, alternando entre períodos de baja actividad y cambios de fluorescencia de alta amplitud. Este patrón de actividad se alinea con hallazgos previos que midieron simultáneamente el EEG de superficie cortical y la dinámica de Ca2+ 26.
A pesar de las fluctuaciones globales o regionales de Ca2+ en la superficie entre los estados de supresión y estallido, la región cortical específica que inicia el aumento de calcio puede diferir. Como se informó anteriormente, cuando una señal estimula una región cortical local, se espera que el área se active, lo que posteriormente impulsará un cambio global en el estado cortical27,28.
Cambios en la dinámica de la corteza Ca2+ después de la inyección intragástrica de glucosa
A continuación, para dilucidar cómo la administración de glucosa o agua influye en la actividad cortical, monitorizamos la dinámica del Ca2+ en toda la corteza durante y después de la inyección. Como resultado, encontramos alteraciones en la dinámica cortical de Ca2+ tras la inyección intragástrica de glucosa. En contraste con la actividad espontánea ilustrada en diversas regiones de activación cortical, observamos una activación inmediata en el área prefrontal o en la corteza motora secundaria (M2) tras la inyección directa de glucosa en el intestino a través del catéter, efecto no inducido por la inyección de agua intragástrica (Figura 3A-C). Además, observamos que estos eventos transitorios y prominentes de Ca2+ tendían a ocurrir de forma continua durante aproximadamente 10 s después de la inyección de glucosa intragástrica. Tales fenómenos persistentes no eran evidentes cuando se administraba agua (Figura 3D-F).
Los eventos de Ca2+ en cada ROI se caracterizaron calculando la relación de cambio de intensidad de fluorescencia, utilizando la corteza auditiva (Referencia) como referencia, en el primer pico que ocurre dentro de los 4-8 s posteriores a la finalización de la administración de glucosa. Como resultado, se observó un cambio significativo cuando se inyectó glucosa después de comparar la respuesta en la región M2 utilizando la corteza auditiva como referencia antes y después de la inyección.
En contraste, no se observó tal cambio cuando se inyectó agua (Figura 3G, agua N = 7: antes vs. inyección, 2.38 ± 2.53 vs. 2.05 ± 1.84, p > 0.05; glucosa N = 7: antes vs. inyección, 2.48 ± 0.97 vs. 3.76 ± 2.76, p < 0.01, prueba de Wilcoxon con señas). A continuación, definiendo los niveles de activación en cada región cortical por la relación entre el valor de después de la inyección y antes de la inyección, se observó una diferencia significativa solo en la región M2 (Figura 3H, M2: 0,92 ± 0,89 vs. 1,30 ± 0,32, p = 0,006; Somato: 0,95 ± 0,076 vs. 1,04 ± 0,13, p = 0,27; Visuales: 0,92 ± 0,3 vs. 1,00 ± 0,06, p = 0,89; RSC: 0,97 ± 0,27 vs. 1,10 ± 0,27, p = 0,60 , t-test).
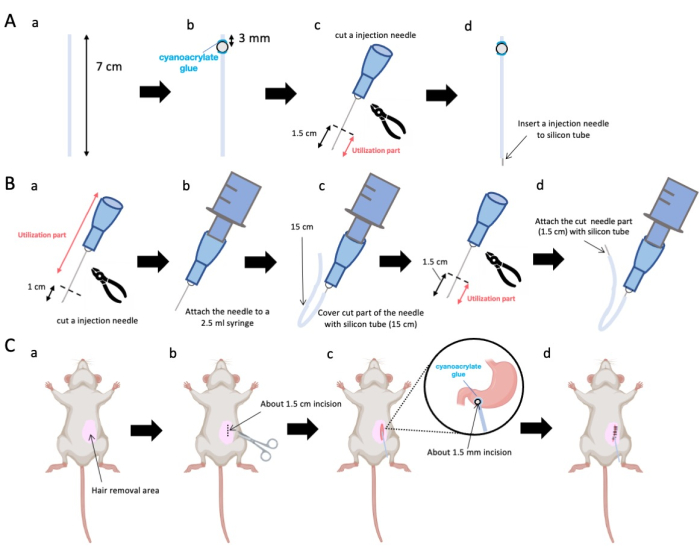
Figura 1: Descripción general del método. (A) Creación del catéter: (a) Corte el tubo de silicona. (b) Fije una cuenta de plástico al tubo de silicona con pegamento médico de cianoacrilato. (c) Corta la aguja de 23 G a 1,5 cm de la punta. (d) Fije el extremo cortado de la aguja al tubo de silicona. (B) Conjunto del inyector: (a) Recorte una aguja de inyección de 23 G 1 cm. (b) Conecte la aguja de inyección recortada a una jeringa de 2,5 mL. (c) Envainar la sección cortada de la aguja de inyección con un tubo de silicona. (d) Corta la aguja de 23 G a 1,5 cm de la punta. (e) Fije el extremo cortado de la aguja al tubo de silicona. (C) Procedimiento quirúrgico: (a) Depilar el área quirúrgica. (b) Incidir la piel y la pared abdominal hasta una longitud aproximada de 1,5 cm. (c) Hacer una pequeña perforación (alrededor de 1,5 mm de diámetro) en el antro pilórico con unas tijeras e insertar el catéter (tubo de silicona). Asegure el catéter al antro pilórico con pegamento médico de cianoacrilato. (d) Coser la pared abdominal y la piel con material de sutura de seda 5/0 y aguja. Haga clic aquí para ver una versión más grande de esta figura.
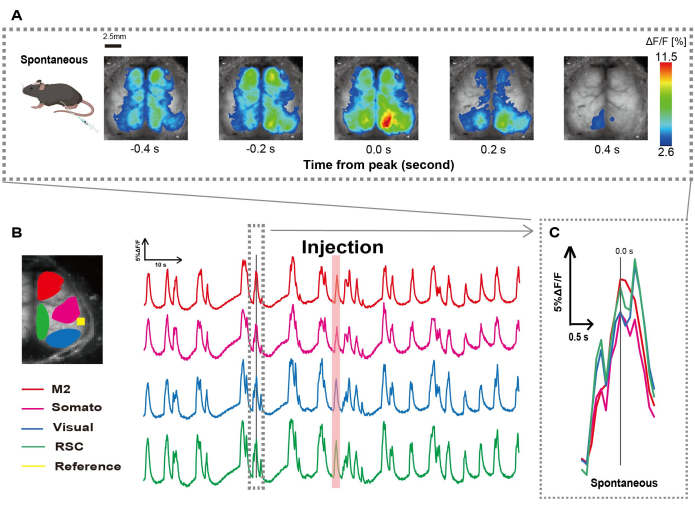
Figura 2: Oscilaciones espontáneas de Ca2+ en G7NG817 ratones con un catéter conectado. (A) Un ejemplo representativo de oscilaciones de Ca2+ en la corteza ancha mostradas a intervalos de 0,2 s. Los cambios en la intensidad de la fluorescencia se representan con una pseudo superposición de color. La ventana de tiempo rodeada por la línea discontinua en B muestra el primer transitorio Ca2+ que aparece, con su pico establecido como tiempo 0. La representación de pseudo color utiliza el pico de ese transitorio Ca2+ como valor máximo y la media +1 SD como valor mínimo. (B) Cambios de series temporales en la intensidad de la fluorescencia para cada ROI en el ejemplo. Los colores de las líneas corresponden a diferentes áreas corticales: el rojo representa M2; el magenta representa el área somatosensorial (Somato); el azul representa el área visual (Visual); y el verde representa la región retro esplenial. La tira de color salmón muestra el tiempo de inyección. (C) Un solo pico dentro del contorno discontinuo se aísla y se muestra en una vista ampliada. Abreviaturas: DE = desviación estándar; ROI = región de interés; RSC = región retro esplenial. Haga clic aquí para ver una versión más grande de esta figura.
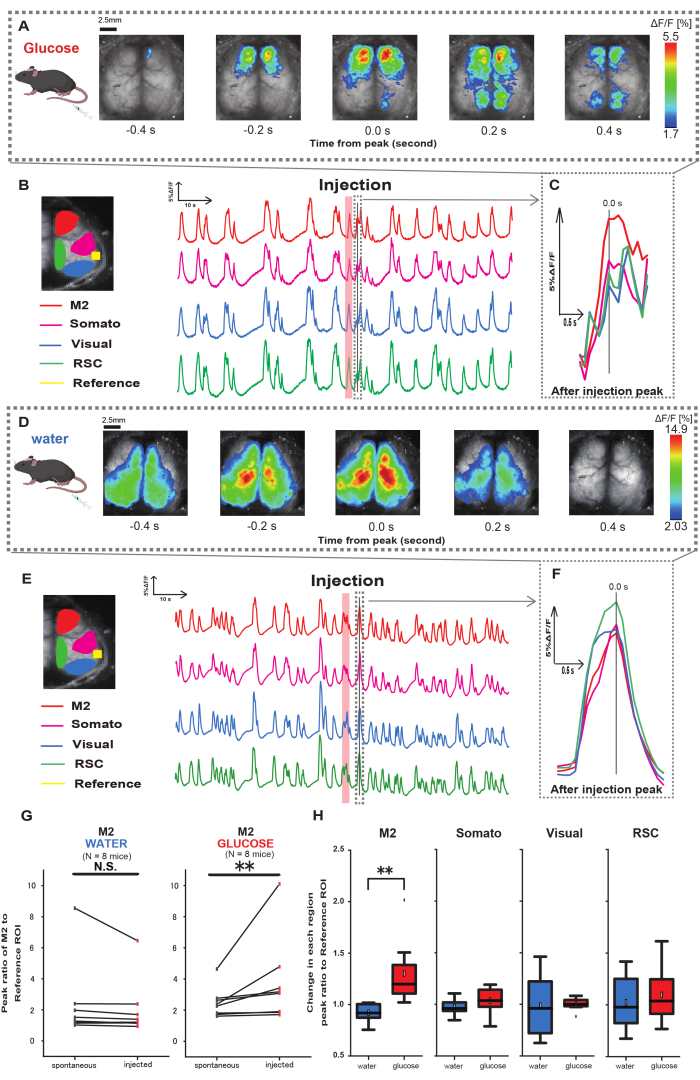
Figura 3: Respuesta de la corteza ancha Ca2+ durante/después de la inyección de glucosa o agua. (A) Un ejemplo representativo de administración de glucosa mostrado a intervalos de 0,2 s. Los cambios en la intensidad de la fluorescencia se representan con una pseudo superposición de color. La ventana de tiempo rodeada por la línea discontinua en B muestra el primer transitorio Ca2+ que aparece después de la inyección, con su pico establecido como tiempo 0. La representación del pseudo color se basa en el pico del primer transitorio de Ca2+ después de la inyección como valor máximo y la media +1 SD como valor mínimo. (B) Cambios en series temporales de la intensidad de la fluorescencia para cada ROI en el ejemplo. Los colores de las líneas corresponden a diferentes áreas corticales: el rojo representa M2, el magenta representa el área somatosensorial (Somato), el azul representa el área visual (Visual) y el verde representa la región retroesplenial. (C) Un solo pico dentro del contorno discontinuo se aísla y se muestra en una vista ampliada. La onda de calcio objetivo es la onda más temprana que apareció dentro de los 4-8 segundos posteriores a la inyección. (D) Un ejemplo representativo de inyección de agua como datos de control de glucosa. (E) Cambios de series temporales en la intensidad de fluorescencia para cada ROI en el ejemplo. Los colores de las líneas son como en B. (F) Un solo pico dentro del contorno discontinuo se aísla y se muestra en una vista ampliada. La onda de calcio objetivo es la onda más temprana que apareció dentro de los 4-8 segundos posteriores a la inyección. (G) Comparación de la actividad espontánea de M2 (antes) y la respuesta después de la inyección (inyectado). La intensidad media de la fluorescencia cambia a lo largo de 50 s antes de la inyección, y se calculó la respuesta máxima en la región M2 entre 4 s y 8 s después de la inyección, utilizando como referencia la corteza auditiva. (H) Comparación de los niveles de activación en cada región cortical cuando se administró agua o glucosa. Para cada región se calculó la relación entre el valor de después de la inyección y antes de la inyección, determinado en G. N.S. representa no significativo (p > 0,05). ** <0,01. Las barras de error se definen como el error estándar de la media. Abreviaturas: DE = desviación estándar; ROI = región de interés; RSC = región retro esplenial. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este artículo presenta cómo conectar un catéter al intestino y observar las señales de Ca2+ de la corteza transcraneal con ratones transgénicos que expresan un indicador de Ca2+ codificado genéticamente. En este experimento, no obtuvimos los datos de imagen que utilizan una longitud de onda secundaria de la fuente de luz. Esto se debe a que los ratones transgénicos que empleamos en este estudio exhiben una tasa de cambio de intensidad de fluorescencia muy alta (~ varias decenas de porcentaje) en respuesta a estímulos sensoriales debido a las propiedades de la proteína indicadora Ca2+ (G-CaMP7) empleada. Por lo tanto, pensamos que la contaminación por hemodinamia era insignificante. Además, las respuestas neuronales en las que nos centramos ocurrieron rápidamente en unos pocos segundos, por lo que consideramos innecesario tener en cuenta la hiperemia funcional local generada posteriormente. Este método de implantación de catéteres es capaz de combinarse con otros ratones modificados genéticamente para observar la actividad neuronal en otras regiones del cerebro y en diferentes escalas de tiempo. Sin embargo, si se utilizan otros ratones modificados genéticamente, se debe realizar el experimento de control descrito anteriormente.
Este método de fijación del catéter al intestino es adecuado para la inyección de dosis única a bajo costo y es fácil y menos invasivo que el método propuesto anteriormente29. Tradicionalmente, el algodón absorbente se aplica en el órgano digestivo y se sutura. Sin embargo, la sutura puede perjudicar la recuperación postoperatoria en ratones. Por lo tanto, adoptamos el método de fijación. La razón por la que elegimos cuentas de plástico es que se adhieren mejor a la silicona con el pegamento de cianoacrilato que utilizamos.
Tradicionalmente se ha postulado que el cerebro percibe la glucosa en función de la escalada en los niveles de glucosa en sangre plasmática y la liberación concomitante de hormonas. En consecuencia, el cerebro necesita de varios minutos a horas para detectar la glucosa después de su absorción en elintestino. Algunas investigaciones han sugerido que la detección intestinal controla la preferencia gustativa de los ratones, además de la recepción oral del sabor dulce 1,3,17,22. Como ejemplo ilustrativo, los investigadores han proporcionado evidencia de que la solución no nutritiva con sabor con glucosa emparejada con IG intragástrica (IG) y la solución no nutritiva con α-metil-d-glucopiranósido (MDG) emparejada con IG pueden provocar preferencia por cada solución no nutritiva con sabor en comparación con el grupo emparejado con agua IG. Dado que la inyección intraperitoneal de glucosa no estimuló la ingesta de soluciones no nutritivas30, se anticipó que la detección de nutrientes intestinales desempeñaría un papel crucial en la elección de alimentos de los ratones 1,19,22.
Un estudio reciente ha revelado la presencia de una célula eléctricamente excitable en el intestino, conocida como "célula neuropoda", que emplea receptores moleculares para detectar y transducir estímulos sensoriales a un nervio vago a través de una sinapsis glutamatérgica. Si bien los estudios anteriores se han centrado principalmente en el papel de GLP-1 en el control de la alimentación de los ratones, investigaciones recientes han demostrado que la activación del nervio vago por parte de las células de neurópodos modula el apetito de los ratones. Posteriormente, el nervio vago activa el núcleo tractus solitarius, lo que conduce a la posterior activación de las neuronas dopaminérgicas19. Sin embargo, se desconoce si la activación de las neuronas dopaminérgicas también activa la corteza. Para categorizar las respuestas cerebrales después de la infusión de glucosa intragástrica, refinamos la técnica de fijación del catéter con fines de imagen. Al emplear esta tecnología, es imperativo tener cuidado para evitar daños en los órganos, con especial atención al hígado, que es susceptible de lesiones durante la manipulación requerida para determinar la ubicación del estómago.
Nuestros hallazgos indican que la inyección intragástrica de glucosa activa la corteza prefrontal en cuestión de segundos. Sin embargo, la administración intragástrica de glucosa inicia múltiples vías de señalización simultáneamente, como las rutas hormonales, el nervio vago y el nervio aferente espinal. Estas señales se procesan en el tronco encefálico en diferentes escalas de tiempo. Por lo tanto, los estudios futuros deberían explorar cómo se procesan e integran estas intrincadas señales dentro del cerebro.
Además, la línea de ratones transgénicos BAC GLT-1-G-CaMP7 que empleamos en el presente estudio expresa el sensor de Ca2+ , G-CaMP7, tanto en neuronas como en astrocitos. En principio, la elevación prefrontal de Ca2+ obtenida por imágenes de Ca2+ de la corteza transcraneal se deriva de neuronas y/o astrocitos. Sin embargo, dado que los astrocitos expresan receptores de dopamina si la señalización de dopamina está involucrada, sugiere la posible activación de la señalización astrocítica IP3 / Ca2+ . Dado que la señalización astrocítica IP3/Ca2+ regula la plasticidad sináptica, también puede desempeñar un papel importante en los cambios en la preferencia por la sacarosa y las alteraciones en el comportamiento alimentario después de la recepción de glucosa. En consecuencia, se requerirían imágenes a resolución celular utilizando microscopía de dos fotones para identificar si la respuesta observada en la corteza prefrontal después de la administración de glucosa se originó en neuronas o astrocitos en estudios futuros. Otro método eficaz consiste en observar la expresión del indicador Ca2+ específico de la célula en ratones utilizando virus adenoasociados (AAV) a través de fotometría de fibras. Además, es necesario verificar, mediante técnicas electrofisiológicas, si el estímulo de la glucosa al intestino estimula realmente el nervio vago. Si las células de los neurópodos transmiten señales al nervio vago mediante la recepción de glucosa, no anticipamos ninguna respuesta del nervio vago cuando se administra un inhibidor de SGLT-1. Finalmente, sería necesaria la validación utilizando varios antagonistas de los receptores de dopamina para confirmar si las proyecciones del nervio vago al núcleo tractus solitarii (NTS) activaron las neuronas dopaminérgicas, aumentando las señales de Ca2+ de la corteza prefrontal. En general, este sistema permite una investigación exhaustiva de los efectos de la rápida transmisión neuronal desde el intestino hasta el cerebro. Presenta una metodología muy prometedora que podría dilucidar mecanismos, como la forma en que el estrés altera la preferencia por la sacarosa con respecto a las interacciones entre el intestino y el cerebro.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo contó con el apoyo de la Universidad de Ochanomizu, las subvenciones KAKENHI (18K14859, 20K15895), el Programa JST FOREST, la Subvención Número JPMJFR204G, la Fundación de Investigación para la Opto-Ciencia y la Tecnología, el Consejo de Investigación de Kao para el Estudio de la Ciencia de la Salud, la Asociación Japonesa para la Innovación Química y la Fundación de Ciencias de la Vida TERUMO. El autor agradece al Dr. Takashi Tsuboi, Kazuki Harada y Akiyo Natsubori por su supervisión de los experimentos. El autor también agradece a los miembros del laboratorio por su apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| 2.5 mL TERUMO syringe | TERUMO | ss-02Sz | |
| 23 G injection needle | TERUMO | 4987350390691 | |
| Anesthetic (ISOFLURANE Inhalation Solution) | viatris | 871119 | |
| cotton swab | local company | ||
| Cyanoacrylate glue (AronArufa A) | TOAGOSEI | 7990700Q1022 | |
| dental acrylic cement C&B | Sun Medical | 221AABZX00115000 | |
| Depilatory cream | Kracie | local company | |
| Digital CMOS camera | Hamamatsu Photonics | ORCA-Spark | |
| Ear bar | NARISHIGE | EB-5N | |
| Filter set (U-MWB2) | Evident | U-MWB2 | |
| Fine Scissors | Fine Dcience Tools | 14040-10 | |
| G7NG817 mice | RIKEN BRC | RBRC09650 | |
| Image software | Hamamatsu Photonics | HC Image software | |
| Isoflurane vapolizer | shinanoseisakusyo | SN-487-0T | |
| Light source (U-HGLGPS) | Evident | U-HGLGPS | |
| microscopy (MVX10) | Evident | ||
| Plastic beads (inner diameter 3 mm, outer diameter 5 mm) | local company | ||
| Pliers | local company | ||
| Polydioxanone suture, monodiox | Alfresa Pharma | HR1305MV45-KF2R | This absorbable, monofilament PDS suture is employed for closing the surgical incision |
| Round ended forceps | F.S.T. | 11617-12 | |
| saline | Otsuka Pharmaceutical Factory | 35061311 | |
| Silicon tube (inner diameter 0.5 mm, outer diameter 1.0 mm) | AS ONE CORPORATIO | 33151413 | local company |
| small surgery needle | Natsume Seisakusho Co., Ltd. | AC03DNT | |
| Stereotaxic stage | NARISHIGE | MA-6N | |
| Xylocaine Jelly 2% | Sandoz K.K. | 614429303 | This jelly is used as a local analgesic to alleviate surgical pain |
Referencias
- Buchanan, K. L., et al. The preference for sugar over sweetener depends on a gut sensor cell. Nature Neuroscience. 25 (2), 191-200 (2022).
- Reimann, F. Molecular mechanisms underlying nutrient detection by incretin-secreting cells. International Dairy Journal. 20 (4), 236-242 (2010).
- Kreuch, D., et al. Gut mechanisms linking intestinal sweet sensing to glycemic control. Frontiers in Endocrinology. 9, 741 (2018).
- Gorboulev, V., et al. Na(+)-D-glucose cotransporter SGLT1 is pivotal for intestinal glucose absorption and glucose-dependent incretin secretion. Diabetes. 61 (1), 187-196 (2012).
- Harada, N., Inagaki, N. Role of sodium-glucose transporters in glucose uptake of the intestine and kidney. Journal of Diabetes Investigation. 3 (4), 352-353 (2012).
- Kaelberer, M. M., Rupprecht, L. E., Liu, W. W., Weng, P., Bohórquez, D. V. Neuropod cells: The emerging biology of gut-brain sensory transduction. Annual Review of Neuroscience. 43, 337-353 (2020).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Larsen, P. J., Tang-Christensen, M., Jessop, D. S. Central administration of glucagon-like peptide-1 activates hypothalamic neuroendocrine neurons in the rat. Endocrinology. 138 (10), 4445-4455 (1997).
- Alhadeff, A. L., Rupprecht, L. E., Hayes, M. R. GLP-1 neurons in the nucleus of the solitary tract project directly to the ventral tegmental area and nucleus accumbens to control for food intake. Endocrinology. 153 (2), 647-658 (2012).
- Raybould, H. E. Gut chemosensing: interactions between gut endocrine cells and visceral afferents. Autonomic Neuroscience: Basic & Clinical. 153 (1-2), 41-46 (2010).
- Routh, V. H. Glucose-sensing neurons: are they physiologically relevant. Physiology & Behavior. 76 (3), 403-413 (2002).
- Secher, A., et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. The Journal of Clinical Investigation. 124 (10), 4473-4488 (2014).
- Williams, E. K., et al. Sensory neurons that detect stretch and nutrients in the digestive system. Cell. 166 (1), 209-221 (2016).
- Borgmann, D., et al. Gut-brain communication by distinct sensory neurons differently controls feeding and glucose metabolism. Cell Metabolism. 33 (7), 1466-1482.e7 (2021).
- Krashes, M. J., et al. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. The Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- Aponte, Y., Atasoy, D., Sternson, S. M. AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training. Nature Neuroscience. 14 (3), 351-355 (2011).
- Zhang, L., Han, W., Lin, C., Li, F., de Araujo, I. E. Sugar metabolism regulates flavor preferences and portal glucose sensing. Frontiers in Integrative Neuroscience. 12, 57 (2018).
- Goldstein, ., et al. Hypothalamic detection of macronutrients via multiple gut-brain pathways. Cell Metabolism. 33 (3), 676-687.e5 (2021).
- Fernandes, A. B., et al. Postingestive modulation of food seeking depends on vagus-mediated dopamine neuron activity. Neuron. 106 (5), 778-788.e6 (2020).
- Kaelberer, M. M., et al. . A gut-brain neural circuit for nutrient sensory transduction. 361 (6408), eaat5236 (2018).
- Bohórquez, D. V., et al. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. The Journal of Clinical Investigation. 125 (2), 782-786 (2015).
- Tan, H. -. E., et al. The gut-brain axis mediates sugar preference. Nature. 580 (7804), 511-516 (2020).
- Wang, D., et al. Whole-brain mapping of the direct inputs and axonal projections of POMC and AgRP neurons. Frontiers in Neuroanatomy. 9, 40 (2015).
- Yamada, S., Wang, Y., Monai, H. Transcranial cortex-wide Ca2+ imaging for the functional mapping of cortical dynamics. Frontiers in Neuroscience. 17, 1119793 (2023).
- Monai, H., et al. Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain. Nature Communications. 7 (1), 11100 (2016).
- Ferron, J. -. F., Kroeger, D., Chever, O., Amzica, F. Cortical Inhibition during Burst Suppression Induced with Isoflurane Anesthesia. The Journal of Neuroscience. 29 (31), 9850-9860 (2009).
- Ming, Q., et al. Isoflurane-induced burst suppression is a thalamus-modulated, focal-Onset rhythm with persistent local asynchrony and variable propagation patterns in rats. Frontiers in Systems Neuroscience. 14, 599781 (2021).
- Schwalm, M., et al. Functional states shape the spatiotemporal representation of local and cortex-wide neural activity in mouse sensory cortex. Journal of Neurophysiology. 128 (4), 763-777 (2022).
- Ueno, A., et al. Mouse intragastric infusion (iG) model. Nature Protocols. 7 (4), 771-781 (2012).
- Zukerman, S., Ackroff, K., Sclafani, A. Post-oral glucose stimulation of intake and conditioned flavor preference in C57BL/6J mice: A concentration-response study. Physiology & Behavior. 109, 33-41 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados