Method Article
ניתוח בזמן אמת של תקשורת עצבית בין המעי למוח: קליפת המוח דינמיקה רחבה של סידן בתגובה לגירוי גלוקוז במעיים
In This Article
Summary
תקשורת מעיים-מוח, המתאפשרת על ידי העצב התועה, חיונית לתקשורת בין המערכת האנדוקרינית של מערכת העיכול לבין המוח. עם זאת, אם הזרקת גלוקוז תוך קיבתי יכול לשנות את פעילות קליפת המוח עדיין לא מובן. כאן, אנו מציעים פרוטוקול מקיף לצפייה בשינויים בפעילות קליפת המוח לאחר הזרקת גלוקוז לתריסריון.
Abstract
תקשורת בין מערכת העיכול למוח לאחר ספיגת אבות מזון ממלאת תפקיד חיוני בהעדפת מזון, חילוף חומרים והתנהגויות האכלה. במיוחד לגבי חומרים מזינים ספציפיים, מחקרים רבים הבהירו כי הטמעה של גלוקוז בתוך תאי אפיתל המעי מעוררת את ההפעלה של מולקולות איתות רבות. הורמונים כגון פפטיד דמוי גלוקגון-1 ידועים כמתווכי איתות מובהקים. מאחר שהורמונים משפיעים בעיקר על המוח דרך מסלולי מחזור הדם, הם מווסתים לאט את פעילות המוח.
עם זאת, מחקרים אחרונים הראו שני מסלולים מהירים של מעיים-מוח המתאפשרים על-ידי מערכת העצבים האוטונומית. האחד פועל דרך המסלול העצבי של עמוד השדרה, בעוד שהעצב התועה מתווך את השני. כתוצאה מכך, תגובות המוח בעקבות הטמעת גלוקוז במערכת העיכול הן מורכבות. יתר על כן, ככל שגירוי המעי גורם לבסוף לפעילויות קליפת מוח מגוונות, כולל תגובות חושיות, נוסיספטיביות, תגמול ומוטוריות, יש צורך להשתמש במתודולוגיות המאפשרות הדמיה של מעגלים מוחיים מקומיים ופעילויות פאן-קורטיקליות כדי להבין את השידור העצבי של המעי והמוח במלואו. מחקרים מסוימים הצביעו על שינויים תלולים בריכוזי יון הסידן (Ca2+) בתוך ההיפותלמוס ואזור הטגמנטל הגחוני באופן עצמאי דרך מסלולים שונים לאחר גירוי המעי. עם זאת, לא ידוע אם ישנם שינויים בפעילות קליפת המוח.
כדי לצפות בפעילות קליפת המוח לאחר הזרקת גלוקוז תוך קיבתית, פיתחנו טכניקת הדמיה להדמיה בזמן אמת של דינמיקת Ca2+ רחבה של קליפת המוח באמצעות גולגולת שלמה לחלוטין, באמצעות עכברים טרנסגניים המבטאים אינדיקטורים מקודדים גנטית של Ca2+ . מחקר זה מציג פרוטוקול מקיף לטכניקה שנועדה לנטר הדמיה של קליפת המוח הטרנס-גולגולתית הרחבה Ca2+ הנגרמת על ידי גירוי מעיים לאחר הזרקת גלוקוז תוך קיבתי באמצעות קטטר מושתל. הנתונים הראשוניים מצביעים על כך שמתן תמיסת גלוקוז למעיים מפעיל את קליפת המוח הקדמית, שאינה מגיבה למתן מים.
Introduction
בראש ובראשונה, חישת מעיים של גלוקוז מתרחשת באמצעות קולטני טעם מתוק (Tas1r2, Tas1r3) וקוטרנספורטר נתרן-גלוקוז 1 (SGLT-1) הממוקם בתאים אנטרואנדוקריניים בתוך לומן המעי 1,2,3,4,5,6. תחושת הגלוקוז במוח היא תהליך שנמשך בדרך כלל בין דקות לשעות לאחר ספיגתו מהמעיים, תופעה המבוססת בעיקר על רמות גבוהות של סוכר בדם בפלזמה ושחרור הורמונים 7,8,9,10,11 (למשל, פפטיד דמוי גלוקגון-1 [GLP-1], פפטיד YY (PYY), ופוליפפטיד אינסולינוטרופי תלוי גלוקוז [GIP]). הם מגיעים לגרעין הארקואט של ההיפותלמוס (ARC), שם הם קושרים נוירונים פרו-אופיומלנוקורטין (POMC) ונוירונים הקשורים לחלבון אגוטי (AgRP) על ידי זרימת דם ועצב הואגוס (עצב פאראסימפתטי)12,13,14. השינוי בפעילות של נוירונים אלה מוביל לשליטה על חילוף החומרים והתנהגות האכלה15,16.
ספרות עדכנית מדגישה יותר ויותר את המשמעות של איתות עצבי בין המעי למוח לאחר ספיגת גלוקוז. ניתן לסווג מסלול מורכב זה באופן כללי לשני מנגנונים עיקריים. הראשון כולל את ההפעלה של afferents בעמוד השדרה, בסופו של דבר להשפיע על הפעילות העצבית AgRP ב ARC. המנגנון השני כרוך בגירוי העצב התועה באמצעות קשרים עם תאי אפיתל. בהתחשב בדרכים המגוונות שבהן תאי אפיתל המעי יכולים להפעיל את העצב התועה13, תפקידו נחשב רב-תכליתי.
חלק ניכר מהפעילויות התועות במעיים ועצבי עמוד השדרה קשורות להתנהגויות האכלה 17,18,19. עם זאת, ראיות חדשות מצביעות על כך שסיבי עצב הואגוס מסוימים, המקרינים ל"תאי נוירופוד", מעורבים בהעדפת גלוקוז. תאי נוירופוד, תת-קבוצה של תאים אנטרואנדוקריניים, מבטאים SGLT-1 בצד הלומינלי שלהם ומעבירים גירויים חושיים לעצב התועה באמצעות סינפסות גלוטמטרגיות 2,20,21,22. הפעלת העצב התועה מפעילה נוירונים דופמינרגיים באזור הטגמנטל הגחוני (VTA) תוך שניות19. יש לציין כי עיכוב הפעלת הנרתיע, במיוחד בתריסריון, באמצעות אנטגוניסט גלוטמט מפחית את העדפת הסוכרוז בעכברים1. זה מדגיש את התפקיד הקריטי של הפעלת תאי נוירופוד בוויסות התנהגות בחירת המזון לאחר צריכת גלוקוז2.
למרות התקדמות זו, הבנה מעמיקה של מנגנוני חישת הגלוקוז המהירה במעי והשפעתם על פעילות קליפת המוח נותרה חידה מורכבת. למרות שהפעלת המוח הנשלטת על ידי נוירוני AgRP אינה כוללת את קליפת המוח23, ידוע כי נוירונים דופמינרגיים בפרויקט VTA לקליפת המוח. עם זאת, לא ידוע אם הפעלה עצבית דופמינרגית מהירה של VTA לאחר חישת גלוקוז באמת מפעילה את קליפת המוח. כדי להבהיר את המנגנון הזה, חקרנו את הפוטנציאל של מתן גלוקוז תוך קיבתי להשפיע במהירות על דינמיקה של Ca2+ בקליפת המוח בעכברים טרנסגניים המבטאים אינדיקטור סידן מקודד גנטית.
מאמר זה מציג שיטה זולה ופחות פולשנית להבנה מקיפה של השינויים בפעילות קליפת המוח בעקבות מתן גלוקוז תוך קיבתי באמצעות הדמיה של קליפת המוח הרחבה Ca2+ בעכברים לאחרונה, טכניקת ההדמיה הטרנס-גולגולתית הרחבה Ca2+ באמצעות גולגולת שלמה, באמצעות עכברים טרנסגניים המבטאים מדדי סידן מקודדים גנטית, צברה פופולריות24. יש לציין כי קו העכבר המהונדס BAC GLT-1-G-CaMP7 #817 (הידוע גם בשם עכבר G7NG817) המשמש במחקר זה מבטא את חיישן Ca2+ , G-CaMP7, בנוירונים ובאסטרוציטים25. בשל צפיפות הביטוי הגבוהה שלו בקליפת המוח, קו עכבר מהונדס זה מתאים במיוחד להדמיית Ca2+ רחב קליפת המוח הטרנס-גולגולתית באמצעות מיקרוסקופ אפיפלואורסצנטי סטנדרטי.
Protocol
כל הפרוטוקולים הניסיוניים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת אוצ'נומיזו, יפן (פרוטוקולי מחקר בבעלי חיים 22017). כל הניסויים בבעלי חיים בוצעו על פי ההנחיות לניסויים בבעלי חיים של אוניברסיטת אוצ'נומיזו התואמות את הנחיות היסוד להתנהלות נאותה של ניסויים בבעלי חיים ופעילויות קשורות במוסדות מחקר אקדמיים (משרד החינוך, התרבות, הספורט, המדע והטכנולוגיה, יפן). נעשו מאמצים למזער את מספר בעלי החיים המנוצלים. מחקר זה בוצע בהתאם להנחיות ARRIVE.
1. הכנת עכברים טרנסגניים
- כדי לעקוב אחר ניסוי זה, השתמש בקו עכברים טרנסגניים בוגרים זכר ונקבה BAC GLT-1-G-CaMP7 #817, כלומר עכברים G7NG81724,25 (מעל 8 שבועות). זן הרקע של עכברי G7NG81725 הוא C57BL/6J.
- אחסן את העכברים תחת מחזור אור / חושך של 12 שעות / 12 שעות וגדל אותם בקבוצות של עד חמישה עכברים.
2. יצירת קטטר
- השתמשו במספריים כדי לכוונן את צינור הסיליקון (קוטר פנימי 0.5 מ"מ, קוטר חיצוני 1.0 מ"מ) לאורך מדויק של 7 ס"מ (איור 1A-a).
הערה: לפני ההליכים, מספריים וצינור סיליקון עוקרו. - הדביקו חרוזי פלסטיק זעירים (קוטר פנימי 3 מ"מ, קוטר חיצוני 5 מ"מ) לצינור המותאם, וודאו שהם ממוקמים 3 מ"מ מהקצה שלו (איור 1A-b). הדביקו את החרוזים בצורה מאובטחת באמצעות דבק ציאנואקרילט (גרסאות רפואיות או סטנדרטיות מקובלות).
- הבלו על קודקוד מחט 23 גרם ולאחר מכן חתכו 1.5 ס"מ מקצה המחט (איור 1A-c).
- הכניסו את מחט 23 גרם החתוכה משלב 2.3 לתוך הגפיים של צינור הסיליקון, הפוך למקום שבו הודבקו החרוזים (איור 1A-d).
3. יצירת מזרק
- השתמשו בצבת סטרילית כדי להוציא 1 ס"מ מקצה המחט (איור 1B-a).
הערה: ודא שהפתח בקצה הכרות שומר על שלמותו ואינו מתעוות, מכיוון שכל עיוות עלול לחסום את זרימת תמיסת ההזרקה. - חברו את מחט ההזרקה המותאמת של 23 G משלב 3.1.1 למזרק בנפח 2.5 מ"ל (איור 1B-b).
- חתכו צינור סיליקון לאורך הדרוש (צינור סיליקון בקוטר 15 ס"מ בניסוי הזה) ועטפו אותו מעל מחט הזרקה של 23 גרם (איור 1B-c).
הערה: נפח התמיסה הניתנת ישתנה בהתאם לאורך הצינור. לדוגמה, עם צינור של 15 ס"מ, כ-50 מיקרוליטר של תמיסה ישתהו לאחר הניסוי. - נתקו את מחט ההזרקה 23 G 1.5 ס"מ מקצה המחט.
- הצטרפו לחלק המקוטע משלב 3.4 עם צנתר הסיליקון המעוצב בשלב 3.3 (איור 1B-d).
הערה: ודא שהפתחים שנוצרו בשלבים 3.1 ו-3.4 יישארו בלתי מעוותים לאחר החתך. אם יש צורך בתיקון, השתמש בצבת כדי לשחזר את התצורה המעגלית שלה.
4. לוקליזציה קיבה
- יש לבצע הרדמה לעכבר באמצעות שאיפת איזופלורן 3.0% בתא מוגדר. יש למרוח משחה אופתלמית למניעת יובש בעיניים.
- העבר בעדינות את העכבר המורדם מתא השאיפה לשולחן הניתוחים עם אימות מצבו המורדם של העכבר. לספק תמיכה תרמית לאורך כל ההליך.
- הניחו את השדרה של העכבר, יישרו את פיו קרוב למנגנון השאיפה, ומווסתים את ריכוז האיזופלורן מ-3.0% ל-2.0%.
הערה: נתק את החלק התחתון של מסכת האיזופלורן ממקבילתה העליונה ועגן את המסכה המופרדת (החלק העליון) לשולחן הניתוחים באמצעות סרט הדבקה. - השלימו את חלל הפה, הגפיים הקדמיות והגפיים האחוריות של העכבר לשולחן הניתוחים באמצעות סרט הדבקה.
הערה: על ידי קיבוע העכבר לשולחן, ניתן למנוע טעויות כירורגיות עקב תנועה גם אם העכבר מורדם. - הסר את שיער העכבר מהבטן השמאלית העליונה (150% מהאזור סביב אתר הניתוח) באמצעות קרם depilatory. החל משכך כאבים מקומי על אתר הניתוח והמתן 5 דקות לפני שתמשיך.
- יש למרוח ג'ל הרדמה מקומית על עור הבטן ולהמתין 5 עד 10 דקות. לאחר מכן, לחטא את אזור הניתוח 3 פעמים עם סיבובים לסירוגין של יודופור ו 70% אתנול. יש לאשר את עומק ההרדמה באמצעות צביטת בוהן ולכסות את בעל החיים בווילונות כירורגיים סטריליים. בצעו חתך בעור באורך של כ-1.5 ס"מ (איור 1C-b), הממוקם 1 ס"מ מימין לחציון הבטן ו-5 מ"מ מתחת לתהליך הקסיפואיד (איור 1C-c). לאחר מכן, יש ליצור חתך בקוטר 1.5 ס"מ בדופן הבטן באותו מיקום כמו החתך הראשוני בעור.
הערה: יש לנקוט משנה זהירות כדי להימנע מגרימת נזק לכבד הבסיסי. - מקם מחדש בעדינות את אונת הכבד השמאלית לרוחב באמצעות מלקחיים קהים, וחושף את הבטן שמתחת.
5. החדרת קטטר
- מרימים את הקיבה ומחלצים אותה בזהירות דרך החתך.
הערה: יש לנקוט משנה זהירות כדי לשמור על שלמות האיברים הסמוכים, בעיקר הכבד, ולהימנע מהפעלת כוח מופרז על הקיבה. - השתמש במספריים כדי ליצור נקב זעיר (בקוטר של כ-1.5 מ"מ) באנטרום הפילורי.
- הכניסו את קצה הצנתר לתוך הנקב, וודאו שהחרוז נמצא במגע ישיר עם האנטרום הפילורי.
הערה: הצנתר עובר חיטוי בתמיסת גלוקונאט כלורהקסידין 0.1% עד 0.5% לפני החדרתו. - הדביקו את החרוז של הצנתר לקיבה באמצעות דבק ציאנואקרילט ברמה רפואית.
הערה: ודא שהקיבה נשארת לא מחוברת לאיברים הסובבים אותה. - ודא את החיבור המוצק של הצנתר לקיבה, ולאחר מכן מקם מחדש בעדינות את הקיבה לאזור המולד שלה מתחת לאונה השמאלית של הכבד.
- תפרו את דופן הבטן, ואפשרו לצנתר להתרחב חיצונית, באמצעות תפר פולידיוקסאנון (PDS). לאחר מכן, סגור את חתך העור באופן המקביל לסגירת הבטן.
- מקם מחדש את העכבר בעדינות בכלוב מחוטא.
הערה: עכברים לאחר הניתוח צריכים להיות מאוכלסים באופן יחיד. החל משכך כאבים מקומי על סגירת הפצע ופעל לפי תוכניות משככי כאבים כפי שהומלץ מחדש על ידי ההנחיות המוסדיות המקומיות. - אפשר תקופת התאוששות מינימלית של 48 שעות בסביבה סטנדרטית.
הערה: קצה אחד של הצנתר המוחדר לקיבתו של העכבר סגור באמצעות מחט 23G עם קצה אטום כדי למנוע כניסת חומרים זרים וכדי למנוע נשיכה. מכיוון שהקטטר הבולט מהבטן קצר, הוא מונע מהעכבר לגרור אותו דרך המצעים, מה שעלול לגרום לו להיפתח או להסתבך.
6. הכנה להדמיית in vivo transcranial Ca2+
- מתן הרדמה לעכבר באמצעות איזופלורן (אינדוקציה ב-2%; תחזוקה בין 0.8% ל-1.0%).
- אבטח את העכבר על פלטפורמה סטריאוטקסית באמצעות מוטות אוזניים עזר כדי למתן את ההשפעות של פעימות ונשימה. לאחר מכן, מקם את העכבר מתחת למיקרוסקופ סטריאו פלואורסצנטי.
- השתמש במסנן פלואורסצנטי כחול רחב פס (עם עירור ב- 460-490 ננומטר ופליטה ב- 520 ננומטר) בשילוב עם מקור אור כספית.
- צלם את התמונות באמצעות מצלמה ועבד אותן באמצעות תוכנת ההדמיה הייעודית.
- יש להסיר בזהירות את השיער מהקרקפת באמצעות מכונת גילוח חשמלית או קרם להסרת שיער.
הערה: אם אתם משתמשים בסכין גילוח, ודאו שהוא עבר חיטוי יסודי והיזהרו שלא לחתוך את העור. - לחטא את פני השטח של הקרקפת באמצעות צמר גפן או כלי דומה עם פתרון של chlorhexidine gluconate מדולל ל 0.1-0.5%. לאחר מכן, לחטא עם אלכוהול ולחזור על זה לסירוגין סיבובים 3x.
- יש למרוח ג'ל הרדמה מקומית ולהמתין 5-10 דקות.
- היכונו ליישם צמנט אקרילי דנטלי.
- השתמש בלהב אזמל סטרילי כדי לחתוך את הקרקפת. או להסיר לחלוטין את הקרקפת או לעשות חתך ישר מהחלק האחורי של הראש אל המצח.
- השתמש קליפסים כדי לחשוף את הגולגולת על ידי הרחבת כל עודפי העור.
- השתמש צמר גפן כדי להסיר את רקמת החיבור של periosteum.
- מיד להחיל את מלט אקריליק לאחר הסרת periosteum. פעלו במהירות כדי למנוע משטח הגולגולת להפוך אטום עקב אידוי מהעצם החשופה.
- המתינו כ-5 דקות עד שהמלט יתייבש.
7. הדמיה Transcranial Ca2+ עם ניהול גלוקוז תוך תריסריון
- אזנו הן את הפתרון הניסיוני והן את המלח לטמפרטורת הסביבה. הכפיפו את העכברים להגבלה תזונתית למשך זמן מוגדר (למשל, שעתיים).
- נקה כל תוכן שאריות בתוך הצנתר בצד העכבר באמצעות ~0.03 מ"ל של מלוחים לפני תחילת ההזרקה.
- שאפו את התמיסה הניסיונית (למשל, תמיסת גלוקוז 10% שהוכנה ב-300 מיקרוליטר מים, בתוספת 300 מיקרוליטר מים נוספים) לתוך המזרק, ואז מממשקים אותה לצנתר. לוודא את המינון האופטימלי של התמיסה המותאמת למטרת הניסוי הספציפית.
הערה: במהלך שלב זה, יש לנקוט משנה זהירות כדי למנוע עומס מופרז על הצנתר, שעלול לסכן את האנטומיה הפנימית של העכבר. השתדלו לתפעל את הצינור בצד העכבר בעדינות מרבית. בנוסף, יש לוודא שהמזרק נותר נטול שאיפת אוויר לאחר תמיסה, שכן אוויר כלוא ובועות עלולים לגרום להתנפחות במערכת העיכול. - הערך את מצבו הפיזיולוגי של העכבר והפעל את פונקציית ההקלטה של תוכנת ההדמיה על ידי לחיצה על כפתור תהליך ההקלטה של יישום התוכנה.
- צלם תמונות ברזולוציה של 512 x 512 פיקסלים, עומק של 16 סיביות וקצב מסגרות של 10 הרץ.
הערה: ניתן להתאים את פרמטרי ההקלטה כך שיתאימו לדרישות ניסוי ספציפיות. - קבלת נתונים ספונטניים (למשל, על פני 50 שניות), ולאחר מכן עירוי הדרגתי של הפתרון הניסיוני בקצב המותאם לניסוי (כאן, 0.035 מ"ל/שנייה).
הערה: בסוף הניסוי, העכבר יעבור המתת חסד מיידית על ידי נקע צוואר הרחם תחת הרדמה isoflurane.
8. עיבוד וניתוח נתוני תמונה
- סל נתוני תמונה ל- 64 x 64 פיקסלים.
- קבע אזורי עניין (ROI) שצוירו ביד באמצעות ImageJ. עיין באטלס המוח של העכבר כדי להגדיר ROI כאזור המצחי (M2), האזור הסומטוסנסורי כולל הקנה (Somato), האזור העורפי (חזותי) והאזור הרטרוספלניאלי (RSC).
- השתמש בפונקציה MATLAB ReadImageJROI כדי לחלץ את הקואורדינטות המתאימות להחזרי ההשקעה. גש לפונקציית MATLAB דרך הקישור המצורף: https://jp.mathworks.com/matlabcentral/fileexchange/32479-readimagejroi
- חשבו את הקצב הממוצע של שינוי עוצמת הפלואורסצנטיות בתוך החזר ההשקעה באמצעות MATLAB.
- הגדר את קצב השינוי בעוצמת הפלואורסצנטיות (ΔF/F) באמצעות משוואה (1):
 (1)
(1)
כאשר Ft מייצג את ערך עוצמת הפלואורסצנטיות בזמן מסוים וערך העוצמה הממוצע מתחילת ההקלטה ועד 50 שניות לתוך ההזרקה מסומן כ- F0.
- הגדר את קצב השינוי בעוצמת הפלואורסצנטיות (ΔF/F) באמצעות משוואה (1):
- הסבר את העיכוב בתמיסת ההזרקה המגיעה לאיבר. השתמש בערך העוצמה הממוצעת המתפרש על פני שלוש השניות שלאחר ההזרקה כקו בסיס. צורות גל מטרה העולות על ערך עוצמת קו הבסיס + 1 SD לניתוח אם הן מתרחשות 3 שניות ואילך לאחר ההזרקה.
תוצאות
קליפת המוח הטרנס-גולגולתית רחבה Ca2+ הדמיה עם עכבר G7NG817 מורדם איזופלורן
יצרנו את הצנתר בעקבות ההליך המתואר באיור 1. לאחר זיהוי קפדני של מיקום הקיבה, חיברנו את הצנתר למיקום הזה (איור 1). לאחר שאפשרנו זמן החלמה מספיק לאחר החדרת הצנתר (כ-48 שעות), מדדנו פעילות עצבית ספונטנית תחת הרדמה איזופלורנית קלה (0.8-1.0%) כדי לקבוע את השינויים בעוצמת הפלואורסצנטיות הבסיסית לתצפיות הבאות על גירוי המעי. כתוצאה מכך, אישרנו את דפוסי התנודות האקראיים של Ca2+ שהקיפו את כל קליפת המוח (איור 2A). איור 2 מספק דוגמאות מייצגות של פעילות מוחית ספונטנית, כאשר הצנתרים מוחדרים מראש. הגדרנו את זמן השיא הארעי הראשון הנצפה Ca2+ באזור M2 לאחר ההזרקה כ-0.0 שניות. ייצוג הצבע המדומה הציג את השיא של ארעי Ca2+ זה כערך המרבי, עם הערך הממוצע בתוספת סטיית תקן אחת (1 SD) כערך המינימלי. היה ברור שההמיספרה השמאלית והימנית הציגו פעילות סינכרונית בכל האזורים.
לאחר מכן, הקמנו ROIs כדי לאפיין את הגלים בתוך כל אזור פונקציונלי. כפי שניתן לראות באיור 2B, הצגנו את השינויים הזמניים בקצב עוצמת הפלואורסצנטיות עבור כל החזר השקעה (איור 2B). תנודות פני השטח הנצפות Ca2+ עקבו אחר דפוס דיכוי פרץ, לסירוגין בין תקופות של פעילות נמוכה ושינויים פלואורסצנטיים באמפליטודה גבוהה. דפוס פעילות זה תואם לממצאים קודמים שמדדו בו זמנית את פני השטח של קליפת המוח EEG ודינמיקה שלCa 2+ 26.
למרות תנודות גלובליות או אזוריות של Ca2+ על פני השטח בין מצבי דיכוי והתפרצות, האזור הספציפי בקליפת המוח היוזם את נחשול הסידן יכול להיות שונה. כפי שדווח בעבר, כאשר אות מגרה אזור קליפת המוח המקומי, האזור צפוי לפעול, וכתוצאה מכך לגרום לשינוי גלובלי במצב קליפת המוח27,28.
שינויים בדינמיקה של Ca2+ בקליפת המוח לאחר הזרקת גלוקוז תוך קיבתי
לאחר מכן, כדי להבהיר כיצד מתן גלוקוז או מים משפיע על פעילות קליפת המוח, עקבנו אחר דינמיקת Ca2+ רחבה בקליפת המוח במהלך ההזרקה ולאחריה. כתוצאה מכך, מצאנו שינויים בדינמיקה של Ca2+ בקליפת המוח לאחר הזרקת גלוקוז תוך קיבתית. בניגוד לפעילות הספונטנית שהודגמה באזורים שונים של פעילות קליפת המוח, נצפתה הפעלה מיידית באזור הקדם-מצחי או בקליפת המוח המוטורית המשנית (M2) בהזרקה ישירה של גלוקוז דרך הצנתר, השפעה שאינה נגרמת על-ידי הזרקת מים תוך-קיבתית (איור 3A-C). יתר על כן, ראינו כי אירועי Ca2+ חולפים ובולטים אלה נטו להתרחש ברציפות במשך כ -10 שניות לאחר הזרקת גלוקוז תוך קיבתית. תופעות מתמשכות כאלה לא נראו לעין כאשר ניתנו מים (איור 3D-F).
אירועי Ca2+ בכל החזר השקעה התאפיינו בחישוב היחס בין יחס שינוי עוצמת הפלואורסצנטיות, תוך שימוש בקליפת המוח השמיעתית (Reference) כנקודת ייחוס, כאשר השיא הראשון התרחש תוך 4-8 שניות לאחר השלמת מתן הגלוקוז. כתוצאה מכך, נצפה שינוי משמעותי כאשר הוזרק גלוקוז לאחר השוואת התגובה באזור M2 באמצעות קליפת המוח השמיעתית כהתייחסות לפני ואחרי ההזרקה.
לעומת זאת, לא נצפה שינוי כזה כאשר הוזרקו מים (איור 3G, מים N=7: לפני הזרקה, 2.38 ± 2.53 לעומת 2.05 ± 1.84, p > 0.05; גלוקוז N = 7: לפני הזרקה, 2.48 ± 0.97 לעומת 3.76 ± 2.76, p < 0.01, Wilcoxon signed-rank test). לאחר מכן, בהגדרת רמות ההפעלה בכל אזור בקליפת המוח על ידי היחס בין הערך של לאחר ההזרקה ללפני ההזרקה, נצפה הבדל משמעותי רק באזור M2 (איור 3H, M2: 0.92 ± 0.89 לעומת 1.30 ± 0.32, p = 0.006; סומאטו: 0.95 ± 0.076 לעומת 1.04 ± 0.13, p = 0.27; חזותי: 0.92 ± 0.3 לעומת 1.00 ± 0.06, p = 0.89; RSC: 0.97 ± 0.27 לעומת 1.10 ± 0.27, p = 0.60, t-test).
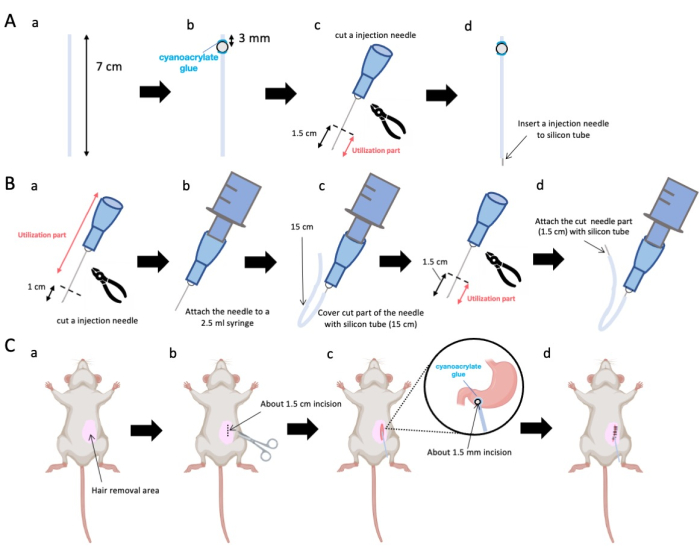
איור 1: סקירה כללית של השיטה. (A) יצירת קטטר: (א) חתכו את צינור הסיליקון. (ב) הצמידו חרוז פלסטיק לצינור הסיליקון באמצעות דבק ציאנואקרילט רפואי. (ג) חותכים את מחט 23 גרם 1.5 ס"מ מהקצה. (ד) חברו את הקצה החתוך של המחט לצינור הסיליקון. (B) מכלול מזרק: (א) חתוך מחט הזרקה של 23 גרם ב-1 ס"מ. (ב) חבר את מחט ההזרקה החתוכה למזרק בנפח 2.5 מ"ל. (ג) מעטרים את החלק החתוך של מחט ההזרקה בצינור סיליקון. (ד) חותכים את המחט 23 גרם 1.5 ס"מ מהקצה. (ה) חבר את הקצה החתוך של המחט לצינור הסיליקון. (ג) הליך כירורגי: (א) לנטרל את אזור הניתוח. (ב) לחתוך את העור ואת דופן הבטן לאורך של כ-1.5 ס"מ. (ג) ליצור נקב קטן (בקוטר של כ-1.5 מ"מ) באנטרום הפילורי באמצעות מספריים ולהחדיר את הצנתר (צינור סיליקון). הצמידו את הצנתר לאנטרום הפילורי באמצעות דבק ציאנואקרילט רפואי. (ד) לתפור את דופן הבטן והעור באמצעות חומר תפר משי 5/0 ומחט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
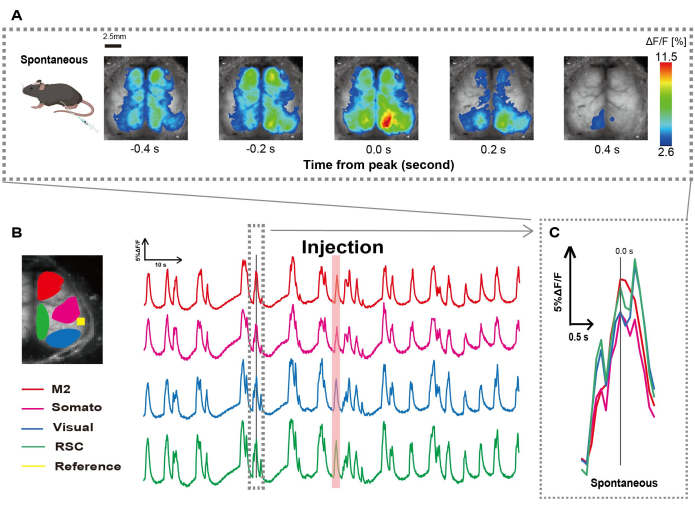
איור 2: תנודות ספונטניות בקליפת המוח ברוחב Ca2+ בעכברים G7NG817 עם קטטר מחובר. (A) דוגמה מייצגת של תנודות Ca2+ רחבות קליפת המוח המוצגות במרווחים של 0.2 שניות. שינויים בעוצמת הפלואורסצנטיות מיוצגים באמצעות שכבת צבע מדומה. חלון הזמן המוקף בקו המקווקו ב-B מציג את ה-Ca2+ הארעי הראשון שמופיע, כשהשיא שלו מוגדר כזמן 0. ייצוג הצבע המדומה משתמש בשיא של Ca2+ ארעי כערך המרבי והממוצע +1 SD כערך המינימום. (B) סדרות זמן משתנות בעוצמת הפלואורסצנטיות עבור כל החזר השקעה בדוגמה. צבעי הקו מתאימים לאזורים שונים בקליפת המוח: אדום מייצג M2; מגנטה מייצגת את האזור הסומטוסנסורי (Somato); כחול מייצג את האזור החזותי (חזותי); וירוק מייצג את אזור הרטרו ספלניאלי. פס בצבע סלמון מראה את זמן ההזרקה. (C) שיא יחיד בתוך קו המתאר המקווקו מבודד ומוצג בתצוגה מוגדלת. קיצורים: SD = סטיית תקן; ROI = אזור עניין; RSC = אזור רטרו ספלניאלי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
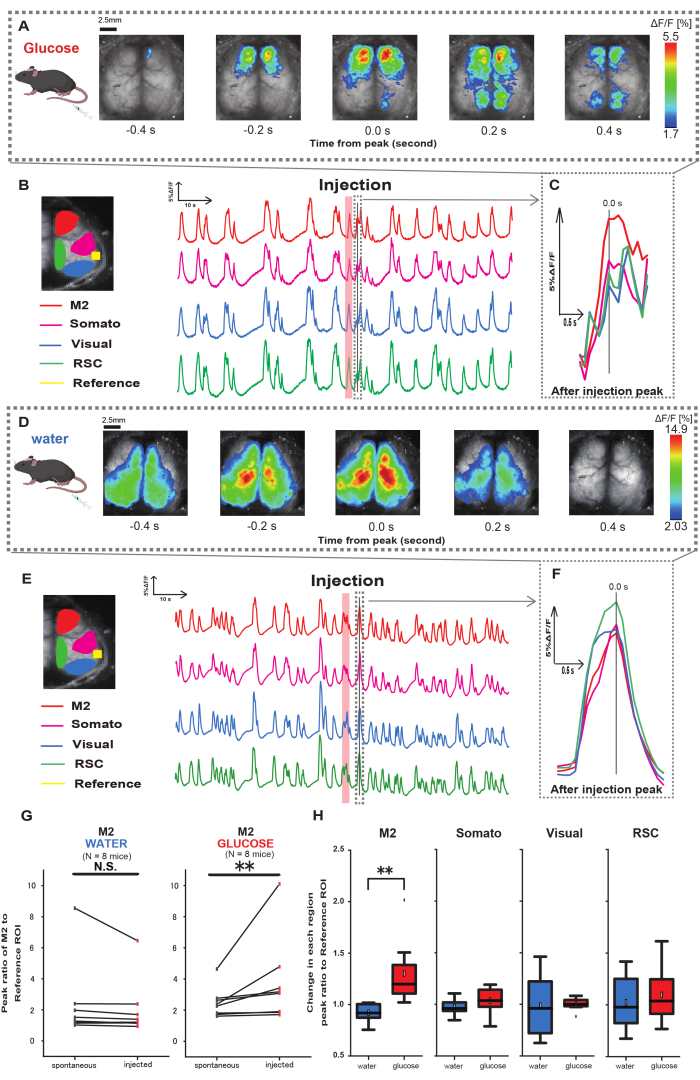
איור 3: תגובת +Ca2 רחבה של קליפת המוח במהלך / אחרי הזרקת גלוקוז או מים. (A) דוגמה מייצגת של מתן גלוקוז המוצגת במרווחים של 0.2 שניות. שינויים בעוצמת הפלואורסצנטיות מיוצגים באמצעות שכבת צבע מדומה. חלון הזמן המוקף בקו המקווקו ב-B מראה את Ca2+ הארעי הראשון לאחר ההזרקה, כאשר שיאו נקבע כזמן 0. ייצוג הצבע המדומה מבוסס על השיא של Ca2+ הארעי הראשון לאחר ההזרקה כערך המקסימלי והממוצע +1 SD כערך המינימלי. (B) שינויים בסדרות הזמן של עוצמת הפלואורסצנטיות עבור כל החזר השקעה בדוגמה. צבעי הקו מתאימים לאזורים שונים בקליפת המוח: אדום מייצג את M2, מגנטה מייצג את האזור הסומטוסנסורי (סומאטו), כחול מייצג את אזור הראייה (חזותי) וירוק מייצג את אזור הטבור רטרו. (C) שיא יחיד בתוך קו המתאר המקווקו מבודד ומוצג בתצוגה מוגדלת. ניתוח גל סידן המטרה הוא הגל המוקדם ביותר שהופיע תוך 4-8 שניות לאחר ההזרקה. (D) דוגמה מייצגת של הזרקת מים כנתוני בקרת סוכר. (E) סדרות זמן משתנות בעוצמת הפלואורסצנטיות עבור כל החזר השקעה בדוגמה. צבעי הקו הם כמו ב-B. (F) שיא יחיד בתוך קו המתאר המקווקו מבודד ומוצג בתצוגה מוגדלת. ניתוח גל סידן המטרה הוא הגל המוקדם ביותר שהופיע תוך 4-8 שניות לאחר ההזרקה. (G) השוואה בין פעילות ספונטנית של M2 (לפני) לבין תגובה לאחר הזרקה (הזרקה). עוצמת הפלואורסצנטיות הממוצעת משתנה מעל 50 שניות לפני ההזרקה, ותגובת השיא באזור M2 בין 4 שניות ל-8 שניות לאחר ההזרקה חושבה, תוך שימוש בקליפת המוח השמיעתית כנקודת ייחוס. (H) השוואת רמות ההפעלה בכל אזור בקליפת המוח כאשר ניתנו מים או גלוקוז. היחס בין הערך של לאחר ההזרקה ללפני ההזרקה, כפי שנקבע ב-G, חושב עבור כל אזור. נ.ש. מייצג לא משמעותי (עמ' > 0.05). ** <0.01. קווי שגיאה מוגדרים כשגיאת התקן של הממוצע. קיצורים: SD = סטיית תקן; ROI = אזור עניין; RSC = אזור רטרו ספלניאלי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
מאמר זה מציג כיצד לחבר קטטר למעיים ולצפות באותות Ca2+ רחבים של קליפת המוח הטרנס-גולגולתית עם עכברים טרנסגניים המבטאים אינדיקטור Ca2+ מקודד גנטית. בניסוי זה לא קיבלנו את נתוני ההדמיה המשתמשים באורך גל משני של מקור האור. הסיבה לכך היא שהעכברים הטרנסגניים שהשתמשנו במחקר זה מפגינים שיעור שינוי גבוה מאוד בעוצמת הפלואורסצנטיות (~כמה עשרות אחוזים) בתגובה לגירויים חושיים בשל התכונות של חלבון האינדיקטור Ca2+ (G-CaMP7) בו נעשה שימוש. לפיכך, חשבנו שהזיהום מהמודינמיקה הוא זניח. יתר על כן, התגובות העצביות שהתמקדנו בהן התרחשו במהירות תוך מספר שניות, ולכן חשבנו שאין צורך להסביר היפרמיה תפקודית מקומית שנוצרה לאחר מכן. שיטת השתלת צנתר זו מסוגלת להשתלב עם עכברים מהונדסים גנטית אחרים כדי לצפות בפעילות עצבית באזורי מוח אחרים ובטווחי זמן שונים. עם זאת, אם משתמשים בעכברים מהונדסים גנטית אחרים, יש לבצע את ניסוי הבקרה המתואר לעיל.
שיטה זו של הצמדת הצנתר למעי מתאימה להזרקה במינון בודד בעלות נמוכה והיא קלה ופחות פולשנית מהשיטה שהוצעה קודםלכן 29. באופן מסורתי, כותנה סופגת מוחל על איבר העיכול ותופר. עם זאת, תפירה עלולה לפגוע בהתאוששות שלאחר הניתוח בעכברים. לכן, אימצנו את שיטת החיבור. הסיבה שבחרנו בחרוזי פלסטיק היא שהם נצמדו טוב יותר לסיליקון עם דבק הציאנואקרילט בו אנו משתמשים.
באופן מסורתי הניחו כי המוח תופס גלוקוז בהתבסס על ההסלמה ברמות הגלוקוז בדם בפלזמה ושחרור ההורמונים במקביל. כתוצאה מכך, למוח נדרשות מספר דקות עד שעות כדי לזהות גלוקוז לאחר ספיגתו מהמעיים4. מחקרים מסוימים הציעו כי חישת מעיים שולטת בהעדפת הטעם של עכברים בנוסף לקליטת טעם מתוק אוראלי 1,3,17,22. כדוגמה להמחשה, חוקרים סיפקו ראיות לכך שתמיסה לא מזינה בטעם גלוקוז תוך קיבתי (IG) ותמיסה לא מזינה בטעם IG שאינה ניתנת לחילוף חומרים α-מתיל-d-גלוקופירנוסיד (MDG) יכולה לעורר העדפה לכל תמיסה לא מזינה בטעמים בהשוואה לקבוצה המזווגת-מים של IG. מכיוון שהזרקת גלוקוז תוך צפקית לא עוררה צריכת תמיסה לא מזינה30, היה צפוי שחישה תזונתית במעיים תשחק תפקיד מכריע בבחירות המזון של העכברים 1,19,22.
מחקר שנערך לאחרונה חשף את נוכחותו של תא מעורר חשמלית במעיים, המכונה "תא נוירופוד", המשתמש בקולטנים מולקולריים כדי לזהות ולהמיר גירויים חושיים לעצב התועה באמצעות סינפסה גלוטמטרגית. בעוד שמחקרים קודמים התמקדו בעיקר בתפקיד של GLP-1 בשליטה על הזנת המזון של עכברים, מחקרים אחרונים הראו כי הפעלת עצב הואגוס על ידי תאי נוירופוד מווסתת את תיאבון העכבר. העצב התועה מפעיל לאחר מכן את גרעין טרקטוס סוליטריוס, מה שמוביל להפעלה הבאה של נוירונים דופמינרגיים19. עם זאת, לא ידוע אם הפעלת נוירונים דופמינרגיים מפעילה גם את קליפת המוח. כדי לסווג תגובות מוחיות לאחר עירוי גלוקוז תוך קיבתי, שיפרנו את טכניקת חיבור הצנתר למטרות הדמיה. כאשר משתמשים בטכנולוגיה זו, חובה לנקוט משנה זהירות כדי למנוע נזק לאיברים, במיוחד לגבי הכבד, אשר רגיש לפגיעה במהלך המניפולציה הנדרשת כדי לוודא את מיקום הקיבה.
הממצאים שלנו מצביעים על כך שהזרקת גלוקוז תוך קיבתי מפעילה את קליפת המוח הקדם-מצחית תוך שניות. עם זאת, מתן גלוקוז תוך קיבתי יוזם מסלולי איתות מרובים בו זמנית, כגון מסלולים הורמונליים, עצב הואגוס ועצב עמוד השדרה. אותות אלה מעובדים בגזע המוח בטווחי זמן שונים. לכן, מחקרים עתידיים צריכים לחקור כיצד אותות מורכבים אלה מעובדים ומשולבים בתוך המוח.
יתר על כן, קו העכבר המהונדס BAC GLT-1-G-CaMP7 בו השתמשנו במחקר הנוכחי מבטא את חיישן Ca2+ , G-CaMP7, הן בתאי עצב והן באסטרוציטים. באופן עקרוני, הגובה הקדם-מצחי Ca2+ המתקבל על ידי הדמיית Ca2+ רחב קליפת המוח הטרנס-גולגולתית נגזר מנוירונים ו / או אסטרוציטים. עם זאת, מאחר שאסטרוציטים מבטאים קולטני דופמין אם מדובר באיתות דופמין, הדבר מצביע על הפעלה פוטנציאלית של איתות אסטרוציטי IP3/Ca2+ . מאחר שאיתות אסטרוציטי IP3/Ca2+ מווסת את הפלסטיות הסינפטית, הוא עשוי גם למלא תפקיד חשוב בשינויים בהעדפת סוכרוז ובשינויים בהתנהגות ההזנה לאחר קבלת גלוקוז. כתוצאה מכך, יהיה צורך בדימות ברזולוציה תאית באמצעות מיקרוסקופ של שני פוטונים כדי לזהות אם התגובה שנצפתה בקליפת המוח הקדם-מצחית לאחר מתן גלוקוז מקורה בנוירונים או אסטרוציטים במחקרים עתידיים. שיטה יעילה נוספת כוללת צפייה בביטוי אינדיקטור Ca2+ ספציפי לתא בעכברים באמצעות וירוס הקשור באדנו (AAV) באמצעות פוטומטריה סיבים. יתר על כן, יש צורך לוודא, באמצעות טכניקות אלקטרופיזיולוגיות, אם גירוי הגלוקוז למעי באמת עורר את העצב התועה. אם תאי נוירופוד מעבירים אותות לעצב התועה על ידי קבלת גלוקוז, אנו לא צופים תגובה מהעצב התועה כאשר מעכב SGLT-1 מנוהל. לבסוף, יהיה צורך בתיקוף באמצעות אנטגוניסטים שונים לקולטני דופמין כדי לאשר אם הקרנות העצבים התועה לגרעין הטרקטוס סוליטרי (NTS) הפעילו נוירונים דופמינרגיים, והגדילו את אותות קליפת המוח הקדם-מצחית Ca2+ . בסך הכל, מערכת זו מאפשרת חקירה מקיפה של השפעות ההעברה העצבית המהירה מהמעיים למוח. הוא מציג מתודולוגיה מבטיחה ביותר שעשויה להבהיר מנגנונים, כגון כיצד לחץ משנה את העדפת הסוכרוז לגבי אינטראקציות מעיים-מוח.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי אוניברסיטת אוצ'נומיזו, מענקי KAKENHI (18K14859, 20K15895), תוכנית יער JST, מענק מספר JPMJFR204G, קרן המחקר לאופטו-מדע וטכנולוגיה, מועצת המחקר של קאו לחקר מדעי הבריאות, האגודה היפנית לחדשנות כימית וקרן TERUMO למדעי החיים. המחבר מודה לד"ר טקאשי צובוי, קזוקי הראדה ואקיו נצובורי על פיקוחם על הניסויים. המחבר מודה גם לחברי המעבדה על תמיכתם.
Materials
| Name | Company | Catalog Number | Comments |
| 2.5 mL TERUMO syringe | TERUMO | ss-02Sz | |
| 23 G injection needle | TERUMO | 4987350390691 | |
| Anesthetic (ISOFLURANE Inhalation Solution) | viatris | 871119 | |
| cotton swab | local company | ||
| Cyanoacrylate glue (AronArufa A) | TOAGOSEI | 7990700Q1022 | |
| dental acrylic cement C&B | Sun Medical | 221AABZX00115000 | |
| Depilatory cream | Kracie | local company | |
| Digital CMOS camera | Hamamatsu Photonics | ORCA-Spark | |
| Ear bar | NARISHIGE | EB-5N | |
| Filter set (U-MWB2) | Evident | U-MWB2 | |
| Fine Scissors | Fine Dcience Tools | 14040-10 | |
| G7NG817 mice | RIKEN BRC | RBRC09650 | |
| Image software | Hamamatsu Photonics | HC Image software | |
| Isoflurane vapolizer | shinanoseisakusyo | SN-487-0T | |
| Light source (U-HGLGPS) | Evident | U-HGLGPS | |
| microscopy (MVX10) | Evident | ||
| Plastic beads (inner diameter 3 mm, outer diameter 5 mm) | local company | ||
| Pliers | local company | ||
| Polydioxanone suture, monodiox | Alfresa Pharma | HR1305MV45-KF2R | This absorbable, monofilament PDS suture is employed for closing the surgical incision |
| Round ended forceps | F.S.T. | 11617-12 | |
| saline | Otsuka Pharmaceutical Factory | 35061311 | |
| Silicon tube (inner diameter 0.5 mm, outer diameter 1.0 mm) | AS ONE CORPORATIO | 33151413 | local company |
| small surgery needle | Natsume Seisakusho Co., Ltd. | AC03DNT | |
| Stereotaxic stage | NARISHIGE | MA-6N | |
| Xylocaine Jelly 2% | Sandoz K.K. | 614429303 | This jelly is used as a local analgesic to alleviate surgical pain |
References
- Buchanan, K. L., et al. The preference for sugar over sweetener depends on a gut sensor cell. Nature Neuroscience. 25 (2), 191-200 (2022).
- Reimann, F. Molecular mechanisms underlying nutrient detection by incretin-secreting cells. International Dairy Journal. 20 (4), 236-242 (2010).
- Kreuch, D., et al. Gut mechanisms linking intestinal sweet sensing to glycemic control. Frontiers in Endocrinology. 9, 741 (2018).
- Gorboulev, V., et al. Na(+)-D-glucose cotransporter SGLT1 is pivotal for intestinal glucose absorption and glucose-dependent incretin secretion. Diabetes. 61 (1), 187-196 (2012).
- Harada, N., Inagaki, N. Role of sodium-glucose transporters in glucose uptake of the intestine and kidney. Journal of Diabetes Investigation. 3 (4), 352-353 (2012).
- Kaelberer, M. M., Rupprecht, L. E., Liu, W. W., Weng, P., Bohórquez, D. V. Neuropod cells: The emerging biology of gut-brain sensory transduction. Annual Review of Neuroscience. 43, 337-353 (2020).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Larsen, P. J., Tang-Christensen, M., Jessop, D. S. Central administration of glucagon-like peptide-1 activates hypothalamic neuroendocrine neurons in the rat. Endocrinology. 138 (10), 4445-4455 (1997).
- Alhadeff, A. L., Rupprecht, L. E., Hayes, M. R. GLP-1 neurons in the nucleus of the solitary tract project directly to the ventral tegmental area and nucleus accumbens to control for food intake. Endocrinology. 153 (2), 647-658 (2012).
- Raybould, H. E. Gut chemosensing: interactions between gut endocrine cells and visceral afferents. Autonomic Neuroscience: Basic & Clinical. 153 (1-2), 41-46 (2010).
- Routh, V. H. Glucose-sensing neurons: are they physiologically relevant. Physiology & Behavior. 76 (3), 403-413 (2002).
- Secher, A., et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. The Journal of Clinical Investigation. 124 (10), 4473-4488 (2014).
- Williams, E. K., et al. Sensory neurons that detect stretch and nutrients in the digestive system. Cell. 166 (1), 209-221 (2016).
- Borgmann, D., et al. Gut-brain communication by distinct sensory neurons differently controls feeding and glucose metabolism. Cell Metabolism. 33 (7), 1466-1482.e7 (2021).
- Krashes, M. J., et al. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. The Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- Aponte, Y., Atasoy, D., Sternson, S. M. AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training. Nature Neuroscience. 14 (3), 351-355 (2011).
- Zhang, L., Han, W., Lin, C., Li, F., de Araujo, I. E. Sugar metabolism regulates flavor preferences and portal glucose sensing. Frontiers in Integrative Neuroscience. 12, 57 (2018).
- Goldstein, ., et al. Hypothalamic detection of macronutrients via multiple gut-brain pathways. Cell Metabolism. 33 (3), 676-687.e5 (2021).
- Fernandes, A. B., et al. Postingestive modulation of food seeking depends on vagus-mediated dopamine neuron activity. Neuron. 106 (5), 778-788.e6 (2020).
- Kaelberer, M. M., et al. . A gut-brain neural circuit for nutrient sensory transduction. 361 (6408), eaat5236 (2018).
- Bohórquez, D. V., et al. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. The Journal of Clinical Investigation. 125 (2), 782-786 (2015).
- Tan, H. -. E., et al. The gut-brain axis mediates sugar preference. Nature. 580 (7804), 511-516 (2020).
- Wang, D., et al. Whole-brain mapping of the direct inputs and axonal projections of POMC and AgRP neurons. Frontiers in Neuroanatomy. 9, 40 (2015).
- Yamada, S., Wang, Y., Monai, H. Transcranial cortex-wide Ca2+ imaging for the functional mapping of cortical dynamics. Frontiers in Neuroscience. 17, 1119793 (2023).
- Monai, H., et al. Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain. Nature Communications. 7 (1), 11100 (2016).
- Ferron, J. -. F., Kroeger, D., Chever, O., Amzica, F. Cortical Inhibition during Burst Suppression Induced with Isoflurane Anesthesia. The Journal of Neuroscience. 29 (31), 9850-9860 (2009).
- Ming, Q., et al. Isoflurane-induced burst suppression is a thalamus-modulated, focal-Onset rhythm with persistent local asynchrony and variable propagation patterns in rats. Frontiers in Systems Neuroscience. 14, 599781 (2021).
- Schwalm, M., et al. Functional states shape the spatiotemporal representation of local and cortex-wide neural activity in mouse sensory cortex. Journal of Neurophysiology. 128 (4), 763-777 (2022).
- Ueno, A., et al. Mouse intragastric infusion (iG) model. Nature Protocols. 7 (4), 771-781 (2012).
- Zukerman, S., Ackroff, K., Sclafani, A. Post-oral glucose stimulation of intake and conditioned flavor preference in C57BL/6J mice: A concentration-response study. Physiology & Behavior. 109, 33-41 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved