Method Article
Echtzeit-Analyse der neuronalen Kommunikation zwischen Darm und Gehirn: Kortexweite Kalziumdynamik als Reaktion auf intestinale Glukosestimulation
In diesem Artikel
Zusammenfassung
Die Darm-Hirn-Kommunikation, die durch den Vagusnerv erleichtert wird, ist entscheidend für die Kommunikation zwischen dem gastrointestinalen endokrinen System und dem Gehirn. Ob die intragastrische Glukoseinjektion die kortikale Aktivität verändern kann, ist jedoch noch nicht verstanden. Hier bieten wir ein umfassendes Protokoll an, um Veränderungen der kortikalen Aktivität nach einer Glukoseinjektion in den Zwölffingerdarm zu beobachten.
Zusammenfassung
Die Kommunikation zwischen dem Magen-Darm-Trakt und dem Gehirn nach der Nährstoffaufnahme spielt eine wesentliche Rolle für die Nahrungspräferenz, den Stoffwechsel und das Ernährungsverhalten. Insbesondere in Bezug auf bestimmte Nährstoffe haben viele Studien gezeigt, dass die Assimilation von Glukose in den Darmepithelzellen die Aktivierung vieler Signalmoleküle auslöst. Hormone wie das Glukagon-ähnliche Peptid-1 sind als wesentliche Signalvermittler bekannt. Da Hormone das Gehirn überwiegend über Durchblutungswege beeinflussen, modulieren sie die Gehirnaktivität langsam.
Neuere Studien haben jedoch gezeigt, dass zwei schnelle Darm-Hirn-Bahnen durch das autonome Nervensystem erleichtert werden. Der eine funktioniert über die spinale afferente Nervenbahn, während der Vagusnerv den anderen vermittelt. Folglich sind die Reaktionen des Gehirns nach der Glukoseassimilation im Magen-Darm-Trakt kompliziert. Da die Darmstimulation schließlich verschiedene kortikale Aktivitäten induziert, einschließlich sensorischer, nozizeptiver, Belohnungs- und motorischer Reaktionen, ist es darüber hinaus notwendig, Methoden anzuwenden, die die Visualisierung lokalisierter Gehirnschaltkreise und pankortikaler Aktivitäten erleichtern, um die neuronale Übertragung zwischen Darm und Gehirn vollständig zu verstehen. Einige Studien haben gezeigt, dass die Konzentrationen von Kalziumionen (Ca2+) im Hypothalamus und im ventralen tegmentalen Bereich unabhängig voneinander auf verschiedenen Wegen nach intestinaler Stimulation verändert wurden. Ob es Veränderungen in der Aktivität der Großhirnrinde gibt, ist jedoch nicht bekannt.
Um die Aktivität der Großhirnrinde nach intragastrischer Glukoseinjektion zu beobachten, haben wir ein bildgebendes Verfahren zur Echtzeit-Visualisierung der kortexweiten Ca2+ -Dynamik durch einen vollständig intakten Schädel entwickelt, wobei transgene Mäuse verwendet wurden, die genetisch kodierte Ca2+ -Indikatoren exprimierten. Diese Studie stellt ein umfassendes Protokoll für eine Technik vor, die entwickelt wurde, um die durch Darmstimulation induzierte transkranielle Cortex-weite Ca2+ -Bildgebung nach intragastrischer Glukoseinjektion über einen implantierten Katheter zu überwachen. Die vorläufigen Daten deuten darauf hin, dass die Verabreichung von Glukoselösung in den Darm den frontalen Kortex aktiviert, der nicht auf die Wassergabe reagiert.
Einleitung
In erster Linie erfolgt die Darmwahrnehmung von Glukose über die Rezeptoren für süße Geschmacksrichtungen (Tas1r2, Tas1r3) und den Natrium-Glukose-Cotransporter 1 (SGLT-1), die sich in enteroendokrinen Zellen im Darmlumen 1,2,3,4,5,6 befinden. Die Empfindung von Glukose im Gehirn ist ein Prozess, der sich typischerweise von Minuten bis Stunden nach ihrer Aufnahme aus dem Darm erstreckt, ein Ereignis, das hauptsächlich auf einem erhöhten Plasma-Blutzuckerspiegel und der Freisetzung der Hormone 7,8,9,10,11 beruht (z. B. Glucagon-ähnliches Peptid-1 [GLP-1], Peptid YY (PYY) und glukoseabhängiges insulinotropes Polypeptid [GIP]). Sie erreichen den Nucleus arcuatus des Hypothalamus (ARC), wo sie Pro-Opiomelanocortin (POMC)-Neuronen und Agouti-Related Protein (AgRP)-Neuronen über den Blutfluss und den Vagusnerv (Nervus parasympathisticus) binden12,13,14. Die Veränderung der Aktivität dieser Neuronen führt zu einer Kontrolle des Stoffwechsels und des Fressverhaltens15,16.
In der neueren Literatur wird zunehmend die Bedeutung der neuronalen Signalübertragung zwischen Darm und Gehirn nach der Glukoseabsorption hervorgehoben. Dieser komplexe Signalweg kann grob in zwei Hauptmechanismen eingeteilt werden. Die erste beinhaltet die Aktivierung von spinalen Afferenzen, die letztendlich die neuronale Aktivität von AgRP im ARC beeinflussen. Der zweite Mechanismus beinhaltet die Stimulation des Vagusnervs durch Verbindungen mit Epithelzellen. Angesichts der vielfältigen Möglichkeiten, wie Darmepithelzellen den Vagusnerv aktivieren können13, gilt seine Rolle als vielseitig.
Ein signifikanter Teil der Aktivitäten des Darmvaguses und des Spinalnervs ist mit dem Fressverhalten verbunden 17,18,19. Neue Erkenntnisse deuten jedoch darauf hin, dass bestimmte Vagusnervenfasern, die zu "Neuropodenzellen" projizieren, an der Glukosepräferenz beteiligt sind. Neuropodenzellen, eine Untergruppe der enteroendokrinen Zellen, exprimieren SGLT-1 auf ihrer luminalen Seite und leiten sensorische Reize über glutamaterge Synapsen an einen Vagusnerv weiter 2,20,21,22. Die Aktivierung des Vagusnervs löst innerhalb von Sekunden dopaminerge Neuronen im ventralen tegmentalen Bereich (VTA) aus19. Bemerkenswert ist, dass die Hemmung der vagalen Aktivierung, insbesondere im Zwölffingerdarm, mit einem Glutamat-Antagonisten die Saccharosepräferenz bei Mäusenreduziert 1. Dies unterstreicht die entscheidende Rolle der Aktivierung von Neuropodenzellen bei der Modulation des Lebensmittelauswahlverhaltens nach der Glukoseaufnahme2.
Trotz dieser Fortschritte bleibt ein umfassendes Verständnis der schnellen intestinalen Glukosemessmechanismen und ihrer Wirkung auf die kortikalen Aktivitäten ein komplexes Rätsel. Obwohl die durch AgRP-Neuronen gesteuerte Gehirnaktivierung die Großhirnrinde23 nicht umfasst, ist bekannt, dass dopaminerge Neuronen in der VTA in die Großhirnrinde projizieren. Ob jedoch eine schnelle dopaminerge neuronale Aktivierung von VTA nach Glukosemessung die Großhirnrinde wirklich aktiviert, ist nicht bekannt. Um diesen Mechanismus aufzuklären, untersuchten wir das Potenzial der intragastrischen Glukoseverabreichung, die kortikaleCa2+ -Dynamik in transgenen Mäusen schnell zu beeinflussen, die einen genetisch kodierten Kalziumindikator exprimieren.
In dieser Arbeit wird eine kostengünstige und weniger invasive Methode vorgestellt, um die Veränderungen der kortikalen Aktivität nach intragastrischer Glukoseverabreichung mit Hilfe der kortexweiten Ca2+ -Bildgebung bei Mäusen umfassend zu verstehen. In jüngster Zeit hat die transkranielle kortexweiteCa2+ -Bildgebungstechnik durch einen intakten Schädel unter Verwendung transgener Mäuse, die genetisch kodierte Kalziumindikatoren exprimieren, an Popularität gewonnen24. Bemerkenswert ist, dass die transgene Mauslinie BAC GLT-1-G-CaMP7 #817 (auch G7NG817 als Maus bekannt), die in dieser Studie verwendet wurde, denCa-2+ -Sensor, G-CaMP7, in Neuronen und Astrozytenexprimiert 25. Aufgrund ihrer hohen Expressionsdichte in der Großhirnrinde eignet sich diese transgene Mauslinie besonders für die transkranielle Cortex-weite Ca2+ -Bildgebung mit einem Standard-Epifluoreszenzmikroskop.
Protokoll
Alle Versuchsprotokolle wurden vom Institutional Animal Care and Use Committee der Ochanomizu University, Japan, genehmigt (Tierstudienprotokolle 22017). Alle Tierversuche wurden gemäß den Richtlinien für Tierversuche der Universität Ochanomizu durchgeführt, die den grundlegenden Richtlinien für die ordnungsgemäße Durchführung von Tierversuchen und damit verbundenen Aktivitäten in akademischen Forschungseinrichtungen (Ministerium für Bildung, Kultur, Sport, Wissenschaft und Technologie, Japan) entsprechen. Es wurden Anstrengungen unternommen, um die Anzahl der verwendeten Tiere zu minimieren. Diese Studie wurde in Übereinstimmung mit den ARRIVE-Richtlinien durchgeführt.
1. Aufbereitung transgener Mäuse
- Um diesem Experiment zu folgen, verwenden Sie adulte männliche und weibliche BAC GLT-1-G-CaMP7 #817 transgene Mauslinie, nämlich G7NG817 Mäusen24,25 (älter als 8 Wochen). Der Hintergrundstamm von G7NG817 Mäusen25 ist C57BL/6J.
- Halten Sie die Mäuse unter einem 12 h /12 h Hell-Dunkel-Zyklus und ziehen Sie sie in Gruppen von bis zu fünf Mäusen auf.
2. Erstellung des Katheters
- Stellen Sie den Silikonschlauch (Innendurchmesser 0,5 mm, Außendurchmesser 1,0 mm) mit einer Schere auf eine genaue Länge von 7 cm ein (Abbildung 1A-a).
HINWEIS: Vor den Eingriffen wurden die Schere und der Silikonschlauch sterilisiert. - Kleben Sie winzige Kunststoffperlen (Innendurchmesser 3 mm, Außendurchmesser 5 mm) auf das maßgeschneiderte Rohr und stellen Sie sicher, dass sie 3 mm von seinem Ende entfernt sind (Abbildung 1A-b). Befestigen Sie die Raupen sicher mit Cyanacrylatkleber (medizinische oder Standardvarianten sind akzeptabel).
- Die Spitze einer 23-g-Nadel herausschneiden und anschließend 1,5 cm von der Nadelspitze abschneiden (Abbildung 1A-c).
- Führen Sie die geschnittene 23-G-Nadel aus Schritt 2.3 in das Ende des Silikonschlauchs ein, entgegengesetzt von der Stelle, an der die Kügelchen angebracht wurden (Abbildung 1A-d).
3. Entwicklung des Injektors
- Verwenden Sie eine sterile Zange, um 1 cm von der Nadelspitze entfernt zu schneiden (Abbildung 1B-a).
HINWEIS: Stellen Sie sicher, dass die Blende am abgetrennten Ende ihre Integrität behält und sich nicht verformt, da jede Verformung den Fluss der Injektionslösung behindern könnte. - Koppeln Sie die angepasste 23-G-Injektionsnadel aus Schritt 3.1.1 mit einer 2,5-mL-Spritze (Abbildung 1B-b).
- Segmentieren Sie ein Silikonröhrchen auf die erforderliche Länge (in diesem Versuch ein 15 cm langes Silikonröhrchen) und ummanteln Sie es mit der 23-G-Injektionsnadel (Abbildung 1B-c).
HINWEIS: Die Menge der abgegebenen Lösung schwankt je nach Länge des Schlauchs. Bei einem 15-cm-Röhrchen verbleiben beispielsweise etwa 50 μl der Lösung nach dem Experiment. - Trennen Sie die 23 G Injektionsnadel 1,5 cm von der Nadelspitze ab.
- Verbinden Sie den geschnittenen Teil aus Schritt 3.4 mit dem Silikonkatheter aus Schritt 3.3 (Abbildung 1B-d).
HINWEIS: Stellen Sie sicher, dass die in den Schritten 3.1 und 3.4 erstellten Öffnungen nach dem Schnitt unverzerrt bleiben. Wenn eine Korrektur erforderlich ist, verwenden Sie eine Zange, um die kreisförmige Konfiguration wiederherzustellen.
4. Lokalisation des Magens
- Verabreichen Sie der Maus eine Anästhesie durch Inhalation von 3,0 % Isofluran in einer bestimmten Kammer. Tragen Sie eine Augensalbe auf, um Augentrockenheit zu verhindern.
- Übertragen Sie die anästhesierte Maus vorsichtig aus der Inhalationskammer auf den Operationstisch, nachdem der anästhesierte Zustand der Maus überprüft wurde. Bieten Sie während des gesamten Eingriffs thermische Unterstützung.
- Legen Sie die Maus in Rückenlage, richten Sie ihren Mund in der Nähe des Inhalationsgeräts aus und modulieren Sie die Isoflurankonzentration von 3,0 % auf 2,0 %.
HINWEIS: Trennen Sie das untere Segment der Isofluranmaske von seinem oberen Gegenstück und verankern Sie die abgetrennte Maske (oberes Segment) mit Klebeband auf dem Operationstisch. - Ergänzen Sie die Mundhöhle, die Vorder- und Hintergliedmaßen der Maus mit Klebeband auf dem Operationstisch.
HINWEIS: Durch die Fixierung der Maus auf dem Tisch können auch bei Betäubung der Maus chirurgische Fehler durch Bewegung verhindert werden. - Entfernen Sie die Haare der Maus vom linken Oberbauch (150 % des Bereichs um die Operationsstelle) mit Enthaarungscreme. Tragen Sie ein lokales Analgetikum topisch auf die Operationsstelle auf und warten Sie 5 Minuten, bevor Sie fortfahren.
- Tragen Sie ein Lokalanästhetikum auf die Bauchhaut auf und warten Sie 5 bis 10 Minuten. Desinfizieren Sie dann den Operationsbereich 3 Mal abwechselnd mit Iodophor und 70% Ethanol. Bestätigen Sie die Narkosetiefe mit einer Zehenklemme und decken Sie das Tier mit sterilen OP-Tüchern ab. Machen Sie einen etwa 1,5 cm langen Hautschnitt (Abbildung 1C-b), der sich 1 cm rechts vom Bauchmedian und 5 mm unterhalb des Processus xiphoideus befindet (Abbildung 1C-c). Erstellen Sie dann einen 1,5 cm langen Schnitt in der Bauchdecke an der gleichen Stelle wie der ursprüngliche Hautschnitt.
HINWEIS: Seien Sie vorsichtig, um die darunter liegende Leber nicht zu schädigen. - Positionieren Sie den linken Leberlappen vorsichtig seitlich mit einer stumpfen Pinzette, so dass der Magen darunter zum Vorschein kommt.
5. Einführen des Katheters
- Heben Sie den Magen an und ziehen Sie ihn vorsichtig durch den Schnitt heraus.
HINWEIS: Seien Sie äußerst vorsichtig, um die Unversehrtheit der angrenzenden Organe, insbesondere der Leber, zu erhalten, und unterlassen Sie es, übermäßige Gewalt auf den Magen auszuüben. - Verwende eine Schere, um eine winzige Perforation (ca. 1,5 mm Durchmesser) im Pylorusantrum zu erzeugen.
- Führen Sie das Ende des Katheters in die Perforation ein und stellen Sie sicher, dass die Perle in direktem Kontakt mit dem Pylorusantrum steht.
HINWEIS: Der Katheter wird vor dem Einführen mit einer 0,1 bis 0,5%igen Chlorhexidingluconatlösung desinfiziert. - Kleben Sie die Raupe des Katheters mit medizinischem Cyanacrylatkleber auf den Magen.
HINWEIS: Stellen Sie sicher, dass der Magen nicht mit den umgebenden Organen verbunden ist. - Überprüfen Sie, ob der Katheter fest am Magen befestigt ist, und positionieren Sie den Magen dann vorsichtig wieder an seine angestammte Stelle unter dem linken Leberlappen.
- Nähen Sie die Bauchdecke, so dass sich der Katheter nach außen ausdehnen kann, mit einer Naht aus Polydioxanon (PDS). Danach schließen Sie den Hautschnitt analog zum Bauchverschluss.
- Positionieren Sie die Maus vorsichtig in einem desinfizierten Käfig.
HINWEIS: Postoperative Mäuse sollten einzeln untergebracht werden. Tragen Sie ein lokales Analgetikum topisch auf den Wundverschluss auf und befolgen Sie die analgetischen Pläne, wie sie in den lokalen institutionellen Richtlinien empfohlen werden. - Erlauben Sie einen Wiederherstellungszeitraum von mindestens 48 Stunden in einer Standardumgebung.
HINWEIS: Ein Ende des Katheters, der in den Magen der Maus eingeführt wird, wird mit einer 23G-Nadel mit versiegelter Spitze verschlossen, um das Eindringen von Fremdsubstanzen und ein Beißen zu verhindern. Da der Katheter, der aus dem Bauch herausragt, kurz ist, verhindert er, dass die Maus ihn durch das Bettzeug zieht, was dazu führen könnte, dass er sich öffnet oder sich verfängt.
6. Vorbereitung für die transkranielle Ca2+-Bildgebung in vivo
- Verabreichen Sie der Maus eine Anästhesie mit Isofluran (Induktion bei 2 %; Erhaltungstherapie zwischen 0,8 % und 1,0 %).
- Befestigen Sie die Maus mit zusätzlichen Ohrbügeln auf einer stereotaktischen Plattform, um die Auswirkungen von Pulsation und Atmung zu mildern. Positionieren Sie anschließend die Maus unter einem Fluoreszenz-Stereomikroskop.
- Verwenden Sie ein breitbandiges blaues Fluoreszenzfilterset (mit Anregung bei 460-490 nm und Emission bei 520 nm) in Verbindung mit einer Quecksilberlichtquelle.
- Nehmen Sie die Bilder mit einer Kamera auf und bearbeiten Sie sie mit der entsprechenden Bildbearbeitungssoftware.
- Entfernen Sie die Haare vorsichtig mit einem Elektrorasierer oder einer Haarentfernungscreme von der Kopfhaut.
HINWEIS: Wenn Sie einen Rasierer verwenden, stellen Sie sicher, dass er gründlich desinfiziert ist, und achten Sie darauf, die Haut nicht zu schneiden. - Desinfizieren Sie die Oberfläche der Kopfhaut mit einem Wattestäbchen oder einem ähnlichen Werkzeug mit einer auf 0,1-0,5% verdünnten Lösung von Chlorhexidingluconat. Anschließend mit Alkohol desinfizieren und diese abwechselnd 3x wiederholen.
- Tragen Sie ein Lokalanästhesiegel auf und warten Sie 5-10 Minuten.
- Bereiten Sie sich auf das Auftragen von Zahnacrylkleber vor.
- Verwenden Sie eine sterile Skalpellklinge, um die Kopfhaut zu schneiden. Entfernen Sie entweder die Kopfhaut komplett oder machen Sie einen geraden Schnitt vom Hinterkopf bis zur Stirn.
- Verwenden Sie Clips, um den Schädel freizulegen, indem Sie überschüssige Haut verlängern.
- Verwenden Sie ein Wattestäbchen, um das Bindegewebe der Knochenhaut zu entfernen.
- Tragen Sie den Acrylzement sofort nach dem Entfernen des Periosts auf. Handeln Sie schnell, um zu verhindern, dass die Schädeloberfläche durch Verdunstung aus dem freiliegenden Knochen undurchsichtig wird.
- Warten Sie ca. 5 Minuten, bis der Zement getrocknet ist.
7. Transkranielle Ca2+ -Bildgebung mit intraduodenaler Glukosegabe
- Sowohl die experimentelle Lösung als auch die Kochsalzlösung werden auf Umgebungstemperatur äquilibriert. Setzen Sie die Mäuse für eine bestimmte Dauer (z. B. 2 Stunden) einer diätetischen Einschränkung aus.
- Entfernen Sie den Restinhalt des mausseitigen Katheters mit ~0,03 ml Kochsalzlösung, bevor Sie die Injektion einleiten.
- Aspirieren Sie die experimentelle Lösung (z. B. eine 10%ige Glukoselösung, die in 300 μl Wasser hergestellt wurde, ergänzt durch weitere 300 μl Wasser) in die Spritze und geben Sie sie dann an den Katheter an. Ermitteln Sie die optimale Dosierung der Lösung, die auf das spezifische Versuchsziel abgestimmt ist.
HINWEIS: Seien Sie während dieser Phase vorsichtig, um eine übermäßige Belastung des Katheters zu vermeiden, die die innere Anatomie der Maus gefährden könnte. Bemühen Sie sich, die Schläuche auf der Mausseite mit äußerster Sanftheit zu manipulieren. Stellen Sie außerdem sicher, dass die Spritze frei von Luft nach der Lösungsaspiration bleibt, da eingeschlossene Luft und Blasen eine gastrointestinale Blähung auslösen können. - Beurteilen Sie den physiologischen Zustand der Maus und aktivieren Sie die Aufzeichnungsfunktion der Bildgebungssoftware, indem Sie auf die Schaltfläche für den Aufnahmevorgang in der Softwareanwendung klicken.
- Nehmen Sie Bilder mit einer Auflösung von 512 x 512 Pixeln, einer Tiefe von 16 Bit und einer Bildrate von 10 Hz auf.
HINWEIS: Die Aufnahmeparameter können angepasst werden, um sie an spezifische experimentelle Anforderungen anzupassen. - Erfassen Sie spontane Daten (z. B. über 50 s), gefolgt von der allmählichen Infusion der experimentellen Lösung mit einer auf das Experiment abgestimmten Geschwindigkeit (hier 0,035 ml/s).
HINWEIS: Am Ende des Experiments wird die Maus umgehend durch Zervixluxation unter Isofluran-Anästhesie eingeschläfert.
8. Bilddatenverarbeitung und -analyse
- Binden Sie Bilddaten in eine Größe von 64 x 64 Pixeln.
- Bestimmen Sie handgezeichnete Regions of Interest (ROIs) mit ImageJ. Beziehen Sie sich auf den Atlas des Mausgehirns, um ROIs als den frontalen Bereich (M2), den somatosensorischen Bereich einschließlich des Fasses (Somato), den okzipitalen Bereich (visuell) und die retrospleniale Region (RSC) zu bezeichnen.
- Verwenden Sie die MATLAB-Funktion ReadImageJROI , um die Koordinaten zu extrahieren, die den ROIs entsprechen. Greifen Sie über den bereitgestellten Link auf die MATLAB-Funktion zu: https://jp.mathworks.com/matlabcentral/fileexchange/32479-readimagejroi
- Berechnen Sie die durchschnittliche Änderungsrate der Fluoreszenzintensität innerhalb des ROI mit MATLAB.
- Definieren Sie die Änderungsrate der Fluoreszenzintensität (ΔF/F) mit Gleichung (1):
 (1)
(1)
Dabei steht F t für den Wert der Fluoreszenzintensität zu einem bestimmten Zeitpunkt, und der durchschnittliche Intensitätswert vom Beginn der Aufzeichnung bis 50 s nach Beginn der Injektion wird als F0 bezeichnet.
- Definieren Sie die Änderungsrate der Fluoreszenzintensität (ΔF/F) mit Gleichung (1):
- Berücksichtigen Sie die Verzögerung, mit der die Injektionslösung das Organ erreicht. Verwenden Sie den durchschnittlichen Intensitätswert für die drei Sekunden nach der Injektion als Ausgangswert. Zielsignale, die den Ausgangsintensitätswert + 1 SD für die Analyse überschreiten, wenn sie 3 s oder später nach der Injektion auftreten.
Ergebnisse
Transkranielle Kortex weite Ca2+ -Bildgebung mit einem Isofluran-anästhesierten G7NG817 Maus
Wir haben den Katheter nach dem in Abbildung 1 dargestellten Verfahren hergestellt. Nachdem wir die Position des Magens sorgfältig identifiziert hatten, befestigten wir den Katheter an dieser Stelle (Abbildung 1). Nachdem wir eine ausreichende Erholungszeit nach dem Einführen des Katheters (ca. 48 Stunden) eingeräumt hatten, maßen wir die spontane neuronale Aktivität unter milder Isofluran-Anästhesie (0,8-1,0%), um die Änderungen der Fluoreszenzintensität zu Studienbeginn für nachfolgende Beobachtungen der Darmstimulation zu ermitteln. Als Ergebnis bestätigten wir die zufälligen Ca2+ -Oszillationsmuster, die sich über den gesamten Kortex erstreckten (Abbildung 2A). Abbildung 2 zeigt repräsentative Beispiele für spontane Hirnaktivität, bei der die Katheter zuvor eingeführt wurden. Wir definierten die Zeit des ersten beobachtbaren transienten Ca2+ -Peaks in der M2-Region nach der Injektion auf 0,0 s. Die Pseudofarbdarstellung zeigte den Peak dieses Ca2+ -Transienten als Maximalwert an, mit dem Mittelwert plus einer Standardabweichung (1 SD) als Minimalwert. Es zeigte sich, dass die linke und die rechte Hemisphäre in allen Regionen synchrone Aktivität zeigten.
Als nächstes haben wir ROIs ermittelt, um die Wellen innerhalb jedes Funktionsbereichs zu charakterisieren. Wie in Abbildung 2B gezeigt, haben wir die zeitlichen Änderungen der Fluoreszenzintensitätsrate für jeden ROI dargestellt (Abbildung 2B). Diese beobachteten Oberflächen-Ca2+ -Oszillationen folgten einem Burst-Suppressionsmuster, das zwischen Perioden geringer Aktivität und Fluoreszenzänderungen mit hoher Amplitude wechselte. Dieses Aktivitätsmuster stimmt mit früheren Ergebnissen überein, die gleichzeitig das kortikale Oberflächen-EEG und die Ca2+ -Dynamik gemessenhaben 26.
Trotz globaler oder regionaler Ca2+-Fluktuationen an der Oberfläche zwischen Suppressions- und Burst-Zuständen kann die spezifische kortikale Region, die den Kalziumanstieg auslöst, unterschiedlich sein. Wie bereits berichtet, wird erwartet, dass sich der Bereich aktiviert, wenn ein Signal eine lokale kortikale Region stimuliert, was in der Folge zu einer globalen Verschiebung des kortikalen Zustands führt27,28.
Veränderungen der Dynamik von Cortex-Ca2+ nach intragastrischer Glukoseinjektion
Um zu klären, wie die Glukose- oder Wasserverabreichung die kortikale Aktivität beeinflusst, überwachten wir die kortexweite Ca2+-Dynamik während und nach der Injektion. Als Ergebnis fanden wir Veränderungen in der kortikalen Ca2+-Dynamik nach intragastrischer Glukoseinjektion. Im Gegensatz zu der spontanen Aktivität, die in verschiedenen Regionen der kortikalen Aktivierung dargestellt wird, beobachteten wir eine sofortige Aktivierung im präfrontalen Bereich oder im sekundären motorischen Kortex (M2) bei direkter Darminjektion von Glukose über den Katheter, ein Effekt, der durch die intragastrische Wasserinjektion nicht induziert wurde (Abbildung 3A-C). Darüber hinaus beobachteten wir, dass diese vorübergehenden, prominenten Ca2+-Ereignisse tendenziell über etwa 10 s nach der intragastrischen Glukoseinjektion kontinuierlich auftraten. Solche anhaltenden Phänomene waren bei der Verabreichung von Wasser nicht erkennbar (Abbildung 3D-F).
Die Ca2+- Ereignisse in jedem ROI wurden charakterisiert, indem das Verhältnis des Fluoreszenzintensitätsänderungsverhältnisses unter Verwendung des auditorischen Kortex (Referenz) als Referenz bei dem ersten Peak, der innerhalb von 4-8 s nach Abschluss der Glukoseverabreichung auftrat, berechnet wurde. Infolgedessen wurde eine signifikante Veränderung bei der Injektion von Glukose beobachtet, nachdem das Ansprechen in der M2-Region verglichen wurde, wobei der auditorische Kortex als Referenz vor und nach der Injektion verwendet wurde.
Im Gegensatz dazu wurde eine solche Veränderung bei der Injektion von Wasser nicht beobachtet (Abbildung 3G, Wasser N = 7: vor vs. Injektion, 2,38 ± 2,53 vs. 2,05 ± 1,84, p > 0,05; Glukose N = 7: vor vs. Injektion, 2,48 ± 0,97 vs. 3,76 ± 2,76, p < 0,01, Wilcoxon-Vorzeichen-Grad-Test). Als nächstes wurde bei der Definition der Aktivierungsniveaus in jeder kortikalen Region durch das Verhältnis des Wertes von nach der Injektion zu vor der Injektion ein signifikanter Unterschied nur in der M2-Region beobachtet (Abbildung 3H, M2: 0,92 ± 0,89 vs. 1,30 ± 0,32, p = 0,006; Somato: 0,95 ± 0,076 vs. 1,04 ± 0,13, p = 0,27; Visuell: 0,92 ± 0,3 vs. 1,00 ± 0,06, p = 0,89; RSC: 0,97 ± 0,27 vs. 1,10 ± 0,27, p = 0,60, t-Test).
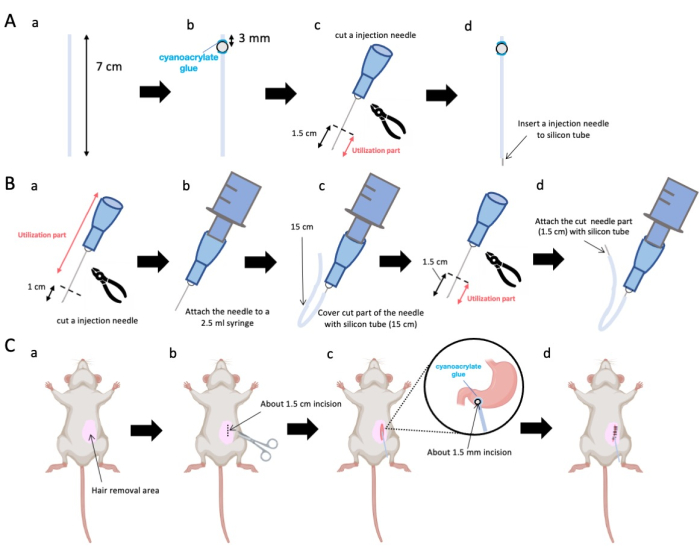
Abbildung 1: Überblick über die Methode. (A) Herstellung des Katheters: (a) Schneiden Sie den Silikonschlauch ab. (b) Befestigen Sie eine Kunststoffraupe mit medizinischem Cyanacrylatkleber auf dem Silikonschlauch. c) Die 23 G Nadel 1,5 cm von der Spitze abschneiden. (d) Befestigen Sie das abgeschnittene Ende der Nadel am Silikonschlauch. (B) Injektor-Baugruppe: (a) Schneiden Sie eine 23-G-Injektionsnadel um 1 cm ab. (b) Verbinden Sie die getrimmte Injektionsnadel mit einer 2,5-ml-Spritze. c) Den abgeschnittenen Teil der Injektionsnadel mit einem Silikonschlauch ummanteln. (d) Die 23 G Nadel 1,5 cm von der Spitze abschneiden. (e) Befestigen Sie das abgeschnittene Ende der Nadel am Silikonschlauch. (c) Chirurgischer Eingriff: (a) Enthaaren Sie das Operationsgebiet. (b) Die Haut und die Bauchdecke bis zu einer Länge von ca. 1,5 cm einschneiden. (c) Mit einer Schere eine kleine Perforation (ca. 1,5 mm Durchmesser) in das Pylorusantrum einstechen und den Katheter (Silikonschlauch) einführen. Befestigen Sie den Katheter mit medizinischem Cyanacrylatkleber am Pylorusantrum. (d) Nähen Sie die Bauchdecke und die Haut mit 5/0 Seidennahtmaterial und einer Nadel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
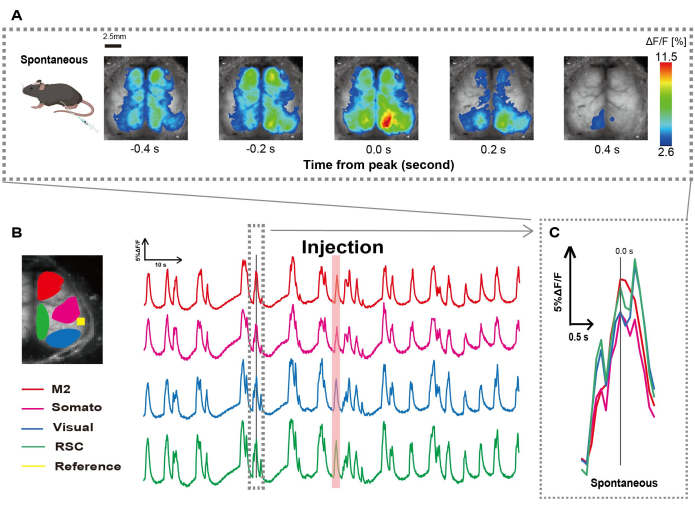
Abbildung 2: Spontane kortexweite Ca2+ -Oszillationen bei G7NG817 Mäusen mit angelegtem Katheter. (A) Ein repräsentatives Beispiel für kortexweite Ca2+ -Oszillationen, die in Intervallen von 0,2 s angezeigt werden. Änderungen der Fluoreszenzintensität werden mit einer Pseudofarbüberlagerung dargestellt. Das Zeitfenster, das von der gestrichelten Linie in B umgeben ist, zeigt das erste erscheinende Ca2+ -Transiente, dessen Spitze auf die Zeit 0 eingestellt ist. Die Pseudofarbdarstellung verwendet den Peak dieses Ca2+ -Transienten als Maximalwert und den Mittelwert +1 SD als Minimalwert. (B) Zeitreihenänderungen der Fluoreszenzintensität für jeden ROI im Beispiel. Die Linienfarben entsprechen unterschiedlichen kortikalen Bereichen: Rot steht für M2; Magenta repräsentiert den somatosensorischen Bereich (Somato); blau stellt den visuellen Bereich dar (Visual); und Grün steht für die Retro-Milzregion. Der lachsfarbene Streifen zeigt die Injektionszeit an. (C) Eine einzelne Spitze innerhalb der gestrichelten Kontur wird isoliert und in einer vergrößerten Ansicht angezeigt. Abkürzungen: SD = Standardabweichung; ROI = Region von Interesse; RSC = Retro-Milzregion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
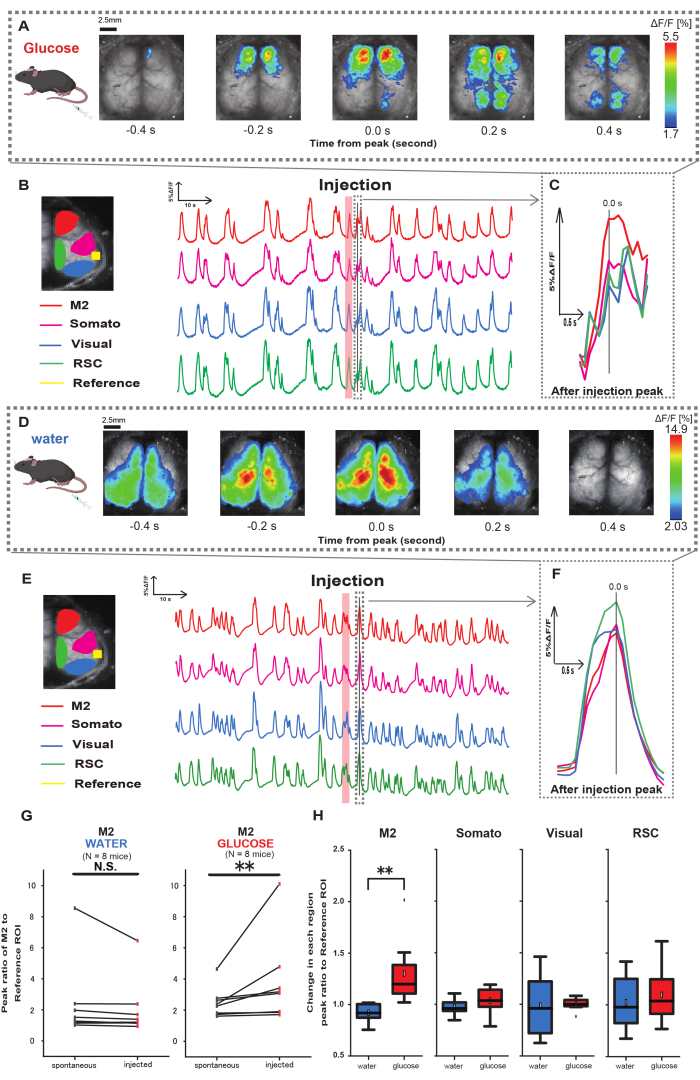
Abbildung 3: Cortex-weite Ca2+ -Reaktion während/nach Glukose- oder Wasserinjektion. (A) Ein repräsentatives Beispiel für die Verabreichung von Glukose, das in Abständen von 0,2 s angezeigt wird. Änderungen der Fluoreszenzintensität werden mit einer Pseudofarbüberlagerung dargestellt. Das Zeitfenster, das von der gestrichelten Linie in B umschlossen wird, zeigt den ersten auftretenden Ca2+ -Transienten nach der Injektion, wobei sein Peak auf die Zeit 0 eingestellt ist. Die Pseudofarbdarstellung basiert auf dem Peak des ersten Ca2+ Transienten nach der Injektion als Maximalwert und dem Mittelwert +1 SD als Minimalwert. (B) Zeitreihenänderungen der Fluoreszenzintensität für jeden ROI im Beispiel. Die Linienfarben entsprechen verschiedenen kortikalen Bereichen: Rot steht für M2, Magenta für den somatosensorischen Bereich (Somato), Blau für den visuellen Bereich (Visual) und Grün für den retro-Milzbereich. (C) Eine einzelne Spitze innerhalb der gestrichelten Kontur wird isoliert und in einer vergrößerten Ansicht angezeigt. Die Zielkalziumwelle ist die früheste Welle, die innerhalb von 4-8 s nach der Injektion auftrat. (D) Ein repräsentatives Beispiel für die Wasserinjektion als Glukosekontrolldaten. (E) Zeitreihenänderungen der Fluoreszenzintensität für jeden ROI im Beispiel. Die Linienfarben sind wie in B. (F) Eine einzelne Spitze innerhalb des gestrichelten Umrisses wird isoliert und in einer vergrößerten Ansicht angezeigt. Die Zielkalziumwelle ist die früheste Welle, die innerhalb von 4-8 s nach der Injektion auftrat. (G) Vergleich der spontanen Aktivität von M2 (vor) und des Ansprechens nach der Injektion (injiziert). Die durchschnittliche Fluoreszenzintensität ändert sich über 50 s vor der Injektion, und die Spitzenreaktion im M2-Bereich zwischen 4 s und 8 s nach der Injektion wurde unter Verwendung des auditorischen Kortex als Referenz berechnet. (H) Vergleich der Aktivierungsniveaus in jeder kortikalen Region, wenn Wasser oder Glukose verabreicht wurde. Für jede Region wurde das Verhältnis des Wertes von nach der Injektion zu vor der Injektion, bestimmt in G, berechnet. N.S. steht für nicht signifikant (p > 0,05). ** <0,01. Fehlerbalken sind als Standardfehler des Mittelwerts definiert. Abkürzungen: SD = Standardabweichung; ROI = Region von Interesse; RSC = Retro-Milzregion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Artikel wird vorgestellt, wie man einen Katheter am Darm anlegt und transkranielle Cortex-weite Ca2+ -Signale bei transgenen Mäusen beobachtet, die einen genetisch kodierten Ca2+ -Indikator exprimieren. In diesem Experiment haben wir keine Bilddaten erhalten, die eine sekundäre Wellenlänge der Lichtquelle verwenden. Dies liegt daran, dass die transgenen Mäuse, die wir in dieser Studie eingesetzt haben, aufgrund der Eigenschaften des verwendetenCa-2+ -Indikatorproteins (G-CaMP7) eine sehr hohe Änderungsrate der Fluoreszenzintensität (~mehrere Dutzend Prozent) als Reaktion auf sensorische Reize aufweisen. Daher dachten wir, dass die Kontamination durch Hämodynamik vernachlässigbar ist. Darüber hinaus erfolgten die neuronalen Reaktionen, auf die wir uns konzentrierten, schnell innerhalb weniger Sekunden, so dass wir es für unnötig hielten, die anschließend erzeugte lokale funktionelle Hyperämie zu berücksichtigen. Diese Katheterimplantationsmethode ist in der Lage, mit anderen genetisch veränderten Mäusen kombiniert zu werden, um die neuronale Aktivität in anderen Hirnregionen und auf verschiedenen Zeitskalen zu beobachten. Werden jedoch andere genetisch veränderte Mäuse verwendet, sollte das oben beschriebene Kontrollexperiment durchgeführt werden.
Dieses Verfahren zum Befestigen des Katheters am Darm eignet sich für eine Einzeldosis-Injektion zu geringen Kosten und ist einfach und weniger invasiv als das zuvor vorgeschlagene Verfahren29. Traditionell wird saugfähige Watte auf das Verdauungsorgan aufgetragen und vernäht. Das Nähen kann jedoch die postoperative Genesung bei Mäusen beeinträchtigen. Deshalb haben wir die Methode des Anbringens gewählt. Der Grund, warum wir uns für Kunststoffkügelchen entschieden haben, ist, dass sie mit dem von uns verwendeten Cyanacrylatkleber besser auf dem Silikon haften.
Traditionell wird postuliert, dass das Gehirn Glukose aufgrund der Eskalation des Plasmablutzuckerspiegels und der damit einhergehenden Hormonausschüttung wahrnimmt. Folglich benötigt das Gehirn mehrere Minuten bis Stunden, um Glukose nach ihrer Aufnahme aus dem Darm zu erkennen4. Einige Untersuchungen deuten darauf hin, dass die Darmwahrnehmung die Geschmackspräferenz von Mäusen zusätzlich zur oralen Aufnahme von süßem Geschmack steuert 1,3,17,22. Als anschauliches Beispiel haben Forscher den Nachweis erbracht, dass intragastrische (IG) glukosegepaarte aromatisierte nicht-nutritive Lösung und IG-nicht metabolisierbare α-Methyl-d-Glucopyranosid (MDG)-gepaarte aromatisierte nicht-nutritive Lösung im Vergleich zur IG-Wasser-gekoppelten Gruppe eine Präferenz für jede aromatisierte nicht-nutritive Lösung hervorrufen können. Da die intraperitoneale Glukoseinjektion die Aufnahme nicht-nutritiver Lösungen nicht stimulierte30, wurde erwartet, dass die Darmnährstofferkennung eine entscheidende Rolle bei der Nahrungsauswahl der Mäuse spielenwürde 1,19,22.
Eine kürzlich durchgeführte Studie hat das Vorhandensein einer elektrisch erregbaren Zelle im Darm aufgedeckt, die als "Neuropod-Zelle" bezeichnet wird und molekulare Rezeptoren verwendet, um sensorische Reize über eine glutamaterge Synapse zu erkennen und an einen Vagusnerv weiterzuleiten. Während sich frühere Studien hauptsächlich auf die Rolle von GLP-1 bei der Kontrolle der Nahrungsaufnahme von Mäusen konzentrierten, haben neuere Untersuchungen gezeigt, dass die Aktivierung des Vagusnervs durch Neuropodenzellen den Appetit der Maus moduliert. Der Vagusnerv aktiviert anschließend den Nucleus tractus Solitarius, was zu einer anschließenden Aktivierung dopaminerger Neuronen führt19. Es ist jedoch nicht bekannt, ob die Aktivierung dopaminerger Neuronen auch den Kortex aktiviert. Um zerebrale Reaktionen nach intragastrischer Glukoseinfusion zu kategorisieren, haben wir die Katheteranlegetechnik für bildgebende Zwecke verfeinert. Bei der Anwendung dieser Technologie ist Vorsicht geboten, um Organschäden zu vermeiden, insbesondere im Hinblick auf die Leber, die bei der Manipulation, die zur Bestimmung der Lage des Magens erforderlich ist, anfällig für Verletzungen ist.
Unsere Ergebnisse deuten darauf hin, dass die intragastrische Glukoseinjektion den präfrontalen Kortex innerhalb von Sekunden aktiviert. Die intragastrische Glukoseverabreichung initiiert jedoch mehrere Signalwege gleichzeitig, wie z. B. hormonelle Wege, den Vagusnerv und den Spinalnerv afferent. Diese Signale werden im Hirnstamm auf unterschiedlichen Zeitskalen verarbeitet. Daher sollten zukünftige Studien untersuchen, wie diese komplizierten Signale im Gehirn verarbeitet und integriert werden.
Darüber hinaus exprimiert die transgene Mauslinie BAC GLT-1-G-CaMP7, die wir in der vorliegenden Studie verwendet haben, den Ca2+ -Sensor, G-CaMP7, sowohl in Neuronen als auch in Astrozyten. Prinzipiell wird die präfrontale Ca2+ -Hebung, die durch die transkranielle Kortex-weite Ca2+ -Bildgebung erhalten wird, von Neuronen und/oder Astrozyten abgeleitet. Da Astrozyten jedoch Dopaminrezeptoren exprimieren, wenn die Dopamin-Signalübertragung beteiligt ist, deutet dies auf eine mögliche Aktivierung der astrozytären IP3/Ca2+ -Signalgebung hin. Da der astrozytäre IP3/Ca2+ -Signalweg die synaptische Plastizität reguliert, könnte er auch eine wichtige Rolle bei Veränderungen der Saccharosepräferenz und Veränderungen des Fressverhaltens nach Glukoseaufnahme spielen. Folglich wäre eine Bildgebung mit zellulärer Auflösung mittels Zwei-Photonen-Mikroskopie erforderlich, um festzustellen, ob die Reaktion, die in zukünftigen Studien im präfrontalen Kortex nach Glukoseverabreichung beobachtet wurde, von Neuronen oder Astrozyten stammt. Eine weitere effektive Methode besteht darin, die zellspezifische Expression des Ca2+ -Indikators bei Mäusen mit Hilfe des Adeno-assoziierten Virus (AAV) mittels Faserphotometrie zu beobachten. Darüber hinaus ist es notwendig, mit elektrophysiologischen Techniken zu überprüfen, ob der Glukosereiz des Darms den Vagusnerv tatsächlich stimuliert hat. Wenn Neuropodenzellen Signale an den Vagusnerv weiterleiten, indem sie Glukose erhalten, erwarten wir keine Reaktion des Vagusnervs, wenn ein SGLT-1-Hemmer verabreicht wird. Schließlich wäre eine Validierung mit verschiedenen Dopaminrezeptor-Antagonisten notwendig, um zu bestätigen, ob die Vagusnerv-Projektionen zum Nucleus Tractus Solitarii (NTS) dopaminerge Neuronen aktivieren und die präfrontalen Kortex-Ca2+ -Signale erhöhen. Insgesamt ermöglicht dieses System eine umfassende Untersuchung der schnellen neuronalen Übertragungseffekte vom Darm zum Gehirn. Es stellt eine vielversprechende Methodik dar, die möglicherweise Mechanismen aufklären könnte, wie z.B. wie Stress die Saccharosepräferenz in Bezug auf Darm-Hirn-Interaktionen verändert.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde unterstützt von der Ochanomizu University, KAKENHI Grants (18K14859, 20K15895), dem JST FOREST Program, der Fördernummer JPMJFR204G, der Research Foundation for Opto-Science and Technology, dem Kao Research Council for the Study of Healthcare Science, der Japan Association for Chemical Innovation und der TERUMO Life Science Foundation. Der Autor dankt Dr. Takashi Tsuboi, Kazuki Harada und Akiyo Natsubori für ihre Betreuung der Experimente. Der Autor dankt auch den Mitgliedern des Labors für ihre Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 2.5 mL TERUMO syringe | TERUMO | ss-02Sz | |
| 23 G injection needle | TERUMO | 4987350390691 | |
| Anesthetic (ISOFLURANE Inhalation Solution) | viatris | 871119 | |
| cotton swab | local company | ||
| Cyanoacrylate glue (AronArufa A) | TOAGOSEI | 7990700Q1022 | |
| dental acrylic cement C&B | Sun Medical | 221AABZX00115000 | |
| Depilatory cream | Kracie | local company | |
| Digital CMOS camera | Hamamatsu Photonics | ORCA-Spark | |
| Ear bar | NARISHIGE | EB-5N | |
| Filter set (U-MWB2) | Evident | U-MWB2 | |
| Fine Scissors | Fine Dcience Tools | 14040-10 | |
| G7NG817 mice | RIKEN BRC | RBRC09650 | |
| Image software | Hamamatsu Photonics | HC Image software | |
| Isoflurane vapolizer | shinanoseisakusyo | SN-487-0T | |
| Light source (U-HGLGPS) | Evident | U-HGLGPS | |
| microscopy (MVX10) | Evident | ||
| Plastic beads (inner diameter 3 mm, outer diameter 5 mm) | local company | ||
| Pliers | local company | ||
| Polydioxanone suture, monodiox | Alfresa Pharma | HR1305MV45-KF2R | This absorbable, monofilament PDS suture is employed for closing the surgical incision |
| Round ended forceps | F.S.T. | 11617-12 | |
| saline | Otsuka Pharmaceutical Factory | 35061311 | |
| Silicon tube (inner diameter 0.5 mm, outer diameter 1.0 mm) | AS ONE CORPORATIO | 33151413 | local company |
| small surgery needle | Natsume Seisakusho Co., Ltd. | AC03DNT | |
| Stereotaxic stage | NARISHIGE | MA-6N | |
| Xylocaine Jelly 2% | Sandoz K.K. | 614429303 | This jelly is used as a local analgesic to alleviate surgical pain |
Referenzen
- Buchanan, K. L., et al. The preference for sugar over sweetener depends on a gut sensor cell. Nature Neuroscience. 25 (2), 191-200 (2022).
- Reimann, F. Molecular mechanisms underlying nutrient detection by incretin-secreting cells. International Dairy Journal. 20 (4), 236-242 (2010).
- Kreuch, D., et al. Gut mechanisms linking intestinal sweet sensing to glycemic control. Frontiers in Endocrinology. 9, 741 (2018).
- Gorboulev, V., et al. Na(+)-D-glucose cotransporter SGLT1 is pivotal for intestinal glucose absorption and glucose-dependent incretin secretion. Diabetes. 61 (1), 187-196 (2012).
- Harada, N., Inagaki, N. Role of sodium-glucose transporters in glucose uptake of the intestine and kidney. Journal of Diabetes Investigation. 3 (4), 352-353 (2012).
- Kaelberer, M. M., Rupprecht, L. E., Liu, W. W., Weng, P., Bohórquez, D. V. Neuropod cells: The emerging biology of gut-brain sensory transduction. Annual Review of Neuroscience. 43, 337-353 (2020).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Larsen, P. J., Tang-Christensen, M., Jessop, D. S. Central administration of glucagon-like peptide-1 activates hypothalamic neuroendocrine neurons in the rat. Endocrinology. 138 (10), 4445-4455 (1997).
- Alhadeff, A. L., Rupprecht, L. E., Hayes, M. R. GLP-1 neurons in the nucleus of the solitary tract project directly to the ventral tegmental area and nucleus accumbens to control for food intake. Endocrinology. 153 (2), 647-658 (2012).
- Raybould, H. E. Gut chemosensing: interactions between gut endocrine cells and visceral afferents. Autonomic Neuroscience: Basic & Clinical. 153 (1-2), 41-46 (2010).
- Routh, V. H. Glucose-sensing neurons: are they physiologically relevant. Physiology & Behavior. 76 (3), 403-413 (2002).
- Secher, A., et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. The Journal of Clinical Investigation. 124 (10), 4473-4488 (2014).
- Williams, E. K., et al. Sensory neurons that detect stretch and nutrients in the digestive system. Cell. 166 (1), 209-221 (2016).
- Borgmann, D., et al. Gut-brain communication by distinct sensory neurons differently controls feeding and glucose metabolism. Cell Metabolism. 33 (7), 1466-1482.e7 (2021).
- Krashes, M. J., et al. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. The Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- Aponte, Y., Atasoy, D., Sternson, S. M. AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training. Nature Neuroscience. 14 (3), 351-355 (2011).
- Zhang, L., Han, W., Lin, C., Li, F., de Araujo, I. E. Sugar metabolism regulates flavor preferences and portal glucose sensing. Frontiers in Integrative Neuroscience. 12, 57 (2018).
- Goldstein, ., et al. Hypothalamic detection of macronutrients via multiple gut-brain pathways. Cell Metabolism. 33 (3), 676-687.e5 (2021).
- Fernandes, A. B., et al. Postingestive modulation of food seeking depends on vagus-mediated dopamine neuron activity. Neuron. 106 (5), 778-788.e6 (2020).
- Kaelberer, M. M., et al. . A gut-brain neural circuit for nutrient sensory transduction. 361 (6408), eaat5236 (2018).
- Bohórquez, D. V., et al. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. The Journal of Clinical Investigation. 125 (2), 782-786 (2015).
- Tan, H. -. E., et al. The gut-brain axis mediates sugar preference. Nature. 580 (7804), 511-516 (2020).
- Wang, D., et al. Whole-brain mapping of the direct inputs and axonal projections of POMC and AgRP neurons. Frontiers in Neuroanatomy. 9, 40 (2015).
- Yamada, S., Wang, Y., Monai, H. Transcranial cortex-wide Ca2+ imaging for the functional mapping of cortical dynamics. Frontiers in Neuroscience. 17, 1119793 (2023).
- Monai, H., et al. Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain. Nature Communications. 7 (1), 11100 (2016).
- Ferron, J. -. F., Kroeger, D., Chever, O., Amzica, F. Cortical Inhibition during Burst Suppression Induced with Isoflurane Anesthesia. The Journal of Neuroscience. 29 (31), 9850-9860 (2009).
- Ming, Q., et al. Isoflurane-induced burst suppression is a thalamus-modulated, focal-Onset rhythm with persistent local asynchrony and variable propagation patterns in rats. Frontiers in Systems Neuroscience. 14, 599781 (2021).
- Schwalm, M., et al. Functional states shape the spatiotemporal representation of local and cortex-wide neural activity in mouse sensory cortex. Journal of Neurophysiology. 128 (4), 763-777 (2022).
- Ueno, A., et al. Mouse intragastric infusion (iG) model. Nature Protocols. 7 (4), 771-781 (2012).
- Zukerman, S., Ackroff, K., Sclafani, A. Post-oral glucose stimulation of intake and conditioned flavor preference in C57BL/6J mice: A concentration-response study. Physiology & Behavior. 109, 33-41 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten