Method Article
Recolección de campo y mantenimiento de laboratorio de algas gigantes formadoras de dosel para facilitar la restauración
En este artículo
Resumen
Este protocolo describe la recolección de campo y el mantenimiento regular en laboratorio de sustratos sembrados con algas gigantes formadoras de dosel para su uso en ensayos de restauración para abordar el éxito y las limitaciones de la técnica de "grava verde" en entornos de campo.
Resumen
Las algas marinas que forman el dosel son especies esenciales que apoyan la biodiversidad y proporcionan servicios ecosistémicos valorados en más de 500 mil millones de dólares anuales. El declive global de los bosques de algas gigantes debido a los factores de estrés ecológico impulsados por el clima subraya la necesidad de estrategias de restauración innovadoras. Una técnica de restauración emergente conocida como "grava verde" tiene como objetivo sembrar algas jóvenes en grandes áreas sin una gran cantidad de mano de obra subacuática y representa una herramienta de restauración prometedora debido a la rentabilidad y la escalabilidad. Este artículo en video ilustra un protocolo y herramientas para el cultivo de algas gigantes, Macrocystis pyrifera. También proporciona un recurso para estudios posteriores que aborden los éxitos y las limitaciones de este método en entornos de campo. Describimos métodos de campo y de laboratorio para recolectar tejido reproductivo, esporular, inocular, criar, mantener y monitorear sustratos sembrados con etapas tempranas de vida utilizando la técnica de 'grava verde'. El protocolo simplifica y centraliza las prácticas actuales de restauración en este campo para apoyar a los investigadores, administradores y partes interesadas en el cumplimiento de los objetivos de conservación de las algas marinas.
Introducción
Las algas marinas formadoras de dosel (macroalgas pardas del orden Laminariales) son especies fundamentales de importancia mundial, que dominan los arrecifes rocosos costeros en los mares templados y árticos1. Estas algas marinas forman hábitats biogénicos estructuralmente complejos y altamente productivos conocidos como bosques de algas marinas que sustentan comunidades marinas taxonómicamente diversas2. Los bosques de algas marinas en todo el mundo proporcionan muchos servicios ecosistémicos a los seres humanos, incluida la producción pesquera comercial, el ciclo del carbono y los nutrientes, y las oportunidades recreativas, con un valor total estimado de USD $ 500 mil millones por año3.
A pesar de su valor sustancial, los bosques de algas marinas se enfrentan a crecientes presiones antropogénicas en muchas regiones3. El cambio climático representa una de las amenazas más importantes para las algas marinas debido al calentamiento oceánico a largo plazo combinado con la creciente frecuencia de anomalías de temperatura 3,4,5,6,7. El aumento de la temperatura de los océanos se asocia con la limitación de nutrientes8, mientras que la exposición al estrés por calor por encima de los umbrales fisiológicos puede provocar mortalidad9. En combinación con factores estresantes locales regionales variables7, las poblaciones de algas marinas están disminuyendo a nivel mundial en aproximadamente un 2% por año10 con pérdidas significativas y cambios persistentes a estados comunitarios alternativos en ciertas regiones 6,11,12,13,14. La recuperación natural de las poblaciones de algas marinas por sí sola puede no ser suficiente para revertir el alcance de las pérdidas actuales y proyectadas 15,16,17,18, lo que subraya la importancia de la restauración activa.
Los esfuerzos actuales de restauración de algas marinas pueden utilizar una combinación de metodologías para restablecer estas importantes especies fundamentales en los arrecifes rocosos costeros 3,19. Las metodologías elegidas para abordar las preocupaciones específicas del sitio dependen del contexto geográfico, los impedimentos específicos para la recuperación de las algas marinas y el contexto socioecológico11. La clave es comprender las conexiones y la interdependencia de los sistemas socioecológicos, y las intervenciones que involucran a las instituciones locales y obtienen el apoyo de las comunidades locales aumentan la probabilidad de éxito de los esfuerzos de restauración20.
Además del cambio climático, la presión de los herbívoros o la competencia interespecífica impulsa, disminuye o suprime la recuperación (por ejemplo, por erizos de mar13, peces herbívoros21,22, algas de césped 9,23 o algas invasoras24). La restauración puede centrarse en la eliminación de estos factores de estrés biótico25, aunque estos métodos requieren recursos sustanciales y un mantenimiento continuo11. Para catalizar la recuperación de las especies de algas marinas, se han realizado esfuerzos hacia un enfoque de siembra directa, por ejemplo, pesando bolsas de malla llenas de hojas de algas marinas fértiles para el bentos que libera zoosporas en el medio ambiente26. Este método, sin embargo, requiere mucho tiempo y requiere una instalación y desmontaje técnico bajo el agua. Otros casos se centran en el trasplante de grandes cantidades de plantas donantes adultas enteras, lo que puede comprometer poblaciones donantes estrechamente asociadas y vulnerables y a menudo se limitan a pequeñas escalas debido a la dependencia del trasplante continuo27.
Para las regiones en las que la limitación de las esporas de algas puede estar impidiendo la recuperación de los bosques de algas debido a la fragmentación del hábitat, se introdujo un enfoque relativamente nuevo de restauración de algas marinas llamado técnica de "grava verde". La técnica se probó con éxito en la Estación Científica de Flødevigen, en el sur de Noruega28 y representó una opción prometedora para la restauración debido a su rentabilidad y escalabilidad. El flujo de trabajo de esta técnica es el siguiente: (1) se crea una solución de esporas a partir de tejido fértil recolectado de algas marinas adultas reproductivas en el campo y luego se siembra en sustratos pequeños, como grava; (2) las algas marinas en etapa temprana se crían en condiciones abióticas controladas en laboratorio sobre sustratos; (3) Los sustratos con esporofitos visibles se despliegan sobre el terreno en arrecifes específicos como «grava verde», donde los esporofitos siguen creciendo. Hay que tener en cuenta que los esfuerzos típicos de trasplante de individuos adultos requieren una instalación subacuática laboriosa e inhibidora de costes por parte de los buzos, y la técnica de la "grava verde" utiliza un despliegue sencillo desde la superficie28.
La técnica de la "grava verde" está siendo probada actualmente por miembros de numerosos grupos de trabajo internacionales29 en diferentes entornos y varias especies de algas laminarias. Este protocolo describe las instalaciones, los materiales y los métodos necesarios para la recolección de tejidos, la esporulación, la siembra, las condiciones de cría, el mantenimiento regular y el monitoreo de las algas marinas en etapa temprana antes de implementar esta técnica de restauración en el campo utilizando el alga gigante, Macrocystis pyrifera. Este protocolo es un recurso valioso para investigadores, gestores y partes interesadas que buscan proporcionar información sobre los éxitos y las limitaciones de este método con M. pyrifera en diferentes entornos de campo.
Protocolo
Los tejidos de algas marinas utilizados como se describe en este protocolo fueron recolectados y supervisados por el Departamento de Pesca y Vida Silvestre de California bajo el permiso S-202020004-20205-001.
1. Preparación de instalaciones y materiales
- Asegúrese de que las instalaciones de cultivo de algas marinas puedan mantener la temperatura (10-15 °C), proporcionar luz de espectro completo (0-180 μmol fotones m-2 s-1) y filtrar la aireación (tamaño de poro de 0,2 μm). Utilice sistemas de incubadora con un tomacorriente incorporado o un puerto de acceso para cables y tubos, luces y una fuente de aire (Figura 1). Si un sistema de incubadora no está dentro del alcance, el presupuesto o la escala prevista del proyecto, use baños de agua templados con agua de mar natural fría o un enfriador (Figura 2). Consulte la Tabla de materiales para obtener detalles específicos.
- Coloque un termómetro en el medio de cultivo o use una pistola de temperatura para asegurarse de que la temperatura esté entre 10 y 18 ° C.
NOTA: Las temperaturas de cría son específicas del sitio y de la estación30. - Programe luces de espectro completo a un fotoperiodo de 12 h de luz: 12 h de oscuridad cambiando la configuración de tiempo en la fuente de luz o utilizando un temporizador mecánico. Mida la intensidad de la luz con un medidor cuántico de radiación fotosintéticamente activa (PAR) impermeable debajo de la superficie cerca de la grava y ajústela utilizando una fuente de luz regulable o colocando capas de celofán (en el caso del cultivo de gametofito vegetativo, consulte la Sección 9) o malla sobre la fuente de luz (para obtener más información sobre los ajustes de la intensidad de la luz, consulte la Sección 6.3).
- Asegure una aireación adecuada mediante el uso de bombas de aire31 un día después de la esporulación. Utilice filtros (tamaño de poro de 0,2 μm) para reducir la contaminación bacteriana en el aire.
NOTA: Para el cultivo de 'grava verde' , la presión de aireación debe ser suficiente para hacer circular el agua en todos los recipientes de cultivo sin perturbar la adhesión de las algas marinas en etapa temprana a los sustratos sembrados. Si hay biomasa de gametofitos (ver sección 9.2), la presión de aireación debe ser suficiente para mantener los gametofitos suspendidos en el medio de cultivo.
- Coloque un termómetro en el medio de cultivo o use una pistola de temperatura para asegurarse de que la temperatura esté entre 10 y 18 ° C.
- Esterilizar materiales y estaciones. Prepárelos con anticipación (consulte la Tabla de materiales).
- Limpie las superficies con alcohol isopropílico al 70%. Si es posible, manipule el tejido reproductivo de los sori y limpie el equipo de recolección fuera del vivero de "grava verde".
- Utilice los siguientes métodos de esterilización: enjuague con un detergente de grado de laboratorio seguido de un enjuague completo con agua destilada, sumérjalo en una solución de lejía diluida (de acuerdo con las instrucciones del fabricante) seguido de un enjuague completo con agua destilada y autoclave con la configuración adecuada (cristalería o instrumentos). Después de la esterilización, los materiales pueden almacenarse en un recipiente sellado o envolverse con papel de aluminio.
- Frote y limpie los recipientes con las tapas que se utilizarán para el cultivo con un detergente de laboratorio, seguido de un enjuague completo con agua destilada.
NOTA: Los recipientes de cultivo con tapa ayudarán a reducir la evaporación de los medios de cultivo. Deje las tapas ligeramente abiertas para permitir el intercambio de aire, o use una válvula de retención para reducir la contaminación en el aire. Si no se dispone de recipientes con tapa, selle los recipientes de cultivo con un termoplástico como una película de parafina y haga 2-3 perforaciones. Si se utilizan tanques más grandes, use cubiertas antievaporación hechas de plástico transparente. - Asegúrese de que la grava tenga una superficie texturizada o ligeramente picada, ya que es más probable que los gametofitos se retengan en sustratos con una alta rugosidad32,33. Frote y enjuague la grava hasta que el agua salga clara para eliminar el polvo o los escombros. Remoje la grava en una solución de lejía diluida al 10% durante al menos 24 h y enjuague con agua de mar esterilizada con filtro (ver Sección 2.1). Alternativamente, después de fregar y enjuagar, remoje la grava durante 1 semana en agua desionizada (DI)32.
NOTA: Idealmente, se utiliza sustrato cosechado localmente para reducir la contaminación del sitio de restauración. Alternativamente, se recomienda grava apta para acuarios. Evite los sustratos calcáreos como la piedra caliza, que pueden provocar el blanqueamiento de los tejidos y la consiguiente mortalidad de las algas trasplantadas32.
2. Preparación de los medios de cultivo
- Filtre y esterilice el agua de mar de acuerdo con los siguientes métodos, dependiendo de la disponibilidad de recursos. Calcule el volumen de agua de mar esterilizada por filtro necesario para refrescar los recipientes de cultivo cada semana (consulte la Sección 7) y programe esta tarea de filtración/esterilización en consecuencia. Almacene grandes lotes de agua de mar esterilizada con filtro en recipientes oscuros durante un máximo de 6 meses a 8-10 °C. Si no dispone de refrigeración, guárdelo en un lugar oscuro y fresco.
- Filtre el agua mediante un sistema de filtración al vacío con un tamaño de poro de 0,55-1 μm. Apague la fuente de vacío antes de que se extraiga toda el agua para evitar dañar el filtro y vierta el agua filtrada en un recipiente estéril dedicado. Para volúmenes más grandes, utilice un sistema de filtración de flujo continuo. Por ejemplo, haga correr el agua de mar a través de una serie de tres filtros plisados (10 μm, 5 μm y 1 μm) dispuestos de mayor a menor tamaño de poro.
NOTA: Si no se puede acceder al agua de mar natural, se puede preparar agua de mar artificial. Alternativamente, el agua de mar natural se puede comprar en las tiendas de acuarios, a granel y, a menudo, se filtra, desinfecta y tiene un pH equilibrado. El enriquecimiento de los medios sigue siendo necesario para estas opciones. - Esterilice el agua de mar filtrada utilizando métodos UV y/o autoclave. Conecte los sistemas de flujo continuo a una luz ultravioleta del acuario a un caudal recomendado por el fabricante. Agua de mar esterilizada en autoclave en cristalería apta para autoclave con tapas ligeramente abiertas o cubiertas con papel de aluminio y en un ciclo de líquidos (121 °C; 1-2 PSI, 15-30 min dependiendo del volumen de líquido34.
NOTA: Se recomienda esterilizar agua de mar filtrada en autoclave para las primeras etapas del cultivo.
- Filtre el agua mediante un sistema de filtración al vacío con un tamaño de poro de 0,55-1 μm. Apague la fuente de vacío antes de que se extraiga toda el agua para evitar dañar el filtro y vierta el agua filtrada en un recipiente estéril dedicado. Para volúmenes más grandes, utilice un sistema de filtración de flujo continuo. Por ejemplo, haga correr el agua de mar a través de una serie de tres filtros plisados (10 μm, 5 μm y 1 μm) dispuestos de mayor a menor tamaño de poro.
- El enriquecimiento del agua de mar esterilizada por filtro con nutrientes y vitaminas es fundamental para el crecimiento de M. pyrifera . El medio de agua de mar enriquecida (PES) con Provasoli es un medio ampliamente utilizado diseñado para cultivos de algas35. Compre estos medios en centros de cultivo de algas. Las preparaciones de PES y vitaminas adicionales para el crecimiento de M. pyrifera se describen en34.
- Enriquecer cada 1 L de agua de mar filtrada con 20 mL de PES. Alternativamente, utilice medios de cultivo de nivel industrial.
- Almacene las soluciones de enriquecimiento de acuerdo con las recomendaciones del fabricante. Enriquezca el agua de mar esterilizada con filtro cuando se necesiten medios de crecimiento para evitar la degradación de las soluciones de enriquecimiento.
3. Recopilación de campo
- Determinar el momento de las colectas de esporófilos para imitar el ciclo reproductivo natural de las poblaciones locales de M. pyrifera. Consulte a expertos locales (p. ej., investigadores de algas marinas, administradores, ecologistas, científicos ciudadanos, grupos de buceo) para garantizar el momento adecuado para la recolección de esporófilas.
- Obtenga los permisos necesarios para la recolección de tejido de algas marinas que cumplan con las leyes y regulaciones locales. Esto puede ser una parte del proceso de cultivo que requiere mucho tiempo y debe incorporarse a los plazos del proyecto.
- Mediante un aparato autónomo de respiración subacuática (SCUBA) para seleccionar de 3 a 5 hojas esporófilas de 10 a 15 individuos fértiles de M. pyrifera con sori visible, espaciados al menos a 2 m de distancia. Seleccione esporófilos limpios e intactos, si es posible, con poca o ninguna suciedad o degradación. A partir de este momento, almacene las hojas de esporófilo por separado según el individuo de origen.
NOTA: Los esporófilos crecen en una densa "falda" en la base, por encima de la sujeción de las algasadultas, y se pueden identificar por su falta de neumatocistos llenos de gas. El tejido maduro del sorus suele estar ligeramente elevado y de color más oscuro que el tejido circundante1. - Transportar las hojas de esporófila en bolsas de recolección oscuras para evitar la sobreexposición a la luz solar, con un mínimo de agua de mar del sitio para mantener las hojas húmedas, y almacenarlas en refrigeradores a aproximadamente 12 °C hasta su llegada al espacio de cultivo. Asegúrese de que las muestras no estén en contacto directo con el hielo.
NOTA: Los esporófilos se pueden enviar hacia o desde otros lugares.- Enjuague los esporófilos con agua de mar. Envuelva las hojas, recogidas de un solo individuo de M. pyrifera , en toallas de papel húmedas empapadas en agua de mar y nuevamente en papel de aluminio para evitar la penetración de la luz y la desecación adicional36. Este método de almacenamiento se conoce comúnmente como el "método burrito".
- Coloca estos envases en una hielera con hielo, con una barrera protectora como plástico de burbujas reciclado o cartón. Prepare la hielera para el envío al día siguiente. Asegúrese de que haya alguien disponible para recibir el envío y colocar los paquetes en condiciones refrigeradas.
4. Esporulación
- Si es posible, procese los esporófilos en un ambiente con temperatura controlada entre 10-15 °C y lejos de cualquier otro cultivo. Prepare y esterilice los instrumentos y las estaciones con anticipación. Use guantes protectores cuando manipule tejido de algas marinas para reducir la contaminación.
- Opcionalmente, almacene los esporófilos durante 12-48 h en condiciones refrigeradas, lo que favorecerá la liberación de esporas del tejido sorus37. Para almacenar, utilice el "método del burrito" descrito en la Sección 3.3.
- Seleccione el tejido de sorus maduro y córtelo en25 cm 2 secciones con unas tijeras estériles. Seleccione 1-2 secciones de sori limpias de 10-15 padres individuales de algas marinas, para promover la diversidad genética.
NOTA: Si se almacena, opcionalmente encuentre evidencia de esporulación parcial en las toallas de papel, lo que indica la presencia de tejido soro fértil. El tejido del soro suele estar ligeramente elevado y es de color más oscuro que el tejido circundante. - Para limpiar, frote suavemente ambos lados del tejido del sorus en una sola dirección con una gasa estéril humedecida con agua de mar esterilizada con filtro. Si es necesario, raspe suavemente el tejido del soro con una cuchilla de afeitar estéril para eliminar completamente la suciedad. Sumerja la sección sori en un baño de agua dulce durante 30 s a 1 min y enjuague con agua de mar esterilizada con filtro.
NOTA: Refresque el baño de agua dulce y esterilice los materiales en uso cuando manipule diferentes secciones de sori de diferentes individuos para reducir la contaminación cruzada. - Sumerja cada sección de sori en agua de mar esterilizada con filtro templada a 10-15 °C dentro de un tubo de centrífuga estéril de 50 ml. Coloque los tubos a 4-12 °C en la oscuridad para esporular durante un máximo de 4 h. Si no hay un refrigerador disponible, guárdelo en un lugar fresco y con poca luz.
NOTA: Alternativamente, las secciones de sori se pueden esporular en un solo recipiente estéril. - Con un microscopio compuesto y un hemocitómetro, observe la densidad de esporas de 3-4 muestras cada 30 minutos hasta 4 h. Cambie las puntas de pipeta entre muestras. Si las densidades son de al menos 10.000 esporas mL-1 (ver Sección 5.1.1), continúe con el siguiente paso. Si una sección de sori no produce esporas después de 4 h, deseche la muestra. Las esporas pueden depositarse en cuestión de horas después de la liberación, pero se pueden observar nadando en un movimiento circular.
- Retire cada sección de sori de los tubos con pinzas estériles. Combine las soluciones de esporas resultantes en un solo recipiente esterilizado y cuantifique la densidad combinada final.
5. Inoculación
- Calcular el volumen final de solución de esporas necesario para la inoculación. Asegúrese de que la concentración final sea de aproximadamente 500-1,000 esporas mL−1 en recipientes de cultivo.
- Para calcular la concentración de la muestra de esporas combinada a partir de los recuentos de la cuadrícula central del hemocitómetro, divida el recuento por 10-4 ml (que representa el volumen de solución visto en el hemocitómetro).
- Para determinar el volumen de la solución de esporas que se agregará a cada recipiente, determine la cantidad de medios de crecimiento necesarios para sumergir los sustratos dentro de los recipientes de cultivo.
- Para encontrar el número total de esporas en cada recipiente, multiplique este volumen de agua de mar por la concentración deseada.
- Para determinar el volumen total de solución de esporas que se agregará, divida la cantidad total de esporas por la concentración de esporas por ml en la solución de esporas.
- Coloque portaobjetos de vidrio estériles dentro de recipientes de cultivo para monitorear el desarrollo de algas marinas. Incluya al menos 30 portaobjetos distribuidos aleatoriamente en contenedores de cultivo para un seguimiento suficiente (consulte los detalles en la Sección 7).
- Inocular el volumen calculado de solución de esporas en el recipiente de cultivo utilizando una punta de pipeta estéril que contenga sustratos sumergidos en medios de crecimiento. Cierre el recipiente y revuelva suavemente para distribuir las esporas. Selle y coloque el recipiente en el sistema de cultivo.
6. Condiciones de cría
- Ajuste la temperatura entre 10 y 15 °C en función de la temperatura en el lugar de despliegue.
- Después de 1 día, proporcione aireación ligera con una fuente de aire filtrada.
- Ajuste las luces LED de espectro completo para plantas acuáticas a una luz de 12 h: ciclo de oscuridad de 12 h, con intensidades de luz que oscilan entre 0-180 μmol fotón m-2 s-1:
- Ajuste la intensidad de la luz a 5-10 μmol fotón m-2 s-1 de 0-1 día y aumente a 20-30 μmol fotón m-2 s-1 hasta el final de 1 semana.
- A partir de este momento, aumente la irradiancia en 10-20 μmol fotón m-2 s-1 cada 3-4 días hasta alcanzar una irradiancia de 180 μmol fotón m-2 s-1 al final de 6 semanas.
- Continúe criando cultivos a 180 μmol fotón m-2 s-1 hasta el final de 8 semanas, o cuando los esporofitos hayan alcanzado aproximadamente 1-2 cm de longitud.
7. Monitoreo
- Monitoree al menos dos portaobjetos de vidrio al azar diariamente o cada dos días durante las primeras dos semanas para evaluar el desarrollo.
- Para monitorear, manipule el portaobjetos con pinzas esterilizadas y colóquelo en una placa de Petri limpia que contenga suficiente agua de mar esterilizada para sumergir el portaobjetos de vidrio. No devuelva los portaobjetos de vidrio a los cultivos después de retirarlos para evitar la contaminación cruzada.
- Utilice un microscopio compuesto o invertido con un aumento de 40-400x para observar las algas marinas en etapa temprana. Realice un seguimiento del desarrollo con la siguiente línea de tiempo (consulte la Figura 3 para ver ejemplos de las etapas de la historia de vida del desarrollo).
NOTA: Las esporas sedimentadas se observan a los 0-1 d. Las esporas pueden germinar en unas pocas horas, como lo demuestra la formación de un tubo germinativo. La germinación se observa típicamente a los 1-2 días. Los gametofitos tempranos se observan típicamente a los 1-4 días. La gametogénesis, el proceso por el cual las células se dividen y diferencian para formar gametos masculinos y femeninos, generalmente se observa dentro de las primeras dos semanas. Las células femeninas son de 5 a 7 veces más grandes que las masculinas. Los gametofitos masculinos desarrollan ramas delgadas y filamentosas, mientras que las hembras tienen forma más redonda u ovoide. Las hembras suelen producir huevos u óvulos en un plazo de 2 a 3 semanas. Los espermatozoides liberados por los machos nadan hacia las hembras y fertilizan los óvulos, lo que resulta en la formación de cigotos diploides. Tener la densidad de inoculación adecuada asegurará una reproducción exitosa por proximidad38,39. Los óvulos fertilizados se convierten en esporofitos embrionarios. Los esporofitos se observan típicamente dentro de las 2-4 semanas. El cigoto experimenta una rápida división celular, lo que resulta en el crecimiento de láminas de 1-2 cm en aproximadamente 6-8 semanas.
- Después de dos semanas, controle al menos dos portaobjetos de vidrio al azar 1-2 veces por semana para ver si crecen sanos y están contaminados hasta que los esporofitos alcancen un tamaño de 1-2 cm.
NOTA: El crecimiento saludable se caracteriza por una coloración marrón dorado (en lugar de verde o transparente). Hay varias métricas cuantitativas que se pueden observar en portaobjetos de vidrio con un microscopio invertido, incluyendo la supervivencia, la tasa de germinación, el desarrollo vegetativo, la madurez reproductiva y la fecundidad, y la proporción de sexos40. - Evalúe la contaminación por bacterias, hongos, ciliados y diatomeas con un microscopio. Eliminar la contaminación aislada. Controlar los primeros signos de contaminación por diatomeas con dióxido de germanio (GeO2) (ver sección 8.3).
8. Mantenimiento
- Ajuste las condiciones de luz de acuerdo con la Sección 6.3.
- Cada semana, cambie los medios de cultivo para reponer los nutrientes y minerales necesarios para el crecimiento de M. pyrifera .
- Enfríe el medio de cultivo fresco a la temperatura adecuada. Asegúrese de que la temperatura no supere los 15 °C durante este proceso.
- Sifón los medios de los recipientes de cultivo para evitar perturbar los sustratos sembrados. Deje que el medio se escurra hasta que el recipiente esté casi vacío. Actualice el medio inmediatamente para minimizar la desecación. Al rellenar los recipientes de crecimiento, inclínelos ligeramente para que el medio corra por el costado del recipiente de cultivo para perturbar mínimamente los sustratos.
- Reorganice aleatoriamente las posiciones de los recipientes o bañeras durante los cambios semanales de medios para tener en cuenta las diferencias en la irradiación de la luz.
NOTA: Consulte el Archivo Suplementario 1 para obtener un calendario para realizar un seguimiento de las actividades y expectativas de los cultivos de Macrocystis. Indica el momento de los ajustes de la luz y la aireación, así como los cambios semanales de medios.
- Opcionalmente, controle la contaminación por diatomeas con un tratamiento de dióxido de germanio (GeO2). Añadir 0,3-0,5 mL de 250 mg/mL deGeO2 a cada 1 L de agua de mar añadida a los sustratos sembrados para reducir la contaminación generalizada por diatomeas.
NOTA: GeO2 puede inhibir la producción de gametos de algas. Aplicar un tratamiento deGeO2 en el corto período de tiempo después de la germinación y antes de los picos de producción de óvulos y espermatozoides (1-7 días) y/o después de la fertilización del óvulo y las observaciones de esporofitos (>21 días), seguido de un cambio de medio 48 h después para eliminar el producto químico. Estos plazos pueden variar según las condiciones del cultivo, por lo que el seguimiento del desarrollo de la etapa de la vida con microscopía es la mejor manera de evaluar el momento de la aplicación de GeO2 . Si la contaminación por diatomeas persiste en los recipientes de cultivo y se observa un crecimiento excesivo en las algas marinas en etapa temprana, considere volver a sembrar los sustratos.
9. Cultivo vegetativo de gametofitos de algas gigantes
- Propagar cultivos de gametofitos en condiciones vegetativas durante todo el año para reducir la dependencia de la recolección estacional de esporófilos del arrecife natural.
- Almacenar cultivos de gametofito según la población de origen en matraces llenos de medios de crecimiento a 4-12 °C en luz roja a una intensidad de 5-20 μmol fotón m-2 s-1 en un ciclo de 12 luz: 12 oscuridad.
- Proporcione aireación constante y cambie el medio cada 2-6 meses.
- Para aumentar la biomasa de gametofitos que han estado creciendo asexualmente para su uso en la siembra de 'grava verde', aumente la aireación para suspender los gametofitos, aumente la frecuencia de los cambios de medios a semanales y fragmente los gametofitos cada dos semanas.
- Suspender la biomasa de gametofitos en el matraz de cultivo agitando o agitando y raspar los lados del matraz de cultivo con una herramienta estéril para desalojar los gametofitos adheridos, si es necesario.
- Vierta los gametofitos suspendidos en una licuadora estéril o molinillo de café y pulse la solución de gametofito durante 1-2 s aproximadamente 5-15 veces, dependiendo de la concentración de biomasa, hasta que no se vean masas agrupadas.
- Para inducir la reproducción para la siembra de 'grava verde', fragmente los gametofitos, como se explicó anteriormente. Luego, inocule el sustrato y aumente la luz LED de espectro completo de 5-20 a 45-60 μmol fotón m-2 s-1 (+10 μmol fotón m-2 s-1 diariamente para fotoaclimatación), luego aumente en 10-20 μmol fotón m-2 s-1 cada 3-4 d hasta alcanzar una irradiancia de 180 μmol fotón m-2 s-1.
10. Implementación
- Después de 6-8 semanas de cultivo en laboratorio, asegúrese de que los esporofitos juveniles midan 1-2 cm de largo y estén listos para su despliegue (Figura 4). Actualice los medios de cultivo en contenedores de cultivo 24 h antes de la implementación.
- Obtenga los permisos necesarios para el despliegue de grava que cumplan con las leyes y regulaciones locales. Esto puede ser una parte del proceso de cultivo que requiere mucho tiempo y debe incorporarse a los plazos del proyecto.
- Transporta la "grava verde" en bandejas cubiertas con toallas empapadas en agua de mar para mantener las algas hidratadas. Coloque las bandejas en hieleras aisladas con hielo, asegurándose de que no estén en contacto directo con hielo. Asegúrese de que la "grava verde" esté bien compactada para evitar que los sustratos se enrollen y se desprendan del esporofito durante el transporte.
NOTA: Dependiendo de la disponibilidad de espacio, los sustratos también se pueden transportar en sus contenedores o tinas de cultivo para reducir la manipulación. - Transporte de "grava verde" durante un máximo de 6 h en una nevera a la sombra. El despliegue debe programarse para evitar la luz solar más directa. Si se despliega desde un barco, utilice una estructura sombreada para evitar el sol directo durante el proceso de despliegue.
- Esparca con cuidado la "grava verde" desde la superficie hacia el arrecife de abajo o a través de SCUBA cuando se pruebe en nuevos sitios y a pequeña escala.
Resultados
La técnica de restauración de la "grava verde" aún se encuentra en fase piloto, con datos limitados de supervivencia de plantas externas para otras especies28, y aún no se han publicado datos para Macrocystis pyrifera. Utilizando la recolección de campo y el mantenimiento de laboratorio descritos en este protocolo, probamos la importancia de las condiciones de cría específicas del sitio para dos poblaciones distintas de algas donantes antes de la hipotética implementación de "grava verde" (Figura 5). El tejido reproductivo de algas marinas se recolectó en California (EE.UU.) de poblaciones más frías de K1 (Santa Cruz 36.60167°N, 121.88508°W) y K4 más cálidas (San Diego, 32.85036°N, -117.27600°W) y se crió a dos temperaturas: (1) 12 °C (la temperatura de cultivo estándar para la acuicultura de algas marinas, y la TSM media de invierno para K1), y (2) 20 °C (la TSM media de verano para K4, y una ola de calor de 4 °C para K1). Todos los portaobjetos de vidrio utilizados para monitorear el desarrollo de la etapa de vida de las algas marinas se marcaron con una cuadrícula estandarizada, y se capturaron imágenes de alta resolución utilizando esta cuadrícula como referencia para permitir la observación de campos fijos a lo largo del tiempo utilizando un microscopio invertido y una cámara (N = 5 imágenes por muestra, 2.479 mm x 1.859 mm).
Después de 24 días después de la esporulación, los gametofitos se contaron a partir de imágenes microscópicas (N = 300 imágenes de 60 muestras). Para probar las diferencias en los recuentos de gametofitos, se emplearon modelos lineales generalizados de efectos mixtos con distribución de Poisson utilizando la función glmmTMB() en el paquete glmmTMB41, y se realizaron comparaciones por pares con emtrends() del paquete emmeans42en R. Nuestros resultados ilustran que la respuesta de los gametofitos a la variabilidad térmica fue diferente entre las poblaciones K1 y K4 (t = 2.7, p = 0.007), donde la temperatura no tuvo un efecto para la población K4 más cálida (estimación = -0.01, error estándar [SE] = 0.01, intervalo de confianza [IC] = [-0.03, 0.01]), pero sí tuvo un efecto para la población K1 más fría (estimación = -0.06, SE = 0,02, IC = [-0,10, -0,03]) (Figura 6A), lo que sugiere una posible divergencia adaptativa en los rasgos de tolerancia térmica. Los gametofitos de algas marinas a menudo se representan como una etapa de resistencia43, lo que significa que producen un fenotipo polivalente que es tolerante al estrés y relativamente insensible a la variabilidad ambiental. Sin embargo, estos resultados indican que la variabilidad térmica impone una presión significativa en esta etapa temprana.
Después de 32 días después de la esporulación, se contaron esporofitos visibles con longitudes superiores a aproximadamente 1 mm en la totalidad de cada portaobjetos de vidrio de 2,5 cm por 7,5 cm (N = 72 muestras en total). Para probar las diferencias en los recuentos de esporofitos visibles, se emplearon modelos lineales generalizados de efectos mixtos con distribución de Poisson utilizando la función glmmTMB() en el paquete glmmTMB y se realizaron comparaciones por pares con emtrends() de las medias del paquete en R. Nuestros resultados ilustran que la respuesta de los esporofitos a la variabilidad térmica es similar entre las poblaciones diferenciadas K1 y K4 (z = 0.92, p = 0.36), donde la temperatura tuvo un efecto para la población K4 más cálida (estimación = -0.66, SE = 0.04, IC = [-0.74, - 0.57]), así como para la población K1 más fría (estimación = -0.85, SE = 0.13, IC = [-1.10, -0.60]) (Figura 6B). Las muestras criadas a 20 °C desarrollaron pocos esporofitos visibles (media ± SE = 0,4 ± 0,2) en comparación con las criadas a 12 °C (media ± SE = 82,4 ± 9,8). Este resultado sugiere que la producción de esporofitos es más sensible a la temperatura que la etapa de gametofito, y que las temperaturas de cultivo específicas del sitio no deben exceder los 15 °C para lograr el desarrollo del esporofito como se describe en el protocolo.

Figura 1: Diagrama del sistema de incubación de 'grava verde' . (A) Fuente de luz roja para cultivos de gametofitos de aumento vegetativo. (B) Puerto de acceso para cables y tuberías eléctricas, que conduce a una toma de corriente externa. (C) Estructura para bloquear la luz de espectro completo fuera de la sección de luz roja. (D) Una sección de cultivo de 'grava verde' . (E) fuentes de luz de espectro completo. (F) Líneas de tubería conectadas a una fuente de aire filtrada externa. (G) Válvulas de retención para reducir la contaminación en el aire. (H) Recipientes de cultivo individuales que minimicen la contaminación. Haga clic aquí para ver una versión más grande de esta figura.
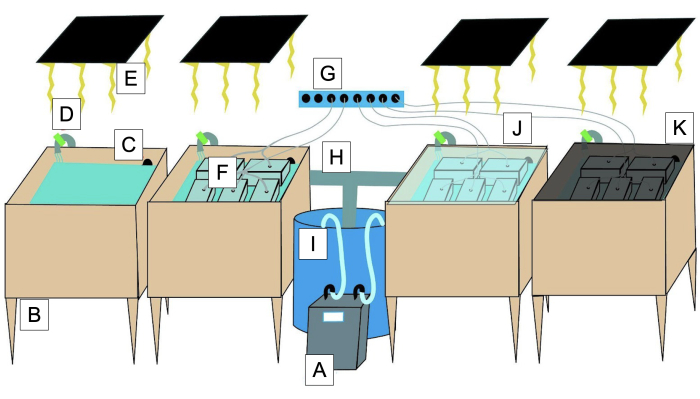
Figura 2: Diagrama del sistema de baño de agua de 'grava verde' . (A) Enfriador con bomba sumergida (en I). (B) Bañera de 20 galones para baño de agua. (C) Drene para recircular el baño de agua. (D) Válvula para la recirculación del baño de agua. (E) Fuente de luz. (F) Contenedor de grava verde de 2,5 L con tapa transparente y abertura de aireación. (G) Fuente de aireación. (H) Tuberías que recirculan el agua con el uso de bombas sumergidas. (I) Receptor de baño de agua desde/hacia el enfriador desde/hacia las bañeras con bombas sumergibles. (J) Cubierta acrílica para minimizar la evaporación del baño de agua. (K) Sombra de malla para ajustar la intensidad de la luz. Haga clic aquí para ver una versión más grande de esta figura.
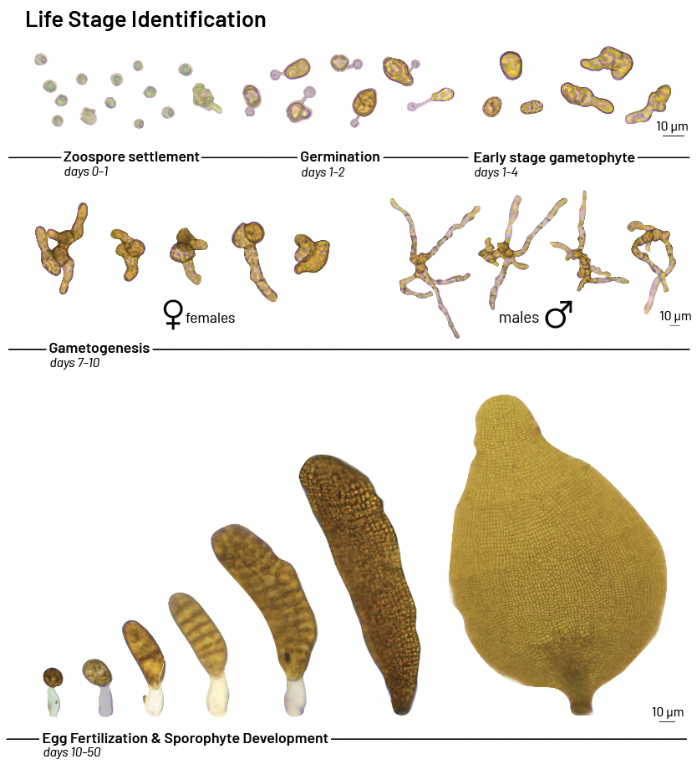
Figura 3: Desarrollo de Macrocystis pyrifera . Etapas del ciclo de vida del desarrollo de Macrocystis pyrifera a partir de ensayos de crecimiento de laboratorio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: 'Grava verde' sembrada con Macrocystis pyrifera. ' La "grava verde" sembrada con Macrocystis pyrifera se cultiva en el laboratorio hasta que los esporofitos alcanzan 1-2 cm. A continuación, se despliega la "grava verde" y continúa creciendo en el campo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Series temporales experimentales. Imágenes de ejemplo de una serie temporal que sigue el crecimiento y desarrollo experimental de gametofitos y esporofitos de Macrocystis pyrifera procedentes de dos poblaciones recogidas en California (EE.UU.) y cultivadas a dos temperaturas diferentes. K1 = Santa Cruz, K4 = San Diego. Haga clic aquí para ver una versión más grande de esta figura.
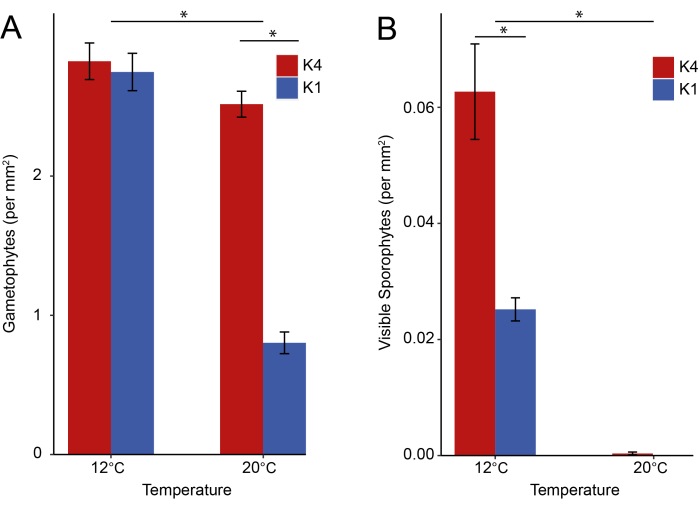
Figura 6: Resultados representativos. Estadios de vida de Macrocystis pyrifera observados para las poblaciones de origen K1 Santa Cruz San Diego K4 Santa Cruz cultivadas en condiciones térmicas constantes de 12 y 20 °C. Barras de error, media ± 1 SE. El asterisco (*) denota diferencias estadísticamente significativas (p < 0,05). (A) Gametofitos en el día 24 (N = 300 imágenes totales de 60 muestras). (B) Esporofitos visibles en el día 32 (N = 72 muestras, dentro de un área estandarizada de 2,5 cm por 7,5 cm). Haga clic aquí para ver una versión más grande de esta figura.
Expediente Complementario 1. Haga clic aquí para descargar este archivo.
Discusión
El cambio climático antropogénico es una amenaza creciente para la salud de los océanos del mundo 44,45,46,47,48, que provoca grandes perturbaciones y pérdida de biodiversidad 49,50,51,52. Para acelerar la restauración de los ecosistemas degradados, las Naciones Unidas han declarado de 2021 a 2030 el "Decenio de las Naciones Unidas sobre la Restauración de los Ecosistemas", coincidiendo con el "Decenio de las Naciones Unidas de las Ciencias Oceánicas para el Desarrollo Sostenible", cuyo objetivo es revertir el deterioro de la salud de los océanos53. En línea con este llamamiento mundial a la acción, la Alianza por los Bosques de Algas ha lanzado el Desafío de los Bosques de Algas Marinas para restaurar 1 millón de hectáreas y proteger 3 millones de hectáreas de bosques de algas marinas para el año 204054. La restauración marina está infravalorada55, y los ecosistemas de algas marinas reciben considerablemente menos atención que hábitats como los arrecifes de coral, los manglares y las praderas marinas56. Se ha demostrado que la restauración de ecosistemas degradados es eficaz para reconstruir los ecosistemas marinos, pero puede costar en promedio entre 80.000 y 1.600.000 dólares por hectárea, y es probable que la mediana de los costos totales sea de dos a cuatro veces mayor57. Las pérdidas actuales y proyectadas exigen el desarrollo de metodologías de restauración de algas marinas escalables, factibles y rentables como intervenciones urgentes de conservación.
Los esfuerzos actuales de restauración de algas marinas utilizan una combinación de metodologías para abordar los factores específicos del sitio de la pérdida de algas marinas, incluido el trasplante de algas adultas, la siembra directa de zoosporas y/o gametofitos, el control de herbívoros y la instalación de arrecifes artificiales11. Sin embargo, estos métodos requieren recursos sustanciales y tienen una escalabilidad limitada. El trasplante típico de algas adultas requiere el despliegue laborioso de materiales o estructuras artificiales en el bentos por parte de buzos. Las intervenciones de abajo hacia arriba para restablecer los arrecifes rocosos costeros, como el control de competidores y herbívoros, también están restringidas por los costos de mano de obra, ya que dependen de la eliminación manual bajo el agua o la exclusión de estos factores de estrés biótico11. La técnica de la «grava verde» supera estas limitaciones con un despliegue sencillo desde la superficie, que no requiere instalación ni conocimientos técnicos bajo el agua, y escalabilidad a costes relativamente bajos28. Este enfoque innovador proporciona una herramienta de restauración prometedora, que insta a realizar ensayos exhaustivos en diversos lugares y entornos para liberar todo su potencial32.
Si bien se han documentado esfuerzos exitosos de restauración con "grava verde" en fiordos protegidos en Noruega utilizando el alga azucarera, Saccharina latissima26, esta técnica aún se encuentra en la fase piloto para Macrocystis pyrifera en el Pacífico oriental. Se necesitan ensayos adicionales para abordar la supervivencia esperada de las plantas externas de M. pyrifera dentro de su área de distribución. En condiciones de exposición a las olas típicas del crecimiento de M. pyrifera , la grava más pequeña puede ser más propensa al movimiento y la abrasión, lo que provoca daños en las plantas externas. Además, la flotabilidad positiva proporcionada por los neumatocistos llenos de gas de M. pyrifera puede llevar a que las plantas externas de "grava verde" se alejen efectivamente del sitio de restauración y, por lo tanto, el tamaño y el peso de la grava son factores importantes a explorar para esta especie. En un estudio piloto reciente (mayo de 2022; Ensenada, Baja California, México), se ha observado un éxito preliminar en campo con M. pyrifera , indicado por la adhesión de los hapteros al sustrato circundante y el crecimiento de los juveniles que alcanzan 1.2 m de longitud después de dos meses en el campo (Figura 4). Esto demuestra una clara oportunidad que aún no se ha explorado en la utilización de "grava verde" para M. pyrifera en el Pacífico Oriental. Este video muestra la técnica de la "grava verde" con M. pyrifera y es un recurso valioso que simplifica y centraliza las prácticas existentes en la fase de cultivo de la restauración para respaldar estudios que abordan los éxitos y las limitaciones en diferentes entornos de campo.
Con la técnica de "grava verde", se pueden sembrar muchas unidades de grava individuales más pequeñas a una escala que puede aumentar la probabilidad de éxito en comparación con los enfoques de trasplante más comunes con plantas adultas. Sin embargo, el aspecto escalable clave de esta técnica es su simple despliegue desde la superficie, lo que puede facilitar la restauración de grandes áreas en barco. Para entornos de campo donde el despliegue de grava pequeña no es adecuado, este protocolo se puede adaptar para trasplantar M. pyrifera en una amplia gama de sustratos, incluida grava más grande o incluso cantos rodados pequeños, cuerdas que se pueden atar a anclajes submarinos naturales o desplegados, o baldosas que se pueden atornillar o pegar con epoxi marino al fondo marino en condiciones más expuestas. Estas adaptaciones de despliegue no cambiarán las instalaciones necesarias para el cultivo de M. pyrifera , pero posteriormente aumentarán el costo de despliegue.
Las perturbaciones antropogénicas y el cambio climático están superando actualmente la capacidad de adaptación de las poblaciones naturales. Esto plantea desafíos significativos a los esfuerzos tradicionales de conservación que restauran los ecosistemas a sus estados históricos 58,59,60,61,62,63. Por lo tanto, los marcos de conservación se han ampliado para incluir el manejo anticipatorio considerando la resiliencia y la capacidad de adaptación64. Se está implementando un manejo anticipatorio para hacer frente al cambio climático para las especies arbóreas en los ecosistemas forestales65 y se ha propuesto para nuevos esfuerzos de restauración a fin de mejorar el potencial evolutivo de las plantas externas 66,67. A pesar de que estas estrategias son inherentemente más fáciles de manipular en ambientes terrestres, varios estudios están comenzando a explorar su aplicación en ambientes marinos 62,68,69,70. Por ejemplo, los arrecifes de coral están amenazados por numerosos factores de estrés antropogénicos que han dado lugar a disminuciones sin precedentes71,72. En respuesta a las pérdidas de estas importantes especies fundacionales, se aboga cada vez más por la restauración activa y las técnicas de adaptación asistida para conservar los arrecifes de coral restantes y sus funciones asociadas 62,73,74. Una técnica consiste en la translocación de individuos dentro de su rango de distribución actual de especies para aumentar la tolerancia al estrés térmico75. Con respecto a la restauración de algas formadoras de dosel, la 'grava verde' tiene un marco personalizable para explorar técnicas de adaptación asistida como la translocación de genotipos resilientes a áreas vulnerables, la manipulación no genética como la hibridación o la aclimatación de individuos al estrés ambiental62 con resultados dirigidos a la obtención de cepas más resistentes para los programas de restauración76,77.
Aprovechar el apoyo local para mejorar los esfuerzos de restauración es crucial para mantener el éxito de la conservación de los ecosistemas de algas marinas. La participación de las partes interesadas locales puede aumentar la aceptación local de las necesidades de restauración 6,50 y promover la gestión costera que, posteriormente, podría dar lugar a una mayor financiación y longevidad de la protección de los ecosistemas de algas marinas. Al igual que con todas las demás metodologías de restauración de algas marinas, los marcos estructurados de toma de decisiones que integren diversos objetivos ecológicos, socioeconómicos y de conservación ayudarán a lograr resultados óptimos para los ecosistemas de algas marinas y las comunidades que sustentan11.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por el Programa de Investigación para la Recuperación de Algas Marinas de California Sea Grant R/HCE-17 para JBL y MESB, un premio de Pasantía de Investigación de la Fundación Nacional de Ciencias DGE-1735040 para PDD, The Nature Conservancy, Schmidt Marine Technology Partners, Sustainable Ocean Alliance, Tinker Foundation para AP-L y el Grupo de Trabajo de Baja Baja de la Alianza para la Ciencia del Clima para RBL y JL. Agradecemos a Steven Allison, Cascade Sorte, Samantha Cunningham, Sam Weber y Caitlin Yee de la Universidad de California, Irvine; Mark Carr, Peter Raimondi, Sarah Eminhizer, Anne Kapuscinski de la Universidad de California, Santa Cruz; Walter Heady y Norah Eddy en The Nature Conservancy; Filipe Alberto y Gabriel Montecinos en la Universidad de Wisconsin, Milwaukee; José Antonio Zertuche-González, Alejandra Ferreira-Arrieta y Liliana Ferreira-Arrieta en la Universidad Autónoma de Baja California; Luis Malpica-Cruz, Alicia Abadía-Cardoso y Daniel Díaz-Guzmán de MexCal; los clavadistas de MexCalitos Alejandra Reyes, Mónica Peralta, Teresa Tavera, Julia Navarrete, Ainoa Vilalta, Jeremie Bauer y Alfonso Ferreira; y Nancy Caruso para el asesoramiento técnico. Agradecemos al Instituto de Investigaciones Oceanológicas de la Universidad Autónoma de Baja California por proporcionar las instalaciones utilizadas para desarrollar el sistema de baños de agua. Agradecemos a Ira Spitzer por el contenido de video submarino y de drones.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 µm filters | Milipore | SCGPS05RE | Natural seawater sterilization |
| 1 L glass bottles | Amazon | B07J6JP4D1 | Natural seawater sterilization |
| 1 µm filters (water + air) | Amazon | B01M1VWUWL | Natural seawater sterilization |
| 1'' PVC 90-Degree Elbow | Home Depot | 203812125 | Option 2 - Medium scale - Water bath systems |
| 10 µm filters | Amazon | B00D04BG56 | Natural seawater sterilization |
| 20 µm filters | Amazon | B082WS9NPH | Natural seawater sterilization |
| 3x5mm tubing | Amazon | B0852HXPN6 | Option 1 Small scale - Incubator |
| 4x4'' Sterile Gauze | Amazon | B07NDK8XM3 | Sporulation |
| 4x6mm tubing | Amazon | B08BCRV1FY | Option 1 Small scale - Incubator |
| 5 µm filters | Amazon | B082WS9NPH | Natural seawater sterilization |
| 50 mL falcon tubing | Amazon | B01M04HGPJ | Sporulation |
| 8x10mm tubing | Amazon | B01MSM3LLZ | Option 1 Small scale - Incubator |
| Air filters | Thermo Fisher | MTGR85010 | Option 1 Small scale - Incubator |
| Alcohol lamp | Amazon | B07XWD9WWC | Sporulation |
| Ammonium iron(II) sulfate hexahydrate ACS reagent, 99% | Sigma | 215406-100G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Aquarium Grade Gravel | Amazon | B07XRCKFBJ | Option 1 Small scale - Incubator |
| Biotin powder, BioReagent, suitable for cell culture, suitable for insect cell culture, suitable for plant cell culture, 99% | Sigma | B4639-100MG | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Boric Acid, 99.8%, 10043-35-3, MFCD00011337, BH3O3, 61.83, 500g | Thermo Fisher | 5090113707 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Calcium D-Pantothenate,ge98.0% (T),C9H17NO5,137-08-6,25g,D-Pantothenic Acid Calcium Salt, P0012-25G 1/EA | Thermo Fisher | P001225G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Check valves | Amazon | B08HRZR4MM | Option 1 Small scale - Incubator |
| Clear tubing 3/8'' - 10 ft | Amazon | B07MTYMW13 | Option 2 - Medium scale - Water bath systems |
| COBALT(II) SULFATE HEPTAH-100G, WARNING - California - Cancer Hazard, 93-2749-100G 1/EA | Thermo Fisher | 5090114752 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Compound microscope with camera | OMAX | M83EZ-C50S | Monitoring |
| Culture flask | Thermo Fisher | 07-250-080 | Option 1 Small scale - Incubator |
| Culture light | Amazon | B07RRRPJ63 | Option 1 Small scale - Incubator |
| Culture stoppers | Amazon | B07DX6J7QD | Option 1 Small scale - Incubator |
| Drainage connector | Amazon | B00GUZ6CV0 | Option 2 - Medium scale - Water bath systems |
| EDTA CAS Number: 6381-92-6 Molecular Formula: C10H14N2O8Na2- 2H2O Molecular Weight: 372.2 | Thermo Fisher | 50213299 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Eisco Safety Pack Graduated Cylinder Sets Class A, ASTM, Capacity: 10 mL, 25 mL, 50 mL, Graduations: 0.2 mL, 0.5 mL, 1.0 mL, Borosilicate 3.3 Glass, Autoclavable: Yes, Class: Class A, Graduated: Yes, Tolerance: 0.10 mL, 0.17 mL, 0.25 mL | Thermo Fisher | S81273 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Eisco Safety Pack Graduated Cylinder Sets Class A, ASTM, Capacity: 50 mL, 100 mL, 250 mL, Graduations: 1.0 mL, 1.0 mL, 2.0 mL, Borosilicate 3.3 Glass, Autoclavable: Yes, Class: Class A, Graduated: Yes, Tolerance: 0.25 mL, 0.50 mL, 1.0 mL | Thermo Fisher | S81275 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Eisco Safety Pack Volumetric Flask Sets - Class A, ASTM, Capacity: 10 mL, 25 mL, 50 mL, Borosilicate 3.3 Glass, Autoclavable: Yes, Class: Class A, Closure Material: Glass, Closure Size: Stopper Number: 9, 9, 13, Closure Type: Penny Stopper, Graduated: Ye | Thermo Fisher | S81271 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Filter holder | Amazon | B07LCKBKCT | Natural seawater sterilization |
| Fisherbrand Graduated Cylinders, Capacity: 500 mL, Graduations: 5 mL, Borosilicate Glass, Autoclavable: Yes, Limit of Error: +/-4.0 mL, Recommended Applications: Education, Subdivision: 5 mL, S63460 1/EA | Thermo Fisher | S63460 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| FLEXACAM C1 Camera | Leica | FLEXACAM C1 | Monitoring |
| Folic acid, C19H19N7O6, CAS Number59303, vitamin m, pteroylglutamic acid, vitamin b9, folvite, folacin, folacid, pteroyllglutamic acid, pteglu, folic acid, folate, 25g, 100781, CHEBI:27470, Yellow to Orange, 2004190, 441.41, OVBPIULPVIDEAOLBPRGKRZSAN | Thermo Fisher | AAJ6083314 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Free Standing 20 Gallon Utility Sink | Amazon | B094TLH19L | Option 2 - Medium scale - Water bath systems |
| GERMANIUM DIOXIDE 99.99 10GR | Thermo Fisher | AC190000100 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Glass Graduated Cylinders, Class A Round Base, Eisco, For Use With: Measuring liquids, Capacity: 1000 mL, Graduations: 10 mL White, CH0344OWT 1/EA | Thermo Fisher | S88442 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Glass slides | Amazon | B00L1S93PS | Option 2 - Medium scale - Water bath systems |
| Glycerol phosphate disodium salt hydrate isomeric mixture | Sigma | G6501-100G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Growth containers -3.4 Qt- 3.25 Lt transparent containers with transparent lid | Container store | #10014828 | Option 2 - Medium scale - Water bath systems |
| Growth light | Amazon | B086R14MFW | Option 1 Small scale - Incubator |
| Hemocytometer | Amazon | B07TJQDKLJ | Sporulation |
| Hinged plastic jars | SKS Bottle & Packaging | 40280125.01S | Option 1 Small scale - Incubator |
| Inositol research grade, USP/NF For bacteriology. Optically inactive. Tested for its suitability in tissue culture. Size - 100G Storage Conditions - +15 C TO +30 C Catalog Number - 26310.01 CAS 87-89-8 | Thermo Fisher | 50247745 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Instant Ocean - 50 G | Amazon | B000255NKA | Option 1 Small scale - Incubator |
| Inverted Microscope Leica DMi1 | Leica | DMi1 | Monitoring |
| Iron(III) chloride hexahydrate ACS reagent, 97% | Sigma | 236489-100G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Licor Ligth Meter Data Logger | Licor | LI-250A | Monitoring |
| Light/temperature HOBO data logger | Amazon | B075X2SWKN | Monitoring |
| Lights 150W | Amazon | B0799DQM9V | Option 2 - Medium scale - Water bath systems |
| Manganese sulfate monohydrate meets USP testing specifications | Sigma | M8179-100G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Medium size rocks 2-3 inch, 20 pounds | Home Depot | 206823930 | Option 2 - Medium scale - Water bath systems |
| Nicotinic Acid, 99%, C6H5NO2, CAS Number59676, daskil, apelagrin, acidum nicotinicum, akotin, 3carboxypyridine, niacin, 3pyridinecarboxylic acid, nicotinic acid, pellagrin, wampocap, 250g, 109591, CHEBI:15940, 1.4, 2004410, 293 deg.C (559 deg.F), 123.11, | Thermo Fisher | AAA1268330 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| p-Aminobenzoic acid 99.82% 4-aminobenzoic acid, C7H7NO2, CAS Number: 150-13-0, 25g, 0210256925 1/EA | Thermo Fisher | ICN10256925 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| PCV cement | Amazon | B001D9WRWG | Option 2 - Medium scale - Water bath systems |
| Plastic water valve | Amazon | B0006JLVE4 | Option 2 - Medium scale - Water bath systems |
| Plastic water valve | Amazon | B07G5FY7X1 | Option 2 - Medium scale - Water bath systems |
| Precision scale 1mg | Amazon | B08DTH95FN | Materials to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Pump for filtered air | Amazon | B0BG2BT9RX | Option 1 Small scale - Incubator |
| PVC tubing 1x24'' | Home Depot | 202300505 | Option 2 - Medium scale - Water bath systems |
| Quantum Light meter | Apogee Instruments | MQ-510 | Monitoring |
| Refrigerated Incubator | Thermo Fisher | 15-103-1566 | Option 1 Small scale - Incubator |
| Rubber Grommets | Amazon | B07YZD22ZP | Option 1 Small scale - Incubator |
| Salinity refractometer | ATC | B018LRO1SU | Monitoring |
| Shade mesh 6x50 ft | Home depot | 316308418 | Option 2 - Medium scale - Water bath systems |
| Sodium Nitrate ge 99.0% Nitric Acid, Sodium Salt, NNaO3, CAS Number: 7631-99-4, 500g, 1/EA | Thermo Fisher | BP360500 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Soldering for aeration opening | Amazon | B08R3515SF | Option 2 - Medium scale - Water bath systems |
| Spray isporopyl alcohol | Amazon | B08LW5P844 | Sporulation |
| Stainless steel sissors | Amazon | B07BT4YLHT | Sporulation |
| Stainless steel tray | Amazon | B08CV33YXG | Sporulation |
| Stainless steel twizzers | Amazon | B01JTZTAJS | Sporulation |
| Stir Bars | Amazon | B07C4TNKXB | Materials to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Submersible circulation pump 400 GPH | Amazon | B07RZKRM13 | Option 2 - Medium scale - Water bath systems |
| Submersible Spherical Quantum Sensor | Waltz | US-SQS/L | Monitoring |
| Temperature gun | Infrared Thermometer 749 | B07VTPJXH9 | Monitoring |
| Thiamine hydrochloride BioReagent, suitable for cell culture, suitable for insect cell culture, suitable for plant cell culture | Sigma | T1270-25G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Thymine 99% 2, 4-Dihydroxy-5-methylpyrimidine, C5H6N2O2, CAS Number: 65-71-4, 25g, 157850250 1/EA | Thermo Fisher | AC157850250 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Transparent Acrylic sheet 24x48 inch | Home Depot | 202038048 | Option 2 - Medium scale - Water bath systems |
| Tubing water circulation 1''x10 ft | Amazon | B07ZC1PSF3 | Option 2 - Medium scale - Water bath systems |
| UV light for natural seawater sterilization | Amazon | B018OI7PYS | Natural seawater sterilization |
| Vacum pump | Amazon | B087XBTPVW | Natural seawater sterilization |
| Vitamin B12 BioReagent, suitable for cell culture, suitable for insect cell culture, suitable for plant cell culture, 98% | Sigma | V6629-100MG | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Volumetric Flasks, Class A Glass, Eisco, with Polypropylene Stopper, Graduated, White printed markings, Capacity: 1000 mL, CH0446IWT 1/EA | Thermo Fisher | S89446 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Volumetric Flasks, Class A Glass, Eisco, with Polypropylene Stopper, Graduated, White printed markings, Capacity: 500 mL, CH0446HWT 1/EA | Thermo Fisher | S89445 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Water Chiller 200-600GPM | Amazon | B07BHHP71C | Option 2 - Medium scale - Water bath systems |
| Y-splitters for 4x6mm tubing | Amazon | B08XTJKFCH | Option 1 Small scale - Incubator |
| Zinc sulfate heptahydrate BioReagent, suitable for cell culture | Sigma | Z0251-100G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
Referencias
- Schiel, D. R., Foster, M. S. . The Biology and Ecology of Giant Kelp Forests. , (2015).
- Smale, D. A., Burrows, M. T., Moore, P., O'Connor, N., Hawkins, S. J. Threats and knowledge gaps for ecosystem services provided by kelp forests: a northeast Atlantic perspective. Ecol Evol. 3 (11), 4016-4038 (2013).
- Eger, A. M., et al. The value of ecosystem services in global marine kelp forests. Nat Comm. 14 (1), 1894 (2023).
- Bennett, S., Wernberg, T., Arackal Joy, B., de Bettignies, T., Campbell, A. H. Central and rear-edge populations can be equally vulnerable to warming. Nat Comm. 6 (1), 10280 (2015).
- Jueterbock, A., et al. Climate change impact on seaweed meadow distribution in the North Atlantic rocky intertidal. Ecol Evol. 3 (5), 1356-1373 (2013).
- Rogers-Bennett, L., Catton, C. A. Marine heat wave and multiple stressors tip bull kelp forest to sea urchin barrens. Sci Rep. 9 (1), 15050 (2019).
- Krumhansl, K. A., et al. Global patterns of kelp forest change over the past half-century. PNAS. 113 (48), 13785-13790 (2016).
- Zimmerman, R. C., Kremer, J. N. Episodic nutrient supply to a kelp forest ecosystem in Southern California. J Mar Res. 42 (3), 591-604 (1984).
- Rothäusler, E., et al. Physiological performance of floating giant kelp Macrocystis pyrifera (phaeophyceae): Latitudinal variability in the effects of temperature and grazing. J Phycol. 47 (2), 269-281 (2011).
- Wernberg, T., Krumhansl, K., Filbee-Dexter, K., Pedersen, M. F. Chapter 3 - Status and trends for the world's kelp forests. World Seas: An Environmental Evaluation (Second Edition). , 57-78 (2019).
- Eger, A. M., Layton, C., McHugh, T. A., Gleason, M., Eddy, N. Kelp restoration guidebook: Lessons learned from kelp restoration projects around the world. TNCKelp Forest Alliance. , (2022).
- Filbee-Dexter, K., et al. Marine heatwaves and the collapse of marginal North Atlantic kelp forests. SciRep. 10 (1), 13388 (2020).
- Filbee-Dexter, K., Scheibling, R. E. Sea urchin barrens as alternative stable states of collapsed kelp ecosystems. Mar Ecol Prog Ser. 495, 1-25 (2014).
- Filbee-Dexter, K., Wernberg, T. Rise of turfs: A new battlefront for globally declining kelp forests. BioSci. 68 (2), 64-76 (2018).
- Assis, J., Araújo, M. B., Serrão, E. A. Projected climate changes threaten ancient refugia of kelp forests in the North Atlantic. Glob Change Biol. 24 (1), e55-e66 (2018).
- Davis, T., Champion, C., Coleman, M. Ecological interactions mediate projected loss of kelp biomass under climate change. Divers Distrib. 28 (2), 306-317 (2021).
- Goldsmit, J., et al. Kelp in the eastern Canadian arctic: Current and future predictions of habitat suitability and cover. Front Mar Sci. 18, 742209 (2021).
- Ling, S. D., Cornwall, C. E., Tilbrook, B., Hurd, C. L. Remnant kelp bed refugia and future phase-shifts under ocean acidification. PLoS One. 15 (10), e239136 (2020).
- Eger, A. M., et al. Global kelp forest restoration: past lessons, present status, and future directions. Biol Rev. 97 (4), 1449-1475 (2022).
- Waylen, K. A., Fischer, A., McGowan, P. J., Thirgood, S. J., Milner-Gulland, E. J. Effect of local cultural context on the success of community-based conservation interventions. Biol Consv. 24 (4), 1119-1129 (2010).
- Vergés, A., et al. The tropicalization of temperate marine ecosystems: climate-mediated changes in herbivory and community phase shifts. Proc Royal Soc. B. 281 (1789), 20140846 (2014).
- Zarco-Perello, S., Wernberg, T., Langlois, T. J., Vanderklift, M. A. Tropicalization strengthens consumer pressure on habitat-forming seaweeds. Sci Rep. 7 (1), 820 (2017).
- Worm, B., Lotze, H. K. Chapter 21 - Marine biodiversity and climate change. Climate Change (Third Edition). , 445-464 (2021).
- Félix-Loaiza, A. C., Rodríguez-Bravo, L. M., Beas-Luna, R., Lorda, J., de La Cruz-González, E., Malpica-Cruz, L. Marine heatwaves facilitate invasive algae takeover as foundational kelp. Botanica Marina. 65 (5), 315-319 (2022).
- Miller, K. I., Blain, C. O., Shears, N. T. Sea urchin removal as a tool for macroalgal restoration: A review on removing "the spiny enemies". Fron Mar Sci. 9, 831001 (2022).
- Westermeier, R., et al. Repopulation techniques for Macrocystis integrifolia (Phaeophyceae: Laminariales) in Atacama, Chile. J Appl Phycol. 26, 511-518 (2014).
- Layton, C., et al. Kelp forest restoration in Australia. Fron Mar Sci. 7, 74 (2020).
- Fredriksen, S., et al. Green gravel: a novel restoration tool to combat kelp forest decline. Sci Rep. 10 (1), 3983 (2020).
- Projects of the Green Gravel Action Group. Green Gravel Action Group. (n.d.) Available from: https://www.greengravel.org/ (2024)
- Fain, S. R., Murray, S. N. Effects of light and temperature on net photosynthesis and dark respiration of gametophytes and embryonic sporophytes of macrocystis pyrifera. J Phycol. 18 (1), 92-98 (1982).
- Westermeier, R., Patiño, D., Piel, M. I., Maier, I., Mueller, D. G. A new approach to kelp mariculture in Chile: production of free-floating sporophyte seedlings from gametophyte cultures of Lessonia trabeculata and Macrocystis pyrifera. Aquac Res. 37 (2), 164-171 (2006).
- Alsuwaiyan, N., et al. A et al. Green gravel as a vector of dispersal for kelp restoration. Fron Mar Sci. 9, 910417 (2022).
- Falace, A., Kaleb, S., De La Fuente, G., Asnaghi, V., Chiantore, M. Ex situ cultivation protocol for Cystoseira amentacea var. stricta (Fucales, Phaeophyceae) from a restoration perspective. PloS One. 13 (2), e0193011 (2018).
- Redmond, S., Green, L., Yarish, C., Kim, J., Neefus, C. . New England seaweed culture handbook. , (2014).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Arch Mikrobiol. 25, 392-428 (1957).
- Navarro, D., Navarro, D. E. . California Kelp Forest Restoration: Science Activity Guide for Teachers. , (2006).
- Alsuwaiyan, N. A., et al. A review of protocols for the experimental release of kelp (Laminariales) zoospores. Ecol Evol. 9 (14), 8387-8398 (2019).
- Lüning, K., Müller, D. G. Chemical interaction in sexual reproduction of several Laminariales (Phaeophyceae): release and attraction of spermatozoids. Z. Pflanzenphysiol. 89 (4), 333-341 (1978).
- Müller, D. G., Maier, I., Gassmann, G. Survey on sexual pheromone specificity in Laminariales (Phaeophyceae). Phycologia. 24 (4), 475-477 (1985).
- Vieira, V. M., Oppliger, L. V., Engelen, A. H., Correa, J. A. A new method to quantify and compare the multiple components of fitness-a study case with kelp niche partition by divergent microstage adaptations to temperature. Plos One. 10 (3), e0119670 (2015).
- Brooks, M. E., et al. glmmTMB balances speed and flexibility among packages for zero-inflated generalized linear mixed modeling. The R Journal. 9 (2), 378-400 (2017).
- Russell, L. emmeans: estimated marginal means, aka least-squares means. R package version. 1 (2), (2018).
- Ladah, L. B., Zertuche-González, J. A. Survival of microscopic stages of a perennial kelp (Macrocystis pyrifera) from the center and the southern extreme of its range in the Northern Hemisphere after exposure to simulated El Niño stress. Mar Biol. 152, 677-686 (2007).
- Halpern, B. S., et al. A global map of human impact on marine ecosystems. Science. 319 (5865), 948-952 (2008).
- Halpern, B. S., et al. Spatial and temporal changes in cumulative human impacts on the world's ocean. Nat Comm. 6 (1), 1-7 (2015).
- Halpern, B. S., et al. Recent pace of change in human impact on the world's ocean. Sci Rep. 9 (1), 11609 (2019).
- Micheli, F., et al. Cumulative human impacts on Mediterranean and Black Sea marine ecosystems: assessing current pressures and opportunities. PloS One. 8 (12), e79889 (2013).
- Portner, H. -. O., et al. IPCC, 2022: Summary for policymakers. IPCC. , (2022).
- Butchart, S. H. M., et al. Global biodiversity: Indicators of recent declines. Science. 328 (5982), 1164-1168 (2010).
- Rocha, J., Yletyinen, J., Biggs, R., Blenckner, T., Peterson, G. Marine regime shifts: Drivers and impacts on ecosystems services. Phil Trans Roy Soc. B. 370 (1659), 20130273 (2015).
- Worm, B., et al. Impacts of biodiversity loss on ocean ecosystem services. Science. 314 (5800), 787-790 (2006).
- Worm, B., Lotze, H. K. Marine biodiversity and climate change. Climate Change (Third Edition). , 445-464 (2021).
- Waltham, N. J., et al. UN decade on ecosystem restoration 2021-2030-What chance for success in restoring coastal ecosystems. Fron Mar Sci. 7, (2020).
- Kelp Forest Challenge. Kelp Forest Alliance Available from: https://kelpforestalliance.com/ (2024)
- Gordon, T. A. C., Radford, A., Simpson, S. D., Meekan, M. G. Marine restoration projects are undervalued. Science. 367 (6478), 635-636 (2020).
- Morris, R. L., et al. Key principles for managing recovery of kelp forests through restoration. BioScience. 70 (8), 688-698 (2020).
- Bayraktarov, E., et al. The cost and feasibility of marine coastal restoration. Ecol Appl. 26 (4), 1055-1074 (2016).
- Breed, M. F., et al. Priority actions to improve provenance decision-making. BioScience. 68 (7), 510-516 (2018).
- Breed, M. F., et al. The potential of genomics for restoring ecosystems and biodiversity. Nat Rev Genet. 20 (10), 615-628 (2019).
- Gurgel, C. F. D., Camacho, O., Minne, A. J. P., Wernberg, T., Coleman, M. A. Marine heatwave drives cryptic loss of genetic diversity in underwater forests. Curr Biol. 30 (7), 1199-1206 (2020).
- Hobbs, R. J., Higgs, E., Harris, J. A. Novel ecosystems: implications for conservation and restoration. Trends Ecol Evol. 24 (11), 599-605 (2009).
- van Oppen, M. J. H., Oliver, J. K., Putnam, H. M., Gates, R. D. Building coral reef resilience through assisted evolution. PNAS. 112 (8), 2307-2313 (2015).
- Perring, M. P., et al. Advances in restoration ecology: Rising to the challenges of the coming decades. Ecosphere. 6 (8), (2015).
- Coleman, M. A., et al. Restore or redefine: Future Trajectories for Restoration. Fron MarSci. 7, 237 (2020).
- O'Neill, G. A. Assisted migration to address climate change in British Columbia: recommendations for interim seed transfer standards. Ministry of Forests and Range, Forest Science Program. , (2008).
- Broadhurst, L. M., et al. Seed supply for broadscale restoration: maximizing evolutionary potential. Evol App. 1 (4), 587-597 (2008).
- Vitt, P., Havens, K., Kramer, A. T., Sollenberger, D., Yates, E. Assisted migration of plants: Changes in latitudes, changes in attitudes. Biol Cons. 143 (1), 18-27 (2010).
- Buerger, P., et al. Heat-evolved microalgal symbionts increase coral bleaching tolerance. Sci Adv. 6 (20), 2498 (2020).
- Chakravarti, L. J., van Oppen, M. J. H. Experimental evolution in coral photosymbionts as a tool to increase thermal tolerance. Fron Mar Sci. 5, (2018).
- van Oppen, M. J. H., et al. Shifting paradigms in restoration of the world's coral reefs. Global Change Biology. 23 (9), 3437-3448 (2017).
- Harborne, A. R., Rogers, A., Bozec, Y. -. M., Mumby, P. J. Multiple Stressors and the Functioning of Coral Reefs. Ann Rev Mar Sci. 9 (1), 445-468 (2017).
- Hughes, T. P., et al. Climate change, human impacts, and the resilience of coral reefs. Science. 301 (5635), 929-933 (2003).
- Anthony, K., et al. New interventions are needed to save coral reefs. Nat Ecol & Evol. 1 (10), 1420-1422 (2017).
- Darling, E. S., Côté, I. M. Seeking resilience in marine ecosystems. Science. 359 (6379), 986-987 (2018).
- van Oppen, M. J. H., Puill-Stephan, E., Lundgren, P., De'ath, G., Bay, L. K. First-generation fitness consequences of inter-populational hybridization in a Great Barrier Reef coral and its implications for assisted migration management. Coral Reefs. 33 (3), 607-611 (2014).
- Coleman, M. A., Goold, H. D. Harnessing synthetic biology for kelp forest conservation1. J Phycol. 55 (4), 745-751 (2019).
- Liboureau, P., Pearson, G. A., Barreto, L., Serrao, E. A., Kreiner, A., Martins, N. Effects of thermal history on reproductive success and cross-generational effects in the kelp Laminaria pallida (Phaeophyceae). Mar Ecol Prog Ser. 715, 41-56 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados