Method Article
복원을 용이하게 하기 위한 캐노피 형성 자이언트 켈프의 현장 수집 및 실험실 유지 관리
요약
이 프로토콜은 현장 환경에서 '녹색 자갈' 기술의 성공과 한계를 해결하기 위한 복원 시험에 사용하기 위해 캐노피를 형성하는 거대한 다시마로 파종된 기질의 현장 수집 및 정기적인 실험실 유지 관리에 대해 설명합니다.
초록
캐노피를 형성하는 다시마는 생물 다양성을 지원하고 연간 5,000억 달러 이상의 가치가 있는 생태계 서비스를 제공하는 필수 기반 종입니다. 기후로 인한 생태학적 스트레스 요인으로 인한 거대한 다시마 숲의 전 세계적인 감소는 혁신적인 복원 전략의 필요성을 강조합니다. '녹색 자갈'로 알려진 새로운 복원 기술은 광범위한 수중 노동 없이 넓은 지역에 어린 다시마를 파종하는 것을 목표로 하며 비용 효율성과 확장성으로 인해 유망한 복원 도구입니다. 이 비디오 기사는 자이언트 켈프인 Macrocystis pyrifera를 배양하기 위한 프로토콜과 도구를 보여줍니다. 또한 현장 설정에서 이 방법의 성공과 한계를 해결하기 위한 추가 연구를 위한 리소스를 제공합니다. 우리는 '녹색 자갈' 기술을 사용하여 생식 조직을 수집하고, 포자화하고, 접종하고, 기르고, 유지 및 초기 생애 단계로 파종된 기질을 모니터링하기 위한 현장 및 실험실 기반 방법을 간략하게 설명합니다. 이 프로토콜은 연구자, 관리자 및 이해 관계자가 다시마 보존 목표를 달성할 수 있도록 지원하기 위해 이 분야의 현재 복원 관행을 단순화하고 중앙 집중화합니다.
서문
캐노피를 형성하는 다시마(Laminariales 목의 갈색 거대 조류)는 세계적으로 중요한 기초 종으로, 온대 및 북극해의 해안 암초를 지배합니다1. 이 다시마는 구조적으로 복잡하고 생산성이 높은 생물 서식지를 형성하여 분류학적으로 다양한 해양 군집을 지원하는 다시마 숲으로 알려져 있다2. 전 세계 다시마 숲은 상업적 어업 생산, 탄소 및 영양 순환, 레크리에이션 기회 등 인간에게 다양한 생태계 서비스를 제공하며, 연간 총 5,000억 달러의 가치가 있는 것으로 추산됩니다3.
다시마 숲의 상당한 가치에도 불구하고, 다시마 숲은 많은 지역에서 인위적인 압력에 직면해 있다3. 기후 변화는 장기적인 해양 온난화와 온도 이상 현상의 빈도 증가로 인해 다시마에 대한 가장 심각한 위협중 하나입니다 3,4,5,6,7. 해수 온도 상승은 영양분 제한8과 관련이있으며, 생리학적 역치 이상의 열 스트레스에 노출되면 사망률9을 초래할 수 있다. 다양한 지역적스트레스 요인7과 함께 다시마 개체군은 전 세계적으로 매년 약 2%씩 감소하고 있으며10 특정 지역에서는 상당한 손실과 대체 군집 국가로의 지속적인 이동이 있다 6,11,12,13,14. 다시마 개체군의 자연 회복만으로는 현재 및 예상되는 손실15,16,17,18의 정도를 되돌리기에 충분하지 않을 수 있으며, 이는 적극적인 복원의 중요성을 강조한다.
현재의 다시마 복원 노력은 해안 암초에 이러한 중요한 기초 종을 재건하기 위해 여러 방법론을 조합하여 사용할 수 있다 3,19. 지역별 문제를 해결하기 위해 선택된 방법론은 지리적 맥락, 다시마 회복에 대한 특정 장애물 및 사회-생태학적 맥락에 따라 달라진다11. 사회-생태 시스템의 연결과 상호 의존성을 이해하는 것이 핵심이며, 지역 기관을 참여시키고 지역 사회의 지원을 얻는 개입은 성공적인 복원 노력의 가능성을 높인다20.
기후 변화 외에도, 초식동물의 압력 또는 종간 경쟁은 회복을 촉진, 감소 또는 억제한다(예: 성게(13), 초식어류(21,22), 뗏장조류(turf algae) 9,23, 또는 침입성 조류(invasive algae)24). 복원은 이러한 생체 스트레스 요인의 제거에 초점을 맞출 수 있지만25 이러한 방법은 상당한 자원과 지속적인 유지 관리11를 필요로 한다. 다시마 종의 회복을 촉진하기 위해, 예를 들어, 비옥한 다시마 잎으로 채워진 그물망 주머니의 무게를 저울질하여 동물원 포자를 환경으로 방출하는 저서까지 직접 파종 접근법을 향한 노력이 있었다26. 그러나 이 방법은 시간이 많이 걸리고 기술적인 수중 설치 및 제거가 필요합니다. 다른 사례들은 많은 양의 전체 성체 기증 식물을 이식하는 데 초점을 맞추는데, 이는 밀접하게 연관되어 있고 취약한 기증자 집단을 손상시킬 수 있으며, 지속적인 이식에 의존하기 때문에 종종 소규모로 제한된다27.
서식지 파편화로 인해 다시마 포자 제한이 다시마 숲 회복을 방해할 수 있는 지역의 경우, '녹색 자갈' 기술이라고 하는 비교적 새로운 다시마 복원 접근 방식이 도입되었습니다. 이 기술은 노르웨이 남부28의 Flødevigen Research Station에서 성공적으로 시험되었으며 비용 효율성과 확장성으로 인해 복원을 위한 유망한 옵션이었습니다. 이 기술의 작업 흐름은 다음과 같습니다 : (1) 포자 용액은 들판에서 생식 가능한 성인 다시마에서 수집 된 비옥 한 조직으로 생성 된 다음 자갈과 같은 작은 기질에 파종됩니다. (2) 초기 단계의 다시마는 기질의 실험실 통제 비생물적 조건에서 사육됩니다. (3) 눈에 보이는 포자식물이 있는 기질은 포자식물이 계속 자라는 '녹색 자갈' 로 특정 암초의 현장에 배치됩니다. 성인 개체의 일반적인 이식 노력은 다이버에 의한 힘들고 비용이 많이 드는 수중 설치를 필요로 하며, '녹색 자갈' 기술은 표면(28)에서 간단한 배치를 사용합니다.
'녹색 자갈' 기법은 현재 다양한 환경과 여러 층류 다시마 종에 걸쳐 수많은 국제 실무 그룹(29)의 구성원들에 의해 시도되고 있다. 이 프로토콜은 거대 다시마인 Macrocystis pyrifera를 사용하여 현장에서 이 복원 기술을 적용하기 전에 조직 수집, 포자 형성, 파종, 사육 조건, 정기 유지 관리 및 초기 단계 다시마의 모니터링에 필요한 시설, 재료 및 방법을 설명합니다. 이 프로토콜은 다양한 현장 환경에서 M. pyrifera를 사용한 이 방법의 성공과 한계에 대한 통찰력을 제공하고자 하는 연구자, 관리자 및 이해 관계자에게 귀중한 리소스입니다.
프로토콜
이 프로토콜에 설명된 대로 사용된 다시마 조직은 허가 S-202020004-20205-001에 따라 캘리포니아 어류 및 야생동물부에서 수집 및 감독했습니다.
1. 시설 및 자재 준비
- 다시마 양식 시설에서 온도(10-15°C)를 유지하고 전체 스펙트럼 광(0-180μmol 광자 m-2 s-1) 및 필터 폭기(0.2μm 기공 크기)를 제공할 수 있는지 확인합니다. 콘센트가 내장되어 있거나 전선 및 튜브, 조명, 공기 공급원을 위한 액세스 포트가 있는 인큐베이터 시스템을 사용합니다(그림 1). 인큐베이터 시스템이 프로젝트의 범위, 예산 또는 의도한 규모에 맞지 않는 경우 시원한 천연 해수 또는 냉각기로 단련된 수조를 사용하십시오(그림 2). 자세한 내용은 재료 표를 참조하십시오.
- 성장 매체에 온도계를 넣거나 온도 총을 사용하여 온도가 10-18 °C 사이인지 확인하십시오.
알림: 사육 온도는 현장 및 계절에 따라다릅니다 30. - 광원의 타이밍 설정을 변경하거나 기계식 타이머를 사용하여 전체 스펙트럼 조명을 12시간 광주기(12시간 어두움)로 프로그래밍합니다. 자갈 근처의 표면 아래에 방수 광합성 활성 방사선(PAR) 양자 측정기로 광도를 측정하고 디밍이 가능한 광원을 사용하거나 셀로판을 레이어링하여(식물 생식식물 배양의 경우 섹션 9 참조) 광원 위에 메쉬(조명 강도 조정에 대한 자세한 내용은 섹션 6.3 참조).
- 포자 형성 후 1일 후에 공기 펌프31 을 사용하여 적절한 폭기를 보장하십시오. 필터(0.2μm 기공 크기)를 사용하여 공기 중 박테리아 오염을 줄이십시오.
참고: '녹색 자갈' 배양의 경우, 통기 압력은 모든 배양 용기에서 물을 순환시키기에 충분해야 하며, 초기 단계의 다시마가 파종된 기질에 부착되는 것을 방해하지 않아야 합니다. 벌킹 생식식물 바이오매쓰( 섹션 9.2 참조)가 존재하는 경우, 폭기 압력은 배양 배지에 부유하는 생식동물을 유지하기에 충분해야 합니다.
- 성장 매체에 온도계를 넣거나 온도 총을 사용하여 온도가 10-18 °C 사이인지 확인하십시오.
- 재료와 스테이션을 소독하십시오. 미리 준비하십시오( 자료표 참조).
- 70% 이소프로필 알코올을 사용하여 표면을 청소하십시오. 가능하면 생식 조직 및 청소 수집 장비를 '녹색 자갈' 보육원 외부에서 취급하십시오.
- 실험실 등급의 세제를 사용하여 헹구고 증류수로 철저히 헹구고, 희석된 표백제 용액에 담근 다음(제조업체 지침에 따라) 증류수로 철저히 헹구고, 적절한 설정(유리 제품 또는 기구)을 사용하여 오토클레이브합니다. 멸균 후 재료는 밀봉된 용기에 보관하거나 호일로 포장할 수 있습니다.
- 실험실 등급의 세제를 사용하여 배양에 사용할 뚜껑이 있는 용기를 문지르고 청소한 다음 증류수로 철저히 헹굽니다.
참고: 뚜껑이 있는 배양 용기는 성장 배지의 증발을 줄이는 데 도움이 됩니다. 공기 교환을 위해 뚜껑을 약간 열어 두거나 체크 밸브를 사용하여 공기 중 오염을 줄이십시오. 뚜껑이 있는 용기를 사용할 수 없는 경우 파라핀 필름과 같은 열가소성 수지로 배양 용기를 밀봉하고 2-3개의 구멍을 뚫습니다. 더 큰 탱크를 사용하는 경우 투명 플라스틱으로 만든 증발 방지 커버를 사용하십시오. - 자갈은 질감이 있거나 약간 움푹 들어간 표면을 가지고 있는지 확인하는데, 이는 생식동물이 높은 견고성32,33을 가진 기질에 잔류할 가능성이 더 높기 때문이다. 먼지나 부스러기를 제거하기 위해 물이 맑아질 때까지 자갈을 문지르고 헹굽니다. 10% 희석된 표백제 용액에 자갈을 최소 24시간 동안 담그고 필터 멸균 해수로 헹굽니다(섹션 2.1 참조). 또는 문지르고 헹군 후 자갈을 탈이온수(DI)32에 1주일 동안 담그십시오.
참고: 이상적으로는 복원 현장의 오염을 줄이기 위해 현지에서 채취한 기질을 사용합니다. 또는 수족관 등급의 자갈을 사용하는 것이 좋습니다. 조직 표백과 이식된 다시마의 후속 사망으로 이어질 수 있는 석회석과 같은 석회질 기질을 피하십시오32.
2. 성장 배지의 준비
- 자원 가용성에 따라 다음과 같은 방법에 따라 해수를 여과하고 살균합니다. 매주 배양 용기를 새로 고치는 데 필요한 필터 멸균된 해수의 양을 계산하고( 섹션 7 참조) 그에 따라 이 여과/멸균 작업을 예약합니다. 필터 멸균된 해수를 대량의 어두운 용기에 담아 8-10°C에서 최대 6개월 동안 보관합니다. 냉장 보관할 수 없는 경우 어둡고 서늘한 곳에 보관하십시오.
- 기공 크기가 0.55-1μm인 진공 여과 시스템을 사용하여 물을 여과합니다. 필터 손상을 방지하기 위해 물을 모두 빼내기 전에 진공 소스를 끄고 여과된 물을 전용 멸균 용기에 붓습니다. 부피가 큰 경우 플로우 스루 여과 시스템을 사용하십시오. 예를 들어, 가장 큰 공극 크기에서 가장 작은 공극 크기로 배열된 일련의 3개의 주름 필터(10μm, 5μm 및 1μm)를 통해 해수를 흘려보냅니다.
알림: 천연 해수에 접근할 수 없는 경우 인공 해수를 준비할 수 있습니다. 또는 천연 해수는 수족관 상점에서 대량으로 구입할 수 있으며 종종 여과, 살균 및 pH 균형을 이룹니다. 이러한 옵션에는 여전히 미디어 보강이 필요합니다. - UV 및/또는 고압멸균 방법을 사용하여 여과된 해수를 살균합니다. 플로우 스루 시스템을 제조업체에서 권장하는 유량으로 수족관 UV 조명에 연결합니다. 뚜껑이 약간 열려 있거나 호일로 덮인 오토클레이브 안전 유리 용기에 해수를 오토클레이브하고 액체 주기(121°C, 1-2PSI, 액체 부피에 따라 15-30분)로34.
알림: 여과된 해수를 고압멸균하는 것은 배양 초기 단계에 권장됩니다.
- 기공 크기가 0.55-1μm인 진공 여과 시스템을 사용하여 물을 여과합니다. 필터 손상을 방지하기 위해 물을 모두 빼내기 전에 진공 소스를 끄고 여과된 물을 전용 멸균 용기에 붓습니다. 부피가 큰 경우 플로우 스루 여과 시스템을 사용하십시오. 예를 들어, 가장 큰 공극 크기에서 가장 작은 공극 크기로 배열된 일련의 3개의 주름 필터(10μm, 5μm 및 1μm)를 통해 해수를 흘려보냅니다.
- 여과 멸균된 해수를 영양분과 비타민으로 풍부하게 하는 것은 M. pyrifera 성장에 매우 중요합니다. 프로바솔리 농축 해수 배지(PES)는 조류 배양을 위해 설계된 널리 사용되는 배지이다35. 조류 배양 센터에서 이 배지를 구입하십시오. M. pyrifera 성장을 위한 PES 및 추가 비타민의 제제는34에 설명되어 있습니다.
- 여과된 해수 1L마다 PES 20mL를 농축합니다. 또는 산업 수준의 배양 배지를 사용하십시오.
- 제조업체의 권장 사항에 따라 농축 용액을 보관하십시오. 농축 용액의 분해를 방지하기 위해 성장 매체가 필요한 경우 필터 멸균된 해수를 농축합니다.
3. 필드 수집
- 지역 M. pyrifera 개체군의 자연 번식 주기를 모방하기 위해 sporophyll 수집의 시기를 결정합니다. 현지 전문가(예: 다시마 연구자, 관리자, 생태학자, 시민 과학자, 다이빙 그룹)와 상의하여 포자 채취를 위한 적절한 시기를 확보하십시오.
- 현지 법률 및 규정을 충족하는 다시마 조직 수집에 필요한 허가를 받으십시오. 이는 배양 과정에서 시간이 많이 소요될 수 있으며 프로젝트 일정에 통합해야 합니다.
- 자급식 수중 호흡 장치(SCUBA)를 사용하여 최소 2m 간격으로 눈에 보이는 소리를 가진 10-15개의 비옥한 M. pyrifera 개체에서 3-5개의 포자 블레이드를 선택합니다. 가능하면 오염이나 분해가 거의 또는 전혀 없는 깨끗하고 온전한 포자를 선택하십시오. 이 시점부터 부모 개체에 따라 sporophyll 블레이드를 별도로 보관하십시오.
참고: 포자포자는 다 자란 다시마의 고정부 위의 밑부분의 빽빽한 "치마"에서 자라며 가스로 채워진 폐낭종의 부족으로 식별할 수 있다1. 성숙한 소러스 조직은 종종 주변 조직보다 약간 융기되어 있고 색이 더 어둡다.1. - 스포자 블레이드는 햇빛에 과도하게 노출되지 않도록 어두운 수집 백에 담아 운반하고, 블레이드를 젖게 유지하기 위해 현장에서 최소한의 바닷물을 사용하며, 배양 공간에 도착할 때까지 약 12°C의 냉각기에 보관합니다. 샘플이 얼음과 직접 접촉하지 않도록 하십시오.
알림: Sporophylls는 다른 위치로 또는 다른 위치에서 배송할 수 있습니다.- 포자를 바닷물로 헹굽니다. 한 마리의 M. pyrifera 개체에서 채취한 칼날을 바닷물에 적신 축축한 종이 타월로 감싸고 빛의 침투와 추가 건조를 피하기 위해 알루미늄 호일로 다시 감쌉니다36. 이 보관 방법은 일반적으로 "부리토 방법"으로 알려져 있습니다.
- 이 패키지를 재활용 버블 랩이나 판지와 같은 보호 장벽이 있는 얼음이 있는 쿨러에 넣으십시오. 익일 배송을 위해 쿨러를 준비합니다. 발송물을 수령할 수 있는 사람이 있는지 확인하고 패키지를 냉장 상태로 보관하십시오.
4. 포자형성
- 가능하면 10-15 °C 사이의 온도 제어 환경에서 다른 배양물에서 멀리 떨어진 곳에서 포자필을 처리하십시오. 기기와 스테이션을 미리 준비하고 멸균하십시오. 오염을 줄이기 위해 다시마 조직을 다룰 때는 보호 장갑을 착용하십시오.
- 선택적으로 포자를 냉장 상태에서 12-48시간 동안 보관하여 소러스 조직(sorus tissue)으로부터 포자 방출을 촉진한다37. 저장하려면 섹션 3.3에 설명된 "부리토 방법"을 사용하십시오.
- 잘 익은 소러스 조직을 선택하고 멸균 가위를 사용하여 25cm2 섹션으로 자릅니다. 유전적 다양성을 촉진하기 위해 10-15마리의 개별 다시마 부모에서 1-2개의 깨끗한 소리 섹션을 선택합니다.
알림: 보관하는 경우 선택적으로 종이 타월에서 비옥한 sorus 조직의 존재를 나타내는 부분적인 포자 형성의 증거를 찾으십시오. 흉창 조직은 종종 주변 조직보다 약간 융기되고 색이 어둡습니다. - 청소하려면 멸균 거즈로만 소러스 조직의 양쪽을 한 방향으로 부드럽게 문지릅니다.amp필터로 멸균된 바닷물을 적십니다. 필요한 경우 멸균 면도날로 소러스 조직을 부드럽게 긁어 오염물을 완전히 제거합니다. 소리 부분을 담수조에 30초에서 1분 동안 담그고 필터 멸균 바닷물로 헹굽니다.
알림: 담수 수조를 새로 고치고 교차 오염을 줄이기 위해 다른 개인의 다른 소리 섹션을 다룰 때 사용 중인 재료를 소독하십시오. - 멸균 50mL 원심분리 튜브 내에서 10-15°C로 템퍼링된 필터 멸균 해수에 각 소리 섹션을 담그십시오. 어두운 곳에서 4-12 °C의 튜브를 놓아 최대 4 시간 동안 포자를 만듭니다. 냉장고를 사용할 수 없는 경우 조명이 어둡고 서늘한 곳에 보관하십시오.
참고: 또는 소리 절편을 하나의 멸균 용기에 포자화할 수 있습니다. - 복합 현미경과 혈구계를 사용하여 최대 4시간까지 30분마다 3-4개 샘플의 포자 밀도를 관찰합니다. 샘플 간에 피펫 팁을 변경합니다. 밀도가 10,000 포자 mL-1 이상인 경우( 섹션 5.1.1 참조) 다음 단계로 넘어갑니다. 소리 섹션에서 4시간 후에도 포자가 생성되지 않으면 샘플을 폐기하십시오. 포자는 방출 후 몇 시간 이내에 가라앉을 수 있지만 원을 그리며 헤엄치는 것이 관찰될 수 있습니다.
- 멸균 핀셋으로 튜브에서 각 소리 섹션을 제거합니다. 생성된 포자 용액을 하나의 멸균된 용기에 결합하고 최종 결합 밀도를 정량화합니다.
5. 접종
- 접종에 필요한 포자 용액의 최종 부피를 계산합니다. 배양 용기에서 최종 농도가 약 500-1,000 포자 mL-1 인지 확인합니다.
- 혈구계의 중앙 격자 수에서 결합된 포자 샘플의 농도를 계산하려면 계수를 10-4mL(혈구계에서 본 용액의 부피를 나타냄)로 나눕니다.
- 각 용기에 추가할 포자 용액의 부피를 결정하려면 배양 용기 내에서 기질을 가라앉히는 데 필요한 성장 배지의 양을 결정하십시오.
- 각 용기의 총 포자 수를 찾으려면이 해수 부피에 원하는 농도를 곱하십시오.
- 추가할 포자 용액의 총 부피를 결정하려면 포자의 총량을 포자 용액의 mL당 포자 농도로 나눕니다.
- 멸균 유리 슬라이드를 배양 용기 내에 배치하여 다시마 발달을 모니터링합니다. 충분한 모니터링을 위해 배양 용기에 무작위로 배포된 최소 30개의 슬라이드를 포함합니다( 섹션 7의 세부 정보 참조).
- 성장 배지에 잠긴 기질이 포함된 멸균 피펫 팁을 사용하여 계산된 양의 포자 용액을 배양 용기에 접종합니다. 용기를 닫고 포자를 분산시키기 위해 부드럽게 저어줍니다. 용기를 밀봉하고 배양 시스템에 넣습니다.
6. 양육 조건
- 배포 사이트의 온도에 따라 온도를 10-15°C 사이로 설정합니다.
- 1일 후 여과된 공기 공급원으로 가벼운 폭기를 제공하십시오.
- 수생 식물용 전체 스펙트럼 LED 조명을 12시간 조명으로 설정: 12시간 다크 사이클, 광도 범위는 0-180μmol 광자 m-2 s-1:
- 광도를 0-1일에서 5-10 μmol 광자 m-2 s-1 로 설정하고 1주일 말까지 20 - 30 μmol 광자 m-2 s-1 로 증가시킵니다.
- 이 시점부터 10 주가 끝날 때 180 μmol 광자 m-2 s-1의 조도에 도달 할 때까지 3-4 일마다 1-6 μmol 광자 m-2 s-1 조도를 증가시킵니다.
- 180 μmol 광자 m-2 s-1 에서 8 wk가 끝날 때까지 또는 포자 식물의 길이가 약 1-2cm에 도달 할 때 배양을 계속합니다.
7. 모니터링
- 처음 2주 동안 매일/격일로 최소 2개의 무작위 유리 슬라이드를 모니터링하여 발달을 평가합니다.
- 모니터링하려면 멸균된 핀셋으로 슬라이드를 다루고 유리 슬라이드가 잠길 만큼 충분한 멸균된 바닷물이 들어 있는 깨끗한 페트리 접시에 담습니다. 교차 오염을 방지하기 위해 유리 슬라이드를 제거한 후 배양액으로 되돌리지 마십시오.
- 40-400x 배율의 복합 또는 도립 현미경을 사용하여 초기 단계의 다시마를 관찰합니다. 다음 타임라인을 사용하여 발달을 추적합니다(발달 생활사 단계의 예는 그림 3 참조).
알림: 침전된 포자는 0-1d에서 관찰됩니다. 포자는 생식관의 형성으로 입증 된 것처럼 몇 시간 내에 발아 할 수 있습니다. 발아는 일반적으로 1-2d에서 관찰됩니다. 초기 생식동물은 일반적으로 1-4 d에서 관찰됩니다. 세포가 분열과 분화를 거쳐 남성과 여성의 배우자를 형성하는 과정인 생식세포 형성은 일반적으로 처음 2주 이내에 관찰됩니다. 암컷 세포는 수컷보다 5-7배 더 큽니다. 수컷 생식동물은 가늘고 섬유질의 가지를 자라는 반면 암컷은 모양이 더 둥글거나 난형입니다. 암컷은 일반적으로 2-3주 이내에 알이나 난자를 생산합니다. 수컷에서 방출된 정자는 암컷에게 헤엄쳐 난자를 수정시켜 이배체 접합체를 형성합니다. 적절한 접종 밀도를 갖는 것은 근접38,39에 의한 성공적인 번식을 보장할 것이다. 수정란은 배아 포자식물로 발달합니다. 포자식물은 일반적으로 2-4주 이내에 관찰됩니다. 접합체는 빠른 세포 분열을 거쳐 약 6-8주 이내에 1-2cm 블레이드가 자랍니다.
- 2주 후, 포자식물의 크기가 1-2cm가 될 때까지 건강한 성장과 오염을 위해 일주일에 1-2회 최소 2개의 무작위 유리 슬라이드를 모니터링합니다.
참고: 건강한 성장은 황금빛 갈색(녹색 또는 투명과 반대)을 띠는 것이 특징입니다. 도립 현미경으로 유리 슬라이드에서 관찰할 수 있는 몇 가지 정량적 지표가 있는데, 생존율, 발아율, 식물 발달, 생식 성숙도 및 번식력, 성비40이 포함됩니다. - 현미경으로 박테리아, 곰팡이, 섬모 및 규조류에 의한 오염을 평가합니다. 고립된 오염을 제거합니다. 게르마늄 이산화물 (GeO2) ( 섹션 8.3 참조) 처리로 규조류 오염의 초기 징후를 제어합니다.
8. 유지 보수
- 섹션 6.3에 따라 조명 조건을 조정합니다.
- M. pyrifera 성장에 필요한 영양소와 미네랄을 보충하기 위해 매주 성장 배지를 교체하십시오.
- 신선한 성장 배지를 적절한 온도로 식힙니다. 이 과정에서 온도가 15°C를 초과하지 않도록 하십시오.
- 파종된 기질을 방해하지 않도록 배양 용기에서 배지를 사이펀합니다. 용기가 거의 비워질 때까지 미디어를 비우십시오. 건조를 최소화하기 위해 즉시 미디어를 새로 고칩니다. 성장 용기를 다시 채울 때 배지가 배양 용기 측면을 따라 흘러내려 기질을 최소화하도록 약간 기울이십시오.
- 빛 방사 조도의 차이를 설명하기 위해 매주 매체를 교체하는 동안 용기 또는 욕조 위치를 무작위로 재배열합니다.
참고: Macrocystis 배양에 대한 활동과 기대치를 추적하기 위한 달력은 보충 파일 1을 참조하십시오. 빛과 폭기에 대한 조정 시기와 주간 미디어 변경을 나타냅니다.
- 선택적으로 게르마늄 이산화물 (GeO2) 처리로 규조류 오염을 제어합니다. 광범위한 규조류 오염을 줄이기 위해 파종된 기질에 첨가된 해수 1L당 250mg/mLGeO2 0.3-0.5mL를 추가합니다.
알림: GeO2는 조류 배우자 생성을 억제할 수 있습니다. 발아 후 및 난자 및 정자 생산의 피크 전(1-7d) 및/또는 난자 수정 및 포자식물 관찰(>21d) 후(21d)의 짧은 창에 GeO2 처리를 적용한 다음 48시간 후에 배지를 교체하여 화학 물질을 제거합니다. 이러한 일정은 배양 조건에 따라 달라질 수 있으므로 현미경으로 수명 단계 발달을 모니터링하는 것이 GeO2 적용 시기를 평가하는 가장 좋은 방법입니다. 규조류 오염이 배양 용기에서 지속되고 초기 단계의 다시마에 과도하게 자라는 것이 관찰되면 기질을 다시 파종하는 것이 좋습니다.
9. 자이언트 켈프 식물 생식동물 배양
- 일년 내내 식물 조건에서 생식식물 배양을 번식시켜 자연 산호초에서 계절에 따라 포자식물 수집에 대한 의존도를 줄입니다.
- 소스 모집단에 따라 배우자 배양물을 4-12 °C의 적색광에서 5-20 μmol 광자 m-2 s-1 의 강도로 적색광으로 채워진 플라스크에 12 light : 12 dark cycle로 저장합니다.
- 일정한 폭기를 제공하고 2-6개월마다 매체를 교체하십시오.
- '녹색 자갈' 파종에 사용하기 위해 무성생식물로 자라는 생식동물의 바이오매스를 대량으로 늘리려면 생식동물을 부유시키기 위해 폭기를 늘리고 배지 변경 빈도를 매주로 늘리고 2주마다 생식동물을 조각화합니다.
- 흔들거나 저어주어 배양 플라스크에 생식식물 바이오매스를 현탁시키고 필요한 경우 멸균 도구로 배양 플라스크의 측면을 긁어 부착된 생식동물을 제거합니다.
- 부유 된 gametophytes를 멸균 블렌더 또는 커피 그라인더에 붓고 덩어리 덩어리가 보이지 않을 때까지 바이오 매스 농도에 따라 약 5-15 회 gametophyte 용액을 1-2 초 동안 펄싱합니다.
- '녹색 자갈' 파종을 위한 번식을 유도하기 위해, 위에서 설명한 것처럼 생식동물을 조각화합니다. 그런 다음 기판을 접종하고 전체 스펙트럼 LED 조명을 5-20에서 45-60 μmol 광자 m-2 s-1 (광 순응을 위해 매일 +10 μmol 광자 m-2 s-1)로 증가시킨 다음 180 μmol 광자 m-2 s-1의 조도에 도달 할 때까지 3-4 d마다 10-20 μmol 광자 m-2 s-1 씩 증가시킵니다.
10. 배포
- 6-8주간의 실험실 배양 후 어린 포자식물이 길이가 1-2cm이고 배치할 준비가 되었는지 확인합니다(그림 4). 배포 24시간 전에 배양 컨테이너에서 성장 배지를 새로 고칩니다.
- 현지 법률 및 규정을 충족하는 자갈 배치에 필요한 허가를 받으십시오. 이는 배양 과정에서 시간이 많이 소요될 수 있으며 프로젝트 일정에 통합해야 합니다.
- '녹색 자갈'은 다시마에 수분을 유지하기 위해 바닷물에 적신 수건으로 덮인 쟁반에 담아 운반하십시오. 얼음이 담긴 단열 쿨러에 트레이를 놓고 얼음과 직접 접촉하지 않도록 합니다. 운송 중 기질의 롤링과 포자식물 분리를 방지하기 위해 '녹색 자갈' 이 단단히 포장되어 있는지 확인하십시오.
참고: 공간 가용성에 따라 기질을 배양 용기 또는 통으로 운송하여 취급을 줄일 수도 있습니다. - 그늘진 쿨러에서 최대 6시간 동안 '녹색 자갈'을 운반하십시오. 배치는 가장 직사광선을 피하도록 시간을 정해야 합니다. 보트에서 배치하는 경우 배치 과정에서 직사광선을 피하기 위해 그늘진 구조를 활용하십시오.
- 새로운 장소와 소규모에서 시험할 때 표면에서 아래 암초로 또는 스쿠버를 통해 ' 녹색 자갈'을 조심스럽게 흩뿌립니다.
결과
'녹색 자갈' 복원 기술은 아직 시범 단계에 있으며, 다른 종에 대한 식물 밖 생존 데이터는 제한적이며,28 Macrocystis pyrifera에 대해서는 아직 발표된 데이터가 없습니다. 이 프로토콜에 요약된 현장 수집 및 실험실 유지 관리를 사용하여 가상의 '녹색 자갈' 을 배치하기 전에 두 개의 서로 다른 기증자 다시마 개체군에 대한 장소별 사육 조건의 중요성을 테스트했습니다(그림 5). 생식 다시마 조직을 캘리포니아(미국)의 서늘한 K1(Santa Cruz 36.60167°N, 121.88508°W)과 따뜻한 K4(San Diego, 32.85036°N, -117.27600°W) 개체군에서 수집하여 (1) 12°C(해조류 양식의 표준 배양 온도, K1의 겨울 평균 SST) 및 (2) 20°C(K4의 여름 평균 SST, 그리고 K4의 경우 1°C 폭염). 다시마 수명 단계 발달을 모니터링하는 데 사용되는 모든 유리 슬라이드는 표준화된 그리드로 표시되었으며, 이 그리드를 참조로 사용하여 고해상도 이미지를 캡처하여 도립 현미경과 카메라를 사용하여 시간 경과에 따른 고정 필드를 관찰할 수 있습니다(N = 샘플당 5개 이미지, 2.479mm x 1.859mm).
24d 포스트 포자형성 후, 현미경 이미지(N = 60개 샘플에서 300개 이미지)로부터 생식동물을 계수했습니다. 생식세포 수의 차이를 검정하기 위해 glmmTMB41 패키지에서 glmmTMB() 함수를 사용하여 푸아송 분포와 함께 일반화 선형 혼합 효과 모델을 사용했으며, R의 emmeans42패키지에서 emtrends()를 사용하여 쌍별 비교를 수행했습니다. 우리의 결과는 열적 변동성에 대한 생식식물의 반응이 K1 개체군과 K4 개체군 간에 달랐고(t = 2.7, p = 0.007), 온도가 따뜻한 K4 개체군에는 영향을 미치지 않았지만(추정치 = -0.01, 표준 오차[SE] = 0.01, 신뢰 구간 [CI] = [-0.03, 0.01]), 더 차가운 K1 개체군에는 영향을 미쳤지만(추정치 = -0.06, SE = 0.02, CI = [-0.10, -0.03])(그림 6A)는 열 내성 특성의 적응적 발산이 가능함을 시사합니다. 다시마 생식식물은 종종 저항 단계(43)로 묘사되는데, 이는 스트레스에 강하고 환경 변동성에 상대적으로 둔감한 다목적 표현형을 생성한다는 것을 의미합니다. 그러나 이러한 결과는 열 변동성이 이 초기 단계에서 상당한 압력을 가한다는 것을 나타냅니다.
32d 포스트 포자형성 후, 길이가 약 1mm보다 큰 가시적 포자식물을 각 2.5cm x 7.5cm 유리 슬라이드 전체에서 계산했습니다(N = 총 72개 샘플). 눈에 보이는 포자식물 수의 차이를 테스트하기 위해 glmmTMB 패키지에서 glmmTMB() 함수를 사용하여 푸아송 분포와 함께 일반화된 선형 혼합 효과 모델을 사용했으며 R의 패키지 emmeans에서 emtrends()를 사용하여 쌍별 비교를 수행했습니다. 우리의 결과는 열적 변동성에 대한 포자식물의 반응이 온도가 더 따뜻한 K4 개체군(추정치 = -0.66, SE = 0.04, CI = [-0.74, - 0.57])과 더 차가운 K1 개체군(추정치 = -0.85, SE = 0.13, CI = [-1.10, -0.60])에 영향을 미치는 K1 및 K4 분화된 개체군(z = 0.92, p = 0.36) 간에 유사하다는 것을 보여줍니다(그림 6B). 20°C에서 사육한 샘플은 12°C에서 사육한 샘플(평균 ± SE = 0.4 ± 0.2)에 비해 눈에 보이는 포자식물(평균 ± SE = 82.4 ± 9.8)이 거의 자라지 않았습니다. 이 결과는 포자식물 생산이 생식식물 단계보다 온도에 더 민감하며, 프로토콜에 설명된 대로 포자식물 발달을 달성하기 위해 부위별 배양 온도가 15°C를 초과해서는 안 된다는 것을 시사합니다.

그림 1: '녹색 자갈' 인큐베이터 시스템 다이어그램. (A) 식물성 벌크 생식동물 배양을 위한 적색 광원. (B) 외부 콘센트로 연결되는 전선 및 튜브용 액세스 포트. (C) 적색광 부분에서 전체 스펙트럼 빛을 차단하는 구조. (D) '녹색 자갈' 경작 구간. (E) 전체 스펙트럼 광원. (F) 외부 여과 공기 공급원에 연결된 튜브 라인. (G) 공기 중 오염을 줄이기 위한 체크 밸브. (H) 오염을 최소화하는 개별 배양 용기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
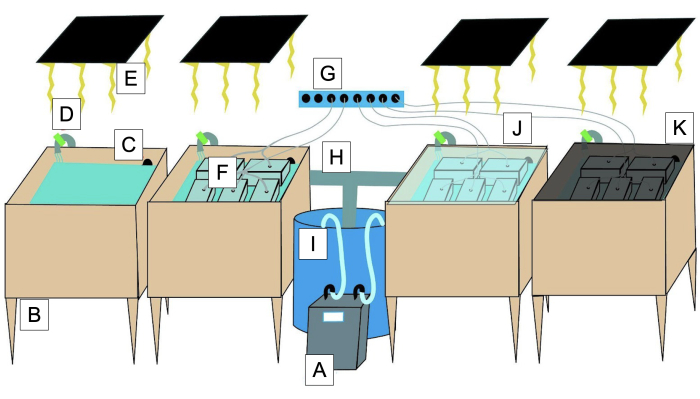
그림 2: '녹색 자갈' 수조 시스템의 다이어그램. (A) 수중 펌프가 있는 냉각기( I에서). (B) 수조용 20갤런 욕조. (C) 수조를 재순환시키기 위해 배수하십시오. (D) 수조의 재순환을 위한 밸브. (E) 광원. (F) 투명한 뚜껑과 폭기 구멍이 있는 2.5L '녹색 자갈' 용기. (G) 폭기원. (H) 수중 펌프를 사용하여 물을 재순환시키는 파이프. (I) 수중 펌프가 있는 욕조에서 냉각기로/로 수조 수신기. (J) 수조 증발을 최소화하기 위한 아크릴 커버. (K) 빛의 강도를 조정하기 위한 메쉬 음영. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
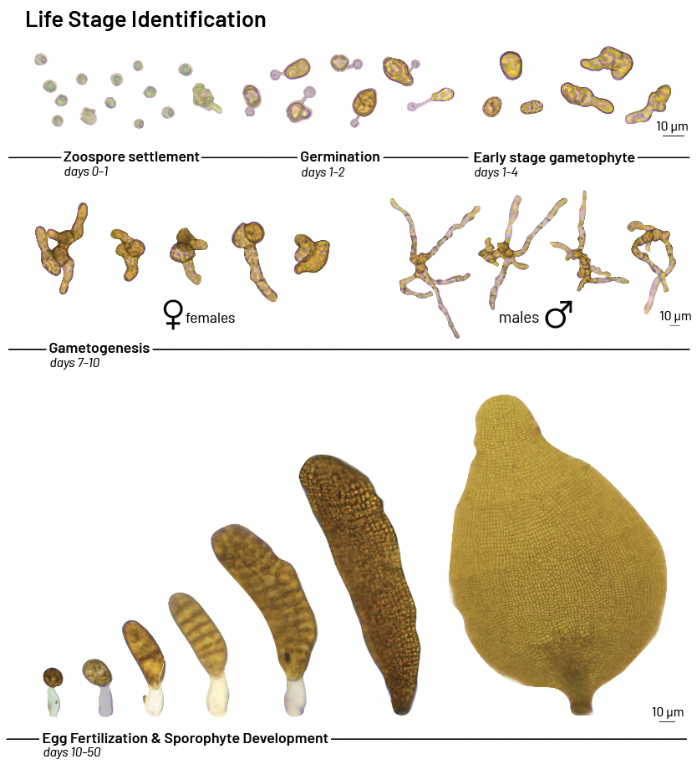
그림 3: Macrocystis pyrifera 발달. 실험실 성장 시험에서 Macrocystis pyrifera 의 발달 생활사 단계. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: Macrocystis pyrifera로 씨를 뿌린 '녹색 자갈'. Macrocystis pyrifera로 파종된 녹색 자갈은 포자식물이 1-2cm에 도달할 때까지 실험실에서 배양됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 실험적 시계열. 캘리포니아(미국)에서 수집되고 두 개의 다른 온도에서 배양된 두 개체군에서 유래한 Macrocystis pyrifera gametophytes 및 sporophytes의 실험적 성장 및 발달에 따른 시계열의 예시 이미지. K1 = 산타크루즈, K4 = 샌디에이고. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
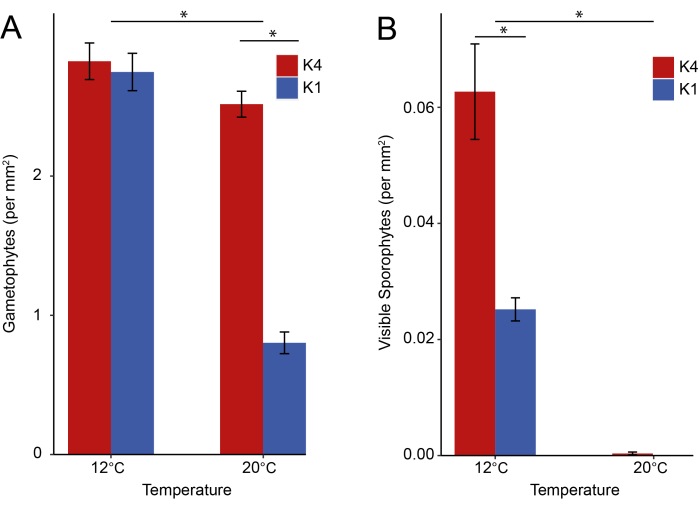
그림 6: 대표 결과. 12 및 20 °C의 일정한 열 조건에서 배양된 K1 Santa Cruz San Diego K4 Santa Cruz 기원 개체군에 대해 관찰된 Macrocystis pyrifera 생활 단계. 오차 막대, 평균 ± 1 SE. 별표(*)는 통계적으로 유의한 차이(p < 0.05)를 나타냅니다. (A) 24일째의 생식동물(N = 60개 샘플에서 총 300개의 이미지). (B) 32일째에 눈에 보이는 포자식물(N = 72개 샘플, 표준화된 2.5cm x 7.5cm 영역 내). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
인위적인 기후 변화는 전 세계 해양의 건강에 점점 더 큰 위협이 되고 있다.44,45,46,47,48 이는 주요 교란과 생물 다양성 손실을 초래한다 49,50,51,52. 훼손된 생태계의 복원을 가속화하기 위해 UN은 2021년부터 2030년까지를 "UN 생태계 복원 10년"으로 선포했으며, 이는 해양 건강의 악화를 되돌리는 것을 목표로 하는 "지속 가능한 개발을 위한 UN 해양 과학 10년"과 일치합니다53. 이러한 글로벌 행동 촉구에 따라 Kelp Forest Alliance는 2040년까지 100만 헥타르를 복원하고 300만 헥타르의 다시마 숲을 보호하기 위해 Kelp Forest Challenge를 시작했습니다54. 해양 복원은 과소평가되고 있으며55 다시마 생태계는 산호초, 맹그로브 숲, 해초 초원과 같은 서식지보다 훨씬 덜 주목받고 있다56. 훼손된 생태계의 복원은 해양 생태계를 재건하는 데 효과적인 것으로 나타났지만 헥타르당 평균 $80,000 - $1,600,000의 비용이 들 수 있으며 총 비용의 중간값은 2배에서 4배 더 높을 수 있다57. 현재 및 예상되는 손실은 긴급한 보존 개입으로 확장 가능하고 실현 가능하며 비용 효율적인 다시마 복원 방법론을 개발할 것을 요구합니다.
현재의 다시마 복원 노력은 다시마 손실의 지역별 동인을 해결하기 위해 성체 다시마 이식, 동물원 포자 및/또는 생식동물의 직접 파종, 방목 방제, 인공 암초 설치11 등의 방법론을 조합하여 사용하고 있다. 그러나 이러한 방법은 상당한 리소스가 필요하며 확장성이 제한적입니다. 성체 다시마의 일반적인 이식은 다이버가 저서에 인공 재료나 구조물을 힘들게 배치해야 합니다. 경쟁자와 방목자를 통제하는 것과 같이 해안 암초를 재건하기 위한 상향식 개입은 이러한 생물적 스트레스 요인의 수동 수중 제거 또는 배제에 의존하기 때문에 인건비에 의해 제한된다11. '그린 그래블(green gravel)' 기법은 수면에서의 간단한 배치로 이러한 한계를 극복하며, 수중 설치나 기술 지식이 필요하지 않으며 상대적으로 저렴한 비용으로 확장성을 제공한다28. 이 혁신적인 접근 방식은 유망한 복원 도구를 제공하며, 잠재력을 최대한 발휘할 수 있도록 다양한 위치와 환경에서 광범위한 시험을 거쳐야 합니다32.
노르웨이의 피요르드에서 설탕 다시마(Saccharina latissima26)를 사용하여 '녹색 자갈'을 사용한 성공적인 복원 노력이 기록되어 있지만, 이 기술은 동태평양의 Macrocystis pyrifera에 대한 파일럿 단계에 있습니다. 범위 내에서 M. pyrifera 외식물의 예상 생존율을 다루기 위해서는 추가 시험이 필요합니다. M. pyrifera 성장의 전형적인 파도에 노출된 조건에서 작은 자갈은 움직임과 마모에 더 취약하여 손상된 외식물로 이어질 수 있습니다. 더욱이, M. pyrifera의 가스로 채워진 폐낭에 의해 제공되는 양의 부력은 '녹색 자갈' 외식물이 복원 현장에서 효과적으로 운반되도록 유도할 수 있으며, 따라서 자갈의 크기와 무게는 이 종을 탐구해야 할 중요한 요소입니다. 최근 파일럿 연구(2022년 5월; Ensenada, Baja California, Mexico), M. pyrifera에 대한 현장에서의 예비 성공이 관찰되었으며, 이는 주변 기질에 haptera가 부착되고 현장에서 2 개월 후에 길이가 1.2m에 도달하는 어린 동물의 성장으로 나타났습니다 (그림 4). 이것은 동태평양의 M. pyrifera에 대한 '녹색 자갈'을 활용하는 데 있어 아직 탐구되지 않은 분명한 기회를 보여줍니다. 이 비디오는 M. pyrifera를 사용한 '녹색 자갈' 기술을 보여주며, 다양한 현장 환경에서 성공과 한계를 해결하는 연구를 지원하기 위해 복원 재배 단계에서 기존 관행을 단순화하고 중앙 집중화하는 귀중한 리소스입니다.
'녹색 자갈' 기술을 사용하면 성충 식물을 사용한 일반적인 이식 접근 방식에 비해 성공 확률을 높일 수 있는 규모로 더 작은 개별 자갈 단위를 파종할 수 있습니다. 그러나 이 기술의 주요 확장 가능한 측면은 표면에서 간단하게 배치할 수 있어 보트로 넓은 지역을 쉽게 복원할 수 있다는 것입니다. 작은 자갈의 배치가 적합하지 않은 현장 설정의 경우, 이 프로토콜은 더 큰 자갈 또는 작은 바위, 자연 또는 배치된 수중 앵커에 묶을 수 있는 끈 또는 해양 에폭시를 사용하여 더 많이 노출된 조건에서 해저에 볼트로 고정하거나 접착할 수 있는 타일을 포함한 광범위한 기질에 M. pyrifera 를 이식하도록 조정할 수 있습니다. 이러한 배치 조정은 M. pyrifera 배양에 필요한 시설을 변경하지 않지만 결과적으로 배치 비용을 증가시킵니다.
인위적인 교란과 기후 변화는 현재 자연 개체군의 적응 능력을 극복하고 있습니다. 이것은 생태계를 역사적 상태로 복원하는 전통적인 보존 노력에 중대한 도전을 제기한다 58,59,60,61,62,63. 따라서 보전의 틀은 회복력과 적응능력을 고려한 예측적 관리(precipatory management)를 포함하도록 확장되었다(64). 산림 생태계의 수종(tree species)에 대해 기후 변화에 대처하기 위한 예측 관리(predictatory management)가 시행되고 있으며65 외생식물(outplants)66,67의 진화 잠재력을 강화하기 위한 추가적인 복원 노력이 제안되었다. 이러한 전략은 본질적으로 육상 환경에서 조작하기가 더 쉽지만, 여러 연구에서 해양 환경에서의 응용을 탐구하기 시작했다 62,68,69,70. 예를 들어, 산호초는 전례 없는 감소를 초래한 수많은 인위적 스트레스 요인에 의해 위협받고 있다71,72. 이러한 중요한 기초 종의 손실에 대응하여, 남아 있는 산호초와 그 관련 기능을 보존하기 위해 적극적인 복원 및 보조 적응 기술이 점점 더 옹호되고 있다 62,73,74. 한 가지 기술은 열 스트레스에 대한 내성을 증가시키기 위해 현재의 종 분포 범위 내에서 개체를 재배치하는 것을 포함한다75. 캐노피를 형성하는 다시마의 복원과 관련하여, '녹색 자갈'은 탄력적인 유전자형을 취약한 지역으로 옮기거나, 교잡과 같은 비유전자 조작 또는 환경 스트레스에 대한 개체의 순응(62)과 같은 보조 적응 기술을 탐구하기 위한 맞춤형 프레임워크를 가지고 있으며, 복원 프로그램을 위한 더 많은 저항성 균주를 얻기 위한 결과를 얻을 수 있다(76,77).
복원 노력을 강화하기 위해 지역 지원을 활용하는 것은 다시마 생태계 보존의 성공을 유지하는 데 매우 중요합니다. 지역 이해 관계자를 참여시키면 복원 요구에 대한 지역 동의를 높일 수 있습니다.6,50 해안 관리를 촉진하여 다시마 생태계 보호의 자금 지원과 수명을 늘릴 수 있습니다. 다른 모든 다시마 복원 방법론과 마찬가지로 다양한 생태학적, 사회경제적 및 보존 목표를 통합하는 구조화된 의사 결정 프레임워크는 다시마 생태계와 그들이 지원하는 지역 사회를 위한 최적의 결과를 달성하는 데 도움이 될 것입니다11.
공개
저자는 공개할 것이 없습니다.
감사의 말
이 연구는 JBL 및 MESB에 캘리포니아 시 그랜트 다시마 회복 연구 프로그램 R/HCE-17, PDD, 자연보호협회, 슈미트 해양 기술 파트너, 지속 가능한 해양 동맹, AP-L에 팅커 재단, RBL 및 JL에 기후 과학 연합 Baja 워킹 그룹에 대한 DGE-1735040의 자금 지원을 받았습니다. 캘리포니아 대학교 어바인 캠퍼스의 Steven Allison, Cascade Sorte, Samantha Cunningham, Sam Weber 및 Caitlin Yee에게 감사드립니다. Mark Carr, Peter Raimondi, Sarah Eminhizer, Anne Kapuscinski, 산타 크루즈 캘리포니아 대학교; 월터 헤디(Walter Heady)와 노라 에디(Norah Eddy), 국제자연보호협회(The Nature Conservancy); 밀워키 위스콘신 대학교의 필리페 알베르토와 가브리엘 몬테치노스; 호세 안토니오 제르투체-곤잘레스, 알레한드라 페레이라-아리에타, 릴리아나 페레이라-아리에타, 바하 칼리포르니아 대학교; MexCal의 Luis Malpica-Cruz, Alicia Abadía-Cardoso 및 Daniel Díaz-Guzmán; 멕스칼리토스 다이버 알레한드라 레예스(Alejandra Reyes), 모니카 페랄타(Monica Peralta), 테레사 타베라(Teresa Tavera), 줄리아 나바레테(Julia Navarrete), 아이노아 빌랄타(Ainoa Vilalta), 제레미 바우어(Jeremie Bauer), 알폰소 페레이라(Alfonso Ferreira); Nancy Caruso는 기술 자문을 제공합니다. 수조 시스템 개발에 사용되는 시설을 제공한 Universidad Autónoma de Baja California의 Instituto de Investigaciones Oceanológicas에 감사드립니다. 수중 및 드론 비디오 콘텐츠를 제공해 주신 Ira Spitzer에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 µm filters | Milipore | SCGPS05RE | Natural seawater sterilization |
| 1 L glass bottles | Amazon | B07J6JP4D1 | Natural seawater sterilization |
| 1 µm filters (water + air) | Amazon | B01M1VWUWL | Natural seawater sterilization |
| 1'' PVC 90-Degree Elbow | Home Depot | 203812125 | Option 2 - Medium scale - Water bath systems |
| 10 µm filters | Amazon | B00D04BG56 | Natural seawater sterilization |
| 20 µm filters | Amazon | B082WS9NPH | Natural seawater sterilization |
| 3x5mm tubing | Amazon | B0852HXPN6 | Option 1 Small scale - Incubator |
| 4x4'' Sterile Gauze | Amazon | B07NDK8XM3 | Sporulation |
| 4x6mm tubing | Amazon | B08BCRV1FY | Option 1 Small scale - Incubator |
| 5 µm filters | Amazon | B082WS9NPH | Natural seawater sterilization |
| 50 mL falcon tubing | Amazon | B01M04HGPJ | Sporulation |
| 8x10mm tubing | Amazon | B01MSM3LLZ | Option 1 Small scale - Incubator |
| Air filters | Thermo Fisher | MTGR85010 | Option 1 Small scale - Incubator |
| Alcohol lamp | Amazon | B07XWD9WWC | Sporulation |
| Ammonium iron(II) sulfate hexahydrate ACS reagent, 99% | Sigma | 215406-100G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Aquarium Grade Gravel | Amazon | B07XRCKFBJ | Option 1 Small scale - Incubator |
| Biotin powder, BioReagent, suitable for cell culture, suitable for insect cell culture, suitable for plant cell culture, 99% | Sigma | B4639-100MG | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Boric Acid, 99.8%, 10043-35-3, MFCD00011337, BH3O3, 61.83, 500g | Thermo Fisher | 5090113707 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Calcium D-Pantothenate,ge98.0% (T),C9H17NO5,137-08-6,25g,D-Pantothenic Acid Calcium Salt, P0012-25G 1/EA | Thermo Fisher | P001225G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Check valves | Amazon | B08HRZR4MM | Option 1 Small scale - Incubator |
| Clear tubing 3/8'' - 10 ft | Amazon | B07MTYMW13 | Option 2 - Medium scale - Water bath systems |
| COBALT(II) SULFATE HEPTAH-100G, WARNING - California - Cancer Hazard, 93-2749-100G 1/EA | Thermo Fisher | 5090114752 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Compound microscope with camera | OMAX | M83EZ-C50S | Monitoring |
| Culture flask | Thermo Fisher | 07-250-080 | Option 1 Small scale - Incubator |
| Culture light | Amazon | B07RRRPJ63 | Option 1 Small scale - Incubator |
| Culture stoppers | Amazon | B07DX6J7QD | Option 1 Small scale - Incubator |
| Drainage connector | Amazon | B00GUZ6CV0 | Option 2 - Medium scale - Water bath systems |
| EDTA CAS Number: 6381-92-6 Molecular Formula: C10H14N2O8Na2- 2H2O Molecular Weight: 372.2 | Thermo Fisher | 50213299 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Eisco Safety Pack Graduated Cylinder Sets Class A, ASTM, Capacity: 10 mL, 25 mL, 50 mL, Graduations: 0.2 mL, 0.5 mL, 1.0 mL, Borosilicate 3.3 Glass, Autoclavable: Yes, Class: Class A, Graduated: Yes, Tolerance: 0.10 mL, 0.17 mL, 0.25 mL | Thermo Fisher | S81273 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Eisco Safety Pack Graduated Cylinder Sets Class A, ASTM, Capacity: 50 mL, 100 mL, 250 mL, Graduations: 1.0 mL, 1.0 mL, 2.0 mL, Borosilicate 3.3 Glass, Autoclavable: Yes, Class: Class A, Graduated: Yes, Tolerance: 0.25 mL, 0.50 mL, 1.0 mL | Thermo Fisher | S81275 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Eisco Safety Pack Volumetric Flask Sets - Class A, ASTM, Capacity: 10 mL, 25 mL, 50 mL, Borosilicate 3.3 Glass, Autoclavable: Yes, Class: Class A, Closure Material: Glass, Closure Size: Stopper Number: 9, 9, 13, Closure Type: Penny Stopper, Graduated: Ye | Thermo Fisher | S81271 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Filter holder | Amazon | B07LCKBKCT | Natural seawater sterilization |
| Fisherbrand Graduated Cylinders, Capacity: 500 mL, Graduations: 5 mL, Borosilicate Glass, Autoclavable: Yes, Limit of Error: +/-4.0 mL, Recommended Applications: Education, Subdivision: 5 mL, S63460 1/EA | Thermo Fisher | S63460 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| FLEXACAM C1 Camera | Leica | FLEXACAM C1 | Monitoring |
| Folic acid, C19H19N7O6, CAS Number59303, vitamin m, pteroylglutamic acid, vitamin b9, folvite, folacin, folacid, pteroyllglutamic acid, pteglu, folic acid, folate, 25g, 100781, CHEBI:27470, Yellow to Orange, 2004190, 441.41, OVBPIULPVIDEAOLBPRGKRZSAN | Thermo Fisher | AAJ6083314 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Free Standing 20 Gallon Utility Sink | Amazon | B094TLH19L | Option 2 - Medium scale - Water bath systems |
| GERMANIUM DIOXIDE 99.99 10GR | Thermo Fisher | AC190000100 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Glass Graduated Cylinders, Class A Round Base, Eisco, For Use With: Measuring liquids, Capacity: 1000 mL, Graduations: 10 mL White, CH0344OWT 1/EA | Thermo Fisher | S88442 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Glass slides | Amazon | B00L1S93PS | Option 2 - Medium scale - Water bath systems |
| Glycerol phosphate disodium salt hydrate isomeric mixture | Sigma | G6501-100G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Growth containers -3.4 Qt- 3.25 Lt transparent containers with transparent lid | Container store | #10014828 | Option 2 - Medium scale - Water bath systems |
| Growth light | Amazon | B086R14MFW | Option 1 Small scale - Incubator |
| Hemocytometer | Amazon | B07TJQDKLJ | Sporulation |
| Hinged plastic jars | SKS Bottle & Packaging | 40280125.01S | Option 1 Small scale - Incubator |
| Inositol research grade, USP/NF For bacteriology. Optically inactive. Tested for its suitability in tissue culture. Size - 100G Storage Conditions - +15 C TO +30 C Catalog Number - 26310.01 CAS 87-89-8 | Thermo Fisher | 50247745 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Instant Ocean - 50 G | Amazon | B000255NKA | Option 1 Small scale - Incubator |
| Inverted Microscope Leica DMi1 | Leica | DMi1 | Monitoring |
| Iron(III) chloride hexahydrate ACS reagent, 97% | Sigma | 236489-100G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Licor Ligth Meter Data Logger | Licor | LI-250A | Monitoring |
| Light/temperature HOBO data logger | Amazon | B075X2SWKN | Monitoring |
| Lights 150W | Amazon | B0799DQM9V | Option 2 - Medium scale - Water bath systems |
| Manganese sulfate monohydrate meets USP testing specifications | Sigma | M8179-100G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Medium size rocks 2-3 inch, 20 pounds | Home Depot | 206823930 | Option 2 - Medium scale - Water bath systems |
| Nicotinic Acid, 99%, C6H5NO2, CAS Number59676, daskil, apelagrin, acidum nicotinicum, akotin, 3carboxypyridine, niacin, 3pyridinecarboxylic acid, nicotinic acid, pellagrin, wampocap, 250g, 109591, CHEBI:15940, 1.4, 2004410, 293 deg.C (559 deg.F), 123.11, | Thermo Fisher | AAA1268330 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| p-Aminobenzoic acid 99.82% 4-aminobenzoic acid, C7H7NO2, CAS Number: 150-13-0, 25g, 0210256925 1/EA | Thermo Fisher | ICN10256925 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| PCV cement | Amazon | B001D9WRWG | Option 2 - Medium scale - Water bath systems |
| Plastic water valve | Amazon | B0006JLVE4 | Option 2 - Medium scale - Water bath systems |
| Plastic water valve | Amazon | B07G5FY7X1 | Option 2 - Medium scale - Water bath systems |
| Precision scale 1mg | Amazon | B08DTH95FN | Materials to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Pump for filtered air | Amazon | B0BG2BT9RX | Option 1 Small scale - Incubator |
| PVC tubing 1x24'' | Home Depot | 202300505 | Option 2 - Medium scale - Water bath systems |
| Quantum Light meter | Apogee Instruments | MQ-510 | Monitoring |
| Refrigerated Incubator | Thermo Fisher | 15-103-1566 | Option 1 Small scale - Incubator |
| Rubber Grommets | Amazon | B07YZD22ZP | Option 1 Small scale - Incubator |
| Salinity refractometer | ATC | B018LRO1SU | Monitoring |
| Shade mesh 6x50 ft | Home depot | 316308418 | Option 2 - Medium scale - Water bath systems |
| Sodium Nitrate ge 99.0% Nitric Acid, Sodium Salt, NNaO3, CAS Number: 7631-99-4, 500g, 1/EA | Thermo Fisher | BP360500 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Soldering for aeration opening | Amazon | B08R3515SF | Option 2 - Medium scale - Water bath systems |
| Spray isporopyl alcohol | Amazon | B08LW5P844 | Sporulation |
| Stainless steel sissors | Amazon | B07BT4YLHT | Sporulation |
| Stainless steel tray | Amazon | B08CV33YXG | Sporulation |
| Stainless steel twizzers | Amazon | B01JTZTAJS | Sporulation |
| Stir Bars | Amazon | B07C4TNKXB | Materials to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Submersible circulation pump 400 GPH | Amazon | B07RZKRM13 | Option 2 - Medium scale - Water bath systems |
| Submersible Spherical Quantum Sensor | Waltz | US-SQS/L | Monitoring |
| Temperature gun | Infrared Thermometer 749 | B07VTPJXH9 | Monitoring |
| Thiamine hydrochloride BioReagent, suitable for cell culture, suitable for insect cell culture, suitable for plant cell culture | Sigma | T1270-25G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Thymine 99% 2, 4-Dihydroxy-5-methylpyrimidine, C5H6N2O2, CAS Number: 65-71-4, 25g, 157850250 1/EA | Thermo Fisher | AC157850250 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Transparent Acrylic sheet 24x48 inch | Home Depot | 202038048 | Option 2 - Medium scale - Water bath systems |
| Tubing water circulation 1''x10 ft | Amazon | B07ZC1PSF3 | Option 2 - Medium scale - Water bath systems |
| UV light for natural seawater sterilization | Amazon | B018OI7PYS | Natural seawater sterilization |
| Vacum pump | Amazon | B087XBTPVW | Natural seawater sterilization |
| Vitamin B12 BioReagent, suitable for cell culture, suitable for insect cell culture, suitable for plant cell culture, 98% | Sigma | V6629-100MG | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Volumetric Flasks, Class A Glass, Eisco, with Polypropylene Stopper, Graduated, White printed markings, Capacity: 1000 mL, CH0446IWT 1/EA | Thermo Fisher | S89446 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Volumetric Flasks, Class A Glass, Eisco, with Polypropylene Stopper, Graduated, White printed markings, Capacity: 500 mL, CH0446HWT 1/EA | Thermo Fisher | S89445 | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
| Water Chiller 200-600GPM | Amazon | B07BHHP71C | Option 2 - Medium scale - Water bath systems |
| Y-splitters for 4x6mm tubing | Amazon | B08XTJKFCH | Option 1 Small scale - Incubator |
| Zinc sulfate heptahydrate BioReagent, suitable for cell culture | Sigma | Z0251-100G | Chemicals to create Provasoli’s Enriched Seawater (PES) and vitamins for media enrichment |
참고문헌
- Schiel, D. R., Foster, M. S. . The Biology and Ecology of Giant Kelp Forests. , (2015).
- Smale, D. A., Burrows, M. T., Moore, P., O'Connor, N., Hawkins, S. J. Threats and knowledge gaps for ecosystem services provided by kelp forests: a northeast Atlantic perspective. Ecol Evol. 3 (11), 4016-4038 (2013).
- Eger, A. M., et al. The value of ecosystem services in global marine kelp forests. Nat Comm. 14 (1), 1894 (2023).
- Bennett, S., Wernberg, T., Arackal Joy, B., de Bettignies, T., Campbell, A. H. Central and rear-edge populations can be equally vulnerable to warming. Nat Comm. 6 (1), 10280 (2015).
- Jueterbock, A., et al. Climate change impact on seaweed meadow distribution in the North Atlantic rocky intertidal. Ecol Evol. 3 (5), 1356-1373 (2013).
- Rogers-Bennett, L., Catton, C. A. Marine heat wave and multiple stressors tip bull kelp forest to sea urchin barrens. Sci Rep. 9 (1), 15050 (2019).
- Krumhansl, K. A., et al. Global patterns of kelp forest change over the past half-century. PNAS. 113 (48), 13785-13790 (2016).
- Zimmerman, R. C., Kremer, J. N. Episodic nutrient supply to a kelp forest ecosystem in Southern California. J Mar Res. 42 (3), 591-604 (1984).
- Rothäusler, E., et al. Physiological performance of floating giant kelp Macrocystis pyrifera (phaeophyceae): Latitudinal variability in the effects of temperature and grazing. J Phycol. 47 (2), 269-281 (2011).
- Wernberg, T., Krumhansl, K., Filbee-Dexter, K., Pedersen, M. F. Chapter 3 - Status and trends for the world's kelp forests. World Seas: An Environmental Evaluation (Second Edition). , 57-78 (2019).
- Eger, A. M., Layton, C., McHugh, T. A., Gleason, M., Eddy, N. Kelp restoration guidebook: Lessons learned from kelp restoration projects around the world. TNCKelp Forest Alliance. , (2022).
- Filbee-Dexter, K., et al. Marine heatwaves and the collapse of marginal North Atlantic kelp forests. SciRep. 10 (1), 13388 (2020).
- Filbee-Dexter, K., Scheibling, R. E. Sea urchin barrens as alternative stable states of collapsed kelp ecosystems. Mar Ecol Prog Ser. 495, 1-25 (2014).
- Filbee-Dexter, K., Wernberg, T. Rise of turfs: A new battlefront for globally declining kelp forests. BioSci. 68 (2), 64-76 (2018).
- Assis, J., Araújo, M. B., Serrão, E. A. Projected climate changes threaten ancient refugia of kelp forests in the North Atlantic. Glob Change Biol. 24 (1), e55-e66 (2018).
- Davis, T., Champion, C., Coleman, M. Ecological interactions mediate projected loss of kelp biomass under climate change. Divers Distrib. 28 (2), 306-317 (2021).
- Goldsmit, J., et al. Kelp in the eastern Canadian arctic: Current and future predictions of habitat suitability and cover. Front Mar Sci. 18, 742209 (2021).
- Ling, S. D., Cornwall, C. E., Tilbrook, B., Hurd, C. L. Remnant kelp bed refugia and future phase-shifts under ocean acidification. PLoS One. 15 (10), e239136 (2020).
- Eger, A. M., et al. Global kelp forest restoration: past lessons, present status, and future directions. Biol Rev. 97 (4), 1449-1475 (2022).
- Waylen, K. A., Fischer, A., McGowan, P. J., Thirgood, S. J., Milner-Gulland, E. J. Effect of local cultural context on the success of community-based conservation interventions. Biol Consv. 24 (4), 1119-1129 (2010).
- Vergés, A., et al. The tropicalization of temperate marine ecosystems: climate-mediated changes in herbivory and community phase shifts. Proc Royal Soc. B. 281 (1789), 20140846 (2014).
- Zarco-Perello, S., Wernberg, T., Langlois, T. J., Vanderklift, M. A. Tropicalization strengthens consumer pressure on habitat-forming seaweeds. Sci Rep. 7 (1), 820 (2017).
- Worm, B., Lotze, H. K. Chapter 21 - Marine biodiversity and climate change. Climate Change (Third Edition). , 445-464 (2021).
- Félix-Loaiza, A. C., Rodríguez-Bravo, L. M., Beas-Luna, R., Lorda, J., de La Cruz-González, E., Malpica-Cruz, L. Marine heatwaves facilitate invasive algae takeover as foundational kelp. Botanica Marina. 65 (5), 315-319 (2022).
- Miller, K. I., Blain, C. O., Shears, N. T. Sea urchin removal as a tool for macroalgal restoration: A review on removing "the spiny enemies". Fron Mar Sci. 9, 831001 (2022).
- Westermeier, R., et al. Repopulation techniques for Macrocystis integrifolia (Phaeophyceae: Laminariales) in Atacama, Chile. J Appl Phycol. 26, 511-518 (2014).
- Layton, C., et al. Kelp forest restoration in Australia. Fron Mar Sci. 7, 74 (2020).
- Fredriksen, S., et al. Green gravel: a novel restoration tool to combat kelp forest decline. Sci Rep. 10 (1), 3983 (2020).
- Projects of the Green Gravel Action Group. Green Gravel Action Group. (n.d.) Available from: https://www.greengravel.org/ (2024)
- Fain, S. R., Murray, S. N. Effects of light and temperature on net photosynthesis and dark respiration of gametophytes and embryonic sporophytes of macrocystis pyrifera. J Phycol. 18 (1), 92-98 (1982).
- Westermeier, R., Patiño, D., Piel, M. I., Maier, I., Mueller, D. G. A new approach to kelp mariculture in Chile: production of free-floating sporophyte seedlings from gametophyte cultures of Lessonia trabeculata and Macrocystis pyrifera. Aquac Res. 37 (2), 164-171 (2006).
- Alsuwaiyan, N., et al. A et al. Green gravel as a vector of dispersal for kelp restoration. Fron Mar Sci. 9, 910417 (2022).
- Falace, A., Kaleb, S., De La Fuente, G., Asnaghi, V., Chiantore, M. Ex situ cultivation protocol for Cystoseira amentacea var. stricta (Fucales, Phaeophyceae) from a restoration perspective. PloS One. 13 (2), e0193011 (2018).
- Redmond, S., Green, L., Yarish, C., Kim, J., Neefus, C. . New England seaweed culture handbook. , (2014).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Arch Mikrobiol. 25, 392-428 (1957).
- Navarro, D., Navarro, D. E. . California Kelp Forest Restoration: Science Activity Guide for Teachers. , (2006).
- Alsuwaiyan, N. A., et al. A review of protocols for the experimental release of kelp (Laminariales) zoospores. Ecol Evol. 9 (14), 8387-8398 (2019).
- Lüning, K., Müller, D. G. Chemical interaction in sexual reproduction of several Laminariales (Phaeophyceae): release and attraction of spermatozoids. Z. Pflanzenphysiol. 89 (4), 333-341 (1978).
- Müller, D. G., Maier, I., Gassmann, G. Survey on sexual pheromone specificity in Laminariales (Phaeophyceae). Phycologia. 24 (4), 475-477 (1985).
- Vieira, V. M., Oppliger, L. V., Engelen, A. H., Correa, J. A. A new method to quantify and compare the multiple components of fitness-a study case with kelp niche partition by divergent microstage adaptations to temperature. Plos One. 10 (3), e0119670 (2015).
- Brooks, M. E., et al. glmmTMB balances speed and flexibility among packages for zero-inflated generalized linear mixed modeling. The R Journal. 9 (2), 378-400 (2017).
- Russell, L. emmeans: estimated marginal means, aka least-squares means. R package version. 1 (2), (2018).
- Ladah, L. B., Zertuche-González, J. A. Survival of microscopic stages of a perennial kelp (Macrocystis pyrifera) from the center and the southern extreme of its range in the Northern Hemisphere after exposure to simulated El Niño stress. Mar Biol. 152, 677-686 (2007).
- Halpern, B. S., et al. A global map of human impact on marine ecosystems. Science. 319 (5865), 948-952 (2008).
- Halpern, B. S., et al. Spatial and temporal changes in cumulative human impacts on the world's ocean. Nat Comm. 6 (1), 1-7 (2015).
- Halpern, B. S., et al. Recent pace of change in human impact on the world's ocean. Sci Rep. 9 (1), 11609 (2019).
- Micheli, F., et al. Cumulative human impacts on Mediterranean and Black Sea marine ecosystems: assessing current pressures and opportunities. PloS One. 8 (12), e79889 (2013).
- Portner, H. -. O., et al. IPCC, 2022: Summary for policymakers. IPCC. , (2022).
- Butchart, S. H. M., et al. Global biodiversity: Indicators of recent declines. Science. 328 (5982), 1164-1168 (2010).
- Rocha, J., Yletyinen, J., Biggs, R., Blenckner, T., Peterson, G. Marine regime shifts: Drivers and impacts on ecosystems services. Phil Trans Roy Soc. B. 370 (1659), 20130273 (2015).
- Worm, B., et al. Impacts of biodiversity loss on ocean ecosystem services. Science. 314 (5800), 787-790 (2006).
- Worm, B., Lotze, H. K. Marine biodiversity and climate change. Climate Change (Third Edition). , 445-464 (2021).
- Waltham, N. J., et al. UN decade on ecosystem restoration 2021-2030-What chance for success in restoring coastal ecosystems. Fron Mar Sci. 7, (2020).
- Kelp Forest Challenge. Kelp Forest Alliance Available from: https://kelpforestalliance.com/ (2024)
- Gordon, T. A. C., Radford, A., Simpson, S. D., Meekan, M. G. Marine restoration projects are undervalued. Science. 367 (6478), 635-636 (2020).
- Morris, R. L., et al. Key principles for managing recovery of kelp forests through restoration. BioScience. 70 (8), 688-698 (2020).
- Bayraktarov, E., et al. The cost and feasibility of marine coastal restoration. Ecol Appl. 26 (4), 1055-1074 (2016).
- Breed, M. F., et al. Priority actions to improve provenance decision-making. BioScience. 68 (7), 510-516 (2018).
- Breed, M. F., et al. The potential of genomics for restoring ecosystems and biodiversity. Nat Rev Genet. 20 (10), 615-628 (2019).
- Gurgel, C. F. D., Camacho, O., Minne, A. J. P., Wernberg, T., Coleman, M. A. Marine heatwave drives cryptic loss of genetic diversity in underwater forests. Curr Biol. 30 (7), 1199-1206 (2020).
- Hobbs, R. J., Higgs, E., Harris, J. A. Novel ecosystems: implications for conservation and restoration. Trends Ecol Evol. 24 (11), 599-605 (2009).
- van Oppen, M. J. H., Oliver, J. K., Putnam, H. M., Gates, R. D. Building coral reef resilience through assisted evolution. PNAS. 112 (8), 2307-2313 (2015).
- Perring, M. P., et al. Advances in restoration ecology: Rising to the challenges of the coming decades. Ecosphere. 6 (8), (2015).
- Coleman, M. A., et al. Restore or redefine: Future Trajectories for Restoration. Fron MarSci. 7, 237 (2020).
- O'Neill, G. A. Assisted migration to address climate change in British Columbia: recommendations for interim seed transfer standards. Ministry of Forests and Range, Forest Science Program. , (2008).
- Broadhurst, L. M., et al. Seed supply for broadscale restoration: maximizing evolutionary potential. Evol App. 1 (4), 587-597 (2008).
- Vitt, P., Havens, K., Kramer, A. T., Sollenberger, D., Yates, E. Assisted migration of plants: Changes in latitudes, changes in attitudes. Biol Cons. 143 (1), 18-27 (2010).
- Buerger, P., et al. Heat-evolved microalgal symbionts increase coral bleaching tolerance. Sci Adv. 6 (20), 2498 (2020).
- Chakravarti, L. J., van Oppen, M. J. H. Experimental evolution in coral photosymbionts as a tool to increase thermal tolerance. Fron Mar Sci. 5, (2018).
- van Oppen, M. J. H., et al. Shifting paradigms in restoration of the world's coral reefs. Global Change Biology. 23 (9), 3437-3448 (2017).
- Harborne, A. R., Rogers, A., Bozec, Y. -. M., Mumby, P. J. Multiple Stressors and the Functioning of Coral Reefs. Ann Rev Mar Sci. 9 (1), 445-468 (2017).
- Hughes, T. P., et al. Climate change, human impacts, and the resilience of coral reefs. Science. 301 (5635), 929-933 (2003).
- Anthony, K., et al. New interventions are needed to save coral reefs. Nat Ecol & Evol. 1 (10), 1420-1422 (2017).
- Darling, E. S., Côté, I. M. Seeking resilience in marine ecosystems. Science. 359 (6379), 986-987 (2018).
- van Oppen, M. J. H., Puill-Stephan, E., Lundgren, P., De'ath, G., Bay, L. K. First-generation fitness consequences of inter-populational hybridization in a Great Barrier Reef coral and its implications for assisted migration management. Coral Reefs. 33 (3), 607-611 (2014).
- Coleman, M. A., Goold, H. D. Harnessing synthetic biology for kelp forest conservation1. J Phycol. 55 (4), 745-751 (2019).
- Liboureau, P., Pearson, G. A., Barreto, L., Serrao, E. A., Kreiner, A., Martins, N. Effects of thermal history on reproductive success and cross-generational effects in the kelp Laminaria pallida (Phaeophyceae). Mar Ecol Prog Ser. 715, 41-56 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유